含铬废水的来源
 不经意的爱情GANG2022-10-04 11:39:541条回答
不经意的爱情GANG2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 水的风 共回答了19个问题
水的风 共回答了19个问题 |采纳率100%- 含铬废水主要来源于电镀生产过程中的镀件情况、镀液过滤、废液排放等,废水中主要含三价铬、六价铬以及各种金属离子、酸、碱和各种助剂.
- 1年前
相关推荐
- 求处理综合废水水量2000 m3/d,含铬废水水量100 m3/d的电镀废水工艺流程图
 一直很安静_c1年前1
一直很安静_c1年前1 -
 pollux_zj 共回答了17个问题
pollux_zj 共回答了17个问题 |采纳率88.2%1、调整ph至2 左右
2、按比例投加硫酸亚铁或焦亚硫酸钠或硫化钠等还原剂还原六价铬(这个有方程式,可以计算,实际投加量要高于理论值)
3、投加石灰调ph至9.1,太高或太低都不好,
4、投加PAC和PAM混凝沉淀,出水即可达标排放.1年前查看全部
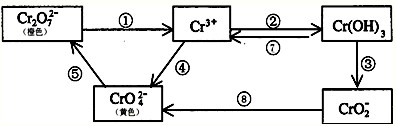
- 铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下
铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下
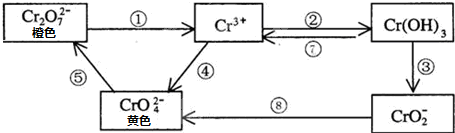
回答下列问题:
(1)上述反应中需用氧化剂的是______(填编号).
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+并最终转化为Cr(OH)3沉淀,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水.写出电极反应和溶液中进行的反应的离子方程式:
阳极______; 阴极______;______
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式______. 幽默三郎1年前1
幽默三郎1年前1 -
 笨笨猫1219 共回答了19个问题
笨笨猫1219 共回答了19个问题 |采纳率89.5%解题思路:(1)根据Cr元素的化合价变化来分析氧化还原反应,若Cr元素的化合价升高,则需要加入氧化剂;
(2)电解池中,金属作阳极时,金属失去电子,溶液中的阳离子得到电子,并利用氧化还原反应来分析溶液中的离子反应;
(3)根据Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色及图中反应⑤的转化来解答.(1)上述几步转化中,①中Cr元素的化合价降低,④⑧中Cr元素的化合价升高,则①④⑧属于氧化还原反应,且④⑧中需要加入氧化剂,
故答案为:④⑧;
(2)铁作阳极,则阳极反应为Fe-2e=Fe2+,溶液中的阳离子H+在阴极放电,则阴极反应为H++2e=H2↑,电解产生的亚铁离子具有还原性,与
Cr2O72-发生氧化还原反应,Cr2O72-转化为Cr3+,则溶液中发生的离子反应为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:Fe-2e=Fe2+;H++2e=H2↑;6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
(3)由Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色及转化⑤可知,发生可逆的离子反应为2CrO42-+2H+ Cr2O72-+H2O,
Cr2O72-+H2O,
故答案为:2CrO42-+2H+ Cr2O72-+H2O.
Cr2O72-+H2O.点评:
本题考点: 氧化还原反应;电解原理.
考点点评: 本题考查氧化还原反应及物质的转化,为高频考点,把握反应中元素的化合价变化为解答的关键,涉及电化学、离子反应及氧化还原反应,注重高频考点的考查,难度较大.1年前查看全部
- 电解法处理酸性含铬废水,以铁板作阴阳极
电解法处理酸性含铬废水,以铁板作阴阳极
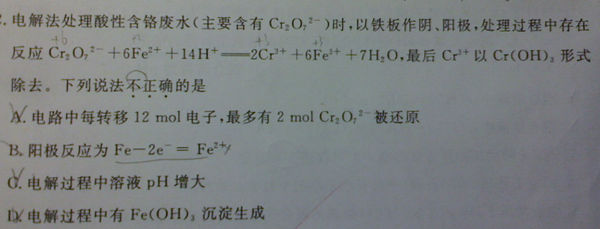
请解释AB选项 HOLLYSON1年前2
HOLLYSON1年前2 -
 一醉回眸 共回答了20个问题
一醉回眸 共回答了20个问题 |采纳率90%首先因为阳极是铁,为活泼金属,所以阳极是铁发生反应生成二价铁.阴极是氢离子发生反应生成氢气.然后再在溶液中发生题干中还原铬的反应.当电路中通过12mol电子时,生成6mol二价铁离子,根据题干方程式可知,此时有1molCr2O7 2-离子被还原1年前查看全部
- 有三块合金,第一块含铝60%,含铬40%,第二块含铬10%,含钛90%,第三块含铝20%,含铬50%,含钛30%,现将它
有三块合金,第一块含铝60%,含铬40%,第二块含铬10%,含钛90%,第三块含铝20%,含铬50%,含钛30%,现将它们铸成一块新的合金,知道其含钛45%,求新合金中含铬百分比的取值范围.
 mwj23041年前1
mwj23041年前1 -
 chenxianghua2005 共回答了16个问题
chenxianghua2005 共回答了16个问题 |采纳率93.8%希望您看了我的回答后可以恍然大悟,并且坚信这题so easy.高手还轮不到做这题,换言之.第一块含铝60%,含铬40%,第二块含铬10%,含钛90%,第三块含铝20%,含铬50%,含钛30%、所有三块合金都是由这些元素组成的,都是100%.即...1年前查看全部
- 含铬废水中Cr(VI)的浓度测定
 sandydengyan1年前1
sandydengyan1年前1 -
 ttleonchen 共回答了15个问题
ttleonchen 共回答了15个问题 |采纳率86.7%用原子吸收光谱仪测定1年前查看全部
- 六价铬对人体有毒,含铬废水要经过化学处理后才能排放。
六价铬对人体有毒,含铬废水要经过化学处理后才能排放。
工业上为处理含有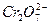 的酸性废水采用如下方法:在工业废水中加入适量nacl,然后以铁为电极电解,鼓入空气,最后将
的酸性废水采用如下方法:在工业废水中加入适量nacl,然后以铁为电极电解,鼓入空气,最后将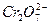 以cr(oh) 3 形式沉淀下来而除去,且还生成fe(oh) 3 沉淀。这种处理方法可使工业废水中的
以cr(oh) 3 形式沉淀下来而除去,且还生成fe(oh) 3 沉淀。这种处理方法可使工业废水中的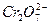 含量达到***规定的排放标准。试完成下列问题:
含量达到***规定的排放标准。试完成下列问题:
(1)在工业废水中加入nacl的作用是:_____________________________________________。
(2)有关电极反应方程式是
________________________________________________________。
(3)由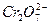 转化为cr 3+ 的离子方程式是
转化为cr 3+ 的离子方程式是
___________________________________________。
(4)电解过程中工业废水由酸性变碱性的原因是
______________________________________。
(5)另一种处理含铬废水的方法是用绿矾(feso 4 ·7h 2 o)把废水中的六价铬还原成铬离子,再加入过量石灰水,使铬离子转为氢氧化铬cr(oh) 3 沉淀,其主要反应的化学方程式如下:
6h 2 so 4 +h 2 cr 2 o 7 +6feso 4 ====3fe 2 (so 4 ) 3 +cr 2 (so 4 ) 3 +7h 2 o
现用上法处理1×10 4 l含铬(+6价)78 mg·l 1 的废水(cr的相对原子质量52),则:
①处理后沉淀除cr(oh) 3 外,还有________________________________(用化学式来表示)。
②需用绿矾多少千克? zhubfu1年前1
zhubfu1年前1 -
 娃哈哈x9q 共回答了20个问题
娃哈哈x9q 共回答了20个问题 |采纳率85%1年前查看全部
- 高考化学氧化还原问题、求解释、有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+Fe3+[ Fe3+(1-x
高考化学氧化还原问题、求解释、
有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+Fe3+[ Fe3+(1-x) · Cr3+x · O4].向含有1.92 mol硝酸的某溶液中加入一定量的该种铁氧体,恰好完全反应后,收集到NO、NO2的混合气体2.688L(标准状况).所得溶液为Fe(NO3)3、Cr(NO3)3的混合溶液
1、溶液中的溶质离子浓度大小顺序 ?
2、参加反应的铁氧体的物质的量为?
3所得气体中no和no2的体积比为?
求老师详解?这怎么算铁氧体的物质的量啊?离子浓度也不会、这铁氧体太复杂了吧、
 shasha1231年前1
shasha1231年前1 -
 rae913 共回答了17个问题
rae913 共回答了17个问题 |采纳率94.1%因为一个铬铁氧体分子中的铁元素数目大于铬元素,所以液体中的铁离子数目肯定大于铬离子浓度,反映后的溶液是盐溶液,不考虑水解,阴离子只和等于阳离子,所以反映后溶液中硝酸根浓度最大,则排名为c(NO3-)>c(Fe3+)>c(Cr3+),这是第一问.
第二问,根据题目的分子式,那其中的X只能取1,其他情况皆不符合,一个分子中不可能有半个铬离子,然后就可以得到分子式了,为Fe2+Fe3+[ Cr3+1· O4].,可以看出,分子式中的铁元素数目为铬元素数目的2倍.然后,根据溶液电荷守恒定律,有3n(Fe3+)+3n(Cr3+)=n(NO3-),根据氮元素守恒,拿硝酸的量减去溢出气体的量2.688/22.4即为溶液中氮元素的量,也即1.92-0.12=1.8mol,为溶液中硝酸跟的浓度,那么根据电荷守恒式和n(Fe3+)=2(Cr3+),可以得到n(Cr3+)=0.2mol.一个铬铁氧体分子中分子中只有一个铬原子,他俩是一比一关系,那么消耗铬铁氧体的量就是0.2mol了.
第三问,这题的可以利用氧化还原知识来解,因为生成NO、NO2的反应为二价铁离子和硝酸的反应,分别写出两个反应的离子反映方程式,书上都有,然后蛇生成NO为Xmol,NO2为ymol,根据生成气体总量,可知x+y=2.688/22.4,然后根据反应式的对应关系,根据二价铁(等于消耗铬铁氧体的量)的含量为3x+y=0.2,联立方程解出得x = 0.04 y = 0.08,则x:y-1:2
完毕,不懂加我QQ问,9313551301年前查看全部
- 电镀含铬废水的处理方法较多。 Ⅰ.某工业废水中主要含有Cr 3+ ,同时还含有少量的Cu 2+ 、Fe 2+
电镀含铬废水的处理方法较多。
Ⅰ.某工业废水中主要含有Cr 3+ ,同时还含有少量的Cu 2+ 、Fe 2+ 、Fe 3+ 和Al 3+ 等,且酸性较强。为回收利用,通常采用如下流程处理:
已知:
(1).Cr(OH) 3 NaCrO 2
NaCrO 2  Na 2 CrO 4
Na 2 CrO 4  Na 2 Cr 2 O 7
Na 2 Cr 2 O 7
(2).Cu(OH) 2 能溶于氨水:Cu(OH) 2 +4NH 3 ·H 2 O = [Cu(NH 3 ) 4 ] 2+ +2OH - +4H 2 O
请回答:
(1).操作I的名称________,上述操作I、II、III相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有_____________。
(2).滤渣I的主要成分为__________ (写化学式) ,试剂乙的名称_______ 。
(3).加入试剂甲的目的__________。
(4).废水处理流程中生成滤渣III的离子方程式_____________。
II.酸性条件下,六价铬主要以Cr 2 O 7 2- 形式存在。工业上用以下方法处理处理含Cr 2 O 7 2- 的废水:
①往废水中加入适量的NaCl,搅拌均匀;
②用Fe为电极进行电解,经过一段时间,最后有Cr(OH) 3 和Fe(OH) 3 沉淀产生;
③过滤回收沉淀,废水达到排放标准。
(5).电解时能否用Cu电极来代替Fe电极__________(填“能”或“不能”),理由_________________。
(6).已知某含Cr 2 O 7 2- 的酸性工业废水中铬元素的含量为104.5mg/L,处理后铬元素最高允许排放浓度为0.5mg/L。处理该废水1000m 3 并达到排放标准至少消耗铁的质量为____kg。 oldshine20061年前1
oldshine20061年前1 -
 zizi0911 共回答了18个问题
zizi0911 共回答了18个问题 |采纳率94.4%(1)过滤 ;玻璃棒
(2)Cu(OH) 2 、Fe(OH) 3 ; 氨水
(3)将Fe 2+ 氧化成Fe 3+
(4)AlO 2 - +CO 2 +2H 2 O = Al(OH) 3 ↓+HCO 3 -
(5)不能 ;因阳极产生的Cu 2+ 不能还原Cr 2 O 7 2-
(6).3361年前查看全部
- 通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7.实验室对含铬废液(含有
通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收k2cr2o7.实验室对含铬废液(含有
cr3+、fe3+、k+、so42-、no3-和少量cr2o72-)回收与再利用工艺如下: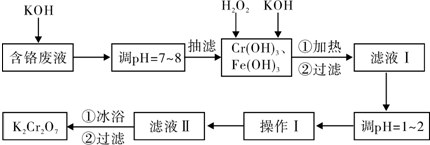
已知:①cr(oh)3+oh-═cro2-+2h2o;②2cro2-+3h2o2+2oh-═2cro42-+4h2o;
③h2o2在酸性条件下具有还原性,能将+6价cr还原为+3价cr.
(1)实验中所用koh浓度为6mol•l-1,现用koh固体配制250ml 6mol•l-1的koh溶液,除烧杯、玻璃棒外,还必需用到的玻璃仪器有______.
(2)抽滤过程中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为______.
(3)滤液Ⅰ酸化前,进行加热的目的是______.冰浴、过滤后,应用少量冷水洗涤k2cr2o7,其目的是______.
(4)下表是相关物质的溶解度数据:
根据溶解度数据,操作Ⅰ具体操作步骤为①______、②______.物质 0℃ 20℃ 40℃ 60℃ 80℃ 100℃ kcl 28.0 34.2 40.1 45.8 51.3 56.3 k2so4 7.4 11.1 14.8 18.2 21.4 24.1 k2cr2o7 4.7 12.3 26.3 45.6 73.0 102.0 kno3 13.9 31.6 61.3 106 167 246.0
(5)称取产品重铬酸钾试样4.000g配成250ml溶液,取出25.00ml于锥形瓶中,加入10ml 2mol•l-1 h2so4和足量碘化钠(铬的还原产物为cr3+),放于暗处5min,然后加入100ml水,加入3ml淀粉指示剂,用0.2400mol•l-1 na2s2o3标准溶液滴定(i2+2s2o32-═2i-+s4o62-).
①若实验***用去na2s2o3标准溶液30.00ml,所得产品的中重铬酸钾的纯度为______(列式计算,设整个过程中其它杂质不参与反应).
②若装na2s2o3标准液的滴定管在滴定前有气泡滴定后没有气泡,测得的重铬酸钾的纯度将:______(填“偏高”、“偏低”、或“不变”). open31年前1
open31年前1 -
 S_L_Zero 共回答了21个问题
S_L_Zero 共回答了21个问题 |采纳率90.5%解题思路:实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收,先加KOH把Cr3+、Fe3+转化沉淀分离出来,再向沉淀中加双氧水和KOH,把Cr(OH)3转化为CrO42-,酸性条件下CrO42-转化为Cr2O72-,通过蒸发浓缩,过滤得到K2Cr2O7;(1)依据溶液配制的步骤和过程分析所用到的仪器,主要仪器应有配制溶液的容量瓶和定容需要的胶头滴管;配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管;(2)实验时,当吸滤瓶中液面高度快达到支管口位置时,为防止液体进入其它装置应该倒出部分液体;(3)H2O2不稳定,受热易分解;K2Cr2O7在冷水中的溶解度较小;(4)根据表中数据可知温度较高时K2Cr2O7的溶解度较大,其它物质的溶解度较小,蒸发浓缩使杂质转化为固体析;,(5)①根据反应:I2+2S2O32-=2I-+S4O62-,碘单质遇到淀粉时,溶液的蓝色消失,据此来回答并计算纯度;②滴定管在滴定前有气泡,会造成V(标准)偏大.(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管,
故答案为:250mL容量瓶、胶头滴管;
(2)实验时,当吸滤瓶中液面高度快达到支管口位置时,为防止液体进入其它装置应该倒出部分液体,所以其操作方法是:拔掉吸滤瓶上的橡皮管,从吸滤瓶上口倒出溶液;
故答案为:拔掉吸滤瓶上的橡皮管,从吸滤瓶上口倒出溶液;
(3)H2O2不稳定,受热易分解,所以通过加热来除去H2O2;K2Cr2O7在冷水中的溶解度较小,用少量冷水洗涤K2Cr2O7,能除去晶体表面残留的杂质,还能减小K2Cr2O7的损耗;
故答案为:除去H2O2;除去晶体表面残留的杂质,减小K2Cr2O7的损耗;
(4)根据表中数据可知温度较高时K2Cr2O7的溶解度较大,其它物质的溶解度较小,蒸发浓缩使杂质转化为固体析,温度较高时K2Cr2O7不析出固体,所以要趁热过滤;
故答案为:①蒸发浓缩; ②趁热过滤;
(5)①由反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-可得反应的关系式为Cr2O72-~3I2~6S2O32-,根据关系式计算.
Cr2O72-~3I2~6S2O32-
1mol 3mol 6mol
n 0.2400×30×10-3mol
则250ml含重铬酸钾的物质的量为n=
0.2400×30×10−3mol
6×10,则所得产品中重铬酸钾纯度为
0.2400×30×10−3×10×294
6×4.000×100%=88.2%,
故答案为:88.2%;
②装Na2S2O3标准液的滴定管在滴定前有气泡滴定后没有气泡,会造成V(标准)偏大,则计算出Na2S2O3的物质的量偏大,重铬酸钾的物质的量偏大,则测得的重铬酸钾的纯度将偏高;
故答案为:偏高.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;化学方程式的有关计算.
考点点评: 本题考查较为综合,涉及溶液的配制、氧化还原反应、溶解平衡以及滴定操作等问题,题目难度中等,本题注意从质量守恒的角度利用关系式法计算纯度.1年前查看全部
- (2014•浙江模拟)电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O7
 (2014•浙江模拟)电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
(2014•浙江模拟)电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
A.阳极反应为Fe-2e-═Fe2+
B.在阴极室,发生的电极反应为:2H2O+2e-═2OH-+H2↑
C.在阳极室,PH增大会有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有1 mol Cr2O72-被氧化 robert_li9851年前1
robert_li9851年前1 -
 唉唷乖乖滴 共回答了18个问题
唉唷乖乖滴 共回答了18个问题 |采纳率83.3%解题思路:A.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子;
B.电解氢氧化钾溶液,阴极生成氢气;
C.由反应式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,生成Fe3+,消耗了大量H+,有利于沉淀的生成;
D.根据反应式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O判断.A.阳-氧-失,活泼电极失电子,Fe-2e-=Fe2+,故A正确;B.在阴极,发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根,故B正确;C.在阳极发生反应:Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O,消耗了大量H+,使...
点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查电解原理、氧化还原反应等,清楚发生的电极反应是解题的关键,是对学生综合能力的考查,难度中等.1年前查看全部
- (2010•汕头一模)铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化
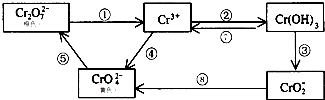 (2010•汕头一模)铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下
(2010•汕头一模)铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下
回答下列问题:
(1)上述反应中需用氧化剂的是______(填编号).
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水.写出电极反应和溶液中进行的反应的离子方程式:阳 极______阴 极______
溶液中______
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式______.
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是______.
(5)要将Fe3+溶液中的杂质离子Cr3+除去,可加入过量NaOH溶液,过滤后再用酸溶解.写出有关的离子方程式______. jary06421年前1
jary06421年前1 -
 九芳界 共回答了18个问题
九芳界 共回答了18个问题 |采纳率94.4%解题思路:(1)根据化合价的变化判断反应是否需要氧化剂;
(2)铁作阳极,电极本身被氧化,反应式为Fe-2e-═Fe2+,溶液呈酸性,H+离子在阴极放电生成氢气,反应式为2H++2e═H2↑,生成的Fe2+离子与Cr2O72-离子发生氧化还原反应;
(3)在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,说明黄色的CrO42-离子与离子反应产生橙色的Cr2O72-离子;
(4)根据溶度积常数判断开始沉淀时需要银离子的浓度,以此判断首先生成沉淀的物质;
(5)要将Fe3+溶液中的杂质离子Cr3+除去,可加入过量NaOH溶液,发生的反应分别有Cr3++4OH-═CrO2-+2H2O;Fe3++3OH-═Fe(OH)3↓,
过滤后再用酸溶解,反应为Fe(OH)3+3H+═Fe3++3H2O.(1)反应Cr3+→CrO42-,CrO2-→CrO42-中,Cr元素的化合价都升高,被氧化,需加入氧化剂,故答案为:④、⑧;
(2)铁作阳极,电极本身被氧化,反应式为Fe-2e-═Fe2+,溶液呈酸性,H+离子在阴极放电生成氢气,反应式为2H++2e═H2↑,Fe2+离子与Cr2O72-离子发生氧化还原反应生成Fe3+离子
和Cr3+离子,反应离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:阳极:Fe-2e-═Fe2+; 阴极:2H++2e═H2↑;溶液中:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
(3)在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,说明黄色的CrO42-离子与离子反应产生橙色的Cr2O72-离子,
该反应为可逆反应,反应式为2CrO42-+2H+ Cr2O72-+H2O,故答案为:2CrO42-+2H+
Cr2O72-+H2O,故答案为:2CrO42-+2H+ Cr2O72-+H2O;
Cr2O72-+H2O;
(4)根据溶度积常数判断,开始生成Ag2CrO4沉淀时,c(Ag+)=
9.0×10−12
c(Cr
O−24),开始生成AgCl沉淀时,c(Ag+)=
1.56×10−10
c(Cl−),向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,开始生成沉淀时,后者需要的银离子浓度较小,首先生成沉淀;故答案为:AgCl;
(5)要将Fe3+溶液中的杂质离子Cr3+除去,可加入过量NaOH溶液,发生的反应分别有Cr3++4OH-═CrO2-+2H2O;Fe3++3OH-═Fe(OH)3↓,过滤后再用酸溶解,
反应为Fe(OH)3+3H+═Fe3++3H2O,故答案为:Cr3++4OH-═CrO2-+2H2O;Fe3++3OH-═Fe(OH)3↓、Fe(OH)3+3H+═Fe3++3H2O.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;离子方程式的书写;氧化还原反应;电极反应和电池反应方程式;电解原理.
考点点评: 本题考查较为综合,涉及氧化还原反应的判断、电解、可逆反应、难溶电解质的转化以及除杂等问题,题目难度中等,本题电解电极方程式的书写以及除杂原理的探究等问题.1年前查看全部
- (2013•赣州模拟)含铬废水对环境污染极大,处理过程中的一个反应方程式为:X+6FeSO4+7H2SO4═Cr2(SO
(2013•赣州模拟)含铬废水对环境污染极大,处理过程中的一个反应方程式为:X+6FeSO4+7H2SO4═Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O,其中X的化学式是( )
A.Cr2(SO4)3
B.K2Cr2O7
C.Cr2O3
D.K2CrO4 zwc3361年前1
zwc3361年前1 -
 sthn4026 共回答了21个问题
sthn4026 共回答了21个问题 |采纳率95.2%解题思路:根据质量守恒定律,化学反应前后原子的种类、原子的个数不变,则可得出X的化学式.根据质量守恒定律可知,反应前后原子的种类没有改变,数目没有增减.反应前已知的原子及个数:铁原子6个、硫原子13个、氧原子52个、氢原子14个;反应后原子及个数:铬原子2个、硫原子13个、氧原子59个、铁原子6个、钾原子2个、氢原子14个,故可知一个X分子中含有2个钾原子、2个铬原子和7个氧原子,故物质X的化学式为K2Cr2O7.
故选B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题主要考查学生运用质量守恒定律进行推断的能力;掌握有关化学式的计算和推断方法.1年前查看全部
- 铁氧化(Fe3O4)法是处理含铬废水的常用方法,其原理是:用FeSO4把废水中Cr2O72-离子还原为Cr3+离子,
铁氧化(Fe3O4)法是处理含铬废水的常用方法,其原理是:用FeSO4把废水中Cr2O72-离子还原为Cr3+离子,
铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是:
用FeSO4把废水中(Cr2O7)2- 离子还原为 Cr3+离子,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或FeO・Fe2O3)的复合氧化物
(Cr x Fe 2-x O3・FeO)
注意:【x和 2-x均为下标,且Cr原子和前一个Fe的化合价均为+3价,后一个Fe原子化合价为+2价】
处理含1 mol Cr2O72-的废水至少需要加入a mol FeSO4・7H2O
求x和a的值, sbhh1年前1
sbhh1年前1 -
 反uu证 共回答了20个问题
反uu证 共回答了20个问题 |采纳率90%FeSO4・7H2O的投加量是由还原Cr6+与提供铁氧体所需的二价铁离子两部分组成的.1mol的Cr2O72-被还原需要6mol的二价铁,生成的2molCr3+与6molFe3+行程铁氧体各自需要1mol和3mol的Fe2+.所以 Cr2O72-与Fe2+的摩尔质量比为1:(6+1+3)即1:10.所以FeSO4・7H2O的理论投加量应为Cr2O72-的十倍.1年前查看全部
- (10分)铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。有关含铬化合物的相互转化关系如下
(10分)铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。有关含铬化合物的相互转化关系如下

回答下列问题:
(1)上述反应中需用氧化剂的是 (填编号)。
(2)工业上处理含Cr 2 O 7 2- 的废水时,一般将剧毒的Cr 2 O 7 2- 转化为Cr 3+ ,以碳为阴极,铁作阳极,电解处理含NaCl、Cr 2 O 7 2- 的酸性废水。写出电极反应和溶液中进行的反应的离子方程式:
阳极 阴极
溶液中
(3)反应⑤是可逆反应,在Na 2 CrO 4 溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式 。 fbex71年前1
fbex71年前1 -
 早春的阳光 共回答了22个问题
早春的阳光 共回答了22个问题 |采纳率90.9%(1) 4 8
(2 )2H + +2e - =H 2 ↑ Fe-2e - =Fe 2+ Cr 2 O 7 2- + 6Fe 2+ + 14H + = 2Cr 3+ +6Fe 3+ +7H 2 O
(3)2CrO 4 2- +2H +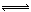 Cr 2 O 7 2- +H 2 O
Cr 2 O 7 2- +H 2 O
本题考查了氧化还原反应、离子反应及电化学的相关知识;
(1)根据铬的化合价可知,化合价升高的反应必然是由外界提供氧化剂
(2)阳极铁要失电子 Fe-2e - =Fe 2+ ,再根据离子的放电顺序知道H + 在阴极放电2H + +2e - =H 2 ↑ ;
Fe 2+ 的产生提供了还原剂,被Cr 2 O 7 2- 氧化:Cr 2 O 7 2- + 6Fe 2+ + 14H + = 2Cr 3+ +6Fe 3+ +7H 2 O
(3)主要考查离子方程式的书写与配平1年前查看全部
- (2014•浙江模拟)工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为:
(2014•浙江模拟)工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为:
已知:CrO2−4
Cr2OH+ ①转化 2−7
Cr3+Fe2+ ②还原
Cr(OH)3↓OH− ③沉淀
(1)步骤①中存在平衡:2CrO42-(黄色)+2H+⇌Cr2O42-(橙色)+H2O
(2)步骤③生成的Cr(OH)3,在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5mol•L-1 时可视作该离子不存下列有关说法中,正确的是( )
A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大
B.步骤①中当2v(CrO42-)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2O达到平衡状态
C.步骤②中,若要还原1mol Cr2O72-离子,需要12mol (NH4)2Fe(SO4)2•6H2O
D.步骤③中,当将溶液的pH调节至6 时,则可认为废水中的铬已除尽 VGTFDRE1年前1
VGTFDRE1年前1 -
 green2010 共回答了10个问题
green2010 共回答了10个问题 |采纳率100%解题思路:A.步骤①中加酸,氢离子浓度增大,平衡正向移动;
B.2v(CrO42-)=v(Cr2O72-)时,正逆反应速率不等;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3;
D.步骤③中,当将溶液的pH 调节至4 时,c(OH-)=10-10mol/L,结合Ksp计算.A.步骤①中加酸,氢离子浓度增大,平衡正向移动,则CrO42-离子浓度减小,故A错误;
B.当2v(CrO42-)=v(Cr2O72-)时,正逆反应速率不等,则该反应不能达到平衡,故B错误;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3,则由电子守恒可知需要6 mol(NH4)2Fe(SO4)2•6H2O,故C错误;
D.步骤③中,当将溶液的pH 调节至6 时,c(OH-)=10-8mol/L,由Ksp可知,c(Cr3+)=
10−32
(10−8)3=10-8mol/L,则可认为废水中的铬元素已经除尽,故D正确;
故选D.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查化学平衡的影响因素,涉及反应速率、平衡移动、转移电子计算、溶解度计算等,注重学生知识迁移应用能力的考查,题目难度中等.1年前查看全部
- 九年级科学题目:急求解 如果电镀废水(含铬、镍、镉)污染的食物中毒,(下面继续)
九年级科学题目:急求解 如果电镀废水(含铬、镍、镉)污染的食物中毒,(下面继续)
,为了解毒,下列4种物质,你不应该选择的是: A 鸡蛋清 B 鲜豆浆 C 鲜牛奶 D糖水
请说明理由,十分感谢 dsptraveller1年前2
dsptraveller1年前2 -
 秋之伊妹 共回答了22个问题
秋之伊妹 共回答了22个问题 |采纳率90.9%选D,鲜牛奶,鸡蛋清,鲜豆浆,都含有蛋白质,而这些重金属会导致人体的蛋白质失去活性,喝这些含有丰富蛋白质的可以缓解毒性,这样的话重金属会优先和这些喝进去的含有蛋白质的物质反应(都到了胃里了吗,接触的面积大,反应就快).而糖水不行,其中没有蛋白质.1年前查看全部
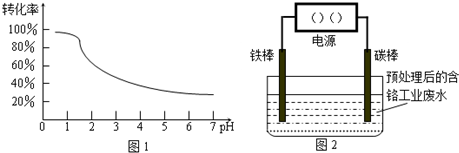
- 处理含铬(Cr)工业废水的原理是将Cr2O2-7转化为Cr3+,再将Cr3+转化为沉淀.已知转化过程中,废水pH与Cr2
处理含铬(Cr)工业废水的原理是将Cr2O2-7转化为Cr3+,再将Cr3+转化为沉淀.已知转化过程中,废水pH与Cr2
处理含铬(Cr)工业废水的原理是将Cr2O2-7转化为Cr3+,再将Cr3+转化为沉淀.已知转化过程中,废水pH与Cr2O2-7转化为Cr3+的关系如图所示.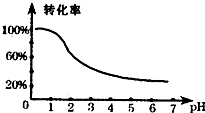
某研究小组为变废为宝,将废水处理得磁性材料Cr0.5Fel1.5FeO4(Fe的化合价依次为+3、+.2价)的实验流程如下: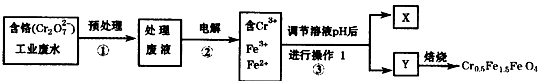
(1)实验室中操作1所用的玻璃仪器名称是______.
(2)物质Y的化学式是______.
(3)步骤①中预处理的关键是______.
(4)步骤②中电解时,阳极的材料是______,阴极的电极反应式为______,电解液中Cr2O2-7转化为Cr3+的离子方程式为______.
(5)含铬废水国家排放标准为
的含量≤0.1000mg/L,用______滴定管取上述溶液X 20.00mL,调节pH后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL.已知酸性条件下,I-被Cr2O2-7氧化为I2,则上述电解法处理后的废水中每升含+6 Cr
的质量为______mg.+6 Cr
 suky3161年前1
suky3161年前1 -
 当众吻你一下 共回答了14个问题
当众吻你一下 共回答了14个问题 |采纳率100%(1)操作1过滤所需仪器为玻璃棒、漏斗、烧杯、铁架台(附铁圈),故答案为:玻璃棒、漏斗、烧杯;
(2)由题给框图之三可得:Fe2+过量,调节PH,产生Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀物,故答案为:Cr(OH)3、Fe(OH)3和Fe(OH)2;
(3)根据废水pH与Cr2O72-转化为Cr3+的关系图1可知:当pH<1时,Cr2O72-转化为Cr3+的转化率接近100%,故答案为:调节废液pH<1;
(4)步骤②中电解要产生Fe2+,所以阳极的材料铁,电极反应为:Fe-2e-=Fe2+,阴极溶液中的氢离子放电,电极反应式为:2H++2e-=H2↑;
Cr2O72-有较强氧化性,Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,Cr2O72-在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,离子方程式为:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O;
故答案为:铁棒;2H++2e-=H2↑;Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O;
(5)Cr2O2-7具有强氧化性,能腐蚀碱式滴定管的橡皮管,所以放在酸式滴定管中;
取上述溶液X 20.00mL,调节pH后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL.已知酸性条件下,I-被Cr2O2-7氧化为I2,
Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,
1 6
n(Cr2O72-) 9×10-3L×0.0001mol/L
n(Cr2O72-)=1.5×10-7mol,
废水1L中n(Cr2O72-)=1.5×10-7mol×50=7.5×10-6mol,废水1L中n(
+6
Cr)=1.5×10-5mol,电解后的1L废水中含量=1.5×10-5mol×52g/mol=0.78mg,不符合国家排放标准为
+6
Cr的含量≤0.1000mg/L.
故答案为:酸式;0.78.1年前查看全部
- 电镀含铬废水的成分有哪些?含量一般是多少?
 cshualiang1年前1
cshualiang1年前1 -
 nuix1016 共回答了22个问题
nuix1016 共回答了22个问题 |采纳率90.9%是 10000\1年前查看全部
- 工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为:
工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为:
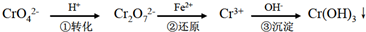
已知:
(1)步骤①中存在平衡:2Cr O42-(黄色)+2H+⇌Cr2O42-(橙色)+H2O
(2)步骤③生成的Cr(OH)3 在溶液中存在沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3 的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol•L-1 时可视作该离子不存在.
下列有关说法中,正确的是( )
A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大
B.步骤①中当溶液呈现深黄色,且2v(CrO42-)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2O 达到平衡状态
C.步骤②中,若要还原1 mol Cr2O72-离子,需要6 mol(NH4)2Fe(SO4)2•6H2O
D.步骤③中,当将溶液的pH 调节至4 时,可认为废水中的铬元素已基本除尽 xx民间xx会1年前1
xx民间xx会1年前1 -
 youmingwu 共回答了16个问题
youmingwu 共回答了16个问题 |采纳率93.8%解题思路:A.步骤①中加酸,氢离子浓度增大,平衡正向移动;
B.2v(CrO42一)=v(Cr2O72-)时,正逆反应速率不等;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3;
D.步骤③中,当将溶液的pH 调节至4 时,c(OH-)=10-10mol/L,结合Ksp计算.A.步骤①中加酸,氢离子浓度增大,平衡正向移动,则CrO42-离子浓度减小,故A错误;
B.2v(CrO42-)=v(Cr2O72-)时,正逆反应速率不等,则该反应不能达到平衡,故B错误;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3,则由电子守恒可知需要6 mol(NH4)2Fe(SO4)2•6H2O,故C正确;
D.步骤③中,当将溶液的pH 调节至4 时,c(OH-)=10-10mol/L,由Ksp可知,c(Cr3+)=
10−32
(10−10)3=10-2mol/L,废水中的铬元素没有除尽,故D错误;
故选C.点评:
本题考点: 化学平衡的影响因素;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查化学平衡的影响因素,涉及反应速率、平衡移动、转移电子计算、溶解度计算等,注重学生知识迁移应用能力的考查,题目难度中等.1年前查看全部
- 铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是用FeSO4把废水中的Cr2O2−7还原为Cr3+,并通过调节废
铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是用FeSO4把废水中的Cr2
还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4)的复合氧化物(O 2−7+3 Crx
O3•+3 Fe2−x
O).处理含1molCr2+2 Fe
的废水至少需要加入amolFeSO4•7H2O,下列结论正确的是( )O 2−7
A.x=1,a=5
B.x=0.5,a=8
C.x=1.a=10
D.x=0.5.a=lO lc76161年前1
lc76161年前1 -
 难得真爱 共回答了21个问题
难得真爱 共回答了21个问题 |采纳率95.2%解题思路:由题目信息可知,Cr2O72-中Cr元素由+6价还原为+3价,FeS04中Fe元素被氧化为+3价,且Fe元素部分化合价为变化,根据电子转移守恒有3x=2-x,据此确定x的值;
计算处理1molCr2O72-时被氧化为+3价的Fe元素物质的量,进而计算复合氧化物中+2的Fe元素物质的量,根据Fe元素守恒计算FeS04•7H2O的物质的量.由题目信息可知,Cr2O72-中Cr元素由+6价还原为+3价,FeS04中Fe元素被氧化为+3价,且Fe元素部分化合价为变化,根据电子转移守恒计算有3x=2-x,解得x=0.5;
处理1molCr2O72-,根据电子转移守恒可知,被氧化为+3价的Fe元素物质的量为
1mol×2×(6−3)
3−2=6mol,复合氧化物中+2的Fe元素与+3价Fe元素的物质的量之比为1:(2-x)=1:(2-0.5)=1:1.5,故算复合氧化物中+2的Fe元素物质的量为[6mol/1.5]=4mol,根据Fe元素守恒可知FeS04•7H2O物质的量为6mol+4mol=10mol,
故选D.点评:
本题考点: 氧化还原反应;氧化还原反应的计算.
考点点评: 本题考查氧化还原法的有关计算,难度中等,注意根据电子转移守恒、原子守恒进行的计算.1年前查看全部
- 关于结晶水,判断结晶水的个数.题文:六价铬对人体有毒,含铬废水要经过化学处理后才能排放.工业上为处理含有Cr2O72-的
关于结晶水,判断结晶水的个数.
题文:六价铬对人体有毒,含铬废水要经过化学处理后才能排放.工业上为处理含有cr2o72-的酸性废水采用如下方法:在工业废水中加入适量nacl,然后以铁为电极电解,鼓入空气,最后将cr2o72-以cr(oh)3形式沉淀下来而除去,且还生成fe(oh)3沉淀,这种处理方法可使工业废水中的cr2o72-含量达到***规定的排放标准.
试回答:
(1)在工业废水中加入nacl的作用是____.
(2)有关的电极反应式是____.
(3)由cr2o72-转化为cr3+的离子方程式是___.
(4)电解过程中工业废水由酸性变碱性的原因是___.
(5)另一种处理含铬废水的方法是用绿矾 [feso4·7h2o]把废水中的六价铬还原成铬离子,再加入过量石灰水,使铬离子转为氢氧化铬[cr(oh)3]沉淀,其主要反应的化学方程式如下:
h2cr2o7+6feso4+6h2so4=3fe2(so4)3+ cr2 (so4)3+7h2o
现用上法处理1×104 l含铬(+6价)78 mg·l-1 的废水(cr的相对原子质量为52),
试回答:
①处理后沉淀除cr(oh)3外,还有__ (用化学式来表示).
②需用绿矾多少千克?____.
(1)增强废水的导电能力
(2)阳极:fe-2e-=fe2+
阴极:2h++2e-=h2↑
(3) cr2o72- +6fe2+ +14h+=2cr3+ +7h2o +6 fe3+
(4)电解过程中,由于h+放电,因而破坏了水的电离平衡,导致溶液中c( oh-)>c(h+),因而废水 由酸性变为碱性
(5)①fe(oh)3和caso4·2h2o
②12.51 kg
看第五问,得出了硫酸钙沉淀是很明显,但是如何判断结晶水的个数.是根据硫酸钙常有的特性(即是不是硫酸钙的结晶水一般是两个),还是具体的计算?
题目较长较多,希望回答者耐心回答, S雨华茶1年前1
S雨华茶1年前1 -
 ee456 共回答了18个问题
ee456 共回答了18个问题 |采纳率83.3%考试时,有时间计算,没时间直接写.因为硫酸钙一般有两个结晶水,可以查阅参考书.平时做题还是算算比较好.1年前查看全部
- 铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下:
铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下:
回答下列问题:
(1)上述转化关系中属于氧化还原反应的是______(填编号),其中需要使用氧化剂的是______(填编号).
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______.
(3)由图示信息可知,有一种含铬化合物显两性,写出该化合物与NaOH溶液反应的离子方程式:______.
(4)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水.写出电极反应和溶液中进行的反应的离子方程式.阳极______ 阴极______溶液中______.
(5)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是______. ol61231年前1
ol61231年前1 -
 盟儿 共回答了19个问题
盟儿 共回答了19个问题 |采纳率89.5%解题思路:(1)根据Cr元素的化合价变化来分析氧化还原反应,若Cr元素的化合价升高,则需要加入氧化剂;
(2)根据Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色及图中反应⑤的转化来解答;
(3)根据氢氧化铝具有两性来分析Cr(OH)3的性质,并完成离子反应;
(4)电解池中,金属作阳极时,金属失去电子,溶液中的阳离子得到电子,并利用氧化还原反应来分析溶液中的离子反应;
(5)根据溶度积计算沉淀需要的Ag+的浓度,浓度小的首先转化为沉淀.(1)上述几步转化中,①中Cr元素的化合价降低,④⑧中Cr元素的化合价升高,则①④⑧属于氧化还原反应,且④⑧中需要加入氧化剂,
故答案为:①④⑧;④⑧;
(2)由Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色及转化⑤可知,发生的离子反应为2CrO42-+2H+ Cr2O72-+H2O,
Cr2O72-+H2O,
故答案为:2CrO42-+2H+ Cr2O72-+H2O;
Cr2O72-+H2O;
(3)转化图中只有氢氧化铬与氢氧化铝类似,则氢氧化铬具有两性,能与碱反应,离子反应为Cr(OH)3+OH-=CrO2-+2H2O,
故答案为:Cr(OH)3+OH-=CrO2-+2H2O;
(4)铁作阳极,则阳极反应为Fe-2e=Fe2+,溶液中的阳离子H+在阴极放电,则阴极反应为H++2e=H2↑,电解产生的亚铁离子具有还原性,与
Cr2O72-发生氧化还原反应,Cr2O72-转化为Cr3+,则溶液中发生的离子反应为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:Fe-2e=Fe2+;H++2e=H2↑;6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
(5)Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,
设Na2CrO4和NaCl的浓度都为1mol/L,
Ag2CrO4沉淀时需要的c(Ag+)=
9.0×10−12=3×10-6,
AgCl沉淀时需要的c(Ag+)=1.56×10-10,则AgCl先沉淀,故答案为:AgCl.点评:
本题考点: 氧化还原反应;难溶电解质的溶解平衡及沉淀转化的本质;电解原理.
考点点评: 本题考查氧化还原反应及物质的转化,难度较大,(5)是学生解答中的难点,应学会利用溶度积来进行简单计算.1年前查看全部
- 如何解释含碳量0.4%含铬12%的铬钢属于过共析钢,而含碳量1.2%含铬12%的铬钢属于莱
 月下青竹1年前1
月下青竹1年前1 -
 想象子明 共回答了19个问题
想象子明 共回答了19个问题 |采纳率78.9%按照金相组织来解释.前者平衡态是渗碳体加珠光体,后者出现莱氏体.1年前查看全部
- 电镀厂含铬废水的来源 电镀工艺流程的哪几个阶段会产生含铬废水 全面一些
电镀厂含铬废水的来源 电镀工艺流程的哪几个阶段会产生含铬废水 全面一些
镀哪几种金属(如金、银、铜、铁、镍、锌、锡)的过程中会有含铬废水产生,只是在钝化后这一个阶段会产生含铬废水吗 尽管曾经1年前1
尽管曾经1年前1 -
 flywangi 共回答了21个问题
flywangi 共回答了21个问题 |采纳率85.7%电镀槽里面电镀液需要定期更换,应该作为危险废物处理处置,如果管理不当,可能进入废水.
镀件需要多级清洗,会产生含铬清洗废水1年前查看全部
- 含镍、含铬废水能否混在一起处理
 shuitailz1年前1
shuitailz1年前1 -
 58671771 共回答了20个问题
58671771 共回答了20个问题 |采纳率85%最好能分开处理,沉淀的话,铬需要氧化成3价的,然后再沉淀处理.也可以用我们的杜笙CH-90螯合树脂直接回收镍,同时达到排放标准,可处理至0.1ppm以下.含铬废水可以直接用A-21S树脂直接回收六价铬,制成铬酸回用,可以处理至ppb级别.
需要可以找我,看我个人资料
杜笙离子交换树脂
于先生1年前查看全部
- (2013•安徽模拟)云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注.利用化学原理可以对工厂排放的含铬废水、
(2013•安徽模拟)云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注.利用化学原理可以对工厂排放的含铬废水、铬渣等进行有效处理.
I.含铬废水的处理:某企业排放的含铬废水中含有较多毒性较大的Cr2O2-7,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程.
(1)加酸调节到pH=6,则用pH试纸测定溶液pH的操作是:______.
(2)在含Cr2O2-7废水中存在着平衡:Cr2
+H20⇌2CrO 2−7
+H+,请写出该平衡的平衡常数表达式k=O 2−4c2(C
)c(H+)rO 2−4c(
)Cr2O 2−7,若继续加水稀释,平衡将______移动(填“正向”、“逆向”“不”).c2(C
)c(H+)rO 2−4c(
)Cr2O 2−7
(3)请写出通入SO2时发生的离子反应方程式:______.
(4)写出加入铝粒在高温下发生反应制取铬的化学方程式2Al+Cr2O3
Al2O3+2Cr高温 .2Al+Cr2O3.
Al2O3+2Cr高温 .
Ⅱ.还有一种净化处理方法是将含+6价Cr的废水放人电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O2-7发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KSPFe(OH)3=4.0×10-38,KSPCr(OH)3=6.0×10-31].
①电解过程中NaCI的作用是______.
②已知电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为______mol•L-1. 寻找过客1年前1
寻找过客1年前1 -
 蓓蓓贝贝 共回答了14个问题
蓓蓓贝贝 共回答了14个问题 |采纳率92.9%解题思路:Ⅰ(1)在测定PH值时,不能湿润、稀释,需要用干燥结晶的玻璃棒;
(2)根据化学平衡常数的定义可解;加入水稀释,平衡向浓度增的方向移动;
(3)二氧化硫与Cr2O72-离子发生氧化还原反应生成SO42-离子和Cr3+离子;
(4)根据铝热反应的概念进行解答;
Ⅱ①NaCl为电解质,加入适量的NaCl可增强溶液的导电能力;
②先根据KspFe(OH)3和c(Fe3+)求出c(OH-),然后再根据c(OH-)和KspCr(OH)3求出c(Cr3+).Ⅰ(1)在测定PH值时,不能湿润、稀释,正确的是将一小块PH试纸放在表面皿上,用玻璃棒蘸取少量待测液,滴在PH试纸上,静置几秒,再与比色卡对比;
故答案为:将一小块PH试纸放在表面皿上,用玻璃棒蘸取少量待测液,滴在PH试纸上,静置几秒,再与比色卡对比;
(2)根据化学平衡常数的定义,可知Cr2O72-(aq)+H2O(l)⇌2CrO42-(aq)+2H+(aq)的平衡常数K=
c2(C
rO2−4)c(H+)
c(
Cr2O2−7);
加入水稀释,平衡向浓度增的方向移动,左边的离子稀释为1,右边的离子系数为3,加水平衡正向移动;
故答案为:
c2(C
rO2−4)c(H+)
c(
Cr2O2−7);正;
(3)重铬酸根具有强氧化性,能将二氧化硫中+4价的硫氧化为+6价,离子反应为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O,
故答案为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O;
(4)根据铝热反应的概念,铝与氧化铬在高温下生成铬和氧化铝,反应方程式为2Al+Cr2O3
高温
.
Al2O3+2Cr;
故答案为:2Al+Cr2O3
高温
.
Al2O3+2Cr;
Ⅱ①因NaCl为电解质,加入适量的NaCl可增强溶液的导电能力,故答案为:增强溶液的导电性;
②溶液中c(OH-)=
3
KspFe(OH)3
c(Fe3+)
=
3
4.0×10−38
2.0×10−13
mol/L=
32.0×10−25
mol/L,则溶液中c(Cr3+)=
KspCr(OH)3
C3(OH点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;化学平衡常数的含义;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了PH值测定、化学平衡常数的计算以及Ksp的有关计算等内容,题目难度中等,注意对图象的分析和数据的处理.1年前查看全部
- 铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是:用FeSO4把废水中Cr2O72-离子还原为 Cr3+离子,
铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是:用FeSO4把废水中Cr2O72-离子还原为 Cr3+离子,
铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是:
节废水的pH,使生成求x和a的值 晓cc1年前1
晓cc1年前1 -
 aihang9635 共回答了25个问题
aihang9635 共回答了25个问题 |采纳率84%x=0.5 a=101年前查看全部
- 工业含铬(Cr)废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.废水pH与Cr2O72-转化为C
工业含铬(Cr)废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.废水pH与Cr2O72-转化为Cr3+的关系如图1,实验室模拟工业电解法处理含铬废水的装置如图2:
请根据以上知识回答下列问题:
(1)含铬废水预处理的方法是______.
(2)在图2中连接铁棒的一极是电源的______极.
(3)实验中除能观察到废水颜色发生变化外,还能观察到的现象是______.
表一:
(4)当废水颜色不再发生明显变化时,切断电源,取出电极,再调节电解液的pH至8左右.调节pH的目的是______.沉淀物 Fe(OH)3 Fe(OH)2 Cr(OH)3 Al(OH)3 开始沉淀 2.7 7.5 4.3 3.4 完全沉淀 4.1 9.7 5.6 5.2
(5)含铬废水国家排放标准为
含量≤0.1000mg/L.取上述电解后的废水200.00mL,调节pH=1后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL.已知酸性条件下,I-被Cr2O72-氧化的产物为I2.用计算所得数据说明上述电解法处理后的废水是否符合国家排放标准______.+6 Cr  free_cheng1年前1
free_cheng1年前1 -
 sxxylrq 共回答了23个问题
sxxylrq 共回答了23个问题 |采纳率100%解题思路:(1)根据废水pH与Cr2O72-转化为Cr3+的关系图1分析;
(2)在电解池中,阳极是活泼金属电极时,则电极本身失去电子,以此来解答;
(3)阴极上是电解质中阳离子得电子的反应,重铬酸根离子具有强氧化性,亚铁离子具有还原性,生成Fe3+,Cr3+,Fe3+、Cr3+转化为氢氧化物沉淀;
(4)根据Cr(OH)3、Fe(OH)3沉淀的PH值进行解答;
(5)根据Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O计算;(1)根据废水pH与Cr2O72-转化为Cr3+的关系图1可知:当pH为1时,Cr2O72-转化为Cr3+的转化率接近100%,
故答案为:调节pH为1左右;
(2)亚铁离子与Cr2O72-发生氧化还原反应被还原为Cr3+,在电解池中,阳极是活泼金属电极时,则电极本身失去电子,所以须用Fe做电极进行电解,阳极发生Fe-2e-=Fe2+,与电源正极相连的为阳极,
故答案为:正;
(3)在电解池中,阳极是活泼金属铁电极时,则电极本身失去电子,即Fe-2e-=Fe2+,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,即6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,阴极,根据放电顺序阴极上是电解质中氢离子得电子的反应,即2H++2e=H2↑,所以阴极区产生沉淀,Fe3++3OH-═Fe(OH)3↓,Cr3++3OH-═Cr(OH)3↓,
故答案为:阴极区产生沉淀;
(4)由氢氧化铁和氢氧化铬沉淀的pH表可知,氢氧化铁完全沉淀pH应控制在4.1,氢氧化铬完全沉淀pH应控制在5.6,调节电解液的pH至8左右,目的使溶液中的Fe3+、Cr3+全部转化为氢氧化物沉淀,
故答案为:使溶液中的Fe3+、Cr3+全部转化为氢氧化物沉淀;
(5)废水200.00mL,调节pH=1后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL,Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,
1 6
n(Cr2O72-)9×10-3L×0.0001mol/L n(Cr2O72-)=1.5×10-7mol,废水1L中n(Cr2O72-)=7.5×10-7mol,废水1L中n(
+6
Cr)=1.5×10-6mol,电解后的废水中
+6
Cr含量=1.5×10-6mol×52g/mol=0.0780 mg/L,符合国家排放标准为
+6
Cr含量≤0.1000mg/L,
故答案为:符合;点评:
本题考点: 金属的回收与环境、资源保护;难溶电解质的溶解平衡及沉淀转化的本质;电解原理.
考点点评: 本题考查较为综合,涉及氧化还原反应、电解、化学计算等,需要学生具备扎实的基础知识,平时注意培养分析和解决问题的能力,题目难度中等.1年前查看全部
- 怎样用化学方法将含铬(6价)中的铬除去.站在就是不知道加什么可以使六价的还原成三价的氢氧化铬.饱和的氢氧化钙可以吗.,.
 flyazure1年前1
flyazure1年前1 -
 acmilan25 共回答了20个问题
acmilan25 共回答了20个问题 |采纳率90%饱和的氢氧化钙怎么可能可以呢……非还原剂
一般六价铬实在酸性条件下被还原的,因为Cr2O7 2-/Cr3+的电极电势(铬酸盐在酸性调节下转变成重铬酸盐)比在碱性条件下(铬酸根稳定)CrO4 2-/Cr(OH)3的电极电势“正”得多1年前查看全部
- 有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+•Fe3+[Fe(1-x)3+•Crx3+•O4].向含有
有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+•Fe3+[Fe(1-x)3+•Crx3+•O4].向含有1.92mol硝酸的某溶液中加入一定量的该种铁氧体,恰好完全反应后,收集到NO、NO2的混合气体2.688L(标准状况).
计算:(均需写出计算过程):
①参加反应的铁氧体的物质的量.
②所得气体中NO、NO2的体积比. 素素水水1年前1
素素水水1年前1 -
 快乐像花儿一样 共回答了19个问题
快乐像花儿一样 共回答了19个问题 |采纳率94.7%解题思路:①铁氧体与硝酸反应生成Fe(NO3)3、Cr(NO3)3,令参加反应的铁氧体为n mol,由Fe、Cr原子守恒,则Fe(NO3)3、Cr(NO3)3的总物质的量为3n mol,根据N元素守恒列方程计算;
②设生成NO为ymol,NO2为ymol,根据电子转移守恒与气体物质的量列方程,进而计算NO、NO2的体积.①NO、NO2的混合气体2.688L,物质的量=[2.688L/22.4L/mol]=0.12mol,铁氧体与硝酸反应生成Fe(NO3)3、Cr(NO3)3,令参加反应的铁氧体为n mol,则Fe(NO3)3、Cr(NO3)3的总物质的量=nmol+nmol+n(1-x)mol+xn mol=3n mol,由N元素守恒:3n mol×3+0.12mol=1.92mol,解得n=0.2,
答:参加反应的铁氧体的物质的量为0.2mol.
②反应亚铁离子失去电子,转移电子为0.2mol×(3-2)=0.2mol,
设生成NO为xmol,NO2为ymol,由转移电子及二者物质的量,则:
x+y=0.12
3x+y=0.2,
解得x=0.04 y=0.08,
故V(NO):V(NO2)=0.04mol:0.08mol=1:2;
答:所得气体中NO、NO2的体积比为1:2.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题以电子工业广泛应用的含铬铁氧体为载体,考查混合物的有关计算,难度中等,注意根据元素守恒与电子转移守恒进行解答.1年前查看全部
- 我有一个材料主要是含铬和钒为什么它被磁场的引力特别大(含铬24 含钒5.5)
我有一个材料主要是含铬和钒为什么它被磁场的引力特别大(含铬24 含钒5.5)
现在上面的材料找不到,有其他材料可以替代吗?我要引力大的。 Faithyee1年前2
Faithyee1年前2 -
 白玉汤盗圣 共回答了22个问题
白玉汤盗圣 共回答了22个问题 |采纳率86.4%可以拿电磁铁试试 用硅钢或软铁的材料,并在硅钢或软铁上饶上圈银 或者铜 或者金 这些都是导电性最强的材料 同样它们对磁场的引力也就大了1年前查看全部
大家在问
- 1高等职业院校人才培养工作状态数据采集平台 英文怎么翻译
- 2“日落胭脂红”中“胭脂”指?
- 3比起打篮球,我更喜欢打羽毛球.用英文翻译.
- 4常见分布的数学期望和方差
- 5放学了,教室里只剩下你和晓明(本来值日生)晓明说:“他们都走了,教室里又不脏,不如我们也走了,这时你怎么劝他和你一起打扫
- 6小明骑自行车去某地,去时用了8小时返回时速度比去时快6千米,返回时了7小时问小明家离某地的距离是多远?
- 7篮子里有若干李子,取它的一半零一个给第一个人,余下李子的一半零一个给第二个人;最后剩2个.原来有多少个
- 8求一道物理题 一质点绕半径为r的原作匀速圆周运动,角速度为w,周期为T,她在六分之T内的品均速度大小为
- 9坐地日行八万里巡天遥看一千河 诗句所说的自然现象是什么?
- 10正弦信号sin(wt)一定是周期信号么?当2pi/w=无理数时还是周期信号么
- 11初一【绝对值】问题1.下列等式不成立的是() A.丨-2/3丨<丨-1/3丨 B.-2/3<-1/3 C.-5.1>6
- 12麻烦帮我翻一段中译英,不要机器或者网络词典翻的.语气尽量婉转友好.中文如下:您好,我真的一直无法使用PAYPAL支付,并
- 13蓬头稚子学垂纶描写的是什么
- 14离子强度与离子活度的区别,什么时候离子活度可以等于离子浓度?
- 15It's a long time since …… 后加什么时态 是固定的吗 还是看情况
