Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O 双桥线、单桥线、化合价升降、氧化剂、还原剂、氧化产物、还原
 城市主角2022-10-04 11:39:541条回答
城市主角2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 wangcai_ying 共回答了20个问题
wangcai_ying 共回答了20个问题 |采纳率80%- 双线桥:Cu指向CuSO4中的Cu,H2SO4中的S指向SO2中的S.
单线桥:Cu指向H2SO4中的S.
化合价:Cu升高0到+2,S降低+6到+4.
氧化剂:H2SO4
还原剂:Cu
氧化产物:CuSO4
还原产物:SO2
很高兴为您解答 - 1年前
相关推荐
- 在Cu+2H2SO4(浓) △ . CuSO4+SO2↑+2H2O
在Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O反应中,若有3.2g的Cu参与反应,则被还原的H2SO4的物质的量是______mol.△ . 风吹九微火1年前1
风吹九微火1年前1 -
 雪映蓝天0902 共回答了18个问题
雪映蓝天0902 共回答了18个问题 |采纳率88.9%n(Cu)=[3.2g/64g/mol]=0.05mol,
Cu+2H2SO4(浓)
△
.
CuSO4+SO2↑+2H2O 被还原H2SO4
1mol 1mol
0.05moln
n=0.05mol,
故答案为:0.05.1年前查看全部
- (2013•泰兴市二模)在Cu+2H2SO4=CuSO4+SO2↑+2H2O反应中,反应物和生成物中不存在的物质种类是(
(2013•泰兴市二模)在Cu+2H2SO4=CuSO4+SO2↑+2H2O反应中,反应物和生成物中不存在的物质种类是( )
A.酸
B.碱
C.盐
D.氧化物 清水淡雅1年前1
清水淡雅1年前1 -
 三界缝隙之灵 共回答了13个问题
三界缝隙之灵 共回答了13个问题 |采纳率100%解题思路:根据氧化物是指有两种元素组成且一种是氧元素的化合物;酸是指在电离时产生的阳离子全部是氢离子的化合物;碱是指在电离时产生的阴离子全部是氢氧根离子的化合物;盐是由金属离子(或铵根离子)和酸根离子组成的化合物;据此进行分析判断.A、硫酸是由氢离子和硫酸根离子组成的化合物,属于酸,故选项错误.
B、反应物和生成物中不存在碱,故选项正确.
C、CuSO4是由铜离子和硫酸根离子组成的化合物,属于盐,故选项错误.
D、SO2、H2O都是由两种元素组成且其中一种元素是氧的化合物,都属于氧化物,故选项错误.
故选B.点评:
本题考点: 常见的氧化物、酸、碱和盐的判别.
考点点评: 本题难度不大,考查物质类别的判别,抓住氧化物、酸、碱、盐的特征、熟悉常见的物质的组成是正确解答本题的关键.1年前查看全部
- 实验室少量制取硫酸铜有多种方法.可直接利用碎铜屑与浓硫酸共热制取[原理是:Cu+2H2SO4(浓)
实验室少量制取硫酸铜有多种方法.可直接利用碎铜屑与浓硫酸共热制取[原理是:Cu+2H2SO4(浓)
CuSO4+SO2↑+H2O],因反应中产生的二氧化硫气体有毒,污染室内环境,我们通常用碎铜屑与稀硫酸经几步反应来获取硫酸铜.请写出你的设计思路(用化学方程式表示,用到的其他简单物质可自己补充):△ .2Cu+O2
2CuO,CuO+H2SO4═CuSO4+H2O加热 .2Cu+O2
2CuO,CuO+H2SO4═CuSO4+H2O加热 .
对比以上两种方法,你所设计方法的优点是______. 假装逍遥1年前1
假装逍遥1年前1 -
 云端莹影 共回答了11个问题
云端莹影 共回答了11个问题 |采纳率100%解题思路:实验室少量制取硫酸铜有多种方法.可直接利用碎铜屑与浓硫酸共热制取[原理是:Cu+2H2SO4(浓)△. CuSO4+SO2↑+H2O],因反应中产生的二氧化硫气体有毒,污染室内环境;则可以先把铜转化为氧化铜,在让氧化铜与稀硫酸反应生成硫酸铜,则不会有二氧化硫生成.为了防止二氧化硫,污染室内环境;则先把铜转化为氧化铜,再让氧化铜与稀硫酸反应生成硫酸铜;故化学方程式为:2Cu+O2
加热
.
2CuO,CuO+H2SO4═CuSO4+H2O;对比以上两种方法,你所设计方法的优点是:无污染、硫酸的利用率高.
故答为:2Cu+O2
加热
.
2CuO,CuO+H2SO4═CuSO4+H2O;无污染、硫酸的利用率高点评:
本题考点: 物质的相互转化和制备;金属的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 了解物质的相互转化和制备的方法及注意事项;掌握金属的化学性质以及根据题目中的信息正确书写化学方程式的方法.1年前查看全部
- Cu+2H2SO4(浓)=CuSO4+SO2+2H20
Cu+2H2SO4(浓)=CuSO4+SO2+2H20
若生成32gSO2,则被还原的H2SO4是多少g ALEX-Edison1年前4
ALEX-Edison1年前4 -
 看到了狮子的眼泪 共回答了16个问题
看到了狮子的眼泪 共回答了16个问题 |采纳率100%n(SO2)=32g/(32+16*2)=0.5
n(H2SO4还原) = n(SO2)=0.5
所以 m(H2SO4还原)= 0.5 *(2+32+16*4)=49 (g)
注:只有1半的H2SO4被还原,另一半硫元素化合价不变1年前查看全部
- 废铜屑与浓硫酸反应,能制得硫酸铜,其反应原理是:Cu+2H2SO4(浓) △
废铜屑与浓硫酸反应,能制得硫酸铜,其反应原理是:Cu+2H2SO4(浓)
CuSO4+X↑+2H2O,则X是______(写化学式).若用废铜屑、稀硫酸和空气作原料制取硫酸铜,依次写出制备过程中发生反应的化学方程式______,______.△ .. 燕北响马1年前3
燕北响马1年前3 -
 liuwae5419 共回答了12个问题
liuwae5419 共回答了12个问题 |采纳率91.7%解题思路:根据质量守恒定律中各元素原子的种类和个数不变来确定物质X的化学式,根据觉金属的化学性质来确定制备硫酸铜的化学反应并写出化学方程式.由质量守恒定律可知,发生化学反应前后各元素原子的种类和个数都是不变的,通过比较可知,物质X是由一个硫原子和两个氧原子构成的,故其化学式为SO2;由于铜在金属活动性顺序中排在氢的后面,故不能和稀硫酸发生置换反应生成硫酸铜和氢气,但可以先让铜与氧气反应生成氧化铜,再把氧化铜与硫酸反应即可生成硫酸铜和水,从而得到硫酸铜.涉及的化学方程式为:2Cu+O2
△
.
2CuO;CuO+H2SO4═CuSO4+H2O.
故答案为:SO2;2Cu+O2
△
.
2CuO;CuO+H2SO4═CuSO4+H2O.点评:
本题考点: 金属的化学性质;酸的化学性质;有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 一般情况下排在氢前面的金属能和酸发生置换反应生成相应的盐和氢气.值得注意的得这里的金属一般不包括钾、钙、钠三种,酸指的是盐酸和稀硫酸.1年前查看全部
- 用32g Cu与足量的浓硫酸反应制取二氧化硫气体,反应方程式:Cu+2H2SO4(浓)
用32g Cu与足量的浓硫酸反应制取二氧化硫气体,反应方程式:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O.△ .
(1)生成的二氧化硫在标准状况下的体积是多少?
(2)该反应中做氧化剂的H2SO4的物质的量为多少? 伯乐3691年前1
伯乐3691年前1 -
 IBL1 共回答了18个问题
IBL1 共回答了18个问题 |采纳率77.8%解题思路:(1)设生成在标准状况下SO2为xL,根据方程式计算;
(2)起氧化剂作用的硫酸生成二氧化硫,由方程式可得关系式Cu~H2SO4(氧化剂),据此计算.(1)设生成在标准状况下SO2为xL,则:
Cu+2H2SO4(浓)═Cu SO4+SO2↑+2H2O
64g22.4L
32g x
所以,64g:32g=22.4L:xL,解得x=11.2,
答:生成的二氧化硫在标准状况下的体积是11.2L.
(2)起氧化剂作用的硫酸生成二氧化硫,由方程式可得关系式Cu~H2SO4(氧化剂),
设做氧化剂的H2SO4为y mol,则:
Cu-----------------H2SO4(氧化剂)
64g 1mol
32g ymol
所以,64g:32g=1mol:ymol,解得y=0.5,
答:做氧化剂的H2SO4的物质的量为0.5mol.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查根据方程式的计算、氧化还原反应计算,难度不大,注意对基础知识的掌握.1年前查看全部
- 在Cu+2H2SO4(浓) △ . CuSO4+SO2↑+2H2O
在Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O反应中△ .
(1)______ 元素被氧化,______ 是氧化剂.
(2)用双线桥标出该反应电子转移的方向和数目.Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O△ .
(3)若有2.4mol的H2SO4参与反应,则被还原的H2SO4为______ g. undertager1年前1
undertager1年前1 -
 巧儿巧儿 共回答了17个问题
巧儿巧儿 共回答了17个问题 |采纳率94.1%解题思路:(1)失电子化合价升高的元素被氧化,得电子化合价降低的反应物是氧化剂;
(2)铜失电子数=1(2-0)=2,硫酸得电子数=1(6-4)=2,该反应中转移电子数是2,用用双线桥标出该反应电子转移的方向和数目;
(3)根据参加反应的和参加氧化还原反应的硫酸之间的关系式计算.(1)Cu+2H2SO4(浓)△. CuSO4+SO2↑+2H2O中,铜元素的化合价由0价→+2价,失电子被氧化,硫元素的化合价由+6价→+4价,所以硫酸得电子作氧化剂,故答案为:铜;硫酸;(2)铜失电子...
点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应,明确元素化合价变化是解本题关键,难点是标电子转移的方向和数目,注意箭头的指向.1年前查看全部
- 1.实验室用浓H2SO4与铜反应制取SO2的反应方程式为 :Cu+2H2so4(浓)==(条件为加热)CuSO4+SO2
1.实验室用浓H2SO4与铜反应制取SO2的反应方程式为 :Cu+2H2so4(浓)==(条件为加热)CuSO4+SO2+2H2O,当得
2.24L(标准状况下)SO2时,有多少克铜被氧化?被还原的H2SO4是多少克?
请帮我写祥细点,感谢为我答题的每一个人. 凯美瑞1年前1
凯美瑞1年前1 -
 631178 共回答了21个问题
631178 共回答了21个问题 |采纳率81%Cu+2H2SO4(浓)=加热=CuSO4+SO2+2H2O,Cu——CuSO4,0——(+2),转移了2个电子,H2SO4——SO2,也转移了2个电子
SO2的物质的量n=2.24/22.4=0.1mol
Cu——SO2——H2SO4
64 1 98
x 0.1mol y
x=6.4g
y=9.8g
即:有6.4gCu被氧化,有9.8gHsSO4被还原1年前查看全部
- 铜在浓硫酸中加热能发生如下反应:Cu+2H2SO4 △ . CuS
铜在浓硫酸中加热能发生如下反应:Cu+2H2SO4
CuSO4+SO2↑+2H2O.某化学兴趣小组的同学设计了如图所示实验,准备探究铜与浓硫酸反应的情况及生成物的性质.请你也一起进行探究,并完成以下的问题.△ .
(1)图中标号的仪器名称分别为:a______,b______.
(2)对实验开始后各装置出现的现象描述及判断:
①当A中观察到铜片溶解、有气泡生成时,还能观察到溶液变______色的现象;
②B中的石蕊试液若变______色,说明生成物中的SO2是一种酸性的气体;
③C中品红溶液由红色变成无色,说明生成物中的SO2具有______性.
(3)C中逸出的SO2气体经装置D中盛装的______溶液干燥后通入装置E,用带火星的木条伸进G中,木条能复燃,说明E中的反应有______生成;E中反应的化学方程式是:______.
(4)F装置的作用是:______. 上hh金雪1年前1
上hh金雪1年前1 -
 dounai_198359 共回答了14个问题
dounai_198359 共回答了14个问题 |采纳率85.7%解题思路:(1)依据装置图分析仪器名称;
(2)①浓硫酸和铜加热反应生成硫酸铜溶液呈蓝色;
②铜和浓硫酸反应生成二氧化硫气体通入石蕊试液中二氧化硫和水反应生成亚硫酸具有酸性;
③二氧化硫具有漂白性;
(3)C中逸出的SO2气体经装置D中的浓硫酸干燥后通过装置E,生成了使带火星的木条复燃的气体为氧气,依据二氧化碳和过氧化钠反应类比得到;
(4)分析F装置是防倒吸的作用.(1)装置图分析可知a为酒精灯,b为试管,
故答案为:酒精灯,试管;
(2)①浓硫酸和铜加热反应生成硫酸铜溶液呈蓝色,当A中观察到铜片溶解、有气泡生成时,还能观察到溶液变蓝,
故答案为:蓝;
②铜和浓硫酸反应生成二氧化硫气体通入石蕊试液中二氧化硫和水反应生成亚硫酸具有酸性,使石蕊试液变红色,说明二氧化硫是酸性气体,
故答案为:红;
③二氧化硫具有漂白性,通过品红试液能使试液褪色,
故答案为:漂白;
(3)C中逸出的SO2气体经装置D中的浓硫酸干燥后通过装置E,生成了使带火星的木条复燃的气体为氧气,依据二氧化碳和过氧化钠反应的产物,分析写出二氧化硫和过氧化钠反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2,
故答案为:浓硫酸,氧气;2Na2O2+2SO2=2Na2SO3+O2;
(4)F装置是安全装置,可以防止G中溶液倒吸到E装置炸裂玻璃管,
故答案为:防止发生倒吸时G中溶液进入装置E中.点评:
本题考点: 性质实验方案的设计.
考点点评: 本题考查了浓硫酸性质的分析判断,产物性质的实验验证实验方法和反应现象应用,主要是二氧化硫性质的分析应用,题目难度中等.1年前查看全部
- 将一定量的铜粉加入100mL浓硫酸中,加热发生反应:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,充分反应后
将一定量的铜粉加入100mL浓硫酸中,加热发生反应:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,充分反应后放出13.44L(标准状况下)气体,固体有剩余,将反应后的溶液加水稀释至500mL.
(1)求参加反应Cu的质量.
(2)最终溶液中CuSO4物质的量浓度. comnetorg1年前0
comnetorg1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在Cu+2H2SO4(浓)=CuSO4+SO2+2H2O中,生成的SO2要有向上箭头吗?
 ii的幸苦1年前2
ii的幸苦1年前2 -
 王晨8083 共回答了20个问题
王晨8083 共回答了20个问题 |采纳率90%要 生成了大量二氧化硫,水溶解不完.1年前查看全部
- 已知:Cu+2H2SO4(浓) △ . CuSO4+SO2↑+2H
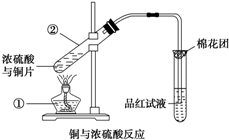 已知:Cu+2H2SO4(浓)
已知:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,如图是铜与浓硫酸反应的实验装置图,请回答下列问题.△ .
(1)写出标号①的仪器名称:______.
(2)将产生气体通入品红试液中的现象为:______.
(3)图中棉花团中浸有氢氧化钠溶液,其作用是______.
(4)反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应,因此反应完毕,试管中一定还有硫酸剩余.下列药品中能用来证明反应结束后的溶液中确有余酸的有______(填字母).
a.Cb.BaCl2溶液c.银粉d.Na2CO3溶液. wxhjss1年前1
wxhjss1年前1 -
 要抽抽1gg你丫 共回答了12个问题
要抽抽1gg你丫 共回答了12个问题 |采纳率91.7%解题思路:(1)根据图示装置中仪器的构造及名称进行解答;
(2)了解二氧化硫具有漂白性,通过品红试液能使品红溶液褪色;
(3)掌握二氧化硫与氢氧化钠溶液的反应;
(4)证明硫酸有剩余,需要验证有H+存在即可.(1)装置中标号①的仪器的名称为:酒精灯,
故答案为:酒精灯;
(2)由于二氧化硫具有漂白性,所以将产生气体通入品红试液中的现象为:品红试液褪色,
故答案为:品红试液褪色;
(3)二氧化硫与氢氧化钠溶液可以反应,二氧化硫有毒,需要进行尾气吸收,所以图中棉花团中浸有氢氧化钠溶液的作用是:吸收多余的SO2,防止污染空气,
故答案为:吸收多余的SO2,防止污染空气;
(4)能用来证明反应结束后的溶液中确有硫酸,可以通过证明反应后的溶液中存在氢离子即可,
a.碳不与稀硫酸反应,无法证明,故a错误;
d.BaCl2溶液加入后出现白色沉淀,但因为生成产物中有硫酸铜生成,也可以生成白色沉淀,不能证明硫酸有剩余,故b错误;
c.银粉不与稀硫酸反应,不能证明硫酸有剩余,故c错误;
d.Na2CO3溶液会与稀硫酸反应发出二氧化碳气体,可以证明硫酸剩余,故d正确,
故答案为:d.点评:
本题考点: 浓硫酸的性质实验.
考点点评: 本题考查了浓硫酸性质、二氧化硫的性质及检验方法,题目难度中等,注意掌握浓硫酸的化学性质,明确二氧化硫的漂白性原理,能够正确书写出铜与浓硫酸反应的化学方程式、离子方程式.1年前查看全部
- (1)Cu+2H2SO4=CuSO4+SO2+2H2O双线桥及指明氧化剂氧化产物还原产物(2)3NO2+2H2O=2HN
(1)Cu+2H2SO4=CuSO4+SO2+2H2O双线桥及指明氧化剂氧化产物还原产物(2)3NO2+2H2O=2HNO3+NO(3)
Fe+CuSO4=FeSO4+Cu 浪子1号1年前1
浪子1号1年前1 -
 爱情老乞丐 共回答了16个问题
爱情老乞丐 共回答了16个问题 |采纳率87.5%化合价升高失去2e^-,被氧化,
↑→→→→↓
(1)Cu+2H2SO4=△=CuSO4+SO2↑+2H2O
↓→→→→ ↑
化合价降低得到2e^-,被还原
H2SO4是氧化剂,Cu是还原剂,硫酸铜是氧化产物,二氧化硫是还原产物.
化合价升高失去2*e^-,被氧化,
↑→→→→↓
(2)3NO2+2H2O =2HNO3+ NO
↓→→→→ →→ ↑
化合价降低得到2e^-,被还原
NO2是既氧化剂,又是还原剂,HNO3是氧化产物,NO是还原产物.
化合价升高失去2e^-,被氧化,
↑→→→↓
(3)Fe+CuSO4= FeSO4+Cu
↓→→ →↑
化合价降低得到2e^-,被还原
铁是还原剂,硫酸铜是氧化剂,硫酸亚铁是氧化产物,铜是还原产物.1年前查看全部
- 在Cu+2H2SO4(浓) △ . CuSO4+SO2
在Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O反应中,△ .
(1)______元素被氧化,______是氧化剂,还原产物是______.
(2)用双线桥标出该反应电子转移的方向和数目.Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O△ .
(3)若有2mol的H2SO4参与反应,则被还原的H2SO4为______ g. 烂西瓜皮BEYOND1年前0
烂西瓜皮BEYOND1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 将一定量的铜粉加入100mL浓硫酸中,加热发生反应:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,充分反应后
将一定量的铜粉加入100mL浓硫酸中,加热发生反应:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,充分反应后放出13.44L(标准状况下)气体,固体有剩余,将反应后的溶液加水稀释至500mL.
(1)求参加反应Cu的质量.
(2)最终溶液中CuSO4物质的量浓度. ss7791年前0
ss7791年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- cu+2h2so4(浓)=cuso4+so2↑+2h2o单线桥写法
 ogj6m1年前1
ogj6m1年前1 -
 天是灰的 共回答了22个问题
天是灰的 共回答了22个问题 |采纳率90.9%---2e- ----
| ↓
cu+2h2so4(浓)=cuso4+so2↑+2h2o1年前查看全部
- 一定量的铜和浓硫酸在加热条件下充分反应:Cu+2H2SO4(浓) △ .
一定量的铜和浓硫酸在加热条件下充分反应:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O.向反应后显酸性的溶液只能逐滴加入含amolNaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是( )△ .
A.溶液中c(Na+)=2c(SO42-)
B.沉淀的物质的量等于[a/2]mol
C.标况下,生成SO2的体积<11.2aL
D.原浓硫酸中H2SO4的物质的量>[a/2]mol 狂奔在牛b的路上1年前1
狂奔在牛b的路上1年前1 -
 无敌神功铁爪猫 共回答了27个问题
无敌神功铁爪猫 共回答了27个问题 |采纳率100%解题思路:A.滴加入NaOH溶液,恰好使反应后的溶液呈中性,溶液中溶质为硫酸钠溶液,根据电荷守恒判断;
B.硫酸有剩余,滴加入NaOH后溶液中c(Na+)=2c(SO42-),故硫酸铜的物质的量小于[a/2]mol;
C.二氧化硫的物质的量等于硫酸铜物质的量,硫酸铜的物质的量小于[a/2]mol,再结构V=nVm计算判断;
D.根据硫元素守恒:n(H2SO4)=n(Na2SO4)+n(SO2).A.滴加入NaOH溶液,恰好使反应后的溶液呈中性,溶液中溶质为硫酸钠溶液,根据电荷守恒可知,溶液中c(Na+)=2c(SO42-),故A正确;
B.硫酸有剩余,滴加入NaOH后溶液中c(Na+)=2c(SO42-),则c(SO42-)=[a/2]mol,溶液中硫酸根源于硫酸铜、剩余的硫酸,故硫酸铜的物质的量小于[a/2]mol,故B错误;
C.二氧化硫的物质的量等于硫酸铜物质的量,硫酸铜的物质的量小于[a/2]mol,故标况下生成二氧化硫的体积小于[a/2]mol×22.4L/mol=11.2a L,故C正确;
D.根据硫元素守恒:n(H2SO4)=n(Na2SO4)+n(SO2),滴加入NaOH后溶液中c(SO42-)=[a/2]mol,故n(H2SO4)>[a/2]mol,故D正确,
故选B.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式的有关计算,侧重对学生分析计算能力的考查,注意利用守恒法解答,难度中等.1年前查看全部
- CU+2H2SO4------CUSO4+SO2+2H2O
CU+2H2SO4------CUSO4+SO2+2H2O
若生长336ML SO2那么反应中转移的电子的物质的量是? 会唱歌的小哑巴1年前1
会唱歌的小哑巴1年前1 -
 清风荷韵677 共回答了19个问题
清风荷韵677 共回答了19个问题 |采纳率89.5%Cu+2H2SO4==CuSO4+SO2+2H2O
336/22400=0.015
转移电子数:0.015*2==0.03mol1年前查看全部
- 在实验室用铜与浓H2SO4反应制取二氧化硫气体,反应如下:Cu+2H2SO4==CuSO4+SO2+2H2O,当得到6.
在实验室用铜与浓H2SO4反应制取二氧化硫气体,反应如下:Cu+2H2SO4==CuSO4+SO2+2H2O,当得到6.4g二氧化硫气体时,
有多少克铜被氧化?有多少克硫酸被还原? moilita1年前3
moilita1年前3 -
 抽520的孩子 共回答了13个问题
抽520的孩子 共回答了13个问题 |采纳率92.3%铜 6.4 g.硫酸 19.6g
SO2的质量分数是64,用反应得到的6.4除以64,即为物质的量0.1摩尔,也即是说,有0.1摩尔的铜和0.2摩尔的硫酸参与了反应.铜的质量分数是64,而硫酸是98,所以铜被氧化为64乘以0.1等于6.4 g .硫酸被还原为 98乘以0.2等于 19.6g.
附:这个题目的前提条件是理想状态,事实上,SO2是弱酸性气体,会溶于水,成为亚硫酸,而亚硫酸也会在一定条件下会氧化成硫酸,而浓硫酸在反应进行过程中,浓度会被稀释,因而要适当的添加浓硫酸.1年前查看全部
- 在Cu+2H2SO4(浓) △ . CuSO4+SO2↑+2H2O
在Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O 反应中,______元素被氧化,电子转移的总数为______.请用双线桥表示该反应的电子转移方向和数目.Cu+2H2SO4(浓)△ .
CuSO4+SO2↑+2H2O______.△ . zhangyangchao1年前0
zhangyangchao1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 铜和浓硫酸共热发生如下反应Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
铜和浓硫酸共热发生如下反应Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
若6.4克Cu参加反应并完全消耗被还原的H2SO4质量为多少反应中转移了多少电子 秋风暮雪1年前3
秋风暮雪1年前3 -
 3nong 共回答了18个问题
3nong 共回答了18个问题 |采纳率94.4%在这反应中,铜作为还原剂,失2个电子,被氧化,由0价升到+2价.
反应中有两个硫酸分子参加,实际只有一个分子作为氧化剂,硫从+6价降到+4价,得2个电子,被还原.
从方程式可以看出.1mol的铜完全反应,就会有1mol硫酸被还原,转移2mol的电子.
现在6.4克铜参加,即是0.1mol的铜参加反应,就会有0.1mol硫酸被还原,转移0.2mol的电子1年前查看全部
- 已知反应Cu+2H2SO4===SO2↑+CuSO4+2H2O,当在标准情况下
已知反应Cu+2H2SO4===SO2↑+CuSO4+2H2O,当在标准情况下
已知反应Cu+2H2SO4(浓)===SO2↑+CuSO4+2H2O,当在标准情况下,得到448ml的气体时,求(1)消耗的铜的质量(2)转移电子数 本痴1年前2
本痴1年前2 -
 jazzbomb 共回答了15个问题
jazzbomb 共回答了15个问题 |采纳率100%气体物质的量 = 0.448/22.4 = 0.02mol
Cu+2H2SO4(浓)====SO2↑+CuSO4+2H2O 转移电子数
64 1 2
x 0.02 y
64/x = 1/0.02 = 2/y
x=1.28g,y=0.04
消耗的铜的质量为1.28g
转移电子数=0.04mol1年前查看全部
- 浓硫酸和铜在加热条件下能发生反应:Cu+2H2SO4═CuSO4+2H2O+SO2↑,有人设计了两种用铜屑制硫酸铜的方案
浓硫酸和铜在加热条件下能发生反应:Cu+2H2SO4═CuSO4+2H2O+SO2↑,有人设计了两种用铜屑制硫酸铜的方案:
A:Cu
CuSO4B:CuH2SO4(浓) 加热
CuOO2 加热
CuSO4H2SO4
这两种方案中,小明认为方案B比较好,他不选A方案的理由是A方案会造成污染,同时浪费H2SO4(或浪费能源)A方案会造成污染,同时浪费H2SO4(或浪费能源),请写出方案B中第二步反应的化学方程式CuO+H2SO4═CuSO4+H2OCuO+H2SO4═CuSO4+H2O. 流浪无终点1年前1
流浪无终点1年前1 -
 robertkim 共回答了25个问题
robertkim 共回答了25个问题 |采纳率92%在浓硫酸与铜的反应中不但生成了污染物二氧化硫,而且还消耗了较多的硫酸,因为硫以二氧化硫的形式跑掉了一部分,而利用将铜屑在空气中加热氧化,然后浸入稀硫酸中反应过滤,有效地避免了这一些.氧化铜和硫酸反应生成硫酸铜和水,反应的化学方程式为CuO+H2SO4═CuSO4+H2O.
故答案为:A方案会造成污染,同时浪费H2SO4(或浪费能源);CuO+H2SO4═CuSO4+H2O.1年前查看全部
- 铜与浓硫酸共热的条件下可以发生化学反应:Cu+2H2SO4=CuSO4+SO2↑+2H2O,但是在工业上制取硫酸铜不是直
铜与浓硫酸共热的条件下可以发生化学反应:Cu+2H2SO4=CuSO4+SO2↑+2H2O,但是在工业上制取硫酸铜不是直接利用浓硫酸与铜反应,而是将铜屑在空气中加热氧化,然后浸入稀硫酸中反应过滤,并反复加热和浸入操作,你认为这样的优点是( )
A.节约能源
B.不产生污染大气的二氧化硫
C.操作简单
D.提高铜的利用率 231247291年前1
231247291年前1 -
 七月的风 共回答了22个问题
七月的风 共回答了22个问题 |采纳率86.4%解题思路:二氧化硫有毒,是污染环境的一种重要物质,是导致的酸雨的主要物质之一.A、将铜屑在空气中加热氧化时要消耗能量,因此该方法不节约能源;
B、该方法不产生污染环境的二氧化硫;
C、该方法需要反复加热和浸入操作,操作不简单;
D、该方法不能提高铜的利用率;
由分析可知,这样操作的优点是不产生污染大气的二氧化硫.
故选:B.点评:
本题考点: 金属的化学性质.
考点点评: 环境污染日趋严重,如何采取科学的工艺流程,不污染环境是人们应该研究的课题之一.1年前查看全部
- Cu+2H2SO4=CuSO4+SO2+2H2O中硫元素的化合价发生了怎样变化?
 娇阳hsr1年前1
娇阳hsr1年前1 -
 磨镜老人 共回答了20个问题
磨镜老人 共回答了20个问题 |采纳率90%硫酸中硫的化合价是+6价.硫酸铜是+6.二氧化硫是+4.升失氧,降得还.反应物到生成物,(SO2)化合价降低,还原反应,硫酸做氧化剂.H2SO4→得2e-→SO21年前查看全部
- (2014•温州模拟)在反应Cu+2H2SO4(浓) △ . Cu
(2014•温州模拟)在反应Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O中,还原剂是( )△ .
A.Cu
B.H2SO4
C.CuSO4
D.SO2 买27只茵宝鞋1年前1
买27只茵宝鞋1年前1 -
 琥珀色的月 共回答了17个问题
琥珀色的月 共回答了17个问题 |采纳率94.1%解题思路:反应中Cu元素化合价升高,S元素化合价降低,结合氧化还原反应的相关概念解答该题.在反应Cu+2H2SO4(浓)
△
.
CuSO4+SO2↑+2H2O中,Cu元素化合价升高,被氧化,Cu为还原剂,S元素化合价降低,被还原,H2SO4为氧化剂.
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应知识,为高考常见考点,侧重于学生的分析能力和基本概念的理解和应用的考查,注意把握元素化合价的变化,为解答该题的关键,难度不大.1年前查看全部
- 帮我写几个离子方程式 Cu+2H2SO4(浓)==CuSO4+2H2O+SO2↑3Cu+8HNO3(稀)==3Cu(NO
帮我写几个离子方程式
Cu+2H2SO4(浓)==CuSO4+2H2O+SO2↑
3Cu+8HNO3(稀)==3Cu(NO3)2+4H2O+2NO↑
2FeCl3+Cu==2Fecl2+CuCl2 chmbob1年前1
chmbob1年前1 -
 在他乡也 共回答了19个问题
在他乡也 共回答了19个问题 |采纳率89.5%Cu + 4H+ 2(SO4)2- == Cu2+ + (SO4)2- + 2H2O + SO2↑
3Cu + 8H+ + 8(NO3)- == 3Cu2+ + 6(NO3)- + 4H2O + 2NO↑
2Fe3+ + 6Cl- == 2Fe2+ + 4Cl- + Cu2+ + 2Cl-1年前查看全部
- 实验时可以用铜与浓硫酸反应制取二氧化硫,反应的化学方程式为:Cu+2H2SO4(浓) △
实验时可以用铜与浓硫酸反应制取二氧化硫,反应的化学方程式为:Cu+2H2SO4(浓)
CuSO4+2X+SO2↑,其中X的化学式为( )△ .
A.H2O
B.H2S
C.S
D.O2 kan3231年前1
kan3231年前1 -
 天天天等 共回答了15个问题
天天天等 共回答了15个问题 |采纳率93.3%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.根据反应的化学方程式Cu+2H2SO4(浓)
△
.
CuSO4+2X+SO2↑,反应物中铜、氢、硫、氧原子个数分别为1、4、2、8,反应后的生成物中铜、氢、硫、氧原子个数分别为1、0、2、6,根据反应前后原子种类、数目不变,则2X中含有4个氢原子和2个氧原子,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O.
故选:A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.1年前查看全部
- 浓硫酸和铜在加热时反应,生成二氧化硫气体的体积为3.36L(标准状况下).已知:Cu+2H2SO4(浓)
浓硫酸和铜在加热时反应,生成二氧化硫气体的体积为3.36L(标准状况下).已知:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O.试计算:反应后生成硫酸铜的物质的量?△ . maninair1年前1
maninair1年前1 -
 山东阿卡 共回答了20个问题
山东阿卡 共回答了20个问题 |采纳率85%解题思路:根据n=
计算二氧化硫的物质的量,再根据方程式中定比关系计算生成硫酸铜的物质的量.V Vm 标况下,3.36L二氧化硫的物质的量=[3.36L/22.4L/mol]=0.15mol,
令生成硫酸铜的物质的量为x,则:
Cu+2H2SO4(浓)
△
.
CuSO4+SO2↑+2H2O
1 1
x 0.15mol
所以x=[0.15mol×1/1]=0.15mol,
答:生成硫酸铜的物质的量为0.15mol.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式的有关计算,比较基础,也可以利用电子转移守恒进行计算.1年前查看全部
- 铜和浓硫酸共热发生如下反应Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
铜和浓硫酸共热发生如下反应Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
若6.4克Cu参加反应并完全消耗被还原的H2SO4质量为多少反应中转移了多少电子 巴夏阳光1年前3
巴夏阳光1年前3 -
 凤梨花 共回答了17个问题
凤梨花 共回答了17个问题 |采纳率94.1%在这反应中,铜作为还原剂,失2个电子,被氧化,由0价升到+2价.
反应中有两个硫酸分子参加,实际只有一个分子作为氧化剂,硫从+6价降到+4价,得2个电子,被还原.
从方程式可以看出.1mol的铜完全反应,就会有1mol硫酸被还原,转移2mol的电子.
现在6.4克铜参加,即是0.1mol的铜参加反应,就会有0.1mol硫酸被还原,转移0.2mol的电子1年前查看全部
- 铜和浓硫酸发生反应的化学方程式为:Cu+2H2SO4(浓) △ .
铜和浓硫酸发生反应的化学方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O△ .
(1)浓H2SO4作______剂,具有______性.
(2)在该反应中,若消耗了32g Cu,则转移了______mol 电子,还原了______mol H2SO4,生成______ L SO2(标准状况)气体.
(3)以下三种物质的氧化性由强到弱的顺序为:______(写出序号)①浓H2SO4②稀H2SO4③CuSO4
(4)用双线桥表示铜和浓硫酸反应的电子转移方向和数目.Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O.△ . 特林格哨兵1年前0
特林格哨兵1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 铜不能与稀硫酸反应,却能与浓硫酸反应,反应的方程式为:Cu+2H2SO4(浓)=CuSO4+2H2O+SO2↑
铜不能与稀硫酸反应,却能与浓硫酸反应,反应的方程式为:Cu+2H2SO4(浓)=CuSO4+2H2O+SO2↑
请回答:
(1)若有1mol铜反应,则参与还原反应的H2SO4物质的量为______.
(2)现用12.8g铜与足量的浓硫酸反应,可生成标准状况下SO2的体积是多少升?(写出计算过程)
(3)若用100mL 18.4mol/L的浓硫酸与足量的铜反应,却不能得到0.92mol的SO2.原因是______. 夜狼1101年前1
夜狼1101年前1 -
 acsj_bb7wp5640 共回答了20个问题
acsj_bb7wp5640 共回答了20个问题 |采纳率90%解题思路:(1)参与还原反应的H2SO4生成SO2,根据方程式计算SO2的物质的量,根据S原子守恒可知n被还原(H2SO4)=n(SO2);
(2)根据n=[m/M]计算12.8g Cu的物质的量,再根据方程式生成SO2计算的物质的量,根据V=nVm计算SO2的体积;
(3)Cu与浓硫酸反应,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应.(1)参与还原反应的H2SO4生成SO2,由Cu+2H2SO4(浓)=CuSO4+2H2O+SO2↑,可知1molCu反应时生成SO2的物质的量为1mol,根据S原子守恒,可知n被还原(H2SO4)=n(SO2)=1mol,
故答案为:1mol;
(2)12.8g Cu的物质的量=[12.8g/64g/mol]=0.2mol,
Cu+2H2SO4(浓)=CuSO4+2H2O+SO2↑
1 1
0.2moln(SO2)
n(SO2)=[0.2mol×1/1]=0.2mol,
故标况下,生成SO2的体积=0.2mol×22.4L/mol=4.48L,
答:生成标准状况下SO2的体积是4.48L.
(3)100mL 18.4mol/L的浓硫酸中H2SO4的物质的量=0.1L×18.4mol/L=1.84mol,若硫酸完全反应,由方程式可知生成二氧化碳的物质的量=1.84mol×[1/2]=0.92mol,由于Cu与浓硫酸反应,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应,故实际得到SO2小于0.92mol,
故答案为:由于Cu与浓硫酸反应,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式的有关计算、氧化还原反应计算,比较基础,(3)中注意浓度为物质性质的影响.1年前查看全部
- 32g Cu与一定量的浓硫酸加热后,恰好完全反应,反应方程式如下:Cu+2H2SO4 △
32g Cu与一定量的浓硫酸加热后,恰好完全反应,反应方程式如下:Cu+2H2SO4
CuSO4+SO2↑+2H2O△ .
问:(1)得到SO2气体的体积(标准状况下)是多少?
(2)把所得的CuSO4 配制成250mL CuSO4溶液,所得溶液中溶质的物质的量浓度. wzdcz1311年前1
wzdcz1311年前1 -
 补火的飞蛾_ss 共回答了18个问题
补火的飞蛾_ss 共回答了18个问题 |采纳率83.3%n(Cu)=[32g/64g/mol]=0.5mol,
Cu+2H2SO4
△
.
CuSO4+SO2↑+2H2O
1mol 1mol 22.4L
0.5mol n(CuSO4) V(SO2)
(1)V(SO2)=[0.5mol×22.4L/1mol]=11.2L
答:得到SO2气体的体积(标准状况下)是11.2L.
(2)n(CuSO4)=0.5mol
c(CuSO4)=[0.5mol/0.25L]=2mol/L.
答:把所得的CuSO4 配制成250mL CuSO4溶液,所得溶液中溶质的物质的量浓度为2mol/L.1年前查看全部
- 利用反应:cu+2h2so4(浓)=cuso4+so2+2h2o来制取二氧化硫,当有12.8g铜完全反应时,计算(1)生
利用反应:cu+2h2so4(浓)=cuso4+so2+2h2o来制取二氧化硫,当有12.8g铜完全反应时,计算(1)生成的二氧化硫在标准状况时的体积(2)被还原的浓硫酸的物质的量.老师这个题目怎么写?
 luoni_20021年前1
luoni_20021年前1 -
 一份素心三分侠气 共回答了14个问题
一份素心三分侠气 共回答了14个问题 |采纳率85.7%(1)设生成的二氧化硫在标准状况时的体积为X升
cu + 2h2so4(浓)= cuso4 + so2 + 2h2o64 22.412.8 XX=4.48升(2)从方程式看出,2摩尔H2SO4有1摩尔被还原.设有Y摩尔硫酸被还原cu + 2h2so4(浓)= cuso4 + so2 + 2h2o64 112.8 YY=0.2mol有0.2摩尔硫酸被还原.1年前查看全部
- 在Cu+2H2SO4(浓) △ . CuSO4+SO2↑+2H2O
在Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O反应中,请用双线桥法标出电子得失的情况______(包括得失和数目),并指出氧化剂、还原剂及浓硫酸作用.△ .
还原剂______;浓硫酸作用______. wuyaonline1年前0
wuyaonline1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 浓硫酸跟铜在加热时能发生反应,放出能使品红溶液______的气体,反应的化学方程式为:Cu+2H2SO4 (浓
浓硫酸跟铜在加热时能发生反应,放出能使品红溶液______的气体,反应的化学方程式为:Cu+2H2SO4 (浓)
CuSO4+SO2↑+______.△ . 小重重1年前1
小重重1年前1 -
 sdlczzp 共回答了15个问题
sdlczzp 共回答了15个问题 |采纳率86.7%解题思路:浓硫酸跟铜在加热时能发生反应生成二氧化硫,二氧化硫具有漂白性,根据质量守恒完成方程式.浓硫酸跟铜在加热时能发生反应的化学方程式为Cu+2H2SO4 (浓)
△
.
CuSO4+SO2↑+2H2O,生成的SO2具有漂白性,能使品红溶液褪色.
故答案为:褪色,2H2O.点评:
本题考点: 浓硫酸的性质.
考点点评: 本题考查浓硫酸的性质,题目较为简单,注意有关反应方程式的书写.1年前查看全部
- 实验室可利用反应“Cu+2H2SO4(浓) △ . CuSO4+SO2↑+2H2O”制取S
实验室可利用反应“Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O”制取SO2,下列措施能降低该化学反应速率的是( )△ .
A.适当降低反应温度
B.用铜粉代替铜片
C.加入MnO2作催化剂
D.将浓硫酸改为稀硫酸 我就是我不是他1年前1
我就是我不是他1年前1 -
 shd105999 共回答了23个问题
shd105999 共回答了23个问题 |采纳率87%解题思路:A、降低温度反应减慢,常温下铜与浓硫酸不反应;
B、固体颗粒越小,反应物的表面积越大,化学反应速率越快;
C、MnO2不能催化该反应,加入MnO2对该反应没有影响;
D、铜与稀硫酸不反应.A、常温下铜与浓硫酸不反应,适当降低温度可以使化学反应速率减慢,故A正确;
B、用铜粉代替铜片,增大接触面积,加快反应速率,故B错误;
C、加入MnO2对该反应没有影响,故C错误;
D、铜与稀硫酸不反应,不能生成二氧化硫,故D错误.
故选A.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查影响化学反应速率的因素,比较基础,注意温度、浓度、压强、催化剂、固体的接触面积等都能影响化学反应速率.1年前查看全部
- 浓硫酸具有:①吸水性 ②脱水性 ③强氧化性④酸性.在反应Cu+2H2SO4(浓)
浓硫酸具有:①吸水性 ②脱水性 ③强氧化性④酸性.在反应Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O中,浓硫酸表现出( )△ .
A.③④
B.①②
C.①③
D.②④ 2683191年前1
2683191年前1 -
 安徽oo 共回答了25个问题
安徽oo 共回答了25个问题 |采纳率84%解题思路:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O中,生成二氧化硫时S元素的化合价不变,生成硫酸铜时,S元素的化合价不变,以此来解答.△ .Cu+2H2SO4(浓)
△
.
CuSO4+SO2↑+2H2O中,生成二氧化硫时S元素的化合价不变,则体现浓硫酸的强氧化性;
而生成硫酸铜时,S元素的化合价不变,则生成硫酸盐体现其酸性,
故选A.点评:
本题考点: 浓硫酸的性质.
考点点评: 本题考查浓硫酸的性质,为高频考点,把握浓硫酸的特性为解答的关键,注意从元素化合价角度及氧化还原反应角度分析,明确生成硫酸盐体现其酸性即可解答,题目难度不大.1年前查看全部
- 已知:Cu+2H2SO4(浓) △ . CuSO4+SO2↑+2H
已知:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O.有关CuSO4制备途径及性质如图所示.△ .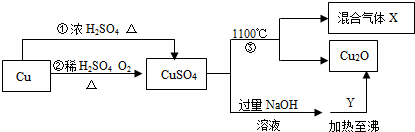
请回答:能更好地体现绿色化学思想的途径是______(填“①”或“②”).反应③分解所得的混合气体为SO2、O2,写出该反应的化学方程式4CuSO4
2Cu2O+4SO2↑+3O2↑1100℃ .4CuSO4.Y可以是葡萄糖,利用此反应______(填“可以”或“不可以”)检验病人是否患糖尿病.
2Cu2O+4SO2↑+3O2↑1100℃ . 绿_小妖1年前1
绿_小妖1年前1 -
 txq178 共回答了17个问题
txq178 共回答了17个问题 |采纳率94.1%解题思路:根据反应后的生成物判断是否体现绿色化学思想;
根据反应物和产物以及反应条件书写化学方程式;
硫酸铜与氢氧化钠生成氢氧化铜沉淀,与葡萄糖生成红色氧化亚铜,可以根据该现象检验病人是否患糖尿病.铜和浓硫酸反应会生成二氧化硫气体污染空气,②是能更好地体现绿色化学思想的途径;
反应③分解所得的混合气体为SO2、O2,另一产物为Cu2O,条件是1100℃,化学方程式为:4CuSO4
1100℃
.
2Cu2O+4SO2↑+3O2↑;
葡萄糖与氢氧化铜反应的方程式为:C6H12O6+2Cu(OH)2=C6H12O7+Cu2O+2H2O,Cu2O显红色,可以根据该现象检验病人是否患糖尿病.
故答案为:②;
4CuSO4
1100℃
.
2Cu2O+4SO2↑+3O2↑;
可以.点评:
本题考点: 物质的相互转化和制备;金属的化学性质;书写化学方程式、文字表达式、电离方程式;鉴别淀粉、葡萄糖的方法与蛋白质的性质.
考点点评: 本题考查了物质的制备,解题的关键是掌握物质的性质,解答时要依据题干提供信息,结合相关知识细心分析解答.1年前查看全部
- Cu+2H2SO4(浓)====CuSO4+SO2↑+2H2O
Cu+2H2SO4(浓)====CuSO4+SO2↑+2H2O
3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O
两个反应中氧化反应 还原反应 氧化剂还原剂 氧化产物 还原产物分别是什么
Fe2O3+3CO====2Fe+3CO2这个反应中氧化剂,还原剂,氧化产物还原产物是什么? Jecal包包鱼1年前3
Jecal包包鱼1年前3 -
 aaa716825 共回答了18个问题
aaa716825 共回答了18个问题 |采纳率77.8%第一个:铜被氧化,铜是还原剂,CuSO4是氧化产物
H2SO4被还原,H2SO4是氧化剂,SO2是还原产物
第二个:铜被氧化,铜是还原剂,Cu(NO3)2是氧化产物
HNO3被还原,HNO3是氧化剂,NO是还原产物
口诀:升失氧,降得还,若说剂,两相反
即化合价升高的物质,被氧化,是还原剂,
化合价降低的物质,被还原,是氧化剂
被氧化而生成的产物叫做氧化产物,被还原而生成的产物叫还原产物1年前查看全部
- 已知下列两个反应:①Fe+H2SO4(稀)=FeSO4+H2↑②Cu+2H2SO4(浓) △
已知下列两个反应:①Fe+H2SO4(稀)=FeSO4+H2↑②Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O△ .
试回答下列问题:
(l)反应①中______元素被还原,反应②中______元素被还原(填元素符号).
(2)反应②中生成32gSO2气体时,消耗H2SO4的质量是______g,其中有______g H2SO4作为氧化剂. tctx1年前1
tctx1年前1 -
 Rchris 共回答了13个问题
Rchris 共回答了13个问题 |采纳率100%解题思路:(1)从元素化合价的角度判断,氧化还原反应中,氧化剂在反应中得电子被还原,所含元素化合价降低;
(2)n(SO2)=[32g/64g/mol]=0.5mol,化合价降低的硫元素所在的硫酸做氧化剂,在反应中被还原,根据方程式来计算即可.(1)反应①中H元素化合价降低,被还原,反应②中S元素化合价降低,被还原,故答案为:H;S;
(2)n(SO2)=[32g/64g/mol]=0.5mol,由方程式可知,当有2molH2SO4参加反应时,由1mol被还原,1mol表现酸性,生成1molSO2,则生成0.5molSO2,消耗1molH2SO4,质量为1mol×98g/mol=98g,其中0.5mol硫酸作氧化剂,质量为49g.
故答案为:98;49.点评:
本题考点: 氧化还原反应的计算;浓硫酸的性质.
考点点评: 本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,注意把握氧化还原反应的特征,从元素化合价的角度认识相关概念和物质的性质,结合反应的方程式计算,难度不大.1年前查看全部
- 在Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O反应中,氧化剂是______;被氧化的元素是______,每生
在Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O反应中,氧化剂是______;被氧化的元素是______,每生成11.2L(标准状况)的SO2,转移的电子的物质的量为______mol.
 磊磊爱磊磊1年前1
磊磊爱磊磊1年前1 -
 戏王之王KEN 共回答了9个问题
戏王之王KEN 共回答了9个问题 |采纳率77.8%解题思路:在Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O反应中,Cu元素化合价升高,被氧化,H元素化合价降低,被还原,结合化合价的升降计算电子转移的数目.在Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O反应中,Cu元素化合价升高,被氧化,H元素化合价降低,被还原,则硫酸为氧化剂,
每生成11.2L(标准状况)的SO2,n(SO2)=0.5mol,则转移的电子的物质的量为1mol,
故答案为:H2SO4;Cu;1.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度不大,注意从元素化合价变化的角度解答该题,注意可从元素化合价变数的数值计算转移的电子数目.1年前查看全部
- 在化学反应Cu+2H2SO4(浓)═CuSO4+SO2↑+H2O中,氧化剂是( )
在化学反应Cu+2H2SO4(浓)═CuSO4+SO2↑+H2O中,氧化剂是( )
A.Cu
B.H2SO4
C.CuSO4
D.SO2 假若风有颜色1年前1
假若风有颜色1年前1 -
 符临 共回答了20个问题
符临 共回答了20个问题 |采纳率75%解题思路:Cu+2H2SO4(浓)═CuSO4+SO2↑+H2O中,Cu元素的化合价升高,S元素的化合价降低,以此来解答.Cu+2H2SO4(浓)═CuSO4+SO2↑+H2O中,Cu元素的化合价升高,则Cu为还原剂;S元素的化合价降低,则H2SO4为氧化剂,
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.1年前查看全部
- 铜和浓硫酸发生反应的化学方程式为:Cu+2H2SO4(浓) △ .
铜和浓硫酸发生反应的化学方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O△ .
(1)浓H2SO4具有______性.
(2)在该反应中,若消耗了32g Cu,则转移了______mol 电子,还原了______mol H2SO4,生成______ L SO2(标准状况)气体. 亦狂亦侠亦儒雅1年前1
亦狂亦侠亦儒雅1年前1 -
 BOBO力量注入 共回答了30个问题
BOBO力量注入 共回答了30个问题 |采纳率86.7%解题思路:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O中,Cu元素的化合价升高,S元素的化合价降低,结合元素的化合价变化计算.△ .(1)S元素的化合价降低生成二氧化硫,体现其氧化性,生成硫酸铜体现其酸性,故答案为:氧化性和酸;
(2)消耗了32g Cu,则转移了[32g/64g/mol]×(2-0)=1mol电子,由反应可知0.5molCu还原0.5molH2SO4,生成0.5molSO2,其体积为0.5mol×22.4L/mol=11.2L,
故答案为:1;0.5;11.2.点评:
本题考点: 氧化还原反应;浓硫酸的性质.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化即可解答,题目难度不大,侧重氧化还原反应基本概念及电子转移计算的考查,注意从元素化合价角度分析.1年前查看全部
- 在实验室用铜与浓H2SO4反应制取二氧化硫气体,反应如下:Cu+2H2SO4==CuSO4+SO2+2H2O,当得到6.
在实验室用铜与浓H2SO4反应制取二氧化硫气体,反应如下:Cu+2H2SO4==CuSO4+SO2+2H2O,当得到6.4g二氧化硫气体时,
有多少克铜被氧化?有多少克硫酸被还原? 教善才伏妆1年前2
教善才伏妆1年前2 -
 A20011687 共回答了18个问题
A20011687 共回答了18个问题 |采纳率94.4%SO2相对分子质量为64,生成0.1molSO2,铜的氧化与SO2的生成为1:1,即铜0.1mol=6.4g
硫酸被还原与铜为1:1即0.1mol=9.8g1年前查看全部
- 实验时可以用铜与浓硫酸反应制取二氧化硫,反应的化学方程式为:Cu+2H2SO4(浓) △ . CuSO4+2X+SO2↑
实验时可以用铜与浓硫酸反应制取二氧化硫,反应的化学方程式为:Cu+2H2SO4(浓) △ . CuSO4+2X+SO2↑
实验时可以用铜与浓硫酸反应制取二氧化硫,反应的化学方程式为:Cu+2H2SO4(浓)
CuSO4+2X+SO2↑,其中X的化学式为( )△ .
A.H2O
B.H2S
C.S
D.O2
 模糊的不不1年前1
模糊的不不1年前1 -
 没有的拉 共回答了17个问题
没有的拉 共回答了17个问题 |采纳率88.2%根据反应的化学方程式Cu+2H2SO4(浓)
△
.
CuSO4+2X+SO2↑,反应物中铜、氢、硫、氧原子个数分别为1、4、2、8,反应后的生成物中铜、氢、硫、氧原子个数分别为1、0、2、6,根据反应前后原子种类、数目不变,则2X中含有4个氢原子和2个氧原子,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O.
故选:A.1年前查看全部
- 在Cu+2H2SO4(浓)=CuSO4+SO2+2H2O反应中,SO2的电子数?
在Cu+2H2SO4(浓)=CuSO4+SO2+2H2O反应中,SO2的电子数?
帮助下吧,不是求答案,而是方法.
我这里是问转移的SO2的电子数.、、.、. 森qu淼1年前1
森qu淼1年前1 -
 laixiyuan 共回答了19个问题
laixiyuan 共回答了19个问题 |采纳率89.5%是转移的电子数吧
Cu从0价变到+2价 S从+6价变到+4价,即1molS得到2mol电子1年前查看全部
- 已知铜和浓硫酸的反应是Cu+2H2SO4=CuSO4+SO2+2H2O,若有6.4g铜参加反应,计算参加反应的H2SO4
已知铜和浓硫酸的反应是Cu+2H2SO4=CuSO4+SO2+2H2O,若有6.4g铜参加反应,计算参加反应的H2SO4是多少克
被还原的H2SO4是多少克?转移电子多少mol?生成标准状况下SO2多少升? shzqthb1年前3
shzqthb1年前3 -
 舞蹈兰 共回答了13个问题
舞蹈兰 共回答了13个问题 |采纳率84.6%铜的物质的量
n(Cu)=6.4g/(64g/mol)=0.1mol
设参加反应和生成二氧化硫的物质的量分别为n1,n2 Cu+2H2SO4=CuSO4+SO2+2H2O
1.2.1
0.1mol.n1.n2
n1=2*0.1mol/1=0.2mol
n2=1*0.1mom/1=0.1mol
参加反应的硫酸的质量
m(H2SO4)=0.2mol*98g/mol
=19.6g
2份硫酸中,其中1份硫酸即0.1mol作为氧化剂被铜还原其质量=19.6g/2=9.8g
每1mol铜反应转移电子的物质的量为2mol,所以0.1mol铜转移的电子的物质的量为0.2mol
生成二氧化硫的体积V(SO2)=0.1mol*22.4L/mol=2.24L1年前查看全部
- 铜与浓硫酸反应时,当转移了0.2mol电子时,消耗的硫酸有几mol?Cu+2H2SO4=CuSO4+2H2O+SO2
 jian2li1年前2
jian2li1年前2 -
 yyzzyy55 共回答了22个问题
yyzzyy55 共回答了22个问题 |采纳率90.9%0.2mol
因为转移0.2mol电子即有0.1mol的Cu参与反应 根据方程得知参与反应的浓硫酸的量1年前查看全部
大家在问
- 1英语作文.题目是在美国我想看到什么?
- 2一篇编童话故事的作文 最好不抄百度
- 3有一桶油,第一次取出它的[1/4],第二次比第一次少取4千克,还剩下19千克,原来这桶油重多少千克?
- 4甲、乙两人从周长为1600米的正方形水池ABCD相对的两个顶点A,C同时出发绕水池的边沿A---B---C---D---
- 5实验室用KMnO 4 溶液与浓盐酸反应制取氯气.反应方程式如下:2KMnO 4 +16HCl═2KCl+2MnCl 2
- 6如图,∠BAF,∠CBD与∠ACE是△ABC的三个外角.你能求出这三个外角度数之和吗?说明你的理由.
- 7钟面上有1,2,······11,12共12个数字.试试在这些数前面标上正、负号,使他们的和为0.
- 8media 和 medium 这两个英文单词的区别是什么?
- 9已知向量a的模为根号2,向量b的模为3,a向量与b向量的夹角为45°,求使向量a+kb与ka+b的夹角为锐角时k的取值范
- 10as far as 这里意思是?
- 11已知sina+cosa=(√2)/2,则cos4a等于多少.
- 12(6分)实验室里用加热氯酸钾和二氧化锰的混合物制取氧气,反应的化学方程式为_______________________
- 13Sometimes my parents let it fly out of the cage,
- 14如图,三角形ABC和三角形ADE都是直角三角形,且∠BAC=∠DAE=90°.已知∠ADC=90°.(1)写出图中所有与
- 15书面表达。(15分)为了预防流感,保持健康,你平时都是怎样做的?请根据下面表格中所提供的信息,以Keeping Heal
