饱和氯水与石灰石反应为什么生成碳酸氢钙
 wuyue432022-10-04 11:39:541条回答
wuyue432022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 MOMOKO 共回答了15个问题
MOMOKO 共回答了15个问题 |采纳率93.3%- 在我看来,氯水中的HCl和HClO的含量都挺少的,而石灰石中的CaO含量很多,所以过量的CaO和酸反应生成碳酸氢钙.
- 1年前
相关推荐
- 已知氧化性强弱顺序是Bro3->Clo3->Cl2>IO3->I2.现将饱和氯水逐渐滴入KI淀粉溶液中
已知氧化性强弱顺序是Bro3->Clo3->Cl2>IO3->I2.现将饱和氯水逐渐滴入KI淀粉溶液中
2方程式 我刚预习到这,请求帮忙把理由写全、、、、、谢谢 pangpang11年前3
pangpang11年前3 -
 wyyxhpm 共回答了15个问题
wyyxhpm 共回答了15个问题 |采纳率100%①不过量时:
溶液先变蓝,氯将碘离子氧化成单质碘,淀粉遇碘变蓝
其反应是:
KI+Cl2==I2+KCl
②加氯水至过量时
蓝色褪成无色
5Cl2+I2+6H2O==2HIO3-+10HCl
理由么:第一步书上都有的吧
第二步的原因就是强氧化剂+强还原剂=弱还原剂+弱氧化剂
里面Cl2是强氧化剂,I2强还原剂,CI-是还原产物,IO3-是氧化产物
因为CL2的氧化性大于IO3-,这反应才得以进行1年前查看全部
- (2015•资阳模拟)利用如图所示装置制备饱和氯水,探究新制饱和氯水的组成和性质而进行了科学实验:先对制得的氯水进行观察
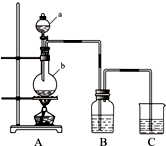 (2015•资阳模拟)利用如图所示装置制备饱和氯水,探究新制饱和氯水的组成和性质而进行了科学实验:先对制得的氯水进行观察,再用胶头滴管将该氯水逐滴滴入盛有含酚酞的NaOH溶液的试管中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液.据此回答:
(2015•资阳模拟)利用如图所示装置制备饱和氯水,探究新制饱和氯水的组成和性质而进行了科学实验:先对制得的氯水进行观察,再用胶头滴管将该氯水逐滴滴入盛有含酚酞的NaOH溶液的试管中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液.据此回答:
(1)C中的试剂是______;仪器b的名称为______,b中发生反应的离子方程式为______.
(2)写出新制饱和氯水中含有氯元素物质的化学式:______.氯水长时间放置,氯水中的成分就会发生变化,能快速判断氯水中含有较多C12的方法是:______.
(3)根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字补充:
①氯水与NaOH反应,碱性减弱红色褪去.②______.
(4)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②.
【实验步骤】
①取上述实验后试管内的无色溶液3mL盛于另一支洁净的试管中;②______,振荡试管.
【现象与结论】
①若______,则证明溶液红色褪去的原因是①而不是②.
②若______,则证明溶液红色褪去的原因是②而不是①.
(5)为了从新制氯水中制得较高浓度的HClO,可向氯水中加入的试剂是______.
A.CaCO3B.NaHSO3C.Na2CO3D.Ca(OH)2. 刺目的疤1年前1
刺目的疤1年前1 -
 creeker 共回答了24个问题
creeker 共回答了24个问题 |采纳率75%解题思路:(1)氯气有毒,不能直接排放到空气中,可用NaOH溶液吸收,依据二氧化锰和浓盐酸反应原理判断仪器b的名称以及书写离子反应方程式;
(2)根据氯气和水反应的方程式确定含氯元素的物质;氯水中含有次氯酸,次氯酸见光易分解,久置氯水变质,能快速判断氯水中含有较多C12的方法是观察颜色;
(3)含有酚酞的红色NaOH溶液,结合氯水中含有盐酸和次氯酸来分析;
(4)对褪色的溶液,若再加碱,恢复红色,则褪色是酸碱中和的原因;若再加碱,仍为无色,则是HClO的强氧化性的原因使溶液红色褪去;
(5)根据化学平衡影响因素和平衡移动原理分析;(1)氯气有毒,不能直接排放到空气中,可用NaOH溶液吸收,发生Cl2+2NaOH=NaCl+NaClO+H2O,
二氧化锰和浓盐酸反应制取氯气,仪器b的名称为圆底烧瓶,反应为MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O,该离子反应为MnO2+4H++2Cl-
△
.
Mn2++Cl2↑+2H2O;
故答案为:NaOH溶液;圆底烧瓶;MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;
(2)因氯气和水反应Cl2+H2O⇌HCl+HClO生成盐酸和次氯酸,饱和氯水中含有氯元素的物质为Cl2、HCl(或Cl-)、HClO,但由于HClO不稳定,见光发生分解生成盐酸和氧气,平衡不断向右移动,最终氯气耗尽,全部转化为氧气,导致黄绿色消褪,所以能快速判断氯水中含有较多C12的方法是观察颜色氯水呈黄绿色,
故答案为:Cl2、HCl(或Cl-)、HClO;观察氯水呈黄绿色;
(3)因碱遇酚酞变红,氯水中有盐酸,盐酸与碱发生中和反应,HCl中和了NaOH,则红色褪去,氯水中还有次氯酸,次氯酸具有强氧化性,HClO氧化了酚酞而使红色褪色,
故答案为:氯水的漂白作用使红色褪去;
(4)对褪色的溶液,取试管内的无色溶液3mL盛于另一支洁净的试管中,再向试管内滴加2滴NaOH溶液振荡后发现恢复红色,则证明溶液红色褪去的原因是①而不是②;若再加碱,仍为无色,则证明溶液红色褪去的原因是②而不是①,
故答案为:加入NaOH溶液;①溶液变红色;②溶液不变红色;
(5)新制氯水中存在平衡:Cl2+H2O⇌HCl+HClO,达到平衡后加入少量CaCO3(s),HCl与碳酸钙反应,而HClO不反应,溶液中氢离子浓度减小,平衡向正反应方向移动,HClO浓度增加,而NaHSO3、Na2CO3、Ca(OH)2,三者与盐酸、次氯酸都反应,所以不选,
故选A;点评:
本题考点: 氯气的实验室制法.
考点点评: 本题为实验探究习题,同时考查氯水的成分、氯气、次氯酸的性质,明确溶液显红色和红色褪去的可能性是解答本题的关键,难度不大,注重了基础知识的考查,注意相关基础知识的积累.1年前查看全部
- 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.2005年的《化学教育》报道了如下实验研究:
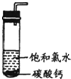 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.2005年的《化学教育》报道了如下实验研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.2005年的《化学教育》报道了如下实验研究:
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液黄绿色褪去.②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强.③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑且有大量无色气体产生.经检测,上述实验
中产生的无色气体均为CO2气体.
请回答:
(1)反应后所得的溶液漂白性增强的原因是______.
(2)写出步骤③中第一份及第三份滤液发生反应的离子方程式:第一份______;第三份Ca2++2HCO3-
CaCO3↓+CO2↑+H2O△ .Ca2++2HCO3-.
CaCO3↓+CO2↑+H2O△ .
(3)请推测②的滤液中含有的溶质除了极少量的氯气外,还有______.(填化学式)
实验二、定量研究:
如图所示,在圆底烧瓶底部,有用塑料网包住的过量的块状碳酸钙,加入150mL饱和氯水,连接好装置,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.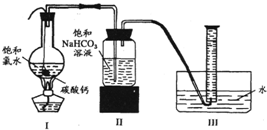
请回答:
(4)为减少用装置Ⅲ收集气体过程中CO2的损失,且水槽中仍然为水.请你对装置Ⅲ进行改进,最简单的方法是______;
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少A g,总共收集到标准状况的CO2气体B L,发现[BL/22.4L/mol]明显小于[Ag/100g/mol].若不考虑实验中CO2的损失和Ⅱ中可能发生的微量副反应等因素,从化学反应原理来看,导致这一大小关系的原因是______.
(6)实验后发现,装置Ⅱ中的液体增多了,其原因是______. 山一东的导师21年前1
山一东的导师21年前1 -
 皇甫星剑 共回答了24个问题
皇甫星剑 共回答了24个问题 |采纳率100%解题思路:(1)从Cl2+H2O HCl+HClO 平衡移动的角度分析;
HCl+HClO 平衡移动的角度分析;
(2)碳酸钙是过量的,碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙,以此书写反应的有关离子方程式;
(3)根据有关反应判断可能的产物;
(4)从二氧化碳微溶于水的角度分析;
(5)消耗的碳酸钙没有全部生成二氧化碳气体;
(6)圆底烧瓶蒸出的水蒸气在广口瓶中凝结为液体,水导致装置Ⅱ中的液体增多.(1)CaCO3 消耗了氯水中的 HC1,使 Cl2+H2O
 HCl+HClO 平衡向右移动,HClO浓度增大,反应中产生的气体为二氧化碳(氯化氢与碳酸钙反应所得),而二氧化碳溶于水呈酸性,抑制了次氯酸的电离平衡,使溶液中存在了浓度更高的次氯酸,因此将滤液滴在有色布条上,发现其比氯水的漂白性更强,
HCl+HClO 平衡向右移动,HClO浓度增大,反应中产生的气体为二氧化碳(氯化氢与碳酸钙反应所得),而二氧化碳溶于水呈酸性,抑制了次氯酸的电离平衡,使溶液中存在了浓度更高的次氯酸,因此将滤液滴在有色布条上,发现其比氯水的漂白性更强,
故答案为:CaCO3 消耗了氯水中的 HC1,使 Cl2+H2O HCl+HClO 平衡向右移动,HClO浓度增大;
HCl+HClO 平衡向右移动,HClO浓度增大;
(2)因为碳酸钙是过量的,碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙,与石灰水混合,立即产生大量白色沉淀,反应的离子方程式为Ca2++HCO3-+OH-=CaCO3↓+H2O,加热时碳酸氢钙分解生成CaCO3和CO2,反应的离子方程式为Ca2++2HCO3-
△
.
CaCO3↓+CO2↑+H2O,
故答案为:Ca2++HCO3-+OH-=CaCO3↓+H2O;Ca2++2HCO3-
△
.
CaCO3↓+CO2↑+H2O;
(3)氯气与水反应Cl2+H2O HCl+HClO,生成HClO,因为碳酸钙是过量的,并且反应中有二氧化碳生成,
HCl+HClO,生成HClO,因为碳酸钙是过量的,并且反应中有二氧化碳生成,
因此碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙CaCO3+H2O+CO2=Ca(HCO3)2,
因此第二份与稀盐酸混合Ca(HCO3)2+2HCl=CaCl2+2H2O+2CO2↑,
所以②的滤液中含有的溶质除了极少量的氯气外,还有HClO、Ca(HCO3)2、CaCl2,
故答案为:HClO、Ca(HCO3)2、CaCl2;
(4)因二氧化碳微溶于水,并且压强越大,气体的溶解度越大,为减少因二氧化碳的溶解而导致二氧化碳的损失,可使导管的出口接近量筒底部,减小二氧化碳的溶解,
故答案为:在导管末端再连接长导管,使导管的出口接近量筒底部;
(5)因为碳酸钙是过量的,碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙,受热时,除生成 CO2外,还生成了CaCO3,所以生成气体的物质的量明显小于固体的物质的量,
故答案为:碳酸钙与氯水反应生成的Ca(HCO3)2 受热时,除生成 CO2 外,还生成了CaCO3;
(6)圆底烧瓶蒸出的水蒸气在广口瓶中凝结为液体,水导致装置Ⅱ中的液体增多了,
故答案为:从圆底烧瓶蒸出的水蒸气在广口瓶中冷凝、聚集.点评:
本题考点: 氯气的化学性质;氯、溴、碘及其化合物的综合应用.
考点点评: 该题综合性较强,在定性研究中要求考生熟练掌握化学平衡移动和书写化学方程式,而在定量研究中则以简答题的形式要求考生答对和答全有关实验操作基本技术问题并进一步的思考实验现象的原因,较大程度地造成答案的难以确定和完整,题目难度较大.1年前查看全部
- 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某科研小组报道了如下实验研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某科研小组报道了如下实验研究:
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;第二份与稀盐酸混合,立即产生大量无色气体;将第三份加热,看到溶液变浑浊且有大量无色气体产生.经检测,上述实验中产生的无色气体均为CO2.
请回答:
(1)请写出实验室制备氯气的离子方程式______;
(2)反应后所得的溶液漂白性增强的原因是______;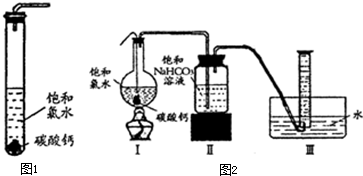
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是______
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少A g,总共收集到标准状况下的CO2气体B L,发现[BL/22.4L/mol]明显小于[Ag/100g/mol].若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是______;
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是______. 只愿做你oo1年前1
只愿做你oo1年前1 -
 woshiah 共回答了22个问题
woshiah 共回答了22个问题 |采纳率86.4%解题思路:(1)根据二氧化锰和浓盐酸反应生成氯化锰、氯气和水进行解答;
(2)根据氯水中存在平衡移动,HClO浓度大,漂白效果好进行解答;
(3)从二氧化碳微溶于水的角度分析;
(4)根据消耗的碳酸钙没有全部生成二氧化碳气体进行解答;
(5)根据圆底烧瓶蒸出的水蒸气在广口瓶中凝结为液体,水导致装置Ⅱ中的液体增多进行解答.(1)二氧化锰和浓盐酸反应生成氯化锰、氯气和水,离子反应为MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O;
(2)氯水中存在平衡移动,碳酸钙消耗了氯水中的H+,使Cl2+H2O⇌H++Cl-+HClO平衡正向移动,HClO浓度大,漂白效果增强,
故答案为:碳酸钙消耗了氯水中的H+,使Cl2+H2O⇌H++Cl-+HClO平衡正向移动,HClO浓度大,漂白效果增强;
(3)因二氧化碳微溶于水,并且压强越大,气体的溶解度越大,为减少因二氧化碳的溶解而导致二氧化碳的损失,可使导管的出口接近量筒底部,减小二氧化碳的溶解,故答案为:在导管末端再连接长导管,使导管的出口接近量筒底部;
(4)因为碳酸钙是过量的,碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙,受热时,除生成 CO2外,还生成了CaCO3,所以生成气体的物质的量明显小于固体的物质的量,
故答案为:有部分碳酸钙与氯水反应生成了Ca(HCO3)2,从而使生成的CO2少于减少的CaCO3的物质的量;
(5)圆底烧瓶蒸出的水蒸气在广口瓶中凝结为液体,水导致装置Ⅱ中的液体增多了,故答案为:从圆底烧瓶蒸出的水蒸气在广口瓶中冷凝、聚集.点评:
本题考点: 性质实验方案的设计;探究物质的组成或测量物质的含量.
考点点评: 该题综合性较强,在定性研究中要求考生熟练掌握化学平衡移动和书写化学方程式,而在定量研究中则以简答题的形式要求考生答对和答全有关实验操作基本技术问题并进一步的思考实验现象的原因,较大程度地造成答案的难以确定和完整,题目难度较大.1年前查看全部
- 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.1.在试管中加入过量的块状碳酸钙,再加入约20ml饱和氯水充分反
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.1.在试管中加入过量的块状碳酸钙,再加入约20ml饱和氯水充分反应,有少量气泡产生,溶液黄绿色褪去,2.过滤,把滤液分为2份,第一份与石灰水混合,立即产生大量白色沉淀,将第二份加热,看到溶液变浑浊且有大量无色气体产生.经检测,无色气体为CO2.写出第一份与第二份滤液中反应的方程式.
 diananiu1年前1
diananiu1年前1 -
 kaixin_620 共回答了18个问题
kaixin_620 共回答了18个问题 |采纳率77.8%第一份是CO2+Ca(OH)2=CaCO3+H2O
第二份是Ca(OH)2=(加热)CaO+H2O
至于气体,是由于温度升高,溶解度降低气体逸出.1年前查看全部
- 饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一.某兴趣小组进行了如下实验探究:
 饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一.某兴趣小组进行了如下实验探究:
饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一.某兴趣小组进行了如下实验探究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水(如图所示),充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现滤液比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;第二份与稀盐酸混合,立即产生大量无色气体;第三份滤液加热,看到滤液变浑浊且有大量无色气体产生.经检测,上述实验中产生的无色气体均为CO2.依据上述实验可推知:滤液中的溶质除CaCl2、HClO外,还有( )
A.Ca(ClO)2
B.CaCO3
C.Ca(HCO3)2
D.CaO grace1qaz1年前1
grace1qaz1年前1 -
 kdxsc 共回答了15个问题
kdxsc 共回答了15个问题 |采纳率93.3%解题思路:因次氯酸的酸性比碳酸弱,则次氯酸不与碳酸钙反应,则不可能存在次氯酸钙,第一份与澄清石灰水混合,立即产生大量白色沉淀,可说明含有碳酸氢钙,因碳酸氢钙可与石灰水反应生成白色碳酸钙沉淀,将第三份加热,看到溶液变浑浊且有大量无色气体产生,说明含有碳酸氢钙,反应的方程式为Ca(HCO3)2
CaCO3↓+H2O+CO2↑.△ .A、因次氯酸的酸性比碳酸弱,则次氯酸不与碳酸钙反应,则不可能存在次氯酸钙,故A错误;
B、碳酸钙不溶于水,因此滤液中不可能含有碳酸钙,故B错误;
C、碳酸氢钙与氢氧化钙反应生成碳酸钙沉淀,碳酸氢钙与盐酸反应生成二氧化碳,碳酸氢钙加热分解,反应的方程式为Ca(HCO3)2
△
.
CaCO3↓+H2O+CO2↑,故C正确;
D、氧化钙与HClO、水反应,因此滤液中不可能含有CaO,故D错误;
故选C.点评:
本题考点: 探究氯水、氯气的漂白作用.
考点点评: 本题考查性质的实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,注意把握实验的原理、步骤和实验方法,根据物质的性质解答该题,难度不大.1年前查看全部
- ①新制氯水和②久置氯水与③饱和氯水三者之间所含溶质方面上有什么区别?
 星之乐1年前1
星之乐1年前1 -
 秋叶飘如雪 共回答了19个问题
秋叶飘如雪 共回答了19个问题 |采纳率84.2%新制氯水,溶质主要是氯气,久置氯水,由于氯气与水反应生成次氯酸,次氯酸见光分解,使平衡身生成盐酸方向进行,时间长了溶液全部变成盐酸.饱和氯水,是氯气溶于水的饱和溶液,溶质是氯气分子.1年前查看全部
- 向饱和氯水加入NaOH溶液至PH=7,为啥C(Na+) = C(Cl-) + C(ClO-) .要是PH不等于7呢.会怎
向饱和氯水加入NaOH溶液至PH=7,为啥C(Na+) = C(Cl-) + C(ClO-) .要是PH不等于7呢.会怎样.
向饱和氯水加入NaOH溶液至PH=7,为啥C(Na+) = C(Cl-) + C(ClO-) .
要是PH不等于7呢.会怎样. longlee1年前2
longlee1年前2 -
 来找oo 共回答了21个问题
来找oo 共回答了21个问题 |采纳率85.7%这个方程是电核守恒的变形
原型:
C(Na+)+C(H+) = C(Cl-) + C(ClO-)+C(OH-)
因为PH=7,C(H+)=C(OH-)
所以C(Na+) = C(Cl-) + C(ClO-)
如果PH!=7
则有
C(Na+)+C(H+) = C(Cl-) + C(ClO-)+C(OH-)
必定成立1年前查看全部
- 常温下一体积水能溶解2体积氯气,所以饱和氯水是浓溶液
常温下一体积水能溶解2体积氯气,所以饱和氯水是浓溶液
为什么? chenqun991年前4
chenqun991年前4 -
 我只是随便看看的 共回答了28个问题
我只是随便看看的 共回答了28个问题 |采纳率100%这是不对的
浓溶液是指溶质含量很高的那种而不是去看容解度1年前查看全部
- 饱和氯水为什么没有HCLO和HCL?
 heyun83411年前1
heyun83411年前1 -
 sayonara 共回答了19个问题
sayonara 共回答了19个问题 |采纳率89.5%谁说没有Cl2+H2O=HClO+HCL,这是可逆的反应,饱和是不能在溶Cl2了,但是该反应一直都在进行1年前查看全部
- 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:第一份与石灰水混合,立即产生大量白色沉淀;第二份与稀盐酸混合,立即产生大量无色气体;将第三份加热,看到溶液变浑浊且有大量无色气体产生。 经检测,上述实验中产生的无色气体均为CO 2 。请回答:
(1)反应后所得的溶液漂白性增强的原因是________________________________。
(2)依据上述实验可推知:②的滤液中的溶质除CaCl 2 、HClO外,还含有_____________________。
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。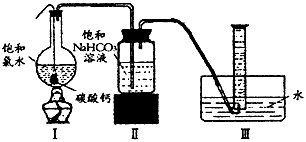
请回答:
(3)为减少用装置Ⅲ收集气体过程中CO 2 因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是_________________________________。
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的
CO 2 气体BL,发现明显小于。若不考虑实验操作和CO 2 的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是_____________________________。
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是_____________________________。 北极星星光灿烂1年前1
北极星星光灿烂1年前1 -
 LWW891015 共回答了16个问题
LWW891015 共回答了16个问题 |采纳率93.8%(1)CaCO 3 消耗了氯水中的HCl,使反应Cl 2 +H 2 O HCl+HClO向右移动,HClO浓度增大(2)Ca(HCO 3 ) 2 (或碳酸轻钙)(3)在导管末端再连接长导管,使导管的出口接近量筒底部(4)碳酸钙与氯水反应生成的碳酸...1年前查看全部
- 为什么饱和氯水参与氧化反应时,是氯气分子参加反应而不是次氯酸根离子呢?
 10kunai1年前3
10kunai1年前3 -
 carfi 共回答了21个问题
carfi 共回答了21个问题 |采纳率85.7%Cl2溶于水后,部分与水反应:Cl2 + H2OH+ + Cl- + HClO,大部分仍以Cl2形式存在.1年前查看全部
- 新制的饱和氯水与久置氯水的主要区别是什么
 Ben21年前2
Ben21年前2 -
 irisok 共回答了16个问题
irisok 共回答了16个问题 |采纳率87.5%新制氯水里还有不少氯分子,所以呈黄绿色.主要成分包括氯、次氯酸、氯化氢 久置后都与水反应,最后成为盐酸,所以成无色.主要成分是氯化氢1年前查看全部
大家在问
- 1请写出以下物质的化学式:甲烷,氧化亚铜,氧化亚铁,碳酸氢钙,硝酸铵,三氧化硫
- 22.Later in this chapter cases will be introduced to readers
- 3如何证明用碳酸氢钙制二氧化碳的产物中有碳酸钙
- 4设a=0.9^1/3,b=0.9^1/2,c=1.1^1/3 ,则a,b,c,从小到大排列的顺序?
- 5碳酸氢钙在270度时开始分解有气态二氧化碳生成
- 6一堆苹果,无论是平均分给6人,还是平均分给8人,都剩下5个,这堆苹果至少有多少个?
- 7把编号为1到n的n个球放进编号为1到n的n个盒子,要求球的编号和盒子的编号不相同,并且每个盒子只能放一...
- 8氢氧化钙和过量二氧化碳反应为什么生成碳酸氢钙
- 9乙醇和氧气反应生成乙酸的条件是什么?
- 10向量夹角范围 线线夹角范围面面夹角范围线面夹角范围谢
- 11乙醇生成乙酸的反应方程乙醇分别与高锰酸钾、重铬酸钾反应生乙酸的化学方程,指明反应条件
- 12神机妙算是褒义词还是贬义词?
- 13共有1个小立方体,1个开得见,0个看不见;共有8个小立方块,其中7个看得见,一个看不见;共有27个小立方块
- 14已知集合A={0,a,2a},B={0,b,b²}求A=B的充要条件
- 15电路如图所示 V1,V2为理想二极管.求:1)哪只二极管导通2)UAO=?(6分)
