25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3k
 鬼老二2022-10-04 11:39:541条回答
鬼老二2022-10-04 11:39:541条回答A. C(s)+12O2(g)=CO(g)△H=-393.5 kJ/mol
B. 2H2(g)+O2(g)=2H2O(l)△H=+571.6 kJ/mol
C. CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol
D. C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-2800 kJ/mol

已提交,审核后显示!提交回复
共1条回复
 玉子烟_ss 共回答了13个问题
玉子烟_ss 共回答了13个问题 |采纳率76.9%- 解题思路:燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,H生成液态水,C生成二氧化碳,据此分析判断.
燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,H生成液态水,C生成二氧化碳,
A、反应中生成一氧化碳不是稳定氧化物,故A错误;
B、氢气燃烧是放热反应,故B错误;
C、生成物水是气体不是稳定氧化物,故C错误;
D、符合燃烧热的概念,故D正确;
故选D.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了燃烧热的概念分析判断和实际应用,理解概念是解题关键,题目较简单. - 1年前
相关推荐
- 关于焓变的化学题8.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为C(石墨) + O2(g) ===
关于焓变的化学题
8.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨) + O2(g) === CO2(g) ΔH = -393.51kJ •mol-1
C(金刚石) + O2(g) === CO2(g) ΔH = -395.41kJ •mol-1
据此判断,下列说法中正确的是
A.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;石墨的能量比金刚石的高 fangwobox1年前3
fangwobox1年前3 -
 _枫 共回答了22个问题
_枫 共回答了22个问题 |采纳率95.5%A
以上方程式两种异形体与氧气反应的摩尔反应焓数值的绝对值大小表明了放出热量的多少,而CO2状态和量相同,可以理解为具有相同能量,那么现在假设生成的CO2具有的能量是A kj/mol ,那么C(石墨)的能量是A+393.51mol/kj ,而C(金刚石)的能量是A+395.41kj/mol ,这样就可以轻易得出结论:金刚石的能量比石墨大,进而得出要想让石墨变成金刚石必需让石墨吸收相差的能量来维持结构的变化,所以是吸热反应.1年前查看全部
- 已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)═CO2(g)△H=-393.51kJ•mol-1
C(金刚石)+O2(g)═CO2(g)△H=-395.41kJ•mol-1
据此判断,下列说法中正确的是( )
A.由石墨制备金刚石是吸热反应
B.由石墨制备金刚石是放热反应
C.石墨的能量比金刚石的低
D.石墨的能量比金刚石的高 一朵飘飞的云1年前1
一朵飘飞的云1年前1 -
 kaimo0125 共回答了23个问题
kaimo0125 共回答了23个问题 |采纳率91.3%解题思路:根据石墨、金刚石燃烧的热化学方程式,利用盖斯定律写出金刚石与石墨转化的热化学方程式,根据反应热比较金刚石与石墨的能量大小.由石墨、金刚石燃烧的热化学方程式①C(石墨)+O2(g)=CO2(g)△H=-393.51kJ•mol-1
②C(金刚石)+O2(g)=CO2(g)△H=-395.41kJ•mol-1,
利用盖斯定律将①-②可得:C(石墨)=C(金刚石);△H=+1.9kJ•mol-1,则
A、C(石墨)=C(金刚石)△H=+1.9kJ•mol-1,可知由石墨制备金刚石是吸热反应,故A正确;
B、C(石墨)=C(金刚石)△H=+1.9kJ•mol-1,可知由石墨制备金刚石是吸热反应,故B错误;
C、C(石墨)=C(金刚石)△H=+1.9kJ•mol-1,可知由石墨制备金刚石是吸热反应,金刚石能量大于石墨的总能量,故C正确;
D、C(石墨)=C(金刚石)△H=+1.9kJ•mol-1,可知由石墨制备金刚石是吸热反应,金刚石能量大于石墨的总能量,故D错误;
故选:AC.点评:
本题考点: 热化学方程式;化学反应中能量转化的原因.
考点点评: 本题考查热化学方程式的书写及应用,题目难度不大,注意吸热反应与反应物和生成物能量的关系.1年前查看全部
- (1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ.则表示甲烷燃烧热的热化学方程式为___
(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ.则表示甲烷燃烧热的热化学方程式为______.
(2)根据如下反应式:
A.Na+(g)+Cl-(g)-→NaCl(s);△H
B.Na(s)+[1/2]Cl2(g)-→NaCl(s);△H1
C.Na(s)-→Na(g);△H2
D.Na(g)-e--→Na+(g);△H3
E.[1/2]Cl2(g)-→Cl(g);△H4
F.Cl(g)+e--→Cl-(g);△H5
写出△H1与△H、△H2、△H3、△H4、△H5之间的关系式______
(3)常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ.mol-1)下表是一些键能数据(KJ•mol-1)
回答下列问题:化学键 键能 化学键 键能 化学键 键能 C-F 427 C-Cl 330 C-I 218 H-H 436 S=S 255 H-S 339
①由表中数据规律预测C-Br键的键能范围:______<C-Br键能<______
②热化学方程式2H2(g)+S2(g)═2H2S(g);△H=______
③已知下列热化学方程式:
O2 (g)═O+2(g)+e-△H1=+1175.7kJ•mol-1
PtF6(g)+e-═PtF6-(g)△H2=-771.1kJ•mol-1
O2+PtF6-(s)═O2+(g)+PtF6-(g)△H3=+482.2kJ•mol-1
则反应O2(g)+______ (g)=O2+PtF6-(s)的△H=______ kJ•mol-1. 仙儿711年前1
仙儿711年前1 -
 乐于水 共回答了21个问题
乐于水 共回答了21个问题 |采纳率95.2%解题思路:(1)lg甲烷完全燃烧生成CO2和液态水时放热55.6kJ热量,16g甲烷燃烧放热889.6KJ,依据热化学方程式书写方法标注聚集状态和对应焓变写出;
(2)依据热化学方程式和盖斯定律计算得到;
(3)①依据元素周期表中同主族存在的变化规律,C-Br原子半径在C-Cl和C-I之间,键能应介于C-Cl和C-I之间,分析图表数据分析化学键键能大小;
②依据键能计算反应焓变,△H=反应物键能总和-生成物键能总和得到;
③依据热化学方程式和盖斯定律计算分析得到所需热化学方程式.(1)lg甲烷完全燃烧生成CO2和液态水时放热55.6kJ热量,16g甲烷燃烧放热889.6KJ,依据热化学方程式书写方法标注聚集状态和对应焓变写出热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6 kJ/mol;
(2)依据盖斯定律A+C+D+E+F得到Na(s)+[1/2]Cl2(g)→NaCl(s)△H1=△H+△H2+△H3+△H4+△H5,
故答案为:△H1=△H+△H2+△H3+△H4+△H5;
(3)①元素周期表中同主族存在的变化规律,C-Br原子半径在C-Cl和C-I之间,键能应介于C-Cl和C-I之间,C-Br键的键能范围为218 KJ•mol-1 <C-Br键能<330 KJ•mol-1,
故答案为:218 KJ•mol-1;330 KJ•mol-1;
②热化学方程式2H2(g)+S2(g)═2H2S(g);△H=Q kJ•mol-1,△H=反应物键能总和-生成物键能总和=2×436KJ/mol+255KJ/mol-2×2×339KJ/mol=-229KJ/mol,则△H=-229KJ/mol,
故答案为:-229KJ/mol;
③Ⅰ、O2(g)═O+2(g)+e-△H1=+1175.7kJ•mol-1
Ⅱ、PtF6(g)+e-═PtF6-(g)△H2=-771.1kJ•mol-1
Ⅲ、O2+PtF6-(s)═O2+(g)+PtF6-(g)△H3=+482.2kJ•mol-1
依据热化学方程式和盖斯定律计算Ⅰ+Ⅱ-Ⅲ得到O2(g)+PtF6 (g)=O2+PtF6-(s)△H=-776KJ/mol,
故答案为:PtF6;-77.6.点评:
本题考点: 用盖斯定律进行有关反应热的计算;反应热和焓变;热化学方程式.
考点点评: 本题考查了化学反应能量变化,热化学方程式书写和盖斯定律计算应用,注意反应焓变可以依据键能计算,题目难度中等.1年前查看全部
- (1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ.则表示甲烷燃烧热的热化学方程式为CH4
(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ.则表示甲烷燃烧热的热化学方程式为CH4(g)+2O2 (g)=CO2 (g)+2H2O(l) △H= -889.6kJ/molCH4(g)+2O2 (g)=CO2 (g)+2H2O(l) △H= -889.6kJ/mol.
(2)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位kJ•mol-1):
根据键能数据计算以下反应的反应热△H,CH4(g)+4F2(g)=CF4(g)+4HF(g)△H=化学键 C-H C-F H-F F-F 键能 414 489 565 158 △H=-1928kJ/mol△H=-1928kJ/mol.
(3)已知下列反应在298K时的反应焓变
N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ•mol-1
NH3(g)+HCl(g)=NH4Cl(s)△H=-176.0kJ•mol-1
Cl2(g)+H2(g)=2HCl(g)△H=-184.6kJ•mol-1
反应N2(g)+4H2(g)+Cl2(g)=2NH4Cl(s)在298K时的焓变△H=______. 何氏璧1年前1
何氏璧1年前1 -
 流浪炫篮 共回答了18个问题
流浪炫篮 共回答了18个问题 |采纳率72.2%解题思路:(1)lg甲烷完全燃烧生成CO2和液态水时放热55.6kJ热量,则16g甲烷燃烧放热889.6KJ,依据热化学方程式书写方法标注聚集状态和对应焓变写出;
(2)依据化学反应的焓变=反应物总键能-生成物总键能计算得到反应的焓变;
(3)根据盖斯定律来解答.(1)lg甲烷完全燃烧生成CO2和液态水时放热55.6kJ热量,16g甲烷燃烧放热889.6KJ,依据热化学方程式书写方法标注聚集状态和对应焓变写出热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6 kJ/mol;
(2)化学反应的焓变=反应物总键能-生成物总键能,
CH4(g)+4F2(g)=CF4(g)+4HF(g)
△H=(414KJ/mol×4+158KJ/mol×4)-(489KJ/mol×4+565KJ/mol×4)=-1928KJ/mol;
故答案为:-1928KJ/mol;
(3)N2(g)+3H2(g)═2NH3(g)△H2=-92.2kJ•mol-1 ①
NH3(g)+HCl(g)═NH4Cl(s)△H1=-176kJ•mol-1②
H2(g)+Cl2(g)═2HCl(g)△H3=-184.6kJ•mol-1③
则由盖斯定律可知,
298K时的N2(g)+4H2(g)+Cl2(g)═2NH4Cl(s)可由①+③+②×2得到,
则△H=△H1+△H3+△H2×2=(-92.2kJ•mol-1)+(-184.6kJ•mol-1)+(-176kJ•mol-1)×2=-628.8kJ/mol,
故答案为:-628.8kJ/mol.点评:
本题考点: 热化学方程式;反应热和焓变.
考点点评: 本题考查学生燃烧热的热化学方程式的书写和利用盖斯定律来计算反应的反应热,明确已知反应和目标反应的关系是解答本题的关键,难度不大,注重了对高考热点的考查.1年前查看全部
- 120摄式度、101kpa下,a毫升由一氧化炭和C2H4组成的混合气体足量的氧气完全燃烧后恢复到原温度的压强测得混合气体
120摄式度、101kpa下,a毫升由一氧化炭和C2H4组成的混合气体足量的氧气完全燃烧后恢复到原温度的压强测得混合气体完全燃烧所消耗氧气的体积与生成二氧化炭的体积相等 请回答:等体积的一氧化炭和C2H4在相同条件下分别完全燃烧生成二氧化碳为多少?消耗氧气体积为多少?燃烧前混合气体中一氧化碳和C2H4体积比是,
 binghanxb1年前1
binghanxb1年前1 -
 我是诗人我怕谁 共回答了15个问题
我是诗人我怕谁 共回答了15个问题 |采纳率93.3%我看到您的问题很久没有人来回答,但是问题过期无人回答会被扣分的并且你的悬赏分也会被没收!所以我给你提几条建议:一,你可以选择在正确的分类下去提问,这样知道你问题答案的人才会多一些,回答的人也会多些.二,您可以到与您问题相关专业网站论坛里去看看,那里聚集了许多专业人才,一定可以为你解决问题的.三,你可以向你的网上好友问友打听,他们会更加真诚热心为你寻找答案的,甚至可以到相关网站直接搜索.四,网上很多专业论坛以及知识平台,上面也有很多资料,我遇到专业性的问题总是上论坛求解决办法的.五,将你的问题问的细一些,清楚一些!让人更加容易看懂明白是什么意思!!1年前查看全部
- 1、25 101kpa下:2Na+1/2O2=Na2O H=-414kj/mol 2Na+O2=Na2O2.H=-511
1、25 101kpa下:2Na+1/2O2=Na2O H=-414kj/mol 2Na+O2=Na2O2.H=-511kj/mol 下列说法正确的是
A、1和2产物的阴阳离子个数比不相等
B、1和2生成等物质的量的产物,转移电子数不同
C、常温下Na与足量O2反应生成Na2O随温度的升高生成Na2O的速率逐渐加快
D、25度过101kpa下,Na2O+2Na=2Na2O.H=-317kj/mol
2、用惰性电极分别电解下列物质的水溶液一段时间后,向剩余溶液中加入一定量的一种物质(括号内),溶液能恢复到与原溶液完全一样的是()
A、CuCl2(CuCl2) B.NaOH(NaOH) C.NaCl(盐酸)D、CuSO4[Cu(OH)2]
答案是A但我觉得是C为什么C不对?其他选项也分析一下~ 沙漠鱼摆摆1年前2
沙漠鱼摆摆1年前2 -
 coolfly14 共回答了16个问题
coolfly14 共回答了16个问题 |采纳率93.8%1
A阴阳离子个数相同阳离子都是钠离子,阴离子第一个是氧离子,第二个是过氧根离子
C随温度升高氧化钠生成过氧化钠或钠直接生成过氧化钠所以速率减少
D无论多少温度多少卡帕下化学热不变
2
A电解CuCl2溶液生成Cu和Cl2
B要加水电解NaOH溶液实质是电解水
C不对可能是电解NaCl溶液时生成的氯气与水生成了HCl和HClO
D电解CuSO4溶液生成Cu,O2,H2SO4,H2SO4与Cu(OH)2生成的水会比原来多一个,你写一下方程式就知道啦1年前查看全部
- 已知在25℃,101kPa下,1gC 8 H 18 (辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反
已知在25℃,101kPa下,1gC 8 H 18 (辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( ) A. C 8 H 18 (l)+12.5 O 2 (g)=8C O 2 (g)+9 H 2 O(g)△H=-48.40kJ•mo l -1 B. C 8 H 18 (l)+12.5 O 2 (g)=8C O 2 (g)+9 H 2 O(l)△H=-5518kJ•mo l -1 C. C 8 H 18 (l)+12.5 O 2 (g)=8C O 2 (g)+9 H 2 O(l)△H=+5518kJ•mo l -1 D. C 8 H 18 (l)+12.5 O 2 (g)=8C O 2 (g)+9 H 2 O(l)△H=-48.40kJ•mo l -1  绿雨滴1年前1
绿雨滴1年前1 -
 jiusuanmeiyoumin 共回答了14个问题
jiusuanmeiyoumin 共回答了14个问题 |采纳率92.9%由25℃,101kPa下,1gC 8 H 18 (辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,
则1molC 8 H 18 燃烧生成二氧化碳和液态水时放出热量为48.40kJ×114=5518kJ,
标明物质的聚集状态,该反应为放热反应,则
热化学反应方程式为C 8 H 18 (l)+
25
2 O 2 (g)═8CO 2 (g)+9H 2 O(l)△H=-5518kJ/mol,
故选B.1年前查看全部
- 25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( ).
25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( ).
A.2H2(g)+O2(g)===2H2O(l),△H=-285.8kJ/mol.
B.2H2(g)+O2(g)===2H2O(l),△H=+571.6kJ/mol.
C.2H2(g)+O2(g)===2H2O(g),△H=-571.6kJ/mol.
D.H2(g)+1/2O2(g)===H2O(l),△H=-285.8kJ/mol.
请写出计算过程和结果并说明理由好吗? maggie11201年前2
maggie11201年前2 -
 蜡笔小新家的小白 共回答了21个问题
蜡笔小新家的小白 共回答了21个问题 |采纳率85.7%D.H2(g)+1/2O2(g)===H2O(l),△H=-285.8kJ/mol.
上式符合2g氢气燃烧生成液态水,放出285.8kJ热量.1年前查看全部
- 在0℃和101KPa下,2.00gHe、3.01×10 22 个N 2 、1.60gO 2 混合,该混合气体的体积是(
在0℃和101KPa下,2.00gHe、3.01×10 22 个N 2 、1.60gO 2 混合,该混合气体的体积是( ) A.13.44L B.7.84L C.10.08L D.无法计算  太阳有火1年前1
太阳有火1年前1 -
 cqzhousong 共回答了18个问题
cqzhousong 共回答了18个问题 |采纳率100%n(He)=
2.00g
4g/mol =0.5mol,n(O 2 )=
1.60g
32g/mol =0.05mol,n(N 2 )=
3.01×1 0 22
6.02×1 0 23 mo l -1 =0.05mol,则混合气体的总物质的量为:0.5mol+0.05mol+0.05mol=0.6mol,该混合气体的体积V=n•V m =0.6mol×22.4L/mol=13.44L,
故选:A.1年前查看全部
- 一道物理题已知在25℃,101kPa下,8gCH4气体燃烧生成二氧化碳和液态水时放出444.8kJ热量.表示上述反应的热
一道物理题
已知在25℃,101kPa下,8gCH4气体燃烧生成二氧化碳和液态水时放出444.8kJ热量.表示上述反应的热化学方程式正确的是
A.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-889.6kJ.mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-889.6kJ.mol-1
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=+889.6kJ.mol-1
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-444.8kJ.mol-1
详细点解释 mlchenfeng1年前4
mlchenfeng1年前4 -
 crystalhuman 共回答了17个问题
crystalhuman 共回答了17个问题 |采纳率76.5%选B.A项水的状态错误.C项应该是放热用“-”D项应是放出889.6kj/mol.8克CH4为0.5mol放出444.8kjl,1molCH4放出889.6kj热量.热方程式注意各物质状态、“+”“-”和吸放热量值.1年前查看全部
- 标况下1升某烃气体与适量O2恰好完全反应生成co2和H2o,在270摄氏度,101kpa下,混合气体体积为b升,当冷却到
标况下1升某烃气体与适量O2恰好完全反应生成co2和H2o,在270摄氏度,101kpa下,混合气体体积为b升,当冷却到标准状况时,气体体积变为a升,用a、b表示该烃分子式.
答案CaHb-2a, judd1111111年前3
judd1111111年前3 -
 pibaooo 共回答了21个问题
pibaooo 共回答了21个问题 |采纳率95.2%以上两个解释的都忽略了一个重要的问题!下面我把我的思路给你说一下:
1、标况时,气体a升是二氧化碳,这个毋庸置疑了,有这个可以判断一分子烃含有a个碳原子;
2、下面就要探讨一分子烃含有氢原子的个数了,(物理学上的理想气体状态方程,不知道你学习过没有,如果学过,下面的解释就简单了.)首先,标况下a升的二氧化碳,它在270摄氏度,101kpa下时,体积就变成了2a升了,所以,水蒸气在270摄氏度,101kpa下时的体积是(b-2a)升,换算到标况下,应该是(b-2a)/2 升,由于水分子里面含两个氢原子,所以再乘以2,这样一分子烃含有(b-2a)个氢原子了.1年前查看全部
- 25℃、101kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值(指一定条件下单位质量的物质完全燃烧所放出
25℃、101kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值(指一定条件下单位质量的物质完全燃烧所放出的热量)依次是33kJ•g-1、143kJ•g-1、56kJ•g-1、23kJ•g-1,则下列热化学方程式正确的是 ( )
A. C(s)+[1/2]O2(g)=CO(g)△H=-396kJ•mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-896kJ•mol-1
C. 2H2(g)+O2(g)=2H2O(l)△H=-286kJ•mol-1
D. CH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=+736kJ•mol-1 柳小丽5201年前1
柳小丽5201年前1 -
 nirvana9 共回答了21个问题
nirvana9 共回答了21个问题 |采纳率100%解题思路:根据燃料的热值以及热化学方程式的含义进行计算.A、煤炭的热值是33kJ•g-1,则12g煤炭放出的热量为396kJ,所以热化学方程式为:C(s)+O2(g)=CO2(g)
△H=-396kJ•mol-1,故A错误;
B、天然气的热值是56kJ•g-1,则16gCH4放出的热量为896kJ,所以热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-896kJ•mol-1,故B正确;
C、氢气的热值是143kJ•g-1,则4gH2放出的热量为572kJ,所以热化学方程式:2H2(g)+O2(g)=2H2O(l)
△H=-572kJ•mol-1,故C错误;
D、甲醇(CH3OH)的热值是23kJ•g-1,则32gCH3OH防出的热量为736kJ,所以热化学方程式:CH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-736kJ•mol-1,故D错误;
故选:B.点评:
本题考点: 热化学方程式.
考点点评: 本题主要考查了热化学方程式的书写以及反应热的计算,题目难度中等,要能根据热值来计算一定量的物质燃烧时放出的热量.1年前查看全部
- 依据事实,按要求作答.(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧
依据事实,按要求作答.
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+[3/2]O2(g)→CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1CH3OH(l)+[3/2]O2(g)→CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1.
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量.热化学方程式为C2H2(g)+[5/2]O2(g)→2CO2(g)+H2O(l)△H=-1300 kJ•mol-1C2H2(g)+[5/2]O2(g)→2CO2(g)+H2O(l)△H=-1300 kJ•mol-1.
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=11,则该温度下水的Kw=______.
(4)已知Sn(s)+Cl2(g)=SnCl2(s)△H=-349.8kJ•mol-1;
SnCl2(s)+Cl2(g)=SnCl4(l)△H=-195.4kJ•mol-1.
则Sn(s)+2Cl2(g)=SnCl4(l)的反应热为△H=______. zhouqing11301年前1
zhouqing11301年前1 -
 lillian419 共回答了20个问题
lillian419 共回答了20个问题 |采纳率95%解题思路:(1)根据1g甲醇燃烧放出的热量,计算出1mol甲醇的热量,然后写出燃烧热的化学方程式;
(2)根据乙炔燃烧方程式和已知热量关系,求出1mol乙炔完全燃烧放出的热量,然后写出燃烧热的化学方程式;
(3)根据Kw表达式求解;
(4)根据盖斯定律将热化学方程式变形,进行运算求解.(1)根据条件得:
CH3OH(l)+[3/2]O2(g)→CO2(g)+2H2O(l) 放出热量
1g 22.68kJ
32g 725.76 kJ
甲醇燃烧热的化学方程式为:CH3OH(l)+[3/2]O2(g)→CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1
故答案为:CH3OH(l)+[3/2]O2(g)→CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1;
(2)1mol乙炔完全燃烧转移电子数5mol,即5NA个.
根据已知条件得:
C2H2(g)+[5/2]O2(g)→2CO2(g)+H2O(l) 放出热量 转移电子数
650kJ 5NA
1300 kJ10NA
乙炔燃烧热的化学方程式为:C2H2(g)+[5/2]O2(g)→2CO2(g)+H2O(l)△H=-1300 kJ•mol-1
故答案为:C2H2(g)+[5/2]O2(g)→2CO2(g)+H2O(l)△H=-1300 kJ•mol-1;
(3)Kw=[H+][OH-],0.01mol•L-1的NaOH溶液的pH=11中,[H+]=10-11mol•L-1 [OH-]=10-2mol•L-1
Kw=10-13,
故答案为:Kw=10-13;
(4)Sn(s)+Cl2(g)=SnCl2(s)△H=-349.8kJ•mol-1①
SnCl2(s)+Cl2(g)=SnCl4(l)△H=-195.4kJ•mol-1②
根据盖斯定律①+②得目标方程式:Sn(s)+2Cl2(g)=SnCl4(l),△H=△H1+△H2=)-545.2 kJ⋅mol-1,
故答案为:-545.2 kJ⋅mol-1.点评:
本题考点: 热化学方程式;有关反应热的计算.
考点点评: 热化学方程式的书写,反应热的求算是高考的热点,解题时注意燃烧热的概念指的是1mol物质完全燃烧生成稳定的氧化物放出的热量.1年前查看全部
- 25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3k
25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是 [ ]
A.C(s)+1/2O 2 (g)==CO(g) △H=-393.5kJ/mol
B.2H 2 (g)+O 2 (g)==2H 2 O(g) △H=+571.6kJ/mol
C.CH 4 (g)+2O 2 (g)==CO 2 (g)+2H 2 O(g) △H=-890.3kJ/mol
D.1/2C 6 H 12 O 6 (s)+3O 2 (g)==3CO 2 (g)+3H 2 O(l) △H=-1400kJ/mol liujiye1191年前1
liujiye1191年前1 -
 crystal__prince 共回答了14个问题
crystal__prince 共回答了14个问题 |采纳率100%D1年前查看全部
- (1)在25℃、101kPa下,若5.2g乙炔(C2H2气态)完全燃烧生成水和CO2(g)时放热260kJ.该反应的热化
(1)在25℃、101kPa下,若5.2g乙炔(C2H2气态)完全燃烧生成水和CO2(g)时放热260kJ.该反应的热化学方程式为______.乙炔的燃烧热为______.
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为______.
(3)2SO2(g)+O2(g)=2SO3(g)△H1=-197kJ•mol-1; H2O(g)═H2O(l)△H2=-44kJ•mol-1;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ•mol-1.则SO3(g)与H2O(l)反应的热化学方程式是______. 古墓鱼1年前1
古墓鱼1年前1 -
 haode712 共回答了13个问题
haode712 共回答了13个问题 |采纳率100%解题思路:(1)依据5.2g乙炔(C2H2气态)完全燃烧生成液态水和CO2(g)时放热260kJ求出2mol乙炔完全燃烧生成液态水和二氧化碳气体的热化学方程式,再求出1mol乙炔燃烧放出的热量据此解答;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)根据盖斯定律计算化学反应的焓变,并书写热化学方程式.(1)5.2g乙炔物质的量为:[5.2g/26g/mol]=0.2mol,0.2mol乙炔(C2H2气态)完全燃烧生成液态水和CO2(g)时放热260kJ,则2mol乙炔完全燃烧生成液态水和CO2(g)时放热2600kJ,所以乙炔燃烧的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2600.0kJ•mol-1;根据乙炔燃烧的热化学方程式可知1mol乙炔完全燃烧生成稳定的氧化物放出的热量为1300KJ,所以乙炔的燃烧热为-1300KJ/mol;
故答案为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2600.0kJ•mol-1;-1300KJ/mol;
(2)在反应N2+3H2⇌2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1.
(3)已知:①2SO2(g)+O2(g)=2SO3(g)△H1=-197kJ•mol-1;
②H2O(g)═H2O(l)△H2=-44kJ•mol-1;
③2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ•mol-1.
则SO3(g)+H2O(l)=H2SO4(l)的反应可以根据[1/2](③-①-②)得到,所以SO3(g)+H2O(l)=H2SO4(l)的焓变△H=[1/2](③-①-②)=[1/2](-545kJ•mol-1+197kJ•mol-1+44kJ•mol-1)=-130kJ•mol-1,故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ•mol-1.点评:
本题考点: 热化学方程式;有关反应热的计算.
考点点评: 本题考查了化学反应的吸放热和反应物产物键能之间的关系、热化学方程式和盖斯定律的计算等知识,注意知识的整理和应用是关键,难度中等.1年前查看全部
- 已知:(1)如图(2)25℃、101kPa下:①2Na (s)+ 1 2 O 2 (g)═Na 2 O(s)△
已知:
(1)如图
(2)25℃、101kPa下:
①2Na (s)+
O 2 (g)═Na 2 O(s)△H 1 =-414kJ/mol1 2
②2Na(s)+O 2 (g)═Na 2 O 2 (s)△H 2 =-511kJ/mol
根据以上信息判断,下列说法正确的是( )A.CO的燃烧热为283 kJ B.常温下Na与足量O 2 反应生成Na 2 O,随温度升高生成Na 2 O的速率逐渐加快 C.25℃、101 kPa下,Na 2 O 2 (s)+2Na(s)═2Na 2 O(s)H=-317 kJ/mol D.Na 2 O 和Na 2 O 2 阴阳离子个数比不相等 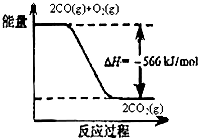
 popokan1年前1
popokan1年前1 -
 lilseven 共回答了10个问题
lilseven 共回答了10个问题 |采纳率70%A、由图可知:2CO(g)+O 2 (g)═2CO 2 (g)△H=-566kJ/mol,CO的燃烧热为283kJ/mol,故A错误;
B、钠与氧气在加热条件下反应生成Na 2 O 2 ,故B错误;
C、①2Na (s)+
1
2 O 2 (g)═Na 2 O(s)△H 1 =-414kJ/mol ②2Na(s)+O 2 (g)═Na 2 O 2 (s)△H 2 =-511kJ/mol,①×2-②得,25℃、101 kPa下,Na 2 O 2 (s)+2Na(s)═2Na 2 O(s)△H=-317 kJ/mol,故C正确;
D、Na 2 O中的离子为:Na + 、O 2- ,Na 2 O 2 中的离子为:Na + 、O 2 2- ,所以Na 2 O 和Na 2 O 2 阴阳离子个数分别为:2:1,2:1,阴阳离子个数比相等,故D错误;
故选:C.1年前查看全部
- 在4摄氏度,101kpa下22.4 克N2和Co的混合气体与18mlh2o分子比
 frankbeauty1年前1
frankbeauty1年前1 -
 liuhongyang 共回答了20个问题
liuhongyang 共回答了20个问题 |采纳率80%因为n2与co的相对分子质量相同,都为28,所以用22,4g/28g/mol=0.8mol.18mlh2o有18g,有1
mol.所以0.8/1=0.8.抓机不容易啊1年前查看全部
- (1)在25℃、101kPa下,1g甲烷燃烧生成CO 2 和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为_
(1)在25℃、101kPa下,1g甲烷燃烧生成CO 2 和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为_____________________________。
(2)根据如下反应式:
A.Na + (g)+Cl - (g)→NaCl(s);△H
B.Na(s)+1/2Cl 2 (g)→NaCl(s);△H1
C.Na(s)→Na(g);△H2
D.Na(g)-e - →Na + (g);△H3
E.1/2Cl 2 (g)→Cl(g);△H4
F.Cl(g)+e - →Cl - (g);△H5
写出△H1与△H、△H2、△H3、△H4、△H5之间的关系式__________________________
(3)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol -1 ):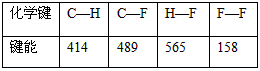
根据键能数据计算以下反应的反应热△H:
CH 4 (g)+4F 2 (g)==CF 4 (g)+4HF(g) △H=______________________ 先已断1年前1
先已断1年前1 -
 金鱼王子 共回答了16个问题
金鱼王子 共回答了16个问题 |采纳率93.8%(1)CH 4 (g)+2O 2 (g)=CO 2 (g)+2H 2 O(l) ΔH=-889.6kJ·mol -1
(2)△H1=△H+△H2+△H3+△H4+△H5
(3)-1928kJ/mol1年前查看全部
- 问道化学计算题120℃、101kPa下,amL由CO、CH4组成的混合气体在bmL O2中完全燃烧后,恢复到原温度和压强
问道化学计算题
120℃、101kPa下,amL由CO、CH4组成的混合气体在bmL O2中完全燃烧后,恢复到原温度和压强.
②若燃烧后气体体积缩小了a/4 mL,则a与b关系的数学表示式是______. xianaier2141年前1
xianaier2141年前1 -
 LY-liwei17 共回答了23个问题
LY-liwei17 共回答了23个问题 |采纳率87%由方程式2 CO+O2=2 CO2知此方程式气体体积减少,且每2体积CO2与1体积O2反应气体体积减少1体积(因为反应后体积为2),而另一个方程
CH4+2 O2=2 CO2+2 H2O知(注意,120度时水为气体)气体体积不减少,
所以体积缩小的a/4ML,则反应的CO2体积为a/2 ml.因为完全燃烧,所以CH4体积为a-a/2=a/2 ml,那么从方程式算出O2体积为5a/4 ml
所以b=5a/41年前查看全部
- 已知25°C、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:C(石墨)+O2(g)═CO2(g)△H=−393.
已知25°C、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:C(石墨)+O2(g)═CO2(g)△H=−393.51kJ•mol−1C(金刚石)+O2(g)═CO2(g)△H=−395.41kJ•mol−1
请写出金刚石转化为石墨的热化学方程式.______. 财迷意乱1年前1
财迷意乱1年前1 -
 yangdan_88 共回答了16个问题
yangdan_88 共回答了16个问题 |采纳率87.5%解题思路:根据金刚石和石墨燃烧的热化学方程式,利用盖斯定律二式相减可得金刚石转化为石墨的热化学方程式,据此进行解答.已知:①C(石墨)+O2(g)=CO2(g)△H=-393.51kJ•mol-1
②C(金刚石)+O2(g)=CO2(g)△H=-395.41kJ•mol-1
利用盖斯定律将②-①可得:
C(金刚石)=C(石墨);△H=(-395.41kJ•mol-1)-(-393.51kJ•mol-1)=-1.9kJ•mol-1,
故答案为:C(金刚石)=C(石墨)△H=-1.9kJ•mol-1.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查反应热的计算,注意盖斯定律的应用,题目难度不大.1年前查看全部
- 25℃、101kPa下:①2Na(s)+[1/2]O2(g)═Na2O(s)△H1=-414kJ/mol;②2Na(s)
25℃、101kPa下:
①2Na(s)+[1/2]O2(g)═Na2O(s)△H1=-414kJ/mol;
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol.
下列说法正确的是( )
A.①和②生成等物质的量的产物,转移的电子数相同
B.Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
C.25℃、101 kPa下,Na2O2(s)+2Na(s)═2Na2O(s)△H=+317 kJ/mol
D.①和②产物中的阴阳离子个数比均为1:1 weare0211年前1
weare0211年前1 -
 mazada 共回答了21个问题
mazada 共回答了21个问题 |采纳率71.4%解题思路:A、生成等物质的量氧化钠和过氧化钠需要的金属钠物质的量相同,依据电子守恒计算分析;
B、钠和氧气反应生成氧化钠,随温度的升高会生成过氧化钠;
C、依据热化学方程式和盖斯定律计算得到热化学方程式分析判断;
D、氧化钠是2个钠离子和一个氧离子构成,过氧化钠是由2个钠在和一个过氧根离子构成,阴阳离子数之比为1:2;A、①和②生成等物质的量的产物,Na2O,Na2O2,需要金属钠物质的量相同,所以转移的电子数相同,故A正确;
B、Na与足量O2反应生成Na2O,随温度升高生成Na2O2,故B错误;
C、①2Na(s)+[1/2]O2(g)═Na2O(s)△H1=-414kJ/mol;
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol.
依据盖斯定律①×2-②得到Na2O2(s)+2Na(s)═2Na2O(s)△H=-317 kJ/mol,故C错误;
D、①和②产物为Na2O,Na2O2,产物中的阴阳离子个数比均为1:2,故D错误;
故选A.点评:
本题考点: 用盖斯定律进行有关反应热的计算;氧化还原反应的电子转移数目计算.
考点点评: 本题考查了热化学方程式书写方法,盖斯定律和反应定量计算应用,注意氧化钠和过氧化钠的结构分析判断,掌握基础是解题关键,题目难度中等.1年前查看全部
- 25℃、101kPa下:①2Na(s)+[1/2]O2(g)=Na2O(s)△H=-414kJ/mol ②2
25℃、101kPa下:①2Na(s)+[1/2]O2(g)=Na2O(s)△H=-414kJ/mol ②2Na(s)+O2(g)=Na2O2 (s)△H=-511kJ/mol下列说法不正确的是( )
A.反应①②均为放热反应
B.反应①中反应物的总能量大于生成物的总能量
C.反应②中反应物断键吸收的能量大于生成物成键放出的能量
D.25℃、101kPa下:Na2O(s)+1/2O2(g)=Na2O2(s)△H=-97 kJ/mol sunstella1年前1
sunstella1年前1 -
 侬是yy 共回答了27个问题
侬是yy 共回答了27个问题 |采纳率96.3%解题思路:A、依据反应的焓变分析判断,焓变小于0是放热反应;
B、依据反应前后能量守恒分析判断;
C、依据拆化学键吸收热量,形成化学键放出热量,二者的相对大小比较判断;
D、依据①②热化学方程式和盖斯定律的应用计算得到;A、反应①②的焓变都是小于0,所以均为放热反应,故A正确;
B、反应①是放热反应,反应中反应物的总能量大于生成物的总能量,故B正确;
C、反应②是放热反应,反应中反应物断键吸收的能量小于生成物成键放出的能量,故C错误;
D、25℃、101kPa下,依据盖斯定律热化学方程式②-①得到Na2O(s)+[1/2]O2(g)=Na2O2(s)△H=-97 kJ/mol,故D正确;
故选C.点评:
本题考点: 化学能与热能的相互转化.
考点点评: 本题考查了化学反应的能量变化判断,热化学方程式的书写方法混合盖斯定律的应用,关键是理解反应焓变=拆化学键吸收的热量-生成化学键放出的热量.1年前查看全部
- 在120℃、101kPa下,a mL由氢气、乙烯组成的混合气体在b mL氧气中充分燃烧后,恢复到原温
在120℃、101kPa下,a mL由氢气、乙烯组成的混合气体在b mL氧气中充分燃烧后,恢复到原温度和压强.已知b>3a,且燃烧后气体体积缩小了[b/16]mL,则乙烯的体积为( )
A. [b/16]mL
B. [b/8]mL
C. a-[b/8]mL
D. [a+b/8]mL hanxueyu1年前2
hanxueyu1年前2 -
 yf6000 共回答了25个问题
yf6000 共回答了25个问题 |采纳率92%解题思路:在120℃、101kPa下,水为气体,发生的反应方程式有:C2H4+3O2=2CO2+2H2O(g)、2H2+O2=2H2O(g),根据反应可知,b>3a,氢气和乙烯完全反应,然后利用差量法计算出混合气体中氢气的体积,最后计算出乙烯的体积.根据反应方程式C2H4+3O2=2CO2+2H2O(g)、2H2+O2=2H2O(g)可知,b>3a时,氧气过量,氢气与乙烯的混合气体充分燃烧生成二氧化碳和水蒸气,
在120℃、101kPa下,水为气体,则乙烯与氧气的反应中,反应前后气体体积不变,则气体体积缩小是由于氢气与氧气的反应引起的,设混合气体中氢气的体积为x,
则:2H2 +O2=2H2O(g) 缩小体积△V
2mL 1mL
x [b/16]mL
则:x=
b
16mL×2mL
1mL=[b/8]mL,
则混合气体中乙烯的体积为:amL-[b/8]mL=(a-[b/8])mL,
故选C.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查了有关混合物燃烧的计算,题目难度中等,注意掌握常见有机物燃烧的化学方程式,明确差量法在化学计算中的应用,正确分析燃烧后气体体积减少的原因是解答本题的关键.1年前查看全部
- (1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ.则表示甲烷燃烧热的热化学方程式为___
(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ.则表示甲烷燃烧热的热化学方程式为______.
(2)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ•mol-1):
根据键能数据计算以下反应的反应热△H:化学键 C-H C-F H-F F-F 键能 414 489 565 158
CH4(g)+4F2(g)=CF4(g)+4HF(g)△H=______.
(3)下列说法正确的是(填序号)______:
A.相同温度下,0.1mol•L-1NH4Cl溶液中NH4+的浓度比0.1mol•L-1氨水中NH4+的浓度大;
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气;
D.对于Al(OH)3(s)⇌Al(OH)3(aq)⇌Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
E.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的大. lengyueyw1年前1
lengyueyw1年前1 -
 围城外的男人26 共回答了15个问题
围城外的男人26 共回答了15个问题 |采纳率100%解题思路:(1)根据燃烧热的概念分析,燃烧热是强调是可燃物为1mol;
(2)根据化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差来判断;
(3)A、强电解质的电离程度大于弱电解质的电离程度;
B、根据氯化银沉淀溶解平衡原理来判断;
C、电解饱和食盐水阴极得到氢气和氢氧化钠;
D、根据溶解平衡和电离平衡的知识来回答;
E、化学反应会向着生成更难溶物质的方向进行.(1)1g甲烷燃烧生成CO2和液态水时放热55.6kJ,所以16g甲烷燃烧生成CO2和液态水时放热889.6kJ,所以甲烷燃烧热的热化学方程式为:CH4(g)+2O2 (g)═CO2 (g)+2H2O(l)△H=-889.6kJ/mol,故答案为:CH4(g)+2O2 (g)═CO2 (g)+2H2O(l)△H=-889.6kJ/mol;
(2)因化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差,化学反应中,旧化学键断裂吸收的能量为:414×4+158×4=2288KJ,新键生成释放的能量为:489×4+565×4=4216KJ,所以化学反应是放热反应,放出的热量为:4216KJ-2288KJ=1928KJ,即△H=-1928kJ/mol,
故答案为:-1928kJ/mol;
(3)A、氯化铵可以直接电离出铵根离子,氨水属于弱电解质,部分电离,电离出的铵根离子浓度小于氯化铵中的铵根浓度,故A正确;
B、盐酸的存在对氯化银的沉淀溶解平衡会起到抑制作用,用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小,故B正确;
C、电解饱和食盐水氢离子在阴极得到电子发生还原反应生成氢气,同时水的电离平衡正向进行氢氧根离子浓度增大生成氢氧化钠,故C错误;
D、对于Al(OH)3(s)⇌Al(OH)3(aq),是固体变为液体的过程,属于溶解平衡,Al(OH)3(aq)⇌Al3+(aq)+3OH-(aq),是电离平衡,故D正确;
E、Mg(OH)2的溶解度比MgCO3的小,沉淀会向着更难溶的方向进行,故E错误.
故选ABD.点评:
本题考点: 热化学方程式;化学反应中能量转化的原因;化学能与热能的应用;盐类水解的原理;离子浓度大小的比较.
考点点评: 本题目是一道综合知识的考查,考查学生电解质的电离、沉淀溶解平衡的移动、沉淀的转化等方面知识,难度不大.1年前查看全部
- (2012•长春一模)25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是△H=-393.5kJ/mol、△H=
(2012•长春一模)25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是△H=-393.5kJ/mol、△H=-285.8kJ/mol、△H=-890.3kJ/mol、△H=-2800kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+[1/2]O2(g)═CO(g)△H=-393.5 kJ/mol
B.2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol
D.[1/2]C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(g)△H=-1400 kJ/mol 有TMC-3的人1年前1
有TMC-3的人1年前1 -
 sev7n831021 共回答了9个问题
sev7n831021 共回答了9个问题 |采纳率77.8%解题思路:燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,依据概念分析判断.A、反应中生成的一氧化碳不是最稳定氧化物,故A错误;
B、氢气燃烧最稳定的产物是液态水,并且燃烧是放热反应,符合燃烧热的含义,故B正确;
C、甲烷燃烧生成物气体水不是稳定氧化物,故C错误;
D、燃烧生成物气体水不是稳定氧化物,不符合燃烧热的概念,故D错误;
故选:B.点评:
本题考点: 热化学方程式.
考点点评: 本题考查热化学方程式的书写,注意反应物、生成物的状态与反应热的关系是关键,难度不大.1年前查看全部
- 标况下1升某烃气体与适量O2恰好完全反应生成co2和H2o,在270摄氏度,101kpa下,混合气体体积为b升,当冷却到
标况下1升某烃气体与适量O2恰好完全反应生成co2和H2o,在270摄氏度,101kpa下,混合气体体积为b升,当冷却到标准状况时,气体体积变为a升,用a、b表示该烃分子式.写下思考过程,
 xubo6176091年前2
xubo6176091年前2 -
 碎晴_琉璃 共回答了9个问题
碎晴_琉璃 共回答了9个问题 |采纳率88.9%这个题要用到理想气体状态方程式,也就是说,温度和压强也要代入计算的!不是高中题吧?!
设分子式为CxHy,最后算出的结果大约是C(1000a)H(1000b-2000a)1年前查看全部
- 【极值法】120℃、101kPa下,a mL由CO、CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强
【极值法】120℃、101kPa下,a mL由CO、CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强.
120℃、101kPa下,a mL由CO、CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强.
② 若燃烧后气体体积缩小了a/4mL,则a与b关系的数学表示式是
请详解什么是极值法和如何利用它解题, 重大kk1年前1
重大kk1年前1 -
 星的履行 共回答了18个问题
星的履行 共回答了18个问题 |采纳率88.9%先假设混合气体全是CO,CO+1/2O2=CO2
1 1/2 1 1/2{缩小的体积】
a/2 a/4=b a/4
所以CO没烧完,O2用完了,故a/4=b,
同理假设混合气体全是CH4,CH4+2O2=CO2+2HO2{不影响体积】
1 2 1 2{缩小的体积】
a/8 a/4=b a/4
所以CH4没烧完,O2用完了,故a/4=b,1年前查看全部
- 已知25℃ 101kpa下 石墨 金刚石燃烧的热化学方程式 怎样①-②?麻烦进来
已知25℃ 101kpa下 石墨 金刚石燃烧的热化学方程式 怎样①-②?麻烦进来
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)=CO2(g);△H=-393.51kJ•mol-1 ①
C(金刚石)+O2(g)=CO2(g);△H=-395.41kJ•mol-1”,②
答案我都知道 就是不会怎么①-②
特别是焓变怎么减! 信言1年前1
信言1年前1 -
 爱你我已失去你 共回答了23个问题
爱你我已失去你 共回答了23个问题 |采纳率100%可以把=理解为等号,①-②可以按等号左边的物质相减等于等号右边的物质相减(类似于二元一次方程的计算)
C(石墨)+O2(g)-[C(金刚石)+O2(g)]=CO2(g)-CO2(g)
将负的移到另一边
C(石墨)=C(金刚石)
△H的计算就是①的△H-②的△H
△H=-393.51-(-395.41)=1.9kJ/mol
我是这么算的T_T1年前查看全部
- (2013•哈尔滨模拟)25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8k
(2013•哈尔滨模拟)25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+[1/2]O2(g)═CO(g)△H=-393.5kJ/mol
B.2H2(g)+O2(g)═2H2O(g)△H=+571.6kJ/mol
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/mol
D.[1/2]C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400kJ/mol 浪子无羽1年前1
浪子无羽1年前1 -
 yujun1978 共回答了16个问题
yujun1978 共回答了16个问题 |采纳率100%解题思路:燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,根据燃烧热的定义判断热化学方程式是否正确.A.C完全燃烧应生成CO2,生成CO,反应热小于393.5kJ/mol,故A错误;
B.H2完全燃烧生成的稳定的氧化物为液态水,故B错误;
C.CH4完全燃烧生成稳定的氧化物为CO2和液态水,故C错误;
D.1mol葡萄糖完全燃烧生成CO2和H2O(l),燃烧热为2800kJ/mol,则[1/2]mol葡萄糖完全燃烧放出1400kJ热量,故D正确.
故选D.点评:
本题考点: 热化学方程式.
考点点评: 本题考查热化学方程式,题目难度不大,本题注意把握燃烧热的概念,特别是水,稳定状态为液态.1年前查看全部
- 在25℃、101kPa下,已知:c(s)+1/2o2(g)=co(g)△h=-110.35kj.mol-1,
在25℃、101kPa下,已知:c(s)+1/2o2(g)=co(g)△h=-110.35kj.mol-1,
在25℃、101kPa下,已知:
c(s)+1/2o2(g)=co(g) △h=-110.35kj.mol-1,c(s)+1/2o2(g)=co2(g)△h=-282.57kj.mol-1
则c(s)的标准燃烧热△h=( )kj.mol-1 hasayxq1年前2
hasayxq1年前2 -
 纨绔谈歌 共回答了16个问题
纨绔谈歌 共回答了16个问题 |采纳率93.8%在25℃,101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.c(s)+1/2o2(g)=co2(g)△h=-282.57kj.mol-1为c(s)的标准燃烧热方程式
故△h=( -282.57 )kj.mol-11年前查看全部
- 25℃、101kPa下充分燃烧一定量丁烷气体放出的热量为xQ kJ,用5mol/L的KOH溶液100mL完全吸
25℃、101kPa下充分燃烧一定量丁烷气体放出的热量为xQ kJ,用5mol/L的KOH溶液100mL完全吸收生成的CO2,并与之生成正盐,则丁烷的燃烧热的数值是( )
A.16xQ
B.8xQ
C.4xQ
D.2xQ psdd9111年前1
psdd9111年前1 -
 Donnie99 共回答了24个问题
Donnie99 共回答了24个问题 |采纳率91.7%解题思路:燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,根据CO2与KOH的反应,计算出CO2的物质的量,进而计算出丁烷的物质的量,则可计算丁烷的燃烧热.n(KOH)=0.1L×5mol/L=0.5mol,则由CO2~2KOH可知,n(CO2)=0.25mol,
则n(C4H10)=[1/4]×n(CO2)=[1/4]×0.25mol=[1/16]mol,放出的热量为xQkJ,
所以1mol丁烷完全燃烧放出的热量为16xQkJ,
故选A.点评:
本题考点: 有关燃烧热的计算.
考点点评: 本题考查燃烧热的计算,题目难度不大,本题注意把握燃烧热的概念,根据生成二氧化碳的物质的量计算丁烷的物质的量是解答该题的关键.1年前查看全部
- 下列说法正确的是 ( ) A.在101kpa下,1mol物质完全燃烧的反应热叫做该物质的热值 B.盐桥通常用含CuCl
下列说法正确的是 ( )
A.在101kpa下,1mol物质完全燃烧的反应热叫做该物质的热值 B.盐桥通常用含CuCl 2 的饱和溶液的琼脂的离子移动来平衡溶液中的电荷 C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀  浣花溪3211年前1
浣花溪3211年前1 -
 jadesunny 共回答了25个问题
jadesunny 共回答了25个问题 |采纳率88%C
1千克(每立方米)某种固体(气体)燃料完全燃烧放出的热量称为该燃料的热值,A不正确。B不正确,盐桥中不一定是氯化铜溶液。D不正确,根据金属活泼性顺序可知Zn>Fe>Sn,所以镀层破损后,镀锌铁板比镀锡铁板更耐腐蚀。所以正确的答案选C。1年前查看全部
- 25℃、101kPa下:①2Na(s)+[1/2]O2(g)=Na2O(s)△H1=-414kJ/mol②2Na(s)+
25℃、101kPa下:
①2Na(s)+[1/2]O2(g)=Na2O(s)△H1=-414kJ/mol
②2Na(s)+O2(g)=Na2O2(s)△H2=-511kJ/mol
下列说法正确的是( )
A. ①和②生成等物质的量产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 25℃、101kPa 下,Na2O2(s)+2Na(s)═2Na2O(s)△H=-97kJ/mol
D. Na与足量O2反应生成Na2O2,随温度升高生成Na2O2的速率逐渐加快 bjvip1年前1
bjvip1年前1 -
 zxvpuoiausfdausf 共回答了11个问题
zxvpuoiausfdausf 共回答了11个问题 |采纳率81.8%解题思路:A、Na2O中阴阳离子个数之比为1:2,Na2O2中阴阳离子个数之比为1:2;
B、由钠原子的个数及钠元素的化合价分析转移的电子数;
C、利用已知的两个反应和盖斯定律来分析;
D、钠与氧气在加热时生成过氧化钠,温度越高,反应速率越大.A、在Na2O中阳离子是钠离子、阴离子是氧离子,Na2O2中阳离子是钠离子、阴离子是过氧根离子,因此阴、阳离子的个数比都是1:2,故A错误;
B、由钠原子守恒可知,①和②生成等物质的量的产物时,钠元素的化合价都是由0升高到+1价,则转移的电子数相同,故B错误;
C、热化学方程式25℃、101kPa下:
①2Na(s)+[1/2]O2(g)═Na2O(s)△H=-414kJ•mol-1,
②2Na(s)+O2(g)═Na2O2(s)△H=-511kJ•mol-1,
①×2-②可得:
Na2O2(s)+2Na(s)═2Na2O(s)△H=-317kJ•mol-1,
故C错误;
D、Na与足量O2反应生成Na2O2,随温度升高生成Na2O2的速率逐渐加快,故D正确;
故选:D.点评:
本题考点: 用盖斯定律进行有关反应热的计算;钠的化学性质.
考点点评: 本题是一综合题,考查化学键类型、氧化还原反应的计算、元素化合物知识、以及盖斯定律,考查了多个考点,设点全面,但难度适中,是一好题.1年前查看全部
- 25℃、101kPa下:①2Na(s)+[1/2]O2(g)=Na2O(s)△H1=-414kJ/mol②2Na(s)+
25℃、101kPa下:
①2Na(s)+[1/2]O2(g)=Na2O(s)△H1=-414kJ/mol
②2Na(s)+O2(g)=Na2O2(s)△H2=-511kJ/mol
下列说法正确的是( )
A.①和②生成等物质的量产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.25℃、101kPa 下,Na2O2(s)+2Na(s)═2Na2O(s)△H=-97kJ/mol
D.Na与足量O2反应生成Na2O2,随温度升高生成Na2O2的速率逐渐加快 guomonkey1年前1
guomonkey1年前1 -
 怡然夏天 共回答了16个问题
怡然夏天 共回答了16个问题 |采纳率87.5%解题思路:A、Na2O中阴阳离子个数之比为1:2,Na2O2中阴阳离子个数之比为1:2;
B、由钠原子的个数及钠元素的化合价分析转移的电子数;
C、利用已知的两个反应和盖斯定律来分析;
D、钠与氧气在加热时生成过氧化钠,温度越高,反应速率越大.A、在Na2O中阳离子是钠离子、阴离子是氧离子,Na2O2中阳离子是钠离子、阴离子是过氧根离子,因此阴、阳离子的个数比都是1:2,故A错误;
B、由钠原子守恒可知,①和②生成等物质的量的产物时,钠元素的化合价都是由0升高到+1价,则转移的电子数相同,故B错误;
C、热化学方程式25℃、101kPa下:
①2Na(s)+[1/2]O2(g)═Na2O(s)△H=-414kJ•mol-1,
②2Na(s)+O2(g)═Na2O2(s)△H=-511kJ•mol-1,
①×2-②可得:
Na2O2(s)+2Na(s)═2Na2O(s)△H=-317kJ•mol-1,
故C错误;
D、Na与足量O2反应生成Na2O2,随温度升高生成Na2O2的速率逐渐加快,故D正确;
故选:D.点评:
本题考点: 用盖斯定律进行有关反应热的计算;钠的化学性质.
考点点评: 本题是一综合题,考查化学键类型、氧化还原反应的计算、元素化合物知识、以及盖斯定律,考查了多个考点,设点全面,但难度适中,是一好题.1年前查看全部
- 80℃,101kPa下,用如图装置进行如下实验。A、C两筒内分别装有无色气体,它们可能是NH 3 、O 2 、N 2 、
80℃,101kPa下,用如图装置进行如下实验。A、C两筒内分别装有无色气体,它们可能是NH 3 、O 2 、N 2 、H 2 S、NO、CO 2 等气体,B筒内装有Na 2 O 2 固体,推动A的活塞,A筒内气体缓缓地全部通过B后进入C筒,C筒内气体由无色变为红棕色,但其体积换算成同温同压下却并未变化。(不考虑2NO 2 ═N 2 O 4 )
(1)C中发生反应的化学方程式是______.已知原C中的气体是单一气体,它是______,理由是______.
(2)将反应后C筒内气体用水充分吸收,在同温同压下,气体体积减少一半,则与水反应前C中的气体是______,理由是______.
(3)若实验开始前A、C中气体体积(换算成标况)分别为1.40L和2.24L,且A中的气体经过B管后,B管增重了1.40g。经计算和推理可判定A中的气体是______,其质量为______g.(不必写出计算和推理过程)
 汕头101年前1
汕头101年前1 -
 笨小甲鸟 共回答了12个问题
笨小甲鸟 共回答了12个问题 |采纳率91.7%(1)C筒内气体由无色变为红棕色,一氧化氮为无色气体,很容易和空气中的氧气化合,生成红棕色的二氧化氮气体;推动A的活塞,A筒内气体缓缓地全部通过B后进入C筒,C筒内气体由无色变为红棕色,但其体积换算成同温同压下却并未变化,根据反应2NO+O 2 =2NO 2 ,一氧化氮转化为二氧化氮体积不变,只发生了颜色变化,
故答案为:2NO+O 2 =2NO 2 ;NO;NO与B管进来的O 2 反应生成NO 2 的体积与原NO体积相同,只发生了颜色变化;
(2)将反应后C筒内气体用水充分吸收,在同温同压下,气体体积减少一半,根据反应3NO 2 +2H 2 O=2HNO 3 +NO,可知假设全部为NO 2 ,则剩余气体的体积为原来的1/3,不符合题意,假设全部为NO,一氧化氮与水不反应,则剩余气体的体积与原来相等,所以,C中气体为NO和NO 2 混合气体,设原混合气体的体积为V,NO 2 的体积为x,根据反应3NO 2 +2H 2 O=2HNO 3 +NO,生成的一氧化氮为
1
3 x,反应后的气体体积为V-X+
1
3 x=
1
2 V,X=
3
4 V,则NO 2 与NO的混合气体体积比为:
3
4 V:
1
4 V=3:1,
故答案为:NO 2 和NO;若C管中只有NO 2 ,则剩余气体的体积为原来的1/3,若只有NO,则剩余气体的体积与原来相等,因而只能是NO 2 与NO的混合气体(3:1);
(3)根据2CO 2 +2Na 2 O 2 =2Na 2 CO 3 +O 2 △m为2Na 2 CO 3 -2Na 2 O 2 =2CO,可知,反应前后,固体质量增加量为CO的质量,B管增重的质量为与CO 2 等物质的量的CO的质量,因此n(CO 2 )=
1.40g
28g/mol =0.05 mol,而C筒中气体体积无变化,则A中另一种气体为O 2 ,n(O 2 )=
1.40L
22.4L/mol -0.05mol=0.0125mol,故A中气体的质量为0.05mol×44g/mol+0.0125mol×32g/mol=2.6g,
故答案为:CO 2 和O 2 ;2.6.1年前查看全部
- 在25℃、101kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为:
在25℃、101kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为:
P4(s)+5O2(g)=P4O10(s);△H=-3093.2kJ•mol-1
4P(s)+5O2(g)=P4O10(s);△H=-2954.0kJ•mol-1
由此判断下列说法正确的是( )
A. 红磷的燃烧热为2954.0 kJ•mol-1
B. 已知白磷分子为正四面体结构,则P-P键之间的夹角为109°28′
C. 由红磷转化为白磷是吸热反应,等质量时白磷能量比红磷高
D. 等质量的白磷和红磷在相同条件下分别与足量氯气反应,设产物只有PCl5,则红磷放出的热量更多 雪白的羽毛61年前1
雪白的羽毛61年前1 -
 sibyl画沙 共回答了22个问题
sibyl画沙 共回答了22个问题 |采纳率86.4%解题思路:A、根据燃烧热的概念分析;
B、白磷分子中P-P键之间的夹角为60°;
C、等质量时白磷能量比红磷高;
D、等质量时白磷能量比红磷高,所以白磷反应放出的热量多.A、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,红磷的燃烧热为[1/4]×2954.0 kJ•mol-1=738.5KJ,故A错误;
B、已知白磷分子为正四面体结构,白磷分子中P-P键之间的夹角为60°,故B错误;
C、已知:P4(s)+5O2(g)=P4O10(s);△H=-3093.2kJ/mol…①
4P(s)+5O2(g)=P4O10(s);△H=-2954.0kJ/mol…②
根据盖斯定律:②-①可得:4P(s)═P4(s)△H=(-2954.0kJ/mol)-(-3093.2kJ/mol)=+138.82kJ/mol,说明红磷转化为白磷是吸热反应,等质量的红磷能量比白磷低,故C正确;
D、等质量时白磷能量比红磷高,所以等质量的白磷和红磷在相同条件下分别与足量氯气反应,设产物只有PCl5,则白磷放出的热量更多,故D错误;
故选C.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查燃烧热的理解和应用,物质稳定性与能量的关系,盖斯定律的应用,题目难度中等,做题时注意要准确理解概念.1年前查看全部
- (1)在25℃、101kPa下,1g甲烷燃烧生成CO 2 和液态水时放热55.6kJ.则表示甲烷燃烧热的热化学方程式为_
(1)在25℃、101kPa下,1g甲烷燃烧生成CO 2 和液态水时放热55.6kJ.则表示甲烷燃烧热的热化学方程式为______.
(2)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ•mol -1 ):根据键能数据计算以下反应的反应热△H:
CH 4 (g)+4F 2 (g)=CF 4 (g)+4HF(g)△H=______.
(3)发射卫星用N 2 H 4 气体为燃料,NO 2 气体为氧化剂,两者反应生成N 2 和水蒸气,已知:化学键 C-H C-F H-F F-F 键能 414 489 565 158
N 2 (g)+2O 2 (g)=2NO 2 (g)△H 1 =+67.7kJ•mol -1 ;
2H 2 (g)+O 2 (g)=2H 2 O(g)△H 2 =-484kJ•mol -1 ;
N 2 H 4 (g)+O 2 (g)=N 2 (g)+2H 2 O(g)△H 3 =-534kJ•mol -1 ;
H 2 O(1)=H 2 O(g)△H 5 =+44.0kJ•mol -1 .
写出N 2 H 4 气体与NO 2 气体反应生成氮气和液态水的热化学方程式:______
(4)下列说法正确的是(填序号)______:
A.同温度下,0.1mol•L -1 NH 4 Cl溶液中NH 4 + 的浓度比0.1mol•L -1 氨水中NH 4 + 的浓度大;
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C.对于Al(OH) 3 (s)⇌Al(OH) 3 (aq)⇌Al 3+ (aq)+3OH - (aq),前段为溶解平衡,后段是电离平衡;
D.除去溶液中的Mg 2+ ,用OH - 沉淀Mg 2+ 比用CO 3 2- 效果好,说明Mg(OH) 2 的溶解度比MgCO 3 的大. changyu9301年前1
changyu9301年前1 -
 sscn 共回答了18个问题
sscn 共回答了18个问题 |采纳率77.8%(1)1g甲烷燃烧生成CO 2 和液态水时放热55.6kJ,所以16g甲烷燃烧生成CO 2 和液态水时放热889.6kJ,所以甲烷燃烧热的热化学方程式为:CH 4 (g)+2O 2 (g)═CO 2 (g)+2H 2 O(l)△H=-889.6kJ/mol,故答案为:CH 4 (g)+2O 2 (g)═CO 2 (g)+2H 2 O(l)△H=-889.6kJ/mol;
(2)因化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差,化学反应中,旧化学键断裂吸收的能量为:414×4+158×4=2288KJ,新键生成释放的能量为:489×4+565×4=4216KJ,所以化学反应是放热反应,放出的热量为:4216KJ-2288KJ=1928KJ,即△H=-1928kJ/mol,
故答案为:-1928kJ/mol;
(3)已知:①N 2 (g)+2O 2 (g)=2NO 2 (g)△H 1 =+67.7kJ•mol -1 ;
②2H 2 (g)+O 2 (g)=2H 2 O(g)△H 2 =-484kJ•mol -1 ;
③N 2 H 4 (g)+O 2 (g)=N 2 (g)+2H 2 O(g)△H 3 =-534kJ•mol -1 ;
④H 2 O(1)=H 2 O(g)△H 5 =+44.0kJ•mol -1 .
N 2 H 4 气体与NO 2 气体反应生成氮气和液态水的化学方程式2N 2 H 4 (g)+2NO 2 (g)=3N 2 (g)+4H 2 O(g)等于③×2-①,所以反应的△H=2×(-534kJ•mol -1 )-67.7kJ•mol -1 =-1311.7KJ/mol=-1135.7KJ/mol,故答案为:2N 2 H 4 (g)+2NO 2 (g)=3N 2 (g)+4H 2 O(l)△H=-1135.7KJ/mol;
(4)A、氯化铵可以直接电离出铵根离子,氨水属于弱电解质,部分电离,电离出的铵根离子浓度小于氯化铵中的铵根浓度,故A正确;
B、盐酸的存在对氯化银的沉淀溶解平衡会起到抑制作用,用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小,故B正确;
C、对于Al(OH) 3 (s)⇌Al(OH) 3 (aq),是固体变为液体的过程,属于溶解平衡,Al(OH) 3 (aq)⇌Al 3+ (aq)+3OH - (aq),是电离平衡,故C正确;
D、Mg(OH) 2 的溶解度比MgCO 3 的小,沉淀会向着更难溶的方向进行,故D错误.
故选ABC.1年前查看全部
- 已知25℃、101kPa下,稀的强酸与强碱溶液反应的中和热为57.3kJ/mol.
已知25℃、101kPa下,稀的强酸与强碱溶液反应的中和热为57.3kJ/mol.
(1)写出表示硫酸与烧碱溶液反应的中和热的热化学方程式:[1/2]H2SO4(aq)+NaOH(aq)=[1/2]Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol[1/2]H2SO4(aq)+NaOH(aq)=[1/2]Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)某实验小组用 0.25mol/L的稀硫酸溶液与 0.55mol/L的稀烧碱溶液进行中和热的测定.
I.配制0.25mol/LH2SO4溶液
①若实验中大约要使用245ml 0.25mol/L H2SO4溶液,需要用量筒量取密度为1.8g/cm3,溶质质量分数为98%的浓硫酸______mL
②从下图中选择配制0.25mol/L H2SO4溶液所需要的仪器(填字母)______
II.实验小组用稀硫酸与稀烧碱溶液测定中和热装置如图.名称 托盘天平(带砝码) 小烧杯 容量瓶 玻璃棒 药匙 量筒 胶头滴管 仪器 




序号 a b c d e f g 
①该装置中仪器k的名称是______;装置中有一处错误是______,如果用
该错误装置测定,测得中和热数值会______(填“偏高”“偏低”“无影响”)
②该小组同学及时发现问题并解决后,决定选用50mL 0.25mol/L的稀
硫酸与50mL 0.55mol/L的稀烧碱溶液进行试验,实验中测得△t=3.2℃,
设反应前硫酸与烧碱溶液的密度均为1g/cm3,中和后溶液的比热容为4.18J/(g•℃).那么该小组测定中和热:△H=______.
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)______
a.量取H2SO4溶液和NaOH溶液前用待测液对量筒进行了润洗.
b.测量H2SO4溶液温度后,温度计没有用水冲洗干净直接测NaOH溶液的温度.
c.分多次把NaOH溶液倒入盛有H2SO4溶液的小烧杯中.
d.量取H2SO4溶液时仰视读数.
e.揭开硬纸板用玻璃棒搅拌. 爱在江湖梦冷清1年前1
爱在江湖梦冷清1年前1 -
 kalen813 共回答了14个问题
kalen813 共回答了14个问题 |采纳率85.7%解题思路:(1)依据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;(2)Ⅰ①浓H2SO4的物质的量浓度C=,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积; ②实验室配制溶液操作步骤分别是计算、量取、溶解、移液、洗涤、定容、摇匀,根据各操作所需要使用的仪器;
Ⅱ①根据所给的装置图,可知k的名称和缺少硬纸板.大烧杯上如不盖硬纸板,会使一部分热量散失;
②根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
③a用量筒量取溶液前需要润洗,否则造成稀释.
b会导致实验测得中和热的数值偏小.c不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中.d量取H2SO4溶液的体积时仰视读数,会导致所量的H2SO4体积偏大,放出的热量偏高.e会造成热量的散失,可以通过环形玻璃棒慢慢搅拌,(1)在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热.定义要点:以生成1 mol水为基准依据中和热概念分析,稀硫酸与稀烧碱溶液中和热的热化学方程式为:[1/2] H2SO4(aq)+NaOH(aq)=[1/2]Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:[1/2] H2SO4(aq)+NaOH(aq)=[1/2] Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)Ⅰ①质量分数为98%,密度为1.8g/cm3的浓硫酸,其物质的量浓度c=[1000×1.8×98%/98]mol/L=18.0mol/L
设需要上述浓硫酸的体积为VmL,根据稀释定律,则:18.0 mol/L×VmL=0.25 mol/L×245mL,解得V=3.5mL.故答案为:3.5mL
②验室配制溶液操作步骤分别是计算、量取、溶解、移液、洗涤、定容、摇匀,根据各操作所需要使用的仪器有bcdfg,故答案为:bcdfg.
Ⅱ①根据所给的装置图,可知k的名称为:环形玻璃搅拌棒;
实验装置保温、隔热效果必须好,否则影响实验结果,所以装置缺少硬纸板,故答案为:未用硬纸板(或塑料板)盖住烧杯.
大烧杯上如不盖硬纸板,会使一部分热量散失,导致测得中和热数值会偏低.故答案为:偏低.
②0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL进行中和反应生成水的物质的量为0.05L×0.50mol=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值△T为3.2℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.2℃=1337.6J,即1.337kJ,所以实验测得的中和热△H=-[1.337KJ/0.025mol]=-53.5 kJ/mol,
故答案为:-53.5 kJ/mol.
③a、用量筒量取溶液前需要润洗,否则对所量取的溶液造成稀释.导致中和热有误差,故a不符合题意.
b、测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小,故b符合题意.
c、尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,否则造成热量的散失,导致中和热有误差,故c符合题意.
d、量取H2SO4溶液的体积时仰视读数,会导致所量的H2SO4体积偏大,放出的热量偏高,中和热的数值偏大,故d符合题意.
e、揭开硬纸片用玻璃棒搅拌,会导致热量散失,影响测定结果,故e符合题意.
故答案为bcde.点评:
本题考点: 热化学方程式;中和热的测定.
考点点评: 本题综合考查了中和热的测定、误差分析以及中和热的热化学方程式的书写,综合性较强,难度较大.1年前查看全部
- 在25℃,101KPa下,1克的甲醇燃烧生成二氧化碳和液态水时放热22.68KJ.甲醇燃烧热化学方程式.
 lovejessie1年前5
lovejessie1年前5 -
 willhard 共回答了21个问题
willhard 共回答了21个问题 |采纳率90.5%2CH3OH+3O2=2CO2+4H2O(=上写点燃)2倍的甲醇与3倍的氧气反应生成2倍的二氧化碳和4倍的水1年前查看全部
- 下列有关概念的说法中正确的是 A.在101KPa下,1mol物质完全燃烧的反应热叫做该物质的热值 B.在化学反应中,能量
下列有关概念的说法中正确的是
A.在101KPa下,1mol物质完全燃烧的反应热叫做该物质的热值 B.在化学反应中,能量较高、能发生碰撞的分子称为活化分子 C.具有相同质子数不同中子数的核素互称同素异形体 D.既可以与酸反应又可以与碱反应生成盐和水的氧化物称为两性氧化物  odjg1年前1
odjg1年前1 -
 menglong37 共回答了16个问题
menglong37 共回答了16个问题 |采纳率100%D
1年前查看全部
- (1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方
(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:______.
(2)2Zn(s)+O2(g)=2ZnO(s)△H1=-702kJ/mol
2Hg(l)+O2(g)=2HgO(s)△H2=-182kJ/mol
由此可知ZnO(s)+Hg(l)=Zn(s)+HgO(s)△H3=______.
(3)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:______. mt78945612301年前1
mt78945612301年前1 -
 uyyer 共回答了26个问题
uyyer 共回答了26个问题 |采纳率92.3%解题思路:(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,依据概念书写热化学方程式,标注物质聚集状态和对应焓变;
(2)运用盖斯定律解答;
(3)依据图象计算反应焓变,结合热化学方程式书写方法写出.(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,依据概念书写热化学方程式,标注物质聚集状态和对应焓变,在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,1mol甲烷燃烧生成稳定氧化物放热880KJ,表示甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880 kJ/mol;
(2)已知:①2Zn(s)+O2(g)=2ZnO(s)△H1=-702kJ/mol
②2Hg(l)+O2(g)=2HgO(s)△H2=-182kJ/mol
据盖斯定律,(②-①)÷2得:ZnO(s)+Hg(l)=Zn(s)+HgO(s)△H3=+260 kJ/mol,故答案为:+260 kJ/mol;
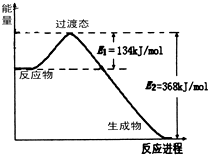
(3)依据图象分析反应物能量高于生成物,反应是放热反应,反应焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,写出热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234 kJ/mol,
故答案为:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234 kJ/mol.点评:
本题考点: 反应热和焓变;热化学方程式;用盖斯定律进行有关反应热的计算.
考点点评: 本题考查了化学反应能量变化,燃烧热概念分析应用,盖斯定律计算式关键,题目较简单.1年前查看全部
- 按要求写出下列方程式(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热
按要求写出下列方程式
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式是:CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-725.8kJ•mol-1CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-725.8kJ•mol-1
(2)已知在25℃、101kPa时,CO的燃烧热为283kJ/mol,相同条件下,若2molCH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.3倍.
则CH4完全燃烧反应的热化学方程式是:______
(3)Na2S在水溶液中水解的离子方程式:______
(4)用电子式表示Na2S的形成过程:______. 上池之水1年前1
上池之水1年前1 -
 小白鹰 共回答了27个问题
小白鹰 共回答了27个问题 |采纳率96.3%解题思路:(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成CO2和液态水时放热22.68kJ×32=725.76kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇生成二氧化碳和液态水放热725.8KJ;
(2)根据CO的燃烧热计算,2molCH4完全燃烧生成液态水,所放出的热量,再根据热化学方程式的书写原则进行书写;
(3)Na2S是二元弱酸氢硫酸的盐,水解分步完成,据此写出电离方程式;
(4)硫化钠为离子化合物,根据离子化合物的电子式表示方法写出Na2S的形成过程.(1)1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ;燃烧热的热化学方程式为:CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ•mol-1,
故答案为:CH3OH(l)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ•mol-1;
(2)CO的燃烧热为283kJ/mol.相同条件下,2molCH4完全燃烧生成液态水,所放出的热量为283kJ×6.3=1782.9kJ,故甲烷完全燃烧生成液态水的热化学方程式为:CH4(g)+2O2 (g)=CO2(g)+2H2O(1);△H=-891.45kJ/mol,
故答案为:CH4(g)+2O2 (g)=CO2(g)+2H2O(1);△H=-891.45kJ/mol;
(3)Na2S是二元弱酸氢硫酸的盐,水解离子方程式为:S2-+H2O⇌HS-+OH-、HS-+H2O⇌H2S+OH-;
故答案为:S2-+H2O⇌HS-+OH-、HS-+H2O⇌H2S+OH-;
(4)硫化钠为离子化合物,用电子式表示Na2S的形成过程为: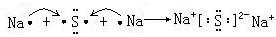
故答案为: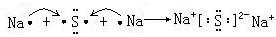 .
.点评:
本题考点: 热化学方程式;用电子式表示简单的离子化合物和共价化合物的形成;盐类水解的原理.
考点点评: 本题考查了热化学方程式、水解方程式的书写、用电子式表示化合物的形成过程,题目难度中等,注意掌握热化学方程式、水解方程式,能够用电子式表示常见化合物的形成过程.1年前查看全部
- 已知:①101kPa下,2C(石墨,s)+O2(g)=2CO(g)△H=-221kJ•mol-1②C(石墨,s)=C(金
已知:
①101kPa下,2C(石墨,s)+O2(g)=2CO(g)△H=-221kJ•mol-1
②C(石墨,s)=C(金刚石,s)△H=-1.91kJ•mol-1
③在稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,下列有关说法正确的是( )
A.金刚石比石墨稳定
B.石墨的热值比9.2kJ•g-1大
C.所有强酸与强碱反应生成1molH2O时放出的热量都为57.3kJ
D.1mol醋酸与1mol氢氧化钠在稀溶液中完全反应时,放出的热量大于57.3kJ lixuchao5201年前1
lixuchao5201年前1 -
 zss925 共回答了22个问题
zss925 共回答了22个问题 |采纳率81.8%解题思路:A、依据热化学方程式②分析,能量越高越活泼;
B、依据热化学方程式①计算热值,结合石墨完全燃烧放出的热量分析判断;
C、强酸强碱反应生成沉淀和水的中和反应伴随沉淀热的生成分析;
D、醋酸是弱酸存在电离平衡,电离过程是吸热过程;A、依据热化学方程式②分析,C(石墨,s)=C(金刚石,s)△H=+1.91kJ•mol-1,石墨能量低于金刚石,能量越高越活泼,石墨比金刚石稳定,故A错误;
B、依据热化学方程式①计算热值,2C(石墨,s)+O2(g)=2CO(g)△H=-221kJ•mol-1,换算为单位质量碳反应放热=[221KJ/24g]=9.2KJ,所以石墨完全燃烧放出的热量应大于9.2kJ•g-1,故B正确;
C、强酸强碱反应生成沉淀和水的中和反应伴随沉淀热的生成,如硫酸和氢氧化钡酸碱中和反应,生成1molH2O时放出的热量都大于57.3kJ,故C错误;
D、醋酸是弱酸存在电离平衡,电离过程是吸热过程,1mol醋酸与1mol氢氧化钠在稀溶液中完全反应时,放出的热量小于57.3kJ,故D错误;
故选B.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了热化学方程式的分析应用,能量高低与化合物我的心的判断方法,注意中和热概念的分析应用,题目难度中等.1年前查看全部
- 按要求完成下列问题:(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22
 按要求完成下列问题:
按要求完成下列问题:
(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1CH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1;将该反应设计成碱性燃料电池,写出该电池的负极电极反应方程式______.
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ•mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=-247.4kJ•mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为______.
(3)已知白磷、红磷燃烧的热化学方程式分别为:
P4(s,白磷)+5O2=P4O10(s);△H=-2986kJ•mol-1
4P(s,红磷)+5O2=P4O10(s);△H=-2956kJ•mol-1
则白磷比红磷______(填“稳定”或“不稳定”)
(4)已知一定条件下A2与B2自发反应生成AB3,则反应A2(g)+3B2(g)=2AB3(g) 的△S=______0,△H______0 (填“<”、“>”、“=”)
(5)如图为电解精炼银的示意图,______(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为______. nlfzzj1年前1
nlfzzj1年前1 -
 米米_goo 共回答了20个问题
米米_goo 共回答了20个问题 |采纳率90%解题思路:(1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,题干所给量计算32g甲醇燃烧生成二氧化碳和液态水放热,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;碱性燃料电池中,甲醇在负极失电子生成碳酸根离子;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)根据物质的总能量与反应热的关系判断,能量越高物质越不稳定;
(4)反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行;据此判断;
(5)电解精炼时,含有杂质的金属作阳极;若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮.(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为725.76KJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1,碱性燃料电池中,甲醇在负极失电子生成碳酸根离子,其电极方程式为CH3OH-6e-+8OH-═CO32-+6H2O;
故答案为:CH3OH(l)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1;CH3OH-6e-+8OH-═CO32-+6H2O;
(2)①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ•mol-1
①×2-②得到CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=206.2×2-(-247.4)=+659.8kJ•mol-1 ;
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+659.8kJ•mol-1;
(3)已知白磷、红磷燃烧的热化学方程式分别为:
P4(s,白磷)+5O2=P4O10(s);△H=-2986kJ•mol-1
4P(s,红磷)+5O2=P4O10(s);△H=-2956kJ•mol-1
等质量的白磷和红磷完全燃烧,白磷放出的热量多,相同的状况下,白磷的能量比红磷高,则白磷比红磷不稳定,
故答案为:不稳定;
(4)已知一定条件下A2与B2自发反应生成AB3,则反应A2(g)+3B2(g)=2AB3(g),该反应正方向为物质的量减小的方向,则△S<0,一定条件下能自发进行,则
△H-T△S<0,所以<0,
故答案为:<;<;
(5)电解精炼时,粗银作阳极,纯银作阴极,所以a极为含有杂质的粗银,若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮,电极反应式为:2H++NO3-+e-=NO2↑+H2O,
故答案为:a;2H++NO3-+e-=NO2↑+H2O.点评:
本题考点: 原电池和电解池的工作原理;热化学方程式;电解原理.
考点点评: 本题考查了化学反应与能量、盖斯定律的应用、燃料电池电极方程式的书写、反应自发性的判断、电解原理的应用等,题目涉及的知识点较多,题目难度中等.1年前查看全部
- 在 25°C 101kpa下,Na2O2+2Na=2Na2O.H=-317kj/mol 是不是说明Na2O比Na2O2更
在 25°C 101kpa下,Na2O2+2Na=2Na2O.H=-317kj/mol 是不是说明Na2O比Na2O2更加稳定啊
如果不是那是为什么 妖精or妖怪1年前1
妖精or妖怪1年前1 -
 tyhw 共回答了22个问题
tyhw 共回答了22个问题 |采纳率95.5%不能,稳定性不靠这个判断,可以根据这两个物质的键能判断.这个也可以举反例,Na2O加热变成Na2O2,所以后者更稳定1年前查看全部
- 在120°C,101KPa下,将aLH2与O2的混合气体点燃后变为bL,求原混合气体中H2与O2各多少升?
 noct1年前2
noct1年前2 -
 yanyan_yu 共回答了15个问题
yanyan_yu 共回答了15个问题 |采纳率80%设O2有X升,最后有多的气体肯定是多余的H2,所以反应的H2是2X,2X+X+b=a 所以O2就是(a-b)/3 H2就是a-x=(2a+b)/31年前查看全部
- (1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.7kJ,则该反应的热化学方程式应为____
(1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.7kJ,则该反应的热化学方程式应为______.
(2)由氢气和氧气反应生成1mol液态水时放热285.8kJ,写出该反应的热化学方程式H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ/molH2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ/mol.若1g水蒸气转化成液态水放热2.444kJ,则反应2H2(g)+O2(g)═2H2O(g)的△H=______. sqq2581年前1
sqq2581年前1 -
 没落青鸟 共回答了13个问题
没落青鸟 共回答了13个问题 |采纳率84.6%解题思路:(1)由1gCH3OH燃烧放热22.7kJ,则2molCH3OH燃烧放热22.7×32×2=1452.8kJ,并在热化学方程式中标明物质的状态;
(2)由氢气和氧气反应生成1mol液态水时放热285.8kJ,则①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ/mol,
1g水蒸气转化成液态水放热2.444kJ,则②H2O(g)=H2O(l)△H=-43.992kJ/mol,
由盖斯定律可知,①×2-②×2得到反应2H2(g)+O2(g)═2H2O(g),以此来解答.(1)由1gCH3OH燃烧放热22.7kJ,则2molCH3OH燃烧放热22.7×32×2=1452.8kJ,则该燃烧反应的热化学方程式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol,
故答案为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol;
(2)由氢气和氧气反应生成1mol液态水时放热285.8kJ,则①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ/mol,
1g水蒸气转化成液态水放热2.444kJ,则②H2O(g)=H2O(l)△H=-43.992kJ/mol,
由盖斯定律可知,①×2-②×2得到反应2H2(g)+O2(g)═2H2O(g),
则△H=(-285.8kJ/mol)×2-(-43.992kJ/mol)×2=-483.6kJ/mol,
故答案为:H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ/mol;-483.6kJ/mol.点评:
本题考点: 热化学方程式;有关反应热的计算.
考点点评: 本题考查热化学方程式的书写.热化学方程式是表示化学反应与反应热关系的方程式.书写和应用热化学方程式时必须注意以下几点:
①明确写出反应的计量方程式,各物质化学式前的化学计量系数可以是整数,也可以是分数;
②各物质化学式右侧用圆括弧( )表明物质的聚集状态.可以用g、l、s分别代表气态、液态、固态.固体有不同晶态时,还需将晶态注明,例如S(斜方),S(单斜),C(石墨),C(金刚石)等.溶液中的反应物质,则须注明其浓度,以aq代表水溶液,(aq) 代表无限稀释水溶液;
③反应热与反应方程式相互对应.若反应式的书写形式不同,则相应的化学计量系数不同,故反应热亦不同;
④热化学方程式必须标明反应的浓度、温度和压力等条件,若在常温常压时可省略.1年前查看全部
- 设N A 表示阿伏伽德罗常数,下列说法正确的是( ) A.在25℃、101kPa下,11.2L氧气所含的原子数为N A
设N A 表示阿伏伽德罗常数,下列说法正确的是( ) A.在25℃、101kPa下,11.2L氧气所含的原子数为N A B.0.5molNa与足量水发生反应转移的电子数为N A C.20g重水(D 2 O)所含的电子数为10N A D.在标准状况下,5.6L的CCl 4 中所含的氯原子总数为N A  zlh01221年前1
zlh01221年前1 -
 上古兵 共回答了20个问题
上古兵 共回答了20个问题 |采纳率95%A、不是标准状况,不能使用气体摩尔体积v m =22.4L/mol,故A错误.
B、Na与水发生反应生成钠离子,一个钠原子失去一个电子生成钠离子,所以转移的电子数与钠原子数相等,为0.5N A ,故B错误.
C、n(D 2 O)=
m (D 2 O)
M (D 2 O) =
20g
20g/mol =1mol,20g重水(D 2 O)所含的电子数为N(电子数)=)=10n(D 2 O)N A =10N A ,故C错误.
D、标况下,CCl 4 是液体,气体摩尔体积v m =22.4L/mol不适用于该物质,所以5.6L的CCl 4 中所含的氯原子总数不是N A ,故D错误.
故选C.1年前查看全部
- 25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( ) A.2
25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( ) A.2H 2 (g)+O 2 (g)═2H 2 O(1)△H=-285.8kJ/mol B.2H 2 (g)+O 2 (g)═2H 2 O(1)△H=+571.6kJ/mol C.2H 2 (g)+O 2 (g)═2H 2 O(g)△H=-571.6kJ/mol D.H 2 (g)+
O 2 (g)═H 2 O(1)△H=-285.8kJ/mol1 2  雨后白合1年前1
雨后白合1年前1 -
 wgh1983 共回答了28个问题
wgh1983 共回答了28个问题 |采纳率82.1%A、因4g氢气燃烧生成液态水,放出热量571.6kJ,不是285.8kJ,故A错误;
B、因4g氢气燃烧生成液态水,放出热量571.6kJ,放热时焓变值为负值,故B错误;
C、因4g氢气燃烧生成液态水,不是气态水,放出热量571.6kJ,故C错误;
D、因2g氢气燃烧生成液态水,放出285.8kJ热量,放热时焓变值为负值,故D正确;
故选:D.1年前查看全部
大家在问
- 1after reading the newspaper ,the old man found there was not
- 2由溴乙烷制取乙二醇,依次发生的反应类型是什么
- 3-jane,what dont this word mean?
- 4把重为5N,体积为600立方厘米的物体投入水中,若不计水的阻力,当物体静止时,物体受到的浮力为5N
- 5氢气球和氧气球的体积相等,哪个受到的浮力大
- 6— Do you have any idea why the bus-drivers are on strike?
- 7期待大神相助.
- 8see you off
- 9当气温达到35度对弯沉的影响大么?
- 10若-abc大于0,b、c异号,则a大于还是小于0
- 1145.18最大公因数
- 12What is this A.it is a ''Z '' B.it is a ''S ''
- 13英文翻译 加班时间从17点半到19点改为17点到18点半
- 14下列句子横线处,填入词语最恰当的一组是 [ ] ①汽车朝我来时的方向驰着
- 15150道一元一次不等式组计算题
