氯化钡溶液经蒸发浓缩 冷却结晶 过滤洗涤,再经真空干燥可以得到Bacl2 2H20
 kabbabc2022-10-04 11:39:542条回答
kabbabc2022-10-04 11:39:542条回答我想问的是为什么用冷却结晶不用蒸发结晶?
冷却结晶前为什么要蒸发浓缩?

已提交,审核后显示!提交回复
共2条回复
 仰kk人 共回答了22个问题
仰kk人 共回答了22个问题 |采纳率95.5%- 蒸发结晶的话就没有结晶水或者结晶水不完全.一般含有结晶水的晶体都是先浓缩然后冷却结晶这样能够保证结晶水的完整.
蒸发浓缩的目的就是让溶液过饱和. - 1年前
 安会 共回答了67个问题
安会 共回答了67个问题 |采纳率- 蒸发结晶的话就没有结晶水或者结晶水不完全。一般含有结晶水的晶体都是先浓缩然后冷却结晶这样能够保证结晶水的完整。
蒸发浓缩的目的就是让溶液过饱和。
- 1年前
相关推荐
- 将碳酸钠和氯化钠的固体混合物18.9g,完全溶于100g水中,向其中加入100.8g氯化钡溶液恰好完全反应,过滤,得沉淀
将碳酸钠和氯化钠的固体混合物18.9g,完全溶于100g水中,向其中加入100.8g氯化钡溶液恰好完全反应,过滤,得沉淀的质量为19.7g.求反应后所得溶液中溶质的质量分数.
 kly91年前1
kly91年前1 -
 cc三 共回答了12个问题
cc三 共回答了12个问题 |采纳率91.7%解题思路:向碳酸钠和氯化钠组成的混合溶液中加入氯化钡溶液,碳酸钠与氯化钡发生反应生成碳酸钡沉淀和氯化钠,而混合溶液中的氯化钠不与氯化钡反应;至恰好完全反应后,所得溶液为氯化钠溶液,其溶质氯化钠由两部分组成:一部分为原混合物质中的氯化钠,另一部分则是反应生成的氯化钠;
综上所述,所得溶液中溶质质量分数,则是原混合物中氯化钠与生成氯化钠质量总和与所得溶液的质量比.设固体混合物中Na2CO3的质量为x,生成的NaCl质量为y
Na2CO3+BaCl2═BaCO3↓+2NaCl
106 197 117
X 19.7 y
[106/x]=[197/19.7]=[117/y]
解得x=10.6g y=11.7g
反应后溶液中NaCl的质量分数为:
[11.7g+18.9g−10.6g/100.8g+100g+18.9g−19.7g]×100%=10%
答:反应后所得溶液中溶质的质量分数为10%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 利用质量守恒定律,可以很方便地解决反应后所得溶液的问题:反应后溶液质量=固体混合物质量+溶解所加水的质量+加入氯化钡溶液的质量-生成的沉淀质量.1年前查看全部
- 今天在课本上看到,向某溶液中滴加氯化钡溶液,若有白色沉淀生成,再滴加稀盐酸白色沉淀不溶解,说明溶液中有硫酸根.但是如果溶
今天在课本上看到,向某溶液中滴加氯化钡溶液,若有白色沉淀生成,再滴加稀盐酸白色沉淀不溶解,说明溶液中有硫酸根.但是如果溶液中有Ag离子呢?生成氯化银也是白色沉淀,
 vv烘烘1年前6
vv烘烘1年前6 -
 杜兰欣 共回答了15个问题
杜兰欣 共回答了15个问题 |采纳率100%书上说的是鉴定,是已经知道溶液中有硫酸根,进行证明;你说的则是鉴别,和前面不是一回事,鉴别的时候,是要考虑溶液中有没有Ag离子的.这时候可以先加稀盐酸,看有无沉淀,没有沉淀再加氯化钡溶液.1年前查看全部
- 向氯化铁和氯化钡溶液中充入二氧化硫,溶液导电能力降低对吗?
 betty0910161年前2
betty0910161年前2 -
 Phedle 共回答了23个问题
Phedle 共回答了23个问题 |采纳率87%不是,SO2与氯化钡不反应,即使反应生成的盐酸会溶解亚硫酸钡,从而使得溶液中离子数量不会减少,反而二氧化硫溶于水后,会增加水中离子数目,导电能力会增强1年前查看全部
- 现有A、B、C、D、E、F六瓶无色溶液,分别为酚酞、氢氧化钠溶液、硫酸铵、氯化钡溶液、硫酸钠溶液和盐酸.
现有A、B、C、D、E、F六瓶无色溶液,分别为酚酞、氢氧化钠溶液、硫酸铵、氯化钡溶液、硫酸钠溶液和盐酸.
进行有关实验后得到如下现象:1、A、B两溶液混合后溶液呈红色2、取A溶液分别加入C、D、E、F中并加热,发现没有任何现象产生.问:上述能得出什么结论?在不添加任何其他试剂下能区分它们吗?具体方法. n245j581年前1
n245j581年前1 -
 mmq_beauty 共回答了23个问题
mmq_beauty 共回答了23个问题 |采纳率91.3%AB混合呈红色,可知AB是酚酞和氢氧化钠,又A加入CDEF加热无现象,可知A是酚酞(氢氧化钠和铵盐混合加热生成氨气).B是氢氧化钠.
分别取样,滴加B,有刺激性气味气体放出的是硫酸铵.剩下的滴加硫酸铵,有白色沉淀的是氯化钡溶液.
将氯化钡溶液滴入剩下两分样品,有白色沉淀生成的是硫酸钠溶液,无明显现象的是盐酸.1年前查看全部
- 为预防荔枝等水果在成熟期发生裂果现象,果农常施用一种钾肥.这种钾肥的水溶液能跟氯化钡溶液发生反应生成不溶于稀HNO3的白
为预防荔枝等水果在成熟期发生裂果现象,果农常施用一种钾肥.这种钾肥的水溶液能跟氯化钡溶液发生反应生成不溶于稀HNO3的白色沉淀,该钾肥为( )
B)K2CO3
C)K2SO4
为什么是硫酸钾
而生成碳酸钾也不溶水的啊? 一斗米12081年前1
一斗米12081年前1 -
 东南西北风 共回答了20个问题
东南西北风 共回答了20个问题 |采纳率85%K2CO3 和氯化钡生成沉淀BaCO3.它是溶于HNO3的.
反应是:BaCO3 + 2H+ =Ba2+ +CO2 +H2O1年前查看全部
- 为何把盐酸溶液加入氯化钡溶液中会出现浑浊现象?
 来了山鬼1年前4
来了山鬼1年前4 -
 dd难申请 共回答了13个问题
dd难申请 共回答了13个问题 |采纳率92.3%嗯,出现这样的情况.应该是向饱和BaCl2溶液(或高浓度)中加入浓盐酸造成的.
也就是所谓“同离子效应”,既:
在电解质饱和溶液中,加入含有与该电解质相同离子的强电解质,会降低该电解质的溶解度.
也就是说,因为BaCl2饱和溶液中存在大量Cl-,而加入的浓盐酸中也有大量Cl-
所以两溶液混合后,BaCl2溶解度降低,从而从溶液中析出,也就出现了浑浊~
有兴趣可以在百度查看“同离子效应”1年前查看全部
- 【化学】硫酸铜与氯化钡溶液反应:加入稀硝酸后现象是什么?
【化学】硫酸铜与氯化钡溶液反应:加入稀硝酸后现象是什么?
硫酸铜与氯化钡溶液反应:加入稀硝酸后现象是什么?
碳酸钠与氯化钡溶液反应:
现象:
化学方程式:
加入稀硝酸,现象:
化学方程式:
稀硫酸与氯化钡溶液反应:加入稀硝酸,现象是? 日落深处的毛毛虫1年前2
日落深处的毛毛虫1年前2 -
 电源qq 共回答了22个问题
电源qq 共回答了22个问题 |采纳率81.8%稀硫酸与氯化钡溶液反应:加入稀硝酸,现象是沉淀不溶解1年前查看全部
- 在硫酸钠溶液中滴加过量氯化钡溶液的化学方程式
 xiaowei18661年前1
xiaowei18661年前1 -
 killwalker 共回答了18个问题
killwalker 共回答了18个问题 |采纳率83.3%Na2SO4+BaCl2=2NaCl +BaSO4上箭头1年前查看全部
- 下列物质中,既能和水反应,其水溶液又能分别和铁、氯化钡溶液、烧碱溶液反应的是()
下列物质中,既能和水反应,其水溶液又能分别和铁、氯化钡溶液、烧碱溶液反应的是()
A. 盐酸
B. 硫酸钾
C. 氧化钙
D. 无水硫酸铜 楚人留香1年前1
楚人留香1年前1 -
 linfeng520 共回答了23个问题
linfeng520 共回答了23个问题 |采纳率91.3%解题思路:A、根据盐酸不会与氯化钡反应进行分析;
B、根据硫酸钾和铁不会反应进行分析;
C、根据氧化钙和水生成的氢氧化钙不会与铁反应进行分析;
D、根据硫酸铜和铁、烧碱等会发生反应进行分析.A、盐酸不和水反应,盐酸和铁会反应,但是和氯化钡不会反应,不满足要求,故A错误;
B、硫酸钾不和水反应,硫酸钾会与氯化钡反应,但是不会与铁反应,不满足要求,故B错误;
C、氧化钙和水生成的氢氧化钙,但是其溶液和铁与氯化钡都不反应,不满足要求,故C错误;
D、无水硫酸铜可以结合水变成五水合硫酸铜晶体(CuSO4•5H2O),硫酸铜溶液可以和铁反应生成铜和硫酸亚铁溶液,与氯化钡反应生成硫酸钡和氯化铜,与烧碱反应生成氢氧化铜和硫酸钠钠,故D正确;
故选D.点评:
本题考点: 酸、碱、盐的鉴别.
考点点评: 在解此类题时,首先分析题中各物质的性质,然后将选项中的物质代入进行验证即可.1年前查看全部
- 有一硫酸和硝酸的混合溶液,取其中的10mL,加入足量的氯化钡溶液,过滤,洗涤,烘干后得到9.32g沉淀,滤液跟4mol/
有一硫酸和硝酸的混合溶液,取其中的10mL,加入足量的氯化钡溶液,过滤,洗涤,烘干后得到9.32g沉淀,滤液跟4mol/L的NaOH溶液反应,用去25mL碱液时恰好中和.
1.求混合溶液中硫酸和硝酸的物质的量浓度.
2.另取10mL原混合溶液,加入3.2g铜粉共热,在标准状况下可收集到多少mL气体? qwert1q1年前3
qwert1q1年前3 -
 不会水的鸭子110 共回答了18个问题
不会水的鸭子110 共回答了18个问题 |采纳率94.4%1、由题意可知9.32克沉淀为硫酸钡
∴其物质的量为:9.32g/233g/mol=0.04mol
根据物质守恒可知,10mL原混合溶液中含有的硫酸物质的量为0.04
∴其物质的量浓度为:0.04mol/0.01L=4mol/L
滤液中含有盐酸和硝酸以及氯化钡,其中盐酸是硫酸与氯化钡的反应产物之一
∴由反应方程式H2SO4+BaCl2=BaSO4↓+2HCl可得
反应生成的HCl的物质的量为参与反应硫酸的物质的量的2倍,即0.08mol
∴被中和的硝酸的物质的量为:0.025*4-0.08=0.02mol
∴原混合溶液中硝酸的物质的量浓度为:0.02mol/0.01L=2mol/L
2、根据题意可知,溶液中发生的反应为:
3Cu+2HNO3+3H2SO4=3CuSO4+4H2O+2NO↑
∵不知道硝酸、硫酸、铜粉三种物质哪一个过量
所以设铜粉、硫酸过量,参与反应的铜粉为x mol,参与反应的硫酸的物质的量为y mol
反应方程式可得
3/x=2/0.02 3/y=2/0.02
x=0.03 y=0.03
因为加入的铜粉质量为3.2克,其物质的量为:3.2/64=0.05mol>0.03mol
原溶液中含有的硫酸物质的量为:0.04mol>0.03mol
所以假设成立
所以设生成气体的物质的量为z mol
则由反应方程式可得
2/0.02=2/z
z=0.02
所以生成的气体体积为:0.02*22.4=0.448L=448mL1年前查看全部
- 将40克的硫酸溶液跟64.66克的氯化钡溶液混合后,恰好完全反应滤出反应中生成的沉淀,得到100克的溶液,则所得溶液中的
将40克的硫酸溶液跟64.66克的氯化钡溶液混合后,恰好完全反应滤出反应中生成的沉淀,得到100克的溶液,则所得溶液中的溶质质量分数为?
 shxk1年前1
shxk1年前1 -
 爬的可快可快了 共回答了19个问题
爬的可快可快了 共回答了19个问题 |采纳率84.2%得到的硫酸钡沉淀质量是4.66克,溶液为盐酸溶液,由于是恰好反应,则根据BaSO4----(SO4)2- -----2H+------2HCl这个关系,可以算出氯化氢的质量为:
M=(2x36.5x4.66)/233=1.46g
则所得溶液中的溶质质量分数为w%=1.46/100x100%=1.46%1年前查看全部
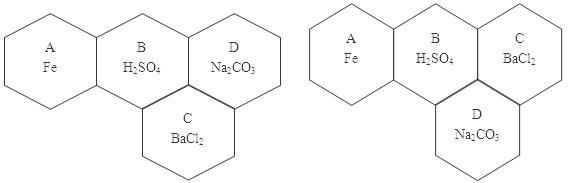
- 现有A、B、C、D四种物质分别是纯铁片、稀硫酸、碳酸钠溶液、氯化钡溶液中的一种,用四个六边形表示四种物质,用相邻的六边形
现有A、B、C、D四种物质分别是纯铁片、稀硫酸、碳酸钠溶液、氯化钡溶液中的一种,用四个六边形表示四种物质,用相邻的六边形有共同的边表示两种物质可以发生反应,请回答下列问题:(已知金属钡的金属活动性在钾和钙之间)
(1)A和B发生置换反应,B能和其他三种物质都反应,将C、D画在A和B周围的适当位置,在六边形中写出物质化学式或溶质的化学式,并注明物质的代号;
(2)写出产生白色沉淀的化学方程式 ;
(3)足量的A与B反应的实验现象为 。 天呀黑1年前1
天呀黑1年前1 -
 网游痴痴 共回答了16个问题
网游痴痴 共回答了16个问题 |采纳率87.5%1年前查看全部
- 请问 硫酸铵中滴加氯化钡溶液
 郁綦君1年前2
郁綦君1年前2 -
 起个名字都好烦 共回答了18个问题
起个名字都好烦 共回答了18个问题 |采纳率94.4%(NH4)2SO4+BaCl2=2NH4Cl+BaSO4↓1年前查看全部
- 氯化钙,氯化钡溶液中通入二氧化碳的化学方程式?
 czkaichun1年前3
czkaichun1年前3 -
 雨莞 共回答了18个问题
雨莞 共回答了18个问题 |采纳率88.9%不会反应,因为弱酸不能生成强酸1年前查看全部
- 二氧化硫通入氯化钡溶液中无沉淀生成,这句话对么?
二氧化硫通入氯化钡溶液中无沉淀生成,这句话对么?
答案是不对,不过二氧化硫不是与氯化钡溶液不反应吗,怎么能有沉淀呢? 糜范郭吧1年前1
糜范郭吧1年前1 -
 妞妞0723 共回答了13个问题
妞妞0723 共回答了13个问题 |采纳率76.9%这是对的.二氧化硫溶于水生成的亚硫酸是弱酸,而盐酸是强酸,弱酸无法制强酸.1年前查看全部
- 在氯化钡溶液中通入二氧化碳,是否会产生沉淀?
在氯化钡溶液中通入二氧化碳,是否会产生沉淀?
我个人认为会产生沉淀.因为二氧化碳通入,与水反应生成碳酸,而碳酸肯定会电离出碳酸根离子,之后碳酸根离子和钡离子结合,生成碳酸钡沉淀. 风吹的脸1年前6
风吹的脸1年前6 -
 19660305 共回答了19个问题
19660305 共回答了19个问题 |采纳率89.5%的确,CO2+H2O=H2CO3,会电离出CO32-
但是,电离出CO32-的同时也产生了H+,H+和Cl-在一起就变成了盐酸.就算产生BaCO3沉淀也立即溶於盐酸生成BaCl2和CO2和H2O
相当於一开始就没有这个反应.1年前查看全部
- 向氯化钡溶液中滴加稀硫酸,直至2价钡离子全部转化为BaSO沉淀为止.过滤后所得虑液(假设过滤时没有另外加水)的质量与原来
向氯化钡溶液中滴加稀硫酸,直至2价钡离子全部转化为BaSO沉淀为止.过滤后所得虑液(假设过滤时没有另外加水)的质量与原来氯化钡溶液的质量恰好相等.问:硫酸中H2SO4的质量分数是多少?
滤液里不是还有HCl吗?为什么没有把HCl的质量算进去,还有就是不一定反应完全硫酸可能剩余或不剩余啊,你们的答案我都看糊涂了,可以再讲细一点吗?
我会再加分的. 爱你已经8年1年前1
爱你已经8年1年前1 -
 taotao999 共回答了22个问题
taotao999 共回答了22个问题 |采纳率81.8%BaCl2+H2SO4=BaSO4+2HCl
观察,cl2一直在溶液中,所以不要算.只要算差值.
溶液中出来了Ba,多出了H和水.
设原溶液中Ba的质量为a克,稀硫酸溶液的质量为b克,稀硫酸质量分数为x
BaCl2 + H2SO4 = BaSO4 + 2HCl
208 98
208a/137 xb
即 137xb=98a (1)
然后根据前后质量相等得(1-96x/98)b=a (2) (96xb/98是硫酸根的质量)
(1)/(2) 得x≈0.421年前查看全部
- 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是( )
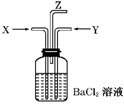
A. 洗气瓶中产生的沉淀是碳酸钡
B. 从Z导管出来的气体中无二氧化碳
C. 洗气瓶中产生的沉淀是亚硫酸钡
D. 在Z导管口有红棕色气体出现 w1zh21年前4
w1zh21年前4 -
 love双双 共回答了26个问题
love双双 共回答了26个问题 |采纳率96.2%解题思路:据反应,判断X为SO2和CO2,Y为NO2,生成NO2和SO2发生反应生成硫酸和NO,故有硫酸钡生成,由于硝酸的存在,二氧化碳与氯化钡不能生成碳酸钡沉淀从溶液中逸出.X为SO2和CO2,Y为NO2,XY混合之后SO2和NO2会发生氧化还原反应:SO2 +NO2+H2O=H2SO4+NO
A、因H2SO4能与氯化钡反应生成BaSO4,CO2与氯化钡不反应,没有BaCO3生成,故A错误;
B、因CO2不与氯化钡反应,从导管中逸出,故C错误;
C、因H2SO4能与氯化钡反应生成BaSO4,故C错误;
D、反应生成的NO在Z导管口与空气中的氧气反应生成NO2,呈红棕色,故D正确;
故选D.点评:
本题考点: 氮的氧化物的性质及其对环境的影响;二氧化硫的化学性质.
考点点评: 本题主要考查了浓硫酸、浓硝酸的性质,根据物质的性质解释实验现象,培养了学生分析问题、解决问题的能力.1年前查看全部
- 鉴别盐酸和硫酸、、A、硝酸银溶液和稀硝酸 B、氯化钡溶液和稀硝酸1、为什么要加稀硝酸、2、AB两种物质和盐酸、硫酸的反应
鉴别盐酸和硫酸、、
A、硝酸银溶液和稀硝酸
B、氯化钡溶液和稀硝酸
1、为什么要加稀硝酸、
2、AB两种物质和盐酸、硫酸的反应式是什么、有什么区别. 赌坊301年前5
赌坊301年前5 -
 oo戒 共回答了22个问题
oo戒 共回答了22个问题 |采纳率81.8%选B 氯化钡溶液``
与硫酸反应可以生成沉淀,而与盐酸不反应,所以可以容易区别盐酸和硫酸.
A不行,因为硝酸银溶液与盐酸反应生成沉淀,而与硫酸反应生成的硫酸银是微溶,和沉淀很难区别开来,效果很差,所以不适宜
1、为什么要加稀硝酸、这是因为生成的沉淀不一定就是氯化银或者硫酸钡!
还有可能是银或者钡和其他离子形成的沉淀!
加硝酸就是为了排除这种可能
2、AB两种物质和盐酸、硫酸的反应式是什么、有什么区别.
硝酸银和盐酸可反应:Ag(NO3)2+2HCl==AgCl2↓+2HNO3生成白色沉淀.而且硝酸银不和硫酸反应
氯化钡只和硫酸反应而不和盐酸硝酸反应
方程式:BaCl2+H2SO4=BaSO4↓+2HCl,有白色沉淀生成
应该选我的吧1年前查看全部
- .用等体积等物质的量浓度的氯化钡溶液可使相同体积的硫酸铁、硫酸亚铁、硫酸钾三种溶液中的硫酸根离子完全转化为沉淀。则三种溶
.用等体积等物质的量浓度的氯化钡溶液可使相同体积的硫酸铁、硫酸亚铁、硫酸钾三种溶液中的硫酸根离子完全转化为沉淀。则三种溶液的物质的量浓度之比为( )
A.1∶1∶1 B.1∶2∶3 C.3∶1∶1 D.1∶3∶3
答案是D
方法讲下。。
 飞一般享受1年前1
飞一般享受1年前1 -
 sexbaby 共回答了20个问题
sexbaby 共回答了20个问题 |采纳率95%n(Ba2+)=n(SO4 2-)
所以假设这些溶液中每份都含有 3 mol SO42- ,体积为 10L 那么
FeSO4 物质的量为 3 mol,物质的量浓度为 0.3mol/L
Fe2(SO4)3 物质的量为 1 mol,物质的量浓度为 0.1mol/L
K2SO4 物质的量为 3mol,物质的量浓度为 0.3mol/L
所以选 D1年前查看全部
- 请设计一个只用氯化钡溶液及试管鉴别碳酸钠溶液和硫酸的试验,简要写出鉴别过程和实验结论
 c445336ba5155f681年前1
c445336ba5155f681年前1 -
 光辉形象 共回答了15个问题
光辉形象 共回答了15个问题 |采纳率73.3%这个简单,先取1号溶液少量于试管中,滴加少量氯化钡,会有白色沉淀,再滴加2号溶液少量,若沉淀消失,则1号为碳酸钠,不消失则1号为硫酸.1年前查看全部
- 用密度为1.32克每毫升的硫酸溶液逐滴滴入氯化钡溶液中直到沉淀恰好完全为止,已知所形成的溶液质量等于原
 洪雅男1年前1
洪雅男1年前1 -
 永蓝涩 共回答了17个问题
永蓝涩 共回答了17个问题 |采纳率82.4%加入H2SO4和H2O,生成BaSO4
溶液质量不变,则m(H2SO4)+m(H2O)=m(BaSO4)
原溶液硫酸的质量分数=98/233=42.06%
硫酸的物质的量浓度=1/(233/1.32)*1000=5.67mol/L1年前查看全部
- 二氧化碳通入碱性氯化钡溶液会不会有沉淀
二氧化碳通入碱性氯化钡溶液会不会有沉淀
酸性好像是没有的. 思念如影随形1年前2
思念如影随形1年前2 -
 我爱小仙女 共回答了16个问题
我爱小仙女 共回答了16个问题 |采纳率81.3%可以,碱性环境说明含有OH-,要想生成沉淀至少碱性不要太弱了
这样CO2就与溶液里的OH-反应生成碳酸离子,然后:
Ba[2+] + CO3[2-]===BaCO3(沉淀)
白色沉淀1年前查看全部
- 有一硫酸和硝酸的混合溶液,从中取出10ml.加入足量氯化钡溶液,过滤、洗涤、干燥后得9.32g沉淀.滤液跟4mol/L的
有一硫酸和硝酸的混合溶液,从中取出10ml.加入足量氯化钡溶液,过滤、洗涤、干燥后得9.32g沉淀.滤液跟4mol/L的NaOH反映,用去35ml恰好中和
1.求混合溶液中硫酸和硝酸的物质的量浓度
2.另取10ml原溶液,加入3.2g铜共热,在STP下生成多少毫升气体? zhegea1年前3
zhegea1年前3 -
 起个名真难哪 共回答了16个问题
起个名真难哪 共回答了16个问题 |采纳率93.8%1.
H2SO4------BaSO4
1 233
x 9.32
解得 x=0.04mol
溶液中H+物质的量为 4*0.035 = 0.14mol
所以 HNO3的物质的量为 0.14-2*0.04 = 0.06mol
其物质的量浓度为 0.06/0.01 = 6mol/L
2.3Cu + 8H+ + 2NO3- === 3Cu2+ + 4H2O + 2NO↑
3*64g 8mol 2
3.2g 0.14 0.06
看出 Cu最少 按Cu计算
3Cu + 8H+ + 2NO3- === 3Cu2+ + 4H2O + 2NO↑
3*64g 2*22.4L
3.2g y
解得 y=746.6ml
如果还有疑问 百度HI找我 详谈1年前查看全部
- 某溶液中加入氯化钡溶液,出现不溶于稀硝酸的白色沉淀,该溶液一定含有SO42-.
某溶液中加入氯化钡溶液,出现不溶于稀硝酸的白色沉淀,该溶液一定含有SO42-.
是对是错,请说理由 乱世飘香1年前5
乱世飘香1年前5 -
 铭音 共回答了21个问题
铭音 共回答了21个问题 |采纳率95.2%这个是错的.初中阶段不溶于酸的沉淀一共有2个,分别是硫酸钡和硝酸银.
而加入氯化钡后,2中都可能生成,所以不能确定.1年前查看全部
- 检验一瓶溶液1.溶液为酸性2.取少量至试管,并加入氯化钡溶液和稀盐酸,无明显变化3.取少量至试管,并加入硝酸银溶液,生成
检验一瓶溶液
1.溶液为酸性
2.取少量至试管,并加入氯化钡溶液和稀盐酸,无明显变化
3.取少量至试管,并加入硝酸银溶液,生成白色沉淀,再加足量稀硝酸,沉淀不消失.
步骤二是为了检验什么
步骤三中生成白色沉淀后又加入足量稀硝酸是为了什么
(谁都知道这是盐酸) great_han1年前4
great_han1年前4 -
 tcmhu 共回答了21个问题
tcmhu 共回答了21个问题 |采纳率90.5%步骤二,看它有没有硫酸,有没有Ag+
步骤三,这是个固定操作,目的是以防一些酸溶性银盐沉淀干扰.1年前查看全部
- 取50.0mlNaCO3和NaSO4的混合溶液,加入过量氯化钡溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减
取50.0mlNaCO3和NaSO4的混合溶液,加入过量氯化钡溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出,试计算:
1.原混合溶液中碳酸钠和硫酸钠的物质的量浓度
2.产生的气体在标准状况下的体积
订:Na2SO4 liufenglly1年前4
liufenglly1年前4 -
 notme2 共回答了22个问题
notme2 共回答了22个问题 |采纳率100%m(BACO3)=14.51-4.66=9.85g
n(BaCO3)=9.85/(137+12+16*3)=0.05mol=n(Na2CO3)
m(BaSO4)=4.66/(137+32+16*4)=0.02mol=n(Na2SO4)
C(Na2CO3)=0.05*1000/50=1mol/L
C(Na2SO4)=0.02*1000/50=0.4mol/L
V(CO2)=0.05*22.4=1.12L1年前查看全部
- 去除硫酸根离子的方法问题去除硫酸根离子时要先酸化,之后要加入过量氯化钡溶液,然后还要加入过量碳酸钠溶液,最后还要加入盐酸
去除硫酸根离子的方法问题
去除硫酸根离子时要先酸化,之后要加入过量氯化钡溶液,然后还要加入过量碳酸钠溶液,最后还要加入盐酸.
问:为什么要先酸化?为什么加入碳酸钠溶液?加入过量盐酸后不需要再除去吗? 游客012312341年前1
游客012312341年前1 -
 爱是什么哟 共回答了18个问题
爱是什么哟 共回答了18个问题 |采纳率94.4%1、除去SO42-不酸化,也行.但是检验SO42-必须酸化.看题,是不是“检验并除去SO42-”
2、加入Na2CO3是为了除去过量的BaCl2.
3、加入盐酸是为了除去过量的Na2CO3
4、加入盐酸后,要蒸发,使HCl挥发除去1年前查看全部
- 一些化学方程式,帮个忙~硝酸钠溶液和氯化钠溶液氯化钡溶液喝硫酸钾溶液氯化铁溶液和氢氧化钠溶液碳酸钾和盐酸氧化铜和硝酸盐酸
一些化学方程式,帮个忙~
硝酸钠溶液和氯化钠溶液
氯化钡溶液喝硫酸钾溶液
氯化铁溶液和氢氧化钠溶液
碳酸钾和盐酸
氧化铜和硝酸
盐酸和硝酸银
硫酸和氢氧化钡
稀硫酸与氢氧化钠稀溶液
稀盐酸与硫酸钠溶液
氯化钠溶液与硝酸银溶液
碳酸钡与硫酸钠溶液 slyuer1年前1
slyuer1年前1 -
 erahui 共回答了10个问题
erahui 共回答了10个问题 |采纳率100%NaNO3和NaCl不能反应 BaCl2 + 2KNO3 = Ba(NO3)2 + 2KCl FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl K2CO3 + 2HCl = 2KCl + H2O + CO2↑ CuCl2 + 2HNO3 = Cu(NO3)2 + 2HCl HCl + AgNO3 = AgCl↓ + HNO3 H2SO4 + Ba(OH)2 = Ba...1年前查看全部
- 硫酸钠溶液与氯化钡溶液反应:SO42-+Ba2+ = BaSO4 ↓ 这是它的离子反应式 我老师说是错的...
 拉一人1年前1
拉一人1年前1 -
 dgfertew 共回答了24个问题
dgfertew 共回答了24个问题 |采纳率87.5%如果你是初中生或者是高中生,那么这个离子方程式是没错的,是你们老师在找茬.
麻烦采纳,谢谢!1年前查看全部
- 能一次性鉴别氯化钠溶液,氯化钡溶液,稀盐酸的是?
能一次性鉴别氯化钠溶液,氯化钡溶液,稀盐酸的是?
为什么能用碳酸钠溶液,不用硫酸钾溶液? 我要视频1年前5
我要视频1年前5 -
 hcbdda 共回答了22个问题
hcbdda 共回答了22个问题 |采纳率90.9%用硫酸钾溶液只能分辨出氯化钡溶液,而不能分辨出另外两种溶液.
用碳酸钠溶液时,没有变化的是氯化钠溶液,生成CO2气体的是稀盐酸,产生BaCO3沉淀的是氯化钡溶液
不懂的欢迎追问,1年前查看全部
- 取3支试管,分别倒入稀硫酸\硫酸铜溶液\碳酸钠溶液,在这3支试管中分别滴加少量氯化钡溶液现象
取3支试管,分别倒入稀硫酸硫酸铜溶液碳酸钠溶液,在这3支试管中分别滴加少量氯化钡溶液现象
1,取3支试管,分别倒入稀硫酸,硫酸铜溶液,碳酸钠溶液,在这3支试管中分别滴加少量氯化钡溶液,观察现象______.再往这3支试管里滴入几滴稀硝酸,振荡后观察现象__________.
2,取3支试管,分别倒入稀盐酸,氯化钠溶液,碳酸钠溶液,在这3支试管中分别滴入几滴稀硝酸,振荡观察其现象_________.再往这3支试管里滴入几滴稀硝酸,振荡后观察现象__________.
还有,我们知道可用氯化钡溶液检验稀硫酸,可用硝酸银溶液检验稀盐酸,为什么在本实验中,还可用这两种溶液分别检验含硫酸根离子和含氯离子的化合物
直接回答 Ciara19881年前1
Ciara19881年前1 -
 gzzqq 共回答了15个问题
gzzqq 共回答了15个问题 |采纳率93.3%1 白色沉淀。沉淀不溶解,并有气泡产生。
2 都有白色沉淀生成。盛有碳酸钠的试管中白色沉淀消失,并有气泡产生。
= =1年前查看全部
- 鉴别稀盐酸和稀硫酸最好选用 A紫色石蕊试液B无色酚酞试液C硝酸银溶液C氯化钡溶液
 老庄v1年前4
老庄v1年前4 -
 哎呀疯了25 共回答了26个问题
哎呀疯了25 共回答了26个问题 |采纳率96.2%选最后一个,氯化钡溶液,稀盐酸和稀硫酸遇到紫色石蕊试液,和无色酚酞现象都一样,因为他们都是酸性溶液,和硝酸银反应都有白色沉淀,只有稀盐酸和氯化钡没有反应,但稀硫酸和氯化钡会有沉淀,就是硫酸钡了.1年前查看全部
- 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中,下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中,下列说法正确的是( )
 A. 洗气瓶中产生的沉淀是碳酸钡
A. 洗气瓶中产生的沉淀是碳酸钡
B. Z导管出来的气体中无二氧化碳
C. 洗气瓶中产生的沉淀是硫酸钡
D. Z导管口有无色气体出现 jvvlsl1年前1
jvvlsl1年前1 -
 orangezt 共回答了17个问题
orangezt 共回答了17个问题 |采纳率100%解题思路:碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,铜与浓硝酸反应产生的Y气体是NO2,同时通入时因NO2与水和SO2共同作用要产生SO42-和NO,NO在空气中又会生成NO2,以此解答该题.碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,CO2和SO2与氯化钡均不反应,故不能生成碳酸钡、亚硫酸钡沉淀;铜与浓硝酸反应产生的Y气体是NO2,SO2+H2O+NO2=H2SO4+NO,硫酸与氯化钡反应产生硫酸钡沉淀,Z处逸出的气体中有CO2和NO,NO遇到空气中的氧气生成了红棕色的NO2.
故选C.点评:
本题考点: 二氧化硫的化学性质;氮的氧化物的性质及其对环境的影响.
考点点评: 本题考查硝酸、浓硫酸的性质以及二氧化硫与二氧化氮等物质的性质题目难度不大,注意相关元素化合物知识的积累.1年前查看全部
- 有甲,乙,丙三瓶等体积,等浓度的硫酸,若将甲稀释,在乙中加少量氯化钡溶液,丙不变,然后用等浓度的氢氧化钠溶液中和至恰好完
有甲,乙,丙三瓶等体积,等浓度的硫酸,若将甲稀释,在乙中加少量氯化钡溶液,丙不变,然后用等浓度的氢氧化钠溶液中和至恰好完全反应时,所需氢氧化钠溶液的体积关系是( )
A甲>乙>丙 B甲=丙>乙 C乙>丙>甲 D甲=乙=丙 只为樱等候1年前4
只为樱等候1年前4 -
 257258259 共回答了29个问题
257258259 共回答了29个问题 |采纳率89.7%选D.即甲=乙=丙.因为三者中的H 的数量是相等的1年前查看全部
- 向10ML碳酸钠和硫酸钠的混合溶液中啊计入足量的氯化钡溶液,生成陈淀的质量为6.24g,
向10ML碳酸钠和硫酸钠的混合溶液中啊计入足量的氯化钡溶液,生成陈淀的质量为6.24g,
向所得陈淀中加入足量的稀盐酸,陈淀质量减少到2.33g,并放出气体,试计算原混合物中硫酸钠的物质的量的浓度 偶是胖胖呀1年前1
偶是胖胖呀1年前1 -
 迁舒 共回答了24个问题
迁舒 共回答了24个问题 |采纳率95.8%NA2CO3+BACL2=BACO3+2NACL
NA2SO4+BACL2=BASO4+2NACL
152 233
1.52g 2.33g
BACO3+2HCL=BACL2+H2O+CO2
197 44
6.24g- 2.33g=3.91
1.52g/152/0.01L=1MOL/L原混合物中硫酸钠的物质的量的浓度1mol/l1年前查看全部
- 下列各物质的溶液中,加入氯化钡溶液不会产生白色沉淀的是 A.稀硫酸 B.硝酸银溶液 C.碳酸钠溶液 D.氢
下列各物质的溶液中,加入氯化钡溶液不会产生白色沉淀的是 A.稀硫酸 B.硝酸银溶液 C.碳酸钠溶液 D.氢
(1)下列各物质的溶液中,加入氯化钡溶液不会产生白色沉淀的是 ( )
A.稀硫酸 B.硝酸银溶液 C.碳酸钠溶液 D.氢氧化钠溶液
(2)为了除去KCl溶液中混有的CaCl2,得到尽可能纯净KCl的溶液,可向溶液中逐滴滴入下列溶液中( )
A.Ca(OH)2 B.K2CO3 C.Na2CO3 D.AgNO3 angel542881年前2
angel542881年前2 -
 ooww女人 共回答了18个问题
ooww女人 共回答了18个问题 |采纳率83.3%1,D 氢氧化钡不是沉淀
2,B 不会增加新杂质1年前查看全部
- 为什么二氧化硫通到氯化钡溶液中不会产生沉淀?
 happyww1年前2
happyww1年前2 -
 a3235932 共回答了11个问题
a3235932 共回答了11个问题 |采纳率90.9%盐酸的酸性比亚硫酸强,如果生成亚硫酸钡沉淀,马上被同时生成的盐酸分解,可以看做没有反应.1年前查看全部
- 可以与氢氧化钠溶液、氯化钡溶液、铁锈、锌碳酸钠同时发生反应的是什么
可以与氢氧化钠溶液、氯化钡溶液、铁锈、锌碳酸钠同时发生反应的是什么
A 硫酸铜 B稀盐酸 C稀硫酸 D二氧化碳
谢谢了~ creen19991年前1
creen19991年前1 -
 eeddcc53 共回答了14个问题
eeddcc53 共回答了14个问题 |采纳率78.6%C1年前查看全部
- 下列物质中均含有少量的括号内的杂质,是选用一种试剂将杂质除去(备选用试剂:氯化钡溶液、硝酸钡溶液、盐酸、硫酸溶液、硫酸铜
下列物质中均含有少量的括号内的杂质,是选用一种试剂将杂质除去(备选用试剂:氯化钡溶液、硝酸钡溶液、盐酸、硫酸溶液、硫酸铜溶液)
除杂质试剂 化学方程式 HCl(H2SO4)溶液 KCl(K2CO3)溶液 Cu(Zn)固体  相逢又何必曾识11年前4
相逢又何必曾识11年前4 -
 921243905 共回答了11个问题
921243905 共回答了11个问题 |采纳率90.9%解题思路:可以根据物质的性质方面进行分析、判断,从而得出正确的结论.例如氯化钡可以除去盐酸中的硫酸.HCl(H2SO4),可以加入氯化钡溶液,因为氯化钡和硫酸反应生成硫酸钡沉淀和盐酸.
化学方程式为:BaCl2+H2SO4═BaSO4↓+2HCl
KCl(K2CO3),可以加入盐酸,因为盐酸和碳酸钾反应生成氯化钾、水和二氧化碳.
化学方程式为:K2CO3+2HCl═2KCl+H2O+CO2↑
Cu(Zn),可以加入硫酸铜,因为硫酸铜和锌反应生成铜和硫酸锌.
化学方程式为:Zn+CuSO4═ZnSO4+Cu点评:
本题考点: 物质除杂或净化的探究.
考点点评: 解答本题时要充分理解物质的性质及其书写化学方程式的方法,只有这样才能对问题做出正确的判断.1年前查看全部
- 为什么先用盐酸酸化,再加氯化钡溶液可以检验未知溶液中有硫酸根?
 蓝天下的傻瓜1年前4
蓝天下的傻瓜1年前4 -
 yueliang3162001 共回答了17个问题
yueliang3162001 共回答了17个问题 |采纳率94.1%因为硫酸钡不溶解于酸性环境,而在你的学习范围中,还有碳酸钡的可溶于酸的沉淀.1年前查看全部
- 向某无色溶液中加氯化钡溶液,产生白色沉淀,再加稀硝酸沉淀不消失,则该溶液中一定有
向某无色溶液中加氯化钡溶液,产生白色沉淀,再加稀硝酸沉淀不消失,则该溶液中一定有
硫酸根离子或银离子,为什么没有亚硫酸根离子? 美丽琳1年前3
美丽琳1年前3 -
 水的狗 共回答了19个问题
水的狗 共回答了19个问题 |采纳率100%酸性条件下,亚硫酸钡不产生白色沉淀1年前查看全部
- 某溶液中可能含有SO42-,S2-,CO32-离子中的一种或数种,取此溶液加入足量氯化钡溶液时,有白色沉淀生成,然后加入
某溶液中可能含有SO42-,S2-,CO32-离子中的一种或数种,取此溶液加入足量氯化钡溶液时,有白色沉淀生成,然后加入足量稀盐酸,沉淀部分溶解,同时有无色,无刺激性气味的气体生成,则溶液中含有的离子推断?
 asdfasdf4441年前1
asdfasdf4441年前1 -
 raduy 共回答了21个问题
raduy 共回答了21个问题 |采纳率90.5%肯定有SO42-和CO32-
因为生成无色,无刺激性气味的气体(CO2),所以有CO32-
不可能有 S2-,因为H+会与S2-结合生成H2S气体,有臭鸡蛋味.
又因为有部分沉淀溶解,所以生成的沉淀为BaCO3和BaSO4
因为BaSO4不溶于盐酸而BaCO3溶于盐酸
所以含有SO42-
综上,含有SO42-和CO32-,没有S2-.1年前查看全部
- 明矾中滴加氯化钡溶液至过量离子方程式
 lijinmimi011年前3
lijinmimi011年前3 -
 边走边吃游世界 共回答了20个问题
边走边吃游世界 共回答了20个问题 |采纳率85%Ba2+ +SO4 2-=BaSO41年前查看全部
- 检验硫酸根离子不能先加稀硝酸再加氯化钡溶液的原因
 正版可可1年前1
正版可可1年前1 -
 骡拉快跑 共回答了21个问题
骡拉快跑 共回答了21个问题 |采纳率81%稀硝酸有强氧化性 可以把亚硫酸根氧化为硫酸根 加入氯化钡 也会产生白色沉淀 无法确定是硫酸根离子1年前查看全部
- 1.向硫酸铜溶液中滴加氯化钡溶液和几滴稀硝酸的实验现象和化学方程式
1.向硫酸铜溶液中滴加氯化钡溶液和几滴稀硝酸的实验现象和化学方程式
2.向碳酸钾溶液中滴加氯化钡和几滴稀硝酸的实验现象和化学方程式 jzhlfs1年前2
jzhlfs1年前2 -
 fredtiger 共回答了14个问题
fredtiger 共回答了14个问题 |采纳率92.9%1.向硫酸铜溶液中滴加氯化钡溶液和几滴稀硝酸的实验现象和化学方程式:
CuSO4 + BaCl2 == CuCl2 + BaSO4↓
现象:生成难溶于稀硝酸的白色沉淀.
2.向碳酸钾溶液中滴加氯化钡和几滴稀硝酸的实验现象和化学方程式:
K2CO3 + BaCl2 == 2KCl + BaCO3↓
3BaSO3 + 2HNO3 == 3BaSO4 + 2NO↑ + H2O
2NO + O2 == 2NO2
现象:生成白色沉淀,加入硝酸后生成无色气体,遇空气变红棕色,沉淀不溶解.1年前查看全部
- 检验某溶液中是否含有硫酸根离子,为什么先加盐酸酸化,再加氯化钡溶液,为什么氯化钡溶液不能换成硝酸钡溶液?
 zist0011年前2
zist0011年前2 -
 我是游客_vv 共回答了21个问题
我是游客_vv 共回答了21个问题 |采纳率95.2%盐酸化你已经知道为什么了!如改加硝酸钡有硫酸钡生成但同时也有硝酸生成,硝酸又把硫酸溶解了,故看不出现象!所以不用硝酸钡…1年前查看全部
- 在含有碳酸钠和硫酸钠的溶液里加入足量的氯化钡溶液,生成43g沉淀.把沉淀用足量的盐酸处理,在标准状况下放出2.24L二氧
在含有碳酸钠和硫酸钠的溶液里加入足量的氯化钡溶液,生成43g沉淀.把沉淀用足量的盐酸处理,在标准状况下放出2.24L二氧化碳气体,则原溶液中含有碳酸钠和硫酸钠的物质的量的比值是多少.
 lili3101年前1
lili3101年前1 -
 zhutous 共回答了23个问题
zhutous 共回答了23个问题 |采纳率87%解题思路:沉淀43g为BaCO3、BaSO4的质量,沉淀用盐酸溶解,碳酸钡反应生成二氧化碳,根据碳元素守恒计算n(Na2CO3),进而计算m(BaSO4),再计算n(BaSO4),根据硫元素守恒计算n(Na2SO4),据此解答.沉淀43g为BaCO3、BaSO4的质量,沉淀用盐酸溶解,碳酸钡反应生成二氧化碳,根据碳元素守恒:n(Na2CO3)=n(BaCO3)=n(CO2)=[2.24L/22.4L/mol]=0.1mol,
故m(BaSO4)=43g-0.1mol×197g/mol=23.3g,n(BaSO4)=[23.3g/233g/mol]=0.1mol,根据硫元素守恒:n(Na2SO4)=n(BaSO4)=0.1mol,
故n(Na2CO3):n(Na2SO4)=0.1mol:0.1mol=1:1,
答:原溶液中含有碳酸钠和硫酸钠的物质的量的比值是1:1.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物计算,难度不大,注意利用守恒思想进行计算.1年前查看全部
- 把aL含硫酸铵、硝酸铵的混合溶液分成两等份,一份用b mol烧碱刚好把NH3全部赶出,另一份用氯化钡溶液完全反应,消耗c
把aL含硫酸铵、硝酸铵的混合溶液分成两等份,一份用b mol烧碱刚好把NH3全部赶出,另一份用氯化钡溶液完全反应,消耗c mol BlCl2,则原溶液中c(NO3-)为( )
A.b-2c/a mol/L
B.2b-4c/a mol/L
C.2b-c/a mol/L
D.2c-4b/a mol/L
c(NO3-)到底是如何算的, xiejinghe1年前3
xiejinghe1年前3 -
 wldshen 共回答了16个问题
wldshen 共回答了16个问题 |采纳率93.8%由“另一份用氯化钡溶液完全反应,消耗c mol BlCl2”知每一份中含有c mol硫酸铵,所以第一份与烧碱反应的
硫酸铵也为c mol ,第一份c mol 硫酸铵消耗的烧碱为2c mol,故与烧碱反应的硝酸铵为(b-2c) mol,即第一份c(NO3-)=(b-2c)/(a/2)=(2b-4c)/a mol/L ,将溶液等分并不改变其浓度,原溶液中c(NO3-)也为(2b-4c)/a mol/L .1年前查看全部
大家在问
- 1终于挽回了一段感情用英语怎么说啊
- 2硅或氧化硅和何种物质结合熔点和沸点最低
- 3史记与资治通鉴都写了的历史有哪些
- 44+2X乘8=112 给我解这个方程,别给我一步等出来 数学学得好的加我好友
- 5磷化氢 氯化氢 沸点哪个高?
- 6为什么水的沸点比硫化氢低
- 7为什么“酸性溶液一定含有氢离子”这句话是对的?
- 8推敲这篇文章体现贾岛什么样的精神?
- 9谁知道氯化氢沸点与压力关系,请指教,
- 10圆内接一四边形(已知四边形四边边长)求面积
- 11世界上最早发明白炽灯的科学家是谁?
- 12弹簧被拉伸或压缩时都产生反抗外力作用的弹力,表明____.
- 13哪位科学家发明电灯?
- 14问一下[√(1+2x)-3]/√(x)-2]怎么变成[2/2√(1+2x)]/[1/2√x]的?
- 15以氢原子、氧原子、水分子、氢离子为例,说说原子、分子、离子三者之间存在着怎样的互相转化关系(要准的