将20mL 0.5mol•L-1K2SO3溶液逐滴加入到20mL 0.2mol•L-1 硫
 竞走2022-10-04 11:39:541条回答
竞走2022-10-04 11:39:541条回答A.Mn
B.Mn2+
C.Mn2O3
D.K2MnO4

已提交,审核后显示!提交回复
共1条回复
 kickbally 共回答了16个问题
kickbally 共回答了16个问题 |采纳率87.5%- 解题思路:由信息可知,S元素的化合价由+4价升高为+6价,则Mn元素的化合价降低,结合电子守恒计算.
由信息可知,S元素的化合价由+4价升高为+6价,则Mn元素的化合价降低,设反应后Mn元素的化合价为x,
由电子守恒可知,20×0.001L×0.5mol/L×(6-4)=20×10-3L×0.2mol•L-1×(7-x),
解得x=+2,
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析能力及计算能力的考查,注意从化合价角度及电子守恒角度分析,题目难度不大. - 1年前
相关推荐
- 实验室用98%的浓硫酸(密度为1.84g•mL-1)配制500mL0.5mol•L-1的稀硫酸.已选用的主要仪器有烧杯、
实验室用98%的浓硫酸(密度为1.84g•mL-1)配制500mL0.5mol•L-1的稀硫酸.已选用的主要仪器有烧杯、胶头滴管、玻璃棒,还缺少的仪器是( )
A.容量瓶、13.6mL量筒
B.容量瓶、100mL量筒
C.500mL容量瓶、100mL量筒
D.500mL容量瓶、25mL量筒 talent猪1年前1
talent猪1年前1 -
 扁嘴鸭 共回答了19个问题
扁嘴鸭 共回答了19个问题 |采纳率78.9%解题思路:先根据c=[1000ρw/M]计算出98%的浓硫酸(密度为1.84g/mL)的物质的量浓度,然后计算出配制500mL 0.5mol/L的稀硫酸需要浓硫酸的体积,据此选用量筒规格;然后根据配制一定物质的量浓度的溶液步骤选择使用的仪器.该浓硫酸的物质的量浓度为:c=[1000ρw/M]=[1000×1.84×98%/98]mol/L=18.4mol/L,
配制500mL 0.5mol/L的稀硫酸,需要浓硫酸的体积为:[0.5mol/L×0.5L/18.4mol/L]≈0.0136L=13.6mL,应该选用25mL量筒;
配制500mL 0.5mol/L的稀硫酸,应该选用500mL容量瓶,
故选D.点评:
本题考点: 溶液的配制.
考点点评: 本题考查了物质的量浓度的简单计算、配制一定物质的量浓度的溶液中选用仪器的方法,题目难度中等,注意掌握物质的量浓度与溶质质量分数之间的转化,明确配制一定物质的量浓度的溶液方法及选用仪器规格的原则.1年前查看全部
- 某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5mol•L-1的NaOH溶液
 某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5mol•L-1的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中( )
某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5mol•L-1的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中( )
A.有Mg2+,没有Al3+
B.有Al3+,没有Mg2+
C.有大量的H+Mg2+、和Al3+、
D.有Mg2+、和Al3+ 多米雪1年前1
多米雪1年前1 -
 xinglee3 共回答了17个问题
xinglee3 共回答了17个问题 |采纳率76.5%解题思路:根据生成沉淀的质量和加入NaOH溶液的体积之间的关系的图示可知,加入氢氧化钠溶液就产生了沉淀,故一定没有大量氢离子;
沉淀达到最大值后又有部分溶解,溶液中一定含有Mg2+、Al3+,所以一定没有氢氧根离子.根据图示可以推断,加入氢氧化钠溶液就生成了沉淀,故溶液中一定没有大量氢离子;
能够和氢氧化钠反应生成沉淀的离子有Mg2+、Al3+,生成的沉淀部分溶解,不溶解的是氢氧化镁,溶解的是氢氧化铝,所以一定含有Mg2+、Al3+,一定没有OH-
A、一定含有 Mg2+、Al3+,故A错误;
B、一定含有Mg2+,故B错误;
C、一定没有大量氢离子,故C错误;
D、一定含有Mg2+、Al3+,故D正确;
故选D.点评:
本题考点: 常见离子的检验方法.
考点点评: 本题考查离子推断,注意氢氧化铝是两性强氧化物,既能和酸反应,又能和强碱溶液反应,本题难度中等.1年前查看全部
- 向100mL 1.0mol•L-1的AlCl3溶液中逐滴加入0.5mol•L-1的NaOH溶液至过量,生成沉淀
向100mL 1.0mol•L-1的AlCl3溶液中逐滴加入0.5mol•L-1的NaOH溶液至过量,生成沉淀的物质的量与加入NaOH的量的理论曲线图正确的是( )
A.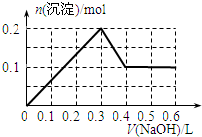
B.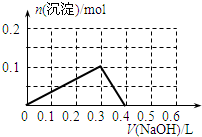
C.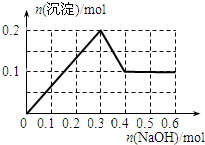
D.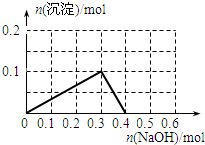
 猫儿木木1年前1
猫儿木木1年前1 -
 qq孤旅KING 共回答了24个问题
qq孤旅KING 共回答了24个问题 |采纳率87.5%解题思路:向氯化铝溶液中加入氢氧化钠溶液发生的化学反应为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,当铝离子恰好和氢氧化钠完全反应生成氢氧化铝时,沉淀的物质的量最大,当氢氧化铝完全转化为偏铝酸钠时,沉淀完全消失,根据方程式及原子守恒进行解答.向氯化铝溶液中加入氢氧化钠溶液发生的化学反应为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,当铝离子恰好和氢氧化钠完全反应生成氢氧化铝时,沉淀的物质的量最大,当氢氧化铝完全转化为偏铝酸钠时,沉淀完全消失;
根据方程式AlCl3+3NaOH=Al(OH)3↓+3NaCl、Al(OH)3+NaOH=NaAlO2+2H2O知,铝离子完全转化为沉淀和沉淀完全消失需要氢氧化钠的物质的量之比为3:1,n(AlCl3)=1.0mol/L×0.1L=0.1mol,完全沉淀时需要氢氧化钠溶液的体积=[0.1mol×3/0.5mol/L]=600mL,根据原子守恒得n(Al(OH)3)=n(AlCl3)=0.1mol,
故选D.点评:
本题考点: 镁、铝的重要化合物;化学方程式的有关计算.
考点点评: 本题以铝的化合物之间的转化为载体考查图象分析,明确物质之间发生的反应及物质之间的关系是解本题关键,再结合原子守恒分析解答,难度中等.1年前查看全部
- 设N A 表示阿伏伽德罗常数的数值,下列说法中正确的是 A.0.5mol∙L -1 Fe 2 (SO 4 ) 3 溶液中
设N A 表示阿伏伽德罗常数的数值,下列说法中正确的是
A.0.5mol∙L -1 Fe 2 (SO 4 ) 3 溶液中含有SO 4 2 - 数为1.5N A B.7.8g Na 2 O 2 溶于水后,所得溶液中含有O 2 2 - 数为N A C.标准状况下,22.4LCl 2 与足量的铁粉反应,转移的电子数为3N A D.常温常压下,7.0g乙烯和丙烯的混合物中含有氢原子的数目为N A  月纱妖姬1年前1
月纱妖姬1年前1 -
 JZCYC 共回答了21个问题
JZCYC 共回答了21个问题 |采纳率100%D
1年前查看全部
- 某研究性学习小组在一次活动中,参照右图组装实验装置,以多孔碳棒为电极,电解质溶液用0.5mol•L-1NaOH溶液,电用
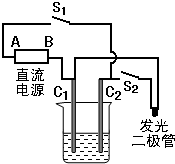 某研究性学习小组在一次活动中,参照右图组装实验装置,以多孔碳棒为电极,电解质溶液用0.5mol•L-1NaOH溶液,电用3~6V直流电,发光二极管起辉电压为1.7V,电流为0.6mA.(提示:电解NaOH溶液实质上是电解水)
某研究性学习小组在一次活动中,参照右图组装实验装置,以多孔碳棒为电极,电解质溶液用0.5mol•L-1NaOH溶液,电用3~6V直流电,发光二极管起辉电压为1.7V,电流为0.6mA.(提示:电解NaOH溶液实质上是电解水)
(1)按下开关S1,半分钟后两碳棒上产生明显的气泡,且碳棒C1上产生气体与碳棒C2上产生气体的物质的量之比为1:2,则碳棒C1为______极;直流电上A为______极;
(2)断开开关S1,按下开关S2,可观察到的明显现象为______;碳棒C1为______极,碳棒C2极的电极反应式为______. lelebule1年前1
lelebule1年前1 -
 一生只为这一天 共回答了18个问题
一生只为这一天 共回答了18个问题 |采纳率72.2%解题思路:(1)按下开关S1,形成电解氢氧化钠的电解池,电解水时,阳极上产生氧气,阴极上产生氢气,两个电极的体积比是1:2;
(2)断开开关S1,按下开关S2,形成氢氧燃料电池,在电池的负极上燃料发生失电子的氧化反应,正极上发生得电子的还原反应.(1)按下开关S1,形成电解氢氧化钠的电解池,电解水时,阳极上产生氧气,阴极上产生氢气,两个电极的体积比是1:2;即C1棒是阳极,B是正极,A是负极,故答案为:阳;负;
(2)断开开关S1,按下开关S2,形成氢氧燃料电池,有电流产生,所以会看到发光二极管变亮,碳棒C1上产生的氧气作正极,碳棒C2上产生的氢气做负极,电极反应为:2H2-4e-+4OH-=4H2O,故答案为:发光二极管变亮;正;2H2-4e-+4OH-=4H2O.点评:
本题考点: 电解原理.
考点点评: 本题考查学生原电池、燃料电池的工作原理知识,注意电极反应式的书写是关键,难度中等.1年前查看全部
- 在过量的稀硫酸溶液中加入5.6g Fe粉,待反应完全后,再加入50mL 0.5mol•L-1 KNO
在过量的稀硫酸溶液中加入5.6g Fe粉,待反应完全后,再加入50mL 0.5mol•L-1 KNO3溶液,恰好反应完全.该反应的方程式为:_FeSO4+_KNO3+_H2SO4=_K2SO4+_Fe(SO4)3+_NxOy+_H2O,则对该反应的下列说法正确的是( )
A.反应中还原产物是NO
B.氧化产物和还原产物的物质的量之比为1:4
C.反应过程中转移的电子数为8e-
D.化学方程式中按物质顺序的化学计量数是8、2、5、1、4、1、5 海阔逍遥1年前1
海阔逍遥1年前1 -
 一根走路的草 共回答了22个问题
一根走路的草 共回答了22个问题 |采纳率90.9%解题思路:该反应中Fe元素化合价由+2价变为+3价,根据原子守恒得n(Fe)=n(FeSO4)=[5.6g/56g/mol]=0.1mol,n(KNO3)=0.5mol/L×0.05L=0.025mol,二者的物质的量之比=0.1mol:0.025mol=4:1,根据转移电子相等得4×1=1×(5-y),y=+1,根据O原子守恒得x=2,该反应方程式为8FeSO4+2KNO3+5H2SO4=1K2SO4+4Fe(SO4)3+1N2O+5H2O,再结合题目分析解答.该反应中Fe元素化合价由+2价变为+3价,根据原子守恒得n(Fe)=n(FeSO4)=5.6g56g/mol=0.1mol,n(KNO3)=0.5mol/L×0.05L=0.025mol,二者的物质的量之比=0.1mol:0.025mol=4:1,根据转移电子相等得4×1=1×(5-y)...
点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,根据转移电子相等及原子守恒配平方程式,正确判断y值是解本题关键,题目难度中等.1年前查看全部
- 如图1是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol•L-1 H2SO4溶液480mL,若由你来配
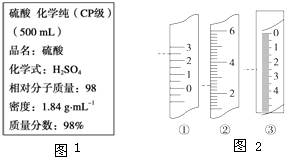 如图1是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol•L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
如图1是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol•L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
(1)容量瓶应如何检漏:______.
(2)实验中除量筒、烧杯外还需要的其他仪器______.
(3)计算所需浓硫酸的体积约为______mL;若将该硫酸与等体积的水混合,所得溶液中溶质的质量分数______49%(填“<”、“=”或“>”).
(4)配制过程中需先在烧杯中将浓硫酸进行稀释.稀释的操作方法是______.
(5)下列操作会引起所配溶液浓度偏大的是______(填字母).A.用量筒量取浓硫酸时,仰视量筒的刻度B.向容量瓶中转移时,有少量液体溅出C.定容时仰视刻度线D.定容后倒置摇匀后再正立时,发现液面低于刻度线
(6)温度计、量筒、滴定管的一部分如图2所示,下述读数(虚线所指刻度)及说法正确的是______(填字母).A.①是量筒,读数为2.5mLB.②是量筒,读数为2.5mLC.③是滴定管,读数为2.5mLD.①是温度计,读数为2.5℃ danny_20051年前1
danny_20051年前1 -
 yangxp_20 共回答了15个问题
yangxp_20 共回答了15个问题 |采纳率100%解题思路:(1)根据容量瓶的正确使用方法进行解答;
(2)根据配制一定物质的量浓度的溶液步骤选用仪器;
(3)根据溶液显示过程中溶质的物质的量不变计算出浓硫酸的体积;硫酸的密度大于水等体积混合后溶质质量分数大于原来的一半;
(4)浓硫酸密度大于水的密度,浓硫酸稀释过程中放出大量的热,应该将浓硫酸缓缓加入水中,顺序不能颠倒;
(5)根据实验操作对c=nV的影响进行判断各操作对配制结果的影响;
(6)根据温度计、容量瓶、滴定管的构造及正确使用方法进行解答.(1)容量瓶检漏的方法是加适量水后塞紧瓶塞倒置不漏水,然后正放,应注意瓶塞要旋转180度,再倒置看是否漏水,
故答案为:将瓶塞打开,加入少量水,塞好瓶塞,倒转不漏水,然后正放,把瓶塞旋转180度,再倒转不漏水,则说明该容量瓶不漏水;
(2)由于没有480mL的容量瓶,故应使用500mL的容量瓶,根据配制过程可知,还缺少500mL容量瓶、玻璃棒、胶头滴管,
故答案为:500mL容量瓶、玻璃棒、胶头滴管;
(3)由所给浓硫酸标签上的数据易求得该硫酸浓度为:18.4mol•L-1,故配制500mL 0.5mol•L-1的稀溶液时约需要13.6mL浓硫酸,
故答案为:13.6;>;
(4)稀释浓硫酸时应将浓硫酸沿器壁慢慢加入到水中,并不断搅拌,操作方法为:向烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌,
故答案为:向烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌;
(5)仰视量筒时,量筒中实际液面高于看到的液面,导致硫酸取多了,结果偏高;B、C两个选项操作均引起结果偏低;选项D.定容后倒置摇匀后再正立时,发现液面低于刻度线,由于容量瓶刻度线上方有部分残留溶液,该选项属于正常现象,不影响配制结果;
故答案为:A;
(6)A.量筒上没有0刻度值,故A错误;
B.量筒的读数能够读到0.1mL,图②中液体体积为2.5mL,故B正确;
C.滴定管读数时应保留两位小数,正确读数为2.50mL,故C错误;
D.只有温度计的0刻度下还有数据,且图示温度为2.5℃,故D正确;
故答案为:BD.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液,题目难度中等,试题涉及的题量稍大,注意掌握配制一定物质的量浓度的溶液方法,明确容量瓶、量筒、滴定管的构造及正确使用方法.1年前查看全部
- 实验室需要0.5mol•L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题:
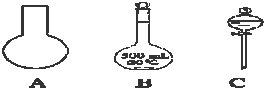 实验室需要0.5mol•L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题:
实验室需要0.5mol•L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是______(填序号),在使用如下B、C两种仪器前都应进行的操作______.
(2)下列操作中,容量瓶所不具备的功能有______(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
(3)根据计算,用量筒量取18.4mol•L-1的浓硫酸体积为______ ml,如果实验室有10mL、15mL、20mL量筒,选用______ml的量筒最好.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.5mol•L-1(填“大于”、“等于”或“小于”,下同).若浓硫酸在烧杯中溶解后,未冷却至室温就转移至容量瓶,则所得溶液浓度______0.5mol•L-1. 夜风独舞1年前1
夜风独舞1年前1 -
 lee_ss 共回答了22个问题
lee_ss 共回答了22个问题 |采纳率86.4%解题思路:(1)根据各仪器的作用选取仪器;带活塞的仪器使用前需检查是否漏水;
(2)容量瓶不能稀释浓溶液、不能用于溶解固体、储存溶液等;
(3)先根据C=
计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算,根据浓硫酸的体积选取量筒规格,根据C=[n/V]判断误差.103ρw M (1)用容量瓶配制溶液,容量瓶有瓶塞,分液漏斗有瓶塞和旋塞,使用前需检查是否漏水;
故答案为:B;检查是否漏水;
(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,
故选BC;
(3)浓硫酸的浓度=
103ρw
M=
103×1.84×98%
98mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.5/L×0.5L,V=0.0136L=13.6mL,选取的量筒规格应该等于或大于量取溶液体积,故选15mL量筒;若定容时仰视刻度线,溶液的体积偏大,则所得溶液浓度小于0.5mol•L-1,若浓硫酸在烧杯中溶解后,未冷却至室温就转移至容量瓶,由于热胀冷缩,所配溶液体积偏小,则所得溶液浓度 大于0.5mol•L-1,
故答案为:13.6;15;小于;大于.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查一定物质的量浓度溶液的稀释,注意容量瓶、量筒规格的选取方法,根据C=[n/V]判断误差.1年前查看全部
- VL浓度为0.5mol•L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
VL浓度为0.5mol•L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
A.通入标准状况下的HCl气体11.2VL
B.加入10mol•L-1的盐酸0.1VL,再稀释至1.5VL
C.将溶液加热浓缩到0.5VL
D.加入VL1.5mol•L-1的盐酸混合均匀 奔跑的蜗牛牛1年前1
奔跑的蜗牛牛1年前1 -
 jiahaifeng21 共回答了15个问题
jiahaifeng21 共回答了15个问题 |采纳率80%解题思路:A、根据C=[n/V]计算判断.
B、根据C=
计算判断.C1V1+C2V2 V
C、加热时,盐酸会挥发.
D、根据浓稀盐酸混合后体积是否变化判断.A、标准状况下的HCl气体11.2VL物质的量是0.5Vmol,向溶液中通入0.5VmolHCl,该溶液体积会增大,所以溶液浓度应该小于Vmol/L,故A错误.
B、VL浓度为0.5mol•L-1的盐酸的物质的量是0.5Vmol,10mol•L-1的盐酸0.1VL的物质的量是Vmol,再稀释至1.5VL,所以C=
C1V1+C2V2
V=[0.5Vmol+Vmol/1.5L]=1mol/L,故B正确.
C、加热浓缩盐酸时,导致盐酸挥发增强,故C错误.
D、浓稀盐酸混合后,溶液的体积不是直接加和,所以混合后溶液的物质的量浓度不是原来的2倍,故D错误.
故选B.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查了物质的量浓度的计算,难度不大,易错选项是D,注意密度不同的溶液混合后,溶液的体积不能直接加和.1年前查看全部
- 将15mL 2mol•L-1 Na2CO3溶液逐滴加入到40mL 0.5mol•L-1
将15mL 2mol•L-1 Na2CO3溶液逐滴加入到40mL 0.5mol•L-1 MCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是( )
A. 4
B. 3
C. 2
D. 1 老款ss1年前1
老款ss1年前1 -
 yushuai1976 共回答了22个问题
yushuai1976 共回答了22个问题 |采纳率81.8%解题思路:根据Na2CO3溶液与MCln盐溶液反应时,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,利用化合价得出Mn+离子与nCO32-离子的关系,然后利用物质的量来计算解答.Na2CO3溶液中nCO32-离子的物质的量为15mL×10-3×2mol•L-1=0.03mol,
MCln盐溶液中Mn+离子的物质的量为40mL×10-3×0.5mol•L-1=0.02mol,
由反应中恰好将溶液中的Mn+离子完全沉淀为碳酸盐,及M的化合价为+n,
则Na2CO3与MCln反应对应的关系式为:
2Mn+~nCO32-
2 n
0.02mol 0.03mol
[2/n=
0.02mol
0.03mol],解得n=3,
故选:B.点评:
本题考点: 离子方程式的有关计算.
考点点评: 本题考查学生利用溶液中的离子之间的反应来进行简单计算,明确离子之间的关系是解答的关键,并应熟悉离子的物质的量的计算来解答即可.1年前查看全部
- 配制lOO mL 0.5mol•L-1碳酸钠溶液
配制lOO mL 0.5mol•L-1碳酸钠溶液
(1)配制碳酸钠溶液时需要用到的玻璃仪器有______(除托盘天平外,按实验使用先后顺序,写出主要四种)
(2)下列操作结果,导致配制溶液物质的量浓度结果偏低的是______
a.没有将洗涤液转移到容量瓶中
b.容量瓶洗净后未经干燥处理
e.转移过程中有少量的溶液溅出
d.摇匀后立即观察,发现溶液未达刻度线. 胖嘟嘟的猪1年前1
胖嘟嘟的猪1年前1 -
 wbjhome 共回答了22个问题
wbjhome 共回答了22个问题 |采纳率86.4%解题思路:(1)根据lOO mL 0.5mol•L-1碳酸钠溶液的正确步骤选择使用的仪器,并按实验使用先后顺序,找出四种只要的玻璃仪器;
(2)根据c=[n/V]可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.(1)配制100mL 0.5mol/LNa2CO3溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,按照试验操作顺序需要使用的仪器有:药匙、托盘天平(砝码、镊子)、烧杯、玻璃棒、100mL容量瓶、胶头滴管等,
故答案为:烧杯、玻璃棒、100mL容量瓶、胶头滴管;
(2)a.没有将洗涤液转移到容量瓶中,导致配制的溶液中溶质的物质的量偏小,根据c=[n/V]可得,配制的溶液浓度偏低,故a正确;
b.容量瓶洗净后未经干燥处理,对溶质和溶液的体积没有影响,根据c=[n/V]可得,不影响配制结果,故b错误;
e.转移过程中有少量的溶液溅出,导致配制的溶液中溶质的物质的量偏小,根据c=[n/V]可得,配制的溶液浓度偏低,故c正确;
d.摇匀后立即观察,发现溶液未达刻度线,导致配制的溶液体积偏小,根据c=[n/V]可得,配制的溶液浓度偏高,故d错误;
故选ac.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法,题目难度中等,注意掌握配制一定物质的量浓度的正确步骤及误差分析的方法与技巧;该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.1年前查看全部
- 一定体积的浓度为0.5mol•L-1的盐酸,欲使浓度增大1倍,选用的方法不可行的是( )
一定体积的浓度为0.5mol•L-1的盐酸,欲使浓度增大1倍,选用的方法不可行的是( )
A.通入一定量的标准状况下的HCl气体
B.加入一定体积的10 mol L -1 的盐酸
C.将溶液敞口加热浓缩至1 mol•L-1
D.加入一定体积的1.5 mol•L-1盐酸 wang_dh2440281年前1
wang_dh2440281年前1 -
 我要分七 共回答了19个问题
我要分七 共回答了19个问题 |采纳率89.5%解题思路:A、根据C=[n/V]计算判断;
B、根据C=
计算判断;c1V1+c2V2 V
C、加热时,盐酸会挥发;
D、根据C=
计算判断;c1V1+c2V2 V A、假设溶液体积为VL,通入标准状况下的HCl气体11.2VL,则物质的量是0.5Vmol,VL浓度为0.5mol•L-1的盐酸中溶质HCl的物质的量增大一倍,所以通入氯化氢后溶液的物质的量浓度增大一倍,故A正确.
B、假设溶液体积为VL,VL浓度为0.5mol•L-1的盐酸的物质的量是0.5Vmol,则10mol•L-1的盐酸0.1VL的物质的量是Vmol,再稀释至1.5VL,所以C=
c1V1+c2V2
V=[0.5V+V/1.5V]=1mol/L,方法可以达到浓度增大一倍的目的,故B正确.
C、加热浓缩盐酸时,导致盐酸挥发增强,故C错误.
D、假设溶液体积为VL,VL浓度为0.5mol•L-1的盐酸的物质的量是0.5Vmol,则1.5mol•L-1的盐酸VL的物质的量是1.5Vmol,溶液体积加水到2VL,所以C=
c1V1+c2V2
V═[0.5V+1,5V/2V]=1mol/L,方法可以达到浓度增大一倍的目的,故D正确.
故选C.点评:
本题考点: 物质的量浓度.
考点点评: 本题考查了物质的量浓度的计算,难度中等,注意密度不同的溶液混合后,溶液的体积不能直接加和,掌握基础是关键.1年前查看全部
- 实验室需要配制0.5mol•L-1的烧碱溶液500mL,根据溶液配制的过程,回答下列问题:
实验室需要配制0.5mol•L-1的烧碱溶液500mL,根据溶液配制的过程,回答下列问题:
(1)实验中除了托盘天平(带砝码)、药匙、量筒和玻璃棒外,还需要的其他玻璃仪器有:______;
(2)根据计算得知,所需NaOH固体的质量为______g;
(3)配制溶液的过程中,有以下操作.其中正确的是______(填代号).
A.将氢氧化钠固体放在纸片上称量
B.在烧杯中溶解氢氧化钠固体后,立即将溶液倒入容量瓶中
C.将溶解氢氧化钠的烧杯用蒸馏水洗涤2~3次,并将洗涤液转移到容量瓶中. 蛤蟆姑娘1年前1
蛤蟆姑娘1年前1 -
 爱_直至成伤 共回答了28个问题
爱_直至成伤 共回答了28个问题 |采纳率92.9%解题思路:(1)根据实验操作步骤以及玻璃仪器的作用选取仪器;
(2)依据m=cVM计算需要的氢氧化钠的质量;
(3)A.氢氧化钠具有腐蚀性,应放在小烧杯称量;
B.容量瓶为精密仪器不能盛放过热、过冷的液体;
C.配置过程应将全部溶质都转移到容量瓶.(1)配置0.5mol•L-1的烧碱溶液500mL,用500mL容量瓶配制溶液,用烧杯稀释浓硫酸,用胶头滴管定容,
故答案为:500ml容量瓶、烧杯、胶头滴管;
(2)配置0.5mol•L-1的烧碱溶液500mL,需要氢氧化钠的质量m=0.5mol•L-1×0.5L×40g/mol=10.0g;
故答案为:10.0;
(3)A.氢氧化钠具有腐蚀性,应用小烧杯称量,故A错误;
B.在烧杯中溶解氢氧化钠固体后,冷却到室温后将溶液倒入容量瓶中,故B错误;
C.将溶解氢氧化钠的烧杯用蒸馏水洗涤2~3次,并将洗涤液转移到容量瓶中,保证溶质全部转移的容量瓶,避免产生误差,故C正确;
故选:C.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制步骤以及用到的仪器,难度不大,注意实验的基本操作方法和注意事项.1年前查看全部
- 向600mL 0.5mol•L-1的硫酸溶液中加入一定量的Fe2O3、Cu的混合物,恰好使混合物完全溶解,所得
向600mL 0.5mol•L-1的硫酸溶液中加入一定量的Fe2O3、Cu的混合物,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
A.6.4g
B.4.8g
C.2.4g
D.1.6g 笑傲浆糊11年前1
笑傲浆糊11年前1 -
 电信小妹儿 共回答了14个问题
电信小妹儿 共回答了14个问题 |采纳率78.6%解题思路:Cu、Fe2O3的混合物中加入硫酸溶液,恰好使混合物完全溶解,所得溶液中不含Fe3+,溶液中溶质为CuSO4、FeSO4,该反应过程为:硫酸与氧化铁恰好反应,生成硫酸铁与水,生成的硫酸铁与铜恰好反应转化为CuSO4、FeSO4,由水的分子式H2O可知,故Fe2O3中n(O)=n(H2SO4),若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为Fe2O3中氧元素的质量.Cu、Fe2O3的混合物中加入硫酸溶液,恰好使混合物完全溶解,所得溶液中不含Fe3+,溶液中溶质为CuSO4、FeSO4,该反应过程为:硫酸与氧化铁恰好反应,生成硫酸铁与水,生成的硫酸铁与铜恰好反应转化为CuSO4、FeSO4,由...
点评:
本题考点: 有关混合物反应的计算;铁盐和亚铁盐的相互转变.
考点点评: 本题考查氧化还原反应及混合物的有关计算,难度中等,判断氧化物中氧原子的物质的量是解题的关键.1年前查看全部
- 在热的稀硫酸中溶解了11.4g FeSO4固体,当加入50mL 0.5mol•L-1 KN
在热的稀硫酸中溶解了11.4g FeSO4固体,当加入50mL 0.5mol•L-1 KNO3溶液时,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体.
(1)推算出x=______;y=______.
(2)配平该反应的方程式:FeSO4+______KNO3+______H2SO4═______K2SO4+______Fe2(SO4)3+______(NxOy)+______H2O(配平时x、y用具体数值表示,物质填在中).
(3)反应中氧化产物是______.
(4)用双线桥法表示该反应中的电子转移方向和数目:______. yinjian1111年前1
yinjian1111年前1 -
 娃哈哈zh 共回答了28个问题
娃哈哈zh 共回答了28个问题 |采纳率89.3%解题思路:(1)判断化合价降低的反应物是氧化剂、化合价升高的反应物是还原剂,根据氧化剂得到的电子等于还原剂失去的电子来求x和y;
(2)根据化合价升降总数相等和质量守恒来配平方程式;
(3)根据化合价升高的反应物是还原剂,其对应产物为氧化产物;
(4)双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子或原子团,要标明电子的得失字样及得失电子数目.(1)n(FeSO4)=11.4g/152g•mol-1=0.075mol,KNO3的物质的量为0.05L×0.5mol•L-1=0.025mol,设NO3-与NxOy中N元素化合价差为a,根据得失电子总数相等的原则,可得关系式:0.075×1=0.025×a,所以a=3即NxOy中N元素化合价为+2价,NxOy为NO,所以x=y=1,故答案为:1;1;
(2)FeSO4中铁的化合价由+2价升高为+3价,变化1,KNO3中氮的化合价由+5价降低为+2价,变化3,化合价升降总数相等和质量守恒来配平方程式:6FeSO4+2KNO3+4H2SO4=3Fe2(SO4)3+K2SO4+2NO↑+4H2O,故答案为:6;2;4;3;1;2;4;
(3)FeSO4中铁的化合价由+2价升高为+3价,是还原剂,所以对应的产物Fe2(SO4)3是氧化产物,故答案为:Fe2(SO4)3;
(4)双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子或原子团,要标明电子的得失字样及得失电子数目,此反应用双线桥法表示如下: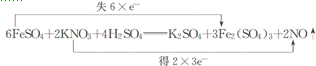 ,
,
故答案为: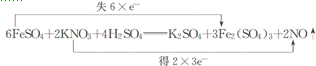 .
.点评:
本题考点: 氧化还原反应方程式的配平;氧化还原反应的计算.
考点点评: 本题主要考查了氧化还原反应的配平、氧化产物的判断及分析氧化还原反应用,难度不大,注意基础知识的掌握,明确元素的化合价变化来分析是解答本题的关键.1年前查看全部
- 一定温度下,1L0.5mol•L-1NH4Cl溶液与2L0.25mol•L-1NH4Cl溶液含N
一定温度下,1L0.5mol•L-1NH4Cl溶液与2L0.25mol•L-1NH4Cl溶液含NH4+物质的量不同.这句话对
请说明理由
这句话对吗?请说明理由 coolboypaul1年前1
coolboypaul1年前1 -
 yuhui860522 共回答了12个问题
yuhui860522 共回答了12个问题 |采纳率100%不对啊.其实就是0.5molNH4CL和0.5molNH4CL.NH4+物质的量是相同的1年前查看全部
- 实验需用480mL 0.5mol•L -1 CuSO 4 溶液,在配制Cu
实验需用480mL0.5mol•L -1 CuSO 4 溶液,在配制CuSO 4 溶液过程中下列说法正确的是( ) A.需用480mL的容量瓶 B.需称取38.4g无水CuSO 4 C.需称取62.5g的胆矾(CuSO 4 •5H 2 O) D.定容时,用玻璃棒引流小心将烧杯中的蒸馏水加至凹液面与刻度线相切  eternityfancy1年前1
eternityfancy1年前1 -
 xckuisadj 共回答了15个问题
xckuisadj 共回答了15个问题 |采纳率80%A、没有480ml容量瓶,应选择500ml容量瓶,故A错误;
B、实际配制溶液500ml,需无水CuSO 4 的质量为m=n(CuSO 4 )•M(CuSO 4 )=0.5L×0.5mol/L×160g/mol=40.0g,故B错误;
C、实际配制溶液500ml,需胆矾(CuSO 4 •5H 2 O)的质量为m=0.5L×0.5mol/L×250g/mol=62.5g,故C正确;
D、定容时,加水至刻度线1-2cm处,改用胶头滴管滴加至凹液面与刻度线相切,故D错误.
故选C.1年前查看全部
- 实验室欲配制100mL 0.5mol•L-1的Na2SO4溶液,试回答:
实验室欲配制100mL 0.5mol•L-1的Na2SO4溶液,试回答:
(1)实验中用不到的仪器是:______;
A.烧杯B.圆底烧瓶C.100mL容量瓶D.胶头滴管E.玻璃棒
(2)配制时应称取Na2SO4______g;
(3)在配制一定物质的量浓度溶液的实验中,下列操作会使所配溶液的浓度偏大的是______.
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液
B.未将洗涤烧杯内壁的溶液转移入容量瓶
C.定容时俯视液面
D.配制时容量瓶没有干燥. 心有方向1年前1
心有方向1年前1 -
 momo-5050 共回答了21个问题
momo-5050 共回答了21个问题 |采纳率76.2%解题思路:(1)根据配制一定物质的量浓度的溶液的步骤选择使用的仪器,然后判断用不到的仪器;
(2)根据ncV、m=nM计算出配制100mL 0.5mol•L-1的Na2SO4溶液需要硫酸钠的质量;
(3)根据c=[n/V]可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.(1)配制100mL 0.5mol•L-1的Na2SO4溶液的步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,使用的仪器有:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管等,所以选项中用不到的仪器为B 圆底烧瓶,
故答案为:B;
(2)100mL 0.5mol•L-1的Na2SO4溶液中含有硫酸钠的物质的量为:0.5mol•L-1×0.1L=0.05mol,需要硫酸钠的质量为:142g/mol×0.05mol=7.1g,
故答案为:7.1;
(3)A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏小,故A错误;
B.未将洗涤烧杯内壁的溶液转移入容量瓶,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏小,故B错误;
C.定容时俯视液面,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液的浓度偏大,故C正确;
D.配制时容量瓶没有干燥,对溶液的体积、溶质的物质的量没有影响,所以不影响配制结果,故D错误;
故选C.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,难易适中,注重灵活性,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.1年前查看全部
- 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
1把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
2把①所得溶液小心转人500mL容量瓶中;
3继续向容量瓶中加蒸馏水至液面距离刻度l~2cm处,改用胶头滴管小心滴加蒸
馏水至溶液凹液面底部与刻度线相切
4用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,
并轻轻摇匀;
5将容量瓶塞紧,充分摇匀.
请填写下列空白:
A.本实验所用氯化钠的质量为14.6g14.6g
B.实验操作步骤的正确顺序为(填序号)1→2→4→3→51→2→4→3→5
C.若出现如下情况,对所配溶液浓度将有何影响?(填偏高,偏低,无影响)
没有进行操作④偏低偏低;加蒸馏水时不慎超过了刻度线后吸出少许溶液偏低偏低.向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面偏低偏低.为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至容量瓶定容偏高偏高.定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度偏低偏低.定容时仰视偏低偏低. Lily_猪1年前1
Lily_猪1年前1 -
 曦约 共回答了20个问题
曦约 共回答了20个问题 |采纳率75%A、需氯化钠的质量为m=0.5L×0.5mol•L-1×58.5g/mol=14.6g.
故答案为:14.6g.
B、操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,用托盘天平(用到药匙)氯化钠,在烧杯中溶解,用玻璃棒搅拌,加速溶解,恢复到室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以实验操作步骤的正确顺序为1→2→4→3→5.
故答案为:1→2→4→3→5.
C、未洗涤烧杯、玻璃棒,少量氯化钠沾在烧杯壁与玻璃棒上,移入容量瓶中氯化钠的实际质量减小,溶液浓度偏低;
定容时,加水超过刻度线,使溶液的体积偏大,所配溶液浓度偏低,溶液是均匀的,再用胶头滴管吸出多余的部分,剩余溶液与所配溶液浓度相同,溶液浓度偏低;
不慎有液滴掉在容量瓶外面,移入容量瓶中氯化钠的实际质量减小,溶液浓度偏低;
液体具有热胀冷缩的性质,未冷却到室温,趁热将溶液到入容量瓶,并配成溶液,会导致溶液体积偏小,溶液浓度偏高;
摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低.
定容时仰视刻度,使溶液的体积偏大,所配溶液浓度偏低;
故答案为:偏低;偏低;偏低;偏高;偏低;偏低.1年前查看全部
- 一定条件下,可逆反应A2+B2⇌2AB达到化学平衡,经测定平衡时c(A2)=0.5mol•L-1,c(B2)=0.1mo
一定条件下,可逆反应A2+B2⇌2AB达到化学平衡,经测定平衡时c(A2)=0.5mol•L-1,c(B2)=0.1mol•L-1,c(AB)=1.6mol•L-1,若A2、B2、AB的起始浓度分别以a、b、c表示.请回答:
(1)a、b应满足的关系是______.
(2)a的取值范围是______. lumin55691年前2
lumin55691年前2 -
 cfgs 共回答了20个问题
cfgs 共回答了20个问题 |采纳率90%解题思路:(1)根据反应A2+B2⇌2AB及质量守恒定律,找出a、b的关系;
(2)根据a、c的关系,c取最小值时,a有最大值;按照计量数关系,假设反应物B2完全反应,a有最小值.(1)由反应A2+B2⇌2AB,将生成物A2、B2按照计量数转化为AB,A2的浓度始终比B2的浓度大0.5-0.1=0.4,即a、b满足关系:a-b=0.4,
故答案为:a-b=0.4;
(2)当c=0时,a有最大值,将c(AB)=1.6mol•L-1按照化学计量数转化成A2的浓度,最大值为0.5+[1/2]×1.6=1.3;
则有b=0时,a有最小值,按照化学计量数将c(A2)=0.5mol•L-1、c(B2)=0.1mol•L-1都转化成AB,a的最小值为0.5-0.1=0.4,
所以a的取值范围为:0.4≤a≤1.3,
故答案为:0.4≤a≤1.3.点评:
本题考点: 化学反应的可逆性;等效平衡.
考点点评: 本题考查了可逆反应特点及等效平衡知识,可以根据可逆反应的特点及题中数据进行分析,本题难度不大.1年前查看全部
- 在2A+B⇌3C+4D反应中,表示该反应速率最快的是( ) A.v(A)=0.5mol•L -1 •s -1 B.v(
在2A+B⇌3C+4D反应中,表示该反应速率最快的是( ) A.v(A)=0.5mol•L -1 •s -1 B.v(B)=0.3mol•L -1 •s -1 C.v(C)=0.8mol•L -1 •s -1 D.v(D)=1.6mol•L -1 •min -1  金海波20061年前1
金海波20061年前1 -
 lw2005chin 共回答了11个问题
lw2005chin 共回答了11个问题 |采纳率100%对于反应2A+B⇌3C+4D,都转化为D表示的速率进行比较,
A.v(A)=0.5mol/(L•s)=30mol/(L•min),反应速率之比等于其计量数之比,故V(D)=2V(A)=60mol/(L•min);
B.v(B)=0.3mol/(L•s)=18mol/(L•min);反应速率之比等于其计量数之比,故V(D)=4V(B)=72mol/(L•min);
C.V(C)=0.8mol/(L•s)=48mol/(L•min),反应速率之比等于其计量数之比,故V(D)=
4
3 V(A)=64mol/(L•min);
D.V(D)=1.6mol/(L•min),
故选:B.1年前查看全部
- 从100mL某种待测浓度的H2SO4溶液中取出25mL,加入10mL 0.5mol•L-1 BaCl
从100mL某种待测浓度的H2SO4溶液中取出25mL,加入10mL 0.5mol•L-1 BaCl2溶液,恰好完全反应.求:
①得到 BaSO4沉淀多少克?
②待测 H2SO4溶液中溶质的物质的量浓度是多少? 拽拽的法拉第1年前3
拽拽的法拉第1年前3 -
 progrem 共回答了16个问题
progrem 共回答了16个问题 |采纳率100%解题思路:发生反应:H2SO4 +BaCl2=BaSO4↓+2HCl,根据n=cV计算n(BaCl2),根据方程式计算n(BaSO4)、n(H2SO4),再根据m=nM计算m( BaSO4 ),根据c=[n/V]计算c( H2SO4 ).n(BaCl2)=0.01L×0.5mol/L=0.005mol,发生反应:H2SO4 +BaCl2=BaSO4↓+2HCl,由方程式可知:n(BaSO4)=n(H2SO4)=n(BaCl2)=0.005mol,
①m( BaSO4 )=0.005mol×233g/mol=1.165g,
②c( H2SO4 )=[0.005mol/0.025L]=0.2mol•L-1,
答:①得到 BaSO4沉淀是1.165克;
②待测 H2SO4溶液中溶质的物质的量浓度是0.2mol•L-1.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式有关计算,侧重对基础知识的巩固,注意对基础知识的理解掌握.1年前查看全部
- 向100mL 0.1mol•L-1的Al2(SO4)3溶液中,加入0.5mol•L-1的氢氧化钠溶液得到1.17克沉淀,
向100mL 0.1mol•L-1的Al2(SO4)3溶液中,加入0.5mol•L-1的氢氧化钠溶液得到1.17克沉淀,则需加入的氢氧化钠溶液的体积是多少?(强调要有解题过程)
 139as1年前1
139as1年前1 -
 不断mm 共回答了25个问题
不断mm 共回答了25个问题 |采纳率96%解题思路:根据Al2(SO4)3溶液与NaOH溶液的反应计算分析,100mL0.1mol/LAl2(SO4)3全转化为沉淀的质量为:0.1L×0.1mol/L×2×78g/mol=1.56g,由Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+2H2O,可知NaOH存在两种情况,一是不足,二是使Al(OH)3部分溶解,以此计算.在100ml 0.1mol/L的Al2(SO4)3溶液中加入0.5mol/L的NaOH溶液,如硫酸铝完全生成Al(OH)3,则沉淀的质量为:0.1L×0.1mol/L×2×78g/mol=1.56g,
而此时为1.17g,说明硫酸铝并没有完全转化为Al(OH)3,此时n(Al(OH)3)=[1.17g/78g/mol]=0.015mol,NaOH可能有两种情况,一是不足,二是使Al(OH)3部分溶解,
当NaOH不足时,
Al3++3OH-=Al(OH)3↓
3mol 1mol
x 0.015mol
则x=0.045mol,
V1(NaOH溶液)=[0.045mol/0.5mol/L]=0.09L=90mL,
如使Al(OH)3部分溶解,则
①Al3++3OH-=Al(OH)3↓
0.02mol 0.06mol
②Al(OH)3 +OH-=AlO2-+2H2O
1mol 1mol
(0.02-0.015)mol (0.02-0.015)mol=0.005mol
两步反应共需要0.06mol+0.005mol=0.065mol,
V2(NaOH溶液)=[0.065mol/0.5mol/L]=0.13L=130mL,
答:所加的NaOH溶液体积是90毫升或130毫升.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式的相关计算,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意判断硫酸铝反应的程度,为解答本题的关键,用讨论法解答.1年前查看全部
- 实验室需要0.1mol•L-1NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回
实验室需要0.1mol•L-1NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称).
(2)容量瓶不能用于______(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol•L-1(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度______0.1mol•L-1.
(4)根据计算得知,所需质量分数为98%、密度为1.84g•cm-3的浓硫酸的体积为______mL(计算结果保留一位小数).如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______. huang26952261年前1
huang26952261年前1 -
 66uit 共回答了18个问题
66uit 共回答了18个问题 |采纳率83.3%解题思路:(1)根据各仪器的作用选取仪器;
(2)容量瓶不能稀释浓溶液、不能用于溶解固体、储存溶液等;
(3)根据m=CVM计算氢氧化钠的质量,注意溶液的体积为500mL而不是450mL,根据C=[n/V]判断;
(4)先根据C=
计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算,根据浓硫酸的体积选取量筒规格,根据浓硫酸稀释时的正确操作解答.103ρw M (1)用容量瓶配制溶液,用胶头滴管定容;还需要用到的仪器有:溶解或稀释药品的烧杯、搅拌或引流用的玻璃棒,
故答案为:AC;烧杯和玻璃棒;
(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,故选BCF;
(3)m=CVM=0.1mol/L×0.5L×40g/mol=2.0g,若定容时仰视刻度线,溶液的体积偏大,则所得溶液浓度小于0.1mol•L-1,若NaOH溶液在转移至容量瓶时,洒落了少许,溶质的物质的量偏小,则所得溶液浓度 小于0.1mol•L-1,
故答案为:2.0;小于;小于;
(4)浓硫酸的浓度=C=
103ρw
M=
103×1.84×98%
98mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.5/L×0.5L,V=0.0136L=13.6mL,选取的量筒规格应该等于或大于量取溶液体积,故选15mL量筒,稀释浓硫酸的正确操作是:将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌,防止液体溅出,
故答案为:13.6;15;将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查一定物质的量浓度溶液的稀释,注意容量瓶、量筒规格的选取方法,并明确浓硫酸的稀释方法,为易错点.1年前查看全部
- 欲用98%的浓硫酸(密度:1.84g•cm-3)配制成浓度为0.5mol•L-1的稀硫酸500mL.
欲用98%的浓硫酸(密度:1.84g•cm-3)配制成浓度为0.5mol•L-1的稀硫酸500mL.
(1)选用的主要仪器有:
①______,②______,③______,④______,⑤______.
(2)请将下列各操作,按正确的序号填在横线上.
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线
D.稀释浓H2SO4
E.将溶液转入容量瓶
其操作正确的顺序依次为______.
(3)简要回答下列问题:①所需浓硫酸的体积为______mL. ②如果实验室有15mL、20mL、50mL的量筒应选用______mL的量筒最好.
(4)以下选填:(“偏高”、“偏低”、“无影响”)
A.量取时发现量筒不干净用水洗净后直接量取将使浓度______,
B.未经冷却就直接定容配置将使浓度______
C.配置时浓硫酸在空气中长时间放置______. 痛心痛得没同感1年前1
痛心痛得没同感1年前1 -
 paopao蔚 共回答了20个问题
paopao蔚 共回答了20个问题 |采纳率100%解题思路:(1)根据配制步骤是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
(3)先计算出浓硫酸的物质的量浓度为c=[1000ρω/M],然后根据溶液稀释定律C浓V浓=C稀V稀来计算;根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
(4)根据c=[n/V]并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.(1)操作步骤有计算、量取、稀释、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管.
故答案为:量筒;烧杯;玻璃棒;500mL容量瓶;胶头滴管;
(2)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是:ADECB,故答案为:ADECB;
(3)浓硫酸的物质的量浓度为c=[1000ρω/M]=[1000×1.84g/ml×98%/98g/mol]=18.4mol/L,设需要的浓硫酸额体积为Vml,根据溶液稀释定律C浓V浓=C稀V稀可知:
18.4mol/L×Vml=0.5mol•L-1×500mL,解得V=13.6mL,
根据“大而近”的原则,根据需要量取的浓硫酸的体积为13.6mL可知选用15mL量筒,故答案为:13.6;15;
(4)A.量取时发现量筒不干净用水洗净后直接量取,会导致浓硫酸被稀释,则所配制出的溶液的浓度偏低,故答案为:偏低;
B.未经冷却就直接定容配置将使浓度,待冷却后溶液体积偏小,则浓度偏高,故答案为:偏高;
C.配置时浓硫酸在空气中长时间放置会吸水,则浓硫酸浓度偏低,所配溶液的浓度偏低,故答案为:偏低.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.1年前查看全部
- 实验室要配制100mL 0.5mol•L-1的NaCl溶液,试回答下列各题:
实验室要配制100mL 0.5mol•L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,肯定不会用到的是______:A.锥形瓶 B.200mL容量瓶 C.量筒 D.胶头滴管E.100mL容量瓶F.天平
(2)若要实施配制,除上述仪器外,还缺少的仪器或用品是______.
(3)容量瓶上除有刻度线外还应标有______,容量瓶在使用前必须进行的一步操作是______.
(4)配制完毕后,老师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是______:
A.定容时仰视容量瓶刻度线B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液直接转入容量瓶后就进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(5)通过计算可得出可用托盘天平称取NaCl固体______克.若用4mol/L的NaCl浓溶液配制100mL 0.5mol•L-1的稀溶液,应用量筒量取______mL该浓溶液. 值Z得D1年前1
值Z得D1年前1 -
 我若为魔 共回答了26个问题
我若为魔 共回答了26个问题 |采纳率92.3%解题思路:(1)(2)根据配制溶液的实验操作过程选择所用仪器.
(3)容量瓶上标有刻度线、容积、使用温度.
配制最后需颠倒摇匀,使用容量瓶使用前必须检查是否漏水.
(4)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=[n/v]分析判断.
(5)根据n=cv计算氯化钠的物质的量,再根据m=nM计算所需氯化钠的质量.
根据溶液稀释前后溶质物质的量不变计算所需4mol/LNaCl浓溶液的体积.(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,用托盘天平称量氯化钠,用药匙取药品,在烧杯中溶解(可用量筒加水),用玻璃棒搅拌,加速溶解,恢复到室温后转移到100mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所用仪器有托盘天平、100mL容量瓶、烧杯、玻璃棒、胶头滴管、药匙等.
肯定不会用到仪器为:锥形瓶、200mL容量瓶.
故选:AB.
(2)由(1)中配制操作步骤可知,还需要的仪器有:烧杯、玻璃棒、药匙.
故答案为:烧杯、玻璃棒、药匙.
(3)容量瓶上标有刻度线、容积、使用温度.
配制最后需颠倒摇匀,使用容量瓶使用前必须检查是否漏水.
故答案为:容积、使用温度;查漏.
(4)A.定容时仰视容量瓶刻度线,导致溶液体积偏大,所配溶液浓度偏低;
B.定容时俯视容量瓶刻度线,导致溶液体积偏小,所配溶液浓度偏高;
C.未洗涤烧杯、玻璃棒,少量氯化钠沾在烧杯壁与玻璃棒上,移入容量瓶中氯化钠的实际质量减小,溶液浓度偏低;
D.摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低.
故选:B.
(5)若用氯化钠固体配制,需氯化钠的质量为m=0.1L×0.5mol•L-1×58.5g/mol=2.925g≈2.9g.
若用4mol/L的NaCl浓溶液配制,根据稀释定律,稀释前后溶质的物质的量不变,来计算4mol/L的NaCl浓溶液的体积,设4mol/L的NaCl浓溶液的体积为xmL,则xmL×4mol/L=100mL×0.5mol/L,解得:x=12.5,所以应量取4mol/L的NaCl浓溶液的体积是12.5mL.
故答案为:2.9g;12.5mL.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制,注意从c=[n/v]理解配制原理.1年前查看全部
- 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放人小烧杯中
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放人小烧杯中,加适量蒸馏水溶解;②把①所得溶液小心转人500mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距离刻度l-2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部,与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀.
请填写下列空白:
A.实验操作步骤的正确顺序为(填序号)______.
B.本实验用到的基本仪器有:托盘天平,药匙,烧杯,量筒,胶头滴管,______,______.
C.若出现如下情况,对所配溶液浓度将有何影响?(填:偏大,偏小或无影响)
(1)没有进行操作④______;
(2)加蒸馏水时不慎超过了刻度______.
(3)定容时俯视读数______;
(4)向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面______. jia3571年前1
jia3571年前1 -
 zte424 共回答了22个问题
zte424 共回答了22个问题 |采纳率95.5%解题思路:A.根据配制一定物质的量浓度溶液的一般步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作;
B.根据配制一定物质的量浓度的溶液的步骤确定所用仪器进行判断;
C.根据c=[n/V]进行误差分析,分析实验操作对溶质的物质的量n、和溶液的体积V产生的影响,凡是使n偏大或者V偏小的操作都会使所配溶液浓度偏大,凡是使n偏小或者使B偏大的操作都会使所配溶液的浓度偏小.A.配制一定物质的量浓度溶液的一般步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,所以实验操作步骤的正确顺序为①②④③⑤;
故答案为:①②④③⑤;
B.本实验用到的基本仪器有:托盘天平,药匙,烧杯,量筒,胶头滴管,500ml容量瓶,玻璃棒,故答案为:500ml容量瓶;玻璃棒;
C.根据c=[n/V]进行误差分析,凡是使n偏大或者V偏小的操作都会使所配溶液浓度偏大,凡是使n偏小或者使B偏大的操作都会使所配溶液的浓度偏小.
(1)没有进行操作④,则溶质的物质的量n偏小,溶液浓度偏小;
(2)加蒸馏水时不慎超过了刻度,则溶液的体积V偏大,溶液的浓度偏小;
(3)定容时俯视读数,则所加蒸馏水偏少,溶液的体积V偏小,溶液的浓度偏大;
(4)向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,则溶质的物质的量n偏小,溶液浓度偏小;
故答案为:偏小;偏小;偏大;偏小.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制有的物质的量浓度的溶液的方法及误差分析,题目难度不大,掌握配制一定物质的量浓度的溶液的步骤是解题关键,注意误差分析的方法与技巧.1年前查看全部
- 图示是某学校实验室从化学试剂商店买回来的硫酸试剂标签上的部分内容.某实验需要0.5mol•L-1 H2SO4溶
图示是某学校实验室从化学试剂商店买回来的硫酸试剂标签上的部分内容.某实验需要0.5mol•L-1 H2SO4溶液240mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:

①所需浓硫酸的体积是______ mL,若该硫酸与等体积的水混合后,所得溶液中溶质的质量分数______49%(填写“<”“=”或“>”).
②配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______. 浣花哥1年前1
浣花哥1年前1 -
 付申8 共回答了17个问题
付申8 共回答了17个问题 |采纳率88.2%解题思路:①根据c=[1000ρw/M]计算浓硫酸的物质的量浓度,没有240mL容量瓶,应选择250mL容量瓶,再根据稀释定律计算需要浓硫酸的体积;该硫酸与等体积的水混合后,所得溶液的质量小于原硫酸溶液质量的2倍,而溶质硫酸的质量不变;
②浓硫酸稀释:将浓硫酸沿器壁(或玻璃棒)慢慢注入水中,且边加边搅拌.①浓硫酸的物质的量浓度=[1000×1.84×98%/98]mol/L=18.4mol/L,没有240mL容量瓶,应选择250mL容量瓶,根据稀释定律,需要浓硫酸的体积=[250mL×0.5mol/L/18.4mol/L]=6.8mL;
该硫酸与等体积的水混合后,所得溶液的质量小于原硫酸溶液质量的2倍,而溶质硫酸的质量不变,所得溶液的质量分数>49%,
故答案为:6.8;>;
②浓硫酸稀释放出大量的热,将浓硫酸沿器壁(或玻璃棒)慢慢注入水中,且边加边搅拌,
故答案为:将浓硫酸沿器壁(或玻璃棒)慢慢注入水中,且边加边搅拌.点评:
本题考点: 溶液的配制.
考点点评: 本题考查溶液浓度计算、基本操作,比较基础,注意理解掌握物质的量浓度与质量分数之间的关系.1年前查看全部
- 已知:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,分别向1L 0.5moL•L-1的KO
已知:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,分别向1L 0.5moL•L-1的KOH溶液中加入①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应的中和热分别为△H1、△H2、△H3,他们的关系正确的是( )
A.△H1>△H3=-57.3 kJ•mol-1>△H2
B.△H2<△H1=-57.3 kJ•mol-1<△H3
C.△H1>△H3>△H2=-57.3 kJ•mol-1
D.△H2<△H3=-57.3 kJ•mol-1<△H2 tudi661年前1
tudi661年前1 -
 linet409 共回答了20个问题
linet409 共回答了20个问题 |采纳率90%解题思路:根据中和热是在稀溶液中强酸与强碱生成1molH2O放出的热量,注意弱电解质的电离吸热,浓硫酸溶于水放热来解答.强酸与强碱的稀溶液发生中和反应热效应表示为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,分别向1L 0.5mol/L的NaOH溶液中加入①稀醋酸 ②浓硫酸 ③稀硝酸,因浓硫酸溶于水放热,醋酸的电离吸热,则恰好完全反应时的放出的热量为②>③>①,但是焓变为负数,所以△H2<△H3<△H1;
故选:A.点评:
本题考点: 反应热的大小比较.
考点点评: 本题主要考查中和热,明确中和热的概念及弱电解质的电离、浓硫酸溶于水的热效应即可解答,需要注意的是放出的能量多,△H反而小.1年前查看全部
- 欲用18.4mol/L的浓硫酸配制浓度为0.5mol•L-1的稀硫酸500ml.
欲用18.4mol/L的浓硫酸配制浓度为0.5mol•L-1的稀硫酸500ml.
(1)①选用的主要仪器有:量筒、烧杯、______、______、胶头滴管.②所需浓硫酸的体积为______mL;
(2)在下列各操作中正确的序号是______
A.用量筒量取浓H2SO4B.反复颠倒摇匀 C.用胶头滴管加蒸馏水至刻度线 D.洗涤烧杯和玻璃棒并转入容量瓶E.将浓硫酸稀释后冷却F.将溶液转入容量瓶.
(3)在配制过程中将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌,若搅拌过程中有液体溅出结果会使浓度偏______;(填“高”、“低”或“无影响”,下同)定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度偏______. 苹果橙_1年前1
苹果橙_1年前1 -
 lzb19831014 共回答了17个问题
lzb19831014 共回答了17个问题 |采纳率76.5%解题思路:(1)根据配制一定物质的量浓度的溶液使用的仪器进行分析;根据溶液稀释过程中溶质硫酸的物质的量不变计算出需要浓硫酸的体积;
(2)根据配制一定物质的量的浓度溶液的方法进行排序;
(2)根据c=[n/V]分析操作对溶质的物质的量或对溶液的体积的影响判断;(1)配制0.5mol•L-1的稀硫酸500ml,使用的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还需要的仪器为:500mL容量瓶、玻璃棒,
配制0.5mol•L-1的稀硫酸500ml,溶液中含有的溶质硫酸的物质的量为:0.5mol•L-1×0.5L=0.25mol,需要浓度为18.4mol•L-1的浓硫酸体积为:[0.25mol/18.4mol/L]=0.01358L=13.6mL,
故答案为:500mL容量瓶、玻璃棒;13.6,
(2)配制步骤为:量取浓硫酸、浓硫酸的稀释、转移、定容、摇匀、转入试剂瓶,所以正确顺序为:AEFDCB,故答案为:AEFDCB;
(3)在配制过程中将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌,若搅拌过程中有液体溅出,会导致溶质硫酸的物质的量偏低,配制的溶液浓度偏低;
定容时必须使溶液凹液面与刻度线相切,若俯视,溶液的体积偏小,会使浓度偏高;
故答案为:低;高;点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查一定物质的量浓度溶液配制过程、物质的量浓度有关计算和误差分析等,难度不大,误差分析为易错点.1年前查看全部
- 下列溶液中,Na + 物质的量浓度最大的是( ) A.1mL 0.5mol•L -1
下列溶液中,Na + 物质的量浓度最大的是( ) A.1mL0.5mol•L -1 的NaNO 3 溶液 B.100mL0.01 mol•L -1 的NaCl溶液 C.10mL0.1mol•L -1 的NaOH溶液 D.100mL0.1mol•L -1 的Na 2 SO 4 溶液  爱上发呆1年前1
爱上发呆1年前1 -
 autumnqy 共回答了18个问题
autumnqy 共回答了18个问题 |采纳率88.9%A、1mL0.5mol•L -1 的NaNO 3 溶液中Na + 浓度为0.5mol/L×1=0.5mol/L;
B、100mL 0.01mol/LNaCl溶液中Na + 浓度为0.01mol/L×1=0.01mol/L;
C、10mL0.1mol•L -1 的NaOH溶液中Na + 浓度为0.1mol/L×1=0.1mol/L;
D、100mL 0.1mol/LNa 2 SO 4 溶液Na + 浓度为0.1mol/L×2=0.2mol/L;
故选A.1年前查看全部
- 在2A(g)+B(g)⇌3C(g)+4D(g)中,表示该反应速率最快的是( ) A.υ A =0.5mol•L -1
在2A(g)+B(g)⇌3C(g)+4D(g)中,表示该反应速率最快的是( ) A.υ A =0.5mol•L -1 •min -1 B.υ B =0.3mol•L -1 •min -1 C.υ C =0.8mol•L -1 •min -1 D.υ D =1mol•L -1 •min -1  泪珠乐儿1年前1
泪珠乐儿1年前1 -
 去年春天 共回答了27个问题
去年春天 共回答了27个问题 |采纳率81.5%对于反应2A+B⇌3C+4D,转化用D表示的速率进行比较,A、υ A =0.5mol•L -1 •min -1 ,速率之比等于化学计量数之比,故υ D =2υ A =2×0.5mol•L -1 •min -1 =1mol•L -1 •min -1 ,B、υ B =0.3mol•L -1 •...1年前查看全部
- 实验室需要0.1mol•L-1NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回
实验室需要0.1mol•L-1NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称).
(2)容量瓶不能用于______(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol•L-1(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度______0.1mol•L-1.
(4)根据计算得知,所需质量分数为98%、密度为1.84g•cm-3的浓硫酸的体积为______mL(计算结果保留一位小数).如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______.
在配制过程中,下列操作中,能引起误差偏高的有______(填代号).
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线. 500217441年前1
500217441年前1 -
 cjx_199 共回答了17个问题
cjx_199 共回答了17个问题 |采纳率100%解题思路:(1)根据溶液的配制步骤结合各仪器的构造及使用方法进行判断;
(2)根据容量瓶的构造及正确使用方法进行解答;
(3)实验室没有450mL容量瓶,需要选用500mL容量瓶,实际上配制的溶液为500mL 0.1mol/L的氢氧化钠溶液,根据n=cV计算出氢氧化钠的物质的量,再根据m=nM计算出氢氧化钠的质量;定容是仰视刻度线,导致加入的蒸馏水体积偏大;少量氢氧化钠溶液洒落,配制的溶液中氢氧化钠的物质的量偏小;
(4)根据c=[1000ρw/M]计算出浓硫酸的浓度,再根据溶液的稀释过程中溶质的物质的量不变计算出需要浓硫酸的体积,根据计算结果选用量筒规格;浓硫酸密度大于水,且稀释过程中放出大量热,应该将浓硫酸缓缓倒入水中;根据c=[n/V]可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.(1)A为平底烧瓶、C为分液漏斗,在配制一定浓度的溶液中不会用到烧瓶和分液漏斗;配制一定物质的量浓度的溶液需要的仪器有:托盘天平、量筒、烧杯、玻璃棒、容量瓶、胶头滴管等,还缺少的玻璃仪器为:烧杯和玻璃棒,
故答案为:AC;烧杯、玻璃棒;
(2)A.容量瓶为定容仪器,用于配制一定体积的、浓度准确的溶液,故A正确;
B.容量瓶只能用来配制一定体积准确浓度的溶液,不能用于贮存溶液,故B错误;
C.容量瓶不能配制或测量容量瓶规格以下的任意体积的液体,故C错误;
D.容量瓶能准确稀释某一浓度的溶液,故D正确;
E.容量瓶上有容积刻度线,可以量取一定体积的液体,故E族去;
F.容量瓶只能用于配制一定浓度的溶液,不能用来加热溶解固体溶质,故F错误;
故答案为:BCF;
(3)需要0.1mol/LNaOH溶液450mL,需要配制500mL 0.1mol/L的氢氧化钠溶液,需要氢氧化钠的物质的量为:0.1mol/L×0.5L=0.05mol,需要氢氧化钠的质量为:40g/mol×0.05mol=2.0g;
在实验中其他操作均正确,若定容时仰视刻度线,导致加入的蒸馏水体积偏大,配制的溶液体积偏大,则所得溶液浓度小于0.1mol•L-1;
若NaOH溶液在转移至容量瓶时,洒落了少许,导致配制的溶液中溶质的物质的量偏小,则所得溶液浓度小于0.1mol•L-1,
故答案为:2.0;小于;小于;
(4)98%、密度为1.84g/cm3的浓硫酸的物质的量浓度为:[1000×1.84×98%/98]mol/L=18.4mol/L,配制0.5mol/L硫酸溶液500mL,需要改浓硫酸的体积为:[0.5mol/L×0.5L/18.4mol/L]≈0.0136L=13.6mL;量取13.6mL浓硫酸,需要使用15mL量筒;
稀释浓硫酸的方法为:将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌;
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,热的溶液体积偏大,冷却后溶液体积变小,配制的溶液体积偏小,浓度偏高,故①正确;
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出,导致配制的溶液体积偏大,溶液的物质的量浓度偏低,故②错误;
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,导致配制的溶液体积偏大,溶液浓度偏低,故③错误;
④定容时,俯视刻度线,导致加入的蒸馏水体积大于容量瓶刻度线,配制的溶液体积偏小,溶液的物质的量浓度偏高,故④正确;
故答案为:13.6;15;将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌;①④.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法,试题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力,误差分析是本题难点,注意明确分析误差的方法与技巧.1年前查看全部
- 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
1把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
2把①所得溶液小心转人500mL容量瓶中;
3继续向容量瓶中加蒸馏水至液面距离刻度l~2cm处,改用胶头滴管小心滴加蒸
馏水至溶液凹液面底部与刻度线相切
4用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,
并轻轻摇匀;
5将容量瓶塞紧,充分摇匀.
请填写下列空白:
A.本实验所用氯化钠的质量为______
B.实验操作步骤的正确顺序为(填序号)______
C.若出现如下情况,对所配溶液浓度将有何影响?(填偏高,偏低,无影响)
没有进行操作④______;加蒸馏水时不慎超过了刻度线后吸出少许溶液______.向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面______.为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至容量瓶定容______.定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度______.定容时仰视______. ziyumo1年前1
ziyumo1年前1 -
 hhblue1980 共回答了25个问题
hhblue1980 共回答了25个问题 |采纳率80%解题思路:A、根据n=cv计算氯化钠的物质的量,再根据m=nM计算所需氯化钠的质量.
B、根据配制溶液的实验操作过程进行实验步骤排序.
C、分析操作对溶质的物质的量或对溶液的体积的影响,根据c=[n/v]分析判断.A、需氯化钠的质量为m=0.5L×0.5mol•L-1×58.5g/mol=14.6g.
故答案为:14.6g.
B、操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,用托盘天平(用到药匙)氯化钠,在烧杯中溶解,用玻璃棒搅拌,加速溶解,恢复到室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以实验操作步骤的正确顺序为1→2→4→3→5.
故答案为:1→2→4→3→5.
C、未洗涤烧杯、玻璃棒,少量氯化钠沾在烧杯壁与玻璃棒上,移入容量瓶中氯化钠的实际质量减小,溶液浓度偏低;
定容时,加水超过刻度线,使溶液的体积偏大,所配溶液浓度偏低,溶液是均匀的,再用胶头滴管吸出多余的部分,剩余溶液与所配溶液浓度相同,溶液浓度偏低;
不慎有液滴掉在容量瓶外面,移入容量瓶中氯化钠的实际质量减小,溶液浓度偏低;
液体具有热胀冷缩的性质,未冷却到室温,趁热将溶液到入容量瓶,并配成溶液,会导致溶液体积偏小,溶液浓度偏高;
摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低.
定容时仰视刻度,使溶液的体积偏大,所配溶液浓度偏低;
故答案为:偏低;偏低;偏低;偏高;偏低;偏低.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制,注意从c=[n/v]理解配制原理.1年前查看全部
- V L浓度为0.5mol•L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
V L浓度为0.5mol•L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
A.通入标准状况下的HCl气体11.2V L
B.加入10 mol•L-1的盐酸0.1V L,再稀释至1.5V L
C.将溶液加热浓缩到0.5V L
D.加入V L 1.5 mol•L-1的盐酸混合均匀 飘飞1年前1
飘飞1年前1 -
 uu要吃蛋炒饭 共回答了16个问题
uu要吃蛋炒饭 共回答了16个问题 |采纳率87.5%解题思路:A、根据c=[n/V]计算判断.
B、根据c=
计算判断.c1V1+c2V2 V
C、加热时,盐酸会挥发.
D、根据浓稀盐酸混合后体积是否变化判断.A、标准状况下的HCl气体11.2VL物质的量是0.5Vmol,向溶液中通入0.5VmolHCl,该溶液体积会增大,所以溶液浓度应该小于Vmol/L,故A错误;
B、VL浓度为0.5mol•L-1的盐酸的物质的量是0.5Vmol,10mol•L-1的盐酸0.1VL的物质的量是Vmol,再稀释至1.5VL,所以C=
c1V1+c2V2
V=[0.5Vmol+Vmol/1.5L]=1mol/L,故B正确;
C、加热浓缩盐酸时,导致盐酸挥发增强,故C错误;
D、浓稀盐酸混合后,溶液的体积不是直接加和,所以混合后溶液的物质的量浓度不是原来的2倍,故D错误;
故选B.点评:
本题考点: 物质的量浓度.
考点点评: 本题考查了物质的量浓度的计算,难度不大,易错选项是D,注意密度不同的溶液混合后,溶液的体积不能直接加和.1年前查看全部
- 在2A+B⇌3C+4D中,表示该反应速率最快的是( ) A.υ(A)=0.5mol•L -1 •min -1 B.υ(
在2A+B⇌3C+4D中,表示该反应速率最快的是( ) A.υ(A)=0.5mol•L -1 •min -1 B.υ(B)=0.2mol•L -1 •min -1 C.υ(C)=0.015mol•L -1 •s -1 D.υ(D)=1mol•L -1 •min -1  丢丢NIC1年前1
丢丢NIC1年前1 -
 5nq3qs 共回答了18个问题
5nq3qs 共回答了18个问题 |采纳率83.3%反应速率的单位相同,用各物质表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快,
A、v(A)=0.5mol•L -1 •min -1 ,A的化学计量数为2,故
v(A)
2 =
0.5mol• L -1 •mi n -1
2 =0.25mol/(L•min);
B、v(B)=0.2mol•L -1 •min -1 ,B的化学计量数为1,故
v(B)
1 =0.2mol•L -1 •min -1 ;
C、v(C)=0.015mol•L -1 •s -1 =υ(C)=0.9mol•L -1 •min -1 ,C的化学计量数为3,
v(C)
3 =0.3mol•L -1 •min -1 ;
D、v(D)=1mol•L -1 •min -1 ,D的化学计量数为4,故
v(D)
4 =0.25mol•L -1 •min -1 ;
所以反应速率v(C)>v(A)=v(D)>v(B),
故选C.1年前查看全部
- 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图坐标曲线来表示,回答下列问题:
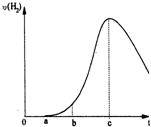
(1)曲线由0→a段不产生氢气的原因______,有关反应的离子方程式为______;
(2)曲线由a→b段产生氢气的速率较慢的原因______有关的化学方程式______;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因______;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因______. lasliesummer1年前3
lasliesummer1年前3 -
 jhwyc 共回答了17个问题
jhwyc 共回答了17个问题 |采纳率88.2%解题思路:由图可知,开始不生成氢气,为氧化铝与硫酸的反应,然后Al与硫酸反应生成氢气,开始温度较低,由于反应放热,则温度升高反应速率加快,后来,氢离子浓度减小,则反应速率减小,以此来解答.(1)曲线由0→a段不产生氢气是因氧化铝与硫酸反应生成硫酸铝和水,离子反应为Al2O3+6H+=2Al3++3H2O,
故答案为:氧化铝与硫酸反应生成硫酸铝和水;Al2O3+6H+=2Al3++3H2O;
(2)曲线由a→b段产生氢气的速率较慢是因开始时温度较低,反应速率较慢,发生2Al+3H2SO4=Al2(SO4)3+3H2↑,
故答案为:开始时温度较低;2Al+3H2SO4=Al2(SO4)3+3H2↑;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因为该反应为放热反应,温度升高,反应速率加快,故答案为:该反应为放热反应;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因为氢离子浓度减小,反应速率减小,故答案为:氢离子浓度减小.点评:
本题考点: 铝的化学性质;化学反应速率的影响因素.
考点点评: 本题考查Al的化学性质及影响反应速率的因素,为高频考点,把握温度、浓度对反应速率的影响及氧化铝、Al与酸的反应为解答的关键,侧重分析能力的考查,题目难度不大.1年前查看全部
- 在Cl-浓度为0.5mol•L-1的某无色澄清溶液中,还可能含有下表中的若干种离子.
在Cl-浓度为0.5mol•L-1的某无色澄清溶液中,还可能含有下表中的若干种离子.
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).阳离子 K+ Al3+ Mg2+ Ba2+Fe3+ 阴离子 NO3- CO32- SiO32- SO42- OH-
请回答下列问题.序号 实验内容 实验结果 Ⅰ 向该溶液中加入足量稀盐酸 产生白色沉淀并放出标准状况下0.56L气体 Ⅱ 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 固体质量为2.4g Ⅲ 向Ⅱ的滤液中滴加BaCl2溶液 无明显现象
(1)通过以上实验能确定一定不存在的离子是______.
(2)实验Ⅰ中生成沉淀的离子方程式为SiO32-+2H+
H2SiO3↓△ .SiO32-+2H+.
H2SiO3↓△ .
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满).
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:______.阴离子 浓度c/(mol•L-1) ①______ ______ ②______ ______ ③ ______ ④ ______ ⑤ ______  王紫君1年前1
王紫君1年前1 -
 矫情倦客 共回答了22个问题
矫情倦客 共回答了22个问题 |采纳率81.8%解题思路:由题意知溶液为无色澄清溶液,一定不含Fe3+,且溶液中含有的离子必须能大量共存.由实验Ⅰ可知,该溶液中一定含有CO32-,其浓度为
=0.25mol/L,则一定没有Al3+、Mg2+、Ba2+;由生成白色沉淀判断溶液中一定含有SiO32-,发生反应SiO32-+2H+=H2SiO3↓,SiO32-的浓度为0.56L 22.4L/mol 0.1L
=0.4mol/L.由实验Ⅲ可知溶液中不含SO42-,根据电荷守恒2c(CO32-)+2c(SiO32-)+c(Cl-)=2×0.25mol/L+2×0.4mol/L+0.5mol•L-1=1.8mol/L,因此溶液中一定含有K+,且其浓度至少为1.8mol/L,不能确定NO3-是否存在,以此来解答.2.4g 60g/mol 0.1L 由题意知溶液为无色澄清溶液,一定不含Fe3+,且溶液中含有的离子必须能大量共存.由实验Ⅰ可知,该溶液中一定含有CO32-,其浓度为
0.56L
22.4L/mol
0.1L=0.25mol/L,则一定没有Al3+、Mg2+、Ba2+;由生成白色沉淀判断溶液中一定含有SiO32-,发生反应SiO32-+2H+=H2SiO3↓,SiO32-的浓度为
2.4g
60g/mol
0.1L=0.4mol/L.由实验Ⅲ可知溶液中不含SO42-,根据电荷守恒2c(CO32-)+2c(SiO32-)+c(Cl-)=2×0.25mol/L+2×0.4mol/L+0.5mol•L-1=1.8mol/L,因此溶液中一定含有K+,且其浓度至少为1.8mol/L,不能确定NO3-是否存在,
(1)由上述分析可知,一定不含Al3+、Mg2+、Ba2+、Fe3+、SO42-,故答案为:Al3+、Mg2+、Ba2+、Fe3+、SO42-;
(2)实验Ⅰ中生成沉淀的离子方程式为为SiO32-+2H+
△
.
H2SiO3↓,故答案为:SiO32-+2H+
△
.
H2SiO3↓;
(3)由上述分析可知,c(CO32-)=0.25mol/L,c(SiO32-)=0.4mol/L,
故答案为:
阴离子CO32-SiO32-
c/(mol•L-1)0.250.4(4)由2c(CO32-)+2c(SiO32-)+c(Cl-)=2×0.25mol/L+2×0.4mol/L+0.5mol•L-1=1.8mol/L,根据电荷守恒可知溶液中一定含有K+,且其浓度至少为1.8mol/L,
故答案为:存在,由电荷守恒可知最小浓度为1.8 mol•L-1.点评:
本题考点: 无机物的推断.
考点点评: 本题考查离子的推断,为高频考点,把握离子的颜色、离子之间的反应为解答的关键,侧重分析、推断及计算能力的综合考查,题目难度不大.1年前查看全部
- (2014•济南模拟)在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶
 (2014•济南模拟)在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是( )
(2014•济南模拟)在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是( )
A.该中和滴定过程,最宜用石蕊作指示剂
B.图中点②所示溶液中,c(CH3COO-)=c(Na+)
C.图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度
D.滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在 郁芙1年前1
郁芙1年前1 -
 二万起步 共回答了21个问题
二万起步 共回答了21个问题 |采纳率100%解题思路:A.在酸碱中和滴定的实验中,一般不用石蕊作指示剂,主要原因是:石蕊的“红色→紫色”、“紫色→蓝色”的颜色变化不够明显,不利于及时、准确地作出酸碱是否恰好完全中和的判断;
B.在②处溶液的pH=7,溶液显示中性,根据电荷守恒可以判断c(CH3COO-)=c(Na+);
C.①点时溶液显示酸性,氢离子抑制了水的电离,而在③点醋酸和氢氧化钠恰好反应生成醋酸钠,醋酸根离子水解促进了水的电离;
D.根据电荷守恒可知,溶液中一定不会出现c(Na+)>c(CH3COO-)>c(H+)>c(OH-).A.中和滴定中,由于其颜色变化不明显,一般不选用石蕊作指示剂,可以选用酚酞作指示剂,故A错误;
B.图中点②所示溶液中,溶液显示中性,则c(OH-)=c(H+),根据电荷守恒可知:c(CH3COO-)=c(Na+),故B正确;
C.图中点①所示溶液中,氢离子抑制了水的电离,导致水的电离程度减小,而在点③所示溶液中,溶质为醋酸钠,醋酸根离子水解促进了水的电离程度,所以水的电离程度:①<③,故C错误;
D.若溶液中离子浓度存在c(Na+)>c(CH3COO-)>c(H+)>c(OH-),则不满足电荷守恒,故D错误;
故选B.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查酸碱混合溶液定性判断及溶液中离子浓度大小比较,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,注意电荷守恒、物料守恒、盐的水解等在比较离子浓度大小中的应用方法.1年前查看全部
- 在热的稀硫酸溶液中溶解了11.4g FeSO4,当加入50mL 0.5mol•L-1KNO3溶液后,
在热的稀硫酸溶液中溶解了11.4g FeSO4,当加入50mL 0.5mol•L-1KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3溶液也完全反应,并有NxOy气体逸出,则该NxOy是( )
A.N2O
B.NO
C.N2O3
D.NO2 zhangyu1091年前1
zhangyu1091年前1 -
 wangyiyumuzi 共回答了19个问题
wangyiyumuzi 共回答了19个问题 |采纳率73.7%解题思路:先根据化合价的升降判断氧化剂和还原剂,然后根据氧化还原反应中得失电子数相等判断该氧化物的化学式.该反应中,Fe2+失电子Fe3+,所以硫酸亚铁作还原剂;硝酸中氮元素得电子化合价降低作氧化剂;
硫酸亚铁的物质的量=[11.4g /152g/mol]=0.075mol,所以硫酸亚铁生成硫酸铁失去0.075mol电子;
根据氧化还原反应中得失电子数相等可知,硝酸中氮元素得到0.075mol电子,硝酸的物质的量=硝酸钾的物质的量=0.5mol•L-1 ×0.05L=0.025mol,
所以硝酸的物质的量和电子的物质的量之比=0.025mol:0.075mol=1:3,既一个氮原子得到3个电子变成+2价,所以该氮的氧化物是NO,
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应,明确氧化还原反应中得失电子相等是解本题的关键,难度不大.1年前查看全部
- 一定量的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)⇌zC(g)达到平衡后,测得A浓度为0.5mol•L-1
一定量的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)⇌zC(g)达到平衡后,测得A浓度为0.5mol•L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A浓度为0.3mol•L-1,则下列叙述正确的是( )
A. 平衡向正反应方向移动
B. x+y<z
C. C的体积分数降低
D. B的转化率提高 happybottle1年前5
happybottle1年前5 -
 shushii 共回答了13个问题
shushii 共回答了13个问题 |采纳率92.3%解题思路:保持温度不变,将容器的体积扩大两倍,如平衡不移动,A的浓度为0.25mol/L,小于实际A的浓度变为0.3mol/L,说明平衡向生成A的方向移动,即向逆反应移动,据此结合选项解答.保持温度不变,将容器的体积扩大两倍,如平衡不移动,A的浓度为0.25mol/L,小于实际A的浓度变为0.3mol/L,说明平衡向生成A的方向移动,即向逆反应移动,
A、由上述分析可知,平衡向逆反应移动,故A错误;
B、增大体积,压强减小,平衡向逆反应移动,压强减小平衡向气体物质的量增大的方向移动,即x+y>z,故B错误;
C、平衡向逆反应移动,减小压强平衡向气体物质的量增大的方向移动,气体的物质的量增大,C物质的量减小,故C的体积分数下降,故C正确;
D、平衡向逆反应方向移动,B的转化率降低,故D错误;
故选C.点评:
本题考点: 化学平衡的影响因素;化学平衡建立的过程.
考点点评: 本题考查化学平衡移动,难度中等,利用假设法判断平衡移动方向是解题关键.1年前查看全部
- 将碳酸钠晶体和碳酸氢钠的混合物ng溶于水制成200mL溶液,钠离子的物质的量浓度为0.5mol•L-1,若将ng该混合物
将碳酸钠晶体和碳酸氢钠的混合物ng溶于水制成200mL溶液,钠离子的物质的量浓度为0.5mol•L-1,若将ng该混合物用酒精灯加热至质量不再改变时,得到的固体物质的质量可能是( )
A. 3.1g
B. 5.3g
C. 9.0g
D. 11.0g wyy8209281年前3
wyy8209281年前3 -
 秦域恶狼 共回答了17个问题
秦域恶狼 共回答了17个问题 |采纳率76.5%解题思路:根据钠离子的物质的量守恒计算加热后固体的质量.n(Na+)=0.2L×0.5mol/L=0.1mol,
解热时:2NaHCO3
△
.
Na2CO3+CO2+H2O,最后剩余固体为Na2CO3,
根据钠离子的物质的量守恒,
则有:n(Na2CO3)=[1/2]n(Na+)=0.05mol,
m(Na2CO3)=0.05mol×106g/mol=5.3g,
故选B.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的计算,题目难度不大,注意从钠离子的物质的量守恒的角度解答较为简单.1年前查看全部
- 将一定质量的金属钠放入100ml 0.5mol•L -1 的氯化铝溶液中,反应中溶液先
将一定质量的金属钠放入100ml0.5mol•L -1 的氯化铝溶液中,反应中溶液先产生沉淀后又逐渐溶解,当沉淀恰好完全溶解时,则此时反应的金属钠的质量至少是( ) A.7.9克 B.4.6克 C.3.45克 D.1.15克  dudu01281年前1
dudu01281年前1 -
 duhjen 共回答了14个问题
duhjen 共回答了14个问题 |采纳率71.4%钠先和水反应生成氢氧化钠和氢气,氢氧化钠和氯化铝反应生成氢氧化铝和氯化钠,氢氧化铝是两性氢氧化物,能和氢氧化钠反应生成偏铝酸钠和水,所以当沉淀恰好完全溶解时,溶液中的溶质是氯化钠和偏铝酸钠,所以根据钠原子守恒计算钠的质量.
有关方程式为:2Na+2H 2 O=2NaOH+H 2 ↑①、3NaOH+AlCl 3 =Al(OH) 3 ↓+3NaCl②、Al(OH) 3 +NaOH=NaAlO+2H 2 O③,
设此时反应的金属钠的质量至少是x,
方程式①×2+②+③得方程式:4Na+2H 2 O+AlCl 3 =NaAlO+3NaCl+2H 2 ↑
92g 1mol
x0.5mol•L -1 ×0.1L
x=4.6g.
故选B.1年前查看全部
- (2013•福建模拟)把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液
 (2013•福建模拟)把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是( )
(2013•福建模拟)把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是( )
A.t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B.t由b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低
D.t=c时反应处平衡状态 shistone11年前1
shistone11年前1 -
 315157 共回答了18个问题
315157 共回答了18个问题 |采纳率88.9%解题思路:A、根据铝的表面有一层致密的氧化膜;
B、金属和酸的反应是放热反应,根据温度对化学反应速率的影响分析;
C、溶液的浓度影响化学反应速率;
D、反应不是化学平衡,t=c时温度影响最大.A、因铝的表面有一层致密的Al2O3能与HCl反应得到盐和水,无氢气放出,发生的反应为Al2O3+6HCl=2AlCl3+3H2O,故A正确;
B、在反应过程中,浓度减小,反应速率减小,但反应放热,溶液温度升高,反应速率加快,且后者为主要因素,故B正确;
C、随着反应的进行,溶液中的氢离子浓度逐渐降低,所以反应速率逐渐减小,故C正确;
D、反应不是化学平衡,随反应进行反应放热对速率的影响比浓度减少的影响大,当t=c时温度影响最大,t>c时温度影响不是主要因素,浓度减少是主要因素,故D错误;
故选D.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题主要考查了影响化学反应速率的因素,关键是分析图象结合外界条件对化学反应速率的影响等知识点来解答,难度不大.1年前查看全部
- 一定条件下,可逆反应A2+B2⇌2AB达到化学平衡,经测定平衡时c(A2)=0.5mol•L-1,c(B2)=0.1mo
一定条件下,可逆反应A2+B2⇌2AB达到化学平衡,经测定平衡时c(A2)=0.5mol•L-1,c(B2)=0.1mol•L-1,c(AB)=1.6mol•L-1,若A2、B2、AB的起始浓度分别以a、b、c表示.请回答:
(1)a、b应满足的关系是______.
(2)a的取值范围是______. 绕寒池1年前1
绕寒池1年前1 -
 平飞 共回答了10个问题
平飞 共回答了10个问题 |采纳率100%解题思路:(1)根据反应A2+B2⇌2AB及质量守恒定律,找出a、b的关系;
(2)根据a、c的关系,c取最小值时,a有最大值;按照计量数关系,假设反应物B2完全反应,a有最小值.(1)由反应A2+B2⇌2AB,将生成物A2、B2按照计量数转化为AB,A2的浓度始终比B2的浓度大0.5-0.1=0.4,即a、b满足关系:a-b=0.4,
故答案为:a-b=0.4;
(2)当c=0时,a有最大值,将c(AB)=1.6mol•L-1按照化学计量数转化成A2的浓度,最大值为0.5+[1/2]×1.6=1.3;
则有b=0时,a有最小值,按照化学计量数将c(A2)=0.5mol•L-1、c(B2)=0.1mol•L-1都转化成AB,a的最小值为0.5-0.1=0.4,
所以a的取值范围为:0.4≤a≤1.3,
故答案为:0.4≤a≤1.3.点评:
本题考点: 化学反应的可逆性;等效平衡.
考点点评: 本题考查了可逆反应特点及等效平衡知识,可以根据可逆反应的特点及题中数据进行分析,本题难度不大.1年前查看全部
- 实验室要配制100mL 0.5mol•L-1的NaCl溶液,试回答下列各题.
实验室要配制100mL 0.5mol•L-1的NaCl溶液,试回答下列各题.
(1)经计算,应该用托盘天平称取NaCl固体______g.
(2)若用NaCl固体配制溶液,需使用的玻璃仪器有______
(3)配制过程有以下操作:A.移液,B.称量,C.洗涤,D.定容,E.溶解,F.摇匀.其正确的操作顺序应是______ (填序号).
(4)下列操作会导致所得溶液浓度偏低的是______(填序号).
A.称量时,左边的托盘放砝码,右边的托盘放NaCl固体
B.定容时仰视容量瓶刻度线
C.将溶解未冷却的溶液转入容量瓶后就直接定容
D.定容后,把容量瓶倒转摇匀后发现液面低于刻度线,便补充几滴水至刻度处. 4383121481年前1
4383121481年前1 -
 mej2395 共回答了24个问题
mej2395 共回答了24个问题 |采纳率91.7%解题思路:(1)根据m=CVM计算溶质的质量;
(2)根据各仪器的作用选取仪器;
(3)实验操作的步骤:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作进行排序;
(4)根据c=[n/V]分析判断误差,如果n偏小或V偏大则配制溶液浓度偏低.(1)m=CVM=0.5mol/L×0.1L×58.5g=2.9g,故答案为:2.9;
(2)该实验中需要烧杯溶解药品,需要玻璃棒搅拌和引流,需要100mL容量瓶配制溶液,需要胶头滴管定容,
故答案为:烧杯、玻璃棒、100mL容量瓶、胶头滴管;
(3)实验操作的步骤:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作进行排序,所以其排列顺序是:B→E→A→C→D→F,故答案为:B→E→A→C→D→F;
(4)A.称量时,左边的托盘放砝码,右边的托盘放NaCl固体,导致溶质的质量偏小,则配制溶液浓度偏低;
B.定容时仰视容量瓶刻度线,溶液体积偏大,配制溶液浓度偏低;
C.将溶解未冷却的溶液转入容量瓶后就直接定容,溶液体积偏小,配制溶液浓度偏高;
D.定容后,把容量瓶倒转摇匀后发现液面低于刻度线,便补充几滴水至刻度处,溶液体积偏大,配制溶液浓度偏低;
故选ABD.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查一定物质的量浓度溶液的配制,注意书写容量瓶时要注明规格,为易错点.1年前查看全部
- 下列溶液中,跟100mL 0.5mol•L-1NaCl溶液所含的Cl-物质的量浓度相同的是( )
下列溶液中,跟100mL 0.5mol•L-1NaCl溶液所含的Cl-物质的量浓度相同的是( )
A. 100mL 0.5mol•L-1MgCl2溶液
B. 200mL 0.25mol•L-1CaCl2溶液
C. 50mL 1mol•L-1NaCl溶液
D. 25mL 0.5mol•L-1HCl溶液 笑忘书W1年前2
笑忘书W1年前2 -
 lhk304 共回答了16个问题
lhk304 共回答了16个问题 |采纳率87.5%解题思路:100mL0.5mol/L NaCl溶液所含的Cl-的物质的量浓度0.5mol/L,根据溶液中溶质的浓度和溶质的构成进行计算.溶液所含的Cl-物质的量浓度与溶液的体积无关.100mL0.5mol/L NaCl溶液所含的Cl-的物质的量浓度0.5mol/L,
A.100ml0.5mol/LMgCl2溶液中c(Cl-)=2×0.5mol/L=1mol/L,故A错误;
B.200mL 0.25mol•L-1CaCl2溶液中c(Cl-)=2×0.25mol/L=0.5mol/L,故B正确;
C.50mL 1mol•L-1NaCl溶液c(Cl-)=1mol/L,故C错误;
D.25mL 0.5mol•L-1HCl溶液c(Cl-)=0.5mol/L,故D正确.
故选BD.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度的计算,题目难度不大,本注意离子浓度与溶质的浓度的关系即可解答,离子浓度与溶液体积无关.1年前查看全部
- 实验室要用98%的浓硫酸(密度为1.84g•ml-1)配制0.5mol•L-1硫酸溶液480ml,选用的主要仪器有烧杯、
实验室要用98%的浓硫酸(密度为1.84g•ml-1)配制0.5mol•L-1硫酸溶液480ml,选用的主要仪器有烧杯、胶头滴管、玻璃棒、量筒,还缺少( )
A.容量瓶
B.250ml容量瓶
C.分液漏斗
D.500ml容量瓶 钓鱼对话1年前1
钓鱼对话1年前1 -
 WANGMIAO818210 共回答了20个问题
WANGMIAO818210 共回答了20个问题 |采纳率90%解题思路:操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,根据配制一定物质的量浓度的溶液的操作步骤选择仪器.操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,
由提供的仪器可知还需要仪器有:500mL容量瓶.
故选D.点评:
本题考点: 不能加热的仪器及使用方法.
考点点评: 本题考查配制一定物质的量浓度的溶液中选用仪器的方法,题目难度中等,注意掌握物质的量浓度与溶质质量分数之间的转化,明确配制一定物质的量浓度的溶液方法及选用仪器规格的原则.1年前查看全部
- 图示是某学校实验室从化学试剂商店买回来的硫酸试剂标签上的部分内容.某实验需要0.5mol•L-1 H2SO4溶液240m
图示是某学校实验室从化学试剂商店买回来的硫酸试剂标签上的部分内容.某实验需要0.5mol•L-1 H2SO4溶液240mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84g•cm-3
质量分数:98%
①所需浓硫酸的体积是______mL,若该硫酸与等体积的水混合后,所得溶液中溶质的质量分数______
49%(填写“<”“=”或“>”).
②配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______. wh太阳鸟1年前1
wh太阳鸟1年前1 -
 西安兆隆7 共回答了19个问题
西安兆隆7 共回答了19个问题 |采纳率89.5%解题思路:①根据c=[1000ρω/M]计算浓硫酸的物质的量浓度,没有240mL容量瓶,应选择250mL容量瓶,再根据稀释定律计算需要浓硫酸的体积;该硫酸与等体积的水混合后,所得溶液的质量小于原硫酸溶液质量的2倍,而溶质硫酸的质量不变;
②浓硫酸稀释:将浓硫酸沿器壁(或玻璃棒)慢慢注入水中,且边加边搅拌.①浓硫酸的物质的量浓度=[1000×1.84×98%/98]mol/L=18.4mol/L,没有240mL容量瓶,应选择250mL容量瓶,根据稀释定律,需要浓硫酸的体积=[250mL×0.5mol/L/18.4mol/L]=6.8mL;
该硫酸与等体积的水混合后,所得溶液的质量小于原硫酸溶液质量的2倍,而溶质硫酸的质量不变,所得溶液的质量分数>49%,
故答案为:6.8;>;
②浓硫酸稀释:将浓硫酸沿器壁(或玻璃棒)慢慢注入水中,且边加边搅拌,故答案为:将浓硫酸沿器壁(或玻璃棒)慢慢注入水中,且边加边搅拌.点评:
本题考点: 物质的量浓度的相关计算;配制一定物质的量浓度的溶液.
考点点评: 本题考查溶液浓度计算、基本操作,比较基础,注意理解掌握物质的量浓度与质量分数之间的关系.1年前查看全部
大家在问
- 1等差数列{an}的前n项和为sn,若a1=1,ak=19,sk=100,则k=
- 2为舟曲的同胞祈福 作文
- 3几何证明如图,等腰直角三角形ABC中,角BAC等于90度,D、E分别为AB、AC上一点,且BD=AB/3,AE等于AC/
- 4安塞腰鼓句子赏析指出下列句子运用的修辞方法,分析其作用.(1)交织!旋转!凝聚!奔突!辐射!翻飞!升华!(2)好一个安塞
- 5请问汽油燃烧用哪种灭火器灭火?
- 6化工塑料里PVCA全称是什么?
- 7一道应用动量守恒和动能的二维上的碰撞物理题
- 8Shuxuw高二已知圆m:(x 1)2 y2=1,圆n:(x-1)2 y2=9,动圆p与圆m外切并且与圆n内切,圆心p的
- 91路车每15分发一辆,3路车12分发一辆从早上6时发出第一辆车,到晚上8时发出最后一辆车.
- 10英语翻译美术有很多种形式,我最喜欢的是素描.因为素描是一种自然美,它诠释的是人性的光芒~也许就是那么一个不经意的细节,就
- 11《天方夜谭》又称《一千零一夜》,《阿里巴巴和四十大盗》《阿拉丁和神灯》等脍炙人口的故事都出自其中。这本书是 [
- 12(2011•普陀区一模)已知在△ABC中,AB=20,AC=12,BC=16,点D是射线BC上的一点(不与端点B重合),
- 13多元线性回归 spss中分析后 f值 与谁去比较呢?f下角0.05( ,)括号里的,逗号左边的是回归,还是残差的自由度吗
- 14孔子 的一句话 大致意思是 批评德行高的人 可以打骂 批评心胸狭隘的人 只能慢慢的解释
- 15阅读下面的小令,完成14~15题。(8分)
