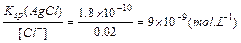沉淀法可出去下列哪些物质A悬浮在水中的杂质 B溶解在水中的杂质 D较重的杂质 个人认为是A
 zxf0002022-10-04 11:39:544条回答
zxf0002022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 192595 共回答了21个问题
192595 共回答了21个问题 |采纳率95.2%- D
悬浮就没法沉淀,不是A - 1年前
 凡心1980 共回答了666个问题
凡心1980 共回答了666个问题 |采纳率- 选择:D
A是悬浮的杂质,密度比水小,沉淀不下去。 - 1年前
 街边的茉莉 共回答了2个问题
街边的茉莉 共回答了2个问题 |采纳率- D,
- 1年前
 jxboy3721 共回答了40个问题
jxboy3721 共回答了40个问题 |采纳率- 应该选择B。沉淀法应该指通过加入化学试剂而生成沉淀,从而除去杂质的方法。比如溶液中溶解了Ca2+,就可以加入碳酸钠来除去。A和D通过离心沉降的方式就可以除去。
- 1年前
相关推荐
- 用沉淀法除杂质时,是否可以用反复沉淀的方法把杂志基本除尽?
 fkgg1年前1
fkgg1年前1 -
 遁逃 共回答了15个问题
遁逃 共回答了15个问题 |采纳率100%需要沉淀的离子一般在溶液里面存在浓度达到10 的-5次方以下,我们就当它已经完全沉淀了,反复沉淀没有必要,可以取上层清液来检验是否残有离子.1年前查看全部
- 有机溶剂沉淀法的原理是什么有关生化分离工程的知识怎么没有人来回答啊,郁闷!
 ZiMing梓铭1年前1
ZiMing梓铭1年前1 -
 dccoolb 共回答了20个问题
dccoolb 共回答了20个问题 |采纳率85%①亲水性有机溶剂加入溶液后降低了介质的介电常数,使溶质分子之间的静电引力增加,聚集形成沉淀;②水溶性有机溶剂本身的水合作用降低了自由水的浓度,压缩了亲水溶质分子表面原有水化层的厚度,降低了它的亲水性,导致脱水凝集1年前查看全部
- (2004•东城区二模)工业上用沉淀法生产的轻质碳酸钙是极细的粉末,是制造牙膏的原料之中.某学生设计了一种用沉淀法制备碳
(2004•东城区二模)工业上用沉淀法生产的轻质碳酸钙是极细的粉末,是制造牙膏的原料之中.某学生设计了一种用沉淀法制备碳酸钙的实验方案,实验过程的主要步骤如下:


(1)实验中还得到二种物质是______和______(写化学式).
(2)请你仍用石灰石为原料(其他试剂自选),设计另一种用沉淀法制备碳酸钙的实验方案,简要写出实验过程的主要步骤.
(3)你设计的方案的优点是______. tiantian450541年前1
tiantian450541年前1 -
 清如月 共回答了21个问题
清如月 共回答了21个问题 |采纳率90.5%解题思路:(1)由题中实验方案可知:石灰石高温生成二氧化碳和氧化钙,石灰水和碳酸钠溶液生成碳酸钙和氢氧化钠,推得实验中得到二种物质.
(2)此题是利用石灰石来制取纯净的碳酸钙.设计实验方案:石石灰石
生石灰高温
石灰水加水
碳酸钙通入二氧化碳
(3)根据(2)中的实验设计,解答.(1)由题中实验方案:石灰石→高温生石灰→加水石灰水→加碳酸钠溶液碳酸钙,可知:
高温分解石灰石制得生石灰和二氧化碳:CaCO3
高温
.
CaO+CO2↑;在生石灰中加水制石灰水;CaO+H2O=Ca(OH)2
③石灰水中加入碳酸钠溶液制碳酸钙:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH所以实验中得到二种物质是二氧化碳和氢氧化钠;
故答案为:CO2、NaOH
(2)设计实验方案:石灰石
高温
生石灰
加水
石灰水
通入二氧化碳
碳酸钙 故答案为:石灰石
高温
生石灰
加水
石灰水
通入二氧化碳
碳酸钙
(3)此方案的优点是二氧化碳得以充分利用,节约原料;
故答案为:二氧化碳得以充分利用,节约原料.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;化学实验方案设计与评价.
考点点评: 本题主要①探究实验的步骤,合理的设计实验方案和评价,正确的加以分析,培养学生分析问题的能力;1年前查看全部
- 沉淀法制备CeO2-ZrO2固溶体用氨水沉淀加入的量以及分散剂的量是多少?
 恋雨er1年前1
恋雨er1年前1 -
 离黎 共回答了25个问题
离黎 共回答了25个问题 |采纳率88%我做过ZrO2的 当时加入聚乙二醇(分散剂)的用量是所用氧氯化锆的7%,氨水的用量不固定,只要通过氨水、把pH控制在10左右就行.1年前查看全部
- (2014•浦东新区二模)不考虑现代物理手段,溶液中离子的定性检验有三种基本方法,①沉淀法(观察反应中沉淀的发生或消失)
(2014•浦东新区二模)不考虑现代物理手段,溶液中离子的定性检验有三种基本方法,①沉淀法(观察反应中沉淀的发生或消失)、②气体法(观察反应中气体的产生及其验证)、③显色法(观察颜色变化).溶液中下列离子的检验或鉴别有以上两种基本方法可供选择的是( )
A.Al3+
B.Na+
C.I-
D.CO32- wodetiannei1年前1
wodetiannei1年前1 -
 在水一方却上心头 共回答了15个问题
在水一方却上心头 共回答了15个问题 |采纳率73.3%解题思路:铝离子的检验方法只有沉淀法、钠离子的检验只有显色法(焰色反应),而碘离子可以通过沉淀法和显色法检验,碳酸根离子可以通过测定法和气体法检验,据此进行解答.A.铝离子的检验方法只有一种,为沉淀法,选用的试剂为强碱溶液,故A错误;
B.检验钠离子的方法只有焰色反应,即显色法,故B错误;
C.检验碘离子,可以使用硝酸银溶液,反应生成碘化银沉淀,即沉淀法,也可以使用淀粉和氯水检验,即显色法,故C正确;
D.检验碳酸根离子,可以通过生成沉淀检验,即沉淀法,也可以通过检验生成二氧化碳气体检验,即气体法,故D正确;
故选CD.点评:
本题考点: 常见离子的检验方法.
考点点评: 本题考查了常见离子的检验方法,题目难度不大,注意掌握常见离子的性质及检验方法,正确理解题干信息是解答本题的关键.1年前查看全部
- 用沉淀法测定NaHCO3和K2CO3混合物的组成.实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相
用沉淀法测定NaHCO3和K2CO3混合物的组成.实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相
同浓度的Ba(OH)2溶液500mL,每次实验均充分反应.实验记录如下:
实验次数样品质量/g沉淀质量/g
12.223.94
23.33
34.447.88
45.557.88
回答下列问题:
(1)第2次实验中产生沉淀质量是多少.
(2)Ba(OH)2溶液中溶质的物质的量浓度是多少.
(3)第2次实验样品中NaHCO3的物质的量是多少. winson161年前1
winson161年前1 -
 快门碎了 共回答了26个问题
快门碎了 共回答了26个问题 |采纳率96.2%(1) 由第三和第四次结果可知,第三组实验是恰好完全反应,所以前三组数据成倍数关系,可得:(5.156+11.302)/2=8.247;
(2) 当所有碳酸根转化为沉淀时,所需Ba+离子完全来自于Ba(OH)2,可求n(Ba+)=11.032/197=0.056mol 再算浓度c(Ba+)=0.056/(50*0.001)=1.12mol/L;
(3) 设碳酸氢钠 x mol ,碳酸钾 y mol
列方程组可知:x+y=0.056
84x+138y=6.864 求出x=0.016 y=0.04 样品中NaHCO3和K2CO3的物质的量之比是 2:5;1年前查看全部
- 沉淀法!金属离子沉淀法,等电点沉淀法,盐酸盐沉淀法,有机溶剂沉淀法的定义优缺点!
 apple120ren1年前1
apple120ren1年前1 -
 82300360 共回答了18个问题
82300360 共回答了18个问题 |采纳率88.9%金属离子沉淀法纯度高,太耗电.等电点装置复杂,也比较纯.盐酸盐的电解装置不好清洗.最后一种成本低,有毒.1年前查看全部
- 用沉淀法测定NaHCO3和K2CO3 混合物的组成.
用沉淀法测定NaHCO3和K2CO3 混合物的组成.
实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液500mL,每次实验均充分反应.实验记录如下:
实验次数 样品质量/g 沉淀质量/g
1 0.858 1.379
3 2.574 4.137
4 3.432 5.516
5 4.290 5.516
⒈ 第二次实验中产生沉淀质量是多少?
⒉ Ba(OH)2 溶液中溶质的物质的量浓度是多少?
⒊ 通过计算确定样品中NaHCO3和K2CO3的物质的量之比是多少? ljx9510191年前1
ljx9510191年前1 -
 cangranke7797 共回答了23个问题
cangranke7797 共回答了23个问题 |采纳率87%1.m=1.379*2=2.758g
2.c=5.516/197*0.5=0.056mol/L
3.NaHCO3:xmol;K2CO3:ymol
84x + 138y = 0.858;x + y = 1.379/197 = 0.0071年前查看全部
- 气浮法与沉淀法相比,各有何优缺点?
 柔情萨克斯1年前1
柔情萨克斯1年前1 -
 单影无人13 共回答了19个问题
单影无人13 共回答了19个问题 |采纳率100%气浮法:能够分离那些颗粒密度接近或者小于水的细小颗粒,适用于活性污泥絮体不易沉淀或易于产生膨胀的情况,但是产生微细气泡需要能量,经济成本较高.
沉淀法:能够分离那些颗粒密度大于水能沉降的颗粒,而且固液的分离一般不需要能量,但是一般沉淀池的占地面积较大.1年前查看全部
- (2002•重庆)工业上用沉淀法生产的轻质碳酸钙是极细的粉末,是制造牙膏的原料之一.某学生设计了一种用沉淀法制备碳酸钙的
(2002•重庆)工业上用沉淀法生产的轻质碳酸钙是极细的粉末,是制造牙膏的原料之一.某学生设计了一种用沉淀法制备碳酸钙的实验方案:
石灰石
生石灰高温
石灰水加水
碳酸钙加碳酸钠溶液
(1)上述方案中还可得到的另外两种生成物是______.
(2)请你仍用石灰石为原料(其他试剂自选),设计另一种用沉淀法制备碳酸钙的实验方案,简要写出实验过程的主要步骤以及每一步反应的化学方程式.
(3)你设计的方案的优点是:______. cbpeb1年前1
cbpeb1年前1 -
 沉默的烟头 共回答了16个问题
沉默的烟头 共回答了16个问题 |采纳率100%解题思路:(1)由题中实验方案:石灰石
生石灰高温
石灰水加水
碳酸钙,可知:石灰石高温生成二氧化碳和氧化钙,石灰水和碳酸钠溶液生成碳酸钙和氢氧化钠.加碳酸钠溶液
(2)此题是利用天然矿物质石灰石来制取纯净的碳酸钙.设计实验方案:石灰石
氯化钙溶液加盐酸
碳酸钙加碳酸钠溶液
(3)根据(2)中的实验设计,解答.(1)由题中实验方案:石灰石
高温
生石灰
加水
石灰水
加碳酸钠溶液
碳酸钙,可知:
①高温分解石灰石制生石灰和二氧化碳:CaCO3
高温
.
CaO+ CO2↑
②在生石灰中加水制石灰水;CaO+H2O=Ca(OH)2
(2)设计实验方案:石灰石
加盐酸
氯化钙溶液
加碳酸钠溶液
碳酸钙
①在石灰石中加盐酸制氯化钙溶液;CaCO3+2HCl=CaCl2+H2O+CO2↑
②在氯化钙溶液中加入碳酸钠溶液制碳酸钙.CaCl2+Na2CO3=CaCO3↓+2NaCl
故答案:(1)CO2、NaOH
第一种方法:
(2)①在石灰石中加盐酸制氯化钙溶液;CaCO3+2HCl=CaCl2+H2O+CO2↑
②在氯化钙溶液中加入碳酸钠溶液制碳酸钙.CaCl2+Na2CO3=CaCO3↓+2NaCl
(3)不需要高温,节约能量
第二种方法:
(2)①高温分解石灰石制生石灰和二氧化碳;CaCO3
高温
.
CaO+ CO2↑
②在生石灰中加水制石灰水;CaO+H2O=Ca(OH)2
③把二氧化碳通入石灰水制碳酸钙.Ca(OH)2+CO2=CaCO3↓+H2O
(3)二氧化碳得以充分利用,节约原料.点评:
本题考点: 实验步骤的探究;化学实验方案设计与评价;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要①探究实验的步骤,合理的设计实验方案和评价.②正确的书写化学方程式.1年前查看全部
- 、用沉淀法测定NaHCO3 和K2CO3混合物的组成.实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度
、用沉淀法测定NaHCO3 和K2CO3混合物的组成.实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液500mL,每次实验均充分反应.实验记录如下:
实验次数 样品质量/g 沉淀质量/g
1 1.716 2.758
2 2.574
3 3.432 5.516
4 4.290 5.516
回答下列问题:
(1)第2次实验中产生沉淀的质量是 4.137
(2)Ba(OH)2溶液的物质的量浓度为_____0.056_______
(3)第2次样品中含NaHCO3的物质的量为___0.006
我用3算出来都对的 可是为什么不可以用1来算?1里面那个Ba(OH)2是过量的 但是沉淀不过量啊 我设NaHCO3 和K2CO3分别为x ymol
联立方程得到 x+y=0.014 84x+138y=1.176为什么这里算出来x=0.014 y=0呢?只要告诉我为什么这样子错?为什么y会等于0? 大家都作粉1年前1
大家都作粉1年前1 -
 yuanfen200401 共回答了15个问题
yuanfen200401 共回答了15个问题 |采纳率100%a(oh)2的量不同跟nahco3反应生成的沉淀也不一样,有可能生成baco3,也有可能是ba(hco3)2,或两者的混合物.1年前查看全部
- 化学的一些概念不清楚请问沉淀法、过滤法、蒸馏法它们分别适用于什么与什么之间的分离,若蒸馏法适用于液体之间的分离,那么食盐
化学的一些概念不清楚
请问沉淀法、过滤法、蒸馏法它们分别适用于什么与什么之间的分离,若蒸馏法适用于液体之间的分离,那么食盐和水为什么不能用蒸馏法,而用结晶法? 丽莉少志1年前1
丽莉少志1年前1 -
 0菜花0 共回答了12个问题
0菜花0 共回答了12个问题 |采纳率91.7%沉淀:溶解度比较低的固体分离 过滤法:适合液体和悬浮固体分离,蒸馏,适合有不同沸点的液体分离. 蒸馏纯食盐水是可行的,但耗能太大,时间太长,不如结晶法经济实用.要考虑性价比呀. 而且可以知道如何炼制海盐的(海盐里还有镁盐等杂质,只能用结晶法) 最后祝您学习愉快. 很欣赏您这样善于思考和提问的朋友.1年前查看全部
- 离子检验的常用方法有三种: 检验方法 沉淀法 显色法 气体法 含义 反应中有沉淀产生或溶解 反应中有颜色变化 反应中有气
离子检验的常用方法有三种:
下列离子检验的方法不合理的是( )检验方法 沉淀法 显色法 气体法 含义 反应中有沉淀产生或溶解 反应中有颜色变化 反应中有气体产生 A.NH 4 + :气体法 B.I - :沉淀法 C.Fe 3+ :显色法 D.Ca 2+ :气体法  karena791年前1
karena791年前1 -
 fjhvbjh 共回答了18个问题
fjhvbjh 共回答了18个问题 |采纳率94.4%A、氨气为碱性气体,在NH 4 + 离子与碱在加热条件下生成氨气,用湿润的红色石蕊试纸检验,故A正确;
B、I - 离子与Ag + 离子反应生成黄色AgI沉淀,并且不溶于硝酸,故B正确;
C、在含有Fe 3+ 离子的溶液中加入KSCN溶液,反应后溶液呈红色,这是Fe 3+ 离子的特征反应,故C正确;
D、实验室检验Ca 2+ 离子常利用碳酸钙难溶于水进行检验,不可能生成气体,故D错误.
故选D.1年前查看全部
- (2006•玄武区二模)工业上用沉淀法生产的轻质碳酸钙是极细的粉末,是制造牙膏的原料之一.某学生设计了一种用沉淀法制备碳
(2006•玄武区二模)工业上用沉淀法生产的轻质碳酸钙是极细的粉末,是制造牙膏的原料之一.某学生设计了一种用沉淀法制备碳酸钙的实验方案,其流程图如下:
石灰石
生石灰高温
石灰水加水
碳酸钙加碳酸钠溶液
(1)写出上述方案中涉及的化学方程式:CaCO3
CaO+CO2↑高温 .CaCO3,______,______.
CaO+CO2↑高温 .
(2)请你仍用石灰石为原料(其他试剂自选),设计另一种用沉淀法制备碳酸钙的实验方案,用流程图简要写出实验过程的主要步骤.
(3)你设计的方案的优点是______. 2st_half_year1年前1
2st_half_year1年前1 -
 A错觉 共回答了21个问题
A错觉 共回答了21个问题 |采纳率76.2%解题思路:根据物质的性质进行分析,碳酸钙高温能分解生成氧化钙,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀,氢氧化钙能与二氧化碳反应生成碳酸钙.(1)碳酸钙高温能分解生成氧化钙和二氧化碳,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以本题答案为:CaCO3
高温
.
CaO+CO2↑,
CaO+H2O═Ca(OH)2,Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)乙石灰石为原料,高温分解生成的氧化钙与水反应生成氢氧化钙,然后向其中通入二氧化碳即可生成碳酸钙,所以本题答案为:石灰石
高温
生石灰
加水
石灰水
通入二氧化碳
碳酸钙;
(3)这样做能将石灰石分解生成的二氧化碳直接利用,节约原料,且减少了二氧化碳的排放,所以本题答案为:节约原料,减少二氧化碳的排放.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;化学实验方案设计与评价;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了常见物质间的转化,完成此题,可以依据已有的物质的性质进行,要求同学们加强物质性质的识记,以便灵活应用.1年前查看全部
- 某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol•L-1.排放前拟用沉淀法除去这两种离子,查找
某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol•L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(1)你认为往废水中投入______(填字母序号),沉淀效果最好.难溶电解质 AgI AgOH Ag2S PbI2 Pb(OH)2 PbS Ksp 8.3×10-17 5.6×10-8 6.3×10-50 7.1×10-9 1.2×10-15 3.4×10-23
A.NaOHB.KIC. K2SD.Ca(OH)2
(2)如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为1.17%(ρ=1g•mL-1).若环境要求排放标准为c(Ag+)低于1.0×10-8 mol•L-1,问该工厂处理后的废水中c(Ag+)=______;[已M(NaCl)=58.5g•mol-1,Ksp(AgCl)=1.8×10-10 mol2•L-2]______(填“能”或“否”)达到排放标准. jnbuqing1年前1
jnbuqing1年前1 -
 nig2158 共回答了24个问题
nig2158 共回答了24个问题 |采纳率79.2%解题思路:(1)根据表格中的溶度积及溶度积越小时沉淀效果越好来分析;
(2)根据氯离子的浓度及氯化银的溶度积来计算.(1)由表格中的溶度积数据可知,Ag2S和PbS的溶度积最小,则加入K2S沉淀效果最好,故答案为:C;
(2)废水中NaCl的质量分数为1.17%(ρ=1g•mL-1),c(Cl-)=c(NaCl)=[1000×1g/mL×1.17%/58.5g/mol]=0.2mol/L,
Ksp(AgCl)=c(Ag+)•c(Cl-)=1.0×10-10mol2•L-2,
则c(Ag+)=
1.8×10−10
0.2=9×10-9mol•L-1,环境要求排放标准为c(Ag+)低于1.0×10-8 mol•L-1,9.0×10-9 mol•L-1<1.0×10-8 mol•L-1,
故答案为:9×10-9mol•L-1;能.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题较难,考查学生应用电离平衡常数、溶度积来分析解决问题,注重了对数据的分析和应用,较好的训练学生分析解决问题的能力.1年前查看全部
- 离子检验常用的方法有三种:下列离子检验的方法不合理的是( ) 检验方法 沉淀法 显色法 气体法 含义 反应中沉淀产生或
离子检验常用的方法有三种:下列离子检验的方法不合理的是( )
检验方法 沉淀法 显色法 气体法 含义 反应中沉淀产生或溶解 反应中有颜色变化 反应中有气体产生
A.NH4+-气体法
B.I--沉淀法
C.Fe3+-显色法
D.SO42--气体法 功夫小子8881年前1
功夫小子8881年前1 -
 温柔aa 共回答了19个问题
温柔aa 共回答了19个问题 |采纳率89.5%解题思路:A、铵离子检验方法是加入强碱生成氨气;
B、I-检验是生成了碘化银沉淀;
C、Fe3+的检验是加入硫氰化钾,显示血红色;
D、SO42-检验是生成了硫酸钡沉淀.A、铵离子的检验方法:取样品加入试管配成溶液,加入浓氢氧化钠溶液,加热,在试管口放一片湿润的红色石蕊试纸,若变蓝,故应该是气体法,故A正确;
B、检验碘离子利用的是生成碘化银沉淀,故是沉淀法,故B正确;
C、三价铁离子的检验是滴加硫氰化钾,反应中有颜色变化,故所以显色法,故C正确;
D、SO42-检验是加稀盐酸和氯化钡溶液,生成了硫酸钡沉淀,所以是沉淀法,故D错误;
故选D.点评:
本题考点: 常见离子的检验方法.
考点点评: 本题考查离子的检验,注重信息的分析、理解能力,难度中等.1年前查看全部
- 下列离子检验方法不合理的是A.铵根离子——气体法B.碘离子——沉淀法C.钙离子——气体法
 赌坊1年前1
赌坊1年前1 -
 killer0054 共回答了25个问题
killer0054 共回答了25个问题 |采纳率84%选C,钙元素不能通过气体法检验,需要通过沉淀法检验.
A.NH4+可以通过与碱溶液反应,然后用红色的石蕊试纸检验,变蓝证明含有NH4+.
B.I-可以通过加稀硝酸酸化的AgNO3,产生黄色沉淀,证明有I-.
C.Ca2+可以通过加Na2CO3溶液产生沉淀证明.1年前查看全部
- 高中化学上的混合物分离和提纯中的转换法和沉淀法是什么?
高中化学上的混合物分离和提纯中的转换法和沉淀法是什么?
各举一个例子来看看!
、
3Q3Q 合英1年前3
合英1年前3 -
 shawuqing 共回答了22个问题
shawuqing 共回答了22个问题 |采纳率100%过滤和蒸发1年前查看全部
- 气相法白碳黑和沉淀法的有什么不同
气相法白碳黑和沉淀法的有什么不同
不用说成分和生产上的不同,详细说用途上的,对产品影响的大小,在涂料和107硅胶上的,我现在用的是沉淀法的 改成气相的除了多花钱还有别的不令人满意的地方吗
 北岸哥哥1年前1
北岸哥哥1年前1 -
 石头ii02 共回答了17个问题
石头ii02 共回答了17个问题 |采纳率94.1%气相法生产的白炭黑和沉淀法生产的白炭黑本质上没有区别,化学名都是二氧化硅.但气相法生产是使用四氯化硅和空气燃烧所得的二氧化硅,细度达1000目以上,沉淀法生产是使用硅酸钠里加入硫酸后使二氧化硅沉淀出来.细度只有300-400目.气相法白炭黑生产的白炭黑价格昂贵,不容易吸湿.使用在涂料做消光剂.沉淀法白炭黑价钱便宜,容易吸湿.只能用在橡胶,塑料制品填充,补强1年前查看全部
- 如何用沉淀法分离蛋白质和酶
 hktianya1年前2
hktianya1年前2 -
 铁无情 共回答了21个问题
铁无情 共回答了21个问题 |采纳率81%问题矛盾,酶本身就是一种蛋白质,
如果根据其不同的分子量和电荷数,可将其层析开来.
如果这个酶的参数你已经知道,那可以选用HPLC进行分离.1年前查看全部
- 离子检验的常用方法有三种: 检验方法 沉淀法 显色法 气体法 含义 反应中有沉淀产生或溶解 反应中有颜色变化 反应中有气
离子检验的常用方法有三种:
下列离子检验的方法不合理的是检验方法 沉淀法 显色法 气体法 含义 反应中有沉淀产生或溶解 反应中有颜色变化 反应中有气体产生
A.NH 4 + — 气体法 B.Cl - — 沉淀法
C.Fe 3 + — 显色法D.SO 4 2- — 气体法 keepcool1年前1
keepcool1年前1 -
 苏家学校 共回答了18个问题
苏家学校 共回答了18个问题 |采纳率88.9%D
1年前查看全部
- 絮凝剂中硫酸根离子怎么测定?要定量测定,而且絮凝剂溶解在水中很粘稠,用沉淀法没法过滤。
 娜娜52011年前1
娜娜52011年前1 -
 孤歌牧雪 共回答了11个问题
孤歌牧雪 共回答了11个问题 |采纳率100%应该加硝酸钡生成沉淀,再加稀硝酸,若沉淀不溶解,则有硫酸根离子.不知道对不对,1年前查看全部
- 沉淀法,过滤法和蒸馏法净化水的优点和不足
 3975513421年前1
3975513421年前1 -
 鲨鱼宝宝儿 共回答了16个问题
鲨鱼宝宝儿 共回答了16个问题 |采纳率81.3%沉淀法:可以是大颗粒的固体杂质清除,但是无法清除水中的小颗粒.
过滤法:可以将小颗粒的固体杂质清除,但是无法清除溶于水的物质.
蒸馏法:最干净的清理方式,但是效率不高.且当液体混在水中时无法分离,必须利用不同液体沸点不同的方式分离.1年前查看全部
- 用沉淀法、过滤法和蒸馏法净化水,效果最好的是过滤法.这句话为什么错误,应如何改正?
 错事1年前2
错事1年前2 -
 MaryM 共回答了25个问题
MaryM 共回答了25个问题 |采纳率84%用过滤法只能除掉水中不溶性的杂质,水中还有一些可溶性的杂质,
采用蒸馏法,把温度控制在水底沸点进行蒸馏,就可以得到的是纯净的水-------蒸馏水1年前查看全部
- (2014•宜春模拟)某同学用沉淀法测定Na2CO3和NaOH混合物中NaOH的质量分数,有关叙述如下.
(2014•宜春模拟)某同学用沉淀法测定Na2CO3和NaOH混合物中NaOH的质量分数,有关叙述如下.
①可以使用MgCl2溶液作沉淀剂,使OH-转化为氢氧化镁沉淀
②检验CO32-是否完全沉淀的操作方法是取上层清液,向其中继续滴加沉淀剂溶液,观察是否有沉淀继续生成
③用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是能提高实验结果的准确度
④用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是CO32-能100%转化为沉淀.其中正确的叙述是( )
A.①②
B.②③
C.①③④
D.都正确 秕谷1年前1
秕谷1年前1 -
 闫安迷926 共回答了22个问题
闫安迷926 共回答了22个问题 |采纳率95.5%解题思路:①使用MgCl2溶液作沉淀剂,氢氧化镁比MgCO3更难溶,OH-转化为沉淀;
②取上层清液中加沉淀剂,生成沉淀则没有沉淀完全,否则沉淀完全;
③用BaCl2溶液代替CaCl2溶液作沉淀剂,可排除氢氧化钙对实验的影响;
④用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是CO32-能100%转化为沉淀,而OH-不会转化为沉淀.①使用MgCl2溶液作沉淀剂,氢氧化镁比MgCO3更难溶,OH-转化为沉淀,则可以使用MgCl2溶液作沉淀剂,但需要合适的指示剂进行滴定,故正确;
②取上层清液中加沉淀剂,生成沉淀则没有沉淀完全,否则沉淀完全,所以观察是否有沉淀继续生成可检验CO32-是否完全沉淀,故正确;
③用BaCl2溶液代替CaCl2溶液作沉淀剂,因氢氧化钙的溶解度较小,可排除氢氧化钙对实验的影响,能提高实验结果的准确度,故正确;
④用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是CO32-能100%转化为沉淀,而OH-不会转化为沉淀,方法更好,故正确;
故选D.点评:
本题考点: 化学实验方案的评价.
考点点评: 本题考查化学实验方案的评价,为高频考点,涉及沉淀法测定物质含量、离子检验及复分解反应等,注重实验原理及物质性质的考查,注意实验的操作性、评价性分析,题目难度不大.1年前查看全部
- 用重量法测定硫酸盐时,烘干沉淀法中熔结玻璃坩埚G4有过滤功能吗?有人做过这个实验吗?
用重量法测定硫酸盐时,烘干沉淀法中熔结玻璃坩埚G4有过滤功能吗?有人做过这个实验吗?
就是烘干沉淀法这一步没有看懂, mowen05021年前1
mowen05021年前1 -
 xiaofeixiaee 共回答了19个问题
xiaofeixiaee 共回答了19个问题 |采纳率94.7%当然有过滤功能了,将溶液滤除后烘干更容易,没什么难懂之处啊?
如还有不清楚欢迎追问.1年前查看全部
- (10分)饮用水安全状况与人类健康有着密切关系。重金属离子对河流、海洋会造成严重污染。沉淀法是处理含重金属离子污水常用的
(10分)饮用水安全状况与人类健康有着密切关系。重金属离子对河流、海洋会造成严重污染。沉淀法是处理含重金属离子污水常用的方法。
某工厂废水(pH=2.0,ρ=1.0 g·mL -1 )中含Ag + 、Pb 2+ 等重金属离子,其浓度各约为0.01mol·L -1 。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(1)你认为往废水中投 (填字母序号),沉淀效果最好。难溶电解质 AgCl AgI AgOH Ag 2 S PbI 2 Pb(OH) 2 PbS Ksp 1.8×10 -10 8.3×10 -17 5.6×10 -18 6.3×10 -50 7.1×10 -9 1.2×10 -15 3.4×10 -28 
A.NaOH B.Na 2 S C.KI D.Ca(OH) 2  (2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中 c (Pb 2+ )= 。
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中 c (Pb 2+ )= 。 (3)如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为 c (Ag + )低于1.0×10 -18 mol·L -1 ,则该工厂处理后的废水是否符合排放标准 。
(3)如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为 c (Ag + )低于1.0×10 -18 mol·L -1 ,则该工厂处理后的废水是否符合排放标准 。 (填“是”或 “否”)写出计算过程。
(填“是”或 “否”)写出计算过程。 sadfjkh23kjhfkaj1年前1
sadfjkh23kjhfkaj1年前1 -
 2euu 共回答了19个问题
2euu 共回答了19个问题 |采纳率78.9%1年前查看全部
大家在问
- 1如果三角形有一个角是钝角,那么他的另外两个角是锐角是真命题还是假命题,举例说明
- 2a=(4cosa,sina),b=(sinb,4cosb),c=(cosb,-4sinb),若a垂直(b-2c),求ta
- 3杨森 翻译成英语,德语等哪个比较好听,贴切
- 4把下面句子补充完整,并解释所填的字.
- 5为什么造物主要创造人,这一破坏性强的生物!
- 6如图,在三角形ABC中,AB=AC,D,E,F,分别为BC,AB.AC上的点,BD=CD,AE=AF
- 7形容时间短的成语至少三个.
- 8把一个圆柱体的侧面展开得到一个正方形,这个圆柱体的底面周长是10厘米,高是______厘米,侧面积是______平方厘米
- 9我现在的溴甲酚绿-甲基红指示剂是5.0暗红色的请问要加什么让它变成5.1灰绿色呢?
- 10中国古代诗歌史上被称为双臂的诗是什么
- 11已知Y=X的平方+PX+Q,当X=1时,Y的值为2:;当 X=-2时,Y的值为2.试求:当X=-3时,Y的值是多少 ?
- 121.y=x的二次方+px+q,当x=1和x=-2时,y的值都为2,则x=-3时y的值为()
- 13已知曲线C:y=x-3x+2与直线l:y=kx相切于点(x0,y0)(x0≠0),求直线l的方程及切点坐标.如题
- 14下图为甲乙两处岩层构造图,读图完成4、5题.
- 15藏字诗:惟爱梅意,要有具体意思,