二氧化氯、氯气混合气体的密度二氧化氯和氯气的混合气体的密度是多少?谢谢緢描的回答。哪二氧化氯的密度是多少啊?氯气的密度是
 3gfiueui2022-10-04 11:39:542条回答
3gfiueui2022-10-04 11:39:542条回答二氧化氯和氯气的混合气体的密度是多少?
谢谢緢描的回答。
哪二氧化氯的密度是多少啊?氯气的密度是多少啊?
二氧化氯发生器排出来的气体我也不知道是多少比例啊。

已提交,审核后显示!提交回复
共2条回复
 coogy 共回答了16个问题
coogy 共回答了16个问题 |采纳率81.3%- 11摄氏度时,二氧化氯3.09g/l.
标况时,氯气3.17g/L.
二氧化氯发生器排出来的气体比例和你所用的二氧化氯发生器及二氧化氯产生方法有关. - 1年前
 true9620 共回答了4个问题
true9620 共回答了4个问题 |采纳率- 二氧化氯比氯气密度略小,要精确计算混合气体密度还要知道两者的比例才行
- 1年前
相关推荐
- 二氧化氯在氢氧化钠溶液中可能发生反应的方程式
 3507556051年前1
3507556051年前1 -
 makelove1111 共回答了17个问题
makelove1111 共回答了17个问题 |采纳率94.1%看co2的量,少得就是碳酸钠,足量就是碳酸氢钠,差不多就两个都有1年前查看全部
- 氯酸钠、甲醇、硫酸反应生成二氧化氯的方程式和机理?
 thediy1年前1
thediy1年前1 -
 onechild 共回答了21个问题
onechild 共回答了21个问题 |采纳率95.2%6NaClO3 + CH3OH + 3H2SO4 = 6ClO2 + 5H2O + 3Na2SO4 + CO2
就是一个氧化还原反应1年前查看全部
- 氯酸钾与亚硫酸钠在有硫酸的条件下反应,生成二氧化氯,求方程式
 波起云涌1年前1
波起云涌1年前1 -
 blueblue_02 共回答了24个问题
blueblue_02 共回答了24个问题 |采纳率87.5%2KClO3+Na2SO3+H2SO4=2ClO2+Na2SO4+K2SO4+H2O1年前查看全部
- 二氧化氯的化学性质是什么?
 haojiahuozl1年前1
haojiahuozl1年前1 -
 于与 共回答了16个问题
于与 共回答了16个问题 |采纳率87.5%主要是强氧化性,用途很广.1年前查看全部
- CO2通入亚氯酸钠(NaClO2)制取二氧化氯的化学方程式
 观沙漠玫瑰1年前5
观沙漠玫瑰1年前5 -
 夜来香34 共回答了20个问题
夜来香34 共回答了20个问题 |采纳率90%亚氯酸钠(NaClO2)发生了歧化反应,CL由原来+3价变为一个-1,一个+4
2CO2+ 5NaClO2 ==NaCl+4ClO2+2Na2CO31年前查看全部
- 二氧化氯的组成元素是什么?如题.我们还没学.
 zhaoshiji1年前3
zhaoshiji1年前3 -
 dp2007 共回答了15个问题
dp2007 共回答了15个问题 |采纳率93.3%氧元素和氯元素
0和Cl1年前查看全部
- HCHO与ClO2的反应式?气态的甲醛与气态的二氧化氯相互作用的反应式,拟用于空气净化,想知道反应后的残留物是否有害.
 yaobin161年前1
yaobin161年前1 -
 kvnor1980 共回答了19个问题
kvnor1980 共回答了19个问题 |采纳率94.7%4HCHO+2ClO2 ==== 4HCOOH + Cl2
HCOOH+Cl2 ==== CO2 + 2HCL
HCL有一定的危害,但比甲醛要小多了.而且它在湿润的环境中会和灰尘中的碳酸盐继续作用生成氯化物,几乎没有危害了.1年前查看全部
- 二氧化氯和次氯酸的消毒原理相同吗
 酒醒后才明白1年前5
酒醒后才明白1年前5 -
 fyd1986 共回答了15个问题
fyd1986 共回答了15个问题 |采纳率93.3%都是靠氧化性破换细胞代谢过程的酶,使得酶失去活性后 细胞代谢不能完成.
但是相同摩尔数的二氧化氯的有效率要比次氯酸钠的高很多,另外,二氧化氯杀菌过程中对PH耐受性要比次氯酸钠强,二氧化氯能够在PH2-10范围内很好的工作,而次氯酸钠不行1年前查看全部
- 二氧化氯中,是否每个氧原子得到2个电子,而氯原子失去4个电子?但氯失去4个电子后怎样维持平衡?
二氧化氯中,是否每个氧原子得到2个电子,而氯原子失去4个电子?但氯失去4个电子后怎样维持平衡?
氯失去四个电子后,有13个电子,是不平衡的呀!到底怎么回事? 楼台高锁1年前3
楼台高锁1年前3 -
 圣龙 共回答了19个问题
圣龙 共回答了19个问题 |采纳率89.5%这个结构在高中化学中不做要求.
只要知道,不是所有的分子中,原子都满足8电子稳定结构就可以了,
如,缺电子分子,BF3等等
多电子分子,PCl5等等1年前查看全部
- 制取二氧化氯的问题用naclo3与so2反应制取clo2为什么要加入稀硫酸?
 行衣1年前1
行衣1年前1 -
 zcywilly 共回答了22个问题
zcywilly 共回答了22个问题 |采纳率90.9%加入酸是因为酸性环境下氯酸根的氧化性变强,从而才能将SO2的S氧化到+6价,而自己被还原成+4价,变为ClO21年前查看全部
- 氯酸钾与浓盐酸在一定温度下反应,生成二氧化氯,氯化钾,氯气和另外一未知物,求反应方程式.
氯酸钾与浓盐酸在一定温度下反应,生成二氧化氯,氯化钾,氯气和另外一未知物,求反应方程式.
二氧化氯具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(以单位质量得到的电子数)表示是氯气的多少倍 狐呶呶小ss1年前4
狐呶呶小ss1年前4 -
 锐锐乖 共回答了19个问题
锐锐乖 共回答了19个问题 |采纳率100%1.
未知产物是水
2kclo3+4hcl=2kcl+cl2+2clo2+2h2o
2.
2.63倍
计算过程
(clo2)=5/2(cl2)(根据得电子数相同时)
质量反比就是消毒效率:
X=(71*5)/(67.5*2)=2.631年前查看全部
- 二氧化氯与双氧水氢氧化钠制亚氯酸钠的方程式
 杀了我去喂猪1年前1
杀了我去喂猪1年前1 -
 blue_spray 共回答了23个问题
blue_spray 共回答了23个问题 |采纳率87%2ClO2+2NaOH+H2O2==2NaClO2+2H2O+O21年前查看全部
- 二氧化氯和金属铁的反应式怎么写?都有哪些反应!据了解二氧化氯在水里可分解成好多强氧化剂的.
 uu菜鸟1231年前1
uu菜鸟1231年前1 -
 unique守护 共回答了16个问题
unique守护 共回答了16个问题 |采纳率100%Cl2O+Fe=Fe3++Cl1-+O21年前查看全部
- 氯化铁+二氧化氯+水的反应方程式
 桥风儿1年前1
桥风儿1年前1 -
 renfeifei2007 共回答了15个问题
renfeifei2007 共回答了15个问题 |采纳率80%8FeCl3+6ClO2+12H2O==15Cl2+8Fe(OH)31年前查看全部
- 二氧化氯有腐蚀性吗?自来水中加入少量二氧化氯会腐蚀金属吗?尤其是铜.
 大鱼的宝宝1年前2
大鱼的宝宝1年前2 -
 n04ss 共回答了15个问题
n04ss 共回答了15个问题 |采纳率100%楼上说得很全面,我就补充一下,会腐蚀铜,在水管中形成原电池,腐蚀不会很迅速,但日积月累.hoho会的1年前查看全部
- 氯酸钠加氯气生成氯化钠加二氧化氯的化学方程式
 loaferyezi1年前1
loaferyezi1年前1 -
 娱凡 共回答了23个问题
娱凡 共回答了23个问题 |采纳率95.7%4NaClO3 + 3Cl2 ----> 4NaCl + 6ClO21年前查看全部
- 用二氧化氯作为生活用水消毒剂时,水中能否测出余氯?
用二氧化氯作为生活用水消毒剂时,水中能否测出余氯?
我用了能测出余氯,但有人说不应该能测出余氯, 汽车人之爵士1年前4
汽车人之爵士1年前4 -
 bzkybzky 共回答了17个问题
bzkybzky 共回答了17个问题 |采纳率94.1%应该不能检出.
二氧化氯用于消毒生活用水的浓度很低,一般不会高于1ppm.1年前查看全部
- 二氧化氯消毒过的水中氯离子浓度会升高
 oscar_jlz1年前1
oscar_jlz1年前1 -
 2007厄运 共回答了16个问题
2007厄运 共回答了16个问题 |采纳率100%二氧化氯对细菌、病毒及真菌孢子的杀灭能力均很强,由于ClO2是一种不稳定化合物,不含H0Cl和H0Cl-形式的有效氯.
由于二氧化氯以分子形式存在,是不含有CL离子的
然后消毒即溶于水以后声称HCLO,HCLO进一步分解成HCL,HCL可以电离出CL离子,
所以说二氧化氯消毒过的水中氯离子浓度会升高
希望对你有帮助1年前查看全部
- 请问谁知道:水厂用二氧化氯消毒时,末梢水中应该测游离余氯还是游离二氧化氯更好呢!
请问谁知道:水厂用二氧化氯消毒时,末梢水中应该测游离余氯还是游离二氧化氯更好呢!
《***卫生监督杂志》2004.5的“2003年四川省饮用水及集中式供水抽检结果分析”中说到:根据《卫生部关于生活饮用水卫生监督有关问题的批复》(卫发监发[2002]202号)规定,使用二氧化氯进行水质消毒不属于“加氯消毒”范畴,出厂水、管网不需测定“游离余氯”.所以本人有疑问,请高手指点. liuanxiang1年前1
liuanxiang1年前1 -
 ss卓越网 共回答了26个问题
ss卓越网 共回答了26个问题 |采纳率92.3%余氯.这是必测项目.1年前查看全部
- 求 二氧化氯消毒剂+水反映的化学方程式 及消毒剂的化学式,貌似反映后会释放 热量 和二氧化氯气体
 价格便宜量又足1年前2
价格便宜量又足1年前2 -
 yoyo116697 共回答了22个问题
yoyo116697 共回答了22个问题 |采纳率90.9%二氧化氯和水反应主要歧化生成亚氯酸和氯酸,极少量的会和水发生反应生成氧气和氯气
消毒剂主要成分就是二氧化氯1年前查看全部
- 化学法二氧化氯消毒剂发生器和化学法二氧化氯复合消毒剂发生器的区别是什么
化学法二氧化氯消毒剂发生器和化学法二氧化氯复合消毒剂发生器的区别是什么
化学法二氧化氯消毒剂发生器和化学法二氧化氯复合消毒剂发生器的概念是什么?他们是怎么区分,谢谢解答
“复合”两字存在,到底是如何意思!他们两个有什么区别 dounimasi1年前4
dounimasi1年前4 -
 123明明 共回答了20个问题
123明明 共回答了20个问题 |采纳率80%纯的二氧化氯 / 复合的消毒剂发生器 ---制出的是二氧化氯和氯气的混合物
每克纯二氧化氯的消毒能力约是复合的有效氯的3倍1年前查看全部
- 春季是传染病菌繁衍流行的季节,必须做好预防.二氧化氯(C1O2)已被世界卫生组织确认为一种安全、高效、广谱的强力杀菌剂.
春季是传染病菌繁衍流行的季节,必须做好预防.二氧化氯(C1O2)已被世界卫生组织确认为一种安全、高效、广谱的强力杀菌剂.制取二氧化氯的反应是:2NaClO3+4HCl(浓)=2NaCl+Cl2↑+2C1O2+2X
(1)X的化学式是______.
(2)Cl2和二氧化氯两种分子中所含氯原子的个数比为______.
(3)135g二氧化氯中含氧元素的质量是______g. roadrunner5211年前1
roadrunner5211年前1 -
 柴火煮饭 共回答了25个问题
柴火煮饭 共回答了25个问题 |采纳率88%解题思路:(1)根据质量守恒定律反应前后原子的种类及数目不变,由2NaClO3+4HCl(浓)=2NaCl+Cl2↑+2C1O2+2X,推断X的化学式;
(2)根据化学式的意义分析计算;
(3)根据化学式进行计算135g二氧化氯中含氧元素的质量.(1)由反应的化学方程式2NaClO3+4HCl═2ClO2↑+Cl2↑+2X+2NaCl可知:反应前有钠、氯、氧、氢原子的数目分别是:2、6、6、4.反应后有钠、氯、氧原子2、6、4.由质量守恒定律化学变化前后原子的种类、数目不变,生成物X的2个分子中含有2个O原子和4个H原子,则每个X分子由2个H原子和1个O原子构成,则物质X的化学式为H2O;
(2)由化学式的意义可知,Cl2和二氧化氯两种分子中所含氯原子的个数比为2:1;
(3)135g二氧化氯中含氧元素的质量是:135g×[32/67.5]×100%=64g
故答为:(1)H2O;(2)2:1;(3)64.点评:
本题考点: 质量守恒定律及其应用;化合物中某元素的质量计算.
考点点评: 本题主要考查了根据质量守恒定律推断物质的化学式及根据化学式的计算,难度不大.会根据化学式的意义机型有关的分析、计算等.1年前查看全部
- 请问:CLO2是过氧化氯还是二氧化氯,如果是,是否代表这两者是同一样东西?如果不是,请问差别在哪里?两者的化学式分别是什
请问:
CLO2是过氧化氯还是二氧化氯,如果是,是否代表这两者是同一样东西?
如果不是,请问差别在哪里?两者的化学式分别是什么,其中氧和氯的化合价又是什么? 躺在海底的鱼1年前11
躺在海底的鱼1年前11 -
 叶子_2008 共回答了12个问题
叶子_2008 共回答了12个问题 |采纳率91.7%是二氧化氯
不是同一样东西
根本就没有过氧化氯这种东西,如果假设存在也不知道过氧化氯中氯的价态,不能推断化学式
氧的化合价是-2价,氯是+4价1年前查看全部
- 二氧化氯(ClO2)是一种新型的自来水消毒剂,下列对它的描述错误的是( )
二氧化氯(ClO2)是一种新型的自来水消毒剂,下列对它的描述错误的是( )
A.这是一种化合物,且是一种氧化物
B.它是由一个氯原子和一个氧分子构成的
C.它的相对分子质量为67.5
D.其中氧元素的化合价为-2 lx32311年前1
lx32311年前1 -
 zome-2000 共回答了13个问题
zome-2000 共回答了13个问题 |采纳率76.9%解题思路:A、由不同种元素组成的纯净物是化合物,在由两种元素组成的化合物中,其中一种是氧元素的是氧化物.
B、根据二氧化氯的微观构成进行分析判断.
C、根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析判断.
D、根据常见元素的化合价进行分析判断.A、二氧化氯(ClO2)是由不同种元素组成的纯净物,属于化合物;且是由两种元素组成且有一种是氧元素,属于氧化物;故选项说法正确.
B、二氧化氯是由二氧化氯分子构成的,1个二氧化氯分子是由一个氯原子和两个氧原子构成的,故选项说法错误.
C、它的相对分子质量为35.5+16×2=67.5,故选项说法正确.
D、氧元素在化合物中通常显-2价,故选项说法正确.
故选B.点评:
本题考点: 化学式的书写及意义;从组成上识别氧化物;单质和化合物的判别;有关元素化合价的计算;相对分子质量的概念及其计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化合物与氧化物的概念、化学式的含义与有关计算等进行分析问题、解决问题的能力.1年前查看全部
- 投加二氧化氯管子需要深入清水池多深为宜?
 xuxin11年前1
xuxin11年前1 -
 很爱小熊 共回答了19个问题
很爱小熊 共回答了19个问题 |采纳率100%投加管子大约插入水深的三分之二为宜,管子锯斜口,斜口顺着水流方向,如果水量偏大,最好在管子上加钻小孔.1年前查看全部
- 如何检测生活饮用水中含有二氧化氯(定性试验)
 x522841年前1
x522841年前1 -
 jinglanbaby 共回答了16个问题
jinglanbaby 共回答了16个问题 |采纳率93.8%二氧化氯含量的检测比较复杂,而且也不统一,不同的方法检测结果也不相同.现在常用的是五步碘量法,具体方法比较复杂就不发了.可以HI我或者Q1379493113我~1年前查看全部
- 用氯消毒(次氯酸钠、氯气、二氧化氯)消毒生活饮用水,会有哪些消毒副产物?
用氯消毒(次氯酸钠、氯气、二氧化氯)消毒生活饮用水,会有哪些消毒副产物?
我的意思是消毒副产物,我知道的有氯代烃类的,非常多,最好将消毒副产物列出来名单。 凉月亮1年前3
凉月亮1年前3 -
 guizigu 共回答了10个问题
guizigu 共回答了10个问题 |采纳率90%首先会有少量氯气残留在里面,其次会有次氯酸根离子,甚至会有光气在里面.1年前查看全部
- 二氧化氯(ClO 2 )是联合国世界卫生组织确认的一种安全、高效、广谱、强力杀菌剂.二氧化氯常温下是橘红色气体,有窒息性
二氧化氯(ClO 2 )是联合国世界卫生组织确认的一种安全、高效、广谱、强力杀菌剂.二氧化氯常温下是橘红色气体,有窒息性臭味,二氧化氯气体易溶于水,形成黄绿色的溶液,一般采用向上排空气法来收集二氧化氯.它是一种有强氧化性的物质,其杀菌能力是氯气的5倍,能与很多物质能发生剧烈反应,如能与镁反应生成亚氯酸镁【Mg(C10 2 ) 2 】.根据上述信息,请回答:
(1)二氧化氯的物理性质有______;
(2)二氧化氯的化学性质有______;
(3)写出镁与二氧化氯反应的化学方程式______,生成物中氯元素的化合价为______. 竟陵王子1年前1
竟陵王子1年前1 -
 lmokch 共回答了18个问题
lmokch 共回答了18个问题 |采纳率88.9%(1)二氧化氯的物理性质有:常温下二氧化氯是橘红色气体,有窒息性臭味,易溶于水,密度比空气大.
(2)二氧化氯的化学性质有:有强氧化性,能与镁发生化学反应.
(3)镁与二氧化氯反应的化学方程式为:Mg+2ClO 2 =Mg(ClO 2 ) 2
在Mg(ClO 2 ) 2 中,镁元素的化合价是+2价,氧元素的化合价是-2价,
设氯元素的化合价为X,根据化合物中元素化合价代数和为零有:
(+2)+2X+(-2)×4=0.
解得:X=+3.
氯元素的化合价是+3价.1年前查看全部
- 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是______(填序号).
A.只有还原性B.还原性和酸性C.只有氧化性D.氧化性和酸性
②若上述反应中产生0.1mol ClO2,则转移电子的物质的量为______mol.
(2)目前已开发出用电解法制取ClO2的新工艺.
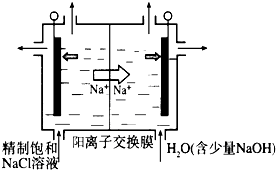
①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:______.
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为______mol;用平衡移动原理解释阴极区pH增大的原因______.
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为______;处理100m3这种污水,至少需要ClO2[50a/13][50a/13]mol. kakaup1年前1
kakaup1年前1 -
 ajiu555 共回答了13个问题
ajiu555 共回答了13个问题 |采纳率92.3%解题思路:(1)①HCl中的氯元素在产物存在于Cl2,氯元素的化合价升高,氯元素被氧化,存在NaCl中氯元素的化合价未变化,据此解答;
②ClO2是还原产物,氯元素的化合价由+5价降低为+4价,转移电子物质的量等于ClO2的物质的量;
(2)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;
②在阴极发生2H++2e-=H2↑,通过阳离子交换膜的阳离子为+1价离子,根据n=
计算氢气的物质的量,根据电子转移守恒计算阳离子的物质的量,电解中H+浓度减小,使得H2O⇌OH-+H+的平衡向右移动;V Vm
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子;
根据方程式计算需要ClO2的物质的量.(1)①HCl中的氯元素在产物存在于Cl2,氯元素的化合价升高,氯元素被氧化,HCl起还原剂注意,同时存在NaCl中氯元素的化合价未变化,故HCl还起酸的作用,故答案为:B;
②ClO2是还原产物,氯元素的化合价由+5价降低为+4价,转移电子物质的量为0.1mol×(5-4)=0.1mol,
故答案为:0.1mol;
(2)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;
②在阴极发生2H++2e-=H2↑,氢气的物质的量为[0.112L/22.4L/mol]=0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.005mol×2=0.01mol,电解中阴极H+浓度减小,使得H2O⇌OH-+H+的平衡向右移动,溶液的pH增大,
故答案为:0.01;在阴极发生2H++2e-=H2↑,H+浓度减小,使得H2O⇌OH-+H+的平衡向右移动,OH-浓度增大,pH增大;
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-,
100m3废水中CN-质量=100m3×ag/m3=100ag,CN-的物质的量为[100ag/26g/mol]=[50a/13]mol,由方程式可知,至少需要ClO2的物质的量=[50a/13]mol,
故答案为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-;[50a/13]mol.点评:
本题考点: 电解原理;氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查氧化还原反应、常用化学用语、电解原理、化学计算等,题目难度中等,电解反应是难点、易错点,是对学生综合能力的考查,需要学生具有扎实的基础与分析解决问题的能力.1年前查看全部
- (2003•柳州)“非典”给人类造成了严重的灾害,但也使我们更加注意养成良好的卫生习惯.例如,经常用消毒水洗手.二氧化氯
(2003•柳州)“非典”给人类造成了严重的灾害,但也使我们更加注意养成良好的卫生习惯.例如,经常用消毒水洗手.二氧化氯(C1O2)的水溶液是一种常用的消毒水.请计算:
(1)二氧化氯的相对分子质量.
(2)二氧化氯申氯、氧元素的质量比.
(3)135克二氧化氯中含氯元素的质量. lancelzg1年前1
lancelzg1年前1 -
 飘飘流水 共回答了20个问题
飘飘流水 共回答了20个问题 |采纳率95%解题思路:(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.(1)二氧化氯的相对分子质量为35.5+16×2=67.5.
(2)二氧化氯中氯元素、氧元素的质量比为35.5:(16×2)=35.5:32=71:64.
(3)135克二氧化氯中含氯元素的质量为135g×
35.5
67.5×100%=71g.
故答案为:(1)67.5;(2)71:64;(3)71g.点评:
本题考点: 相对分子质量的概念及其计算;元素质量比的计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 次氯酸钾与浓盐酸在一定温度下生成绿黄色的医保无二氧化氯的反应方程式?
次氯酸钾与浓盐酸在一定温度下生成绿黄色的医保无二氧化氯的反应方程式?
急 zhangqian19871年前2
zhangqian19871年前2 -
 penny850211 共回答了17个问题
penny850211 共回答了17个问题 |采纳率94.1%2KClO+2HCl+O2=2KCl+2ClO2+H2O1年前查看全部
- 次氯酸钠和二氧化氯一样吗
 白烟儿1年前2
白烟儿1年前2 -
 PoringBo 共回答了15个问题
PoringBo 共回答了15个问题 |采纳率100%不一样. 加氯机是氯气投加到水中,水解后主要以HCLO,CLO-杀菌.
二氧化氯发生器直接制备出二氧化氯溶液,CLO2杀菌21年前查看全部
- 世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效、安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛的应用.
世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效、安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛的应用.下列说法中正确的是( )
A.ClO2是强氧化剂
B.ClO2是强还原剂
C.ClO2是离子化合物
D.ClO2中氯元素为-1价 chuyou991年前1
chuyou991年前1 -
 qjxjack 共回答了17个问题
qjxjack 共回答了17个问题 |采纳率88.2%解题思路:A、依据二氧化氯中氯的化合价为+4价,化合价为该元素的高价态分析判断;
B、依据氯的化合价情况分析判断;
C、依据离子化合物一般的特点分析判断;
D、依据化合物中各元素化合价代数和为零分析判断;A、二氧化氯中氯的化合价为+4价,化合价为该元素的高价态,所以该物质有较强的氧化性;
B、由A知ClO2是强氧化剂不是强还原剂;
C、离子化合物一般由金属离子与酸根离子构成,二氧化氯不具备该特点,所以ClO2不是离子化合物;
D、因为化合物中各元素化合价代数和为零,所以ClO2中氧元素为-2价,故氯元素为+4价;
故选A.点评:
本题考点: 氧化反应;有关元素化合价的计算.
考点点评: 此题是对氧化还原知识的考查,解题的关键是掌握氧化剂还原剂的组成元素化合价的特点.1年前查看全部
- 请问:含量为42%的氯酸钠溶液与含量为31%的盐酸溶液反应能产生多少二氧化氯,如何计算?
请问:含量为42%的氯酸钠溶液与含量为31%的盐酸溶液反应能产生多少二氧化氯,如何计算?
一个日处理量为10000吨的污水厂,用含量为42%的氯酸钠溶液与含量为31%的盐酸,现场制作二氧化氯消毒,每立方水用二氧化氧6克,问:每天需用氯化钠溶液和盐酸多少公斤? 巡线路过1年前1
巡线路过1年前1 -
 爱到不爱 共回答了13个问题
爱到不爱 共回答了13个问题 |采纳率100%(1)5NaCIO3 + 6HCI == 6CIO2 + 5NaCI + 3H2O
--532.5------219-----405
--42x%------31y%------60Kg
(2)每天需用氯酸钠溶液==60*532.5/(405*42%) ==187.8kg
(3)每天需用盐酸 == 60*219/(405*31%) ==104.7kg1年前查看全部
- 二氧化氯和余氯的问题二氧化氯和余氯有什么关系?有没有严格的定义?如何反应才可以生成?写出方程式.消毒原理分别是什么?
 berich_0_01年前2
berich_0_01年前2 -
 hellobabylei 共回答了23个问题
hellobabylei 共回答了23个问题 |采纳率82.6%二氧化氯:就是氯的氧化物,红黄色有强烈刺激性臭味气体,有类似氯气和硝酸的特殊刺激臭味.沸点11℃.相对蒸气密度2.3g/L.遇热水则分解成次氯酸、氯气、氧气,受光也易分解,其溶液于冷暗处相对稳定.属强氧化剂,其有效氯是氯的2.6倍.与很多物质都能发生剧烈反应.腐蚀性很强.极易溶于水而不与水反应,几乎不发生水解(水溶液中的亚氯酸和氯酸只占溶质的2%);在水中的溶解度是氯的5-8倍.溶于碱溶液而生成亚氯酸盐和氯酸盐.
余氯是指水经过加氯消毒,接触一定时间后,水中所余留的有效氯.即水中余留的游离性氯和结合性氯的总称
可以说,两者没啥密切的关系
无论氯气还是二氧化氯,均是利用强氧化性来消毒的.
二氧化氯可以用草酸或者亚硫酸盐与氯酸盐混合反应制备1年前查看全部
- 二氧化氯是由两个氧原子和一个氯原子构成是对是错?
 eioeptweq1年前4
eioeptweq1年前4 -
 飞花皆落泪 共回答了16个问题
飞花皆落泪 共回答了16个问题 |采纳率93.8%应该说是二氧化氯分子1年前查看全部
- 自来水中用来消毒的主要化学物质是什么?二氧化氯、还是次氯酸钠?还是其他?
 amd75511年前1
amd75511年前1 -
 虾皮520 共回答了12个问题
虾皮520 共回答了12个问题 |采纳率100%消毒物质是漂白粉,但是漂白粉里面有效物质是次氯酸钠.它可以产生次氯酸根离子和少量的次氯酸.次氯酸起主要作用.1年前查看全部
- 相同物质的量的氯气与二氧化氯消毒时转移电子数目之比是?3,
 wxd548107701年前0
wxd548107701年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效、安全灭菌消毒剂,ClO2是一种消毒杀菌效率高、二次污染小的水处
世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效、安全灭菌消毒剂,ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,它在食品保鲜、饮用水消毒等方面有着广泛的应用.
(1)实验室制备ClO2的方法之一为:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O(H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是______.△ .
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中被氧化
D.1mol KClO3参加反应有2mol电子转移
(2)KClO3和浓盐酸在一定温度下反应也会生成绿黄色的二氧化氯.其变化可表示为2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O
①浓盐酸在反应中表现出来的性质是______;
②已知每产生0.1mol Cl2,则发生转移的电子的物质的量为0.2mol.ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒后的还原产物是氯离子,则其消毒的效率(以单位质量得到的电子数表示)是Cl2的______倍. 娟老大1年前1
娟老大1年前1 -
 silver0rr 共回答了18个问题
silver0rr 共回答了18个问题 |采纳率83.3%解题思路:(1)2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高为+4价;△ .
(2)①反应中Cl元素的化合价升高表现还原性,反应生成盐,表现酸性;
②作消毒剂,其消毒后的还原产物是氯离子,利用化合价的变化计算消毒效率.(1)2KClO3+H2C2O4+H2SO4
△
.
2ClO2↑+K2SO4+2CO2↑+2H2O中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高为+4价,
A.KClO3在反应中Cl元素的化合价降低,得到电子,故A正确;
B.ClO2是还原产物,故B错误
C.H2C2O4在反应中,C元素的化合价升高,则被氧化,故C正确;
D.1molKClO3参加反应,Cl元素的化合价由+5价降低为+4价,有1mol电子转移,故D错误;
故答案为:AC;
(2)①KClO3和浓盐酸在一定温度下反应也会生成绿黄色的二氧化氯.其变化可表示为2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O,反应中Cl元素的化合价升高表现还原性,反应生成盐KCl,表现酸性;
故答案为:还原性和酸性;
②作消毒剂,其消毒后的还原产物是氯离子,则消毒效率为
m
67.5×5
m
71×2×1=2.63,故答案为:2.63.点评:
本题考点: 氧化还原反应.
考点点评: 本题以氯及其化合物考查氧化还原反应,侧重氧化还原反应的考查,明确反应中元素的化合价变化是解答的关键,注重知识的迁移应用,题目难度不大.1年前查看全部
- 写出下列物质的化学式碳酸碳酸钠碱式碳酸铜碳酸氢钠碳酸钙碳酸氢钙氯化氢氯气氯化钾二氧化锰氯酸氯酸钾二氧化氯氧化二氯硝酸硝酸
写出下列物质的化学式
碳酸
碳酸钠
碱式碳酸铜
碳酸氢钠
碳酸钙
碳酸氢钙
氯化氢
氯气
氯化钾
二氧化锰
氯酸
氯酸钾
二氧化氯
氧化二氯
硝酸
硝酸钾
硝酸钡
硝酸铵
硝酸铜
硝酸汞
硝酸银
硫酸
硫酸铵
硫酸氢铵
硫酸钡
硫酸铝
硫酸铁
硫酸亚铁
磷酸
磷酸钠
磷酸氢钠
磷酸氢二钠
磷酸氢铵
磷酸钙
磷酸二铵
氮气
硫磺
白磷
金刚石
氦气
二氧化硅
氖气
二氧化氮
氩气
氧化铁
氧化铝
氢氧根离子
硫酸根离子
碳酸根离子
硝酸根离子
铵根离子 lcon011年前2
lcon011年前2 -
 lewis_xuxu 共回答了16个问题
lewis_xuxu 共回答了16个问题 |采纳率100%碳酸 H2CO3
碳酸钠 Na2CO3
碱式碳酸铜 Cu2(OH)2CO3
碳酸氢钠 NaHCO3
碳酸钙 CaCO3
碳酸氢钙 Ca(HCO3)2
氯化氢 HCl
氯气 Cl2
氯化钾 KCl
二氧化锰 MnO2
氯酸 HClO3
氯酸钾 KClO3
二氧化氯 ClO2
氧化二氯 Cl2O
硝酸 HNO3
硝酸钾 KNO3
硝酸钡 Ba(NO3)2
硝酸铵 NH4NO3
硝酸铜 Cu(NO3)2
硝酸汞 Hg(NO3)2
硝酸银 AgNO3
硫酸 H2SO4
硫酸铵 (NH4)2SO4
硫酸氢铵 NH4HSO4
硫酸钡 BaSO4
硫酸铝 Al2(SO4)3
硫酸铁 Fe2(SO4)3
硫酸亚铁 FeSO4
磷酸 H3PO4
磷酸钠 Na3PO4
磷酸氢钠 NaH2PO4
磷酸氢二钠 Na2HPO4
磷酸氢铵 NH4H2PO4
磷酸钙 Ca3(PO4)2
磷酸二铵 (NH4)2HPO4
氮气 N2
硫磺 S
白磷 P
金刚石 C
氦气 He
二氧化硅 SiO2
氖气 Ne
二氧化氮 NO2
氩气 Ar
氧化铁 Fe2O3
氧化铝 Al2O3
氢氧根离子 OH^-
硫酸根离子 SO4^2-
碳酸根离子 CO3^2-
硝酸根离子 NO3^-
铵根离子 NH4^+1年前查看全部
- 常用的消毒剂有氯气、二氧化氯、漂白粉等,这三种物质都含()理由是?
常用的消毒剂有氯气、二氧化氯、漂白粉等,这三种物质都含()理由是?
A.原子团 B.氯分子 C.氯离子 D.氯元素 毛毛与卡尔1年前3
毛毛与卡尔1年前3 -
 碳酸小子 共回答了16个问题
碳酸小子 共回答了16个问题 |采纳率93.8%D
氯气:Cl2
二氧化氯;ClO2
漂白粉:Ca(ClO)2(都由氯元素组成)
因为氯气为单质,不是由离子构成,更不是原子团
二氧化氯是由二氧化氯分子构成
所以选D1年前查看全部
- Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的K
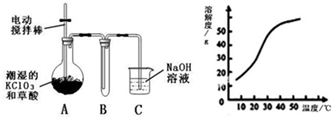 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有______.
(2)反应后在装置C中可得NaClO2溶液.已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2•3H2O,在温度高于38℃时析出晶体是NaClO2.根据图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:①蒸发结晶;②______;③洗涤;④干燥.
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液.为测定所得溶液中ClO2的浓度,进行了下列实验:
①准确量取ClO2溶液V1 mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0.
②加入足量的KI晶体,静置片刻.此时发生反应的离子方程式为:______;
③加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL.则原ClO2溶液的浓度为cV2 5V1 mol/L(用含字母的代数式表示).(已知2Na2S2O3+I2=Na2S4O6+2NaI)cV2 5V1
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl-组合形成的三种强电解质溶液,分别装入如图装置中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极.
接通电源,经过一段时间后,测得乙中c电极质量增加.常温下各烧杯中溶液pH与电解时间t的关系如图(忽略因气体溶解带来的影响).据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式2CuSO4+2H2O
2Cu+O2↑+2H2SO4通电 .2CuSO4+2H2O;
2Cu+O2↑+2H2SO4通电 .
(2)电极f上发生的电极反应为______;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是______. 礼物漂亮1年前1
礼物漂亮1年前1 -
 三年天下 共回答了19个问题
三年天下 共回答了19个问题 |采纳率89.5%解题思路:(1)根据反应需要的温度介于60~100℃之间的要采用水浴加热;
(2)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,根据题意温度高于38℃时析出晶体是NaClO2来确定过滤的温度;
(3)②二氧化氯具有氧化性,可以将碘离子氧化为碘单质,据此书写方程式;
③根据关系式2ClO2~5I2~10Na2S2O3计算c(ClO2);
Ⅱ、乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阳极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,根据电解池的工作原理以及电子守恒来书写电解方程式并进行计算即可.I.(1)KClO3和草酸(H2C2O4)在60℃时的反应来制取目标产物,需要的温度介于60~100℃之间的要采用水浴加热,所以还缺少盛水的装置:烧杯,
故答案为:烧杯;
(2)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,并且只有温度高于38℃时析出晶体才是NaClO2,所以要趁热过滤,故答案为:趁热过滤;
(3)②二氧化氯具有氧化性,可以将碘离子氧化为碘单质,2ClO2+8H++10I-═Cl2+5I2+4H2O,故答案为:2ClO2+8H++10I-═Cl2+5I2+4H2O;
③设原ClO2溶液的浓度为x,
2ClO2~5I2~10Na2S2O3
2 10
10-3×xV110-3×cV2
解得x=
cV2
5V1,故答案为:
cV2
5V1;
Ⅱ.乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阳极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,
(1)乙烧杯为电解硫酸铜溶液,反应的总反应式为2CuSO4+2H2O
通电
.
2Cu+O2↑+H2SO4,故答案为:2CuSO4+2H2O
通电
.
2Cu+O2↑+H2SO4;
(2)丙为电解硫酸钠溶液,f为阳极,电极f上发生的电极反应为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(3)c电极质量增加了8g,为Cu,n(Cu)=[8g/64g/mol]=0.125mol,转移0.25mol电子,丙中发生2H2O
通电
.
O2↑+2H2↑,转移0.25mol电子应消耗0.125mol水,质量为0.125mol×18g/mol=2.25g,应加入2.25g水可恢复到原来的浓度,
故答案为:向丙烧杯中加入2.25g水.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;电解原理.
考点点评: 本题是一道综合知识的考查题,涉及物质的制备实验,电解池的工作原理等方面知识,综合性强,难度大.1年前查看全部
- (2007•泉州)(泉州市)二氧化氯(Cl02)是一种新型自来水消毒剂.下列有关二氧化氯说法错误的是( )
(2007•泉州)(泉州市)二氧化氯(Cl02)是一种新型自来水消毒剂.下列有关二氧化氯说法错误的是( )
A.由氯元素和氧元素组成
B.相对分子质量是67.5
C.是一种氧化物
D.氯氧两元素的质量比是1:2 avaforget1年前1
avaforget1年前1 -
 weiminabc 共回答了17个问题
weiminabc 共回答了17个问题 |采纳率76.5%解题思路:A、由二氧化氯(Cl02)可知该物质的元素的组成;
B、相对分子质量,即各种元素的相对原子质量和的总和;
C、氧化物由两种元素组成,其中一种为氧元素;
D、元素的质量比为各种元素的相对原子质量和的比.由二氧化氯(Cl02)具体分析如下:
A、可知由氯元素和氧元素组成,故A正确;
B、相对分子质量=35.5+16×2=67.5,故B正确;
C、是一种氧化物,它由氯元素和氧元素组成,故C正确;
D、氯氧两元素的质量比=35.5:(16×2)=35.5:32,而1:2为原子个数比,故D错误.
故选D.点评:
本题考点: 化学式的书写及意义;从组成上识别氧化物;有关化学式的计算和推断.
考点点评: 了解化学式的书写及其意义,从组成上识别氧化物;了解有关化学式的计算和推断方法及其技巧.1年前查看全部
- 求氯酸钠和浓硫酸反应制取二氧化氯等物的方程式
 愤怒绝望的羔羊1年前1
愤怒绝望的羔羊1年前1 -
 心外身外 共回答了21个问题
心外身外 共回答了21个问题 |采纳率100%3NaClO3+2H2SO4===2NaHSO4+2ClO2+NaClO4+H2O1年前查看全部
- 二氧化氯氧化除去锰离子生成亚氯酸根方程式
 byefriday1年前1
byefriday1年前1 -
 彼岸碎风 共回答了16个问题
彼岸碎风 共回答了16个问题 |采纳率93.8%产物不是亚氯酸,二价锰被二氧化氯氧化生成不溶于水的MnO2(四价锰),二氧化氯(+4价)被还原生成氯离子(-1价).方程式为
2ClO2 + 5Mn2+ + 6H2O===5MnO2 + 12H+ + 2Cl-1年前查看全部
- ClO2读做什么?二氧化氯吗/?
 失羽鸟1年前1
失羽鸟1年前1 -
 陆主rr 共回答了20个问题
陆主rr 共回答了20个问题 |采纳率95%没错!
氯是正四价!1年前查看全部
- 11.世界卫生组织(WHO)将二氧化氯ClO2列为A级高效安全灭菌消毒剂,ClO2是一种消毒杀菌效率高,二次污染小的水处
11.世界卫生组织(WHO)将二氧化氯ClO2列为A级高效安全灭菌消毒剂,ClO2是一种消毒杀菌效率高,二次污染小的水处理剂,它在食品保鲜,饮用水消毒等方面有着广泛的应用.
(1)实验室制备ClO2的方法之一为:
2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O(H2C2O4俗称草酸,其中H为+1价,O为-2价),则下列说法正确的是( )AC
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被氧化 D.1 molKClO3参加反应有2mol电子转移
(2)下列关于ClO2的说法中正确的是( )AC
A.二氧化氯是强氧化剂
B.二氧化氯是强还原剂
C.1个二氧化氯分子由2个O原子和1个Cl原子组成
D.二氧化氯分子中氯为负1价
(3)KClO3和浓盐酸在一定温度下反应也会生成绿黄色的二氧化氯.其变化可表示为
2KClO3+4HCl=2KCl+2ClO2↑+Cl2↑+2H2O
①浓盐酸在反应中显示出来的性质是___________;
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②已知每产生0.1molCl2,则发生转移的电子的物质的量为0.2mol.ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒后的还原产物是氯离子,则其消毒的效率(以单位质量得到的电子数表示)是Cl2的 倍.
综合应用
最后一问的答案是2.63倍,不知道怎么算出来的
 冰与火的故事1年前1
冰与火的故事1年前1 -
 32520z12 共回答了17个问题
32520z12 共回答了17个问题 |采纳率88.2%1molCl2,则发生转移的电子的物质的量为2mol,消毒效率(以单位质量得到的电子数表示)=2/71,而1molClO2,发生转移的电子的物质的量为5mol,所以消毒效率(以单位质量得到的电子数表示)=5/67.5,5/67.5:2/71=2.63,所以ClO2消毒效率是Cl2的2.63倍.1年前查看全部
- 30克二氧化氯溶解在8千克水中,浓度是多少PPM?二氧化氯纯度在95%左右.
30克二氧化氯溶解在8千克水中,浓度是多少PPM?二氧化氯纯度在95%左右.
30克二氧化氯溶解在8千克水中,浓度是多少PPM? mayufeng91年前2
mayufeng91年前2 -
 小童1960 共回答了15个问题
小童1960 共回答了15个问题 |采纳率86.7%二氧化氯是中性分子,在水中几乎以分子状态存在,水溶液中的亚氯酸和氯酸仅占溶质的2%.如果按此计算,溶质中二氧化氯为:30g*98%=29.4g,则溶液浓度为(29.4g/30g+8000g)*1000000=3661.27ppm.1年前查看全部
- 亚氯酸分解生成氯气,二氧化氯和水的化学方程式
 feng-q1年前3
feng-q1年前3 -
 hollexixi_1120 共回答了18个问题
hollexixi_1120 共回答了18个问题 |采纳率72.2%8HClO2===Cl2+6ClO2+4H2O
这个用升降法配平,还是蛮容易的1年前查看全部
大家在问
- 1if从句用现在时,主句也用现在时,这是一种什么用法?
- 2中秋节祝福语用英语怎么说
- 3麻烦哪位英文好的 假设你是公司职员刘兵,给经理MR.JOHNSON写一张请假条.1.咳嗽特别厉害,想
- 4my cousin has a computer(改为一般疑问句)
- 5求解初一寒假生活中的几道数学题(钟数金牌)
- 6求大神英语翻译:我们可以更加深入地了解问题,建立知识之间的联系,从而在面对实际问题时,能灵活地运用知识解决问题.
- 7求把下列文段翻译成英文1我已经于5月7日以电汇的方式在中国工商银行完成缴费并与5月19号将相关复印件寄出,但现在申请页面
- 8阅读材料,完成下列各题。材料一下面左图是某国某州区域图,右图是三城市年降水量和冬雨率柱状图。 材料二圣迭戈是一个典型的
- 9阅读下文,完成下列各题。 真理诞生于一百个问号之后
- 10你能从写雨的诗句中说出它们写的是什么季节的雨吗
- 11英语翻译夏玑吴县人,父尝夜坐凭窗,月阴中,见一白晰少年醉行,夫曰:“谁家嗜狂药若此?”逼近叩门,乃玑也,父置不言.后登第
- 12如图所示,水平放置的两根平行金属导轨相距O.2m,上面有一质量为O.4kg的均匀金属棒ab垂直导轨放置,金属棒与导轨间的
- 13《岳阳楼记》用成语概括
- 14人与山的关系日益密切,怎能不使我们感到亲切舒服呢?(改成陈述句)
- 15一些英语习题不会做...一.中英互译1.在热带雨林里 ________2.长颈鹿吃草吗?Do______ ______e
