(2014•邯郸县二模)食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦
 kentlaw2022-10-04 11:39:541条回答
kentlaw2022-10-04 11:39:541条回答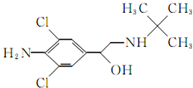 (2014•邯郸县二模)食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )
(2014•邯郸县二模)食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )A.化学式为C12H18ONH2Cl2
B.遇FeCl3溶液发生显色反应
C.属于芳香族化合物
D.可以发生取代、加成、水解、酯化、消去反应

已提交,审核后显示!提交回复
共1条回复
 笑倒像个粮票 共回答了16个问题
笑倒像个粮票 共回答了16个问题 |采纳率75%- 解题思路:由结构简式可知分子式,分子中含氨基、-Cl、醇-OH等,结合卤代烃、醇、氨基的性质来解答.
A.由结构简式可知分子式为C12H18ONH2Cl2,故A正确;
B.不含酚-OH,则不能遇FeCl3溶液发生显色反应,故B错误;
C.分子中含苯环,为芳香族化合物,故C正确;
D.含-Cl、-OH可发生取代,含苯环可发生加成,含-Cl可发生水解,含-OH可发生酯化、消去反应,故D正确;
故选B.点评:
本题考点: 有机物的结构和性质;有机物分子中的官能团及其结构.
考点点评: 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醇、卤代烃性质及相关概念的考查,注意酚与醇的区别,题目难度不大. - 1年前
相关推荐
- (2014•邯郸县二模)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为1
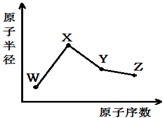 (2014•邯郸县二模)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
(2014•邯郸县二模)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
A.化合物XZW既含离子键也含共价键
B.对应气态氢化物的稳定性Y>Z
C.对应简单离子半径:X>W
D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 公子凯1年前1
公子凯1年前1 -
 9vpi 共回答了22个问题
9vpi 共回答了22个问题 |采纳率95.5%解题思路:W、X、Y、Z是四种常见的短周期元素,已知W的一种核素的质量数为18,中子数为10,则W元素原子的质子数为18-10=8,故W为氧元素;X和Ne原子的核外电子数相差1,X为Na或F,X原子半径大于氧原子,故X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na元素,故Y为Si元素;Z的非金属性在同周期元素中最强,故Z为Cl元素,据此解答.W、X、Y、Z是四种常见的短周期元素,已知W的一种核素的质量数为18,中子数为10,则W元素原子的质子数为18-10=8,故W为氧元素;X和Ne原子的核外电子数相差1,X为Na或F,X原子半径大于氧原子,故X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na元素,故Y为Si元素;Z的非金属性在同周期元素中最强,故Z为Cl元素,
A.化合物NaClO中钠离子与次氯酸根离子之间形成离子键,次氯酸根中氯原子与氧原子之间形成共价键,故A正确;
B.非金属性Cl>Si,故氢化物稳定性Y<Z,故B错误;
C.电子层结构相同核电荷数越大离子半径越小,故离子半径O2->Na+,故C错误;
D.二氧化硅能与氢氧化钠反应生成硅酸钠与水,除氢氟酸外二氧化硅不溶于其它酸,不能越高氯酸反应,故D错误;
故选A.点评:
本题考点: 微粒半径大小的比较;元素周期律和元素周期表的综合应用.
考点点评: 本题考查位置结构性质关系、半径比较、化学键、二氧化硅的性质等,难度中等,推断元素是解题的关键,注意对元素周期律的理解与运用.1年前查看全部
- (2014•邯郸县二模)类推是化学学习和研究中常用的思维方法.下列类推错误的是( )
(2014•邯郸县二模)类推是化学学习和研究中常用的思维方法.下列类推错误的是( )
①Mg可由电解熔融MgCl2制取;则Al也可由电解熔融AlCl3制取
②晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子
③1mol•L-1的NaCl溶液每升中含有1mol Na+;则1mol•L-1的FeCl3溶液每升中也含有1mol Fe3+
④使用pH试纸时必须保持干燥;则湿润的pH试纸测得的pH一定有误差.
A.①③
B.①③④
C.②③④
D.①②③④ hisusi1年前1
hisusi1年前1 -
 qqd28835 共回答了15个问题
qqd28835 共回答了15个问题 |采纳率93.3%解题思路:①氯化铝是共价化合物,熔融物中不含自由移动的铝离子;
②在金属晶体中,存在金属阳离子和自由移动的电子;
③铁离子在溶液中要水解,但是钠离子不会水解;
④pH试纸在使用之前不能用蒸馏水润湿.①氯化铝是共价化合物,熔融氯化铝不含自由移动的铝离子,电解熔融的氧化铝来制取金属铝,故错误;
②晶体中有阳离子,未必一定有阴离子,如:在金属晶体中,存在金属阳离子和自由移动的电子,故错误;
③铁离子在溶液中要水解,1mol•L-1的FeCl3溶液每升中含有Fe3+小于1mol,故错误;
④pH试纸在使用之前不能用蒸馏水润湿,否则测定的是稀释以后溶液的pH值,但是弱测定纯水的pH时,不会影响结果,故错误.
故选D.点评:
本题考点: 金属冶炼的一般原理;金属晶体;测定溶液pH的方法;盐类水解的应用.
考点点评: 本题涉及金属的冶炼、盐的水解、pH试纸的使用以及晶体的构成微粒等知识,注意知识的归纳和整理是关键,难度中等.1年前查看全部
- (2014•邯郸县二模)(1)粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用
(2014•邯郸县二模)(1)粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用.精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是______(填序号).
(2)工业生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.选择适宜的催化剂,是否可以提高SO2的转化率?______(填“是”或“否”),是否可以增大该反应所放出的热量?______(填“是”或“否”);
(3)水是一种重要的自然资源,天然水在净化处理过程中加入的混凝剂可以是______(填两种物质名称),其净水作用的原理是______.
(4)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO).若某天然水中c(Ca2)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为______.
(5)若(4)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2______g,后加入Na2CO3______g. zhangxiaohong7111年前1
zhangxiaohong7111年前1 -
 有风的天 共回答了23个问题
有风的天 共回答了23个问题 |采纳率87%解题思路:(1)抓住除钡离子要放在除碳酸根离子前、盐酸放在最后即可得到顺序关系;
(2)催化剂只影响反应速率,不影响化学平衡,所以不影响转化率和反应热,据此进行解答;
(3)混凝剂是溶液中水解生成胶体的盐类,净水作用是吸附悬浮杂质使其聚沉达到净化目的;
(4)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(5)硬水软化需要把钙离子和镁离子全部沉淀,加入氢氧化钙和镁离子、碳酸氢根离子反应,加入碳酸钠沉淀钙离子.(1)应先加入过量BaCl2,除去SO42-,然后加过量Na2CO3,可除去Ca2+、Mg2+、人e3+等,过滤后加入盐酸可除去Na2CO3,
故答案为:③①②;
(2)催化剂只对反应速率有影响,催化剂不影响化学平衡,所以变化对二氧化硫的转化率产生影响,也不会影响反应放出的热量,
故答案为:否;否;
(3)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,如明矾、硫酸铝、硫酸铁、硫酸亚铁等,
故答案为:明矾、硫酸铝、硫酸铁、硫酸亚铁(填其中任何两种);铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的;
(4)某天然水中c(Ca2+)=1.2×10-3mol•L-1,c(Mg2+)=6×10-4mol•L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,所以水的硬度=[67.2mg/10mg]=10°
故答案为:10°;
(5)10m3这种天然水水中含有钙离子物质的量=10×103L×1.2×10-3mol•L-1=12mol;镁离子物质的量为:10×103L×6×10-4mol•L-1=6mol;碳酸氢根离子物质的量=10×103L×8×10-4mol•L-1=8mol;加入氢氧化钙发生的反应为:
Mg2++2OH-=Mg(OH)2↓ HCO3-+OH-=CO32-+H2O
1 2 1 1 1
6mol 12mol8mol 8mol 8mol
共需氢氧根物质的量20mol;
需要Ca(OH)2物质的量10mol,氢氧化钙质量为74g/mol×10mol=740g,
水溶液中Ca2+物质的量为12mol+10mol=22mol,
其中需要加入的CO32-的物质的量为:n(CO32-)=22mol-8mol=14mol,
需要Na2CO3的质量为:m(Na2CO3)=14mol×106g/mol=1484g,
故答案为:740;1484.点评:
本题考点: 粗盐提纯;化学平衡的影响因素.
考点点评: 本题考查了粗盐的提纯、盐类水解的应用,题目难度中等,注意掌握净水方法和软化原理,计算水的硬度时需要理解题干信息,然后准确计算.1年前查看全部
- (2014•邯郸县二模)I.Fe2+和I-是两种常见的还原性离子.
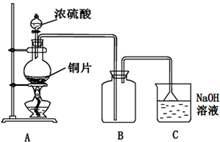 (2014•邯郸县二模)I.Fe2+和I-是两种常见的还原性离子.
(2014•邯郸县二模)I.Fe2+和I-是两种常见的还原性离子.
请以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+.设计实验方案,补充完成实验步骤、预期现象和结论.其他限选试剂:3mol•L-1 H2SO4、0.01mol•L-1 KMnO4、20% KSCN、3% H2O2、淀粉溶液、紫色石蕊溶液.
Ⅱ.某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g铜片和含0.2moL溶质的18.4mol•L-1浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)实验步骤 预期现象与结论 步骤1:取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水. 溶液变成黄色 步骤2:
______
______
(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:______
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:______
a.铁粉 b.钠c.氯化钡溶液d.银粉
(3)为定量测定余酸的物质的量浓度,进行了如下设计:
设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度.他设计了如下二种方案来测定SO2的量:
方案①将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
方案②将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀.
经仔细分析后,发现有不合理之处,请填写下表(若合理不填):
序号 不合理的原因 误差
(偏低或偏高)改变措施 方案① ______ ______ ______ 方案② ______ ______ ______  飞舞大uu的uu1年前1
飞舞大uu的uu1年前1 -
 恶猛 共回答了20个问题
恶猛 共回答了20个问题 |采纳率85%解题思路:Ⅰ步骤二可以用淀粉溶液检验碘单质的存在,也可以用KSCN溶液检验铁离子的存在;Ⅱ(1)随着反应的进行,硫酸的浓度逐渐降低,如铜和硫酸都剩余,则可说明稀硫酸与铜不反应;(2)如证明有硫酸剩余,可用铁等金属验证;(3)方案①中含有硫酸,会导致生成的硫酸钡质量偏大,则二氧化硫的物质的量偏大,测定的剩余的硫酸的浓度偏低;二氧化硫可与硝酸钡发生氧化还原反应,生成硫酸钡沉淀,可用于测量含量;乙学生设计的方案没有排除硫酸铜的影响,因硫酸铜与氢氧化钠反应生成沉淀,不能达到滴定终点;I步骤二:可以用淀粉溶液检验碘单质的存在,溶液变蓝,证明I-的还原性强于Fe2+,也可以用20%KSCN溶液检验铁离子的存在,向试管中继续滴加几滴KSCN溶液,若溶液不变红,也说明I-的还原性强于Fe2+,
故答案为:
实验步骤 预期现象与结论
步骤1:
步骤2:
向试管中继续滴加几滴20%KSCN溶液
或向试管中继续滴加几滴淀粉溶液 溶液不变红血红色,证明I-的还原性强于Fe2+
或溶液变蓝色,证明I-的还原性强于Fe2+II.(1)随着反应的进行,硫酸的浓度逐渐降低,如铜和硫酸都剩余,则可说明稀硫酸与铜不反应,则没有必要进行稀硫酸与铜片的反应,
故答案为:无必要,随着反应的进行,浓硫酸变成稀硫酸,稀硫酸与铜不反应;
(2)如证明有硫酸剩余,可用铁等金属验证,因含有水,则不能用钠,因含有生成的硫酸铜,则不能用氯化钡,银与稀硫酸不反应,故答案为:a;
(3)方案①中含有硫酸,会导致生成的硫酸钡质量偏大,则二氧化硫的物质的量偏大,测定的剩余的硫酸的浓度偏低,可将硫酸酸化的高锰酸钾溶液换成溴水后碘水后硝酸溶液;方案②二氧化硫可与硝酸钡发生氧化还原反应,生成硫酸钡沉淀,可用于测量含量,
故答案为:
序号 不合理的原因 误差
(偏低或偏高) 改变措施
方案① 高锰酸钾溶液中含有硫酸,与氯化钡反应,使生成的沉淀增多 偏低 将硫酸酸化的高锰酸钾溶液换成溴水后碘水后硝酸溶液
方案② --- --- ---.点评:
本题考点: 性质实验方案的设计;氧化还原反应;浓硫酸的性质.
考点点评: 本题考查了还原性大小的实验探究、物质组成的测定、对实验方案的理解评价等,难度中等,理解原理是解题的关键,注意基础知识的掌握,综合性较强.1年前查看全部
- (4w中如•邯郸县二模)中L某混合溶液p,溶质X、Y的浓度都为w.中mol•L-中,向混合溶液p滴加某溶液Z(w.中mo
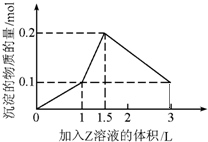 (4w中如•邯郸县二模)中L某混合溶液p,溶质X、Y的浓度都为w.中mol•L-中,向混合溶液p滴加某溶液Z(w.中mol•L-中氢氧化钠或硫酸溶液)至溶液呈p性,所得沉淀的物质的量如4所示,则X、Y、Z分别是( )
(4w中如•邯郸县二模)中L某混合溶液p,溶质X、Y的浓度都为w.中mol•L-中,向混合溶液p滴加某溶液Z(w.中mol•L-中氢氧化钠或硫酸溶液)至溶液呈p性,所得沉淀的物质的量如4所示,则X、Y、Z分别是( )
A.氯化铝、氯化铁、氢氧化钠
B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸 waseywb1年前1
waseywb1年前1 -
 不ee的花猫 共回答了18个问题
不ee的花猫 共回答了18个问题 |采纳率100%解题思路:若Z为氢氧化钠溶液,根据图象中生成沉淀消耗的体积计算分析判断,生成氢氧化铝沉淀、氢氧化铁沉淀、氢氧化镁沉淀时沉淀物质的量和消耗的碱的物质的量不符合,不能是铝盐;
所以z是硫酸溶液,根据图象分析.从小象趋势和沉淀于消耗Z的量,可知溶液1有偏铝酸钠,无铝盐溶液,故所加Z为硫酸溶液,从生成沉淀质量增加知含na2+;故An错误;
若为偏铝酸钠、氯化钡、硫酸,开始滴入硫酸时会生成沉淀氢氧化铝和硫酸钡沉淀,生成最大量沉淀氢氧化铝0.1m大l,需要硫酸0.02m大l;生成硫酸钡沉淀0.1m大l,需要硫酸0.1m大l,同时生成盐酸氯化氢0.2m大l,所以溶液不能为1性,并且不符合第42拐点,故D不符合;
按小象拐点分成三2阶段.
1:硫酸和氢氧化钡分别是二元强酸强碱,因此4开始氢氧化钡的大H-和硫酸里的H+1:11和.同时na2+和八大42-,1:1反应生成硫酸钡沉淀.
2:氢氧化钡消耗完,硫酸继续滴加,氢离子开始和偏铝酸根离子反应生成氢氧化铝沉淀,由于H+和Al大2-是1:1反应,但硫酸是两元酸,因此硫酸的消耗量和沉淀的生成量是1:2.
3:硫酸进4步过量,开始消耗沉淀,3份H+消耗4份Al(大H)3,因此硫酸和沉淀消耗量应为1.2:1直到把氢氧化铝完全溶解,只剩下不溶于酸的na八大4.符合小象的数值变化;故C符合;
故选C.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题考查了铝盐、偏铝酸盐和钡盐与碱、酸反应的图象分析判断,题目较难,需要从图象中分析数据结合物质反应和沉淀生成判断.1年前查看全部
- (2014•邯郸县二模)对-甲乙苯()是一种重要的有机原料,用该物质可合成其他物质.
(2014•邯郸县二模)对-甲乙苯(
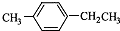 )是一种重要的有机原料,用该物质可合成其他物质.
)是一种重要的有机原料,用该物质可合成其他物质.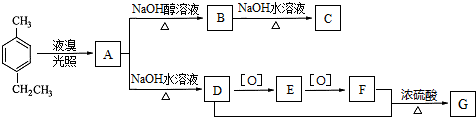
已知:①1mol D与足量钠反应可生成1mol氢气;
②D、E、F每种分子中均只含有一种含氧官能团.
③G是一种有机高分子化合物.
回答下列问题:
(1)对-甲乙苯的系统命名为______;A的结构简式为______.
(2)A→B的反应类型为______;F中含氧官能团的名称为______.
(3)C在引发剂的作用下,可生成高分子化合物,该高分子化合物的链节为______.
(4)1molE和足量银氨溶液反应,生成沉淀的物质的量为______.
(5)D+F→G的化学方程式为______.
(6)H比D相对分子质量小14,H的同分异构体能同时满足如下条件:
①苯环上有两个取代基;②遇氯化铁溶液显紫色;③核磁共振氢谱为六组峰,且峰面积比为2:2:2:2:1:1,写出H的这种同分异构体的简式______. 凤栖梧1年前1
凤栖梧1年前1 -
 byplion 共回答了27个问题
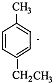
byplion 共回答了27个问题 |采纳率77.8%解题思路: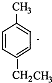 与液溴在光照条件下溴取代在侧链上,由于D→E→F是两步氧化,可推知它们是醇醛酸之间的转化,根据已知(1)可知每个D中含有两个羟基,再根据已知(2)推知溴只能取代在
与液溴在光照条件下溴取代在侧链上,由于D→E→F是两步氧化,可推知它们是醇醛酸之间的转化,根据已知(1)可知每个D中含有两个羟基,再根据已知(2)推知溴只能取代在 的两个甲基上,得到A(
的两个甲基上,得到A(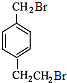 ),再根据有机框图中的条件可以推得D为:
),再根据有机框图中的条件可以推得D为: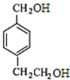 E为:
E为: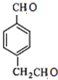 F为:
F为: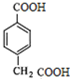 ,
,
G是一种有机高分子化合物,所以G为: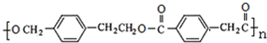 ;根据A→B→C的条件,NaOH的醇溶液发生消去反应,NaOH的水溶液发生取代反应,可推知B为
;根据A→B→C的条件,NaOH的醇溶液发生消去反应,NaOH的水溶液发生取代反应,可推知B为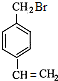 ; C为
; C为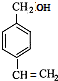 ;
;
 与液溴在光照条件下溴取代在侧链上,由于D→E→F是两步氧化,可推知它们是醇醛酸之间的转化,根据已知(1)可知每个D中含有两个羟基,再根据已知(2)推知溴只能取代在
与液溴在光照条件下溴取代在侧链上,由于D→E→F是两步氧化,可推知它们是醇醛酸之间的转化,根据已知(1)可知每个D中含有两个羟基,再根据已知(2)推知溴只能取代在 的两个甲基上,得到A(
的两个甲基上,得到A( ),再根据有机框图中的条件可以推得D为:
),再根据有机框图中的条件可以推得D为: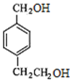 E为:
E为: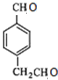 F为:
F为: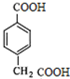 ,G是一种有机高分子化合物,所以G为:
,G是一种有机高分子化合物,所以G为: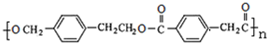 ;根据A→B→C的条件,NaOH的醇溶液发生消去反应,NaOH的水溶液发生取代反应,可推知B为
;根据A→B→C的条件,NaOH的醇溶液发生消去反应,NaOH的水溶液发生取代反应,可推知B为 ; C为
; C为 ;
;
(1)根据系统命名法规则,对-甲乙苯中以苯环作母链,从小取代基开始编号,甲基、乙基作支链如图所示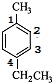 .根据反应
.根据反应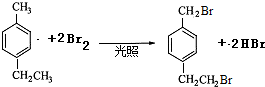 可推知A的结构为
可推知A的结构为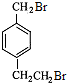 .故答案为:1-甲基-4-乙基苯;
.故答案为:1-甲基-4-乙基苯; ;
;
(2)卤代烃在NaOH的醇溶液发生消去反应,根据前面的分析可知F的结构,从而可推知F中含有官能团为羧基,故答案为:消去反应;羧基;
(3) 在一定条件下会发生加聚反应生成
在一定条件下会发生加聚反应生成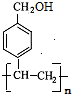 ,此高分子聚合物链节为:
,此高分子聚合物链节为: ,故答案为:
,故答案为: ;
;
(4)根据反应: +4[Ag(NH3)2]++4OH-
+4[Ag(NH3)2]++4OH-
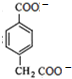 +2NH4++4Ag↓+6NH3+2H2O进行计算可得Ag的物质的量为4mol,
+2NH4++4Ag↓+6NH3+2H2O进行计算可得Ag的物质的量为4mol,
故答案为:4mol;
(5)根据前面的分析可得D为: F为:
F为: ,D+F→G的化学方程式为:
,D+F→G的化学方程式为: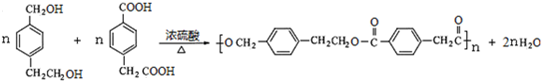 ,故答案为:
,故答案为: ;
;
(6)H比D相对分子质量小14,可知H的组成比D少一个碳,遇氯化铁溶液显紫色说明H中有苯酚的结构,苯环上有两个取代基且核磁共振氢谱为六组峰,说明H中两个取代基在苯环的对位,由于峰面积比为2:2:2:2:1:1,则H的结构为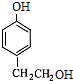 ,故答案为:
,故答案为: .
.点评:
本题考点: 有机物的推断.
考点点评: 本题主要考查了学生对有机官能团性质及有机反应类型的把握情况,具有一定的综合性,只要基础扎实的学生解决这样的问题没什么难度,本题主要难点还是在于书写有条件的同分异构体.对学生综合分析问题的能力要求比较高.1年前查看全部
- (2014•邯郸县二模)下列说法正确的是( )
(2014•邯郸县二模)下列说法正确的是( )
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)•c(SO42-),所以在BaSO4溶液中有c(Ba2+)=c(SO42-)=KSP
③将0.1mol•L-1的NaHS和0.1mol•L-1 Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
④在0.1mol•L-1氨水中滴加0.1mol•L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol•L-1.
A.①④
B.②③
C.③④
D.①② cyj6071年前1
cyj6071年前1 -
 xjw222qy 共回答了17个问题
xjw222qy 共回答了17个问题 |采纳率88.2%解题思路:①若a+n<7时,常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;但是若a+n≥7时,溶液稀释后其pH不可能大于7,只能无限接近7;
②对于饱和溶液,在BaSO4溶液中有c(Ba2+)=c(SO42-)=
,若溶液不饱和,该关系不成立;KSP
③根据0.1mol•L-1的NaHS和0.1mol•L-1 Na2S混合溶液中物料守恒和电荷守恒进行判断;
④刚好完全中和时,氢离子与氢氧根离子浓度相等,pH=a的溶液中c(H+)=c(OH-)=10-amol•L-1.①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,若a+n<7时,则pH=a+n;但是若a+n≥7时,溶液稀释后其pH不可能大于7,溶液的pH只能无限接近7,故①错误;
②已知BaSO4的Ksp=c(Ba2+)•c(SO42-),对于饱和溶液BaSO4溶液中,则有c(Ba2+)=c(SO42-)=
KSP,但是若溶液不是饱和溶液,该关系不会成立,故②错误;
③将0.1mol•L-1的NaHS和0.1mol•L-1 Na2S溶液等体积混合,根据物料守恒可得:2c(Na+)=3[c(HS-)+c(H2S)+c(S2-)],根据电荷守恒可知:c(H+)+c(Na+)=2c(S2-)+c(OH-)+c(HS-),由电荷守恒和物料守恒联立可得:c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S),故③正确;
④在0.1mol•L-1氨水中滴加0.1mol•L-1盐酸,刚好完全中和时pH=a,则溶液中c(OH-)=c(H+)=10-amol•L-1,故④正确;
故选C.点评:
本题考点: pH的简单计算;难溶电解质的溶解平衡及沉淀转化的本质;离子浓度大小的比较;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了溶液pH的计算、溶液中离子浓度大小比较、难溶电解质的沉淀平衡等知识,题目难度中等,注意掌握酸碱混合后溶液的定性判断及溶液中pH的计算方法,明确酸溶液稀释后不可能变成碱溶液,常温下溶液的pH只能无限接近7;学会利用电荷守恒、物料守恒、盐的水解原理比较溶液中离子浓度大小.1年前查看全部
大家在问
- 11、2、3题请解释一下.4题直接写就好了
- 2桃花源记、要答案,急老人引杨氏入山之大穴.鸡犬陶冶,居民之大聚落也.至一家,老人谓曰:“此公欲来,能相容否?”对曰:“老
- 3His mood was one of the resigned acceptance是什么意思?
- 4仿写:弹得多纯熟啊!感情多深哪!
- 5分别以孔.雀.东.南.飞.开头的五字经典诗句
- 6英语先行词的表抽象地点的有哪些
- 7(2009•上海)在牛蛙的脊髓反射实验中,若要证明感受器是完成曲腿反射必不可少的环节,下列操作不合适的是( )
- 8于是左右皆惧,
- 9我花费350元买那辆自行车.The bike ______350 yuan
- 10某校举行了一次“防火安全知识竞赛”,共有900名学生参加竞赛(得分取整数,满分100分).从中抽取了部分学生的成绩进行统
- 11() she medium height?() she wear glasses?A.Has;is B.Is;has C
- 12请问~数学是我最感兴趣的课程,怎么翻译成英语
- 13关于地字的古诗句,俩句
- 14抛物线y=4x2-1与y轴的交点坐标是 ___ ,与x轴的交点坐标是 ___ .
- 15(1)下列事实说明分子的什么性质?
