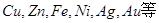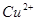电解精炼铜的电极反应式和总反应方程是和i
 hmdubd2022-10-04 11:39:541条回答
hmdubd2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 zqq032003 共回答了20个问题
zqq032003 共回答了20个问题 |采纳率90%- Cu - 2e- = Cu2+
Cu2+ + 2e- = Cu
上面是粗铜下面是精铜 合起来就Cu=Cu - 1年前
相关推荐
- 下列说法中正确的是( )A.电解精炼铜时,用粗铜(含少量锌、铁等杂质)作阳极,纯铜作阴极,用CuSO4溶液作电解液.电
下列说法中正确的是( )
A.电解精炼铜时,用粗铜(含少量锌、铁等杂质)作阳极,纯铜作阴极,用CuSO4溶液作电解液.电解前后,溶液中铜离子浓度不变
B.20℃稀NaOH溶液的Kw大于80℃稀H2SO4溶液的Kw
C.100℃pH=2的H2SO4溶液与100℃pH=12的NaOH溶液等体积混合,溶液显碱性
D.往NH4HCO3溶液中加过量NaOH溶液的离子方程式为:NH4++OH-=NH3+H2O 网络gg1年前1
网络gg1年前1 -
 alex_wo 共回答了27个问题
alex_wo 共回答了27个问题 |采纳率85.2%解题思路:A、粗铜中铜是电子发生氧化反应,含有的锌、铁也会失电子发生氧化反应,依据电子守恒分析判断;
B、水的电离是吸热过程,升温促进水的电离,水的离子积常数增大;
C、100°C离子积常数增大中性溶液PH小于7;
D、过量的氢氧化钠溶液和碳酸氢根离子、铵根离子反应.A、粗铜中铜是电子发生氧化反应,含有的锌、铁也会失电子发生氧化反应,依据电子守恒分析判断,溶液中铜离子浓度减小,故A错误;
B、水的电离是吸热过程,升温促进水的电离,水的离子积常数增大,20℃稀NaOH溶液的Kw小于80℃稀H2SO4溶液的Kw,故B错误;
C、100°C离子积常数增大中性溶液PH小于7,100℃pH=2的H2SO4溶液与100℃pH=12的NaOH溶液等体积混合,碱过量溶液显碱性,故C正确;
D、往NH4HCO3溶液中加过量NaOH溶液的离子方程式为:NH4++HCO3-+2OH-=NH3•H2O+H2O+CO32-,故D错误;
故选C.点评:
本题考点: 电解原理;离子方程式的书写;水的电离;pH的简单计算.
考点点评: 本题考查了电解原理分析应用,水的电离平衡影响因素分析,离子积常数的分析应用,离子方程式书写量不同产物不同,题目难度中等.1年前查看全部
- 下列叙述不正确的是( )A.铜锌原电池中,锌作负极,电子从锌极流向铜极B.电解精炼铜时,同一时间内阳极溶解铜的质量比阴
下列叙述不正确的是( )
A.铜锌原电池中,锌作负极,电子从锌极流向铜极
B.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
C.电镀铜时,金属铜作阳极,电镀液可用硫酸铜溶液
D.电解饱和食盐水时,用铁做阳极,Cl-发生氧化反应 桦之恋王1年前1
桦之恋王1年前1 -
 fdrete 共回答了11个问题
fdrete 共回答了11个问题 |采纳率100%解题思路:A、活泼性强的作负极,电子从负极流向正极;
B、电解精炼铜时,阳极溶解铜和活泼性比铜强的金属杂质,阴极只析出铜;
C、电镀时,镀层金属作阳极,含有镀层金属离子的盐为电解质;
D、活性电极作阳极时,电极失电子.A、原电池中活泼性强的金属作负极,电子从负极流向正极,则铜锌原电池中,锌作负极,电子从锌极流向铜极,故A正确;
B、电解精炼铜时,阳极溶解铜和活泼性比铜强的金属杂质,阴极只析出铜,所以同一时间内阳极溶解铜的质量比阴极析出铜的质量小,故B正确;
C、电镀时,镀层金属作阳极,含有镀层金属离子的盐为电解质,则电镀铜时,金属铜作阳极,电镀液可用硫酸铜溶液,故C正确;
D、活性电极作阳极时,电极失电子,所以电解饱和食盐水时,用铁做阳极,铁失电子发生氧化反应,Cl-不反应,故D错误.
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理和电解池原理,题目难度不大,侧重于基础知识的考查.1年前查看全部
- 书上说电解就是电能转化为化学能,那么电镀,电解精炼铜时电能到底转化为什么样的化学能了?
 火焰之子1年前1
火焰之子1年前1 -
 qingang 共回答了16个问题
qingang 共回答了16个问题 |采纳率81.3%说一个你容易理解的例子:给手机锂电池充电的过程,是电解过程,消耗电能,电极物质发生转换;电池在使用过程中,正负极材料自发地发生与充电过程相反的反应,电子从负极流向正极形成电流而得以驱动用电器工作.
电镀铜、电解精炼铜其原理是一样的,都是阳极发生铜溶解、阴极发生铜沉积,两个电极(阴极/阳极)的反应都不是自发的,都需要外加电源才能进行.
阳极产物:Cu - 2e=Cu++ 电能驱使单质铜转换成铜离子(或硫酸铜、或铜离子水团)
阴极反应:Cu++ + 2e=Cu 电能把铜离子转换成单质铜
两个电极的反应一正一反,貌似未发生变化,但电能确确实实被消耗了.1年前查看全部
- 下列说法中正确的是( )A.Pt电极电解NaOH溶液,实质就是电解水,溶液的pH升高B.电解精炼铜时,精铜与外电源的正
下列说法中正确的是( )
A.Pt电极电解NaOH溶液,实质就是电解水,溶液的pH升高
B.电解精炼铜时,精铜与外电源的正极相连
C.铜锌稀硫酸形成的原电池放电时,溶液中阳离子向锌电极移动
D.钢铁发生吸氧腐蚀时,正极的反应是:Fe-2e-=Fe2+ followfeng1年前1
followfeng1年前1 -
 sbzrx 共回答了23个问题
sbzrx 共回答了23个问题 |采纳率82.6%解题思路:A、根据离子放电顺序,电解氢氧化钠溶液实质电解水;
B、电解精炼铜,粗铜做阳极,精铜做阴极;
C、铜锌原电池反应过程中,锌做负极,阳离子移向正极;
D、吸氧腐蚀正极是氧气得到电子发生还原反应;A、Pt电极电解NaOH溶液,实质就是电解水,溶液中氢氧根离子浓度增大,溶液的pH升高,故A正确;
B、电解精炼铜时,精铜与外电源的负极相连,故B错误;
C、铜锌稀硫酸形成的原电池放电时,溶液中阳离子向正极电极移动,锌做负极,铜做正极,故C错误;
D、钢铁发生吸氧腐蚀时,正极的反应是:O2+2H2O+4e-=4OH-,故D错误;
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了电解原理的应用,电解精炼铜的电解选择,原电池的溶液中离子移动方向,吸氧腐蚀的电解反应.1年前查看全部
- 下列有关电解精炼铜的说法中错误的是( )
下列有关电解精炼铜的说法中错误的是( )
A.粗铜做阴极
B.电解一段时间后,溶液中会存在锌、铁等不活泼的金属阳离子
C.阳极泥中含有金、银等贵重金属
D.电解质溶液可以选用硫酸铜溶液 香草加草莓1年前1
香草加草莓1年前1 -
 diangying 共回答了18个问题
diangying 共回答了18个问题 |采纳率100%解题思路:A、电解精炼铜,粗铜作阳极,精铜作阴极;
B、锌、铁等金属的活泼性强于金属铜,会先于铜失电子;
C、不参与阳极放电的金属单质会形成阳极泥;
D、电解精炼铜,所选的电解质是含有铜离子的盐溶液.A、电解精炼铜,粗铜作阳极,精铜作阴极,故A错误;
B、锌、铁等金属的活泼性强于金属铜,会先于铜失电子,电解质中会含有锌离子,亚铁离子,故B正确;
C、在阳极上,不参与放电的金属单质金、银等贵重金属会形成阳极泥,故C正确;
D、电解精炼铜,所选的电解质是含有铜离子的盐溶液,可以选用硫酸铜溶液,故D正确.
故选A.点评:
本题考点: 电解原理.
考点点评: 本题考查学生电解精炼铜的原理,注意电解池的工作原理是关键,难度不大.1年前查看全部
- 电解精炼铜的电极反应式和总反应方程
电解精炼铜的电极反应式和总反应方程
RT JAVACARD1年前1
JAVACARD1年前1 -
 池阁红烛背 共回答了18个问题
池阁红烛背 共回答了18个问题 |采纳率94.4%阴极 Cu2+ +2e- =Cu
阳极 Cu - 2e- =Cu2+
总的方程式一般不要求,1年前查看全部
- 下列有关电解精炼铜的说法中错误的是 A.粗铜做阴极 B.电解一段时间后,溶液中会存在锌、铁等不活泼的金属阳离子 C.阳极
下列有关电解精炼铜的说法中错误的是
A.粗铜做阴极 B.电解一段时间后,溶液中会存在锌、铁等不活泼的金属阳离子 C.阳极泥中含有金、银等贵重金属 D.电解质溶液可以选用硫酸铜溶液  chenyongzhou1年前1
chenyongzhou1年前1 -
 yao1211 共回答了22个问题
yao1211 共回答了22个问题 |采纳率100%A
电解精炼铜时粗铜必须作阳极,精铜作阴极,硫酸铜作电解质溶液。A不正确,D正确。粗铜中含有比铜活泼的金属,电解时先失去电子,B正确。同时粗铜中也含有比铜不活泼的金、银等贵重金属,在电解时不会失去电子,故而形成阳极泥。答案是A。1年前查看全部
- 下列有关电解精炼铜的说法不正确的是( )
下列有关电解精炼铜的说法不正确的是( )
A. 粗铜作阳极
B. 用CuSO4溶液作电解液
C. 阴极的电极反应试为:Cu(2+)+2e-=Cu
D. 当阳极质量减少ag时,阴极质量一定增加ag
下列反应物X,Y ,开始有沉淀,X过量后沉淀消失的一组是
X Y
A. H2S Na2SO3
B.HCL NaALO2
C.NH3 AgNO3
D.NH3.H2O FeCL3
下列叙述中正确的是
A. 离子晶体中一定含有金属阳离子
B. 原子晶体中只有非极性键
C. 金属晶体容易导电,是因为其中含有只有电子
D. 干冰汽化是,共价键被破坏
在空气中不易被氧化,也不易被分解,且可以用无色玻璃试剂瓶存放的是
A.石灰炭 B.氢硫酸 C,氢氟酸 D.醋酸 wjf11年前1
wjf11年前1 -
 sfyfbg 共回答了19个问题
sfyfbg 共回答了19个问题 |采纳率89.5%D
B
C
D1年前查看全部
- 试分析电解精炼铜与电镀铜又和相似之处,并写出电解精炼铜的电极反应式
 czhs55881年前1
czhs55881年前1 -
 xiaofeng36 共回答了22个问题
xiaofeng36 共回答了22个问题 |采纳率100%相同点都可以用硫酸铜溶液做电解液.
电解精炼铜的电极反应式:阴极 Cu2++2e-=Cu
阳极 Cu-2e-=Cu2+
Zn-2e-=Zn2+
Ni-2e-=Ni2+1年前查看全部
- 下列说法正确的是( )A. 电解精炼铜的过程中,粗铜与电源的负极相连B. C4H9Br在氢氧化钾醇溶液中加热后可生成4
下列说法正确的是( )
A. 电解精炼铜的过程中,粗铜与电源的负极相连
B. C4H9Br在氢氧化钾醇溶液中加热后可生成4种烯烃
C. 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
D. 常温下,将0.1 mol•L-1氨水加水稀释,则c(NH4+)与c(H+)的比值将减小 海岸之珠1年前1
海岸之珠1年前1 -
 caoshuiyi 共回答了18个问题
caoshuiyi 共回答了18个问题 |采纳率100%解题思路:A.粗铜精炼时粗铜为阳极;
B.丁烷有2种同分异构体,则C4H9Br有4种结构,但消去反应生成的烯烃只有3种;
C.反应C(s)+CO2(g)=2CO(g)的△S>0,由不能自发进行可知,△H-T△S>0;
D.0.1 mol•L-1氨水加水稀释,促进电离,铵根离子的浓度减小,氢氧根离子浓度减小,由Kw可知,c(H+)增大.A.粗铜精炼时粗铜为阳极,则粗铜与电源的正极相连,故A错误;
B.丁烷有2种同分异构体,则C4H9Br有4种结构,但消去反应生成的烯烃只有3种,为1-丁烯、2-丁烯、2-甲基丙烯,故B错误;
C.反应C(s)+CO2(g)=2CO(g)的△S>0,由不能自发进行可知,△H-T△S>0,所以△H>T△S>0,故C正确;
D.0.1 mol•L-1氨水加水稀释,促进电离,铵根离子的浓度减小,氢氧根离子浓度减小,由Kw可知,c(H+)增大,则c(NH4+)与c(H+)的比值将减小,故D正确;
故选CD.点评:
本题考点: 电解原理;反应热和焓变;弱电解质在水溶液中的电离平衡;卤代烃简介.
考点点评: 本题为小综合,涉及粗铜精炼、同分异构体、消去反应、反应进行方向的判断、弱电解质的电离等,综合性较强,注重对高考常考考点的考查,题目难度中等.1年前查看全部
- 下列叙述正确的是 A.电解精炼铜时,转移1mol电子,阳极上溶解的铜原子数必为0.5N A B.常温下,4.4gCO 2
下列叙述正确的是
A.电解精炼铜时,转移1mol电子,阳极上溶解的铜原子数必为0.5N A B.常温下,4.4gCO 2 和N 2 O混合物中所含有的原子数为0.3×6.02×10 23 C.等体积0.2mol·L -1 HCl溶液与0.05mol·L -1 Ba(OH) 2 溶液混合后,溶液的pH=1 D.溶液中由水电离出的c(H + )=1×10 -12 mol/L,SO 4 2 - 、NO 3 - 、Fe 2 + 、Mg 2 + 能大量共存  jaea781年前1
jaea781年前1 -
 象梦游般 共回答了18个问题
象梦游般 共回答了18个问题 |采纳率88.9%B
1年前查看全部
- 下列关于电解的说法中,正确的是( ) A.电解池是把化学能转变为电能的装置 B.电解精炼铜时,粗铜板做阴极 C.电镀时
下列关于电解的说法中,正确的是( ) A.电解池是把化学能转变为电能的装置 B.电解精炼铜时,粗铜板做阴极 C.电镀时,通常把待镀的金属制品做阴极 D.工业电解饱和食盐水用于生产金属钠和氯气  ae_uca95kj3e041年前1
ae_uca95kj3e041年前1 -
 西北雪狼狐 共回答了16个问题
西北雪狼狐 共回答了16个问题 |采纳率100%A.电解池中电能转化为化学能,则电解池是把电能转变为化学能的装置,故A错误;B.电镀时粗铜作阳极,则电解精炼铜时,粗铜板做阳极,故B错误;C.电镀时,镀件作阴极,则电镀时,通常把待镀的金属制品做阴极,...1年前查看全部
- 下列叙述错误的是( )A.钢铁表面发生吸氧腐蚀时,钢铁表面水膜的pH增大B.电解精炼铜,开始通电一段时间后,阳极溶解的
下列叙述错误的是( )
A.钢铁表面发生吸氧腐蚀时,钢铁表面水膜的pH增大
B.电解精炼铜,开始通电一段时间后,阳极溶解的铜的质量比阴极析出的铜的质量少
C.在镀件上电镀锌,用锌作阳极
D.工作时在原电池的负极和电解池的阴极上都是发生失电子过程 爱匝匝地1年前1
爱匝匝地1年前1 -
 银白温度 共回答了15个问题
银白温度 共回答了15个问题 |采纳率93.3%解题思路:A、根据钢铁表面发生吸氧腐蚀时的电极反应式分析判断;
B、根据阳极材料组成分析判断;
C、电镀时,镀层作阳极,镀件作阴极;
D、工作时,原电池的负极上失电子,电解池的阴极上得电子.A、钢铁表面发生吸氧腐蚀时,正极上的电极反应式为:2H2O+O2+4e-=4OH-,由此可知,钢铁表面水膜的pH增大,故A正确;.
B、电解精炼铜时,因为粗铜含有杂质,所以开始通电一段时间后,阳极溶解的铜的质量比阴极析出的铜的质量少,故B正确;
C、电镀时,镀层作阳极,镀件作阴极,所以在镀件上电镀锌,用锌作阳极,故C正确;
D、工作时,原电池的负极上失电子发生氧化反应,电解池的阴极上得电子发生还原反应,故D错误.
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,难度不大,明确原电池和电解池的区别.1年前查看全部
- 下列说法正确的是 A.电解精炼铜时,同一时间内阳极溶解的粗铜的质量比阴极析出的铜的质量大 B.在镀件上电镀锌,可以用锌做
下列说法正确的是
A.电解精炼铜时,同一时间内阳极溶解的粗铜的质量比阴极析出的铜的质量大 B.在镀件上电镀锌,可以用锌做阳极,也可以用惰性材料做阳极 C.二次电池充电过程是化学能转化为电能的过程 D.二次电池充电时,电池上标有“+”的电极应与外接电源的负极相连  hitleijunmin1年前1
hitleijunmin1年前1 -
 ff文云 共回答了14个问题
ff文云 共回答了14个问题 |采纳率100%1年前查看全部
- 电解精炼铜的硫酸铜溶液为什么要加一定量的硫酸铜?
电解精炼铜的硫酸铜溶液为什么要加一定量的硫酸铜?
回答越详细越准确越好
是加一定量的硫酸,去掉最后一个"铜"字 xuanwind1年前3
xuanwind1年前3 -
 huang209 共回答了12个问题
huang209 共回答了12个问题 |采纳率83.3%酸性环境保证硫酸铜不水解沉淀1年前查看全部
- 下列关于工业生产说法不正确的是( ) A.电解精炼铜时,用粗铜做阴极,纯铜做阳极 B.在硫酸工业、合成氨工业、硝酸工业
下列关于工业生产说法不正确的是( ) A.电解精炼铜时,用粗铜做阴极,纯铜做阳极 B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 C.在炼铁工业,需要的原料有铁矿石、焦炭、空气、石灰石等 D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳  leeyxu1年前1
leeyxu1年前1 -
 可悲的老虎 共回答了14个问题
可悲的老虎 共回答了14个问题 |采纳率78.6%A、电解精炼铜时,金属铜在阴极析出,粗铜作阳极不断的溶解,纯铜作阴极析出金属铜,故A错误;
B、化学反应产物的循环利用可以提高原料利用率,故B正确;
C、高炉炼铁的原理是一氧化碳还原氧化铁,一氧化碳可以由焦炭还原二氧化碳得到,原料有铁矿石、焦炭、空气、石灰石,故C正确;
D、因为氨气溶解度非常大,先氨气后二氧化碳,能增大二氧化碳的吸收,有利于生成纯碱,故D正确.
故选A.1年前查看全部
- 电解精炼铜(杂质Zn,Au,Pt,Ag)时的阳极泥是啥?
 jeavincf1年前2
jeavincf1年前2 -
 vincentandlaura 共回答了19个问题
vincentandlaura 共回答了19个问题 |采纳率89.5%就是在电极上无法失去电子的金属,金,铂,银等.1年前查看全部
- 电解精炼铜为什么比铜活泼的金属:Zn、Fe、Ni只溶解,不析出
电解精炼铜为什么比铜活泼的金属:Zn、Fe、Ni只溶解,不析出
还有为什么比铜不活泼的金属:Au、Pt不溶解,而以单质沉积形成阳极泥; z3621036331年前1
z3621036331年前1 -
 0722ing 共回答了22个问题
0722ing 共回答了22个问题 |采纳率77.3%用电流强度控制:Cu被氧化(不活泼的就不被氧化);Cu2+被还原(活泼的就不被还原).1年前查看全部
- 电解精炼铜①粗铜的溶解与纯铜的生成:阳极(粗铜):Cu -2e- = Cu2+阴极(纯铜):Cu2+ + 2e- = C
电解精炼铜
①粗铜的溶解与纯铜的生成:阳极(粗铜):Cu -2e- = Cu2+
阴极(纯铜):Cu2+ + 2e- = Cu
②比铜活泼的金属:Zn、Fe、Ni只溶解,不析出;
Zn - 2e- = Zn 2+ Ni-2e- = Ni 2+
③比铜不活泼的金属:Au、Pt不溶解,而以单质的形式沉积在电解槽底,形成阳极泥;
我想问的是,②Zn、Fe、Ni是不放电的啊,为什么为失去电子,再者,变成离子后应该会得电子变成单质啊,为什么为什么?③为什么Au、Pt会跑出来,什么原因? 刘bao1年前2
刘bao1年前2 -
 蠢过只猪 共回答了21个问题
蠢过只猪 共回答了21个问题 |采纳率90.5%问题1:Zn、Fe、Ni肯定是放电的啊,越活泼的越先析出的;离子得电子变单质不是初中化学学的吗?
问题2:因为Au、Pt是粗铜中的杂质,因为铜析出,而Au、Pt不发生电极反应,因而出来了啊1年前查看全部
- 下列说法正确的是( )A.原电池中的负极质量一定减轻B.电解精炼铜时精铜做阳极C.金属被腐蚀的实质是金属原子失电子被氧
下列说法正确的是( )
A.原电池中的负极质量一定减轻
B.电解精炼铜时精铜做阳极
C.金属被腐蚀的实质是金属原子失电子被氧化
D.钢铁发生吸氧腐蚀时的负极反应为:Fe-3e-=Fe3+ 想看发嗲包落泪1年前1
想看发嗲包落泪1年前1 -
 sp2156333 共回答了15个问题
sp2156333 共回答了15个问题 |采纳率100%解题思路:A.原电池放电时,负极质量可能增大、可能不变也可能减小;
B.电解精炼粗铜时,粗铜作阳极、纯铜作阴极;
C.失电子的物质作还原剂,在反应中被氧化;
D.钢铁发生吸氧腐蚀时,负极上铁失电子生成亚铁离子.A.原电池放电时,负极质量可能增大、可能不变也可能减小,如铅蓄电池中负极电极反应式为Pb-2e-+SO42-=PbSO4↓,负极质量增加,燃料电池中负极材料质量不变,故A错误;
B.电解精炼粗铜时,粗铜作阳极、纯铜作阴极,电解质溶液为可溶性的铜盐,故B错误;
C.失电子的物质作还原剂,在反应中被氧化,所以金属被腐蚀的实质是金属原子失电子被氧化,故C正确;
D.钢铁发生吸氧腐蚀时,负极上铁失电子生成亚铁离子,电极反应式为Fe-2e-=Fe2+,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,明确各个电极上发生的反应是解本题关键,注意A中负极质量变化情况、D中铁生成亚铁离子而不是铁离子,这些都是易错点.1年前查看全部
- 为什么电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小?
 悠U1年前2
悠U1年前2 -
 豆豆2722 共回答了21个问题
豆豆2722 共回答了21个问题 |采纳率90.5%你也说道了的,是精炼铜,在反应方程中应该是平衡的,但是由于被电解的铜中有杂质,例如氧化铜等铜的化合物存在,阴极析出的铜市纯铜,铜元素质量没有变,但是氧元素等杂质转化了,所以同一时间阳极溶解的铜的质量小于阴极析出铜的质量.1年前查看全部
- 若N A 表示阿佛加德罗常数,下列说法正确的是( ) A.电解精炼铜时,阴极质量每增加63.5g时转移的电子数是2N
若N A 表示阿佛加德罗常数,下列说法正确的是( ) A.电解精炼铜时,阴极质量每增加63.5g时转移的电子数是2N A B.5.6L Cl 2 与足量铁粉反应时转移的电子数为0.5N A C.1L 1mol•L -1 的CH 3 COOH溶液中含有H + 的数目是N A D.1L 0.5mol•L -1 的Na 2 CO 3 溶液中含有CO
的数目是0.5N A2-3  风之天秤1年前1
风之天秤1年前1 -
 wq19 共回答了16个问题
wq19 共回答了16个问题 |采纳率87.5%A、电解精炼铜粗铜做阳极,精铜做阴极,溶液中铜离子在阴极得到电子析出,阴极质量每增加63.5g时,物质的量=
63.5g
63.5g/mol =1mol;电极反应Cu 2+ +2e - =Cu;转移的电子数是2N A ,故A正确;
B、温度压强不知,5.6L Cl 2 无法计算物质的量,故B错误;
C、醋酸是弱电解质,存在电离平衡;1L 1mol•L -1 的CH 3 COOH溶液中含有H + 的数目小于N A ,故C错误;
D、碳酸钠溶液中碳酸根离子水解;1L 0.5mol•L -1 的Na 2 CO 3 溶液中含有CO
2-3 的数目小于0.5N A ,故D错误;
故选A.1年前查看全部
大家在问
- 1极限运动包括哪些运动?
- 2(2011•淮安)在半径为6cm的圆中,60°的圆心角所对的弧长等于_________
- 3wind 过去式和过去分词 急,quick
- 4用分子的相关知识解释下列生活中的现象,其中错误的是( ) A.湿衣服在夏天比冬天容易晾干,说明分子
- 5若f(x)在[a,+∞)上连续,且limf(x)存在,证明:f(x)在[a,+∞)有界
- 61mol X能与足够的碳酸氢钠溶液反应放出44、8升2氧化碳,X 的分子氏
- 7用显微镜观察周围的物体,与放大镜相比,物体图象的放大倍数增加了,原因是?
- 8已知关于X的方程x*x-2*x的绝对值+2=m恰好有三个实数根,求m的值
- 9妈妈买来的西瓜真甜啊,甜得( ).
- 10《仲夏的暴雨》为题写一个400字左右作文!十万火急!
- 111 一个底面是正方形的长方形纸箱,如果把他的侧面展开,正好得到一个边长是20厘米的正方形.这个纸箱表面积
- 12化学高中 ,硫化锌和氟化钙是一种晶格吗?
- 13一共有16个长方形.翻译成英文什么
- 14Is Miss Li____(he) teacher?
- 15(1)计算:|-1|+(3-π)0-([1/2])-1;