铜锌原电池在工作时,Zn2+向铜片附近移动 电镀时,电镀池里的阳极材料发生氧化反应.那句话不对?
 没贴邮票的信封2022-10-04 11:39:542条回答
没贴邮票的信封2022-10-04 11:39:542条回答一道单选题……

已提交,审核后显示!提交回复
共2条回复
 山水逸情 共回答了15个问题
山水逸情 共回答了15个问题 |采纳率93.3%- 铜锌原电池中,锌是负极,锌离子应该在锌片附近.
电镀时,如果阳极用了较活泼金属电极(如铁、铜等),确实会发生阳极氧化. - 1年前
 狠我太痴情 共回答了626个问题
狠我太痴情 共回答了626个问题 |采纳率- 1.铜锌原电池在工作时,Zn2+向铜片附近移动
1是错的。铜锌原电池在工作时,H+向铜片附近移动.
2.电镀时,电镀池里的阳极材料发生氧化反应
2是对的。镀层金属作阳极材料发生氧化反应 - 1年前
相关推荐
- 下列关于铜电极的叙述正确的是( ) A.铜锌原电池中铜是负极 B.用电解法精炼粗铜时粗铜作阴极 C.在镀件上电镀铜时可
下列关于铜电极的叙述正确的是( ) A.铜锌原电池中铜是负极 B.用电解法精炼粗铜时粗铜作阴极 C.在镀件上电镀铜时可用铜作阳极 D.电解食盐水时铜作阳极  独宝1年前1
独宝1年前1 -
 南方人2006 共回答了22个问题
南方人2006 共回答了22个问题 |采纳率81.8%A.原电池中活泼金属作负极,铜锌原电池中,Zn活泼,则Zn为负极,Cu为正极,故A错误;
B.粗铜精炼时粗铜作阳极,纯铜作阴极,故B错误;
C.电镀Cu时Cu作阳极,在镀件上铜离子得到电子生成Cu,故C正确;
D.电解食盐水用惰性电极作阳极,若利用Cu为阳极,则生成氢氧化铜沉淀,故D错误;
故选C.1年前查看全部
- 将铜锌原电池插入稀硫酸做电解质溶液的烧杯中,为什么反应产生氢气的速率比单质锌与稀硫酸反应产生的快?
将铜锌原电池插入稀硫酸做电解质溶液的烧杯中,为什么反应产生氢气的速率比单质锌与稀硫酸反应产生的快?
如题,希望高手来帮下忙 老米一页1年前1
老米一页1年前1 -
 冷杉语羽 共回答了16个问题
冷杉语羽 共回答了16个问题 |采纳率87.5%注意题目已经给你提示了,前面构成的是铜锌原电池.关键是原电池!原电池的特点要牢牢记住,可以增加化学反应的速率!所以,针对于后面的只是简单的锌与稀硫酸的反应来说,前面的原电池反应速率会比较快!
希望对你有帮助1年前查看全部
- 关于铜锌原电池的问题铜锌原电池就是那个锌片插在ZnSO4溶液中,铜片插在CuSO4中,铜锌之间用导线连接,然后用盐桥连接
关于铜锌原电池的问题
铜锌原电池就是那个锌片插在ZnSO4溶液中,铜片插在CuSO4中,
铜锌之间用导线连接,
然后用盐桥连接的那个装置.
问题就是为什么Zn会失电子?
锌片插在ZnSO4溶液中,应该不会这么脆弱就给ZnSO4强了电子吧?
是Cu离子的吸引?但是它又接触不到Zn又为何会使到Zn失电子呢?
请高手讲解下. lttlmonster1年前1
lttlmonster1年前1 -
 西门大大 共回答了10个问题
西门大大 共回答了10个问题 |采纳率90%Zn与Cu相比
还原性强,易失去电子,化合价升高,被氧化
Cu与Zn相比
氧化性强,易得到电子,化合价降低,被还原
原电池3个条件中的一个就是必须发生氧化还原反应1年前查看全部
- 铜锌原电池的各方面优点
 h548521年前2
h548521年前2 -
 wangqiuguo3 共回答了18个问题
wangqiuguo3 共回答了18个问题 |采纳率88.9%常用原电池有锌-锰干电池、锌-汞电池、锌-银扣式电池及锂电池等.
1 锌-锰干电池:锌-锰电池具有原材料来源丰富、工艺简单,价格便宜、使用方便等优点,成为人们使用最多、最广泛的电池品种.锌-锰电池以锌为负极,以二氧化锰为正极.按照基本结构,锌-锰电池可制成圆筒形、扣式和扁形,扁形电池不能单个使用,可组合叠层电池(组).按照所用电解液的差别将锌-锰电池分为三个类型:
(1)铵型锌-锰电池:电解质以氯化铵为主,含少量氯化锌.
电池符号:(-)Zn│NH4Cl·ZnCl2│MnO2(+)
总电池反应:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnO(OH)
(2) 锌型锌-锰电池:又称高功率锌-锰电池,电解质为氯化锌,具有防漏性能好,能大功率放电及能量密度较高等优点,是锌-锰电池的第二代产品,20世纪70年代初首先由德国推出.与铵型电池相比锌型电池长时间放电不产生水,因此电池不易漏液.
电池符号:(-)Zn│ZnCl2│MnO2(+)
总电池反应(长时间放电):
Zn+2Zn(OH)Cl+6MnO(OH)=ZnCl2·2ZnO·4H2O+2Mn3O4
(3) 碱性锌-锰电池:这是锌-锰电池的第三代产品,具有大功率放电性能好、能量密度高和低温性能好等优点.1年前查看全部
- 铜锌原电池在没有接通外电路的情况下、负极的锌也会和电解液硫酸反应.1)那么铅蓄电池在没有接通外电
铜锌原电池在没有接通外电路的情况下、负极的锌也会和电解液硫酸反应.1)那么铅蓄电池在没有接通外电
铜锌原电池在没有接通外电路的情况下、负极的锌也会和电解液硫酸反应.
1)那么铅蓄电池在没有接通外电路的情况下、阴极上的铅会和电解液硫酸反应吗?
如果会反应、岂不是一冲完电蓄电池内部的铅就会和电解液反应?
2)还有锰锌干电池为什么只有接通外电路时、电池内部才反应? zz1年前1
zz1年前1 -
 wuxingzhe123 共回答了22个问题
wuxingzhe123 共回答了22个问题 |采纳率90.9%你好,
(1)会自己反应,但是相对速率较慢,对于现在一些新出来的电池品种,通过离子交换膜,可以最大限度阻止负极材料和电解液反应.
(2)这个也是会反应的.但是由于内部电解质是固态的,所以相对来说反应活性很低,反应速率很慢.
希望对你有所帮助!
不懂请追问!
望采纳!1年前查看全部
- 铜锌原电池中铜一定是正极吗如果在浓硝酸中呢?另外请问 哪些金属在浓硝酸中可以钝化
 ManIn30s1年前3
ManIn30s1年前3 -
 tozlc 共回答了20个问题
tozlc 共回答了20个问题 |采纳率95%铜锌原电池中铜一定是正极;在浓硝酸中,锌不会钝化;一般情况下只有铁,铝在浓硝酸中可以钝化.1年前查看全部
- 铜锌原电池(如图)工作时,下列叙述正确的是( )
铜锌原电池(如图)工作时,下列叙述正确的是( )
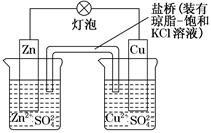
A.正极反应为:Zn―→Zn 2 + +2e - B.电池反应为:Zn+Cu 2 + =Zn 2 + +Cu C.在外电路中,电子从正极流向负极 D.盐桥中的K + 移向ZnSO 4 溶液  zjc12281年前1
zjc12281年前1 -
 xqer 共回答了13个问题
xqer 共回答了13个问题 |采纳率84.6%B
在原电池中,活泼的金属材料作负极,相对不活泼的金属材料作正极,负极反应为:Zn―→Zn 2 + +2e - ,正极反应为:Cu 2 + +2e - ―→Cu,两个半反应相加,得出电池反应为:Zn+Cu 2 + =Zn 2 + +Cu;D项,因Zn失电子,生成Zn 2 + ,为使ZnSO 4 溶液中电荷保持电中性,盐桥中的Cl - 移向ZnSO 4 溶液。1年前查看全部
- 铜锌原电池中(电解质是稀硫酸) 总反应的离子方程式是什么?铜电极产生2g气体有几克锌溶解?
 8732411年前1
8732411年前1 -
 蓝色迷雾 共回答了5个问题
蓝色迷雾 共回答了5个问题 |采纳率80%离子方程式:Zn+2H+=H2+Zn2+,Cu极产生的气体是H2,产生2g则消耗锌65g1年前查看全部
- 下列关于铜电极的叙述中正确的是 [ ] A.铜锌原电池中铜作负极
下列关于铜电极的叙述中正确的是 [ ]A.铜锌原电池中铜作负极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时用金属铜作阳极
D.电解饱和食盐水制氯气时用铜作阳极 能笑就笑啊1年前1
能笑就笑啊1年前1 -
 hurricaneill 共回答了15个问题
hurricaneill 共回答了15个问题 |采纳率100%C1年前查看全部
- 如图将Cu、Zn两种金属片插入稀H2SO4中,构成铜锌原电池,下列关于铜锌原电池的叙述正确的是( )
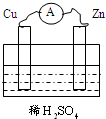 如图将Cu、Zn两种金属片插入稀H2SO4中,构成铜锌原电池,下列关于铜锌原电池的叙述正确的是( )
如图将Cu、Zn两种金属片插入稀H2SO4中,构成铜锌原电池,下列关于铜锌原电池的叙述正确的是( )
A.溶液中的H+向负极移动
B.Zn片作负极,发生还原反应
C.溶液的PH值将增大
D.电子从Cu流出经导线流向Zn 一次就行1年前1
一次就行1年前1 -
 狗眼看人生 共回答了16个问题
狗眼看人生 共回答了16个问题 |采纳率93.8%解题思路:Cu-Zn-稀硫酸原电池放电时,较活泼的金属锌作负极,较不活泼的金属铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,溶液中阳离子向正极移动,阴离子向负极移动.A、溶液中阳离子向正极移动,阴离子向负极移动,则H+向正极移动,故A错误;
B、Cu-Zn-稀硫酸原电池放电时,较活泼的金属锌作负极,负极上失电子发生氧化反应,故B错误;
C、该原电池放电时,溶液中氢离子从铜片获得电子被还原成氢气,所以氢离子的浓度减小,则溶液的PH值将增大,故C正确;
D、电子从负极锌片沿导线流向正极铜片,故D错误.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,难度不大,注意把握正负极的判断方法,难点是判断溶液中阴阳离子的移动方向.1年前查看全部
- 原电池的电流是如何形成的啊,比如铜锌原电池为何书上说两极板上都失电子,只是锌失的能力强,形成回路时
原电池的电流是如何形成的啊,比如铜锌原电池为何书上说两极板上都失电子,只是锌失的能力强,形成回路时
破坏了两级的沉淀溶解平衡,锌极向失电子的方向移动,铜级像生成铜方向度移动.这样的话正极不就是正极材料发生反应,而不是根据总反应式判断谁得电子了吗 富江鱼1年前2
富江鱼1年前2 -
 催命符 共回答了20个问题
催命符 共回答了20个问题 |采纳率90%铜锌原电池中铜为正极材料,正极材料不发生反应,只是而是溶液中的离子在正极得到电子,正极不参加反应,但负极材料参加反应,负极材料上的金属锌失去电子,然后沿着导线到正极.1年前查看全部
- 原电池是把______转化成______的装置,其反应的实质是______.在铜锌原电池(稀硫酸为介质)中:正极材料是_
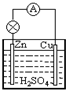 原电池是把______转化成______的装置,其反应的实质是______.在铜锌原电池(稀硫酸为介质)中:正极材料是______,其电极反应式:______;负极材料是______,其电极反应式:______.
原电池是把______转化成______的装置,其反应的实质是______.在铜锌原电池(稀硫酸为介质)中:正极材料是______,其电极反应式:______;负极材料是______,其电极反应式:______.  哭苦的蟋蟀1年前1
哭苦的蟋蟀1年前1 -
 落单的孤燕 共回答了17个问题
落单的孤燕 共回答了17个问题 |采纳率100%解题思路:根据原电池概念确定原电池,原电池反应一定有电子转移;铜锌原电池中锌易失电子作负极,铜作正极,正极上氢离子得电子发生还原反应.原电池是将化学能转化为电能的装置,原电池中有电子的转移,所以其反应的实质是氧化还原反应,铜锌原电池中,锌易失电子作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,电极反应式为Zn-2e-=Zn2+,Cu为正极,正极上氢离子放电生成氢气,发生还原反应,电极反应式为2H++2e-=H2↑,
故答案为:化学能,电能;氧化还原反应;Cu,2H++2e-=H2↑;Zn,Zn-2e-=Zn2+.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池概念、原电池原理,明确原电池概念、电极上得失电子即可解答,难点的电极反应式的书写,题目难度不大.1年前查看全部
- 铜锌原电池的装置如图所示,下列叙述不正确的是( )A.溶液中的H+定向移动到正极B.铜片逐渐溶解,质
铜锌原电池的装置如图所示,下列叙述不正确的是( )A.溶液中的H+定向移动到正极B.铜片逐渐溶解,质
 铜锌原电池的装置如图所示,下列叙述不正确的是( )
铜锌原电池的装置如图所示,下列叙述不正确的是( )
A.溶液中的H+定向移动到正极
B.铜片逐渐溶解,质量减轻
C.锌片为负极
D.该装置可以将化学能转化为电能
 陪风淋雨雨1年前1
陪风淋雨雨1年前1 -
 yinuo80 共回答了16个问题
yinuo80 共回答了16个问题 |采纳率81.3%该原电池中,锌易失电子作负极,铜作正极,
A.电解质溶液中氢离子向正极移动,故A正确;
B.铜电极上氢离子得电子生成氢气,所以铜片质量不变,故B错误;
C.锌易失电子发生氧化反应而作负极,故C正确;
D.该装置是原电池,是将化学能转化为电能的装置,故D正确;
故选B.1年前查看全部
- 铜锌原电池在未连接外电路时是否有电势差?如果有,为什么?如果没有,干电池两端的电压是怎么来的?
 3615302991年前1
3615302991年前1 -
 jixixixixixi 共回答了18个问题
jixixixixixi 共回答了18个问题 |采纳率88.9%有,此电势差可依据“能斯特”方程计算.其本质是:阴、阳极的反应已经进行到极限,两个电极已经带有一定的电荷了,并导致参与电化学反应的离子(此处为Zn2+)在阳极附近所形成的电场力(引力)的作用下Zn2+不能离开电极进入电解质,阴极附近所形成的电场力(斥力)作用下,H+无法迁移至阴极构成持续的阴极反应.1年前查看全部
- 某同学在做完铜锌原电池实验后,又做出了以下几组实验,请判断下列关于实验现象的描述正确的是( ) A.
某同学在做完铜锌原电池实验后,又做出了以下几组实验,请判断下列关于实验现象的描述正确的是( ) A.
某同学在做完铜锌原电池实验后,又做出了以下几组实验,请判断下列关于实验现象的描述正确的是( )
A.用导线连接锌片、铜片,一起浸在CuSO4溶液中,锌片表面析出单质铜
B.把铜片插入FeCl3溶液中,在铜片表面出现一层铁
C.用导线连接铁片、铜片,一起浸在浓硝酸中,铁片不断溶解
D.把锌粒放入盛有盐酸的试管中,加入几滴CuCl2溶液,气泡放出速率加快
为多选题 dongfang1631年前4
dongfang1631年前4 -
 kingsong2004 共回答了23个问题
kingsong2004 共回答了23个问题 |采纳率82.6%A.用导线连接锌片、铜片,一起浸在CuSO4溶液中,锌片表面析出单质铜-------------错,构成的原电池,Zn是负极,Cu是正极,所以在Cu片上析出Cu
B.把铜片插入FeCl3溶液中,在铜片表面出现一层铁------------------错,不可能置换出Fe,会反应,生成CuCl2和FeCl2,所以Cu片减少,溶液颜色会变化
C.用导线连接铁片、铜片,一起浸在浓硝酸中,铁片不断溶解-----------错,浓硝酸,需要注意Fe钝化,所以Cu做负极,溶解减少
D.把锌粒放入盛有盐酸的试管中,加入几滴CuCl2溶液,气泡放出速率加快-----------对,Zn可以先置换出少量Cu后,Zn与Cu一起构成了原电池,加快了放出H2的速率1年前查看全部
- 铜锌原电池的实验结论、实验原理和反应方程式是什么?
 我的天堂村1年前1
我的天堂村1年前1 -
 可爱的老牛 共回答了16个问题
可爱的老牛 共回答了16个问题 |采纳率100%结论:锌比铜活泼.原理:氧化还原反应.Zn+Cu2+=Zn2++Cu1年前查看全部
- 铜锌原电池 一个用硫酸铜溶液做电解液 一个用盐桥 电极反应一样 现象为什么不一样呢?
 likeic1年前0
likeic1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 用能斯特方程解释浓度对电极电势的影响,以铜锌原电池为例,如下
用能斯特方程解释浓度对电极电势的影响,以铜锌原电池为例,如下
在铜锌原电池中,锌电极插在硫酸锌溶液中,铜电极插在硫酸铜溶液中,中间用盐桥连接.测得电动势为1v,在硫酸铜溶液中加入浓氨水,直至生成的沉淀溶解为止,测得电动势为0.8v,再向硫酸锌溶液中加入浓氨水,直至生成的沉淀消为止,测得电压为1.1v,用能斯特方程解释实验现象. 孤独少卿1年前1
孤独少卿1年前1 -
 subeinongmin 共回答了23个问题
subeinongmin 共回答了23个问题 |采纳率82.6%反应方程式为:Zn+Cu2+===Cu+Zn2+
写出其能斯特方程式:E=E(标准态)+0.0592/2*ln{[Cu2+]/[Zn2+]}
则,Cu2+(铜离子)浓度下降,电压E下降,Zn2+浓度下降,电压上升.
当加入氨水时,Cu2+先生成Cu(OH)2沉淀后生成[Cu(NH3)4]2+离子,沉淀溶解,铜离子浓度是降低的,所以电压会下降.
同理,加入氨水时,锌离子先生成氢氧化锌沉淀后生成四氨配锌离子,沉淀溶解,但锌离子浓度也是降低的,所以电压会上升1年前查看全部
- 铜锌原电池中,为什么锌在负极是溶解而不是产生气泡?
 **仙人1年前1
**仙人1年前1 -
 qyxwan1314 共回答了17个问题
qyxwan1314 共回答了17个问题 |采纳率82.4%而在原电池中,是铜离子得电子,所以没有气泡!或许我错误理解你的意思了!有疑问请补充,^_^补充:
锌溶解是锌失去电子变成氢离子!补充:
我插,是锌离子,不是氢离子!打错了追问:
铜不跟稀硫酸反应,锌活动顺序在氢前面,可以跟酸反应产生氢气!铜和锌一起形成了原电池!能不能产生气泡必须考虑电解质溶液!一般电解质溶液为硫酸铜!析出铜,不产生氢气!1年前查看全部
- NH3的实验室制法、HNO3、H2SO4、Na2CO3的工业制法、电解质和原电池的区别、电解饱和食盐水、铜锌原电池、SO
NH3的实验室制法、HNO3、H2SO4、Na2CO3的工业制法、电解质和原电池的区别、电解饱和食盐水、铜锌原电池、SO42-,NH4+,SO32-,CL-的检验、Br2、I2的检验
 谢先生11年前1
谢先生11年前1 -
 佛即吾心 共回答了14个问题
佛即吾心 共回答了14个问题 |采纳率100%NH3的实验室制法:做法:加碱加热
步骤:1.取少量氯化铵固体研成粉末后放入试管中,后加入少量氢氧化钙(过量)
2.将带有导气管的胶塞盖在试管上,加热混合物,并用向下排空气法收集所得气体
反应方程:2NH4CL+Ca(OH)2===加热===2NH3(g)+CaCL2+2H2O
HNO3的工业制法
1.氨的催化氧化:
4NH3+5O2==催化剂,加热==4NO+6H2O
2.一氧化氮氧化:
2NO+O2===2NO2
3.制硝酸:
4NO2+2H2O+O2===4HNO3
H2SO4的工业制法:
1.二氧化硫氧化
2SO2+O2==催化剂,加热(可逆)===2SO3
2.制硫酸
SO3+H2O====H2SO4
Na2CO3的工业制法
侯氏制碱法又名联合制碱法
(1)NH3+H2O+CO2=NH4HCO3
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑
即:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓
②2NaHCO3(加热)=Na2CO3+H2O+CO2↑
电解质和原电池的区别:
电解质:电解质是溶于水溶液中或在熔融状态下就能够导电
原电池:将化学能转化为电能的装置
电解饱和食盐水:
2H2O+2NaCl===通电===2NaOH+CL2(g)+H2(g)
铜锌原电池:
H2SO4做电解质:
(-):Zn--2e-===Zn2*
(+):2H*+2e-===H2
总:Zn+2H*==Zn2*+H2(g)
CuSO4做电解质:
(-):Zn--2e-===Zn2*
(+):Cu2*+2e-==Cu
总:Zn+Cu2*=Cu+Zn2*
SO42-的检验
先加入BaCl2后产生沉淀,再加入HCl后沉淀不溶解证明有SO42-
NH4+的检验:
加入Ca(OH)2溶液(在试管中)共热,生成有刺激性气味气体,且将湿润红色石蕊试纸放在试管口后试纸变蓝
SO32-的检验:
CL-的检验
加入AgNO3溶液后产生白色沉淀后加入稀硝酸沉淀不溶解则证明有CL-
Br2的检验:
I2的检验:
加入淀粉变蓝,1年前查看全部
- 在铜锌原电池中,为什么在负极锌的表面也有气泡产生?
 愚人19991年前1
愚人19991年前1 -
 javave 共回答了7个问题
javave 共回答了7个问题 |采纳率85.7%原因,锌不纯,在锌表面形成原电池.答案多为这样解释.1年前查看全部
- 在铜锌原电池中为什么铜极会有气泡
 HFTALK1年前1
HFTALK1年前1 -
 hnzk460 共回答了16个问题
hnzk460 共回答了16个问题 |采纳率87.5%发生氧化还原反应,生成氢气1年前查看全部
- 铜锌原电池:两极之间溶液中离子如何定向移动?锌是被谁氧化为正二价而可传递出两个电子的?
 听风雨笑红尘1年前3
听风雨笑红尘1年前3 -
 记忆流失 共回答了20个问题
记忆流失 共回答了20个问题 |采纳率85%1、阳离子向正极移动,阴离子向负极移动.这个只要记住阳离子移动方向和电流方向一致,就行了
2、Zn被溶液中的阳离子(Cu2+或H+)氧化为Zn2+1年前查看全部
- 铜锌原电池,铜被氧化?
 zhanshan1年前1
zhanshan1年前1 -
 syshishi 共回答了20个问题
syshishi 共回答了20个问题 |采纳率90%应该是锌,锌的还原性比铜强,如果用酸作电解质溶液的话应该是锌作负极,被氧化1年前查看全部
- 铜锌原电池(有有盐桥的那种)为什么锌会溶解到硫酸锌里
铜锌原电池(有有盐桥的那种)为什么锌会溶解到硫酸锌里
我知道是氧化还原反应
注意,锌是浸在硫酸锌里的 jinpiopio1年前2
jinpiopio1年前2 -
 我要结婚了00 共回答了18个问题
我要结婚了00 共回答了18个问题 |采纳率94.4%单质锌2个电子通过外接导线转移到铜极(阳极)变成锌离子,溶解到锌电极所在溶液里,同时阳极溶液中铜离子得到电子变成单质铜,负极溶液中阳离子增多了,正极阳离子减少了,负极多出的阳离子再通过盐桥移到正极溶液中,补充阳极少的阳离子,两极溶液离子也平衡了.1年前查看全部
- 无盐桥的铜锌原电池为什么不能产生持续电流
无盐桥的铜锌原电池为什么不能产生持续电流
做实验时发现锌片上也有铜析出,它造成电流不能持续,常用锌片不纯解释,若锌片纯净,锌片上还会有铜析出吗
把锌与硫酸铜分开就可产生持续电流 fence_zhx1年前1
fence_zhx1年前1 -
 孤独百年solitude 共回答了18个问题
孤独百年solitude 共回答了18个问题 |采纳率88.9%若锌片纯净,锌片上依然会有铜析出,这是无法避免的,因为锌片与铜离子接触.化学中有许多非绝对的东西,比如我们常说液体沸腾和晶体熔化时温度不变,但事实上温度会改变,只是变化范围较小1年前查看全部
- 铜锌原电池中,为什么锌在负极是溶解而不是产生气泡?
 yiainiforever1年前1
yiainiforever1年前1 -
 wenjuanv1 共回答了11个问题
wenjuanv1 共回答了11个问题 |采纳率90.9%而在原电池中,是铜离子得电子,所以没有气泡!或许我错误理解你的意思了!有疑问请补充,
锌溶解是锌失去电子变成氢离子!补充:
我插,是锌离子,不是氢离子!打错了追问:
铜不跟稀硫酸反应,锌活动顺序在氢前面,可以跟酸反应产生氢气!铜和锌一起形成了原电池!能不能产生气泡必须考虑电解质溶液!一般电解质溶液为硫酸铜!析出铜,不产生氢气!1年前查看全部
- 在铜锌原电池中,Zn的大量溶解在周围产生锌离子不排斥氢离子,从而使其移向铜吗?
 股海一箭1年前3
股海一箭1年前3 -
 飘落红尘 共回答了20个问题
飘落红尘 共回答了20个问题 |采纳率85%排斥肯定是有的,同种电荷相互排斥的嘛!只是排斥力很小不足以使氢离子不能移动到正极上得到电子而发生反应!1年前查看全部
- 【化学判断题一道】下面这句话为什么不对?错在哪里?“在以碳棒为两极的电解池中,氢离子向阴极方向移动;在铜锌原电池(稀硫酸
【化学判断题一道】
下面这句话为什么不对?错在哪里?
“在以碳棒为两极的电解池中,氢离子向阴极方向移动;在铜锌原电池(稀硫酸做电解液)中,氢离子向负极方向移动.” 撒旦_an1年前2
撒旦_an1年前2 -
 zhutao929 共回答了14个问题
zhutao929 共回答了14个问题 |采纳率100%在铜锌原电池(稀硫酸做电解液)中,氢离子向负极方向移动 错了
H+应向正极移动,所以在铜锌原电池试验中可以看到的现象是铜片上有气泡冒出1年前查看全部
- 铜锌原电池中,带有盐桥的,锌是怎样失电子的,锌是不与硫酸锌反应的呀.
 wuxiangseng1年前3
wuxiangseng1年前3 -
 KONTOyiran 共回答了22个问题
KONTOyiran 共回答了22个问题 |采纳率95.5%锌失去的电子通过导线到达正极,与正价铜离子反应:2e-十Cu2+=Cu
本身变成锌离子进入溶液,Zn一2e-=Zn2+
锌不与硫酸锌反应,但是锌和硫酸铜反应,而原电池就是根据同种电荷相斥原理来通过导线来引导失去的电子到达正极产生电流的.实际锌还是和硫酸铜反应,因为锌失去的电子通过导线给了铜离子,而不是以往的直接反应给了铜离子.1年前查看全部
- 为什么铜锌原电池中阳极是氢离子得电子,而不是铜离子得电子呢?
为什么铜锌原电池中阳极是氢离子得电子,而不是铜离子得电子呢?
负极不是锌失去电子么 变成Zn2+进入溶液中 然后阳极的H+得电子变成氢气,为什么不是Zn2+得电子?是不是阳离子放电顺序的问题啊? lifengyuqin1年前3
lifengyuqin1年前3 -
 报喜鸟1402 共回答了12个问题
报喜鸟1402 共回答了12个问题 |采纳率100%知道吗,你把原电池和电解池混淆了
原电池没有阴阳极,电解池才有阴阳极哦
如果是锌自己失电子又得电子,那不是和没反应一样啊1年前查看全部
- 铜锌原电池形成的闭合回路是不是电子由正极通过外电路流入负极,接着怎么样啦?内电路是怎么走的大?怎么构成闭合回路的?
 怎么老不行啊1年前1
怎么老不行啊1年前1 -
 kenan5200 共回答了15个问题
kenan5200 共回答了15个问题 |采纳率93.3%锌电极失去电子变为锌离子进入溶液,溶液中的氢离子在铜电极处得到电子.溶液中正离子向正极(铜电极)移动,此即溶液内部电流方向,导线中电子由负极移向正极,而电流方向指的是正电荷方向,所以电流方向就是正极指向负极.
两者方向一致,形成闭合回路.1年前查看全部
- 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
这句话是对的吗? yingyi0111年前1
yingyi0111年前1 -
 玩儿得就是心跳 共回答了22个问题
玩儿得就是心跳 共回答了22个问题 |采纳率86.4%错了 ,电子由活泼金属流向不活泼的金属 ,电子由锌→铜
但是电流就是反过来,电流从铜→锌1年前查看全部
- 铜锌原电池中溶液会变蓝么.为什么
 jiecheng21年前2
jiecheng21年前2 -
 wangyunfly-1 共回答了10个问题
wangyunfly-1 共回答了10个问题 |采纳率80%锌块溶解,铜不会反应.因而溶液中不会有铜离子而不会呈蓝色.这也是金属防腐的一种方式:轮船上挂着锌块就是为了防止海水腐蚀钢铁.
原则:构成原电池的两极材料,活性相对强的倍氧化,活性相对弱的倍保护.1年前查看全部
- 铜锌原电池为什么要有电解质溶液铜锌原电池的电解质溶液所形成的回路中并没有电子的转移它的负极将硫酸根离子吸过去,它的正极将
铜锌原电池为什么要有电解质溶液
铜锌原电池的电解质溶液所形成的回路中并没有电子的转移
它的负极将硫酸根离子吸过去,它的正极将正离子吸过去这样到底对原电池有什么作用?
它的电解质溶液倒替有什么用? KoalaWu1年前1
KoalaWu1年前1 -
 sumw 共回答了17个问题
sumw 共回答了17个问题 |采纳率94.1%在电源外部电流流向电源负极,但是在电源内部电流是流向电源正极的,原电池负极将硫酸根离子吸过去,正极将正离子吸过去,这样电流才能在电路中形成闭合回路,否则电流是不可能产生的1年前查看全部
- 铜锌原电池的装置如图所示,下列叙述不正确的是( )
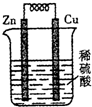 铜锌原电池的装置如图所示,下列叙述不正确的是( )
铜锌原电池的装置如图所示,下列叙述不正确的是( )
A.溶液中的H+定向移动到正极
B.铜片逐渐溶解,质量减轻
C.锌片为负极
D.该装置可以将化学能转化为电能 sahara9541年前1
sahara9541年前1 -
 rqsyd 共回答了15个问题
rqsyd 共回答了15个问题 |采纳率86.7%解题思路:该原电池中,Zn易失电子作负极,Cu作正极,正极上氢离子得电子生成氢气,电解质溶液中阳离子向正极移动、阴离子向负极移动,据此分析解答.该原电池中,锌易失电子作负极,铜作正极,
A.电解质溶液中氢离子向正极移动,故A正确;
B.铜电极上氢离子得电子生成氢气,所以铜片质量不变,故B错误;
C.锌易失电子发生氧化反应而作负极,故C正确;
D.该装置是原电池,是将化学能转化为电能的装置,故D正确;
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,根据电极上得失电子确定正负极,再结合电解质溶液中阴阳离子的移动方向、原电池概念来分析解答,题目难度不大.1年前查看全部
- 在铜锌原电池(无盐桥)中 锌与酸接触 为什么不直接反应 转移电子 而是电子通过导线到铜上 然后和氢离子反
在铜锌原电池(无盐桥)中 锌与酸接触 为什么不直接反应 转移电子 而是电子通过导线到铜上 然后和氢离子反
我说的可能不太清楚 我是想说 在铜锌原电池 (无盐桥)中 锌与酸接触 为什么不直接转移电子 而是电子先通过导线到铜上 然后和氢离子反应 gongren1111年前2
gongren1111年前2 -
 存在着你的存在 共回答了20个问题
存在着你的存在 共回答了20个问题 |采纳率90%做为原电池需要有盐桥的存在啊,原电池要有闭合的内电路的.
再来解答你的问题,我们假设锌直接与酸进行反应而不转移电子到铜上.锌片溶解后在锌片附近形成大量的Zn2+ ,根据同种电荷互斥,会排斥H+远离锌片,阻碍反应继续进行.
而如果电子转移到铜上就不会有上述的过程了,H+在铜片附近反应,而Zn2+在锌片附近.1年前查看全部
- 铜锌原电池,如果把铜和锌插在ZNSO溶液或CUSO4溶液中行不行?
 maggie_dandan1年前5
maggie_dandan1年前5 -
 话肥 共回答了20个问题
话肥 共回答了20个问题 |采纳率75%原理:原电池的原理是能自发的放生氧化还原反应,置换反应属于其中的一种.
Zn可以和CuSO4发生置换反应,所以可以构成原电池.
Cu和Zn都没法和CUSO4溶液反应,所以不能构成原电池.1年前查看全部
- 高一化学关于铜锌原电池铜锌原电池,如果电解质溶液为CuSO4的话那在正极会有什么现象?是Cu片又被镀上一层铜吗?那和电镀
高一化学关于铜锌原电池
铜锌原电池,如果电解质溶液为CuSO4的话那在正极会有什么现象?是Cu片又被镀上一层铜吗?那和电镀铜有什么区别吗?
如果此时把装置上方的电流表改为某一用电器是否用电器可以运作啦? 樱桃小樱1年前1
樱桃小樱1年前1 -
 性格开朗喜欢上网 共回答了11个问题
性格开朗喜欢上网 共回答了11个问题 |采纳率81.8%锌棒是负极,铜棒是正极.将正极与负极用导线连接后,电池开始 工作(电子从锌棒经过导线流向铜棒).现象是:负极:锌棒渐渐溶解(锌棒上的锌失去电子,变成锌离子进入溶液) Zn = Zn2+ + 2e- 正极:铜棒质量增加,表面析...1年前查看全部
- 在铜锌原电池中,为什么要把锌插入硫酸锌,铜插入硫酸铜中?老师说这样能增大此装置的电势差,
在铜锌原电池中,为什么要把锌插入硫酸锌,铜插入硫酸铜中?老师说这样能增大此装置的电势差,
不要用高中知识给我讲啊!我知道不用这两种溶液照样行,只是没这两种好!
亲,你只给回答产生电极电势的原理!并未回答为什么要插入相应的离子盐溶液,不插入相应的离子盐溶液行吗 xfengty1年前1
xfengty1年前1 -
 胡兔 共回答了18个问题
胡兔 共回答了18个问题 |采纳率100%分开可以测定影响电极电势的因素,以下是电极电极电势产生的过程
把金属置于其盐溶液中,金属表面层的正离子受水分子的极性作用,有进入溶液的倾向,使得金属因存在过剩的电子而带负电荷.金属越活泼,溶液中金属离子浓度越小,这种倾向越大.
与此同时,溶液中的金属正离子也有与金属表面的自由电子结合成中性原子而沉积于金属表面的倾向,导致金属带正电荷.金属越不活泼,溶液中金属离子浓度越大,这种倾向就越大.
即:M ==Mn+ + ne 若失电子倾向大,最终Mn+进入溶液,棒上带负电;若得电子倾向大,最终金属沉积表面,棒带正电.
总之, 金属上的自由电子和溶液中的正离子由于静电吸引聚集在固液界面附近,从而形成一个类似电容器的双电层.由于双电层的形成,在金属和溶液之间存在一个电势差.这就是该金属电极的 电极电势1年前查看全部
- 盐桥的概念铜锌原电池,铜插在CuCl2中,Zn插在ZnCl2中,中间用盐桥相连.为什么Zn能和Cu2+反应
 悠悠谷雨1年前3
悠悠谷雨1年前3 -
 libra莉香 共回答了17个问题
libra莉香 共回答了17个问题 |采纳率88.2%铜锌电池和其他的电池其实的本质都是一样,通过电子的得失从而获得电流.在铜锌电池中,锌失去电子,氯化铜中的铜离子获得电子,其中的电子就是通过盐桥来传递的.所以导致了电子的定向移动,就是获得了电流.1年前查看全部
- 铜锌原电池如图工作时,下列叙述正确的是( )
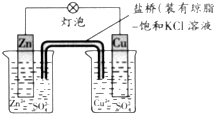 铜锌原电池如图工作时,下列叙述正确的是( )
铜锌原电池如图工作时,下列叙述正确的是( )
A.正极反应为:Zn-2e-=Zn2+
B.电池总反应为:Zn+2H+=Zn2++H2↑
C.盐桥主要作用是形成回路、中和两极电荷
D.盐桥中的Cl-移向CuSO4溶液 ShowTime_Canada1年前1
ShowTime_Canada1年前1 -
 ss66 共回答了20个问题
ss66 共回答了20个问题 |采纳率95%解题思路:原电池中负极为较活泼金属,发生氧化反应,在外电路中,电子从负极移向正极,溶液中,阴离子向负极移动,反应的总方程式为Zn+Cu2+=Zn2++Cu.A.锌作负极,故A错误;
B.电池总反应和没有形成原电池的氧化还原反应相同,为Zn+Cu2+=Zn2++Cu,故B错误;
C.加了盐桥后,原电池放电时,带负电离子(Cl-)会流到负极处,带正电离子(K+)流到正极,中和两极上的电荷,形成闭合回路,从而保持两边溶液电中性而保证电流的稳定,故C正确;
D.在溶液中,阴离子向负极移动,所以氯离子向硫酸锌溶液移动,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池原理,盐桥在原电池中的作用是代替了单一溶液体系,电子的流向问题是学生普遍感到困难的一个考点.1年前查看全部
- 如图所示为铜锌原电池,下列有关说法不正确的是( ) A.锌片作负极 B.铜片上有气泡 C.电子由铜片经导线流向锌片 D
如图所示为铜锌原电池,下列有关说法不正确的是( ) A.锌片作负极 B.铜片上有气泡 C.电子由铜片经导线流向锌片 D.一段时间后,溶液中氢离子的物质的量减小 
 36634991年前1
36634991年前1 -
 余强 共回答了24个问题
余强 共回答了24个问题 |采纳率87.5%A.该装置中锌易失电子作负极,故A正确;
B.铜作正极,正极上氢离子得电子生成氢气,所以Cu上有气泡生成,故B正确;
C.电子从负极沿导线流向正极,即电子从负极锌沿导线流向正极铜,故C错误;
D.正极上氢离子得电子发生还原反应生成氢气,所以一段时间后,溶液中氢离子的物质的量减小,故D正确;
故选C.1年前查看全部
- 向铜锌原电池的cuso4溶液中加入氨水,电池电动势减小,若向znso4中加氨水电池电动势将变大,为什么
 屏侧1年前1
屏侧1年前1 -
 底斯里 共回答了23个问题
底斯里 共回答了23个问题 |采纳率87%根据原电池的能斯特方程
E=E0-(0.0592/n)lg([Zn2+]/[Cu2+])
向CuSO4溶液中加入氨水,[Cu2+]减小,lg([Zn2+]/[Cu2+])增大,E减小
向ZnSO4溶液中加入氨水,[Zn2+]减小,lg([Zn2+]/[Cu2+])减小,E增大1年前查看全部
- 铜锌原电池(铜插硫酸铜,锌插硫酸锌,两溶液盐桥联接)当锌溶解,溶液锌离子数增加
铜锌原电池(铜插硫酸铜,锌插硫酸锌,两溶液盐桥联接)当锌溶解,溶液锌离子数增加
问撤除盐桥和锌片后,硫酸锌溶液是否带正电?为什么? 傲霜凌雪21年前1
傲霜凌雪21年前1 -
 electropro 共回答了16个问题
electropro 共回答了16个问题 |采纳率100%不会带电的,在锌离子产生的同时,盐桥为硫酸锌提供了等电荷的阴离子,溶液呈电中性.在撤去盐桥的同时,反应随之停止,溶液仍是电中性的.1年前查看全部
- (2014•浦东新区二模)图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“
 (2014•浦东新区二模)图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )
(2014•浦东新区二模)图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )
A.导线上的电流方向为A→B
B.A中SO42-浓度有所减小
C.盐桥中Cl-向A中移动
D.B中铜片质量有所增加 cc帮女八路1年前1
cc帮女八路1年前1 -
 南极北熊 共回答了33个问题
南极北熊 共回答了33个问题 |采纳率87.9%解题思路:将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液构成的原电池中,金属锌是负极,发生氧化反应,铜是正极,发生还原反应,根据原电池的工作原理来回答.A.Zn为负极,Cu为正极,则导线上的电流方向为B→A,故A错误;B.原电池工作时,阴离子向负极移动,A中SO42-浓度基本不变,故B错误;C.原电池工作时,阴离子向负极移动,盐桥中的氯离子可向A移动,故C正确;D.Cu为...
点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查学生盐桥原电池的工作原理知识,为高频考点,侧重于学生的分析能力的考查,注意正负极的判断以及电解质中阴阳离子的移动是解题的关键,难度不大.1年前查看全部
- 书上有说明,但是我看不懂,(现以铜锌原电池为例来分析原电池的电流是怎样产生的.锌片上和ZnSO4溶液中都存在锌离子.在锌
书上有说明,但是我看不懂,(现以铜锌原电池为例来分析原电池的电流是怎样产生的.锌片上和ZnSO4溶液中都存在锌离子.在锌片和溶液的接触面上,水分子与金属表面的锌离子相互吸引,发生水合作用,使部分锌离子离开锌片进入溶液:Zn→锌离子+2电子.)就是这段话,里面一直都在说的是锌离子,为什么到最后的方程式却是锌原子变成锌离子和两个电子?我觉得可能是锌片表面的锌离子与水发生水合作用后,锌片上的锌原子变成锌离子来补充空缺的位置,
 桃桃淘气1年前3
桃桃淘气1年前3 -
 远方远足 共回答了22个问题
远方远足 共回答了22个问题 |采纳率90.9%锌离子不与水发生反应.首先你要了解这个原电池的方程式,本质就是:
Zn+2H+ → Zn2+ + H2↑
但分步写便会体现电子的转移:
Zn - 2e- → Zn2+
2H+ + 2e- → H2↑
也就是说.电子从锌那一及跑出来,锌变成锌离子,因为金属之间存在可以自由移动的电子(你们以后会学到),所以自由电子沿着金属导线跑到铜那里,水电离出的H+在铜那里得到锌失去的电子,变成氢气.这就是铜极产生了气体而锌极却没有.
如果中间没有导线.铜极不会有气体产生的.
注意:铜极产生气体是实验现象,不是本质.1年前查看全部
- 在有盐桥的铜锌原电池中,电解质溶液的选择为什么要与电极材料的阳离子相同?
在有盐桥的铜锌原电池中,电解质溶液的选择为什么要与电极材料的阳离子相同?
如果两个溶液都选硫酸铜,是不是在锌上析出铜,那还是叫原电池吗?请分析下原理
 jason21ce1年前1
jason21ce1年前1 -
 Prince_handsome 共回答了9个问题
Prince_handsome 共回答了9个问题 |采纳率77.8%不是,还是在铜棒上析出铜。锌棒上锌失的电子通过导线转移到铜棒上,溶液中的铜离子在铜棒上得电子,被还原。1年前查看全部
- 铜锌原电池电解质为什么不能用硫酸?
铜锌原电池电解质为什么不能用硫酸?
rt
将锌和铜用导线连起来,氢离子和锌反应,锌上电子通过导线移向铜,电子在铜那段与H+结合,有什么不可以呢?有好几组,老师没选这项。但我觉得可以。 for_shense1年前4
for_shense1年前4 -
 心铭月情 共回答了18个问题
心铭月情 共回答了18个问题 |采纳率94.4%如果溶液是稀硫酸,
Zn - 2e- = Zn2+,
2 H+ + 2e- = H2↑
溶液中没有Cu2+,怎么会发生反应 Zn + CuSO4 = Cu + ZnSO4呢?
就变成 Zn + 2 H+ = H2↑ + Zn2+ 了1年前查看全部
大家在问
- 1请问这几句意大利文是什么意思?Io sottoscritto Bulgarelli Dr.Mario,notaio in
- 2负2012加4000又4分之3加(负2011又3分之2)加(负1又2分之1)
- 3(2014•武汉模拟)如图①②③④所示,它们都是由小圆圈组成的图案.现按同样的排列规则进行排列,记第n个图形包含的小圆圈
- 4如图有四条互相不平行的直线l1、l2、l3、l4所截出的七个角,关于这七个角的度数关系,下列结论正确的是( )
- 5小学五年级上册数学82页综合练习8题答案(青岛出版社)由梯形平形四边形和三角形组成求面积的题
- 6In ancient China tea was probably used as a relish(开胃小菜) and
- 7在1.01×10 5 Pa、150℃条件下,某烃完全燃烧,反应前后压强不发生变化,该有机物可能是 [
- 8园的( )和( )的比值是一个固定的数,通常叫做( ),它大约等于( ),用字母表示为( ).
- 9不()向上的成语不()向上?想不出来,孩子的题.
- 10观察鸟类翅膀的形状,解释为什么鸟在空中展翅滑翔时不会坠落下来?
- 11我想问一下:颔首低眉是褒义词还是贬义词呢?这个成语的具体用法是怎样的?
- 12could you tell me the way to the post office?sorry,i don't k
- 13its╱was+被强调部分+that……造句
- 14计算:(1) (-1)的2014次方+(-2分之1)的-2次方-(3.14-pai)°
- 15(2003•江西)如图,已知A、D两点分别是正三角形DEF、正三角形ABC的中心,连接GH、AD,延长AD交BC于M,延
