往1.00ml1.0molZnCl2溶液中加入NaOH固体至ph=6,需NaOH的物质的量
 叫板拍一砖2022-10-04 11:39:542条回答
叫板拍一砖2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 musickiller 共回答了17个问题
musickiller 共回答了17个问题 |采纳率82.4%- ZnCl2+H2O=Zn(OH)2+2HCl
1.0mol/LZnCl2溶液,[H+]=2mol/L
NaOH的物质的量 (2-10^-6)/1000=0.002-10^-9 mol - 1年前
 南方大鸟 共回答了6个问题
南方大鸟 共回答了6个问题 |采纳率- ZnCl2+H2O=Zn(OH)2+2HCl
是可逆反应,这么做不对。题目是不是条件不够。我查了查ZNCL2的水解常熟,算出来大概是0.0018MOL - 1年前
相关推荐
- 有关标准加入法的题目用标准加入法测定离子浓度时,于100mL铜盐溶液中添加0.100mol/L硝酸铜溶液1.00mL后电
有关标准加入法的题目
用标准加入法测定离子浓度时,于100mL铜盐溶液中添加0.100mol/L硝酸铜溶液1.00mL后电动势有4mV的增加,求铜的原来总浓度. 璨璨9281年前1
璨璨9281年前1 -
 south_sky169 共回答了20个问题
south_sky169 共回答了20个问题 |采纳率85%设铜的原来总浓度=X mol/L.有电极电位
E=Eo+0.0592lgX
那么,添加0.100mol/L硝酸铜溶液1.00mL后铜的浓度=(100X+0.1)/101 mol/L.有电极电位
E'=Eo+0.0592lg(100X+0.1)/101
E'-E=0.004=0.0592lg{(100X+0.1)/101 X}
求出X即得.1年前查看全部
- Ⅰ.测定亚硝酸盐含量时要配制标准显色液,即吸取0.20mL、0.40mL、0.60mL、0.80mL、1.00mL和1.
Ⅰ.测定亚硝酸盐含量时要配制标准显色液,即吸取0.20mL、0.40mL、0.60mL、0.80mL、1.00mL和1.50mL亚硝酸钠,分别置于50mL比色管中,再另取1支空比色管。向各管中分别加入2.0mL对氨基苯磺酸,混匀,静置3~5min后,加入1.0mLN-1-萘基乙二胺盐酸盐溶液,最后加蒸馏水补足50mL。
Ⅱ.用样品处理液代替亚硝酸钠溶液做一个50mL的样品比色管,15min后与标准管对比。请分析回答:
(1)本实验所用测定亚硝酸盐含量的方法为______________。
(2)Ⅰ中空比色管起_____________作用。
(3)关于亚硝酸盐含量测定原理的正确描述是___________。
A.重氮化→酸化→显色→比色 B.重氮化→酸化→比色→显色
C.酸化→重氮化→显色→比色 D.酸化→重氮化→比色→显色
(4)Ⅱ中为什么要15min后对比?___________________________。 inuyasha2g1年前1
inuyasha2g1年前1 -
 hgjx614xs266e 共回答了20个问题
hgjx614xs266e 共回答了20个问题 |采纳率95%(1)目测比较法
(2)对照
(3)C
(4)时间太短显色反应不彻底,会直接影响比色,最终影响实验结果1年前查看全部
- 某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H 2 SO 4 溶液。以0.14mo
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H 2 SO 4 溶液。以0.14mol/L的NaOH溶液滴定上述稀H 2 SO 4 25mL,滴定终止时消耗NaOH溶液15mL,其操作分解为如下几步:
E.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液。A.移取稀H 2 SO 4 25.00 mL,注入洁净的锥形瓶中,并加入2-3滴指示剂。 B.用蒸馏水洗涤滴定管,后用标准溶液润洗2-3次。 C.取标准NaOH溶液注入碱式滴定管至 “0”或“0”刻度线以上。 D.调节液面至 “0”或“0”以下某一刻度,记下读数。
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点,记下滴定管液面读数。
就此实验完成填空:
(1)①滴定操作的正确顺序是(用序号填写) 。
②该滴定操作中应选用的指示剂是 。
③在F操作中如何确定终点? 。
(2)该滴定过程中,造成测定结果偏高的原因可能有哪些 。
①配制标准溶液的NaOH中混有Na 2 CO 3 杂质
②滴定终点读数时,俯视滴定管的刻度,其他操作正确
③ 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
④滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
⑤滴定前碱式滴定管尖嘴部分未充满溶液
⑥滴定中不慎将锥形瓶内液体摇出少量于瓶外
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度 mol/L(保留2位小数) lls776241年前1
lls776241年前1 -
 ZYG2000 共回答了18个问题
ZYG2000 共回答了18个问题 |采纳率88.9%⑴ ①B C E D A F②酚酞
③锥形瓶中溶液颜色由无色变成浅红色,且半分钟内不褪色
⑵①④⑤ ⑶4.20
1年前查看全部
- 若要配制500ml 1.00ml/L的稀硫酸溶液,应量取多少体积的浓度为98.0%(密度1.80g/ml的浓硫酸
若要配制500ml 1.00ml/L的稀硫酸溶液,应量取多少体积的浓度为98.0%(密度1.80g/ml的浓硫酸
这里的浓度98.0%应该怎样利用?还有这个密度是不是原来算质量的,那个浓硫酸的质量算出来后,需不需要用到那个98.0%? motorola1351年前2
motorola1351年前2 -
 uptoflying 共回答了19个问题
uptoflying 共回答了19个问题 |采纳率78.9%c(浓)=1000*1.80*98%/98=18mol/L
V=500*1/18=27.8mL1年前查看全部
- 求碘-淀粉分光光度法测甲醛中碘-淀粉分光光度法测甲醛中:“ 吸取1.00ml甲醛标准工作溶液于25ml比色管中,加1.0
求碘-淀粉分光光度法测甲醛中
碘-淀粉分光光度法测甲醛中:“ 吸取1.00ml甲醛标准工作溶液于25ml比色管中,加1.00mlKI溶液,2.5ml浓度为lmol/L的Na0H溶液,摇匀,放置20min.用1mol/LHCI溶液中和NaOH,使溶液呈中性,并过量1.0ml.加入淀粉溶液4ml,用水稀释至刻度,摇匀.用1cm比色皿,试液作参比,在600nm测定试剂空白吸光度,即甲醛降低碘淀粉溶液的吸光值”理解不了.
@@@@@予10ml比色管中依次加入2.00ml 4.5ug/mL的甲醛标准溶液、0.50ml 3mol/L的硫酸溶液、1.5ml 25.0ug/mL的重铬酸钾溶液,摇匀,于70℃恒温水浴锅中加热35分钟,流水冷却5分钟,再加入3.00ml 0.1mol/L的碘化钾溶液、1.00ml 10g/L的淀粉溶液,摇匀,放置稳定30分钟,配制相应的空白试剂(即不加入甲醛溶液)于另一支比色管中,以二次去离子水做参比,在596nm波长处,用10mm玻璃比色皿分别测定溶液的吸光度A0和A,并计算△A=A- A0。式中:A0——空白溶液的吸光度;A——样品溶液的吸光度@@@@@这里怎么没碘溶液,且在酸性条件下碘与甲醛根本不反应啊。 第1次1年前1
第1次1年前1 -
 骏123 共回答了12个问题
骏123 共回答了12个问题 |采纳率91.7%不光你理解不了,俺也理解不了.KI溶液不跟甲醛反应的啊...
我查了一下原始文献,是加的已知浓度的碘-碘化钾溶液.此时碘把甲醛氧化,剩余的碘再与淀粉显色.用它做参比,测出的没有加甲醛的试剂(就是碘-淀粉)的吸光度就是两者吸光度之差.就关联到甲醛浓度了,也就是甲醛降低碘淀粉溶液的吸光值.比如说用蒸馏水做参比时,假设加过甲醛的试液吸光度是0.4,没加甲醛的空白吸光度是0.6,那么如果用试液做参比的话,仪器认为试液是0点,空白测出的就是0.2.正好是差值.
你再看看原始文献,确认一下.1年前查看全部
- 溶液稀释计算有效氯含量为5.2%的次氯酸钠溶液,要使其1.00ml中含有1.50mg的有效氯,若用水稀释,其要用水的体积
溶液稀释计算
有效氯含量为5.2%的次氯酸钠溶液,要使其1.00ml中含有1.50mg的有效氯,若用水稀释,其要用水的体积为? 王者之駶1年前3
王者之駶1年前3 -
 skectium 共回答了14个问题
skectium 共回答了14个问题 |采纳率92.9%有效氯含量为5.2%的次氯酸钠溶液:,设其密度为 d g/ml,则1 ml溶液中有效氯的质量为:
m(Cl) = d*1 *5.2% = 0.052d g = 52d mg
要使其1.00ml中含有1.50mg的有效氯,则溶液体积增大的倍数为:
52d/1.50 = 34.7/d
即 1体积原溶液必须稀释至 (34.7/d)体积,其要用水的体积为
(34.7/d -1) 体积.1年前查看全部
- 某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H 2 SO 4 溶液;以0.14
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H 2 SO 4 溶液;以0.14
mol/L的NaOH溶液滴定上述稀H 2 SO 4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H 2 SO 4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度0以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度0或0刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
a.滴定操作的正确顺序是(用序号填写):_________________ 。
b.该滴定操作中应选用的指示剂是:_____________。
c.在G操作中如何确定终点? ____________________。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ______________,原因是_______________________ 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果精确到小数点后二位) ____________
mol/L。 梦醒了无梦1年前1
梦醒了无梦1年前1 -
 akuccc 共回答了21个问题
akuccc 共回答了21个问题 |采纳率95.2%(1)a:ECDBAGF(或ECBADGF);b:酚酞;c:滴入最后一滴NaOH溶液,溶液突然变成红色,半分钟不褪色
(2)偏大;滴定管内壁上的水膜,将标准液稀释,使体积读数偏大
(3)4.201年前查看全部
- 某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H 2 SO 4 溶液;以0.14mol
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H 2 SO 4 溶液;以0.14mol·L -1 的NaOH溶液滴定上述稀H 2 SO 4 25.00mL(酚酞作指示剂),滴定终止时消耗NaOH溶液15.00mL。
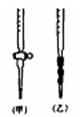
(1)该学生用标准0.14mol·L -1 NaOH溶液滴定硫酸的实验操作如下:
以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下A.用酸式滴定管取稀H 2 SO 4 25.00mL,注入锥形瓶中,滴入指示剂。 B.用待测定的溶液润洗酸式滴定管 C.用蒸馏水洗干净滴定管 D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写);E→C→D→ → → →F;
②在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(填“偏小”、“偏大”或“不变”)。
(3)如有1mol/L和0.1mol/L的NaOH溶液,应用0.1mol/L的NaOH溶液,原因是______________ _____ ___。
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 __(选填“甲”或“乙”)中。
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H 2 SO 4 溶液浓度 (选填“偏大”“偏小”或“无影响”)
(6)计算待测硫酸(稀释前的硫酸)的物质的量浓度(保留到小数点后二位) 。 天下第一毒1年前1
天下第一毒1年前1 -
 吠天之猪 共回答了18个问题
吠天之猪 共回答了18个问题 |采纳率77.8%(1) 若a=7,则HA是强酸;若a>7, 则HA是弱酸 (2) 否
(3) 弱 c(HA)>c(Na + )>c(A - ) (4) 10 -6 -10 -8 或9.9×10 -7
略1年前查看全部
- 在50.00mL 0.15mol/LNH3和0.20mol/LNH4Cl溶液中,加入1.00mL 0.10mol/LHC
在50.00mL 0.15mol/LNH3和0.20mol/LNH4Cl溶液中,加入1.00mL 0.10mol/LHCl溶液.计算加HCl溶液前后溶液的pH值各为多少?
 wfbzhl1年前1
wfbzhl1年前1 -
 闻风香儿来 共回答了13个问题
闻风香儿来 共回答了13个问题 |采纳率92.3%反应前:0.05L x 0.15mol/L = 0.0075mol MH3; 0.2mol/L x 0.05L = 0.01mol NH4Cl; 0.1mol/L x 0.001L = 0.0001mol HCl PKa (NH4Cl) = 10 PH = PKa + log [NH3] / [NH4+] = 10 + log (0.0075/0.01) = 10 - 0.12 = 9.875 NH3 + HCl --- NH4Cl 反应后:0.0074mol NH3 ; 0.0101mol NH4Cl PH = PKa + log [NH3] / [NH4+] = 10 + log (0.0074/0.0101) = 10 - 0.135 = 9.8651年前查看全部
- 一道分析化学的题目!急!已知酸性溶液准哦年个,高锰酸钾与二价铁反应时,1.00ml高锰酸钾溶液相当于0.1117g1Fe
一道分析化学的题目!急!
已知酸性溶液准哦年个,高锰酸钾与二价铁反应时,1.00ml高锰酸钾溶液相当于0.1117g1Fe,这句话是什么意思? cyf20081年前2
cyf20081年前2 -
 鉺釘恋ル 共回答了11个问题
鉺釘恋ル 共回答了11个问题 |采纳率90.9%指1ml高锰酸钾可以和0.1117gFe完全反应1年前查看全部
- 1.00mLHCl溶液相当于0.01400gCaO,计算HCl的摩尔浓度.计算时为什么HCl前加2,而CaO前是1呢?
 happylaosi1年前1
happylaosi1年前1 -
 fcuk_bcmei408 共回答了17个问题
fcuk_bcmei408 共回答了17个问题 |采纳率82.4%因为一份的CaO消耗两份的Hcl1年前查看全部
大家在问
- 1在Rt△OAB中,∠OAB=90°,∠BOA=30°,AB=2,若以O为坐标原点,OA所在直线为x轴,建立如图所示的平面
- 2cooking丶watching TV丶a new dress是什么意思中文请学霸帮忙,谢谢
- 3李爷爷用20块1米长的栅栏围成了一个羊圈.如果围成的羊圈长7米,面积应该是多少平方米?
- 4“书香校园师生读书年”给学校带来的变化 作文
- 5八年级上册英语第十课听力资料ab翻译
- 6高效a计划七年级数学答案是什么?快啊,只要专题四后面的答案
- 7she usually walks after supper .改为同义句she ususlly ------- ---
- 8第二次工业革命标志着人类进入到了什么时代?开始于什么时间?
- 9这个符号(&)哪国文字?怎么读
- 10这里为什么要用复数?Olny applicants with proper _(__)_ will be conside
- 11(﹣2x)²·﹙3x²-ax-6)-3x³﹢x²中不含X的3次项,确定a的 值
- 12下列安全标志图中,是中心对称图形的是( )
- 13四位数7□4□能被55整除,求出所有这样的四位数?
- 14跪求《报刊的四种理论》的读书报告,3000字左右.
- 15Where do you like to live? For this question, different peop
