CaC2O4溶于稀硫酸中,然后用0.5mol/l的KMnO4溶液滴定,用去KMnO4溶液1.2mol,求钙的质量
 ericer20022022-10-04 11:39:542条回答
ericer20022022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 soant 共回答了18个问题
soant 共回答了18个问题 |采纳率100%- 设物质的量为X
根据草酸根守恒得知
Ca(2+)----CaC2O4----H2C2O4
草酸与KMnO4的反应方程式如下
5H2C2O4+2KMnO4+3H2SO4===K2SO4+2MnSO4+10CO2+8H2O
所以1mol草酸对应2/5=0.4mol的KMnO4
Ca(2+)----CaC2O4----H2C2O4----0.4KMnO4
简化为Ca(2+)----0.4KMnO4
1-------------0.4
x-----------1.2mol
X=0.0012/0.4
所以Ca(2+)质量为 40*1.2/0.4=120克 - 1年前
 spider1821 共回答了409个问题
spider1821 共回答了409个问题 |采纳率- 5C2O42- + 2MnO4- + 16H+ == 2Mn2+ +10CO2 +8H2O
Ca-----CaC2O4----C2O42------0.4MnO4-
40g 0.4mol
x 1.2mol
x=120g
钙的质量120g - 1年前
相关推荐
- (2014•重庆)人体结石有多种,其中一种含有较多的草酸钙(CaC2O4),CaC2O4中碳元素的化合价是( )
(2014•重庆)人体结石有多种,其中一种含有较多的草酸钙(CaC2O4),CaC2O4中碳元素的化合价是( )
A.+1
B.+2
C.+3
D.+4 高棉的微笑1年前1
高棉的微笑1年前1 -
 wlg65 共回答了24个问题
wlg65 共回答了24个问题 |采纳率83.3%解题思路:根据草酸钙的化学式及化合物中元素的正负化合价的代数和为0来解答.草酸钙中钙元素为+2价,氧元素为-2价,设其中碳元素的化合价为x,根据化合物中元素的正负化合价的代数和为0,则(+2)+x×2+(-2)×4=0,解得x=+3;
故选:C.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查化合物中元素化合价的计算,能训练学生知识迁移使用的能力.1年前查看全部
- H2C2O4+CaSO4=CaC2O4↓+H2SO4 咋配平、?
 beifang51年前3
beifang51年前3 -
 chujianliang 共回答了18个问题
chujianliang 共回答了18个问题 |采纳率83.3%方程本身就平了1年前查看全部
- 称取大理石试样0.2303g,溶于酸中,调节酸后加入过量的(Nh4)2C2O4溶液,使Ca(正2价)沉淀为CaC2O4;
称取大理石试样0.2303g,溶于酸中,调节酸后加入过量的(Nh4)2C2O4溶液,使Ca(正2价)沉淀为CaC2O4;过滤、
洗净将沉淀溶于稀H2SO4中.溶解的溶液用C1/5 KMnO4=0.2012 MOL*L的KMnO4标准溶液滴定,消耗22.30ML,计算大理石中CaCo3的质量分数.
5C2O42- +2 MNO4- + 16H+ ===10CO2 + 2MN2+ + 8H2O 吃吃荡荡1年前1
吃吃荡荡1年前1 -
 hensy 共回答了21个问题
hensy 共回答了21个问题 |采纳率76.2%n(MnO4-) = 1/5*0.2012*0.02230 = 9*10^(-4) mol
5CaCO3 5Ca2+ 5C2O42- 2MnO4-
5 5 5 2
n(CaCO3) 9*10^(-4)
5/n(CaCO3) = 2/9*10^(-4)
n(CaCO3)=0.00225mol
m(CaCO3)=100*0.00225=0.225g
所以大理石中CaCO3的质量分数=0.225/0.2303=97.7%1年前查看全部
- 稀硫酸溶解CaC2O4沉淀的方程式
 vv之剑1231年前1
vv之剑1231年前1 -
 ee糖糖 共回答了15个问题
ee糖糖 共回答了15个问题 |采纳率86.7%CaC2O4+H2SO4==CaSO4+ H2C2O4(强酸制弱酸)1年前查看全部
- 草酸钙晶体(CaC2O4•H2O)高温完全分解的化学方程式
 只应是1年前1
只应是1年前1 -
 zhch_987 共回答了22个问题
zhch_987 共回答了22个问题 |采纳率86.4%CaC2O4.H2O==CaO+CO+CO2+H2O1年前查看全部
- CaC2O4溶于稀硫酸中,然后用0.004mol/l的KMnO4溶液滴定生成的H2C2O4,计算KMnO4溶液对CaO,
CaC2O4溶于稀硫酸中,然后用0.004mol/l的KMnO4溶液滴定生成的H2C2O4,计算KMnO4溶液对CaO,CaCO3的滴定度?
 名字真难取郁闷1年前1
名字真难取郁闷1年前1 -
 robertzxy 共回答了16个问题
robertzxy 共回答了16个问题 |采纳率87.5%为什么会有Cao和CaCO3?这两个都不能在酸性溶液中存在啊.
反应方程式是这个:
2KMnO4 + 5CaC2O4 + 8H2SO4 = 5CaSO4 + 2MnSO4+ K2SO4 + 10CO2 + 8H2O
具体计算,根据方程式的系数算就好.1年前查看全部
- 大学化学问题 计算CaC2O4在PH=1.00时的溶解度,已知Ksp(CaC2O4),H2C2O4的Ka1,Ka2 那个
大学化学问题 计算CaC2O4在PH=1.00时的溶解度,已知Ksp(CaC2O4),H2C2O4的Ka1,Ka2 那个“教授王”,你跟没说一样,我也知道这样算,具体杂算
乐家兵你也够扯蛋,这管什么酸啥事 chjf881年前1
chjf881年前1 -
 而里 共回答了26个问题
而里 共回答了26个问题 |采纳率96.2%先计算出C2O42-离子浓度,然后就算出啦.1年前查看全部
- (2012•金坛市一模)将水中的钙离子转化为草酸钙(CaC2O4)后进行反应与计算是测定水硬度的一种方法.已知草酸钙在4
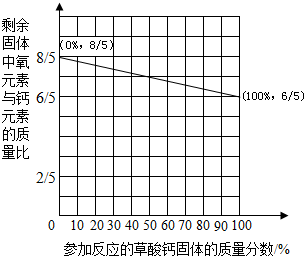 (2012•金坛市一模)将水中的钙离子转化为草酸钙(CaC2O4)后进行反应与计算是测定水硬度的一种方法.已知草酸钙在400℃~500℃时发生反应的化学方程式:CaC2O4
(2012•金坛市一模)将水中的钙离子转化为草酸钙(CaC2O4)后进行反应与计算是测定水硬度的一种方法.已知草酸钙在400℃~500℃时发生反应的化学方程式:CaC2O4
CaCO3+CO↑.当温度达到800℃以上,该反应生成的固体开始高温分解.如图是在400℃~500℃“剩余固体中氧元素与钙元素的质量比”随着“参加反应的草酸钙固体的质量分数”变化的一次函数关系图象.400℃~500℃ .
(1)根据图象,剩余固体中氧元素与钙元素的质量比为[6/5]时,剩余固体的组成______;当参加反应的草酸钙固体的质量分数达到60%时,剩余固体中氧元素与钙元素的质量比[34/25][34/25].(用最简分数表示)
(2)当温度超过800℃以后,氧元素与钙元素的质量比最小值为[2/5][2/5](用最简分数表示).当剩余固体中氧元素与钙元素的质量比为[4/5]时,则参加反应的固体的质量分数为______. maofuwang1年前1
maofuwang1年前1 -
 东正街桐子路 共回答了27个问题
东正街桐子路 共回答了27个问题 |采纳率77.8%解题思路:(1)根据草酸钙(CaC2O4)、碳酸钙的化学式求出各物质的质量比来分析.
(2)氧元素与钙元素的质量比最小值为碳酸钙全部分解为CaO,及氧化钙中钙元素与氧元素的质量比;根据求得的最小值与剩余固体中氧元素与钙元素的质量比的比较可求得参加反应的固体的质量分数(1)草酸钙(CaC2O4)中氧元素与钙元素的质量比为:(16×4):(40×1)═8:5
碳酸钙中氧元素与钙元素的质量比为:(16×3):40=6:5
故剩余固体中氧元素与钙元素的质量比为[6/5]时,剩余固体的组成应为碳酸钙;参加反应的草酸钙固体的质量分数达到60%时,剩余固体中氧元素与钙元素的质量比为:
16×(10×4−10×60%)
40×10=[34/25]
(2)氧元素与钙元素的质量比最小值为碳酸钙全部分解为CaO,及氧化钙中钙元素与氧元素的质量比;则,氧元素与钙元素的质量比最小值为[16×1/40×1]=[2/5]
剩余固体中氧元素与钙元素的质量比为[4/5]时,参加反应的固体的质量分数为:
2
5
4
5×100%=50%
故答案为:(1)CaCO3、[34/25] (2)[2/5]、50%点评:
本题考点: 有关化学式的计算和推断.
考点点评: 本类题主要是考查学生综合运用知识来解决问题的能力,解题时要注意题给的信息,这对解题有较大的帮助.1年前查看全部
- (2002•昆明)草酸钙(CaC2O4)是人体内不能吸收的沉积物.菠菜、洋葱、竹笋中含有丰富的草酸(H2C2O4)、草酸
(2002•昆明)草酸钙(CaC2O4)是人体内不能吸收的沉积物.菠菜、洋葱、竹笋中含有丰富的草酸(H2C2O4)、草酸钠(Na2C2O4);豆腐中含有较多的钙盐,如硫酸钙(CaSO4)等成分.化学工作者证实上述物质可以发生如下复分解反应:Na2C2O4+CaSO4═Na2SO4+CaC2O4↓,假如你是一位医生或营养学家,请从医学和营养学的角度谈谈应怎样科学、合理地安排饮食.
 fengxiaoyong1年前1
fengxiaoyong1年前1 -
 落花缤纷 共回答了22个问题
落花缤纷 共回答了22个问题 |采纳率77.3%解题思路:不同的物质中含有不同的营养物质,要根据物质中的不同成分合理膳食.要将波菜豆腐同食只需除去波菜中的草酸即可.菠菜中含有大量的草酸,而普通豆腐是用石膏或卤水点的,含有大量的钙,草酸与钙可结合形成不溶性的沉淀.既浪费了豆腐中的钙;又会导致肾结石.在吃波菜之前先将波菜用开水烫一下,除去草酸此问题就可解决.
故答案为:
先将波菜用开水烫,然后沥水,除去波菜中的草酸;先炒豆腐,然后加入焯水的菠菜,翻几下就出锅,减少草酸带来的麻烦,并保持菠菜豆腐的美味.点评:
本题考点: 均衡营养与健康.
考点点评: 在日常生活中要注意:不同的物质中含有不同的营养物质,要根据物质中的不同成分合理膳食,防止物质间反应发生中毒现象.1年前查看全部
- 草酸钙(CaC2O4)分解生成什么?
 NJYOYO141年前2
NJYOYO141年前2 -
 seagull1987 共回答了23个问题
seagull1987 共回答了23个问题 |采纳率95.7%CaC2O4 =(△加热) CaCO3 + CO ↑1年前查看全部
- 下图是100mgCaC2O4•H2O受热分解时,所得固体产物的质量随温度变化的曲线.
下图是100mgCaC2O4•H2O受热分解时,所得固体产物的质量随温度变化的曲线.

试利用图中信息结合所学的知识,回答下列问题:
(1)温度分别为t1和t2,固体产物的化学式为:A______,B______.
(2)由CaC2O4•H2O得到A的化学方程式为CaC2O4•H2O
CaC2O4+H2O↑△ .CaC2O4•H2O.
CaC2O4+H2O↑△ .
(3)由A得B的化学方程式为CaC2O4
CaCO3+CO↑△ .CaC2O4.
CaCO3+CO↑△ .
(4)由图计算产物C的分子量,并推断C的合理的化学式. mdot1年前1
mdot1年前1 -
 wang_Mf123 共回答了22个问题
wang_Mf123 共回答了22个问题 |采纳率95.5%解题思路:对图象进行分析,从图中曲线变化分析推出不同温度下发生的化学反应.根据题目要求可分3段讨论CaC2O4•H2O的受热分解.
(1)t1时A点,100mgCaC2O4•H2O的质量减少至87.7mg,从中分析CaC2O4•H2O受热分解的产物,固体CaC2O4•H2O的摩尔质量为146g/mol,设分解后产物的摩尔质量为M1.
100×10−3g
146g/mol=
87.7×10−3g
M1M1=128.04g/mol
由于CaC2O4的摩尔质量为128g/mol,从而判断出CaC2O4•H2O的分解反应方程式为:CaC2O4•H2O
△
.
CaC2O4+H2O↑(1)
A的化学式是CaC2O4.
再讨论t2时B点,87.7mg的CaC2O4受热分解,设分解产物的摩尔质量为M2.
87.7×10−3g
128g/mol=
68.5×10−3g
M2M2=99.98g/mol
从M2的实验值可推断出产物B应为CaCO3,分解方程式为:
CaC2O4
△
.
CaCO3+CO↑(2)
(2)综上分析,由CaC2O4•H2O得到A的化学方程式即为CaC2O4•H2O
△
.
CaC2O4+H2O↑
(3)综上分析,由A得到B的化学方程式即为CaC2O4
△
.
CaCO3+CO↑
(4)当加热至1100℃~1200℃时,由图读得分解产物C的质量约为38mg,设C点化合物摩尔质量为M3.
68.5×10−3g
100g/mol=
38×10−3g
M3M3=55.47g/mol
M3的实验值与CaO的摩尔质量(56g/mol)接近,分解方程式应为:
CaCO3
△
.
CaO+CO2↑(3)
由此得出C的化学式为CaO,其分子量即为56.
故答案为:
(1)CaC2O4、CaCO3(2)CaC2O4•H2O
△
.
CaC2O4+H2O↑
(3)CaC2O4
△
.
CaCO3+CO↑(4)CaO点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;相对分子质量的概念及其计算.
考点点评: 本题通过固体受热分解曲线的图象告诉我们做化学题时一定要重视化学过程,从而培养化学意识,提高化学素质.1年前查看全部
- CaC2O4结晶水合物化学式及其求法
 _34811年前2
_34811年前2 -
 早生花发 共回答了16个问题
早生花发 共回答了16个问题 |采纳率93.8%CaC2O4·H2O 草酸钙晶体
是一种白色晶体粉末.不溶于水、醋酸,溶于稀盐酸或稀硝酸.灼烧时转变成碳酸钙或氧化钙.
草酸钙结构式由钙盐水溶液与草酸作用制得.用于陶瓷上釉、制草酸等.味道是弱酸的.1年前查看全部
- 已知:CaC2O4沉淀的Ksp=2.3×10-9,将等体积的CaCl2溶液与Na2C2O4溶液混合,若起始CaCl2的浓
已知:CaC2O4沉淀的Ksp=2.3×10-9,将等体积的CaCl2溶液与Na2C2O4溶液混合,若起始CaCl2的浓度为1×10-2mol•L-1,则生成沉淀所需Na2C2O4溶液的最小起始浓度为( )
A.2.3×10-7mol•L-1
B.4.6×10-7mol•L-1
C.9.2×10-7mol•L-1
D.
×10-3mol•L-123  luo14371年前1
luo14371年前1 -
 风中的燕子 共回答了11个问题
风中的燕子 共回答了11个问题 |采纳率100%解题思路:根据Ksp(CaC2O4)=c(C2O42-)×c(Ca2+)计算.一定温度下溶度积是常数;CaCl2溶液的浓度为1×10-2mol/L,等体积混合后浓度为5×10-3mol/L,
由Ksp(CaC2O4)=c(C2O42-)×c(Ca2+)可知,混合后c(C2O42-)=
Ksp
C(Ca2+)=
2.3×10−9
5×10−3=4.6×10-7mol•L-1
所以所需Na2C2O4溶液的最小起始浓度为4.6×10-7mol•L-1×2=9.2×10-7mol/L;
故选C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了难溶电解质的沉淀溶解平衡的计算,溶液等体积混合是解题注意的关键.1年前查看全部
- 称取含CaCO360%的试样0.25g,用酸溶解后加入过量(NH4)2C2O4,使Ca2+沉淀为CaC2O4
称取含CaCO360%的试样0.25g,用酸溶解后加入过量(NH4)2C2O4,使Ca2+沉淀为CaC2O4
称取含CaCO3 60%的试样0.25g,用酸溶解后加入过量(NH4)2C2O4,使Ca2+沉淀为CaC2O4.在过滤、洗涤沉淀时,为了使沉淀溶解损失造成的误差不大于万分之一,应该用100mL质量百分比浓度至少为多少的(NH4)2C2O4作洗涤液?已知溶液中当Ca2+和C2O42―离子物质的量浓度的乘积等于或大于2.3×10-9时会析出CaC2O4沉淀. catbb1年前1
catbb1年前1 -
 孤独的摆摆 共回答了19个问题
孤独的摆摆 共回答了19个问题 |采纳率100%441年前查看全部
- 为什么CaC2O4溶于HCL
 cherryqy1年前6
cherryqy1年前6 -
 樱飞如雪 共回答了20个问题
樱飞如雪 共回答了20个问题 |采纳率80%因为草酸(H2C2O4)的酸性比盐酸酸性弱,可以强酸制弱酸,所以CaC2O4溶于HCL.
化学方程式:CaC2O4+ 2HCl = CaCl2 + H2C2O41年前查看全部
- 草酸钙高温分解化学方程式?草酸钙化学式CaC2O4
 cui250381年前2
cui250381年前2 -
 海水正蓝-珍珍 共回答了22个问题
海水正蓝-珍珍 共回答了22个问题 |采纳率90.9%CaC2O4=CaCO3+CO↑
强热800至1000摄氏度的反应.
在1000摄氏度或者更高时候,碳酸钙也会分解,整个反应为:
CaC2O4=CaO+CO↑+CO2↑1年前查看全部
- CaC2O4在PH=3.0HCL溶液中的溶解度
CaC2O4在PH=3.0HCL溶液中的溶解度
已知Ksp,cac2o4=2.0*10^-9, Ka1=5.9*10^-2, Ka2=6.4*10^-11 人在方向1年前1
人在方向1年前1 -
 心灵圣地 共回答了16个问题
心灵圣地 共回答了16个问题 |采纳率93.8%溶解时生成的是H2C2O4
Ka=Ka1*Ka2=3.776*10^-12
[H+]^2*[C2O42-]
---------------=Ka (1)
[H2C2O4]
[Ca2+]*[C2O42-]=Ksp (2)
[H+]=10^-3 (3)
[Ca2+]=.=[C2O42-]+[H2C2O4]
CaC2O4+2H+====Ca2++H2C2O4
K=[Ca2+][H2C2O4]/[H+]^2=[Ca2+][C2O42-]/Ka=Ksp/Ka
可以求出[Ca2+],再换算成溶解度1年前查看全部
- 某试样为等物质的量的纯Ca2CO3和纯MgCO3混合物,处理后加(NH4)2C2O4得CaC2O4沉淀,
某试样为等物质的量的纯Ca2CO3和纯MgCO3混合物,处理后加(NH4)2C2O4得CaC2O4沉淀,
经过滤洗涤后,用H2SO4溶解,用40.00mL KMnO4(1mL KMnO4相当于0.008378g Fe2+)完成滴定,若将沉淀钙以后的溶液中的镁沉淀为MgNH4PO4,再灼烧成Mg2P2O7,问可得MgP2O7多少克?[M(Fe)=55.85g/mol;M(MgP2O7)=222.6g/mol]
明显打错了么 CaCO3 黑努力1年前2
黑努力1年前2 -
 玄玄之子 共回答了15个问题
玄玄之子 共回答了15个问题 |采纳率73.3%这道题好像有点问题,因为草酸镁是微溶于水的,用草酸铵沉淀时钙镁都应该生成沉淀.但按照题目的意思好像是只生成草酸钙的沉淀.照着题目做这道题的话如下:
加完草酸铵生成的沉淀是CaC2O4,用H2SO4溶解得到H2C2O4,KMnO4与H2C2O4发生氧化还原反应:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2 + 8H2O(1)
先根据KMnO4溶液对铁的滴定度求其浓度,MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
0.008378g Fe2+的物质的量为0.008378/55.85=0.00015mol,据反应式知对应的n(KMnO4)=1/5n(Fe)=0.00003mol,即1mLKMnO4溶液中含KMnO4的量为0.00003mol,所以其浓度为0.00003mol/mL.
由反应式(1),得n(H2C2O4)=5/2n(KMnO4)=2.5cV=2.5*0.00003*40.00=0.003mol
所以n(Ca)=n(H2C2O4)=0.003mol
因为钙镁等物质的量,所以镁元素的量n(Mg)=0.003mol
则n(Mg2P2O7)=1/2n(Mg)=0.0015mol
所以m(Mg2P2O7)=222.6*0.0015=0.334g .
如果按照钙镁都被沉淀为草酸盐解题,前面都一样,算出草酸的量后,钙镁的量只需各取一半就行,也就是结果为0.167g1年前查看全部
- 取血清5毫升,稀释至25毫升,量取10毫升加入H2C2O4适量使Ca离子沉淀为CaC2O4,将CaC2O4溶于硫酸中,
取血清5毫升,稀释至25毫升,量取10毫升加入H2C2O4适量使Ca离子沉淀为CaC2O4,将CaC2O4溶于硫酸中,
再用高锰酸钾标准溶液0.001700mol\L滴定,终点时用去1.2ml,求血样中Ca离子的含量(mg100ml),(Mca40.08) faxuejia1年前1
faxuejia1年前1 -
 bageda 共回答了21个问题
bageda 共回答了21个问题 |采纳率85.7%好吧,这个得慢慢算,听好咯!
5C204- + 2MnO4- + 16H+ =10CO2 +2Mn2+ +8H20
计算出C204-的含量为 0.001700*2.5=0.004250mmol
然后溶液中钙离子的含量就是草酸根的含量 0.004250mmol.
其次,我们可以推断出,稀释后血清中钙离子含量 0.004250*2.5=0.01063mmol(注意有效数字)
然后计算出血清中钙离子浓度(有些跳步,应该可以自己解决)
0.01063mmol/25mL *5 =0.002016mol/L,换算得到0.0002016mol/100mL,最后得到答案
8.504mg/100mL.
我也不知道答案对不对.1年前查看全部
- 1 正常人每天排尿量约为1.4L,其中约含0.1克钙离子,为了不是尿中形成CaC2O4,沉淀,其中C2O4-最高浓度为多
1 正常人每天排尿量约为1.4L,其中约含0.1克钙离子,为了不是尿中形成CaC2O4,沉淀,其中C2O4-最高浓度为多少,ksp=2.32*10的-9次方(特别提问,是用Ksp/10的-5次方,还是除以该例子浓度)
2 已知下列电池(-)Zn(s)|Zn离子(x摩尔每升)||阴离子(0.1摩尔每升)|Ag(s)(+)的电动势为1.5V,求锌离子浓度(为什么是Ag箭头e-+Ag+,不能反过来呢,虽然差不多但影响结果啊,还有那个锌,不是负极失点子,正极得电子吗)
3 计算285K时金属锌放在浓度为0,1摩尔每升的锌离子溶液中的电极电势(特别提问,为什么是锌离子+2e-=Zn,不是Zn=2e-+锌离子)
4 计算下列电池电动势Pt|MnO4-(O.1摩尔每升),锰离子(1*10的-2次方),氢离子(1摩尔每升)||氯离子(0.1摩尔每升)|氯气(100kPa)|Pt(为什么是氯气+2e-=2氯离子,而不是反过来写呢,虽然好像差不多,但是结果不同啊)
以上问题求详解,真心着急, louhn1年前2
louhn1年前2 -
 ztuu844 共回答了13个问题
ztuu844 共回答了13个问题 |采纳率92.3%1.c(Ca2+) = 0.10g/(40g·mol-1×1.4L)=1.8×10-3 mol·L-1c(C2O42-) = Ksp/ c(Ca2+) = 2.3×10-9 /1.8×10-3 = 1.3×10-6 mol·L-1 以该题浓度为准.
2.3.4不好意思,电池神马的也是我的弱项.1年前查看全部
- 计算CaC2O4在pH=4的0.010mol/L草酸溶液中的溶解度
 xyr12231年前1
xyr12231年前1 -
 lrbs 共回答了21个问题
lrbs 共回答了21个问题 |采纳率95.2%草酸pka2=4.27,即ka2=5.37E-5,则pH=4的0.010mol/L草酸溶液中草酸根浓度为
0.01x(0.537/(0.537+1))=3.49E-3M
草酸钙的溶度积为2.32E-9,则饱和溶液中钙离子浓度(同时也是草酸钙溶解度)为
2.32E-9 / 3.49E-3=6.64E-7M1年前查看全部
- HNO3可以用来溶解哪种电解质MgCO3 AgPO4 AgCl CaC2O4 BaSO4利用平衡移动原理可以溶解上面那几
HNO3可以用来溶解哪种电解质
MgCO3 AgPO4 AgCl CaC2O4 BaSO4
利用平衡移动原理
可以溶解上面那几种阿 蕻毵毵1年前1
蕻毵毵1年前1 -
 sweetsmileyoyo 共回答了15个问题
sweetsmileyoyo 共回答了15个问题 |采纳率93.3%可以溶解的是
MgCO3 Ag3PO4 CaC2O41年前查看全部
- 在CaSO4,Ca(OH)2,CaC2O4,CaCl2四种物质中,溶解度最小的估计是________.
在CaSO4,Ca(OH)2,CaC2O4,CaCl2四种物质中,溶解度最小的估计是________.
参考答案为CaC2O4.为什么?是不是与分子极化率有关?要是有关的话,那又怎么判断CaC2O4的溶解度是这四者中最小的? 5879285301年前2
5879285301年前2 -
 魔之星 共回答了18个问题
魔之星 共回答了18个问题 |采纳率100%CaCl2是可溶物质,CaSO4,Ca(OH)2是微溶物质,CaC2O4是难溶物质.溶解度最小的是CaC2O4.1年前查看全部
- 水中碳酸氢根离子Hco3主要以CaH2co3的形式存在,那在水中加入草酸H2C2O4后除了形成草酸钙CaC2o4还有?
水中碳酸氢根离子Hco3主要以CaH2co3的形式存在,那在水中加入草酸H2C2O4后除了形成草酸钙CaC2o4还有?
草酸去除水中钙离子后,Hco3缓冲物质是否跟着消失了?草酸与碳酸氢钙CaH2co3的反应的方程式是什么? 我是一只海鸥1年前2
我是一只海鸥1年前2 -
 顺手一枪 共回答了15个问题
顺手一枪 共回答了15个问题 |采纳率100%H2C2O4+Ca(HCO3)2=CaC2O4+2H2O+2CO2;
在这个反应方程中,Hco3缓冲物质反应消失了,但是水中的Hco3缓冲物质是不可能完全 被除去的.1年前查看全部
大家在问
- 1初中数学如图,在平面直角坐标系中, 点A为二次函数y=-x^2+4x-1图象的顶点,图象与y轴交于点C,过点A并与AC垂
- 2句子是由( )构成的.一个句子一般可分为两个部分,前一部分( ),后一部分( ).
- 3do you like wise me?汉语翻译.
- 4用四个相同的数字写算式,使它的结果是100
- 5“2009年”用英语读“two thousand nine"?
- 6有没有那个数是2的n次方,又是3的倍数
- 7一项工程甲独做8小时可以完成,乙独做8小时只能完成这项工程的80%,甲、乙合做多
- 8ca怎么变成cao
- 9什么时候在动词后面加es什么时候加ing?最好是多举几个例子,形象地加以说明,
- 10(2014•上海)一列横波沿水平放置的弹性绳向右传播,绳上两顶点A、B的平衡位置相距[3/4]波长,B位于A右方.t时刻
- 11如果两个有理数的和比其中任意一个加数都大,那么下列说法正确的是( ) A.它们都是正数 B.它们都是负数 C.一个正数
- 12李清照——《菩萨蛮》风柔日薄春犹早,夹衫乍著心情好.睡起觉微寒,梅花鬓上残.故乡何处是?忘了除非醉.沈水卧时烧,香消酒未
- 13(2012•天津)如图所示,墙壁上线盒内有三根电线,其中红色为火线、蓝色为零线、黄绿色为地线,现将三孔插座与三根电线连接
- 14一句名言名句先是给我一句名言警句,然后解释它的意思,给一个关于这个名言的名人故事,
- 15连词成句你本来不用这么早来.You______ ______come so early.我很后悔对她说了实情.I____
