可逆反应aX+2Y(g)⇌2Z(g)在一定条件下达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)-时间(
 鸣想2022-10-04 11:39:541条回答
鸣想2022-10-04 11:39:541条回答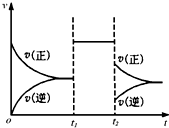 可逆反应aX+2Y(g)⇌2Z(g)在一定条件下达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)-时间(t)图象如图.则下列说法正确的是( )
可逆反应aX+2Y(g)⇌2Z(g)在一定条件下达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)-时间(t)图象如图.则下列说法正确的是( )A.若X是固体,则t1时一定是增大了容器的压强
B.若X是气体,则t2时可能是增大了容器的压强
C.若X是固体,则t1时可能是增大了X的质量
D.t2时不可能是减小容器压强;若采用了降温措施,则该反应的正反应方向△H<0

已提交,审核后显示!提交回复
共1条回复
 wangfandaiju 共回答了17个问题
wangfandaiju 共回答了17个问题 |采纳率94.1%- 解题思路:由图可知,可逆反应到达平衡后,在t1时改变条件,正、逆速率都同等程度增大,平衡不移动,故改变条件可能是加入催化剂,或是增大压强,且反应前后气体的物质的量不变,改变温度与某一物质浓度,平衡一定移动;在t2时改变条件,正逆反应速率都减小,且逆反应速率减小的程度大,故改变的条件可能是降低温度,根据以上分析进行判断.
由图可知,可逆反应到达平衡后,在t1时改变条件,正、逆速率都同等程度增大,平衡不移动,故改变条件可能是加入催化剂,或是增大压强,且反应前后气体的物质的量不变,改变温度与某一物质浓度,平衡一定移动;在t2时改变条件,正逆反应速率都减小,且逆反应速率减小的程度大,故改变的条件可能是降低温度,
A、若X是固体,反应前后气体体积不变,压强不影响化学平衡,可以增大压强来改变平衡,但是加入催化剂也可以出现同样效果,所以不一定是增大了压强,故A错误;
B、若X是气体,反应前后气体体积变大,则t2时增大了容器的压强,正逆反应速率都应该增大,不是减小,故B错误;
C、若X是固体,则t1时可能是增大了X的质量,对化学平衡没有影响,故C错误;
D、由于a+2≥2,反应物的气体体积不会小于生成物的气体体积,减小压强平衡不移动或者向着逆向移动,不会出现正反应速率大于逆反应速率,所以一定不是减小压强;若是降低温度,v(正)>v(逆),平衡向着正向移动,正反应是放热反应,△H<0,故D正确;
故选D.点评:
本题考点: 化学反应速率的影响因素;化学平衡的影响因素.
考点点评: 考查化学平衡移动影响因素、化学平衡图象等,难度中等,根据外界条件对平衡的影响分析图象变化的可能原因是关键. - 1年前
相关推荐
- 可逆反应aX+2Y(g)⇌2Z(g)在一定条件下达到平衡后,t 1 和t 2 时各改变某一种外界条件,化学反应速率(v)
可逆反应aX+2Y(g)⇌2Z(g)在一定条件下达到平衡后,t 1 和t 2 时各改变某一种外界条件,化学反应速率(v)-时间(t)图象如图.则下列说法正确的是( ) A.若X是固体,则t 1 时一定是增大了容器的压强 B.若X是气体,则t 2 时可能是增大了容器的压强 C.若X是固体,则t 1 时可能是增大了X的质量 D.t 2 时不可能是减小容器压强;若采用了降温措施,则该反应的正反应方向△H<0 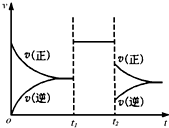
 一生童话1年前1
一生童话1年前1 -
 notme2 共回答了22个问题
notme2 共回答了22个问题 |采纳率100%由图可知,可逆反应到达平衡后,在t 1 时改变条件,正、逆速率都同等程度增大,平衡不移动,故改变条件可能是加入催化剂,或是增大压强,且反应前后气体的物质的量不变,改变温度与某一物质浓度,平衡一定移动;在t 2 时改变条件,正逆反应速率都减小,且逆反应速率减小的程度大,故改变的条件可能是降低温度,
A、若X是固体,反应前后气体体积不变,压强不影响化学平衡,可以增大压强来改变平衡,但是加入催化剂也可以出现同样效果,所以不一定是增大了压强,故A错误;
B、若X是气体,反应前后气体体积变大,则t 2 时增大了容器的压强,正逆反应速率都应该增大,不是减小,故B错误;
C、若X是固体,则t 1 时可能是增大了X的质量,对化学平衡没有影响,故C错误;
D、由于a+2≥2,反应物的气体体积不会小于生成物的气体体积,减小压强平衡不移动或者向着逆向移动,不会出现正反应速率大于逆反应速率,所以一定不是减小压强;若是降低温度,v(正)>v(逆),平衡向着正向移动,正反应是放热反应,△H<0,故D正确;
故选D.1年前查看全部
- 可逆反应aX+2Y(g)⇌2Z(g)在一定条件下的达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)-时间
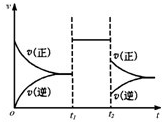 可逆反应aX+2Y(g)⇌2Z(g)在一定条件下的达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)-时间(t)图象如图.则下列说法中正确的是( )
可逆反应aX+2Y(g)⇌2Z(g)在一定条件下的达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)-时间(t)图象如图.则下列说法中正确的是( )
A.若X是固体,则t1时一定是增大了容器的压强
B.若X是气体,则t2时不可能是减小容器压强
C.若X是固体,则t1时可能是增大了X的质量
D.若t2时采用了降温措施,则该反应的正反应方向△H>0 wlw1234520031年前1
wlw1234520031年前1 -
 明家的大女儿 共回答了17个问题
明家的大女儿 共回答了17个问题 |采纳率88.2%解题思路:由图可知,可逆反应到达平衡后,在t1时改变条件,正、逆速率都同等程度增大,平衡不移动,故改变条件可能是加入催化剂,或是增大压强,且反应前后气体的物质的量不变,改变温度与某一物质浓度,平衡一定移动;在t2时改变条件,正逆反应速率都减小,且逆反应速率减小的程度大,故改变的条件可能是降低温度,根据以上分析进行判断.由图可知,可逆反应到达平衡后,在t1时改变条件,正、逆速率都同等程度增大,平衡不移动,故改变条件可能是加入催化剂,或是增大压强,且反应前后气体的物质的量不变,改变温度与某一物质浓度,平衡一定移动;在t2时改变条件,正逆反应速率都减小,且逆反应速率减小的程度大,故改变的条件可能是降低温度,
A、若X是固体,反应前后气体体积不变,压强不影响化学平衡,可以增大压强来改变平衡,但是加入催化剂也可以出现同样效果,所以不一定是增大了压强,故A错误;
B、若X是气体,反应前后气体体积变化,则t2时减小容器的压强,正逆反应速率都应该减小,不是不变,则t2时不可能是减小容器压强,故B正确;
C、若X是固体,则t1时可能是增大了X的质量,对化学平衡没有影响,故C错误;
D、由于a+2≥2,反应物的气体体积不会小于生成物的气体体积,减小压强平衡不移动或者向着逆向移动,不会出现正反应速率大于逆反应速率,所以一定不是减小压强;若是降低温度,v(正)>v(逆),平衡向着正向移动,正反应是放热反应,△H<0,故D错误;
故选B.点评:
本题考点: 化学反应速率与化学平衡图象的综合应用.
考点点评: 本题考查化学平衡移动影响因素、化学平衡图象等,难度中等,根据外界条件对平衡的影响分析图象变化的可能原因是关键.1年前查看全部
大家在问
- 1鲁有执长竿入城门者中的之是什么意思
- 2判断对错:任何一个有理数的绝对值都是非负数
- 3语文书上五年级园地6漫画父与子作文怎么写?
- 4阳光穿透云层散射出一缕缕阳光.这个现象的学名是什么?
- 5初二数学中的一道几何题,禁止使用三角函数.
- 6巨型石雕矗立在( ),这里是汉代古都( ),也是丝绸之路( )的起点.
- 7her notebook are on the tabie改为一般疑问句
- 8明白的来某商场有一部自动扶梯匀速由下向上运动,甲、乙两人都急于上楼办事.因此在乘扶梯的同时匀速登梯,甲登55级后到达了楼
- 9Whose pencil is this?的意思
- 10用边长为1、4、7、8、9、10、14、15、18的正方形怎样拼一个长为33,宽为32的完美长方形?
- 11人教版数学必修二习题4.3(P138)和参考复习题(P144)答案
- 12不太明白p>a表示的含义假设有个检验统计量是F,然后把样本数据代入F可以算出一个值记为f,那么P值就是在原假设成立的条件
- 13函数f(x)=x3-ax2-bx+a2在x=1处有极值10,则点(a,b)为( )
- 14若a是方程x的平方-2x-1的一个根 则a的平方+a平方分之一等于
- 15抛物线y的平方=-X的焦点坐标为?
