抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图 已知:①炉气、尾气中含有SO 2 ;②混合反应
 sadlgjwaklrgrsth2022-10-04 11:39:541条回答
sadlgjwaklrgrsth2022-10-04 11:39:541条回答| 抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图 |
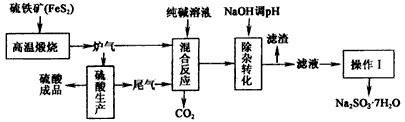 |
| 已知:①炉气、尾气中含有SO 2 ;②混合反应中还溶解有少量Fe 2 O 3 、MgO等矿尘。 |
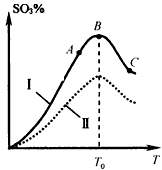 |
| A.该反应的正反应为放热反应 B.曲线I上A、C两点反应速率的关系是:vA>vC C.反应达到B点时,2v 正 (O 2 )=v 逆 (SO 3 ) D.已知V 2 O 5 的催化效果比Fe 2 O 3 好,若I表示用V 2 O 5 催化剂的曲线,则Ⅱ是Fe 2 O 3 作催化剂的曲线 |

已提交,审核后显示!提交回复
共1条回复
 一见喜来 共回答了17个问题
一见喜来 共回答了17个问题 |采纳率100%- (1)4FeS 2 (s)+11O 2 (g)=8SO 2 (g)+2Fe 2 O 3 (s) △H= -3412 kJ/mol
(2)SO 2 +Na 2 CO 3 =Na 2 SO 3 +CO 2 ↑(或2SO 2 +Na 2 CO 3 +H 2 O=NaHSO 3 +CO 2 ↑)
(3)Fe 3+ +3OH - =Fe(OH) 3 ↓(或Fe 2+ +2OH - =Fe(OH) 2 ↓或Mg 2+ +2OH - =Mg(OH) 2 ↓或HSO 3 - +OH - =SO 3 2- +H 2 O)
(4)加热蒸发、冷却结晶、过滤(洗涤干燥)
(5)AC - 1年前
相关推荐
- Na 2 SO 3 是抗氧剂.向烧碱和Na 2 SO 3 的混合溶液中加入少许溴水,振荡溶液变为无色.
Na 2 SO 3 是抗氧剂.向烧碱和Na 2 SO 3 的混合溶液中加入少许溴水,振荡溶液变为无色.
(1)SO 2 是大气污染物,是形成______的因素之一,实验室用亚硫酸钠固体与一定浓度的硫酸溶液反应制备SO 2 气体,写出该反应的离子反应方程式______.尾气通入过量NaOH溶液可得到烧碱和Na 2 SO 3 的混合溶液,该反应的化学反应方程式为______.
(2)碱性条件下Br 2 与Na 2 SO 3 溶液反应的离子方程式为______.
(3)硅酸钠溶液俗称水玻璃.取少量硅酸钠溶液于试管中,通入过量的SO 2 ,得到沉淀物.写出该反应的离子方程式:______.
(4)CO 2 气体中含有少量SO 2 气体,要除去SO 2 杂质,将混合气体通入______试剂,其反应的离子方程式:______.
(5)为了探究氨还原性,某研究小组用氨和CuO在加热条件下反应,产物中得到一种红色固体和一种气体单质.写出反应化学方程式______. mouseshan1年前1
mouseshan1年前1 -
 5527596 共回答了14个问题
5527596 共回答了14个问题 |采纳率78.6%(1)二氧化硫是酸性氧化物,能和水反应生成亚硫酸,亚硫酸不稳定,易被氧化生成硫酸,所以二氧化硫是形成酸雨的主要成分;
浓硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,离子反应方程式为:SO 3 2- +2H + =SO 2 ↑+H 2 O;
少量二氧化硫和氢氧化钠溶液反应生成亚硫酸钠和水,化学反应方程式为:SO 2 +2NaOH=Na 2 SO 3 +H 2 O,
故答案为:酸雨;SO 3 2- +2H + =SO 2 ↑+H 2 O;SO 2 +2NaOH=Na 2 SO 3 +H 2 O;
(2)溴具有强氧化性,亚硫酸钠具有强还原性,碱性条件下,二者发生氧化还原反应生成硫酸根离子和溴离子,离子方程式为:Br 2 +SO 3 2- +2OH - =2Br - +SO 4 2- +H 2 O,
故答案为:Br 2 +SO 3 2- +2OH - =2Br - +SO 4 2- +H 2 O;
(3)二氧化硫和水反应生成亚硫酸,亚硫酸的酸性大于硅酸,所以过量亚硫酸和硅酸钠反应生成亚硫酸氢钠和硅酸,离子方程式为:SiO 3 2- +2SO 2 +2H 2 O=H 2 SiO 3 ↓+2HSO 3 - ,
故答案为:SiO 3 2- +2SO 2 +2H 2 O=H 2 SiO 3 ↓+2HSO 3 - ;
(4)亚硫酸酸性大于碳酸,二氧化碳和碳酸氢钠不反应,所以可以用饱和碳酸氢钠除去二氧化硫,离子反应方程式为:2HCO 3 - +SO 2 =SO 3 2- +2CO 2 +H 2 O,
故答案为:饱和碳酸氢钠溶液;2HCO 3 - +SO 2 =SO 3 2- +2CO 2 +H 2 O;
(5)氨气和氧化铜在加热条件下,生成一种红色固体,则该固体为Cu,同时生成一种单质,为氮气,根据元素守恒知,还生成水,则该反应方程式为:3CuO+2NH 3
△
.
2Cu+N 2 +3H 2 O,故答案为:3CuO+2NH 3
△
.
2Cu+N 2 +3H 2 O.1年前查看全部
- (2012•佛山一模)Na2SO3是抗氧剂.向烧碱和Na2SO3的混合溶液中加入少许溴水,振荡后溶液变为无色.
(2012•佛山一模)Na2SO3是抗氧剂.向烧碱和Na2SO3的混合溶液中加入少许溴水,振荡后溶液变为无色.
(1)SO2通入过量NaOH溶液可得到烧碱和Na2SO3的混合溶液,该反应的化学方程式为______.
(2)碱性条件下Br2与Na2SO3溶液反应的离子方程式为______,该反应的氧化剂是______,1mol Br2参与反应转移______ mol电子.
(3)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告.
限选试剂:2mol•L-1HCl;1mol•L-1H2SO4;1mol•L-1BaCl2;1mol•L-1Ba(NO3)2;0.1mol•L-1AgNO3;CCl4;新制饱和溴水;新制饱和氯水.
编号 实验操作 预期现象和结论 步骤① 取少量待测液于试管A中,D滴加2mol•L-1HCl至溶液呈酸性,加入几滴______(填试剂).震荡. ______
证明待测液中含SO2−3步骤② ______ 有白色沉淀生成证明待测液中含SO 2−4步骤③ 另取少量待测液于试管C中,加入足量氯水,再加入四氯化碳,震荡,静置后观察颜色 ______
待测液中含Br- 扮13的脸1年前1
扮13的脸1年前1 -
 luckuuu 共回答了20个问题
luckuuu 共回答了20个问题 |采纳率95%解题思路:(1)氢氧化钠过量,二氧化硫和氢氧化钠反应生成亚硫酸钠和水;
(2)碱性条件下,Br2与Na2SO3溶液反应生成硫酸钠和NaBr;鉴定其中SO32-、SO42-和Br-离子;在氧化还原反应中化合价降低的物质为氧化剂,根据得失电子解答;
(3)①利用溴水与亚硫酸根离子的氧化还原反应,鉴定SO32-;
②加盐酸先排除亚硫酸离子,再利用硫酸钡白色沉淀的生成鉴定SO42-;
③利用萃取后,溴溶解在四氯化碳中,下层为橙红色,鉴定Br-.(1)SO2与过量NaOH溶液反应,因NaOH过量,故生成的是正盐,化学方程式为:SO2+2NaOH=Na2SO3+H2O,
故答案为:SO2+2NaOH=Na2SO3+H2O;
(2)碱性条件下,Br2与Na2SO3溶液反应生成硫酸钠和NaBr,该离子反应为SO32-+Br2+2OH-=H2O+SO42-+2Br-;该反应中溴从0价变为-1价,Br2为氧化剂,1mol Br2参与反应转移2mol电子,
故答案为:SO32-+Br2+2OH-=H2O+SO42-+2Br-;Br2;2;
(3)鉴定其中SO32-、SO42-和Br-离子,
①加新制饱和溴水与亚硫酸根离子的氧化还原反应,观察溴水褪色,说明含SO32-;
②另取少量待测液于试管B中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液,观察到白色沉淀的生成,说明含SO42-;
③另取少量待测液于试管C中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色,溴溶解在四氯化碳中,下层为橙红色,说明含Br-,
故答案为:
编号 实验操作 预期现象和结论
步骤① 新制饱和溴水 溴水褪色
步骤② 另取少量待测液于试管B中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液
步骤③ 溶液分层,下层液体呈橙红色点评:
本题考点: 含硫物质的性质及综合应用;常见阴离子的检验.
考点点评: 本题考查物质的组成及成分的测定,侧重二氧化硫和亚硫酸盐的性质的考查,把握发生的氧化还原反应、实验方案的设计为解答的关键,注意离子检验的应用,题目难度中等.1年前查看全部
- 抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图:
抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图:
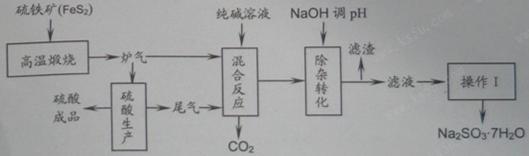
已知:①炉气、尾气中含有SO 2 ;②混合反应中还溶解有少量Fe 2 O 3 、MgO等矿尘。
(1)煅烧1molFeS 2 放出热量为853kJ,则FeS 2 燃烧的热化学方程式为_____________。
(2)“混合反应”中纯碱(Na 2 CO 3 )参与反应的化学方程式为_____________(任写一个)。
(3)用NaOH“除杂”时,主要的离子方程式为_____________(任写一个)。
(4)通过“操作Ⅰ”可以得到亚硫酸钠晶体,写出主要操作步骤的名称:__________。
(3)硫酸生产中炉气转化反应为:2SO 2 (g)+ O 2 (g)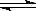 2SO 3 (g)。研究发现,SO 3 的体积分数(SO 3 %)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
2SO 3 (g)。研究发现,SO 3 的体积分数(SO 3 %)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________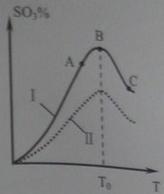
A.该反应的正反应为放热反应
B.曲线Ⅰ上A、C两点反应速率的关系是: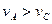
C.反应达到B点时,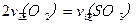
D.已知V 2 O 5 的催化效果比Fe 2 O 3 好,若Ⅰ表示用V 2 O 5 催化剂的曲线,则Ⅱ是Fe 2 O 3 作催化剂的曲线 whiteseal1年前1
whiteseal1年前1 -
 草上肥肥 共回答了16个问题
草上肥肥 共回答了16个问题 |采纳率100%(1)4FeS 2 (S)+11O 2 (g)=8SO 2 (g)+2Fe 2 O 3 (s) ,△H= -3412 kJ ·mol -1
(2)SO 2 + Na 2 CO 3 =Na 2 SO 3 +CO 2 ↑
2 SO 2 + Na 2 CO 3 +H 2 O=NaHSO 3 +CO 2 ↑ (写对任意一个均给分)
(3)Fe 3+ +3OH - = Fe(OH) 3 ↓或Fe 2+ +2OH - = Fe(OH) 2 ↓
或Mg 2+ +2OH - = Mg(OH) 2 ↓或HSO 3 - + OH - = SO 3 2 - + H 2 O
(4)加热蒸发、冷却结晶、过滤(洗涤干燥)
(5)AC
略1年前查看全部
- 亚硫酸钠经常被用在酸性溶液中做抗氧剂还释经常被用在碱性溶液中?
 HIV19721年前1
HIV19721年前1 -
 幻觉漂移 共回答了23个问题
幻觉漂移 共回答了23个问题 |采纳率91.3%用在碱性中
如果用在酸性中,亚硫酸根会和氢离子结合形成亚硫酸,马上分解成二氧化硫和水.1年前查看全部
- 1.抗氧化剂通常包括哪几类?(多选) A无机抗氧剂B金属钝化剂C有机抗氧剂D过氧化物终止剂
 kgvta1年前1
kgvta1年前1 -
 俺只是来看看 共回答了14个问题
俺只是来看看 共回答了14个问题 |采纳率71.4%A D C是正确答案1年前查看全部
- 抗氧剂、促进剂、防老剂属于化工或者化学的哪一类呢?最好具体一点,
 王家小伙1年前2
王家小伙1年前2 -
 freepass9999 共回答了10个问题
freepass9999 共回答了10个问题 |采纳率100%精细化工,或者环境化工都可以用到1年前查看全部
大家在问
- 1关于国名的英语单词有多少 如:China中国,Japan日本,German德国,America美国,Italy意大利,A
- 2那个兄弟姐妹知道 骑马坐命、一发如山.这句话怎么解释啊!
- 3短文填空:it is picture of a modem school.look at the
- 4太阳加月亮等于什么
- 52011年上海市徐汇区高三英语二模答案
- 6若安好,便是晴天 作文
- 7望江南的翻译
- 8You seem to be an actor ----
- 9下面各词的反义词是什么?inside.rarely.softly.uncle.boring.late.alwayspol
- 10原问题是:把7棵树排成6排,每排3棵。以下图是问题答案,可我看不出来第6排树在哪,请问这6排树该怎么数?
- 111至9的数字分四组,每组三个数,合为15怎么分
- 12单词four-day和four days有什么区别?
- 13玉米果常有缺粒的现象,这是由于什么引起的,为了避免这种现象的发生,农业上给植物
- 14让梦不再孤单(3) 作文
- 15100克柑橘含维C0.028克,与400克桃中所含维C数量相等,每100克桃中含维C多少克?

 2SO 3 (g)。研究发现,SO 3 的体积分数(SO 3 %) 随温度(T)的变化如曲线I所示。下列判断正确的是__________。
2SO 3 (g)。研究发现,SO 3 的体积分数(SO 3 %) 随温度(T)的变化如曲线I所示。下列判断正确的是__________。