氕氘氚 是否属于同种原子氕氘氚都是氢元素 是否属于同种原子 什么样的才算是同种原子 还有核素的概念怎么理解 举几个例子
 ycsqlc2022-10-04 11:39:543条回答
ycsqlc2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 hanshanweng04 共回答了17个问题
hanshanweng04 共回答了17个问题 |采纳率88.2%- 核素是指具有一定数目质子和一定数目中子的一种原子.例如,原子核里有6个质子和6个中子的碳原子,质量数是12,称为碳-12核素,或写成12C核素.原子核里有6个质子和7个中子的碳原子,质量数为13,称13C核素.氧元素有16O,17O,18O三种核素.
氕氘氚都是氢元素,但他们不是同种原子.他们互为同位素
同种元素取决于质子数是否一致,如12C,14C也是同种元素
同一种原子取决于质子数与中子数是否分别都相等,12C与14C质子数(原子序数)相同,但他们中子数一个是6另一个是8,不相等,所以不是同种原子
而1H,2H,3H同理因为质子数都是1,中子数分别为0,1,2,所以不是同种原子,只能说他们是同位素
补充:同位素是具有相同原子序数(即质子数相同,因而在元素周期表中的位置相同),但质量数不同,亦即中子数不同的一组核素. - 1年前
 逍遥哈哈 共回答了771个问题
逍遥哈哈 共回答了771个问题 |采纳率- 它们不是同一原子。
对于元素来说,区分不同元素的唯一方法就是核电荷数。
而对于原子的区分来说,则必须所有情况都相同 - 1年前
 秋千886 共回答了7个问题
秋千886 共回答了7个问题 |采纳率- 不同
各是不同的核素,但为同种元素
核素是指具有一定数目质子和一定数目中子的一种原子。
像碳十二和碳十四就是不同的核素,互为同位素。 - 1年前
相关推荐
- 氕氘氚,高一简单化学判断正误 理由1、氢气和氘气是氢元素的两种核素2、氢气、氘气互为同位素3、正一价氢离子、正一价氘离子
氕氘氚,高一简单化学
判断正误 理由
1、氢气和氘气是氢元素的两种核素
2、氢气、氘气互为同位素
3、正一价氢离子、正一价氘离子互为同位素
4、正一价氢离子、负一价氢离子、正一价氘离子属于同一种元素 plaispool1年前1
plaispool1年前1 -
 abruptme 共回答了19个问题
abruptme 共回答了19个问题 |采纳率84.2%1,错 核素是原子
2,错 同位素是原子
3,错,同位素是原子
4,对了 质子数都是1都是氢元素1年前查看全部
- 1.能不能说氕是氘的同位素?1.\x05能不能说氕是氘的同位素?我认为应该是护为同位素,要说也只能说氕氘氚是氢的同位素.
1.能不能说氕是氘的同位素?
1.x05能不能说氕是氘的同位素?
我认为应该是护为同位素,要说也只能说氕氘氚是氢的同位素.诸位认为呢?
2.25℃,ph=8的NaOH溶液和NH3H2O溶液中,由水电离出的c(OH-)不相等
为什么是错的.
酸碱抑制水的电离,盐类促进水的电离.是不是弱酸弱碱也是促进?
3,以NaCl为电解液,一极为Zn,一级为Cu,能否构成原电池?
答案是肯定的.可是nacl和zn和cu都不反应啊?反应方程式是什么?
4,将3molX和3molY充入恒温恒容的容器中,发生可逆反应X(s)+3Y(g)=Z(g)+2R(g),△H bhzqs1年前1
bhzqs1年前1 -
 393534167 共回答了18个问题
393534167 共回答了18个问题 |采纳率88.9%1、同位素就是在周期表中同一位置的元素,氕氘氚互为同位素.所以说氕是氘的同位素是可以的.
2、酸碱抑制水的电离,不管是强、弱碱,只要PH相等,水电离出的OH-就相等.
3、这样的原电池可以存在,有电压,但电流维持的时间极短.Zn为负极发生氧化,电子经导线流向Cu;Cu为正极接受电子转移给溶液中的H+,反映在一瞬间就停止了.
4、虽然充入Y使平衡往右移动,R增多了,但是充入Y也使气体总体积增加了,因而导致R的体积分数减少.
5、原电池中发生氧化反应的是负极,发生还原反应的是正极.所以负极是H2,正极是O2.1年前查看全部
- 有一副对联:“氕氘氚,弘天地正气;钾钙镁,铸英雄本色.”其中“氕、氘、氚”三种原子的质子数都是1,中子数分别为0、1、2
有一副对联:“氕氘氚,弘天地正气;钾钙镁,铸英雄本色.”其中“氕、氘、氚”三种原子的质子数都是1,中子数分别为0、1、2.则下列说法中错误的是( )
A.氕、氘、氚属于同种元素----氢元素
B.氕、氘、氚的相对原子质量相等
C.氕、氘、氚三种原子的核外电子数相同
D.氕、氘、氚的原子结构示意图均可用如图表示: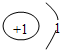
 马上要结婚了1年前1
马上要结婚了1年前1 -
 蟲蟲和小虫 共回答了11个问题
蟲蟲和小虫 共回答了11个问题 |采纳率81.8%解题思路:A、根据元素的概念分析;B、原子的相对原子质量=质子数+中子数;C、根据原子结构分析;D、根据原子结构示意图分析;A、“氕、氘、氚”三种原子的质子数都是1,所以属于同种元素--氢元素,故正确;
B、氕的相对原子质量=1+0=1、氘的相对原子质量=1+1=2、氚的相对原子质量=1+2=3,故错误;
C、由于在原子中质子数=核外电子数,所以氕、氘、氚三种原子的核外电子数都为1,故正确;
D、由于氕、氘、氚三种原子的质子数都为1,氕、氘、氚三种原子的核外电子数都为1,所以原子结构示意图均可用如图表示: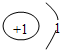 ,正确.
,正确.
故选:B点评:
本题考点: 元素的概念;原子结构示意图与离子结构示意图;原子的有关数量计算.
考点点评: 熟练掌握在原子中的两个等量关系:原子序数=质子数=核外电子数=核电荷数和相对原子质量=质子数+中子数,常是解决此类问题的关键.1年前查看全部
- 已知氢的同位素氕氘氚,和氧16 氧17 氧18 可以组成几种水分子?物质的质量是?
 liaochunbao1年前1
liaochunbao1年前1 -
 luludong3 共回答了13个问题
luludong3 共回答了13个问题 |采纳率92.3%18种1年前查看全部
- 工整的化学对联例如:氕氘氚,弘天地正气 钾钙镁,铸英雄本色
 snlove1年前2
snlove1年前2 -
 rchabc3 共回答了16个问题
rchabc3 共回答了16个问题 |采纳率87.5%碳氢氧,正生命起源
氦氖氩,显不动雄风1年前查看全部
- 氕氘氚怎么读知道这三个字是做什么用的,但是不知道怎么读,
 3FF21年前1
3FF21年前1 -
 jeans_j 共回答了23个问题
jeans_j 共回答了23个问题 |采纳率82.6%氕〈名〉piē
原子质量为1的普通的轻氢同位素
氕piē氢的同位素之一,符号H.质量数1.它是氢的主要成分.
氘 dāo
氢的同位素,其原子量为普通轻氢的二倍,少量的存在于天然水中,用于核反应,并在化学和生物学的研究工作中作示踪原子
氘dāo 1.氢的同位素之一.符号冈或D
氚〈名〉chuān
氢的放射性同位素,原子量为普通氢的三倍,半衰期12.5年,蜕变时放出β射线后形成质量数为三的氦.用中子轰击锂可产生氚
氚chuān氢的同位素之一,即"超重氢".符号T,质量数3.具有放射性.自然界中存在极微,从核反应制得.主要用于热核反应.1年前查看全部
- 谁能帮忙找找高考常考的特殊物质的摩尔质量和分子中的中子数 的归纳?例如氕氘氚、重水这样的.
 sem_ares1年前1
sem_ares1年前1 -
 cherry8898806 共回答了20个问题
cherry8898806 共回答了20个问题 |采纳率90%在原子序数较低时,通常稳定元素的中子数等于或近似等于质子数,摩尔质量可以近似认为等于质子数和中子数之和,氕氘氚都是氢的同位素,中子数分别为0、1、2,重水是氘与氧形成的水,中子数为10.1年前查看全部
- 同位素不是多了中子么,如氕氘氚,但是放射性不是阿尔法,贝塔,伽马射线么,和中子什么关系
 日月5211年前2
日月5211年前2 -
 arthome 共回答了16个问题
arthome 共回答了16个问题 |采纳率87.5%多了中子跟少了中子都叫做同位素.多了种子并不意味着就要对外辐射中子.而且同位素并不代表要具有放射性.
中子跟质子在原子核物理是属于同一类粒子的,假设进行了贝塔衰变,那么就会有一个中子放出一个电子然后转变为质子.阿尔法衰变跟贝塔衰变之后就都不是原来的元素了.
纠正楼上一小错误,伽马射线是原子核内放出的射线.阿尔法衰变和贝塔衰变都有可能会伴随着放出伽马射线1年前查看全部
- 同位素的问题有氕氘氚三种原子1.在标况下,他们的单质的密度比为?2.1mol各单质中,他们的质子数之比为?3.1g各单质
同位素的问题
有氕氘氚三种原子
1.在标况下,他们的单质的密度比为?
2.1mol各单质中,他们的质子数之比为?
3.1g各单质中他们的种子数之比为
4.在标况下,1L各单质中,他们的电子数之比为?
 jin123bo1年前1
jin123bo1年前1 -
 矜持笑笑生 共回答了16个问题
矜持笑笑生 共回答了16个问题 |采纳率93.8%1.单质密度之比1:2:3 密度=质量/体积 在标况下(三种同位素均为气体) 取同体积的三种同位素 质量只与它们的摩尔质量有关,也就是是他们的摩尔质量之比1:2:3。(标况下 气体质量=摩尔质量*22.4L/mol*体积)
2.质子数之比1:1:1 同种元素所有的同位素所含的质子数均相等。
3.1g单质中它们的中子数之比0:3:4 它们的相对原子质量分别为1,2,3。所以一g中他们分别有1mol,0.5mol,1/3mol 氕不含中子,氘含一个,氚含两个。中子之比为0:1/2:2/3=0:3:4
4.电子数之比为1:1:1 电子数之比等于质子数之比,标况下1mol气体体积为22.4L/mol。1L单质中它们所含的三种元素的物质的量相等。质子数相等。1年前查看全部
- NA 与NA+属于同一种() 铁原子核内含有26个质子和30个() 氕氘氚三种原子的()数相同,互为()
NA 与NA+属于同一种() 铁原子核内含有26个质子和30个() 氕氘氚三种原子的()数相同,互为()
A元素
B同位素
C分子
D原子
E离子
F质子
G中子
H电子 骑蚂蚁闯红灯1年前1
骑蚂蚁闯红灯1年前1 -
 simplewhite 共回答了22个问题
simplewhite 共回答了22个问题 |采纳率90.9%A G F B1年前查看全部
- 选修3-5原子核能量方程:1.E=hv怎么读啊.2.氕氘氚都是氢的什么结果啊,质量数什么的都是多少啊.3.原子核里面有个
选修3-5原子核
能量方程:
1.E=hv怎么读啊.
2.氕氘氚都是氢的什么结果啊,质量数什么的都是多少啊.
3.原子核里面有个质量单位是小写的u,和其他常用单位怎么换算的啊?
4.能级图为什么都是符号的啊, hans10001年前1
hans10001年前1 -
 深圳小tt 共回答了19个问题
深圳小tt 共回答了19个问题 |采纳率89.5%1、E,h不用说,v是希腊字母,读niu(四声),一般老师有念miu(四声)的.
2、它们三个都有一个质子,中子数分别是0,1,2.质量数分别是1,2,3.它们的关系是同位素.
3、英文字母u,表示为某个单位质量(约质子质量吧)的倍数,几个u就是几倍.换算关系都写在题里了.1u=1.660566*10^(-27)kg
4、能级分主能级和亚层,主要的能级就是层数,1,2,3,4,5,6,7
亚层电子区分为spdf四类,分别为该层电子的2,6,10,14个电子的统称.s轨道就是能量小的,只能容纳2个电子,p是能量高点的,容纳6个等等,字母前面的数字表示其主量子数(电子层数).周期表里省去了内层部分的电子排布.
还有不会的继续问1年前查看全部
- 氕氘氚的符号分别是什么
 天玄地黄1年前2
天玄地黄1年前2 -
 独身到底不妥协 共回答了27个问题
独身到底不妥协 共回答了27个问题 |采纳率85.2%氕、氘、氚是中子数不同的氢的名称.氕的原子由一个质子和一个电子组成,是氢的主要成分.氘为氢的一种稳定形态同位素,也被称为重氢,元素符号一般为D或2H.它的原子核由一颗质子和一颗中子组成.氚是元素氢的一种放射性同位素 ,符号简写为3H,氚还有其专用符号T.它的原子核由一颗质子和二颗中子组成.1年前查看全部
- 氕氘氚算几种原子?
 杀身成佛1年前6
杀身成佛1年前6 -
 rammaonly 共回答了21个问题
rammaonly 共回答了21个问题 |采纳率90.5%3种核素,也就是3种原子,同属于H这种元素.
核素是指具有一定数目质子和一定数目中子的一种原子.例如,原子核里有6个质子和6个中子的碳原子,质量数是12,称为碳-12核素,或写成12C核素.原子核里有6个质子和7个中子的碳原子,质量数为13,称13C核素.氧元素有16O,17O,18O三种核素.
氕氘氚都是氢元素,但他们不是同种原子.他们互为同位素
同种元素取决于质子数是否一致,如12C,14C也是同种元素
同一种原子取决于质子数与中子数是否分别都相等,12C与14C质子数(原子序数)相同,但他们中子数一个是6另一个是8,不相等,所以不是同种原子
而1H,2H,3H同理因为质子数都是1,中子数分别为0,1,2,所以不是同种原子,只能说他们是同位素
补充:同位素是具有相同原子序数(即质子数相同,因而在元素周期表中的位置相同),但质量数不同,亦即中子数不同的一组核素.1年前查看全部
- 同位素半径怎样比较?像氕氘氚 哪个半径大!WHY?
 6236169521年前1
6236169521年前1 -
 xzie 共回答了21个问题
xzie 共回答了21个问题 |采纳率90.5%同位素是一种元素存在着质子数相同而中子数不同的几种原子.由于质子数相同,所以它们的核电荷和核外电子数都是相同的(质子数=核电荷数=核外电子数),并具有相同电子层结构.
影响原子半径大小的是库仑力,所以同位素半径是一样的1年前查看全部
- 氕氘氚的相同处和不同处
 summ19811年前2
summ19811年前2 -
 rrSHOWTIME 共回答了21个问题
rrSHOWTIME 共回答了21个问题 |采纳率90.5%氕氘氚是氢元素的三种同位素,具有相同的质子数(1),不同的中子数(0、1、2),质量数也就不同(1、2、3),物理性质不同(放射性),但化学性质相同(最外层电子数相同).1年前查看全部
- 氕氘氚到底是不是同位素?有人说是同位素,因为质子数相同中子数不同有人说它们都是大自然中存在的三种形式,都为同样的氢元素.
 gggrdfggg1年前6
gggrdfggg1年前6 -
 gykoko 共回答了20个问题
gykoko 共回答了20个问题 |采纳率100%是的.质子数相同,中子数不同的具有一定质子数和一定中子数的原子互称为同位素.
氕有一个质子,没有中子,
氘有一个质子和一个中子,
氚有一个质子两个中子.
因为他们的质子数同为一,所以同属于氢元素.但因中子数不同,所以说,氢元素存在氕氘氚三种原子.1年前查看全部
- 电子层上的电子分布众所周知,电子层上的电子数与电子层的关系为2n的平方,还有,氢存在氕氘氚三种形式,氧存在16O和18O
电子层上的电子分布
众所周知,电子层上的电子数与电子层的关系为2n的平方,还有,氢存在氕氘氚三种形式,氧存在16O和18O,试求双氧水的分子种类和不同的相对分子质量 废铁时代1年前1
废铁时代1年前1 -
 liangdeyu 共回答了19个问题
liangdeyu 共回答了19个问题 |采纳率89.5%因为电子层每往外一层,电子亚层数就比前一层的多一个,每增加一个亚层,电子云的伸展方向就增加两个,由于每个伸展方向可以容纳两个自旋相反的电子.所以每个亚层比前一个亚层就多了四个电子,就可以推导出电子数与电子层的关系为2n^2.相对分子质量最大的是由两个氚和一个18O构成,为24 相对分子质量最大的是由两个氕和一个16O构成,为18 24和18之间有23、22、21、20、19,共有7种不同的相对分子质量.1年前查看全部
- 同位素的荷质比是否都一样?为什么?如果不是,氕氘氚的荷质比是否一样
 蟹行天下131年前3
蟹行天下131年前3 -
 不知所云也 共回答了8个问题
不知所云也 共回答了8个问题 |采纳率87.5%同种元素的同位素的荷质比,肯定不一样.
荷质比 = 核电荷数 ÷质量数
氕 = 1 /1 =1
氘 = 1/2
氚 = 1/3
不一样啊1年前查看全部
- 氕氘氚的气体单质是同一物质吗老师讲不是,有些参考书上说是
 _20231年前5
_20231年前5 -
 拯救亡灵 共回答了15个问题
拯救亡灵 共回答了15个问题 |采纳率93.3%氕:氢的同位素之一,符号(其中的“1”是左上标数字),质量数
为1,是氢的主要成分.
氘:氢的同位素之一,符号,质量数为2,用于热核反应.
氚: 氢的同位素之一, 符号,质量数为3,有放射性,应用于热核反应.1年前查看全部
- 是不是氕氘氚的相对原子质量不同?
 1d45308fba15503d1年前4
1d45308fba15503d1年前4 -
 thfghgh 共回答了15个问题
thfghgh 共回答了15个问题 |采纳率100%是.
质子数 中子数 相对原子质量
氕 1 0 1
氘 1 1 2
氚 1 2 31年前查看全部
- 有关氕氘氚氕氘氚和氢原子是什么关系(除同位素关系外)氢元素是包括了氕原子\氘原子\氚原子和氢原子么?(那为什么叫氢元素.
有关氕氘氚
氕氘氚和氢原子是什么关系(除同位素关系外)
氢元素是包括了氕原子氘原子氚原子和氢原子么?(那为什么叫氢元素.不叫氕元素之类的啊?)
那氢原子是包括氕原子氘原子氚原子的么?
老师说.原子的相对质量=中子数+质子数
氢原子是包括氕原子氘原子氚原子的话
那他们的中子数不同..那氢原子的相对质量是算哪个一个哦?
那个?什么是原子数?同位素的原子量乘上各自在自然界中的比例?是什么比例啊?氯原子中有半个中子吧?我初二刚接触到化学...不懂!
根据第三个人的回答..那是不是能这么理解呢?
氢原子是包括氕原子氘原子氚原子..我们说的氢原子其实只是三个的概括.一般情况下是指氕原子.对不? whucyw1年前1
whucyw1年前1 -
 raxxu 共回答了17个问题
raxxu 共回答了17个问题 |采纳率88.2%普通的氢原子就是氕,原子核只有一个质子
氘的原子核为一个质子一个中子
氚的原子核为一个质子两个中子
还有,一般我们所知道的元素中,不存在半个中子或者半个质子的情况
中子,原子都是有夸克组成的,夸克有6种
--------------------
通常所说的氢原子就是指原子相对质量=1(原子核只有一个质子的那个)的那个.
氘和氚在自然界中占的比重很小很小很小的,一般我们说的重水,重水水分子中的氢元素就是包含中子的氢元素.一般在初中甚至高中化学中都不涉及(高中偏重于有机化学,初中接触更多的是方程式配平、物质推理和计算题).
初中刚接触化学的话.先把基础知识学好了吧,同位素什么的可以作为课外读物理解.1年前查看全部
- 什么叫同位素?比如氢的同位素是氕氘氚,它的化学符号是什么?
 ameng06211年前3
ameng06211年前3 -
 雨凡888 共回答了16个问题
雨凡888 共回答了16个问题 |采纳率93.8%质子数相同,中子数不同的元素叫同位素.它们的元素符号都一样.
氕氘氚是特例,它们的符号分别是H、D、T.
(^-^)1年前查看全部
- 相同条件下相同质量的H3和H2分子的原子核的数目是否相同?是否要考虑氕氘氚的问题?
 feeada1年前1
feeada1年前1 -
 糖果年华 共回答了18个问题
糖果年华 共回答了18个问题 |采纳率88.9%不相同,要考虑氕氘氚的问题,因为他们三者的相对原子质量不相同,在相同质量下,氕氘氚的原子核的数目一次递增!1年前查看全部
- 下列属于同位素的一组是A H2O和D2O B Na2O和Na2O2 C 氕氘氚 D 40 K 40 Ca (40位于元素
下列属于同位素的一组是
A H2O和D2O
B Na2O和Na2O2
C 氕氘氚
D 40 K 40 Ca (40位于元素符号的左上方) 碳正离子1年前3
碳正离子1年前3 -
 小小的我呀 共回答了16个问题
小小的我呀 共回答了16个问题 |采纳率81.3%具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素.所以同位素应该元素,而不是物质,它质子数相同,只是中子数不同即质量数不同而已,所以选C1年前查看全部
- 为什么氕氘氚符号不同
 浪子51年前6
浪子51年前6 -
 折翼丘比特 共回答了17个问题
折翼丘比特 共回答了17个问题 |采纳率88.2%氕氘氚是氢的三中同位素,由于核外电子都为1所以化学性质相同,但原子核包含中子数不同,分别为0、1、2,为了做区分所以符号不同1年前查看全部
- 盐酸中的氢元素,其中氕氘氚三种原子的比例和自然中氢元素这三种原子...
盐酸中的氢元素,其中氕氘氚三种原子的比例和自然中氢元素这三种原子...
盐酸中的氢元素,其中氕氘氚三种原子的比例和自然中氢元素这三种原子的比例相同吗 gyy19751年前1
gyy19751年前1 -
 点燃记忆 共回答了24个问题
点燃记忆 共回答了24个问题 |采纳率87.5%氢有三种同位素:氕、氘、氚.氕的原子核只有一个质子,自然界所占百分比最多.
氘的原子核有1个质子和1个中子,比氕原子核重1倍.由於它比氕重1倍,
所以化学性质相差较大.氚原子核则有1个质子和2个中子,
所以质量约为氕原子核的3倍.氢是上述三种同位素的总称,是元素名称.1年前查看全部
- 氢的同位素氕氘氚的原子核分别以相同的速率和相等的动量值在匀强磁场中垂直磁场方向的平面内做匀速圆周运动,试分别确定它们的轨
氢的同位素氕氘氚的原子核分别以相同的速率和相等的动量值在匀强磁场中垂直磁场方向的平面内做匀速圆周运动,试分别确定它们的轨道半径之比R1:R2:R3和运动周期之比T:T2:T3
2:3 1:2:3
或1:1:1 1:2:3
是为什么呢? xczxwang1年前1
xczxwang1年前1 -
 极品苍狼 共回答了17个问题
极品苍狼 共回答了17个问题 |采纳率82.4%啊,我没看着还有个相等速率
相等动量时
R=mv/(B*q),所以R1:R2:R3=1:1:1
T=2*3.14*m/(q*B),所以T是1:2:3
相等速度时,带入上面的公式,OK1年前查看全部
- H 的同位素想问个关于H的同位素的问题H的同位素 氕氘氚 他们有什么区别?什么相同 什么不同?有种写发 H 2 1 ,2
H 的同位素
想问个关于H的同位素的问题
H的同位素 氕氘氚 他们有什么区别?
什么相同 什么不同?
有种写发 H 2 1 ,2 在H的右上方,1 在H的右下方,
他们具体代表的是什么意思?
氕 氘氚 要是按这样的写法 应该怎么写? baigaofei1年前2
baigaofei1年前2 -
 bless_for_me 共回答了17个问题
bless_for_me 共回答了17个问题 |采纳率88.2%氕氘氚,它们的中子数不同,质子数相同.
氕质子数是1,中子数是0,写成H11(两个1分别写在H的左上和左下)
氘质子数是1,中子数是1,写成H21(2在H左上,1在H左下)
氚质子数是1,中子数是2,写成H31(3在H左上,1在H左下)
写在符号左下方的叫质子数,左上方的叫质量数(质子数与中子数之和)1年前查看全部
- α粒子的质量数,质子数,中子数分别是多少以及其所带电荷量 还有氕氘氚的分别所带的电荷量以及他们的质量数,中子数,质子数
 燕燕hhy1年前3
燕燕hhy1年前3 -
 woainiyou 共回答了18个问题
woainiyou 共回答了18个问题 |采纳率83.3%质量数:4,质子数:2,中子数:2,带电量:2.1年前查看全部
- 氕氘氚属于氢元素吗?
 lamy06291年前1
lamy06291年前1 -
 将就九九 共回答了26个问题
将就九九 共回答了26个问题 |采纳率92.3%具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素.这里的原子是广义的概念,指微观粒子.氢有三种同位素,H氕、D氘(又叫重氢)、T氚(又叫超重氢)1年前查看全部
- 氕氘氚是不是同一种物质?还有能使高锰酸钾褪色的物质是不是都发生了氧化反应?
 男人VS海洋1年前3
男人VS海洋1年前3 -
 huanghyouy2004 共回答了20个问题
huanghyouy2004 共回答了20个问题 |采纳率85%H2、D2、T2,虽然是不同的分子,但它们是一种物质,都是氢气,混在一起是纯净物
同位素形成的不同分子,属于同一种物质.这是规定!
能使高锰酸钾褪色的物质,都被氧化,都发生了氧化反应.
因为Mn已经是最高价+7了,不可能再被氧化,只能是它氧化别的物质,自身被还原1年前查看全部
- 原子(比如说氢分氕氘氚三种原子)为什么都用元素符号H表示,
原子(比如说氢分氕氘氚三种原子)为什么都用元素符号H表示,
H2O中H为元素符号,难道由氕氘氚三种原子组成的不同水分子都满足H2O的化学方程式吗?
也就是说假设氕原子不满足H2O的化学方程式时,需要特殊标明了? holidaysun1年前3
holidaysun1年前3 -
 雨落梧桐听残荷 共回答了26个问题
雨落梧桐听残荷 共回答了26个问题 |采纳率73.1%他们是同位素.所谓的同位素,就是原子核中的质子数相同,而中子数不同.他们的化学性质完全相同.
补充的问题的答案是:不会不满足.1年前查看全部
- 对于氕氘氚的疑问氕氘氚是不是都是属于氢元素的不同原子?但是在初中时我们学过氢,既能表示元素又是原子,当它表示原子的时候又
对于氕氘氚的疑问
氕氘氚是不是都是属于氢元素的不同原子?
但是在初中时我们学过氢,既能表示元素又是原子,当它表示原子的时候又与氕氘氚是什么关系?
氕氘氚不是互为同位素吗?为什么说他们是氢的同位素呢?
为什么会凭空跑出来个氕氘氚呢= = quweichang1年前1
quweichang1年前1 -
 欢乐圣诞 共回答了19个问题
欢乐圣诞 共回答了19个问题 |采纳率94.7%简单的说就是三种中子数依次增加的氢原子,分别012个中子.互为同位素.都属于氢元素.平时说的氢原子就是氕.
氕氘氚统称氢原子.1年前查看全部
- 老师好,同素异形体定义是由相同元素组成,不同形态的单质.可是氕氘氚也是相同元素,为什么H2和D2不
老师好,同素异形体定义是由相同元素组成,不同形态的单质.可是氕氘氚也是相同元素,为什么H2和D2不
互为同素异形体呢 邓肯kk1年前1
邓肯kk1年前1 -
 yepeihua123 共回答了21个问题
yepeihua123 共回答了21个问题 |采纳率76.2%同素异形体,是同种元素在原子分子级别上构成物质的差别.
比如碳中的石墨和金刚石,氧中的氧气和臭氧,磷中的红磷和白磷.
同位素是核子级别的差别,并不会影响原子分子级别的差别
(当然D2和H2的理化性质还是有较明显的区别)
但是高中化学,就按定义来,H2和D2不是同素异形体.1年前查看全部
大家在问
- 1"元素相对原子质量是该元素的原子质量与12C原子质量1\12的比值"对吗?
- 2氕,氘,氚三种原子的_____数相同,互为______原子
- 3有什么官能团才能酯化 氧化 加成 还原
- 4活碱 是氢氧化钠吗
- 5DNA探针能检测到标本上的( )
- 6氢氧化钠是碱还是盐
- 7氕、氘、氚是同种原子吗rt
- 8为什么关于地球水的储量由大到小的排列是海洋水 河流水 地下淡水 而不是海洋水 冰川水 地下淡水
- 9地球的质量约是5.98×10的24次方kg,木星的质量约为1.9×10的27次方kg,
- 10地球表面大海和陆地的比率是多少
- 11与朱元思书、小石潭记和三峡的写景异同
- 12请慢走用英语怎么说
- 13一个平形四边形的面积是24平方厘米,它的底和高各是多少?(底和高都是整厘米数)用算式
- 14一个平行四边形的面积是24平方厘米,且它的低和高都是整厘米数,列表有几种情况(只写出底大于高的情况)
- 15The first teacher will never forget the days____he spent wit
