纸浆双氧水漂白问题在纸浆双氧水漂白工段,需要加入螯合剂(DTPA-5Na)和双氧水,那么螯合剂(DTPA-5Na)吨浆用
 豆子猫2022-10-04 11:39:542条回答
豆子猫2022-10-04 11:39:542条回答在纸浆双氧水漂白工段,需要加入螯合剂(DTPA-5Na)和双氧水,那么螯合剂(DTPA-5Na)吨浆用量是多少,双氧水(折算成100%H2O2)用量又是多少?现在纸浆厂在用的还有哪些螯合剂及其用量?这双氧水漂白工段,纸浆白度一般是从多少增加到多少?
双氧水是过氧化氢和纯水混合物的商品名称,国标中有27.5%、35%及50%三个品种,不知二楼兄台(zcmxiaori)所述双氧水是哪个规格,20-50kg用量100%过氧化氢不?谢谢zcmxiaori

已提交,审核后显示!提交回复
共2条回复
 保护zz鲟1 共回答了26个问题
保护zz鲟1 共回答了26个问题 |采纳率100%- 螯合剂DTPA用量在0.25%左右 如果一吨浆(按绝干算)那么需要2.5kg的螯合剂 双氧水用量在2%-5%左右 同样是1吨浆 那么用100%的双氧水的量就是20-50kg 现在用的螯合剂有DTPA还有EDTA,基本就这两个 可能还有别的 我没用过. 至于双氧水漂白的白度 我的原料是麻,白度从20多漂白到50.
过氧化氢这东西很难弄到纯的(也就是说100%的),至于具体含量多少也不好说,因为过氧化氢自己可以分解,就算是100%的过氧化氢,过一段时间也不会是这个浓度了,会分解的.所以一般来说过氧化氢再使用以前都要进行滴定,用标定的方法确定过氧化氢的具体浓度. 最开始的回答因为你问按100%的过氧化氢计算是多少,所以我就直接回答的.不知道我说明白了没.
还有如果是用20kg的过氧化氢,你滴定的过氧化氢浓度是30%,那么你加入的这个浓度的过氧化氢的实际的量就是20/30%=66.7kg - 1年前
 udbaps1234 共回答了1268个问题
udbaps1234 共回答了1268个问题 |采纳率- 二氧化氯纸浆漂白的特点
1、 二氧化氯氧化能力强,漂白效率高;易使尘埃点脱色;去除阔叶木浆中的树脂,效果好。
2、 选择地去除木素,漂白浆得率高,机械强度高,白度高且稳定性好。
3、 能去除浆中的铜、铁、锰等重金属离子,有利于后序漂白。
4、 具有防腐、杀菌作用,有效地降低抄造白水的粘度,能降低漂白废水的酸度、... - 1年前
相关推荐
- 请问用竹子造纸浆,需要用剥去竹皮-竹青(有腊)吗?机械法和化学法造纸都要吗,使用剥的还是用化学剂去掉.
 自己能有1年前1
自己能有1年前1 -
 mycasper 共回答了21个问题
mycasper 共回答了21个问题 |采纳率85.7%不需要,直接打浆就可以了.1年前查看全部
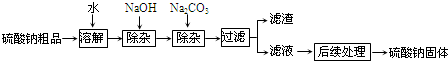
- 硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和MgCl2,实验室进行提纯的流程如下
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和MgCl2,实验室进行提纯的流程如下:

(1)操作a的名称是______,在实验室中进行此项操作时,若得到的溶液c仍然呈浑浊,其原因可能是______.(写一条)
(2)写出沉淀b的成分______ (填化学式).
(3)NaOH和Na2C03如果添加过量了,可加入适量的______(填化学式)溶液将其全部除去.
(4)若要用提纯后的硫酸钠固体来配制100g质量分数为10%的硫酸钠溶液,除了用到天平、药匙、烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是______,其作用是______. hongdou231年前1
hongdou231年前1 -
 xiedodo77 共回答了12个问题
xiedodo77 共回答了12个问题 |采纳率100%解题思路:本题给出了除去杂质应选用的试剂,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;
造成过滤失败的原因有多种,总结起来主要为滤纸作用失效、仪器不干净;
如果氢氧化钠和碳酸钠过量,可加入适量的稀硫酸,稀硫酸和氢氧化钠反应生成硫酸钠和水,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳;
注意溶解时玻璃棒的作用.(1)操作a的名称是过滤,在实验室中进行此项操作时,若过滤后的溶液仍然浑浊,可能的原因是倾倒液体时液面高于滤纸边缘,液体会不经过滤纸而使滤纸作用失效,过滤不净;或接受仪器不干净等;
(2)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;则沉淀b的成分Mg(OH)2、CaC03;
(3)如果氢氧化钠和碳酸钠过量,可加入适量的稀硫酸,稀硫酸和氢氧化钠反应生成硫酸钠和水,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳;
(4)若要用提纯后的硫酸钠固体来配制100g质量分数为10%的硫酸钠溶液,除了用到天平、药匙、烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是玻璃棒,其作用是搅拌,加速溶解.
故答案为:(1)过滤,滤纸破损.(2)Mg(OH)2、CaC03.
(3)H2SO4.(4)玻璃棒,搅拌,加速溶解点评:
本题考点: 盐的化学性质;一定溶质质量分数的溶液的配制;过滤的原理、方法及其应用.
考点点评: 掌握正确的过滤操作方法,理解操作注意事项,是解答此类问题的必备知识.1年前查看全部
- 硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl 2 和MgCl 2 ,实验室进行提纯的
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl 2 和MgCl 2 ,实验室进行提纯的流程如下: 
回答下列问题:
(1)用NaOH和Na 2 CO 3 除杂时,反应的化学方程式分别为
______、______.
(2)NaOH和Na 2 CO 3 如果添加过量了,可加入适量______溶液除去.
(3)“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至______(填序号).
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
(4)已知硫酸钠的溶解度随温度变化的曲线如图所示.
40℃时,100g蒸馏水中溶解______g硫酸钠达到饱和.将该饱和溶液升高温度至90℃,观察到的现象是______. 斯日古楞1年前1
斯日古楞1年前1 -
 风梦ff 共回答了16个问题
风梦ff 共回答了16个问题 |采纳率87.5%(1)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,故填:2NaOH+MgCl 2 ═Mg(OH) 2 ↓+2NaCl,
Na 2 CO 3 +CaCl 2 ═CaCO 3 ↓+2NaCl;
(2)硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,二氧化碳以气体形式逸出,不带入任何其它杂质,所以,除去过量的氢氧化钠和碳酸钠时,可以用稀硫酸,故填:H 2 SO 4 ;
(3)被加热的滤液中含有一定量的NaCl,故单纯的蒸发操作无法得到纯净的硫酸钠晶体,应该加热使大部分硫酸钠晶体析出,而此时溶液中主要为氯化钠,然后过滤除去滤液,从而的较纯净的硫酸钠晶体,故答案为:C;
(4)根据溶解度的定义以及溶解度受温度影响的关系可知.100克蒸馏水中溶解50克硫酸钠恰好饱和.根据硫酸钠的溶解的曲线可知,在0℃到40℃之间,硫酸钠的溶解度随温度的升高而增大,在40℃到90℃时,硫酸钠的溶解度随温度的升高而减小.饱和的硫酸钠溶液由40℃升高到90℃时,溶解能力下降,所以有硫酸钠固体析出.故填:50,有固体析出.1年前查看全部
- (2014•重庆二模)硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.实验室可
(2014•重庆二模)硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2.
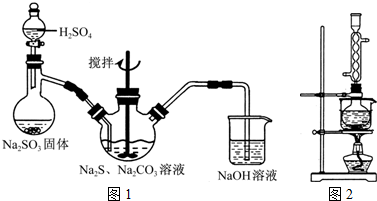
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是______.如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有______(填化学式)杂质生成.
(2)为测定所得保险粉样品中Na2S2O3•5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.
①利用KIO3、KI和HCl可配制标准碘溶液.写出配制时所发生反应的离子方程式:______.
②准确称取一定质量的Na2S2O3•5H2O样品于锥形瓶中,加水溶解,并滴加______作指示剂,用所配制的标准碘溶液滴定.滴定时所用的玻璃仪器除锥形瓶外,还有______.
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的质量分数的测量结果______(填“偏高”“偏低”或“不变”).
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待______时,停止加热,将烧瓶取下;
④______;
⑤______;
⑥将所得固体洗涤、干燥,得到Na2S•9H2O晶体. apimh1年前1
apimh1年前1 -
 关心生活 共回答了21个问题
关心生活 共回答了21个问题 |采纳率81%解题思路:(1)制备过程中需要制备二氧化硫进行反应生成硫代硫酸钠,二氧化硫是污染性气体不能排放空气中,需要用氢氧化钠溶液吸收;若换成盐酸除了反应生成硫代硫酸钠外还有氯化钠;
(2)①KIO3、KI和HCl可配制标准碘溶液,利用KIO3、KI在酸溶液中发生的氧化还原反应生成单质碘;
②用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点;碘溶液具有氧化性,应选用酸式滴定管;
③局部变色就停止滴定,消耗标准溶液少,测定结果偏低;
(3)③依据Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精,根据提纯硫化钠晶体的实验步骤和方法分析判断的;
④温度增大硫化钠在酒精中溶解度增大,热溶液过滤得到滤液;
⑤热的滤液冷却结晶过滤得到晶体.(1)装置中氢氧化钠是吸收尾气的主要作用,因为原料气二氧化硫是污染性气体不能排放到空气中,以防止污染空气;换做 盐酸进行反应产物中 除了硫代硫酸盐外还有氯化钠,
故答案为:吸收二氧化硫等尾气,防止污染空气;NaCl;
(2))①KIO3、KI和HCl可配制标准碘溶液,利用KIO3、KI在酸溶液中发生的氧化还原反应生成单质碘,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+=3I2+3H2O;
②用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点;碘溶液具有氧化性,应选用酸式滴定管,
故答案为:淀粉溶液;酸式滴定管;
③滴定时振荡不充分,刚看到溶液局部变色就停止滴定,消耗标准溶液体积减小,则会使样品中Na2S2O3•5H2O的质量分数的测量偏低;
故答案为:偏低;
(3)由提纯硫化钠的实验步骤和操作过程可知,
③依据Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精,根据提纯硫化钠晶体的实验步骤和方法可知,但烧瓶中固体不再减少,说明硫化钠全部溶解于酒精中,不溶的杂质沉淀过滤除去,故答案为:烧瓶中固体不再减少;
④温度增大硫化钠在酒精中溶解度增大,热溶液过滤得到滤液中主要是硫化钠的酒精溶液,故答案为:趁热过滤;
⑤热的滤液通过冷却、结晶、过滤得到晶体,故答案为:将所得滤液冷却结晶,过滤得到硫化钠结晶水合物.点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查了物质制备实验方案的设计和制备过程分析应用,主要是实验基本操作的应用,掌握基础,注意积累是解题关键,题目难度中等.1年前查看全部
- 造纸纸浆的来源是大树吗?岂不是要砍很多树?
造纸纸浆的来源是大树吗?岂不是要砍很多树?
看洁柔还有其他一些不错的卫生纸的外包装上介绍说,来源是原生木浆,那就是造纸要砍很多树的意思吗?那地球每年要砍很多树用于造纸(废纸再造不算),很不环保啊.如果不是,那又是怎样来的呢? dandan09201年前1
dandan09201年前1 -
 山间小鱼 共回答了16个问题
山间小鱼 共回答了16个问题 |采纳率93.8%呵呵
木浆只是造纸原料其一,还有草浆(麦秆、稻草)、竹浆、甘蔗渣浆,俺们广西多数用甘蔗渣浆,甘蔗榨糖后制浆再造纸,没有废物,非常环保1年前查看全部
- 化学与能源开发,环境保护、生产生活等密切相关。下列有关说法正确的是 A.二氧化硫可用于纸浆漂白,表明二氧化硫具有还原性
化学与能源开发,环境保护、生产生活等密切相关。下列有关说法正确的是
A.二氧化硫可用于纸浆漂白,表明二氧化硫具有还原性 B.煤经过气化和液化等物理变化可以转化为清洁燃料 C.明矾可用于净水是因为它能够消毒杀菌 D.静电除尘、血液透析均与胶体性质相关  石中玉20071年前1
石中玉20071年前1 -
 8145uu0 共回答了15个问题
8145uu0 共回答了15个问题 |采纳率93.3%D
1年前查看全部
- 活性炭纸浆吸附碘量法测定金实验步骤及器材!
 窦文涛51年前1
窦文涛51年前1 -
 起名字真是烦 共回答了20个问题
起名字真是烦 共回答了20个问题 |采纳率95%吸附柱:1cm纸浆,1cm活性炭纸浆.矿样经逆王水和洗王水溶解后经吸附柱抽滤,然后将滤饼在马弗炉内灰化.残渣加氯化钠溶液和1ml王水在水浴上蒸近干,加盐酸蒸近干,加5ml7%乙酸,取下冷却.0.2g氟化氢铵,1mlEDTA溶液,0.5g碘化钾,用硫代硫酸钠标准溶液滴定溶液的黄色变浅,加淀粉溶液,继续滴定至蓝色消失为终点.
具体的步骤如下:
1.方法提要
试样用王水分解,在稀王水介质中用活性炭富集金,活性炭灰化灼烧后用王水复溶,加HC1蒸干,在乙酸介质中以NH4HF2、 EDTA掩蔽少量的Fe、Cu等干扰元素,加人KI将Au3+还原为Au+,同时析出游离I2,以淀粉为指示剂,用硫代硫酸钠标准溶液滴定.本法适用于一般矿石中ω(Au)/10^-6>0.X的测定.
2.试剂配制
活性炭一纸浆:首先处理活性炭.将粒径为0.074mm的活性炭在20 g/L NH3HF2溶液中浸泡3 d,过滤,用HCl(2+98)及热水各洗涤7~8次.将处理后的活性炭与纸浆以干时的质量比按1+2混匀.
金标准溶液:称取0.0500 g纯金(99.99%以上)于100 mL瓷坩埚中,加10 mL王水,盖表面皿,在60~70℃水浴上加热溶解后立即加人8~10滴250 g/L NaCl溶液,再在沸水浴上加蒸干,取下,加1 mL HCl,继续在沸水浴上蒸干.取下加少量水,微热使盐类全溶,取下冷至室温,移人盛有5 mL HCl的500 mL容量瓶中,用水稀释至刻度,混匀.此溶液含100µg /mLAu.
硫代硫酸钠标准溶液:称取25.2g硫代硫酸钠(Na2S2O3·5H2O)溶于新煮沸后冷却的蒸馏水中,加0.lg Na2CO3,用水稀释至1L(溶液pH7.2~7.5),此溶液1 mL相当于10 mgAu.
分别取30 mL和100 mL上述溶液于 10L下口瓶内,各加人1g无水碳酸钠)3和10 mL氯仿,用冷却的新煮沸的蒸馏水稀释至10L,摇匀,放置一周后,进行标定:取5mL或10mL金标准溶液于50mL瓷坩埚中,加3~5滴250g/L NaCl溶液,加2~3 mL王水,水浴蒸干,加3~4滴HCl,蒸干,重复两次.然后用两种硫代硫酸钠标准溶液按碘量法滴定.求出其1 mL溶液相当金的质量(1 mL分别相当30µg和100µg)µg /mL.
3.分析步骤
称取10~30g(精确至0.01g)试样于瓷方舟中,在高温炉中于600℃灼烧40min,取出放冷,将试样转人400mL烧杯中,用少量水润湿,加l00mL王水(1+1),加热微沸30~60 min,中间摇至100~120 mL,将溶液注人连接在装有活性炭-纸浆吸附柱的布氏漏斗中,用热HCl(2十98)溶液洗涤活性炭3~4次,再用热HCl(2+98)洗3~4次,最后用温水洗3~4次,抽干.取出活性炭-纸浆吸附饼,移人50 mL瓷坩埚中.放在电炉盘上低温烘干,并升温炭化,再移人650~700℃高温炉内灼烧至无炭粒存在,取出冷却.在瓷坩埚内加人5滴250g/L NaCl溶掖,沿坩埚壁加人2~3 mL王水,放在沸水浴上蒸干,滴加3~5滴HCl,继续蒸干,重复两次,最后蒸至无酸味.取下坩埚,加3~5 mL乙酸(7十93),搅动使可溶性盐类全部溶解,冷至室温.加人0.1 g NH4HF2,搅匀.滴加数滴25g/L EDTA溶液后,立即加人0.5 g KI,用硫代硫酸钠标准溶液滴定至淡黄色,加人3~5滴10 g/L淀粉溶液,继续滴定至蓝色消失即为终点.
按下式计算试样中金的含量
Au(g/t)=V*T/m
式中 T —1 mL Na2S2O3标准溶液相当于金的质量,µg/mL;
V—滴定时消耗Na2S2O3标准溶液的体积,mL;
m——称取试样的质且,g.
注意事项:
1)试样的粒径应小于0.074mm,以保证试样的均匀性.
2)视试样性质不同,可用下列方法溶①含硫高的硫化矿.先用逆王水(1十1)溶解,每次加人10 mL,待激烈反应结束后,再加100~200 mL王水(1十1);②含硫低的矿样.一次加人100~120 mL王水(1+1);③氧化铁矿样.加50~60 mL HCl,煮沸,再加50~60 mL王水(1+1);④含炭质和有机物的矿样.经600~700℃灼烧除炭,然后按氧化矿样进行处理,或用HNO3-KC1O3氧化除炭.
3)活性炭用量应根据金的含量而定,一般金量在5 mg以下,活性炭用量为0.5~0.8 g;金盆在5~30 mg,其用量为1g左右;金量30~60 mg,活性炭用量则为1~1.5 g.
4)吸附柱安装:将吸附柱紧密装在抽滤筒的圆孔中,在吸{附柱内加人纸浆,开动真空泵,抽干压紧,纸浆约为4~5 mm厚,再加少许稀纸浆抽干,加人活性炭-纸浆混合物(绝对防止活性炭渗漏),上面复盖一层纸浆.装上布氏漏斗,铺上滤纸即可过滤.
5)活性炭一纸浆炭化的时候,切勿着火,以免金损失.
6) EDTA对AuCl3有还原作用,加人EDTA应立即加人KI,迅速滴定.1年前查看全部
- (2014•浙江模拟)亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生
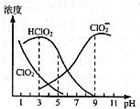 (2014•浙江模拟)亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析错误的是( )
(2014•浙江模拟)亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析错误的是( )
A.含氯消毒剂中的有效氯含量是指含氯消毒剂的氧化能力相当于多少氯的氧化能力,则亚氯酸钠的理论有效氯含量157%
B.使用该漂白剂的最佳pH为3
C.25℃时,HClO2的电离平衡常数的数值Ka=10-6
D.若浓度均为0.1mol•L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(OH-)-c(H+)>c(HClO2)-c(ClO2-) loser19861年前1
loser19861年前1 -
 av120 共回答了19个问题
av120 共回答了19个问题 |采纳率73.7%解题思路:A、根据消毒剂中的有效含氯量结合亚氯酸钠的性质、电子守恒知识来计算;
B、根据题意:HClO2和ClO2都具有漂白作用,结合图中HClO2和ClO2的浓度大小来确定使用该漂白剂的最佳pH;
C、HClO2的电离平衡常数K=
结合图示数据来计算;c(ClO−)•c(H+) c(HClO)
D、根据溶液中的电荷守恒,质子守恒以及物料守恒等来回答判断.A、消毒剂的消毒是基于物质的氧化性,1mol氯气得电子2mol,1mol亚氯酸钠得电子4mol,当转移电子的量相等时,氯气中氯原子和亚氯酸钠的量之比即为亚氯酸钠的理论有效氯含量,即[0.5×71/0.25×90.5]×100%=157%,故A正确;
B、HClO2和ClO2都具有漂白作用,结合图中HClO2和ClO2的浓度越大即为使用该漂白剂的最佳pH,应该是小于3,故B错误;
C、HClO2的电离平衡常数K=
c(ClO−)•c(H+)
c(HClO)=10-3×10-3=10-6,故C正确;
D、浓度均为0.1mol•L-1的HClO2溶液和NaClO2溶液等体积混合后所得溶液显酸性,c(H+)+c(Na+)=c(OH-)+c(ClO2-),c(ClO2-)+c(HClO2)=2c(Na+),
c(ClO2-)>c(Na+)>c(H+)>c(OH-),联立得:c(OH-)-c(H+)>c(HClO2)-c(ClO2-),故D正确.
故选B.点评:
本题考点: 氯气的化学性质.
考点点评: 本题考查了酸碱混合的定性判断,题目难度稍大,正确分析、理解题中信息及图象数据是解答本题关键,注意明确溶液酸碱性与溶液pH的关系.1年前查看全部
- 某纸厂用进口纸浆生产白纸,每捆1000张叠放在一起,是一个长320㎝
某纸厂用进口纸浆生产白纸,每捆1000张叠放在一起,是一个长320㎝
宽240cm,高20cm的长方体,如果装纸浆的桶是一个底面直径180cm,高180cm的圆柱体,且生产过程中有15%体积的纸浆损耗,每桶纸浆可生产白纸多少张?
(π取3.141)用一元一次方程解 samilau19861年前1
samilau19861年前1 -
 广西田野 共回答了18个问题
广西田野 共回答了18个问题 |采纳率83.3%桶的底面半径 180/2=90cm
设生产x个1000张
90² *3.141*180*(1-15%)=(320*240*20.)x
3892641.3=1536000x
x=3892641.3÷1536000≈2.5343
2.5243×1000=2534张1年前查看全部
- 硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料。某硫酸品粗品中含有少量CaCl 和Mg Cl ,实验室进行提纯的流程如
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料。某硫酸品粗品中含有少量CaCl
 和Mg Cl
和Mg Cl ,实验室进行提纯的流程如下:
,实验室进行提纯的流程如下:
回答下列问题:
小题1:用NaOH和Na CO
CO 除杂时,反应的化学方程式分别为
除杂时,反应的化学方程式分别为
小题2:NaOH和Na CO
CO 如果添加过量了,可加入适量溶液除去。
如果添加过量了,可加入适量溶液除去。
小题3:“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至(填序号)。
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
小题4:已知硫酸钠的溶解度随温度变化的曲线如下图所示。40℃时,100g蒸馏水中溶解 g硫酸钠达到饱和。将该饱和溶液升高温度到90℃,观察到的现象是
 19028421年前1
19028421年前1 -
 离婚二度 共回答了16个问题
离婚二度 共回答了16个问题 |采纳率81.3%小题1:2NaOH+MgCl 2 =M(OH) 2 ↓+ 2NaCl Na 2 CO 3 + CaCl 2 = CaCO 3 ↓+2NaCl
小题2:稀硫酸
小题3:C
小题4:有白色固体析出
硫酸钠粗产品加水溶解得到硫酸钠、氯化钙、氯化镁的溶液再加入氢氧化钠,氢氧化钠和氯化镁反应生成氢氧化镁的白色沉淀和氯化钠,再向溶液中加入碳酸钠,碳酸钠和氯化钙反应生成碳酸钙的白色沉淀和氯化钠在通过过滤出去氢氧化镁和碳酸钙得到滤液。滤液中有硫酸钠和氯化钠。如果氢氧化钠和碳酸钠过量可以加入稀硫酸反应生成硫酸钠。蒸发时应出现较多量固体时停止加热,利用余热蒸干。在40℃时硫酸钠的溶解度为50g 40℃~90℃时硫酸钠的溶解度随温度的升高而增大,因此温度升高硫酸钠的溶解度降低会有白色固体析出1年前查看全部
- 制浆造纸废水COD蒸煮时,纸浆得率48%,每吨浆耗水设为X,COD/(Kg/t浆)负荷:1330.将上面的COD换成废水
制浆造纸废水COD
蒸煮时,纸浆得率48%,每吨浆耗水设为X,COD/(Kg/t浆)负荷:1330.将上面的COD换成废水中的含量,单位:mg/立方米.最好给出计算过程, azhe19831年前1
azhe19831年前1 -
 刘馨忆 共回答了19个问题
刘馨忆 共回答了19个问题 |采纳率84.2%废水COD=1330*(1-48%)/(X*1000000)1年前查看全部
- 氯化钠是制造纸浆、染料稀释剂、医药品等的重要原料.某氯化钠粗品中含有少量CaCl2和MgCl2,实验室进行提纯的流程如下
氯化钠是制造纸浆、染料稀释剂、医药品等的重要原料.某氯化钠粗品中含有少量CaCl2和MgCl2,实验室进行提纯的流程如下:
回答下列问题:
(1)用NaOH和Na2CO3除杂时,反应的化学方程式分别为:______、______.
(2)NaOH和Na2CO3如果添加过量了,可加入适量______溶液除去.
(3)“后续处理”主要是为了获得纯净的氯化钠固体,其操作为______. 选择坎坷1年前1
选择坎坷1年前1 -
 水牛皮 共回答了20个问题
水牛皮 共回答了20个问题 |采纳率80%解题思路:(1)本题给出了除去杂质应选用的试剂,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠.
(2)如果氢氧化钠和碳酸钠过量,可加入适量的稀盐酸,稀盐酸和氢氧化钠反应生成氯化钠和水,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳.
(3)在此蒸发过程中,不同于常规的蒸发操作,溶液中含有NaCl,要注意先加热后过滤.(1)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;故填:2NaOH+MgCl2═Mg(OH)2↓+2NaCl;
Na2CO3+CaCl2═CaCO3↓+2NaCl;
(2)盐酸和氢氧化钠反应生成氯化钠和水,没有带入新杂质,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,二氧化碳以气体形式逸出,不带入任何其它杂质,所以,除去过量的氢氧化钠和碳酸钠时,可以用稀盐酸;故填:稀盐酸;
(3)被加热的滤液中含有一定量的NaCl,故单纯的蒸发操作无法得到纯净的氯化钠晶体,应该加热使大部分氯化钠晶体析出,而此时溶液中主要为氯化钠,然后过滤除去滤液,从而的较纯净的氯化钠晶体.故答案为:有大量固体析出时停止加热,过滤弃去剩余的少量溶液.点评:
本题考点: 氯化钠与粗盐提纯.
考点点评: 本题主要考查选择试剂、化学方程式的写法及蒸发操作,完成此题,可以依据物质的性质进行,书写反应的化学方程式要注意配平.1年前查看全部
- 硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaSO4和MgSO4,实验室进行提纯的流程如下
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaSO4和MgSO4,实验室进行提纯的流程如下:(提示:本题中微溶物质当可溶物质)

试回答下列问题:
(1)加入NaOH和Na2CO3时,反应的化学方程式分别为______,______.
(2)如果NaOH和Na2CO3添加过量了,可在过滤______(填前或后)加入适量______溶液.
(3)“后续处理”的主要操作是蒸发;蒸发时用玻璃棒不断搅拌,其作用是______,蒸发操作中应______时停止加热. cenliji81年前1
cenliji81年前1 -
 路灯冷了 共回答了18个问题
路灯冷了 共回答了18个问题 |采纳率94.4%解题思路:(1)根据本题给出的除去杂质选用的试剂,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,写出反应的化学方程式即可.(2)如果氢氧化钠和碳酸钠过量,可加入适量的稀硫酸,稀硫酸和氢氧化钠反应生成硫酸钠和水,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂的原则.(3)根据蒸发操作的原理、注意事项,解答在蒸发过程中玻璃棒的作用、停止加热的时机.(1)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,反应的化学方程式分别为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl,Na2CO3+CaCl2═CaCO3↓+2NaCl.
(2)稀硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质;碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳气体,没有带入任何其它杂质;符合除杂的原则,故除去过量的氢氧化钠和碳酸钠时,可在过滤后向滤液中滴加稀硫酸除去.
(3)①为使液体均匀受热,蒸发时用玻璃棒不断搅拌,以防止受热不均匀而使液体溅出;
②蒸发操作中应在有大量固体析出时停止加热,利用余热蒸干.
故答案为:(1)2NaOH+MgCl2═Mg(OH)2↓+2NaCl;Na2CO3+CaCl2═CaCO3↓+2NaCl;
(2)后;H2SO4;
(3)①使液体均匀受热;②有大量固体析出;点评:
本题考点: 物质除杂或净化的探究;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题综合性较强,主要考查了盐的化学性质、化学方程式的书写、蒸发操作等,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.1年前查看全部
- 硫代硫酸钠(Na2S2O3)别名大苏打、海波,可用作照相的定影剂,造纸工业纸浆漂白后的除氯剂,印染工业棉织品漂白后的脱氯
硫代硫酸钠(Na2S2O3)别名大苏打、海波,可用作照相的定影剂,造纸工业纸浆漂白后的除氯剂,印染工业棉织品漂白后的脱氯剂,医药上用作洗涤剂、消毒剂,食品工业用作螯合剂,抗氧化剂等.硫代硫酸钠中硫元素的化合价为( )
A.+1
B.+2
C.+4
D.+6 文wen文1年前1
文wen文1年前1 -
 文武双全123 共回答了16个问题
文武双全123 共回答了16个问题 |采纳率68.8%解题思路:根据化合价原则可以知道:在化合物中各元素的正负化合价的代数和为零,所以可以据此来求出硫代硫酸钠中硫元素的化合价.钠元素在形成化合物时的化合价为+1价,氧元素的化合价为-2价,则依据化合物中元素的正负化合价的代数和为零可以求出硫元素的化合价,
设硫元素的化合价为x
(+1)×2+x•2+(-2)×3=0
解得:x=+2
即硫代硫酸钠中硫元素的化合价为+2.
故选B.点评:
本题考点: 有关元素化合价的计算.
考点点评: 在求元素的化合价时要先定后变,即先标具有固定价态的元素的化合价,然后再根据化合价的原则来求出未知元素的化合价.1年前查看全部
- 硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和MgCl2,实验室进行提纯的流程如下
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和MgCl2,实验室进行提纯的流程如下:

回答下列问题:
(1)用NaOH和Na2CO3除杂时,反应的化学方程式分别为:______、______.
(2)NaOH和Na2CO3如果添加过量了,可加入适量______溶液除去.
(3)“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至______(填序号).
A.完全蒸干时停止加热 B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
(4)已知硫酸钠的溶解度随温度变化的曲线如右图所示.则40℃时,100g蒸馏水中溶解______g硫酸钠达到饱和.将该饱和溶液升高温度至90℃,观察到的现象是______. akang_qh1年前1
akang_qh1年前1 -
 zgxjhl 共回答了19个问题
zgxjhl 共回答了19个问题 |采纳率100%解题思路:(1)本题给出了除去杂质应选用的试剂,由复分解反应发生的条件写出化学方程式即可;
(2)如果氢氧化钠和碳酸钠过量,可加入适量的稀硫酸,稀硫酸和氢氧化钠反应生成硫酸钠和水,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳;
(3)在蒸发过程中,不同于常规的蒸发操作,溶液中含有NaCl,需注意先加热后过滤;
(4)因为40℃时,硫酸钠的溶解度是50克,故100克水中溶解50克硫酸钠恰好饱和;当由40℃升高到90℃时,硫酸钠的溶解度减小,故有硫酸钠固体析出.(1)由复分解反应发生的条件,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠.反应的化学方程式为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl; Na2CO3+CaCl2═CaCO3↓+2NaCl
(2)硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,二氧化碳以气体形式逸出,不带入任何其它杂质.故除去过量的氢氧化钠和碳酸钠时,可以用稀硫酸.
(3)被加热的滤液中含有一定量的NaCl,故蒸发操作无法得到纯净的硫酸钠晶体,应加热使大部分硫酸钠晶体析出,而此时溶液中的溶质主要为氯化钠,然后过滤除去滤液,从而的较纯净的硫酸钠晶体;
(4)根据溶解度的定义以及溶解度受温度影响的关系可知.100克蒸馏水中溶解50克硫酸钠恰好饱和.由硫酸钠的溶解的曲线可知,在0℃到40℃之间,硫酸钠的溶解度随温度的升高而增大,在40℃到90℃时,硫酸钠的溶解度随温度的升高而减小.饱和的硫酸钠溶液由40℃升高到90℃时,溶解度减小,故有硫酸钠固体析出.
故答案为:(1)2NaOH+MgCl2=Mg(OH)2↓+2NaCl;Na2CO3+CaCl2=CaCO3↓+2NaCl;
(2)H2SO4;
(3)C;
(4)50; 有固体析出.点评:
本题考点: 固体溶解度曲线及其作用;物质除杂或净化的探究;酸碱盐的溶解性.
考点点评: 主要考查了对固体溶解度的概念的理解和固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.1年前查看全部
- 硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.实验室可通过如下反应制取:2N
硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.
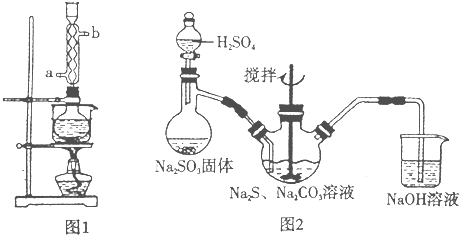
(1)本实验对Na2S的纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图1所示装配所需仪器,向冷凝管的______处(填a或b)通入冷却水,同时水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下;
④______;
⑤______;
⑥将所得固体洗涤、干燥,得到Na2S•9H2O晶体.
(2)用图2所示装置制取Na2S2O3,其中NaOH溶液的作用是______.如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有可能出现浑浊,写出该反应的化学方程式______.
(3)为测定所得保险粉样品中Na2S2O3•5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6.
①利用KIO3、KI和HCl可配制标准碘溶液.写出配制时所发生反应的离子方程式:______.
②准确称取一定质量的Na2S2O3•5H2O样品于锥形瓶中,加水溶解,并滴加______作指示剂,用所配制的标准碘溶液滴定.滴定时所用的玻璃仪器除锥形瓶外,还有______.
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的质量分数的测量结果______(填“偏高”“偏低”或“不变”). xmcxcoc1年前1
xmcxcoc1年前1 -
 caolingyun 共回答了18个问题
caolingyun 共回答了18个问题 |采纳率83.3%解题思路:(1)②为充分冷却,应使冷水充满冷凝管;
④温度增大硫化钠在酒精中溶解度增大,热溶液过滤得到滤液;
⑤热的滤液冷却结晶过滤得到晶体;
(2)制备过程中需要制备二氧化硫进行反应生成硫代硫酸钠,二氧化硫是污染性气体不能排放空气中,需要用氢氧化钠溶液吸收;若换成盐酸除了反应生成硫代硫酸钠外还有氯化钠;
(3)①KIO3、KI和HCl可配制标准碘溶液,利用KIO3、KI在酸溶液中发生的氧化还原反应生成单质碘;
②用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点;碘溶液具有氧化性,应选用酸式滴定管;
③刚看到溶液局部变色就停止滴定,可能还没有达到滴定终点.(1)②为充分冷却,应使冷水充满冷凝管,则应向冷凝管的a处通入水,故答案为:a;
④温度增大硫化钠在酒精中溶解度增大,热溶液过滤得到滤液中主要是硫化钠的酒精溶液,故答案为:趁热过滤;
⑤热的滤液通过冷却、结晶、过滤得到晶体,故答案为:冷却结晶,过滤;
(2)装置中氢氧化钠是吸收尾气的主要作用,因为原料气二氧化硫是污染性气体不能排放到空气中,以防止污染空气;换做盐酸进行反应产物中除了硫代硫酸盐外,在酸性条件下发生反应生成单质硫和氯化钠,反应的方程式为4HCl+2Na2S+SO2=4NaCl+3S↓+2H2O,
故答案为:吸收SO2等有害气体,防止污染空气;4HCl+2Na2S+SO2=4NaCl+3S↓+2H2O;
(3)①KIO3、KI和HCl可配制标准碘溶液,利用KIO3、KI在酸溶液中发生的氧化还原反应生成单质碘,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+=3I2+3H2O;
②用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇碘单质变蓝指示反应终点;碘溶液具有氧化性,应选用酸式滴定管,
故答案为:淀粉溶液;酸式滴定管;
③刚看到溶液局部变色就停止滴定,可能还没有达到滴定终点,消耗的碘少,则浓度偏低,故答案为:偏低.点评:
本题考点: 制备实验方案的设计;含硫物质的性质及综合应用.
考点点评: 本题考查了物质制备实验方案的设计和制备过程分析应用,主要是实验基本操作的应用,掌握基础,侧重于学生的分析能力、实验能力的考查,为高考常见题型和高频考点,注意把握物质的性质以及实验原理的探究,题目难度中等.1年前查看全部
- 硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和MgCl2,实验室进行提纯的流程如下
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和MgCl2,实验室进行提纯的流程如下:

(1)用Na2CO3除杂时,反应的化学方程式为______
(2)NaOH和Na2CO3如果添加过量了,可加入适量的______溶液除去
(3)“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至______(填序号)
A.完全蒸干时停止加热
B.有大量固体析出时停止加热,过滤,弃去剩余的少量溶液
C.快干时停止加热,利用余热蒸干
(4)已知硫酸钠的溶解度随温度变化的曲线如下所示.
在40℃时,当100g蒸馏水中溶解______g硫酸钠时,溶液恰好达到饱和.将该饱和溶液升高温度至90℃,观察到的现象是______. 女25征婚1年前1
女25征婚1年前1 -
 kongque83 共回答了15个问题
kongque83 共回答了15个问题 |采纳率86.7%解题思路:(1)本题给出了除去杂质应选用的试剂,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠.
(2)如果氢氧化钠和碳酸钠过量,可加入适量的稀硫酸,稀硫酸和氢氧化钠反应生成硫酸钠和水,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳.
(3)在此蒸发过程中,不同于常规的蒸发操作,溶液中含有NaCl,要注意先加热后过滤.
(4)因为40℃时,硫酸钠的溶解度是50克,根据溶解度的定义,100克水中溶解50克硫酸钠恰好饱和.当由40℃升高到90℃时,硫酸钠的溶解度减小,溶解能力下降,所以有硫酸钠固体析出.(1)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,故填:Na2CO3+CaCl2═CaCO3↓+2NaCl;(2)硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,二氧化碳以气体形式...
点评:
本题考点: 盐的化学性质;固体溶解度曲线及其作用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查选择试剂、化学方程式的写法及蒸发操作,完成此题,可以依据物质的性质进行,书写反应的化学方程式要注意配平.1年前查看全部
- 硫酸钠是制造纸浆,染料稀释剂硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和MgCl
硫酸钠是制造纸浆,染料稀释剂
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和MgCl2,实验室进行提纯的流程如下:
=
太长而且有图不好排版啊
请教第三题,蒸发溶解度变大 为什么还有析出硫酸钠? ljlll1年前1
ljlll1年前1 -
 爱要越做越勇 共回答了14个问题
爱要越做越勇 共回答了14个问题 |采纳率92.9%蒸发时温度升高,硫酸钠溶解度变大,但蒸发时溶剂水会因挥发而减少,溶质硫酸钠自然就会析出了.1年前查看全部
- 硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaSO4和MgSO4,实验室进行提纯的流程如下
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaSO4和MgSO4,实验室进行提纯的流程如下(每一种试剂只除去一种杂质):
回答下列问题:
(1)试剂X是______,试剂Y是______;用X和Y除杂时,反应的化学方程式分别为______、______.
(2)试剂X和试剂Y应该______(填“适量”或“过量”),理由是______.
 都是假的和1年前1
都是假的和1年前1 -
 我是小kk2 共回答了14个问题
我是小kk2 共回答了14个问题 |采纳率92.9%解题思路:(1)根据氢氧化钠和硫酸镁反应生成氢氧化镁沉淀和硫酸钠,碳酸钠和硫酸钙反应生成碳酸钙沉淀和硫酸钠,写出反应的化学方程式即可;
(2)根据氢氧化钠和碳酸钠过量可以使硫酸钠粗品中含有少量CaSO4和MgSO4全部反应进行解答.(1)氢氧化钠和硫酸镁反应生成氢氧化镁沉淀和硫酸钠,碳酸钠和硫酸钙反应生成碳酸钙沉淀和硫酸钠,所以试剂X是氢氧化钠溶液,试剂Y是碳酸钠溶液,反应的化学方程式分别为:2NaOH+MgSO4═Mg(OH)2↓+Na2SO4,Na2CO3+CaSO4═CaCO3↓+Na2SO4;故答案为:氢氧化钠溶液;碳酸钠溶液;2NaOH+MgSO4═Mg(OH)2↓+Na2SO4;Na2CO3+CaSO4═CaCO3↓+Na2SO4;
(2)氢氧化钠和碳酸钠过量可以使硫酸钠粗品中的CaSO4和MgSO4全部反应,而氢氧化钠和碳酸钠过量,可加入适量的稀硫酸,稀硫酸和氢氧化钠反应生成硫酸钠和水,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂的原则.
故答案为:过量;使硫酸钠粗品中的CaSO4和MgSO4全部反应.点评:
本题考点: 混合物的分离方法;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要涉及选择试剂、化学方程式的写法,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.1年前查看全部
- 大型造纸厂一般采用什么方法来造浆? 新闻纸的主要原料是什么? 纸浆的主要成分是什么?
大型造纸厂一般采用什么方法来造浆? 新闻纸的主要原料是什么? 纸浆的主要成分是什么?
大型造纸厂一般采用什么方法来造浆?
新闻纸的主要原料是什么?
纸浆的主要成分是什么?
印刷纸中,平滑度要求最高的是什么纸?
 杰杰的小幸福1年前1
杰杰的小幸福1年前1 -
 依捏粑粑 共回答了18个问题
依捏粑粑 共回答了18个问题 |采纳率88.9%大型造纸厂都有自己的木浆线,用树木来造纸,有化学浆、化机浆等.
新闻纸的主要原料为木浆、旧新闻纸、旧杂质纸等.
纸浆的主要成本为植物纤维或再生纤维.
印刷纸中,对平滑度的要求都很高,向铜版纸、复印纸等.1年前查看全部
- 现今纸板生产商最常用的纸浆漂白是什么方法?所使用的漂白剂主要成分是什么?
 不动产世界1年前1
不动产世界1年前1 -
 tidecome 共回答了18个问题
tidecome 共回答了18个问题 |采纳率94.4%ecf(无元素氯漂白,俗话说的Clo2漂白)和 tcf(全无氯漂白,俗话称双氧水漂白)1年前查看全部
- 硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaSO 4 和MgSO 4 ,实验室进行提纯的
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaSO 4 和MgSO 4 ,实验室进行提纯的流程如下:(提示:本题中微溶物质当可溶物质)试回答下列问题 

(1)用NaOH和Na 2 CO 3 除杂时,反应的化学方程式分别为 _________ 、 _________ .
(2)如果NaOH和Na 2 CO 3 添加过量了,可在过滤 _________ (填前或后)加入适量 ________ 溶液除去.
(3)“后续处理”的主要操作是蒸发①蒸发时用玻璃棒不断搅拌,其作用是 _________ _,②蒸发操作中应 _________
( 4)已知硫酸钠的溶解度随温度变化的曲线如上图所示.40℃时,50g蒸馏水中溶解 _________ g硫酸钠达到饱和.将该饱和溶液升高温度至80℃,观察到的现象是 _________ . hanxiao200601年前1
hanxiao200601年前1 -
 bonami_jyd 共回答了23个问题
bonami_jyd 共回答了23个问题 |采纳率91.3%(1)2NaOH+MgCl 2 =Mg(OH) 2 ↓+2NaCl;Na 2 CO 3 +CaCl 2 =CaCO 3 ↓+2NaCl;
(2)后;H 2 SO 4 ;
(3)①使液体均匀受热;②有大量固体析出;
(4)25;有固体析出.1年前查看全部
- 造纸的生产工艺是怎样的?纸浆的区别?
造纸的生产工艺是怎样的?纸浆的区别?
我们在生活中所用的手帕纸和卷纸,标签上总有100%原生木浆或100%原生浆,请问这两种有何差别优劣? 神19841年前1
神19841年前1 -
 ffd010 共回答了21个问题
ffd010 共回答了21个问题 |采纳率100%造纸的工艺流程由如下几个主要环节组成:制浆段:原料选择→蒸煮分离纤维→洗涤→漂白→洗涤筛选→浓缩或抄成浆片→储存备用抄纸段:散浆→除杂质→精浆→打浆→配制各种添加剂→纸料的混合→纸料的流送→头箱→网部→压榨部→干燥部→表面施胶→干燥→压光→卷取成纸涂布段:涂布原纸→涂布机涂布→干燥→卷取→再卷→超级压光加工段:复卷→裁切平板(或卷筒)→分选包装→入库结束 俩者的区别浆料因其来源不同可分为木浆、草浆、蔗浆、棉浆、回收废纸浆等,木浆是指由木片蒸煮萃取纤维制成的纸浆;原生浆是指纯净的原生纤维,有别于回收废纸浆.唯洁雅、清风系列 生活用纸 是以100%原生木浆 为原料,以先进工艺加工而成.1年前查看全部
- 造纸为什么放淀粉?以旧报纸或用过的的纸造再生纸,做纸浆时放入淀粉,淀粉在其中起 作用
 一生走拉拉路1年前1
一生走拉拉路1年前1 -
 gc56 共回答了16个问题
gc56 共回答了16个问题 |采纳率100%不是所有的造纸都放淀粉,如表面施胶时就用淀粉,淀粉作为一种填料,有提高纸的强度和柔性,提高纸的重量,增加施胶效果.1年前查看全部
- (2014•海安县模拟)硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和
(2014•海安县模拟)硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和
MgCl2,实验室进行提纯的流程如图所示:回答下列问题:
①溶解过程需要的玻璃仪器有烧杯和玻璃棒玻璃棒.
②用NaOH除杂时,反应的化学方程式为2NaOH+MgCl2═Mg(OH)2↓+2NaCl2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
③NaOH和Na2CO3如果添加过量了,可加入适量稀硫酸稀硫酸溶液除去.
④“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至BB(填序号).
A.完全蒸干时停止加热B.有较多固体析出时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液. 水磨涧1年前1
水磨涧1年前1 -
 淡莣 共回答了18个问题
淡莣 共回答了18个问题 |采纳率83.3%①溶解过程需要的玻璃仪器有烧杯和玻璃棒,玻璃棒用于溶解时的搅拌.
②氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式分别为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
③稀硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质;碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳气体,没有带入任何其它杂质;符合除杂的原则,故NaOH和Na2CO3如果添加过量了,可在过滤后向滤液中滴加稀硫酸除去.
④故为了获得纯净的硫酸钠,蒸发操作中应在有大量固体析出时停止加热,利用余热蒸干,得到纯净的硫酸钠.
故答案为:①玻璃棒;②2NaOH+MgCl2═Mg(OH)2↓+2NaCl;③稀硫酸;④B.1年前查看全部
- (2014•海安县模拟)硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和
(2014•海安县模拟)硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和
MgCl2,实验室进行提纯的流程如图所示:回答下列问题:
①溶解过程需要的玻璃仪器有烧杯和______.
②用NaOH除杂时,反应的化学方程式为______.
③NaOH和Na2CO3如果添加过量了,可加入适量______溶液除去.
④“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至______(填序号).
A.完全蒸干时停止加热B.有较多固体析出时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液. 非螃蟹1年前1
非螃蟹1年前1 -
 可乐泡泡鱼 共回答了17个问题
可乐泡泡鱼 共回答了17个问题 |采纳率82.4%解题思路:①根据溶解操作所需的仪器进行分析解答.
②根据本题给出的除去杂质选用的试剂,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,写出反应的化学方程式即可.
③如果氢氧化钠和碳酸钠过量,可加入适量的稀硫酸,稀硫酸和氢氧化钠反应生成硫酸钠和水,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂的原则.
④根据蒸发操作的原理,蒸发过程中停止加热的时机,进行分析解答即可.①溶解过程需要的玻璃仪器有烧杯和玻璃棒,玻璃棒用于溶解时的搅拌.
②氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式分别为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
③稀硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质;碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳气体,没有带入任何其它杂质;符合除杂的原则,故NaOH和Na2CO3如果添加过量了,可在过滤后向滤液中滴加稀硫酸除去.
④故为了获得纯净的硫酸钠,蒸发操作中应在有大量固体析出时停止加热,利用余热蒸干,得到纯净的硫酸钠.
故答案为:①玻璃棒;②2NaOH+MgCl2═Mg(OH)2↓+2NaCl;③稀硫酸;④B.点评:
本题考点: 物质除杂或净化的探究;物质的溶解;蒸发与蒸馏操作;盐的化学性质.
考点点评: 本题综合性较强,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质),掌握盐的化学性质、化学方程式的书写、蒸发操作等是正确解答本题的关键.1年前查看全部
- 造纸行业中.纸浆含有很多碳酸钙.如何除去碳酸钙.或则使它溶解?
 liteng20061年前4
liteng20061年前4 -
 等人爱的宝宝 共回答了18个问题
等人爱的宝宝 共回答了18个问题 |采纳率88.9%基本没有办法,最好的办法是使用锥形除砂器,但很难全部除去,而且能耗很高!不能使用盐酸,否则,浆料将产生大量的泡沫,很难回用!同时,也会产生大量的钙离子,干扰生产!1年前查看全部
- (14分)硫代硫酸钠(Na 2 S 2 O 3 )俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可
(14分)硫代硫酸钠(Na 2 S 2 O 3 )俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可通过如下反应制取:2Na 2 S+Na 2 CO 3 +4SO 2 =3Na 2 S 2 O 3 +CO 2 。

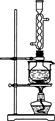
图1图2
(1)用图1所示装置制取Na 2 S 2 O 3 ,其中NaOH溶液的作用是_____________________。
如将分液漏斗中的H 2 SO 4 改成浓盐酸,则三颈烧瓶内除Na 2 S 2 O 3 生成外,还有
(填化学式)杂质生成。
(2)为测定所得保险粉样品中Na 2 S 2 O 3 ·5H 2 O的质量分数,可用标准碘溶液进行滴定,
该反应的化学方程式为:2Na 2 S 2 O 3 +I 2 = 2NaI+Na 2 S 4 O 6
①利用KIO 3 、KI和HCl作原料可配制标准碘溶液。写出配制时所发生反应的离子方程式 。
②准确称取一定质量的Na 2 S 2 O 3 ·5H 2 O样品于锥形瓶中,加水溶解,并滴加______作指示剂,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有 。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na 2 S 2 O 3 ·5H 2 O的质量分数的测量结果___________(填“偏高”“偏低”或“不变”)。
(3)本实验对Na 2 S的纯度要求较高,利用图2所示的装置可将工业级的Na 2 S提纯。已知Na 2 S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。
提纯步骤依次为:
①将已称量好的工业级Na 2 S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待 时,停止加热,将烧瓶取下;
④ __________________________;
⑤ __________________________;
⑥将所得固体洗涤、干燥,即可得到Na 2 S·9H 2 O晶体。 奘淼潇潇1年前1
奘淼潇潇1年前1 -
 云中羽衣孑 共回答了12个问题
云中羽衣孑 共回答了12个问题 |采纳率100%(14分)(1)吸收二氧化硫等尾气,防止污染空气 (2分) NaCl(2分)
(2)①IO 3 - +5I - +6 H + =3I 2 + 3H 2 O(2分)
②淀粉溶液 (2分) 酸式滴定管(2分)
③偏低(1分)
(3)③烧瓶中固体不再减少(1分)
④趁热过滤(1分)
⑤将所得滤液冷却结晶,过滤(1分)
1年前查看全部
- 硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量的氯化钙、氯化镁,实验室进行提纯的流程如下: (
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量的氯化钙、氯化镁,实验室进行提纯的流程如下: 
(1)滤渣中两种主要成分的化学式为 _________ 、 _________ .
(2)NaOH和Na 2 CO 3 如果添加过量了,可加入适量_________.
(3)“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至_________(选填字母).
A、完全蒸干时停止加热
B、快干时停止加热,利用余热蒸干
C、有大量固体析出时停止加热,过滤弃去剩余的少量溶液(4)已知硫酸钠的溶解度随温度变化的曲线如下图所示.40℃时,硫酸钠的饱和溶液中溶质质量分数为 _________ (结果精确到0.1%),将该饱和溶液升高温度至90℃,观察到的现象是 _________ . 
 joinus801年前1
joinus801年前1 -
 镰刀Z爷爷 共回答了22个问题
镰刀Z爷爷 共回答了22个问题 |采纳率81.8%(1)CaCO 3 ,Mg(OH) 2 ;
(2)硫酸;
(3)B;
(4)33.3%,析出晶体.1年前查看全部
- (2014•海安县模拟)硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和
(2014•海安县模拟)硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和
MgCl2,实验室进行提纯的流程如图所示:回答下列问题:
①溶解过程需要的玻璃仪器有烧杯和玻璃棒玻璃棒.
②用NaOH除杂时,反应的化学方程式为2NaOH+MgCl2═Mg(OH)2↓+2NaCl2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
③NaOH和Na2CO3如果添加过量了,可加入适量稀硫酸稀硫酸溶液除去.
④“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至BB(填序号).
A.完全蒸干时停止加热B.有较多固体析出时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液. 风_ascb1年前1
风_ascb1年前1 -
 装鬼黑人 共回答了16个问题
装鬼黑人 共回答了16个问题 |采纳率81.3%①溶解过程需要的玻璃仪器有烧杯和玻璃棒,玻璃棒用于溶解时的搅拌.
②氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式分别为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
③稀硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质;碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳气体,没有带入任何其它杂质;符合除杂的原则,故NaOH和Na2CO3如果添加过量了,可在过滤后向滤液中滴加稀硫酸除去.
④故为了获得纯净的硫酸钠,蒸发操作中应在有大量固体析出时停止加热,利用余热蒸干,得到纯净的硫酸钠.
故答案为:①玻璃棒;②2NaOH+MgCl2═Mg(OH)2↓+2NaCl;③稀硫酸;④B.1年前查看全部
- 硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量的氯化钙、氯化镁,实验室进行提纯的流程如下:
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量的氯化钙、氯化镁,实验室进行提纯的流程如下:
先用NaOH再Na2CO3能否换顺序

 云麓子随1年前1
云麓子随1年前1 -
 知己知彼1 共回答了11个问题
知己知彼1 共回答了11个问题 |采纳率81.8%:(1)氢氧化钠和氯化镁、碳酸钠和氯化钙反应的化学方程式为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl,Na2CO3+CaCl2═CaCO3↓+2NaCl;
(2)硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,二氧化碳以气体形式逸出,不带入任何其它杂质.所以,除去过量的氢氧化钠和碳酸钠时,可以在过滤后向滤液中滴加稀硫酸除去.
(3)①为使液体均匀受热,蒸发时用玻璃棒不断搅拌,以防止受热不均匀而使液体溅出;
②蒸发操作中应在有大量固体析出时停止加热,利用余热蒸干.
(4)根据溶解度的定义以及溶解度受温度影响的关系可知.100克蒸馏水中溶解50克硫酸钠恰好饱和,50g水最多可溶解25g硫酸钠; 根据硫酸钠的溶解的曲线可知,在0℃到40℃之间,硫酸钠的溶解度随温度的升高而增大,在40℃到90℃时,硫酸钠的溶解度随温度的升高而减小.饱和的硫酸钠溶液由40℃升高到80℃时,溶解能力下降,所以有硫酸钠固体析出.
故答案为:
(1)2NaOH+MgCl2═Mg(OH)2↓+2NaCl;Na2CO3+CaCl2═CaCO3↓+2NaCl;
(2)后;H2SO4;
(3)①使液体均匀受热;②有大量固体析出;
(4)25;有固体析出.1年前查看全部
- 为什么用臭氧漂白纸浆?有什么化学道理?
 笑奈儿1年前4
笑奈儿1年前4 -
 lovefuai 共回答了18个问题
lovefuai 共回答了18个问题 |采纳率88.9%臭氧具有强的氧化性(永久性),能够将一些有色物质氧化成白色物质,如氯气,次氯酸一样,不过氯气过些时间久会恢复了!1年前查看全部
- (2014•沐川县二模)纸浆,经过漂白,送入造纸机得到洁白的纸张.
(2014•沐川县二模)纸浆,经过漂白,送入造纸机得到洁白的纸张.
(1)将浓硫酸滴到一小块白纸上,白纸炭化变黑,这是因为浓硫酸具有______.
(2)ClO2是生产饮用水的新一代消毒剂,也可用于纸浆等的漂白.制取ClO2的反应过程示意图如下:
ClO2的名称为______,该化学反应的基本类型是(填编号)______.
A.置换反应B.复分解反应C.分解反应D.以上都不是
(3)硫代硫酸钠(Na2S2O3),可用作造纸工业漂白后的除氯剂.Na2S2O3中硫元素的化合价为______. ppaop8201年前1
ppaop8201年前1 -
 dengyong18 共回答了14个问题
dengyong18 共回答了14个问题 |采纳率85.7%解题思路:(1)根据浓硫酸具有脱水性和腐蚀性解答;
(2)根据化合物的命名和化学反应的基本类型判断;
(3)根据化合价规则计算.(1)浓硫酸具有脱水性和腐蚀性,所以白纸炭化变黑,故答案:腐蚀性(或脱水性);
(2)ClO2名称是二氧化氯;该反应生成一种单质和一种化合物反应生成两种化合物,所以该反应不是置换反应,也不是复分解反应,也不是分解反应,故答案:二氧化氯;D;
(3)设Na2S2O3中硫元素的化合价为x,(+1)×2+2x+(-2)×3=0,x=+2,故答案:+2.点评:
本题考点: 浓硫酸的性质及浓硫酸的稀释;微粒观点及模型图的应用;化学式的书写及意义;有关元素化合价的计算;反应类型的判定.
考点点评: 浓硫酸的性质主要是指无色、黏稠、油状液体,不挥发,但有酸性、吸水性、脱水性和腐蚀性(或强氧化性),它易溶于水,能以任意比与水混溶,溶于水放热等等.1年前查看全部
- 1立方米干纸浆一般有多少吨?急
 糊涂缘分1年前1
糊涂缘分1年前1 -
 latterdays 共回答了20个问题
latterdays 共回答了20个问题 |采纳率95%立方米是体积单位
吨是质量单位
质量=体积*密度
比如水的密度是1000千克/立方米
那么1立方米水的质量=1*1000=1000千克即1吨
你的干纸浆密度多少1年前查看全部
- (高一化学选择题)造纸工业中常用氯气漂白纸浆,漂白后的纸浆用NaHSO3除去残留的氯气,其反应为:
(高一化学选择题)造纸工业中常用氯气漂白纸浆,漂白后的纸浆用NaHSO3除去残留的氯气,其反应为:
[
Cl2+NaHSO3+H2O=NaCl+H2SO4+HCl,在这个反应中,氧化产物与还原产物的物质的量之比为:A.2:3 B.3:1 C.2:1 D1:2(请说明为什么,
我觉得此反应中cl2即作为还原剂又作为氧化剂,氧化产物应该是硫酸和盐酸啊. 2806951791年前1
2806951791年前1 -
 柳御寒 共回答了13个问题
柳御寒 共回答了13个问题 |采纳率84.6%选D,Cl2 作为氧化剂,得到2molCl-(还原产物),(氧化产物)1molSO4 2-.1年前查看全部
- 硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和MgCl2,实验室进行提纯的流程如下
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量CaCl2和MgCl2,实验室进行提纯的流程如下:
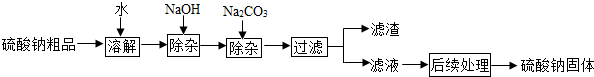
回答下列问题:
(1)用NaOH和Na2CO3除杂时,反应的化学方程式分别为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl2NaOH+MgCl2=Mg(OH)2↓+2NaCl、Na2CO3+CaCl2=CaCO3↓+2NaClNa2CO3+CaCl2=CaCO3↓+2NaCl.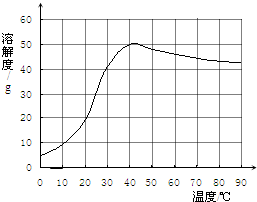
(2)NaOH和Na2CO3如果添加过量了,可加入适量H2SO4H2SO4溶液除去.
(3)“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至CC(填序号).
A.完全蒸干时停止加热 B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
(4)已知硫酸钠的溶解度随温度变化的曲线如右图所示.则40℃时,100g蒸馏水中溶解5050g硫酸钠达到饱和.将该饱和溶液升高温度至90℃,观察到的现象是有固体析出有固体析出. xiaofong_991年前1
xiaofong_991年前1 -
 山乐水乐 共回答了13个问题
山乐水乐 共回答了13个问题 |采纳率76.9%(1)由复分解反应发生的条件,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠.反应的化学方程式为:2NaOH+MgCl2═Mg(OH)2↓+2NaCl; Na2CO3+CaCl2═CaCO3↓+2NaCl
(2)硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,二氧化碳以气体形式逸出,不带入任何其它杂质.故除去过量的氢氧化钠和碳酸钠时,可以用稀硫酸.
(3)被加热的滤液中含有一定量的NaCl,故蒸发操作无法得到纯净的硫酸钠晶体,应加热使大部分硫酸钠晶体析出,而此时溶液中的溶质主要为氯化钠,然后过滤除去滤液,从而的较纯净的硫酸钠晶体;
(4)根据溶解度的定义以及溶解度受温度影响的关系可知.100克蒸馏水中溶解50克硫酸钠恰好饱和.由硫酸钠的溶解的曲线可知,在0℃到40℃之间,硫酸钠的溶解度随温度的升高而增大,在40℃到90℃时,硫酸钠的溶解度随温度的升高而减小.饱和的硫酸钠溶液由40℃升高到90℃时,溶解度减小,故有硫酸钠固体析出.
故答案为:(1)2NaOH+MgCl2=Mg(OH)2↓+2NaCl;Na2CO3+CaCl2=CaCO3↓+2NaCl;
(2)H2SO4;
(3)C;
(4)50; 有固体析出.1年前查看全部
- 下列有关物质用途的说法,错误的是( ) A.二氧化硫常用于漂白纸浆 B.漂粉精可用于游泳池水消毒 C.晶体硅常用于制作
下列有关物质用途的说法,错误的是( )
A.二氧化硫常用于漂白纸浆 B.漂粉精可用于游泳池水消毒 C.晶体硅常用于制作光导纤维 D.氧化铁常用于红色油漆和涂料  kikolan1年前1
kikolan1年前1 -
 传说中的xx人 共回答了19个问题
传说中的xx人 共回答了19个问题 |采纳率89.5%C
制作光导纤维的材料是SiO 2 而不是Si,C项错误。1年前查看全部
- 硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量的氯化钙、氯化镁,实验室进行提纯的流程如下:
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量的氯化钙、氯化镁,实验室进行提纯的流程如下:
(1)滤渣中两种主要成分的化学式为______、______.
(2)NaOH和Na2CO3如果添加过量了,可加入适量______溶液除去.
(3)“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至______(选填字母).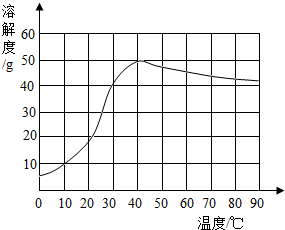 A.完全蒸干时停止加热
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
(4)已知硫酸钠的溶解度随温度变化的曲线如图所示.40℃时,硫酸钠的饱和溶液中溶质质量分数为______(结果精确到0.1%),将该饱和溶液升高温度至90℃,观察到的现象是______. ouxy5201年前1
ouxy5201年前1 -
 秋风瑟瑟忆相思 共回答了21个问题
秋风瑟瑟忆相思 共回答了21个问题 |采纳率95.2%解题思路:(1)根据氢氧根离子和镁离子会生成氢氧化镁沉淀,碳酸根离子和钙离子会生成碳酸钙沉淀进行分析;
(2)根据氢氧化钠和碳酸钠对于硫酸钠,氢氧根离子和碳酸根离子就是杂质进行分析;
(3)根据蒸发操作的步骤进行分析;
(4)根据表中的数据结合质量分数的计算进行分析.(1)氢氧化钠和混合物中氯化镁生成氢氧化镁沉淀,碳酸钠和氯化钙生成碳酸钙沉淀,故答案为:Mg(OH)2,CaCO3;
(2)由于是硫酸钠中混有氢氧化钠和碳酸钠,只需要除去阴离子即可,由于两者都显碱性,所以可以加入酸,为不引入新的杂质,只能加适量稀硫酸,故答案为:稀硫酸;
(3)被加热的滤液中含有一定量的NaCl,故单纯的蒸发操作无法得到纯净的硫酸钠晶体,应该加热使大部分硫酸钠晶体析出,而此时溶液中主要为氯化钠,然后过滤除去滤液,从而的较纯净的硫酸钠晶体,故答案为C;
(4)从图象中可以看出硫酸钠的溶解度是50克,所以质量分数是:[50/150]×100%=33.3%,40℃到90℃之间硫酸钠的溶解度随温度的升高而减小,所以会有晶体析出.故答案为:33.3% 有晶体析出.点评:
本题考点: 物质除杂或净化的探究;固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 在解此类题时,首先分析题中的问题,然后结合学过的知识进行分析解答,在除杂质时,注意不能引入新的杂质.1年前查看全部
- 二氧化硫可以用来漂白纸浆吗
 菠菠萝萝2251年前2
菠菠萝萝2251年前2 -
 抱滑板的少年 共回答了25个问题
抱滑板的少年 共回答了25个问题 |采纳率96%可以二氧化硫的漂白作用的原理是二氧化硫与有色物质反应生成无色的物质.不仅能漂白品红,也能漂白其它有机色素.如黄色的小麦秸秆经二氧化硫漂白就会变白,小麦秸秆编织的草帽就是用二氧化硫漂白的.但是二氧化硫与有机色素形成的无色物质不稳定.时间长了还会分解的,所以草帽在一段时间后会发黄.二氧化硫不能漂白有色的无机物.1年前查看全部
- 证明纸浆中千维素含有碳元素的方法是
 8042549251年前1
8042549251年前1 -
 moneywtr 共回答了15个问题
moneywtr 共回答了15个问题 |采纳率100%用浓硫酸滴在上面,一会滴硫酸的地方就变黑了,黑的就是碳1年前查看全部
- 硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料。某硫酸钠粗品中含有少量CaCl 2 和MgCl 2 ,实验室进行提纯的
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料。某硫酸钠粗品中含有少量CaCl 2 和MgCl 2 ,实验室进行提纯的流程如下: 
回答下列问题:
(1)用NaOH和Na 2 CO 3 除杂时,反应的化学方程式分别为 _________________________________、__________________________________。
(2)NaOH和Na 2 CO 3 如果添加过量了,可加入适量___________溶液除去。
(3)“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至________(填序号)。
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
(4)已知硫酸钠的溶解度随温度变化的曲线如下图所示。40℃时,100g蒸馏水中溶解______g硫酸钠达到饱和。将该饱和溶液升高温度至90℃,观察到的现象是_____________________。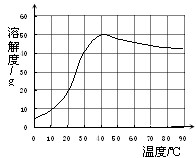
 zhangliyu61年前1
zhangliyu61年前1 -
 junyangz 共回答了15个问题
junyangz 共回答了15个问题 |采纳率86.7%(1)2NaOH+MgCl 2 ==Mg(OH) 2 ↓+2NaCl;Na 2 CO 3 +CaCl 2 =CaCO 3 ↓+2NaCl
(2)H 2 SO 4
(3)C
(4)50;有固体析出1年前查看全部
- 纸浆厂都产生哪些废水具体采取的处理工艺流程是什么样的 急
 雅雅仔1年前1
雅雅仔1年前1 -
 今日不爽逃课上网 共回答了13个问题
今日不爽逃课上网 共回答了13个问题 |采纳率92.3%根据你生产的原材料以及工艺的不同还有不同生产环节所产生的废水污染成分也大不相同.
碱法制浆中段废水:纤维,杂细胞,半纤维,甲醇,醋酸,蚁酸,糖类,木素及衍生物,松香酸和不饱和脂肪酸.
机械磨木浆,半化学浆污水:主要是纤维,木素及衍生物,胶状物等
废纸脱墨废水:主要成分为纤维及降解物,胶状物,油墨,脱墨剂等表面活性1年前查看全部
- 证明纸浆中纤维素含有碳元素的方法有什么?
 lucy2011年前1
lucy2011年前1 -
 隐身用户 共回答了23个问题
隐身用户 共回答了23个问题 |采纳率91.3%点燃它,然后在它的火焰上放一个内壁表面铺满澄清石灰水的烧杯 ,若澄清石灰水变浑浊则有CO2产生,也就证明了有碳元素的存在.1年前查看全部
- 二氧化硫具有氧化性,可用于漂白纸浆.错在哪?
 zb1976921年前6
zb1976921年前6 -
 lvxlj 共回答了18个问题
lvxlj 共回答了18个问题 |采纳率100%后边一句错了 有毒不能漂纸1年前查看全部
- 固体加热会变成液体,但为什么木头加热了会烧起来而且不会变成液体呢?纸浆又是怎么产生的呢?
固体加热会变成液体,但为什么木头加热了会烧起来而且不会变成液体呢?纸浆又是怎么产生的呢?
RT liyunping1年前1
liyunping1年前1 -
 木狗鱼 共回答了19个问题
木狗鱼 共回答了19个问题 |采纳率94.7%木头的主要成分是纤维素,属于高分子聚合物,没有固定的熔点,而且是有机物,可能在熔化之前就达到点燃着火的温度.如果隔绝氧气,可能可以把木头液化.
纸浆是纤维素的悬浊液,不是溶液,把木头捣碎后在稀硫酸中加热水解,增强其溶解度,减少粗纤维数量,以提高纸张质量1年前查看全部
- 关于制作再生纸以下是我的制作过程打纸浆,用纱网过滤,贴窗上晾干1纸不容易打碎2晾干后撕不下来3纸太黑4纸不平,有洞5(这
关于制作再生纸
以下是我的制作过程
打纸浆,用纱网过滤,贴窗上晾干
1纸不容易打碎
2晾干后撕不下来
3纸太黑
4纸不平,有洞
5(这个不一定要答)搅拌机不给力 agelasteao1年前1
agelasteao1年前1 -
 151658412 共回答了18个问题
151658412 共回答了18个问题 |采纳率94.4%1.纸张中的纤维在干燥过程中氢键结合,需要一定力度才能破坏,工业中采用钢制转子产生的水流涡旋来打浆,所以不易打碎是正常的.提高水温可以加快打浆.
2.撕不下来可能跟你的再生纸原料中含有胶物有关,比如书本胶装时的胶,杂物胶.或者还跟你纱网材料有关,可选塑料或铜丝网.
3.纸太黑跟你的再生纸原料有关,纸张一般都经过了印刷,油墨附着在了上面,如果你没有除去这些油墨粒子必然会造成新造的纸上也还有油墨.
4.不平,有洞一个跟你的打浆程度有关,建议你打碎一点.再个跟你自己的手艺有关.还有就是跟杂物去除的程度有关.1年前查看全部
- 塑木板材(密度为1.16g/cm3)是用废纸纸浆和塑料融合而成,如果纸浆密度为1.0g/cm3,假设融合过程中体积不变,
塑木板材(密度为1.16g/cm3)是用废纸纸浆和塑料融合而成,如果纸浆密度为1.0g/cm3,假设融合过程中体积不变,1立方米的纸浆与多少立方米的密度为2.0g/cm3的塑料融合才能得到这种塑木板材?
 冰竹儿1年前3
冰竹儿1年前3 -
 蕉下闪客 共回答了13个问题
蕉下闪客 共回答了13个问题 |采纳率76.9%设1立方厘米米纸浆与x立方厘米塑料融合,得到这种塑料,有(1+2x)/(1+x)=1.16推得x=0.16/0.84
换下单位就得到所需塑料为4/21个立方.1年前查看全部
- 一个圆柱形油桶,从里面量,底面纸浆是6分米,高是5分米,这个油桶能否装120千克的油?(每升重0.85千克)
 zhouruihua1年前1
zhouruihua1年前1 -
 cristino 共回答了19个问题
cristino 共回答了19个问题 |采纳率89.5%6/2=3(分米)
3*3=9(分米)
9*3.14*5=141.3(平方分米)
141.3*0.85=120.105(千克)
120.105千克大于120千克
答:能装120千克的油.1年前查看全部
- 硫代硫酸钠(Na 2 S 2 O 3 )俗称保险粉,可用作定影剂,也可用于纸浆漂白、脱氯剂等。
硫代硫酸钠(Na 2 S 2 O 3 )俗称保险粉,可用作定影剂,也可用于纸浆漂白、脱氯剂等。
Na 2 S 2 O 3 易溶于水,不溶于乙醇,常温下溶液中析出晶体通常为Na 2 S 2 O·5H 2 O。实验室制备保险粉的装置如下图所示。涉及的总化学方程式如下: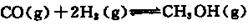

(1)检查虚线框内装置气密性的方法是 。
(2)反应前仪器a中加入的药品为 ,仪器c中加入的药品为 。
(3)仪器b的名称是 。
(4)在制备过程中,持续通人气体时,观察到B装置中先有大量浅黄色沉淀析出,反应一段时间,沉淀逐渐减少;待浅黄色沉淀消失时反应完成,停止加热。反应的离子方程式为 。
(5)反应完成后,为了从混合溶液中获取产品,操作如下:
操作②为 。
(6)为了测产品的纯度,称取8.000 g粗产品,配制成250 mL溶液,用移液管移取25.00 mL于锥形瓶中,再用0.05000 mol·L -l 的碘标准溶液进行滴定(2S 2 O 3 2- +I 2 =S 4 O 6 2- +2I - ),
平行3次实验,平均消耗碘标准溶液的体积为30.00mL。
①测得产品的纯度为 。
②关于上述实验的有关操作,以下表述正确的是 。(填编号)A.用碱式滴定管盛装碘标准溶液 B.用移液管移取25.00mL溶液于锥形瓶中,移液管的尖嘴和锥形瓶内壁要接触 C.如果滴定终点没有控制好,碘标准溶液滴加过量,则必须重新进行滴定 D.滴定过程中若剧烈摇动锥形瓶(溶液不外溅),则所测得的纯度将会偏高  bailinghua1年前1
bailinghua1年前1 -
 新重庆遮阳扇 共回答了20个问题
新重庆遮阳扇 共回答了20个问题 |采纳率95%(1)关闭蒸馏烧瓶右端活塞,往分液漏斗中加水,打开分液漏斗的活塞,水开始下滴,一段时间后,如果水不再下滴,表明气密性良好。反之则气密性不好。
(2)Na 2 SO 3 固体 NaOH溶液(或KMnO 4 溶液等)
(3)三颈烧瓶
(4)S 2 O 3 2- +SO 2 +H 2 O=S↓+2HSO 3 2-
(5)蒸发浓缩、冷却结晶
(6)①93.00% ②B
1年前查看全部
大家在问
- 1青岛版数学七下11.5 一次函数题
- 2形容团结就是力量的成语
- 3一次函数f(x)是减函数,且满足f(f(x))=4x-2,则f(x)=?
- 4谁知道生物分类可分为哪几个“域”?
- 5关于这15名同学每天使用的零花钱,下列说法正确的是( )
- 6为何要分辛温解表、辛凉解表、扶正解表三大类的道理?如题
- 7甲数是240,比乙数多25%,求乙数是多少?
- 8小明戴上红趣巾和书包,高兴地上学去了.(修改符号修改病句)
- 9如图所示,有一长度x=1m、质量M=10kg的平板车,静止在光滑的水平面上,在小车一端放置一质量m=4kg的小物块,物块
- 10计算题(√12–3√1/3)–(√1/8–√18)
- 11英语翻译Tax Laws are enacted to explore the development of incom
- 12求助!定语从句练习题翻译成英文.1,住在隔壁的那个人是个有名的医生.2,与我说话的人是新来的语文老师.3,他就是住我隔壁
- 13用计算器求-325的立方根,正确的按键顺序是什么?
- 14作文《做最好的自己》750字.
- 15去年八月用英语怎么说
