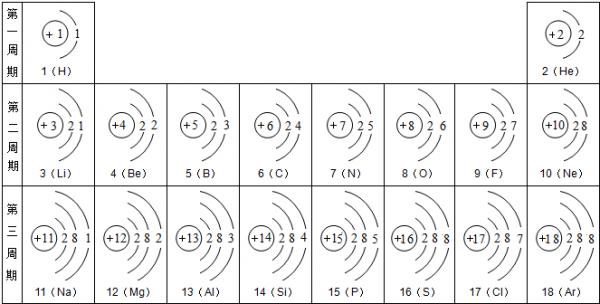
在1~18号元素中,下列叙述正确的是( ) A.最外层只有一个电子的元素一定是金属元素 B.最外层有两个电子的元素一定
 zero862022-10-04 11:39:541条回答
zero862022-10-04 11:39:541条回答 在1~18号元素中,下列叙述正确的是( )
|

已提交,审核后显示!提交回复
共1条回复
 99yut 共回答了19个问题
99yut 共回答了19个问题 |采纳率100%- A、最外层只有一个电子的元素是氢元素,属于非金属元素.故A错误;
B、最外层有两个电子的元素不一定是金属元素,如氦元素最外层有两个电子,但氦元素属于非金属元素.故B错误;
C、原子核外各层电子数相等的不一定是非金属元素,如铍元素原子有两个电子层,每层上都是2个电子,但铍元素不是非金属而是金属元素.故C错误;
D、核电荷数为17的原子是氯原子,最外层有7个电子,易得到一个电子而形成稳定结构.故D正确.
故选D. - 1年前
相关推荐
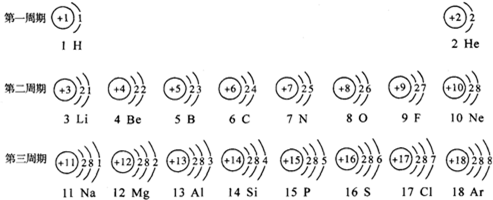
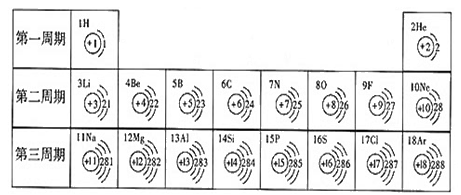
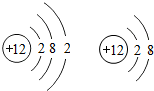
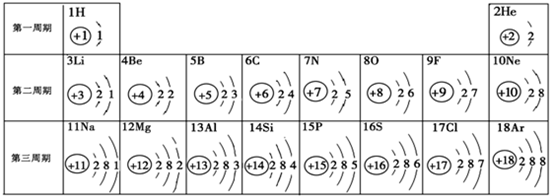
- 元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
(1)第16号元素属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“得”或“失”)电子;第一周期 1H 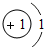
2He 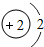
第二周期 3Li 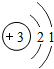
4Be 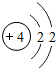
5B 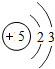
6C 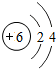
7N 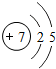
8O 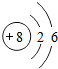
9F 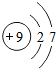
10Ne 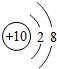
第三周期 11Na 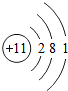
12Mg 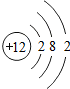
13Al 
14Si 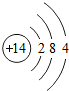
15P 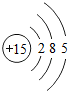
16S 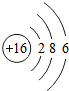
17Cl 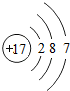
18Ar 
(2)元素的化学性质与原子结构中的______数关系密切;
(3)He与Ne、Ar原子最外层电子数不一样,但都处在每周期的最后,从原子结构上分析其原因______. 依洛的空心菜1年前1
依洛的空心菜1年前1 -
 小睡狗 共回答了18个问题
小睡狗 共回答了18个问题 |采纳率94.4%解题思路:(1)根据元素周期表可知,第16号元素名称为硫,由其汉语名称偏旁可知其元素种类、由最外层电子数为6可知容易得到电子情况;
(2)元素的化合价数值一般与它的原子最外层电子数有关;或元素的化合价与该元素的离子所带的电荷数有关进行分析即可.
(3)从最外层电子数的特点分析.(1)根据元素周期表可知,第16号元硫元素,它属于非金属元素,它的原子的最外层有6个电子,在化学反应中容易得电子;
(2)原子在相互化合是存在得失电子或形成共用电子对,都与最外层电子数有关,所以元素的化学性质与原子的最外层电子数关系密切.
(3)He与Ne、Ar都是稀有气体元素,原子最外层电子数不一样,但最外层都是稳定结构,化学性质都不活泼,故都处在每周期的最后.
故答案为:(1)非金属;得;
(2)最外层电子
(3)最外层都是稳定结构,化学性质都不活泼.点评:
本题考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;元素的简单分类.
考点点评: 了解元素周期表的特点及其应用;核外电子在化学反应中的具体作用是解题的关键.1年前查看全部
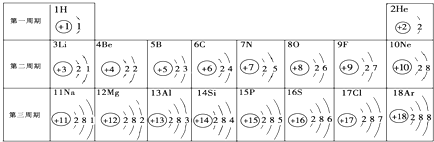
- 元素周期表是学习和研究化学的重要工具,它的内容十分丰富.如图是依据元素周期表画出的1~18号元素的原子结构示意图.我对它
元素周期表是学习和研究化学的重要工具,它的内容十分丰富.如图是依据元素周期表画出的1~18号元素的原子结构示意图.我对它进行研究:
原子序数为8的元素名称是______,在化学反应中,该元素的原子容易______电子,变成______(填符号);原子序数为13的元素属于______元素(金属或非金属),上述两种元素所形成的化合物的化学式为______. sundayfqn11年前1
sundayfqn11年前1 -
 冲天之子1 共回答了13个问题
冲天之子1 共回答了13个问题 |采纳率76.9%解题思路:根据原子序数熟记前20号元素名称;在化学反应中,根据元素原子的最外层电子多少判定得失电子数目,推测化合价,书写化学式.根据元素周期表可知,原子序数为8的元素名称是氧,最外层电子数是6,在化学反应中容易得到两个电子,变成氧离子;原子序数为13的元素是铝,属于金属元素,这两种元素可形成三氧化二铝.
故答案为:氧;得; O2-; 金属;Al2O3.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;化学式的书写及意义.
考点点评: 本题考查学生对元素周期律和元素的性质与最外层电子数的关系的理解与掌握,要能在解题中灵活应用.1年前查看全部
- A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质.
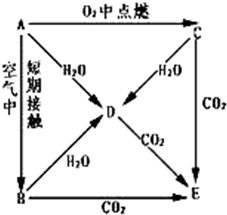 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质.
(1)写出A→E的化学式:A______ B______C______ D______E______
(2)写下列反应的离子方程式
A→D:______C→D:______D+CO2(过量)______. 寒风吹雪-1年前0
寒风吹雪-1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 1~18号元素中X元素的原子最外层只有1个电子,Y元素的原子的第三层有6个电子,Z元素的第二层也有6个电子,在化合物中只
1~18号元素中X元素的原子最外层只有1个电子,Y元素的原子的第三层有6个电子,Z元素的第二层也有6个电子,在化合物中只有Z元素的化合价为负.由这三种元素组成的化合物的化学式可能是( )
A.XYZ4
B.X2YZ3
C.X3YZ4
D.XYZ3 七色小蜡笔1年前1
七色小蜡笔1年前1 -
 醴陵1277 共回答了25个问题
醴陵1277 共回答了25个问题 |采纳率84%解题思路:X元素的原子最外层只有1个电子,在反应中容易失去,化合价为+1价,Y元素的原子的第三层有6个电子,是硫元素,在化合物中的化合价常常表现为+4价、+6价,Z元素的第二层有6个电子,是氧元素,在化合物中的化合价是-2价.X元素的化合价为+1价,Y元素的化合价为+4价或+6价,Z元素的化合价是-2价.
A、XYZ4的化合价的代数和为:(+1)+(+4)+(-2)×4=-3,或:(+1)+(+6)+(-2)×4=-1,都不为零.错误;
B、X2YZ3的化合价的代数和为:(+1)×2+(+4)+(-2)×3=0,为零.正确;
C、X3YZ4的化合价的代数和为:(+1)×3+(+4)+(-2)×4=-1,或:(+1)×3+(+6)+(-2)×4=+1,都不为零.错误;
D、XYZ3的化合价的代数和为:(+1)+(+4)+(-2)×3=-1,或:(+1)+(+6)+(-2)×3=+1,都不为零.错误.
故选B.点评:
本题考点: 化学式的书写及意义;核外电子在化学反应中的作用;化合价规律和原则.
考点点评: 在化合物中元素化合价代数和为零,根据这一原则可以求出物质的化学式.1年前查看全部
- (1)下表是1~18号元素按一定规律排列,请观察,并按要求回答问题
(1)下表是1~18号元素按一定规律排列,请观察,并按要求回答问题
①写出11号元素的元素名称:______;
②16号元素属于______元素(填“金属”、“非金属”或“稀有气体”);
③观察此表,写出一条你发现的规律:______.
(2)下列粒子中:①与镁原子化学性质相似的是______(填写序号);
②与镁元素在同一周期的是______(填写序号);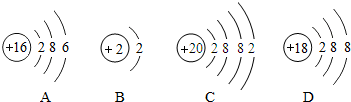
(3)由l号和8号元素组成的化合物(分子中原子个数比为2:1)与6号元素的单质,在高温下发生置换反应,生成一种最轻的气体和一种由双原子分子构成的化合物,该反应的化学方程式是______.
(4)下图为某化学反应的微观过程,其中“ ”和“
”和“ ”表示两种不同原子.
”表示两种不同原子.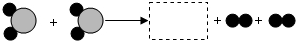
①该反应属于____________(填基本反应类型)反应.
②虚线框内应填的微观图示是______ (选填下图序号),你推断的依据是______.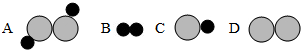
 smydlx1年前1
smydlx1年前1 -
 木子女那 共回答了15个问题
木子女那 共回答了15个问题 |采纳率86.7%解题思路:(1)根据元素周期表提供的信息以及每一周期中各元素的变化规律解答;
(2)根据原子结构示意图来解答;
(3)根据质量守恒定律正确书写化学方程式;
(4)根据化学反应的微观过程分析反应物、生成物的种类及反应的特点,判断反应的基本类型;根据质量守恒定律反应前后原子的种类及数目不变进行分析.(1)①从元素周期表中可查得,原子序数为11号的元素的名称是钠;
②根据金属金属元素名称一般有“金”字旁;固态非金属元素名称有“石”字旁;气态非金属元素名称有“气”字头,则16号元素属于硫属于非金属元素;
③元素周期表内含的规律比较多,只要善于总结就能发现,例如:同一周期,从左到右,原子序数依次增大;同一周期,从左到右原子的最外层电子数依次增大等.
故答案为:①钠;②非金属;③同一周期,从左到右原子序数依次增大;
(2)最外层电子数相同化学性质相似,故与C化学性质相似;电子层数相同的原子居于同一周期,故镁元素与AD在同一周期;
(3)由l号和8号元素组成的化合物(分子中原子个数比为2:1)为水;6号元素的单质为碳;在高温下发生置换反应,生成一种最轻的气体和一种由双原子分子构成的化合物,该反应的化学方程式是H2O+C═CO+H2;
(4)由化学反应的微观过程可知,反应物是一种,生成物是两种,该反应属于分解反应.
由质量守恒定律反应前后原子的种类及数目不变可知,虚线框内应填的微观图示是D;
答案:(1)①钠②非金属③同一周期核内质子数依次递增(或同一族电子层数递增) (2)C;AD(3)H2O+C═CO+H2
(4)①分解②D; 质量守恒定律(或化学反应前后原子的种类、数目不变)点评:
本题考点: 元素周期表的特点及其应用;微粒观点及模型图的应用;原子结构示意图与离子结构示意图;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查学生对元素周期表知识的总结应用能力,元素周期表是学习化学的重要工具,在学习中,要利用好这个工具;通过给出微粒的模型,考查学生的观察能力和对基本概念的理解与运用能力,本题解题的关键是根据质量守恒定律分析判定另一种生成物的构成.1年前查看全部
- 元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
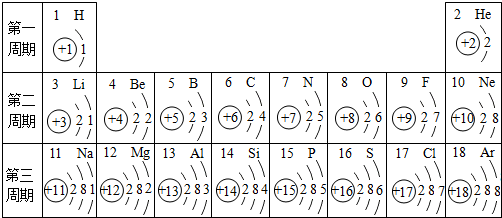
(1)第16号元素属于______金属元素(填“金属”或“非金属”),它在化学反应中容易______失(填“得”或“失”)电子,所形成的微粒的符号:______Mg2+
(2)元素的化学性质与原子结构中的______最外层电子数关系密切.
(3)在同一族中各元素的原子结构呈现的规律有______(任写一点)
(4)研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的吸引力逐渐增大,故原子半径逐渐减小.我分析第三周期从11~17号元素原子半径变化规律是______. 寸草欣1年前1
寸草欣1年前1 -
 碗在天上飞 共回答了18个问题
碗在天上飞 共回答了18个问题 |采纳率83.3%解题思路:(1)根据16号元素是硫元素,属非金属元素,在化学反应中中易得两个电子,形成带两个单位负电荷的阴离子解答;
(2)根据元素的化学性质与原子结构中原子核外最外层电子数关系最密切解答;
(3)根据同一周期中原子最外层电子数相同解答;
(4)根据第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的吸引力逐渐增大,故原子半径逐渐减小可知第三周期中的元素也存在这样的规律解答.(1)16号元素是硫元素,属非金属元素,在化学反应中中易得两个电子,形成带两个单位负电荷的阴离子,故答案:非;得;S2-;(2)元素的化学性质与原子结构中原子核外最外层电子数关系最密切,故答案:原子核外;(3...
点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查元素周期表相关知识,以信息题的形式多角度考查学生分析问题和解决问题的能力.1年前查看全部
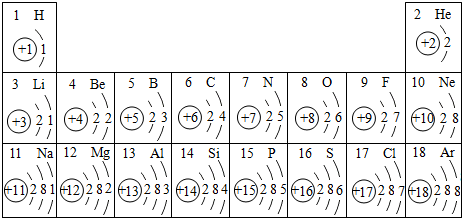
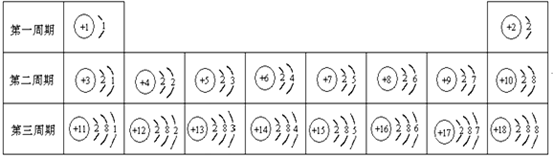
- 元素周期表是我们学习化学和研究化学的重要工具.下表是元素周期表中1~18号元素原子核外电子排布,我对它进行研究:
元素周期表是我们学习化学和研究化学的重要工具.下表是元素周期表中1~18号元素原子核外电子排布,我对它进行研究:
(1)第11号元素它属于______元素(填“金属”或“非金属”),它在化学反应中容易______电子,它的离子符号为______.第一周期 1 H 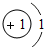
2 He 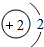
第二周期 3 Li 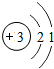
4 Be 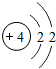
5 B 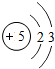
6 C 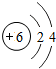
7 N 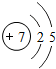
8 O 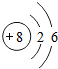
9 F 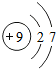
10 Ne 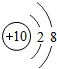
第三周期 11 Na 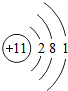
12 Mg 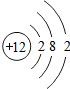
13 Al 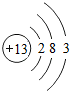
14 Si 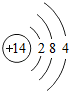
15 P 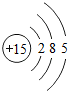
16 S 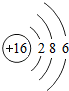
17 Cl 
18 Ar 
(2)从上表中我探究出以下规律:在原子里核电荷数=原子序数=______.
(3)我通过细致地分析,还可以总结出元素周期表的一些规律:如______. haicaokimo1年前1
haicaokimo1年前1 -
 te9168 共回答了30个问题
te9168 共回答了30个问题 |采纳率80%解题思路:(1)根据原子序数来判断元素,利用原子结构来分析性质并书写离子的符号;
(2)根据原子序数表示的意义,利用表中的数字来分析规律;
(3)根据提供的周期表,从横行和竖行来分析元素周期表中的规律.(1)因原子序数为11的元素是钠元素,名称的偏旁为“金”,则属于金属元素,因原子结构中最外层电子数为1,则在反应中容易失去1个电子而满足最外层8电子的稳定结构,钠原子变为钠离子,钠离子带1个单位的正电荷,其...
点评:
本题考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;化学符号及其周围数字的意义.
考点点评: 本题考查学生对周期表的认识,学生应理解周期表的排列,并能利用信息来发现规律,较好的考查了学生的分析归纳能力.1年前查看全部
- 元素周期表是我们学习化学和研究化学的重要工具.下表是元素周期表中1~18号元素原子的核外电子排布,请回答:
元素周期表是我们学习化学和研究化学的重要工具.下表是元素周期表中1~18号元素原子的核外电子排布,请回答:
(1)第13号元素名称是______,它属于______(填“金属”或“非金属”)元素,它在化学反应中容易______电子,它的离子符号为______.
(2)原子序数为11、17的元素组成化合物的化学式______.
(3)对1~18号元素的原子结构示意图进行分析,可以发现许多规律,如第一周期元素的原子核外只有一个电子层.请再总结出其他规律,并写出其中两条:
①______;②______.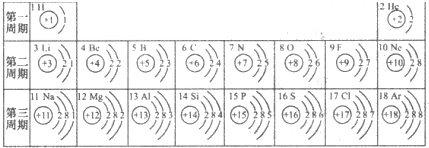
 4xae1年前1
4xae1年前1 -
 steven_lu 共回答了22个问题
steven_lu 共回答了22个问题 |采纳率95.5%(1)第13号元素名称是铝,它属于金属元素,原子最外电子层上有3个电子,它在化学反应中容易失去电子形成阳离子,其离子符号为:Al 3+ .
(2)原子序数为11、17的元素分别是钠元素和氯元素,组成化合物为氯化钠,其化学式为:NaCl.
(3)每一周期元素的原子的核外电子层数相同;每一周期元素原子的最外层电子数从左到右逐渐增加;每一纵列元素原子的最外层电子数相同等.
故答案为:(1)铝;金属;失去;Al 3+ ;(2)NaCl;(3)每一周期元素的原子的核外电子层数相同;每一周期元素原子的最外层电子数从左到右逐渐增加等.1年前查看全部
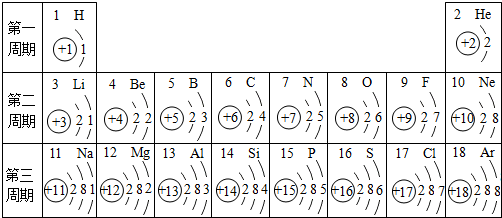
- 元素周期表是学习化学的重要工具.如图是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
元素周期表是学习化学的重要工具.如图是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
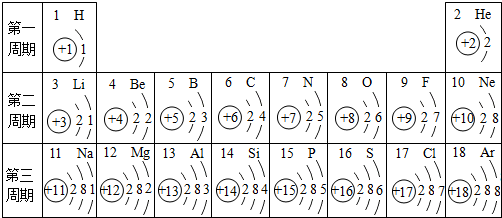
(1)生物体中含量最多的元素名称是______,该元素属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“得”或“失”)电子.
(2)某原子结构示意图为 ,其中X值为______,它位于元素周期表里第______周期,该粒子的最外层电子数为______.
,其中X值为______,它位于元素周期表里第______周期,该粒子的最外层电子数为______.
(3)原子序数为12和17的原子不属于同一种元素,原因是______ 不同(填字母).
A.质子数B.相对原子质量C.中子数 D.电子数
(4)研究表明:第二周期3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期11~17号元素原子半径变化规律是______. 大音堂1年前1
大音堂1年前1 -
 希峰_东ru 共回答了19个问题
希峰_东ru 共回答了19个问题 |采纳率89.5%解题思路:(1)生物体中含量最多的元素是氧,由其汉语名称可知其元素种类、由最外层电子数可知得失电子情况;
(2)原子中核内质子数=核外电子数;元素周期表中电子层数=周期数,该粒子最外层电子数是2;
(3)元素的种类是由核内质子数或核电荷数决定的,原子序数=核内质子数;
(4)总结规律:“第二周期从3号~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小”,利用知识迁移,则可知第三周期从11号~17号元素原子半径变化规律.(1)生物体中含量最多的元素是氧元素,它属于非金属元素;该原子的最外层电子数是6,在化学反应中容易得电子;
(2)该原子的核外电子数是20,根据核内质子数=核外电子数,X=20;该原子有四个电子层,故位于第四周期,最外层电子数是2;
(3)原子序数为12和17的原子不属于同一种元素,原因是质子数不同;
(4)研究表明:第二周期从3号~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小;利用知识迁移,则可分析第三周期从11号~17号元素原子半径变化规律是原子半径逐渐减小;
故答案为:
(1)氧;非金属;得;
(2)20;四;2;
(3)A;
(4)原子半径逐渐减小.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 了解元素周期表的特点及其应用,原子结构示意图中数字的含义,元素的定义等知识,是解答此题的关键.1年前查看全部
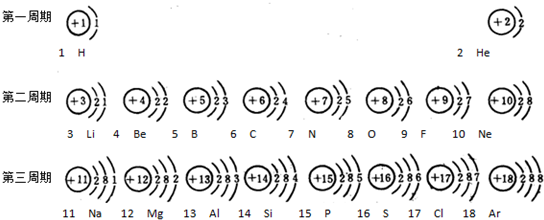
- 一、元素周期表是学习和研究化学的重要工具,它的内容十分丰富.如图1是依据元素周期表画出的1~18号元素的原子结构示间图.
一、元素周期表是学习和研究化学的重要工具,它的内容十分丰富.如图1是依据元素周期表画出的1~18号元素的原子结构示间图.我对它进行研究:
(1)原子序数为17的元素名称是______,在化学反应中,该元素的原子容易______(填“得”或“失”)电子;原子序数为13的元素属于______元素(填“金属”或“非金属”)
(2)我发现如下规律:
①原子序数与元素原子核电荷数在数值上相等;
②______;
③______;…
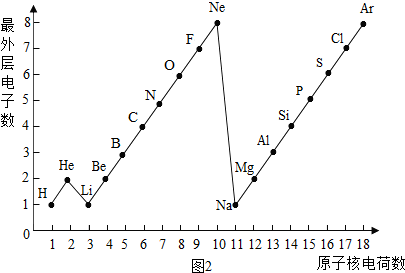
二、如图2是1~18号元素原子最外层电子数与原子核电荷数的关系图.试回答:
(1)一个水分子共有______原子核、______个质子.
(2)一个Mg2+核外共有______电子;Cl-的最外层电子数和______原子的最外层电子数相同.
(3)通过对该图的分析,你能发现哪些规律?请写出其中一个:______
图11 1H 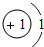
2He 
2 3Li 
4Be 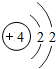
5B 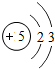
6C 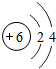
7N 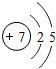
8O 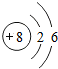
9F 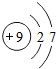
10Ne 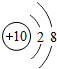
3 11Na 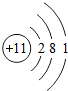
12Mg 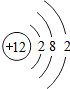
13Al 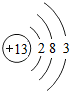
14Si 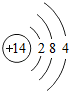
15P 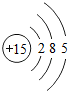
16S 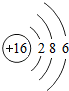
17Cl 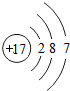
18Ar 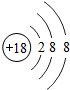
 傣天蝎1年前1
傣天蝎1年前1 -
 fenggou 共回答了23个问题
fenggou 共回答了23个问题 |采纳率95.7%解题思路:一、(1)质子数决定元素种类,最外层电子数小于4个的易失电子,多天4个易得电子;
(2)根据元素周期表及原子结构示意图分析找出规律.
二、(1)由图中1~18号元素原子最外层电子数与原子核电荷数的关系图可知:氢元素、氧元素的质子数;
(2)一个Mg2+是失去2个电子而带的正电荷,故可知其离子核外电子数;Cl-是得到1个电子而带的负电荷,故可知其离子最外层电子数;
(3)通过对该图的分析,总结归纳规律.一、(1)质子数决定元素种类,原子序数等于质子数,故原子序数为17的元素为 氯元素,氯原子最外层上有7个电子,在化学反应中,该元素的原子容易 得电子;原子序数为13的元素是铝元素,属于 金属元素
(2)分析元素周期表及原子结构示意图可以发现以下规律:第一周期元素的原子核外只有一个电子层;第二周期元素的原子核外有两个电子层;第三周期元素的原子核外有三个电子层;每一周期元素原子的核外电子层数相同;每一周期元素原子的最外层电子数从左到右逐渐增加;每一列元素原子的最外层电子数相同;最后一列元素原子的最外层电子数都达到稳定结构;最外层电子数小于3的原子一般为金属元素,最外层电子数小于3的原子易失去最外层电子形成阳离子.
二、(1)根据“核内质子数=核外电子数=核电荷数”,由图中1~18号元素原子最外层电子数与原子核电荷数的关系图可知:氢元素、氧元素的质子数分别为:1、8;又因为1个水分子由2个氢原子和1个氧原子构成;故一个水分子共有3个原子核,1×2+8=10个质子;
(2)一个Mg2+是失去2个电子而带的正电荷,故可知其离子核外电子数为:12-2=10个;Cl-是得到1个电子而带的负电荷,故可知其离子最外层电子数为:7+1=8,故与Ar、Ne原子的最外层电子数相同;
(3)通过对该图的分析,总结归纳规律:随着核电荷数的递增,最外层电子数呈周期性变化.
故答案为:
一、(1)氯;得;非金属,(2)第一周期元素的原子核外只有一个电子层;第二周期元素的原子核外有两个电子层;第三周期元素的原子核外有三个电子层;每一周期元素原子的核外电子层数相同;每一周期元素原子的最外层电子数从左到右逐渐增加;每一列元素原子的最外层电子数相同;最后一列元素原子的最外层电子数都达到稳定结构;最外层电子数小于3的原子一般为金属元素,最外层电子数小于3的原子易失去最外层电子形成阳离子.
二、(1)3;10;(2)10;Ne、Ar;(3)随着核电荷数的递增,最外层电子数呈周期性变化.点评:
本题考点: 元素周期表的特点及其应用.
考点点评: 了解原子的定义和构成,了解核外电子在化学反应中的作用.会根据图表分析规律.1年前查看全部
- 下表是元素周期表中1~18号元素原子核外电子排布,我对它进行研究:
下表是元素周期表中1~18号元素原子核外电子排布,我对它进行研究:
(1)原子序数为16的元素名称是 ,在化学反应中,该元素的原子容易 (填“得”或“失”)电子,成为 (填“阴”或“阳”)离子,离子符号为 ,原子序数为13的元素属于 (填“金属”或“非金属”)。
(2)通过对元素周期表的分析,我能得出的一条信息是 .
(3)研究表明:在同一周期中,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强。由此推断:第二周期中得电子能力最强的的是 原子,具有稳定结构的是 原子。 海奇珠宝1年前1
海奇珠宝1年前1 -
 6120525 共回答了13个问题
6120525 共回答了13个问题 |采纳率100%(1)硫; 得; 阴; S 2- ; 金属
(2)略,符合题意可以给分;(3)F或氟 ;Ne或氖;
:(1)由元素周期表,可知原子序数为16的元素名称为硫元素;它的最外层电子为6,易“得”2个电子;原子序数为13的元素为铝元素,由汉字名称,可知其元素分类为“金属元素”;
(2)从表中发现如下规律:①原子序数与元素原子核电荷数在数值上相等;②每周期从左到右原子的最外层电子数递增;③从左到右,各元素原子的电子层数相同;④从左到右,元素原子的原子序数依次增加;⑤同一族(从上到下)最外层电子数相同…(选一条)
(3)随着最外层电子数的增加原子得电子的能力增强,达到7时为最强,稳定结构即最外层电子数是8的结构(氦是2)
故答案为:
(1)硫;得;阴;S 2- ;金属;
(2):①原子序数与元素原子核电荷数在数值上相等;②每周期从左到右原子的最外层电子数递增;③从左到右,各元素原子的电子层数相同;④从左到右,元素原子的原子序数依次增加;⑤同一族(从上到下)最外层电子数相同…(选一条);
(3)F或氟;Ne或氖;1年前查看全部
- A、B、C、D、E五种物质都含1~18号元素中的某 一 元素,它们按图所示关系相互转化,已知A为单质
A、B、C、D、E五种物质都含1~18号元素中的某 一 元素,它们按图所示关系相互转化,已知A为单质.
(1)写出A→E的化学式:
A______B______C______D______E______
(2)写出A→D、C→D、反应的化学方程式:A→D______;C→D______.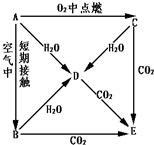
 zhaojawen1年前1
zhaojawen1年前1 -
 uu倭猪 共回答了17个问题
uu倭猪 共回答了17个问题 |采纳率94.1%A为单质,由A
O 2
C可知,C为氧化物,由C
H 2 O
D,结合A
H 2 O
D可知,D只能为碱,A的元素为短周期元素,故A为Na,C为Na 2 O 2 ,D为NaOH,由D
C O 2
E,C
C O 2
E可知,
E为Na 2 CO 3 ;Na在空气中短期接触生成B,B为Na 2 O,Na 2 O与CO 2 反应生成Na 2 CO 3 ,与水反应生成NaOH,符合转化关系,
(1)由上述分析可知,A为Na,B为Na 2 O,C为Na 2 O 2 ,D为NaOH,E为Na 2 CO 3 ,故答案为:Na;Na 2 O;Na 2 O 2 ;NaOH;Na 2 CO 3 ;
(2)A→D是钠与水反应生成氢氧化钠与氢气,反应方程式为:2Na+2H 2 O=2NaOH+H 2 ↑;
C→D是过氧化钠与水反应生成氢氧化钠与氧气,反应方程式为:2Na 2 O 2 +2H 2 O=4NaOH+O 2 ↑,
故答案为:2Na+2H 2 O=2NaOH+H 2 ↑;2Na 2 O 2 +2H 2 O=4NaOH+O 2 ↑.1年前查看全部
- 学完元素周期表以后,小明想探究一下1~18号元素的核电荷数和最外层电子数的关系,绘制了如图所示的关系图,请据图回答下列问
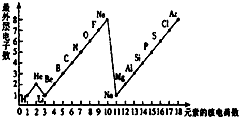 学完元素周期表以后,小明想探究一下1~18号元素的核电荷数和最外层电子数的关系,绘制了如图所示的关系图,请据图回答下列问题:
学完元素周期表以后,小明想探究一下1~18号元素的核电荷数和最外层电子数的关系,绘制了如图所示的关系图,请据图回答下列问题:
(1)一个水分子(h2o)***有______个原子核、______个质子、______个电子.
(2)一个al3+核外共有______个电子;cl-的电子数和______原子的电子数相同.
(3)通过绘制的图示,你能帮助小明发现哪些规律?请写出其中的二个:
①______
②______. ccwwrrcwr1年前1
ccwwrrcwr1年前1 -
 tengkaijian 共回答了20个问题
tengkaijian 共回答了20个问题 |采纳率95%解题思路:(1)由图中1~18号元素原子最外层电子数与原子核电荷数的关系图可知:氢元素、氧元素的质子数;
(2)一个Mg2+是失去2个电子而带的正电荷,故可知其离子核外电子数;Cl-是得到1个电子而带的负电荷,故可知其离子最外层电子数;
(3)通过对该图的分析,总结归纳规律.(1)根据“核内质子数=核外电子数=核电荷数”,由图中1~18号元素原子最外层电子数与原子核电荷数的关系图可知:氢元素、氧元素的质子数分别为:1、8;又因为1个水分子由2个氢原子和1个氧原子构成;故一个水分子共有3个原子核,1×2+8=10个质子;
(2)一个Mg2+是失去2个电子而带的正电荷,故可知其离子核外电子数为:12-2=10个;Cl-是得到1个电子而带的负电荷,故可知其离子最外层电子数为:7+1=8,故与Ar、Ne原子的最外层电子数相同;
(3)通过对该图的分析,总结归纳规律:随着核电荷数的递增,最外层电子数呈周期性变化;同一周期中的元素电子层数相同.
故答为:(1)3,10,10;(2)10,Ar;(3)随着核电荷数的递增,最外层电子数呈周期性变化;同一周期中的元素电子层数相同.点评:
本题考点: 元素周期表的特点及其应用;原子和离子的相互转化.
考点点评: 了解原子的定义和构成:原子由原子核和核外电子构成,其中原子核由质子和中子构成的;了解核外电子在化学反应中的作用.1年前查看全部
- (2014•九江三模)已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
(2014•九江三模)已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A. 质子数:c>d
B. 离子的还原性:Y2->Z-
C. 氢化物的稳定性:H2Y>HZ
D. 原子半径:X<W 新包青天1年前4
新包青天1年前4 -
 天行健是我 共回答了7个问题
天行健是我 共回答了7个问题 |采纳率85.7%解题思路:根据离子的电子层结构相同,判断出四种元素的原子序数的大小以及在周期表中的大体位置,再根据元素周期律判断各选项的正误.因四种离子的电子层结构相同,所以质子数a、b、c、d的大小关系应为a>b>d>c,且Y、Z在上一周期,Y在Z的左边,Y的非金属性小于Z;W、X在下一周期,X在W的左边,X的金属性大于W.
A、质子数d>c,故A错误;
B、离子的还原性:Y2->Z-,故B正确;
C、氢化物稳定性应为HZ>H2Y,故C错误;
D、原子半径大小关系应为X>W,故D错误;
故选B.点评:
本题考点: 物质的结构与性质之间的关系.
考点点评: 本题通过四种电子层结构相同的粒子考查学生对原子(离子)结构、元素周期律、氧化还原等知识的掌握情况,同时也要求学生平时应善于对知识进行归纳总结并变通应用.1年前查看全部
- 如图是元素周期表中的1~18号元素原子核外电子排布,我们对它进行研究:
如图是元素周期表中的1~18号元素原子核外电子排布,我们对它进行研究:

(1)写出硫元素的一种氧化物的化学式______.
(2)写出质子数为1、6、8、11四种元素组成的可以治疗胃酸过多物质的化学式:______.
(3) 表示一种元素的两种粒子,它们属于同一种元素的依据是______.
表示一种元素的两种粒子,它们属于同一种元素的依据是______.
(4)图中He与Ne、Ar原子最外层电子数不一样,但都处在每周期的结尾处,从原子结构上分析其原因______. laosv1年前1
laosv1年前1 -
 helinliu 共回答了17个问题
helinliu 共回答了17个问题 |采纳率88.2%解题思路:(1)根据硫元素和氧元素的化合价来书写化学式;
(2)根据碳酸氢钠可以与盐酸反应用于治疗胃酸过多解答;
(3)根据质子数决定元素种类解答;
(4)根据最外层电子数的特点分析.(1)硫元素有+4价和+6价两种价态,氧元素显-2价,故可组成二氧化硫和三氧化硫两种化合物;
(2)质子数为1、6、8、11四种元素组成的可以治疗胃酸过多物质是碳酸氢钠;
(3)图中两结构示意中原子的质子数相同,故属于同种元素;
(4)He与Ne、Ar都是稀有气体元素,原子最外层电子数不一样,但最外层都是稳定结构,化学性质都不活泼,故都处在每周期的最后.
故答案为:(1)SO2或SO3;(2)NaHCO3;(3)这两种微粒的质子数相同;(4)氦原子只有一个电子层,只能容纳2个电子,与Ne、Ar原子一样,它们的最外层电子数都达到稳定结构(答案合理即可).点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 了解元素周期表的特点及其应用;核外电子在化学反应中的具体作用是解题的关键.1年前查看全部
- 元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
(1)第16号元素属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“得”或“失”)电子;
(2)元素的化学性质与原子结构中的______关系密切;一个水分子中有______个原子核,氯离子的最外层有______个电子.
(3)在同一族中,各元素的原子结构呈现的规律有______(任写一点);
(4)研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期从11~17号元素原子半径变化规律是______. 等待花1年前1
等待花1年前1 -
 从小就缺钙 共回答了23个问题
从小就缺钙 共回答了23个问题 |采纳率95.7%解题思路:(1)根据元素原子最外层电子数的特点:非金属元素的原子最外层电子的数目一般多于4,在化学反应中容易得到电子达到稳定结构,进行解答;
(2)根据元素的化学性质与原子核外的最外层电子数有密切关系:电子数少于四个的一般容易失去电子形成阳离子,电子数少于八个而多于或等于四个的一般容易得到电子形成阴离子,电子数为八个的化学性质一般稳定,不容易发生化学变化;进行解答;
(3)根据在同一个族中,电子层数的变化或最外层电子数的特点等或从上到下核电荷数变化特点进行分析解答;
(4)依据题中信息从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.进行分析解答.(1)根据元素原子最外层电子数的特点:非金属元素的原子最外层电子的数目一般多于4,在化学反应中容易得到电子达到稳定结构,可知:第16号元素属于非金属元素;故答案为:非金属;得;
(2)元素的化学性质与原子核外的最外层电子数有密切关系;由水的化学式可知一个水分子中有3个氢原子,氯离子的最外层有达到了稳定结构最外层电子数是8;故答案为:最外层电子;3;8;
(3)根据在同一个族中,电子层数的变化或最外层电子数的特点等或从上到下核电荷数变化特点可知:电子层数递增,或最外层电子数相等,或从上到下核电荷数增大等;故答案为:电子层数递增 或最外层电子数相等 或从上到下核电荷数增大等;
(4)依据题中信息从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.所以从11~17号元素原子半径变化规律是;逐渐减小;故答案为:逐渐减小.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查元素原子最外层电子数的特点及与化学性质的关系和元素周期表的知识理解与应用.1年前查看全部
- 核电荷数的增加,依照一定的规律将1~18号元素顺次排列成下表.
核电荷数的增加,依照一定的规律将1~18号元素顺次排列成下表.
运用所学过的核外电子排布的初步知识,根据上表进行填空.
(1)在化学反应中,第Ⅰ纵列的元素比较容易 电子;第Ⅵ纵列、第Ⅶ纵列的元素比较容易 电子,(除去H之外)通常都达到8电子的稳定结构,可见元素的化学性质主要决定于原子的 数.
(2)从原子结构上看同一横行的元素具有相同的 数,同一纵列的元素具有相同的 数.
(3)在表中,和氖原子核外电子排步相同的两种阴离子的结构示意图分别是 和 ,三种阳离子的离子符号分别是 、 、 . 四川省1年前1
四川省1年前1 -
 ccchen65875 共回答了20个问题
ccchen65875 共回答了20个问题 |采纳率85%1:第一纵列的元素比较容易失电子,第六纵列第七纵列的元素容易得到电子达到8电子稳定结构(除H外),可见元素的化学性质主要决定于原子的最外层电子数.
2:从原子结构上看同一横行的元素具有相同的电子层数,同一纵列的元素具有相同的最外层电子数.
3:在表中,和氖原子核外电子排布相同的两种阴离子的结构示意图分别是O2-,F+(没办法把结构示意图写出来,不好意思),三种阳离子的离子符号分别是Na+,Mg2+ ,Al3+.1年前查看全部
- 元素周期表是化学和研究化学的重要工具,它的内容十分丰富,下图是依据元素周期表画出的1~18号元素的原子结构示意图.请对它
元素周期表是化学和研究化学的重要工具,它的内容十分丰富,下图是依据元素周期表画出的1~18号元素的原子结构示意图.请对它进行探究 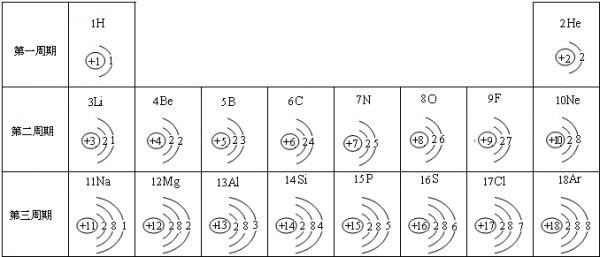
(1)原子序数为17的元素名称是______,在化学反应中,该元素的原子容易______(填“得”或“失”)电子;原子序数为13的元素属于______元素(填“金属”或“非金属”).
(2)请从上表中总结出一条原子排布的规律______.
(3)研究表明:第二周期从3号到9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力增大,故原子半径逐渐减小.请判断:钠原子半径______镁原子半径(填“<”或“>”或“﹦”). 幸福的婚姻1年前1
幸福的婚姻1年前1 -
 葱头五号 共回答了9个问题
葱头五号 共回答了9个问题 |采纳率88.9%(1)根据金属元素的原子最外层电子数一般少于4个,可知原子序数为13的元素属于金属元素;非金属元素的原子最外层电子数一般多于4个,可知原子序数为17的元素为非金属元素,名称是氯;非金属元素在化学反应中易...1年前查看全部
- 元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
 元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
(1)第11号元素属于______元素(填“金属”或“非金属”);
(2)元素的化学性质与原子结构中的______关系最密切;
(3)研究表明:在上表同一横行,从左至右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强;在同一纵行中,从上到下,原子失去电子的能力逐渐增强,得到电子的能力逐渐减弱.上表中,失去电子能力最强的原子是______(填元素符号). Deanlily71年前1
Deanlily71年前1 -
 shang34jk3000 共回答了14个问题
shang34jk3000 共回答了14个问题 |采纳率85.7%解题思路:(1)根据元素原子最外层电子数的特点:金属元素的原子最外层电子的数目一般少于4,进行解答;
(2)根据元素的化学性质与原子核外的最外层电子数有密切关系,进行解答;(1)根据元素原子最外层电子数的特点:金属元素的原子最外层电子的数目一般少于4,在化学反应中容易得到电子达到稳定结构,可知:第11号元素最外层电子的数目为1属于非金属元素,在化学反应中容易失去电子;
(2)元素的化学性质与原子核外的最外层电子数有密切关系;
(3)在同一纵行中,从上到下,原子失去电子的能力逐渐增强,所以钠原子失去电子能力最强.
故答案为:(1)金属(2)最外层电子数;(3)Na点评:
本题考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;元素的简单分类.
考点点评: 本题考查元素原子最外层电子数的特点及与化学性质的关系和元素周期表的知识理解与应用.1年前查看全部
- 元素周期表是学习和研究化学的重要工具,它的内容十分丰富.如表是依据元素周期表画出的1~18号元素的原子结构示意图.我对它
元素周期表是学习和研究化学的重要工具,它的内容十分丰富.如表是依据元素周期表画出的1~18号元素的原子结构示意图.我对它进行研究:
(1)原子序数为16的元素名称是______,在化学反应中,该元素的原子容易______电子,;原子序数为11的元素属于______元素,上述两种元素所形成的化合物的化学式为______.
(2)我发现如下规律:
①原子最外层电子数一般不超过8个;
②金属元素的原子最外层电子数一般少于4个,非金属元素的原子原子最外层电子数一般多于4个;
③______
④______;
⑤______. lcs20041年前1
lcs20041年前1 -
 564167842 共回答了19个问题
564167842 共回答了19个问题 |采纳率100%解题思路:(1)根据原子序数熟记前20号元素名称;在化学反应中,根据元素原子的最外层电子多少判定得失电子数目,推测化合价,书写化学式.
(2)根据元素周期律及图表中的信息进行分析解答.(1)根据元素周期表可知,原子序数为16的元素名称是硫,最外层电子数是6,在化学反应中容易得到两个电子,变成硫离子;原子序数为11的元素是钠,属于金属元素,这两种元素可形成硫化钠;故答案为:硫;得;金属;Na2S;
(2)根据原子结构示意图的变化规律可知:电子层数等于周期数;同一周期中最外层电子数由1-8依次排列;同一纵行,原子最外层电子数相同.
故答案为:电子层数等于周期数;同一周期中最外层电子数由1-8依次排列;同一纵行,原子最外层电子数相同.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对元素周期律和元素的性质与最外层电子数的关系的理解与掌握,要能在解题中灵活应用.1年前查看全部
- 元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:

(1)第16号元素属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“得”或“失”)电子;
(2)元素的化学性质与原子结构中的______数关系密切;
(3)此表纵行排列的依据是______;此表横行排列的依据是______.
(4)我发现如下规律:
①原子序数与元素原子核电荷数在数值上相等;
②______;
③______. 非常观点1年前1
非常观点1年前1 -
 xyhwsl 共回答了22个问题
xyhwsl 共回答了22个问题 |采纳率95.5%解题思路:(1)根据元素原子最外层电子数的特点:非金属元素的原子最外层电子的数目一般多于4,在化学反应中容易得到电子达到稳定结构,进行解答;(2)根据元素的化学性质与原子核外的最外层电子数有密切关系:电子数少于四个的一般容易失去电子形成阳离子,电子数少于八个而多于或等于四个的一般容易得到电子形成阴离子,电子数为八个的化学性质一般稳定,不容易发生化学变化;进行解答;(3)根据在同一个族中,电子层数的变化或最外层电子数的特点等或从上到下核电荷数变化特点进行分析解答;(4)依据表中信息;进行分析解答.(1)根据元素原子最外层电子数的特点:非金属元素的原子最外层电子的数目一般多于4,在化学反应中容易得到电子达到稳定结构,可知:第16号元素属于非金属元素;故答案为:非金属;得;
(2)元素的化学性质与原子核外的最外层电子数有密切关系;故答案为:最外层电子;
(3)根据在同一个族中,从上到下最外层电子数相等,同一横行的从左到右电子层数相同;故答案为:最外层电子数相等;电子层数相同;
(4)发现如下规律:原子中的质子数=核外电子数;同一横行的从左到右最外层电子数依次增大;故答案为:②原子中的质子数=核外电子数;③同一横行的从左到右最外层电子数依次增大.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查元素原子最外层电子数的特点及与化学性质的关系和元素周期表的知识理解与应用.1年前查看全部
- 元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
(1)第16号元素属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“得”或“失”)电子;
(2)在同一周期中,各元素的原子结构呈现的规律有______;
(3)写出由原子序数为1、7、8的三种元素所组成的一种化合物的化学式______. 东方高阳1年前1
东方高阳1年前1 -
 dai1318 共回答了10个问题
dai1318 共回答了10个问题 |采纳率90%解题思路:(1)根据元素周期表可知,第12号元素名称、由其汉语名称可知其元素种类、由最外层电子数可知得失电子情况;
(2)根据元素周期律,同一周期中,随质子数或原子序数的递增(或从左到右)各原子的(最外层)电子数依次增多,进行解答.
(3)根据元素周期表可知原子序数为1的元素为H,原子序数为8的元素是O,原子序数为7的元素是N;(1)根据元素周期表可知,第16号元硫元素,它属于非金属元素,它的原子的最外层有6个电子,在化学反应中容易得电子;
(2)根据元素周期律,同一周期中,随质子数或原子序数的递增(或从左到右)各原子的(最外层)电子数依次增多,
(3)根据元素周期表可知原子序数为1的元素为H,原子序数为8的元素是O,原子序数为7的元素是N,由氮、氢、氧三种元素组成的化合物的化学式可以为:HNO2或NH4OH或HNO3
故答案为:(1)非金属;得;(2)从左到右各原子的质子数依次递增;(3)HNO2或NH4OH或HNO3
.点评:
本题考点: 元素周期表的特点及其应用.
考点点评: 了解元素周期表的特点及其应用;核外电子在化学反应中的具体作用是解题的关键.1年前查看全部
- 元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1~18号元素的原子结构示意图.小明同
元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1~18号元素的原子结构示意图.小明同学对它进行研究:
(1)原子序数为18的元素名称是氩,在化学反应中,该元素的化学性质______ (填“活泼”或“不活泼”);
(2)小明发现如下规律:原子序数与元素原子核电荷数在数值上相等.请帮助他再找出两条规律:
①______②______③______. 飞天鱼20021年前1
飞天鱼20021年前1 -
 46昂首 共回答了17个问题
46昂首 共回答了17个问题 |采纳率94.1%解题思路:(1)根据原子结构示意图的特点:氩原子最外层上有8个电子,化学性质不活泼.(2)根据元素周期律及图表中的信息进行分析解答.(1)根据原子结构示意图的特点,氩原子最外层上有8个电子,化学性质不活泼;(2)根据元素周期律及图表中的信息可总结:电子层数等于周期数;同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同;最右纵行的原子结构均为稳定结构;同一周期原子的最外层电子数从左到右逐渐增加;
故答案为:(1)不活泼;(2)①原子核电荷数等于核外电子数;②原子核电荷数等于核内质子数;③同一周期中,原子核电荷数从左向右依次增加.(合理即可)点评:
本题考点: 元素周期表的特点及其应用.
考点点评: 本题考查学生对元素周期律的理解与掌握,并能灵活应用的能力.1年前查看全部
- 元素周期表是我们学习化学和研究化学的重要工具.如图所示是元素周期表中1~18号元素原子核外电子排布,请你对它进行研究:
元素周期表是我们学习化学和研究化学的重要工具.如图所示是元素周期表中1~18号元素原子核外电子排布,请你对它进行研究:

(1)稀有气体原子最外层电子数为______个(He除外,为2个),达到稳定结构,所以稀有气体化学性质稳定;金属原子最外层电子数一般<4个,容易______电子,变成______离子;非金属原子的最外层电子数一般≥4个,容易______电子,变成______离子.
(2)第11号元素名称是______,它在化学反应中容易______电子,它的离子符号为______;第17号元素名称是______,它在化学反应中容易______电子,它的离子符号为______.这两种离子相互作用就形成了______(填一种具体物质的名称) 奇搜搜1年前1
奇搜搜1年前1 -
 123dbt 共回答了20个问题
123dbt 共回答了20个问题 |采纳率90%解题思路:(1)根据元素原子最外层电子数的特点,最外层电子数与得失电子的关系考虑;(2)根据元素的化学性质与原子核外的最外层电子数有密切关系,离子的写法回答本题.(1)由图示可知稀有气体原子最外层电子数为8(He除外,为2个),带正电荷的离子属于阳离子,带负电荷的离子属于阴离子,金属原子最外层电子数一般<4个,易失去电子变成阳离子;非金属原子的最外层电子数一般≥4个,容易得到电子变成阴离子;
(2)由图示可知第11号元素名称是钠,最外层电子数是1,易失去电子,带一个单位正电荷,所以钠离子为:Na+;第17号元素名称是氯,最外层电子数是7,易得到1个电子,带一个单位负电荷,所以离子是Cl-;由于钠显+1价,氯显-1价,所以化学式是:NaCl,名称为氯化钠.
故答案为:(1)8;失去;阳;得到;阴;(2)钠;失去;Na+;氯;得到;Cl-;氯化钠.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查元素原子最外层电子数的特点及与化学性质的关系和元素周期表的知识理解与应用.1年前查看全部
- 已知1~18号元素的离子 a W 3 + 、 b X + 、 c Y 2 - 、 d Z - 都具有相同的电子层结构,下
已知1~18号元素的离子 a W 3 + 、 b X + 、 c Y 2 - 、 d Z - 都具有相同的电子层结构,下列关系正确的是( )
A.a-3=c+2 B.质子数a>b>c>d C.离子的还原性Y 2 - <Z - D.离子半径X + < W 3 + < Y 2 - < Z -  无风清凉1年前1
无风清凉1年前1 -
 泪清目明 共回答了21个问题
泪清目明 共回答了21个问题 |采纳率90.5%A
1年前查看全部
- 元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1~18号元素的原子结构示意图.小明同
元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1~18号元素的原子结构示意图.小明同学对它进行研究:

(1)原子序数为18的元素名称是氩,在化学反应中,该元素的化学性质______(填“活泼”或“不活泼”);原子序数为3的元素属于______(填“金属”或“非金属”)元素.
(2)小明发现如下规律:原子序数与元素原子核电荷数在数值上相等.请帮助他再找出两条规律:
①______;②______. 做客的小猫1年前1
做客的小猫1年前1 -
 hdmsepc 共回答了25个问题
hdmsepc 共回答了25个问题 |采纳率80%解题思路:(1)根据原子结构示意图的特点:氩原子最外层上有8个电子,化学性质不活泼.金属元素的最外层电子数一般少于4;
(2)根据元素周期律及图表中的信息进行分析解答.(1)根据原子结构示意图的特点,氩原子最外层上有8个电子,化学性质不活泼.金属元素的最外层电子数一般少于4;锂原子最外层上有1个电子,易失去一个电子,属于金属元素.
(2)根据元素周期律及图表中的信息可总结:
电子层数等于周期数;同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同;最右纵行的原子结构均为稳定结构;同一周期原子的最外层电子数从左到右逐渐增加;
故答案为:(1)不活泼,金属
(2)同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同;(或最右纵行的原子结构均为稳定结构;或同一周期原子的最外层电子数从左到右逐渐增加).点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对元素周期律的理解与掌握,并能灵活应用的能力.1年前查看全部
- (4分)下表是元素周期表中的1~18号元素原子核外电子排布,我们对它进行研究:
(4分)下表是元素周期表中的1~18号元素原子核外电子排布,我们对它进行研究:

(1)写出硫元素的一种氧化物的化学式 。
(2)写出质子数为1、6、8、11四种元素组成的可以治疗胃酸过多物质的化学式: 。
(3) 表示一种元素的两种粒子,它们属于同一种元素的依据是 。
表示一种元素的两种粒子,它们属于同一种元素的依据是 。
(4)图中He与Ne、Ar原子最外层电子数不一样,但都处在每周期的结尾处,从原子结构上分析其原因 。 缘来是你CUI1年前1
缘来是你CUI1年前1 -
 火浴修罗 共回答了13个问题
火浴修罗 共回答了13个问题 |采纳率84.6%(1)SO 2 或SO 3 (2)NaHCO 3 (3)这两种微粒的质子数相同
(4)氦原子只有一个电子层,只能容纳2个电子,与Ne、Ar原子一样,它们的最外层电子数都达到稳定结构
1年前查看全部
- 如图所示框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素.
如图所示框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素.
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出).请回答下列问题: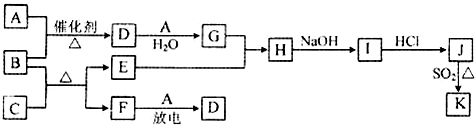
(1)D的化学式为______;F的电子式为______.
(2)A与B生成D的反应化学方程式为4NH3+5O2
4NO+6H2O催化剂 .△ 4NH3+5O2.
4NO+6H2O催化剂 .△
(3)B和C反应的化学方程式为3CuO+2NH3
3Cu+N2 +3H2O△ .3CuO+2NH3.
3Cu+N2 +3H2O△ .
(4)J、K是同种金属的不同氯化物,K为白色沉淀.写出SO2还原J生成K的离子方程式2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-△ .2Cu2++2Cl-+SO2+2H2O.
2CuCl↓+4H++SO42-△ . xgth011年前1
xgth011年前1 -
 笛菲 共回答了21个问题
笛菲 共回答了21个问题 |采纳率90.5%解题思路:E为红色金属单质,应为Cu,则C为CuO,B为具有刺激性气味的气体,应为NH3,A为O2,D为NO,G为HNO3,F为N2 ,H为Cu(NO3)2,I为Cu(OH)2,J为CuCl2,K为CuCl,结合对应物质的性质以及题目要求可解答该题.E为红色金属单质,应为Cu,则C为CuO,B为具有刺激性气味的气体,应为NH3,A为O2,D为NO,G为HNO3,F为N2 ,H为Cu(NO3)2,I为Cu(OH)2,J为CuCl2,K为CuCl,(1)由以上分析可知D为NO,F为N2 ,电子式为
 ,故答案为:NO;
,故答案为:NO; ;
;
(2)氨气和氧气在催化剂作用下发生氧化还原反应,方程式为故答案为:4NH3+5O2
催化剂
.
△4NO+6H2O,故答案为:4NH3+5O2
催化剂
.
△4NO+6H2O,
(3)氧化铜与氨气在加热条件下可发生氧化还原反应生成铜、氮气和水,反应的方程式为故答案为:4NH3+5O2
催化剂
.
△4NO+6H2O,
故答案为:3CuO+2NH3
△
.
3Cu+N2 +3H2O;
(4)由题给信息可知氯化铜与二氧化硫发生氧化还原反应生成氯化亚铜,反应的离子方程式为2Cu2++2Cl-+SO2+2H2O
△
.
2CuCl↓+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O
△
.
2CuCl↓+4H++SO42-.点评:
本题考点: 无机物的推断;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查无机物的推断,题目难度中等,注意以E为解答该题的突破口,结合物质的转化关系进一步推断其它物质,学习中注意相关物质的性质的把握.1年前查看全部
- X和Z是由A、B、C三种元素(A、B、C均为1~18号元素)形成的两种化合物.已知元素A在两种化合物中的质量分数分别为2
X和Z是由A、B、C三种元素(A、B、C均为1~18号元素)形成的两种化合物.已知元素A在两种化合物中的质量分数分别为29.1%和17.0%,且B、C的质量比在两种化合物中是相同的.已知化合物X的化学式为A2B2C3,z的化学式为A2BxCy.它的溶液跟盐酸混合时有气体和浅黄色沉淀生成,该气体是形成酸雨的主要原因.则元素A是______,B是______,C是______(填元素符号),Z的化学式为______.
 雨荔秋垣1年前1
雨荔秋垣1年前1 -
 fdgddfd 共回答了14个问题
fdgddfd 共回答了14个问题 |采纳率85.7%解题思路:形成酸雨的气体为二氧化硫,浅黄色沉淀 为硫,确定出BC元素种类为硫和氧,根据A在X化合物中质量分数确定出A元素的种类,再根据质量分数确定出xy的原子个数比.Z与盐酸反应生成形成酸雨的气体(即二氧化硫)和浅黄色沉淀,则为单质S,故Z中一定含有硫元素和氧元素,即B为硫元素,C为氧元素,根据X中A的质量分数为29.1%,可知:29.1%=[A×2/A×2+32×2+16×3]×100% 求出A=23,故A元素为钠元素,根据Z中A元素的质量分数为17%可知:17%=[23×2/23×2+32×x+16×y]×100%,求出2x+y≈14.因为且B、C的质量比在两种化合物中是相同的,所以[x/y]=[2/3] 综上,可得x=4,y=6,故Z的化学式为Na2S4O6
故答案为 Na,S,O,Na2S4O6点评:
本题考点: 物质的鉴别、推断;元素的符号及其意义;化学式的书写及意义.
考点点评: 根据反应前后元素种类不变以及反应现象确定出元素种类,再根据质量分数确定原子个数,灵活运用质量分数的计算公式是解答本题关健.1年前查看全部
- 在1~18号元素中,有A、B、C、D、E五种元素,它们的原子序数依次增大.A、B元素原子的电子层数均与其未成对电子数相等
在1~18号元素中,有A、B、C、D、E五种元素,它们的原子序数依次增大.A、B元素原子的电子层数均与其未成对电子数相等,且A和B能形成AB2型化合物.D3+离子的最外层电子排布式为ns2npn+4,C、D、E三元素原子的最外层电子数之和为10,它们的最高价氧化物水化物之间,任意两种都能发生反应,生成盐和水,
它们的元素符号:
写出C和D的最高价氧化物水化物之间的离子方程式
写出AB2型化合物与⑵的主要产物发生反应的离子方程式:
是NaAlO2 甜又甜1年前2
甜又甜1年前2 -
 ertrtytr 共回答了16个问题
ertrtytr 共回答了16个问题 |采纳率87.5%先判断A与B,这要用到电子排布式,因为A、B元素原子的电子层数均与其未成对电子数相等,
满足条件的元素的电子排布式为:1S1(H),1S2.2S2.2P2(C),1S2.2S2.2P4(O),
1S2.2S2.2P6.3S2.3P3(P),因为A和B能形成AB2型化合物,所以A为碳,B为氧
D更简单,D3+为ns2npn+4,则n+41,所以D为Al,又因为它们的最高价氧化物水化物之间,任意两种都能发生反应,生成盐和水,容易想到C是Na,所以E是硫
1.A=C,B=O,C=Na,D=Al,E=S
2.NaOH+Al(OH)3=NaAlO2+2H20
3.⑵的主要产物是啥?补充1年前查看全部
- 元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1~18号元素的原子结构示意图.我对它
元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1~18号元素的原子结构示意图.我对它进行研究:
(1)原子序数为16的元素名称是______,在化学反应中,该元素的原子容易______电子,变成______(填符号);原子序数为8的元素属于______元素(填金属或非金属),上述两种元素所形成的化合物的化学式为______.
(2)我发现如下规律:
①原子最外层电子数一般不超过8个;
②金属元素的原子最外层电子数一般少于4个,非金属元素的原子原子最外层电子数一般多于4个;
③______;
④______;
⑤______. royalvan1年前1
royalvan1年前1 -
 chen8383 共回答了23个问题
chen8383 共回答了23个问题 |采纳率91.3%解题思路:(1)根据原子序数熟记前20号元素名称;在化学反应中,根据元素原子的最外层电子多少判定得失电子数目,推测化合价,书写化学式.
(2)根据元素周期律及图表中的信息进行分析解答.(1)根据元素周期表可知,原子序数为16的元素名称是硫,最外层电子数是6,在化学反应中容易得到两个电子,变成硫离子;原子序数为8的元素是氧,属于非金属元素,这两种元素可形成二氧化硫或三氧化硫.故答案为:硫;得; S2-; 非金属;SO2或SO3;
(2)根据原子结构示意图的变化规律可知:电子层数等于周期数;同一周期中最外层电子数由1-8依次排列;同一纵行,原子最外层电子数相同,故答案为:电子层数等于周期数;同一周期中最外层电子数由1-8依次排列;同一纵行,原子最外层电子数相同.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对元素周期律和元素的性质与最外层电子数的关系的理解与掌握,不能在解题中灵活应用.1年前查看全部
- 元素周期表是化学和研究化学的重要工具,它的内容十分丰富,下图是依据元素周期表画出的1~18号元素的原子结构示意图.请对它
元素周期表是化学和研究化学的重要工具,它的内容十分丰富,下图是依据元素周期表画出的1~18号元素的原子结构示意图.请对它进行探究

(1)原子序数为17的元素名称是______,在化学反应中,该元素的原子容易______(填“得”或“失”)电子;原子序数为13的元素属于______元素(填“金属”或“非金属”).
(2)请从上表中总结出一条原子排布的规律______.
(3)研究表明:第二周期从3号到9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力增大,故原子半径逐渐减小.请判断:钠原子半径______镁原子半径(填“<”或“>”或“﹦”). 蓝铃草1年前1
蓝铃草1年前1 -
 冷紫涵 共回答了17个问题
冷紫涵 共回答了17个问题 |采纳率100%解题思路:(1)根据原子结构示意图和金属元素的原子最外层电子数一般少于4个,非金属元素的原子最外层电子数一般多于4个,非金属元素在化学反应中易得到电子,形成阴离子,进行解答;
(2)根据原子结构示意图的变化规律进行分析总结来解答;
(3)在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小.(1)根据金属元素的原子最外层电子数一般少于4个,可知原子序数为13的元素属于金属元素;非金属元素的原子最外层电子数一般多于4个,可知原子序数为17的元素为非金属元素,名称是氯;非金属元素在化学反应中易得到电子,形成阴离子;
(2)从上表中总结出规律有:①原子最外层电子数一般不超过8个;(或金属元素的原子最外层电子数一般少于4个,非金属元素的原子最外层电子数一般多于4个)
(3)钠和镁的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力增大,故原子半径逐渐减小.
故答案为:(1)氯元素;得;金属;
(2)每一横行电子层数相等;或每一横行最外层电子数依次增加;或每一纵行最外层电子数相同;或每一纵行最外层电子数依次增加…;
(3)>.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生根据元素周期表、周期律及题中所给的信息解题的能力.1年前查看全部
- 下图是1~18号元素原子最外层电子数与原子核电荷数的关系图.
下图是1~18号元素原子最外层电子数与原子核电荷数的关系图.
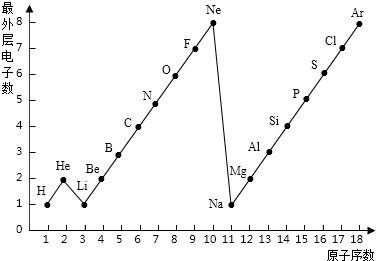
请回答下列问题:
(1)l~18号元素中属于稀有气体元素的有______(填元素符号).
(2)He和Be元素的原子最外层均有2个电子,它们的化学性质是否相似?______.(填“相似”或“不相似”).
(3)某元素的原子序数为16,它在化学反应中一般易______电子(填“得到”或“失去”),它与地壳中含量最多的金属元素形成化合物的化学式为______. zb6301年前1
zb6301年前1 -
 liuhulove 共回答了17个问题
liuhulove 共回答了17个问题 |采纳率76.5%解题思路:(1)根据最外层电子数可分析稀有气体元素;
(2)根据原子结构来分析它们的性质是否相似;
(3)利用原子结构中的最外层电子数来分析其性质,地壳中含量最多的金属元素为铝元素,利用最外层电子数来分析其化合价,然后书写化学式.(1)因有一个电子层时,电子数为2即为稳定结构,则He为稀有气体,有两个以上电子层时,最外层电子数为8的为稳定结构,由图可知则Ne、Ar为稀有气体,故答案为:He、Ne、Ar;
(2)因因He有一个电子层,则最外层电子数是2为稳定结构,化学性质稳定,但Be元素的原子有两个电子层,最外层电子数是2,则容易失去2个电子而满足稳定结构,化学性质较活泼,则它们的性质不相似,故答案为:不相似;
(3)因元素的原子序数为16的是S元素,其最外层电子数为6,则容易得到2个电子而满足最外层8电子的稳定结构,在化合物中化合价为-2价,而地壳中含量最多的金属元素为铝元素,其最外层电子数为3,容易失去最外层电子而满足最外层8电子的稳定结构,再化合物中的化合价为+3价,则
+3
Al
−2
S,由化合物中正负化合价的代数和为0,则化合价相互交叉,可得化学式为Al2S3,故答案为:Al2S3.点评:
本题考点: 核外电子在化学反应中的作用;元素的符号及其意义;化学式的书写及意义.
考点点评: 本题考查学生利用图中的最外层电子数来分析元素,并利用最外层电子数来分析性质,能利用化合价来书写物质的化学式,注重了化学用语的训练.1年前查看全部
- 1~18号元素中,各个元素的特点是
 dd手里的啥1年前1
dd手里的啥1年前1 -
 马瘦风西 共回答了16个问题
马瘦风西 共回答了16个问题 |采纳率68.8%嗯,与中高考有关么?说具体一点.
我个人认为,考试重点元素一号氢元素,六号碳元素,七号氮元素,八号氧元素,九号氟元素,十一号钠元素,十三号铝元素,十四号硅元素,十六号硫元素,十七号氯元素.有时候也会有十二号镁元素.
考试重点不仅仅是单质的特点,更重要的是他们的化合物.1年前查看全部
- (13分)A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质。
(13分)A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质。
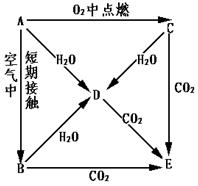
(1)写出A→E的化学式:A 、B 、C 、D 、E 。
(2)写出A→D反应的离子方程式
A→D 。
(3)写出C→D、C→E反应的化学方程式,并标出电子转移的方向和数目。
C→D 。
C→E 。 有风斋主1年前1
有风斋主1年前1 -
 tyot 共回答了17个问题
tyot 共回答了17个问题 |采纳率88.2%(1)A.Na; B.Na 2 O; C. Na 2 O 2 ; D. NaOH; E. Na 2 CO 3 ;(各1分)
(2)2Na+2H 2 O=2Na + +2OH - +H 2 (各2分)
(3) 2Na 2 O 2 +2H 2 O=4NaOH+O 2 ; 2Na 2 O 2 +2CO 2 =2Na 2 CO 3 +O 2 (各3分)
略1年前查看全部
- 元素周期表共有7个横行,18个纵行.每一个横行叫做一个周期,每一个纵行叫一个族.下表是依据元素周期表画出的1~18号元素
元素周期表共有7个横行,18个纵行.每一个横行叫做一个周期,每一个纵行叫一个族.下表是依据元素周期表画出的1~18号元素的原子结构示意图,据表回答:
(1)第12号元素的名称是______,在化学反应中该元素的原子比较容易______(填“得到”或“失去”)电子;
(2)有一种金属单质,现在世界上年产量居金属中的第二位(元素在地壳中含量最多的金属元素),该金属是______(填原子序数)号元素,它能在8号元素的单质中燃烧发出耀眼的白光,其化学方程式为______.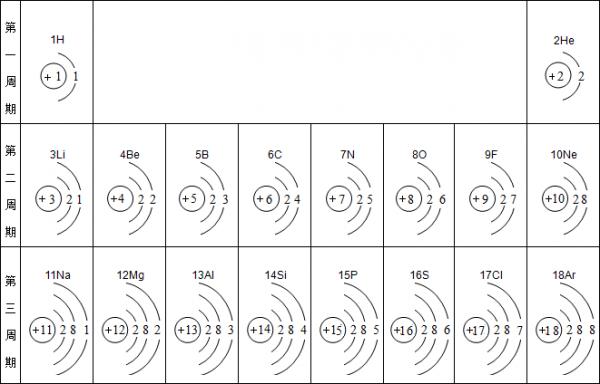
 feixia1081年前1
feixia1081年前1 -
 miya99 共回答了16个问题
miya99 共回答了16个问题 |采纳率100%(1)利用图表信息可知12号元素是镁,最外层电子数小于4,容易失去电子;
故答案为:
镁;失去;
(2)地壳中含量最多的金属元素是铝,铝与氧气在点燃的条件下生成氧化铝;
故答案为:
13;4Al+3O 2
点燃
.
2Al 2 O 3 .1年前查看全部
- 下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素.
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素.
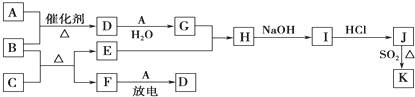
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出).请回答下列问题:
(1)F的组成元素在元素周期表中的位置______.
(2)B和C反应的化学方程式为3CuO+2NH3
3Cu+N2+3H2O△ .3CuO+2NH3.
3Cu+N2+3H2O△ .
(3)E与G的稀溶液反应的离子方程式为______.
(4)J、K是同种金属的不同氯化物,K为白色沉淀.写出SO2还原J生成K的离子方程式______. yj274230991年前1
yj274230991年前1 -
 颖漩 共回答了24个问题
颖漩 共回答了24个问题 |采纳率91.7%解题思路:E为红色金属单质,应为Cu,C为黑色氧化物,则C为CuO,B为具有刺激性气味的气体,应为NH3,可与CuO在在加热条件下发生氧化还原反应生成单质Cu,生成的气体单质F为N2,可与氧气在放电条件下反应生成NO,则A为O2,D为NO,G为HNO3,H为Cu(NO3)2,I为Cu(OH)2,J为CuCl2,J、K是同种金属的不同氯化物,K为白色沉淀,应为CuCl,据此答题.E为红色金属单质,应为Cu,C为黑色氧化物,则C为CuO,B为具有刺激性气味的气体,应为NH3,可与CuO在在加热条件下发生氧化还原反应生成单质Cu,生成的气体单质F为N2,可与氧气在放电条件下反应生成NO,则A为O2,D为NO,G为HNO3,H为Cu(NO3)2,I为Cu(OH)2,J为CuCl2,J、K是同种金属的不同氯化物,K为白色沉淀,应为CuCl,
(1)由以上分析可知F为N2,氮元素在周期表第二周期第ⅤA族,故答案为:第二周期第ⅤA族;
(2)B为NH3,可与CuO在在加热条件下发生氧化还原反应生成单质Cu,反应的方程式为3CuO+2NH3
△
.
3Cu+N2+3H2O,
故答案为:3CuO+2NH3
△
.
3Cu+N2+3H2O;
(3)G为HNO3,稀硝酸与铜反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)SO2还原CuCl2生成CuCl的离子方程式为2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-,故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-.点评:
本题考点: 无机物的推断.
考点点评: 本题考查无机物的推断,难度中等,本题侧重于常见元素化合物知识的考查,注重于物质的工业生成、物理性质的考查,学习中注意牢固把握相关基础知识.1年前查看全部
- 元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
元素周期表是学习化学的重要工具.下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:

(1)第16号元素属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“得”或“失”)电子;
(2)元素的化学性质与原子结构中的______数关系密切;
(3)在同一族中,各元素的原子结构呈现的规律有______(任写一点);
(4)研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.我分析第三周期从11~17号元素原子半径变化规律是______. 乐水无忧1年前1
乐水无忧1年前1 -
 风舞轩 共回答了11个问题
风舞轩 共回答了11个问题 |采纳率90.9%解题思路:(1)根据元素原子最外层电子数的特点:非金属元素的原子最外层电子的数目一般多于4,在化学反应中容易得到电子达到稳定结构,进行解答;
(2)根据元素的化学性质与原子核外的最外层电子数有密切关系:电子数少于四个的一般容易失去电子形成阳离子,电子数少于八个而多于或等于四个的一般容易得到电子形成阴离子,电子数为八个的化学性质一般稳定,不容易发生化学变化;进行解答;
(3)根据在同一个族中,电子层数的变化或最外层电子数的特点等或从上到下核电荷数变化特点进行分析解答;
(4)依据题中信息从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.进行分析解答.(1)根据元素原子最外层电子数的特点:非金属元素的原子最外层电子的数目一般多于4,在化学反应中容易得到电子达到稳定结构,可知:第16号元素属于非金属元素;故答案为:非金属;得;
(2)元素的化学性质与原子核外的最外层电子数有密切关系;故答案为:最外层电子;
(3)根据在同一个族中,电子层数的变化或最外层电子数的特点等或从上到下核电荷数变化特点可知:电子层数递增,或最外层电子数相等,或从上到下核电荷数增大等;故答案为:电子层数递增 或最外层电子数相等 或从上到下核电荷数增大等;
(4)依据题中信息从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.所以从11~17号元素原子半径变化规律是;逐渐减小;故答案为:逐渐减小.点评:
本题考点: 元素周期表的特点及其应用;原子的定义与构成;核外电子在化学反应中的作用;原子结构示意图与离子结构示意图.
考点点评: 本题考查元素原子最外层电子数的特点及与化学性质的关系和元素周期表的知识理解与应用.1年前查看全部
- 在短周期内1~18号元素内,用元素符号或化学式回答相关的问题.
在短周期内1~18号元素内,用元素符号或化学式回答相关的问题.
(1)除稀有气体外,原子半径最大的是______;离子半径最大的是______
(2)最高价氧化物对应的水化物呈两性的物质是______
(3)最高价氧化物对应的水化物酸性最强的是______ lljkent1年前1
lljkent1年前1 -
 CLON23 共回答了13个问题
CLON23 共回答了13个问题 |采纳率84.6%钠,硫离子,铝,氯1年前查看全部
- a、b、c、d是1~18号元素,a、b元素的阳离子和c、d元素的阴离子都具有相同的电子层结构,且b元素原子的最外层电子数
a、b、c、d是1~18号元素,a、b元素的阳离子和c、d元素的阴离子都具有相同的电子层结构,且b元素原子的最外层电子数比a元素原子的最外层电子数少,c的阴离子所带的负电荷比d的阴离子所带的负电荷多,则它们的核电荷数大小关系是( )
A. a>b>d>c
B. c>b>a>b
C. a>b>c>d
D. b>a>c>d tingjing1年前1
tingjing1年前1 -
 公理自在人人心 共回答了24个问题
公理自在人人心 共回答了24个问题 |采纳率95.8%解题思路:因为a、b元素的阳离子和c、d元素的阴离子都具有相同的电子层结构,又知阳离子是原子失去电子造成的,阴离子是原子得到电子造成的,根据在原子中,核电荷数=质子数=核外电子数,可推断a、b的核电荷数与c、d的核电荷数大小;由b元素原子的最外层电子数比a元素原子的最外层电子数少,可推断出a、b的核电荷数大小;由c的阴离子所带的负电荷比d的阴离子所带的负电荷多,可推断出c、d的核电荷数大小.因为a、b元素的阳离子和c、d元素的阴离子都具有相同的电子层结构,又知阳离子是原子失去电子造成的,阴离子是原子得到电子造成的,根据在原子中,核电荷数=质子数=核外电子数,可推断a、b的核电荷数一定比c、d的核电荷数大;又因为b元素原子的最外层电子数比a元素原子的最外层电子数少,说明a元素原子的电子数比b元素原子的电子数多,根据在原子中,核电荷数=质子数=核外电子数,可推断出a比b的核电荷数大;由c的阴离子所带的负电荷比d的阴离子所带的负电荷多,说明c原子比d原子得到的电子多,根据在原子中,核电荷数=质子数=核外电子数,可推断出c比d的核电荷数小.
故选A.点评:
本题考点: 原子的定义与构成;原子和离子的相互转化.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 已知1~18号元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( ).
已知1~18号元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( ).
A.质子数 c > b
B.离子的还原性Y2- > Z-
C.氢化物的稳定性 H 2Y < HZ
D.原子半径 X < W
那个是 aW3+ zhl1001年前3
zhl1001年前3 -
 蓝玉容峙 共回答了22个问题
蓝玉容峙 共回答了22个问题 |采纳率95.5%化学啊 选择C1年前查看全部
- 已知1~18号元素中,元素X、Y最外层分别有n个和(m-5)个电子,次外层分别有(n+2)和m个电子,据此可推断元素x和
已知1~18号元素中,元素X、Y最外层分别有n个和(m-5)个电子,次外层分别有(n+2)和m个电子,据此可推断元素x和y能形成化合物的分子式为( )
A.Y2X3
B.X2Y3
C.X2Y
D.XY2 ngfriend02981年前1
ngfriend02981年前1 -
 猴戏周 共回答了20个问题
猴戏周 共回答了20个问题 |采纳率95%解题思路:元素X、Y的原子序数都小于18.X元素原子最外层电子数为n,次外层电子数为(n+2),则X元素的次外层为L层,有3个电子层,则n+2=8,所以n=8-2=6,故X为硫元素,
Y元素原子最外层电子数为m-5,需满足m-5>0,m>5,次外层电子数为m,则Y元素的次外层为L层,m=8,有3个电子层,则m-5=8-5=3,故Y为铝元素,结合物质的性质即可解答.元素X、Y的原子序数都小于18.X元素原子最外层电子数为n,次外层电子数为(n+2),则X元素的次外层为L层,有3个电子层,则n+2=8,所以n=8-2=6,故X为硫元素,通常显-2价,Y元素原子最外层电子数为m-5,需满足m-5>0...
点评:
本题考点: 原子结构与元素的性质.
考点点评: 本题考查了位置结构和性质的关系,题目难度不大,理解核外电子排布规律,推断元素是解题关键.1年前查看全部
- 元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1~18号元素的原子结构示意图.
元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1~18号元素的原子结构示意图.
(1)原子序数为17的元素名称是______,在化学反应中,该元素的原子容易______(填“得”或“失”)电子;原子序数为13的元素属于______元素(填“金属”或“非金属”).原子序数为9的元素在化合物中一般表现为______价.
(2)从表中我发现如下规律:
①原子序数与元素原子核电荷数在数值上相等;
②______. wolfyy1311年前1
wolfyy1311年前1 -
 saiGG 共回答了19个问题
saiGG 共回答了19个问题 |采纳率84.2%解题思路:(1)由元素周期表,可知元素名称,根据“原子序数=核内质子数=核外电子数=核电荷数”,可知核外电子;由汉字名称,可知其元素分类;由原子序数可知核外电子数,可知电子层排布,可知得失电子情况,而其化合价与离子的符号同,数值等;
(2)从表中发现如下规律:①了解原子序数与元素原子核电荷数在数值上的关系;②归纳总结每周期从左到右有哪些规律;③归纳总结从上到下,有哪些规律.(1)由元素周期表,可知原子序数为17的元素名称为氯元素;它的最外层电子为7,易“得”1个电子;原子序数为13的元素为铝元素,由汉字名称,可知其元素分类为“金属元素”;原子序数为9的元素的最外层电子为7,易得1个电子,带1个负电荷,其化合价与离子的符号同,数值等,故原子序数为9的元素在化合物中一般表现为-1价;
(2)从表中发现如下规律:①原子序数与元素原子核电荷数在数值上相等;②每周期从左到右原子的最外层电子数递增;③从左到右,各元素原子的电子层数相同;④从左到右,元素原子的原子序数依次增加;⑤同一族(从上到下)最外层电子数相同…(选一条)
故答为:(1)氯元素;得;金属;-1;
(2)每周期从左到右原子的最外层电子数递增等.点评:
本题考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;原子结构示意图与离子结构示意图;元素的简单分类.
考点点评: 了解元素周期表的特点及其应用;核外电子在化学反应中的作用;了解元素的简单分类;了解原子结构示意图与离子结构示意图的特点.1年前查看全部
- X和Z是由A、B、C三种元素(A、B、C均为1~18号元素)形成的两种化合物.已知元素A在两种化合物中的质量分数分别为2
X和Z是由A、B、C三种元素(A、B、C均为1~18号元素)形成的两种化合物.已知元素A在两种化合物中的质量分数分别为29.1%和17.0%,且B、C的质量比在两种化合物中是相同的.已知化合物X的化学式为A2B2C3,z的化学式为A2BxCy.它的溶液跟盐酸混合时有气体和浅黄色沉淀生成,该气体是形成酸雨的主要原因.则元素A是______,B是______,C是______(填元素符号),Z的化学式为______.
 xiaoyuetan1年前1
xiaoyuetan1年前1 -
 raiguo 共回答了15个问题
raiguo 共回答了15个问题 |采纳率100%解题思路:形成酸雨的气体为二氧化硫,浅黄色沉淀 为硫,确定出BC元素种类为硫和氧,根据A在X化合物中质量分数确定出A元素的种类,再根据质量分数确定出xy的原子个数比.Z与盐酸反应生成形成酸雨的气体(即二氧化硫)和浅黄色沉淀,则为单质S,故Z中一定含有硫元素和氧元素,即B为硫元素,C为氧元素,根据X中A的质量分数为29.1%,可知:29.1%=[A×2/A×2+32×2+16×3]×100% 求出A=23,故A元素为钠元素,根据Z中A元素的质量分数为17%可知:17%=[23×2/23×2+32×x+16×y]×100%,求出2x+y≈14.因为且B、C的质量比在两种化合物中是相同的,所以[x/y]=[2/3] 综上,可得x=4,y=6,故Z的化学式为Na2S4O6
故答案为 Na,S,O,Na2S4O6点评:
本题考点: 物质的鉴别、推断;元素的符号及其意义;化学式的书写及意义.
考点点评: 根据反应前后元素种类不变以及反应现象确定出元素种类,再根据质量分数确定原子个数,灵活运用质量分数的计算公式是解答本题关健.1年前查看全部
- 已知1~18号元素的离子 a W 3+ 、 b X + 、 c Y 2- 、 d Z - 都具有相同的电子层结构,下列关
已知1~18号元素的离子 a W 3+ 、 b X + 、 c Y 2- 、 d Z - 都具有相同的电子层结构,下列关系正确的是( ) A.质子数:c>d B.离子的还原性:Y 2- >Z - C.氢化物的稳定性:H 2 Y>HZ D.原子半径:X<W  herogui1年前1
herogui1年前1 -
 HL566 共回答了12个问题
HL566 共回答了12个问题 |采纳率66.7%因四种离子的电子层结构相同,所以质子数a、b、c、d的大小关系应为a>b>d>c,且Y、Z在上一周期,Y在Z的左边,Y的非金属性小于Z;W、X在下一周期,X在W的左边,X的金属性大于W.
A、质子数d>c,故A错误;
B、离子的还原性:Y 2- >Z - ,故B正确;
C、氢化物稳定性应为HZ>H 2 Y,故C错误;
D、原子半径大小关系应为X>W,故D错误;
故选B.1年前查看全部
- 下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。已知:A、F为无色气体单质,B为具有刺激性气味的气
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列全)。 
请回答下列问题
(1)B的电子式为_________________。
(2)J、K是同种金属的氯化物,且K为白色沉淀。写出SO 2 还原J生成K的离子方程式_________________________________。
(3)汽车尾气中常含有D。B在加热和催化剂存在的条件下能消除D的污染。已知:
①4NH 3 (g)+5O 2 (g) 4NO(g)+6H 2 O(g) △H=-905 kJ·mol -1
4NO(g)+6H 2 O(g) △H=-905 kJ·mol -1
②4NH 3 (g)+3O 2 (g) 2N 2 (g)+6H 2 O(g) △H=-1268 kJ·mol -1
2N 2 (g)+6H 2 O(g) △H=-1268 kJ·mol -1
则B与D反应的热化学方程式为________________________。
(4)有人认为:“表面化学”研究成果能使B和D的反应在催化剂表面进行时的效率大大提高,从而使污染物D的转化率大大提高。请你应用化学基本理论对此观点进行评价:___________________________ 来自北方的狐狸1年前1
来自北方的狐狸1年前1 -
 冰舞悠扬 共回答了17个问题
冰舞悠扬 共回答了17个问题 |采纳率88.2%1年前查看全部
- 如图是依据元素周期表画出的1~18号的元素的原子结构示意图.
如图是依据元素周期表画出的1~18号的元素的原子结构示意图. 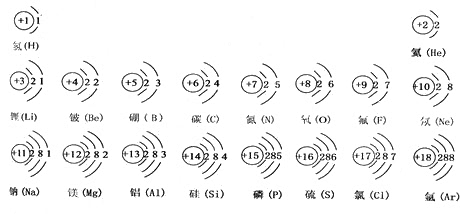
(1)原子序数为17的元素名称是______,在化学反应中,该元素的原子容易______(填“得”或“失”)电子.
(2)地壳中含量最多的金属元素的核电荷数是______,其离子符号为______,若该元素原子的相对原子质量为27,则该原子的核内中子数为______.
(3)由表中信息可发现如下规律:①原子序数与元素原子核电荷数在数值上相等;②______;③______. mmhndbsnfsn1年前1
mmhndbsnfsn1年前1 -
 空窗 共回答了16个问题
空窗 共回答了16个问题 |采纳率100%(1)根据元素周期表可查出原子序数为17的元素名称为氯;氯为非金属元素,在化学反应中易得到电子;故答案为:氯;得;
(2)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,因此地壳中含量最多的金属元素是Al;从元素周期表查出铝原子序数为13;铝离子表示为 Al 3+ ;
根据相对原子质量=质子数+中子数,可得13+x=27,则x=14;
故答案为:13;Al 3+ ;14;
(3)根据元素周期表中的信息和元素周期律可得:同一周期元素原子的电子层数相同;同一周期元素原子的最外层电子数从左到右依次增加;同一纵行元素原子的最外层电子数相同;从左到右由金属元素过度到非金属元素最终以稀有气体元素结束等
故答案为:同一周期元素原子的电子层数相同;同一周期元素原子的最外层电子数从左到右依次增加.1年前查看全部
- X、Y均是在1~18号内的元素.它们可组成化合物X2Y3,若已知Y的核电荷数为m,则X的核电荷数不可能是( )
X、Y均是在1~18号内的元素.它们可组成化合物X2Y3,若已知Y的核电荷数为m,则X的核电荷数不可能是( )
A. m+5
B. m-1
C. m-3
D. m+6 69323291年前1
69323291年前1 -
 janelsw 共回答了15个问题
janelsw 共回答了15个问题 |采纳率93.3%解题思路:根据化合物X2Y3,则X元素的化合价为+3价,Y元素的化合价为-2价,则X可能为B或Al元素,Y可能为O或S元素,还存在特殊情况为X为N元素,Y为O元素形成的化合物.A、若化合物X2Y3为Al2O3,Al的核电荷数为13,O的为8,已知Y的核电荷数为m,则X的核电荷数为m+5,故A有可能;
B、若化合物X2Y3为N2O3,N的核电荷数为7,O的为8,已知Y的核电荷数为m,则X的核电荷数为m-1,故B有可能;
C、若化合物X2Y3为Al2S3,Al的核电荷数为13,S的为16,已知Y的核电荷数为m,则X的核电荷数为m-3,故C有可能;
D、根据价序原则,化合价为奇数的,核电荷数为奇数,化合价为偶数的,核电荷数为偶数,则X、Y的核电荷数之差不可能为偶数6,因奇数和偶数的差与和还是奇数,不可能为D;
故选D.点评:
本题考点: 有关化学式的计算和推断;元素周期表的特点及其应用.
考点点评: 本题考查学生利用化合价与化学式及核电荷数的关系,学生应熟悉常见的化合物中的元素的化合价及元素的核电荷数,能利用举例的方法或价序原则来分析解答.1年前查看全部
- X和Z是由A、B、C三种元素(A、B、C均为1~18号元素)形成的两种化合物.已知元素A在两种化合物中的质量分数分别为2
X和Z是由A、B、C三种元素(A、B、C均为1~18号元素)形成的两种化合物.已知元素A在两种化合物中的质量分数分别为29.1%和17.0%,且B、C的质量比在两种化合物中是相同的.已知化合物X的化学式为A 2 B 2 C 3 ,z的化学式为A 2 B x C y .它的溶液跟盐酸混合时有气体和浅黄色沉淀生成,该气体是形成酸雨的主要原因.则元素A是______,B是______,C是______(填元素符号),Z的化学式为______.  云起时20051年前1
云起时20051年前1 -
 乐乐的麻麻 共回答了17个问题
乐乐的麻麻 共回答了17个问题 |采纳率94.1%Z与盐酸反应生成形成酸雨的气体(即二氧化硫)和浅黄色沉淀,则为单质S,故Z中一定含有硫元素和氧元素,即B为硫元素,C为氧元素,根据X中A的质量分数为29.1%,可知:29.1%=
A×2
A×2+32×2+16×3 ×100% 求出A=23,故A元素为钠元素,根据Z中A元素的质量分数为17%可知:17%=
23×2
23×2+32×x+16×y ×100%,求出2x+y≈14.因为且B、C的质量比在两种化合物中是相同的,所以
x
y =
2
3 综上,可得x=4,y=6,故Z的化学式为Na 2 S 4 O 6
故答案为 Na,S,O,Na 2 S 4 O 61年前查看全部
大家在问
- 1求走过泸定桥后的感想.
- 2从1,2,3,4,…,1996这些自然数中,最多可以取出______个数来,才能使取出的每两个数的差不等于4.
- 3(2008•宁波)A.在同一个平面内,两条直线如果不垂直,就互相平行.______
- 4以下物质的变化过程中,没有发生化学变化的是 [ ] A.吃进的食物一段时
- 5英语作文带翻译初一英语我最喜欢的老师及外貌(头发,身高)
- 6求算A楼日照时间.A楼10米高,B楼100米.B楼位于A楼正东30-50米.本地北纬28.5°,感激不尽~
- 7几道填空,大哥大姐帮帮忙,1·如果a分之5=8分之b,a和b都不是等0的自然数,那么a最大是( ),最小是( )2·小明
- 81w的小灯泡5分钟耗多少电忘了怎么算了...呵呵,
- 9除了初中的五言诗!跪求!越简单越好!高悬赏!
- 10圆木18公.长2米,一百根等于多少方
- 11数列an的前n项和Sn=n²+2n(N∈N+,n≥1),则数列通项an
- 12下面几组线段中(单位:厘米),不能组成三角形一组的是( )
- 13I don’t think he is right, ________? A.do I B.don’t I C.is h
- 14下列有关人体血管的叙述中,错误的是( ) A.人的手臂上一条条的“青筋”不是血管而是神经 B.病人到医院打点滴时,针头
- 1518和72的因数有多少

