以Na2S2O3反应研究化学反应速率的时候,若不用S2O8 2 -而用I3-或 I-浓度变化来表示,反应速度k有什么变化
 dongisking2022-10-04 11:39:541条回答
dongisking2022-10-04 11:39:541条回答是化学实验:化学反应速率和反应活化能的那个

已提交,审核后显示!提交回复
共1条回复
 feieatfire 共回答了18个问题
feieatfire 共回答了18个问题 |采纳率83.3%- 反应速率v用摩尔反应速率来表示,也就是用单位时间物质的量浓度的变化除以化学计量数.可以避免因不同物质计量数不同导致反应速率不同.
所以,用I-浓度变化来表示,是不妥的,要除以化学计量数.
用I3-,是可以的,和S2O8 2 -是相等的. - 1年前
相关推荐
- 已知反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,下列各组实验中最先出现浑浊的是( )
已知反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,下列各组实验中最先出现浑浊的是( )
组号 温度 Na2S2O3 H2SO4 H2O 体积 浓度 体积 浓度 体积 A 0℃ 10mL 0.1mol/L 10mL 0.1mol/L 0mL B 10℃ 5mL 0.1mol/L 5mL 0.1mol/L 10mL C 30℃ 5mL 0.1mol/L 5mL 0.1mol/L 10mL D 30℃ 5mL 0.2mol/L 5mL 0.2mol/L 10mL
A. A
B. B
C. C
D. D hwq959001年前1
hwq959001年前1 -
 x5boy 共回答了16个问题
x5boy 共回答了16个问题 |采纳率87.5%解题思路:温度对反应速率的影响最大,首先考虑温度的影响,温度越高、浓度越大,则反应速率就越快,在实验中就最先出现浑浊.因由于温度30℃>10℃>0℃,则选项C和D中的反应速率大于选项A和B中的反应速率,
又由于D中在溶液体积相同条件下,反应物的浓度大于C中反应物的浓度,
所以D中反应速率最快,即在实验中就最先出现浑浊,
故选D点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查影响化学反应速率的因素,明确温度和浓度对化学反应速率的影响即可解答,注意利用表格中的数据来比较温度和浓度.1年前查看全部
- 硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100mol•L-1 Na2S2O3溶液恰好把224m
硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100mol•L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成( )
A. S2-
B. S
C. SO32-
D. SO42- 天无极1年前1
天无极1年前1 -
 vv湖畔看烟花 共回答了22个问题
vv湖畔看烟花 共回答了22个问题 |采纳率90.9%解题思路:根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等列式计算.n(Na2S2O3)=0.025L×0.100mol/L=0.0025mol,n(Cl2)=[0.224L/22.4L/mol]=0.01mol,
设S2O32-被氧化后的S元素的化合价为n,
根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等,则
0.0025×2×(n-2)mol=2×0.01mol
n=6
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应的计算,题目难度不大,注意从氧化剂、还原剂得失电子数目相等的角度解答.1年前查看全部
- Na2S2O3+H2SO4=S↓+SO2↑+H2O + Na2SO4 到底是不是氧化反应啊
Na2S2O3+H2SO4=S↓+SO2↑+H2O + Na2SO4 到底是不是氧化反应啊
他是总之最后是Na2S2O3自身氧化还原反应,但其实又是复分解反应啊,到底怎么回事啊 idcqhainan1年前2
idcqhainan1年前2 -
 怀念勇气 共回答了18个问题
怀念勇气 共回答了18个问题 |采纳率100%你可以理解为先发生Na2S2O3+H2SO4=Na2SO4+H2S2O3 复分解
再发生H2S2O3=S↓+SO2↑+H2O 氧化还原
但实际为氧化还原1年前查看全部
- (2007•宿迁二模)Na2S2O3•5H2O(俗称海波)是照相业常用的一种定影剂,常采用下法制备:
(2007•宿迁二模)Na2S2O3•5H2O(俗称海波)是照相业常用的一种定影剂,常采用下法制备:
将亚硫酸钠溶液与硫粉混合共热,生成硫代硫酸钠Na2SO3+S=Na2S2O3,滤去硫粉,再将滤液浓缩、冷却,即有Na2S2O3•5H2O晶体析出.该法制得的晶体中常混有少量
Na2SO3和Na2SO4的杂质,为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的H2SO4溶液20mL,充分反应后滤出硫,并将滤液微热(假定生成的SO2全部逸出),测得有关实验数据如下(标准状况):
(1)样品与硫酸可能发生反应的离子方程式为:______;第一份 第二份 第三份 样品的质量/g 12.60 18.90 28.00 二氧化碳的体积/L 1.12 1.68 2.24 硫的质量/g 1.28 1.92 2.56
(2)根据上表数据分析,该样品______(填选项字母);
A.只含有Na2S2O3B.含有Na2S2O3和Na2SO3两种成分C.含有Na2S2O3、Na2SO3,和Na2SO4三种成分
(3)试计算:该样品中各成分的物质的量之比?______
(4)所加硫酸溶液的物质的量浓度为多少?______. kingtion3191年前1
kingtion3191年前1 -
 sunandtea 共回答了16个问题
sunandtea 共回答了16个问题 |采纳率100%解题思路:(1)样品中硫代硫酸钠与酸反应生成硫、二氧化硫与水;亚硫酸钠与酸反应生成二氧化硫与水;
(2)硫酸的体积一定,由表中数据可知,样品质量增大,硫的质量与二氧化硫的体积都增大,故第一、二组样品完全反应,酸有剩余,28g样品完全反应可以硫的质量为[28g/12.6g]×1.28g=2.84>2.56g,故第三组硫酸不足,样品完全反应.
以第一组计算判断:根据硫的质量计算根据硫的质量可求出硫代硫酸钠的物质的量、生成的二氧化硫的物质的量,在根据产生的二氧化硫的总的物质的量确定是否含有亚硫酸钠,利用总质量确定是否含有硫酸钠;
(3)根据(2)中的判断计算解答;
(4)由(2)中分析可知,第三份硫酸不足.由方程式知硫酸的物质的量即为反应生成二氧化硫的物质的量,据此计算硫酸的物质的量浓度.(1)样品中硫代硫酸钠与酸反应生成硫、二氧化硫与水,离子方程式为:S2O32-+2H+=S↓+SO2↑+H2O,亚硫酸钠与酸反应生成二氧化硫与水,离子方程式为:SO32-+2H+=SO2↑+H2O,
故答案为:S2O32-+2H+=S↓+SO2↑+H2O;SO32-+2H+=SO2↑+H2O;
(2)硫酸的体积一定,由表中数据可知,样品质量增大,硫与二氧化硫的产量增大,故第一、二组样品完全反应,酸有剩余,28g样品完全反应可以硫的质量为[28g/12.6g]×1.28g=2.84>2.56g,故第三组硫酸不足,样品完全反应.
以第一组计算判断:1.28gS的物质的量为[1.28g/32g/mol]=0.04mol,由S2O32-+2H+=S↓+SO2↑+H2O可知,样品中硫代硫酸钠为0.04mol,该反应生成的二氧化硫为0.04mol,反应得到的二氧化硫总的物质的量为[1.12L/22.4L/mol]=0.05mol>0.04mol,故含有Na2SO3,反应SO32-+2H+=SO2↑+H2O生成二氧化硫为0.05mol-0.04mol=0.01mol,由方程式可知,样品中Na2SO3为0.01mol,硫代硫酸钠晶体与亚硫酸钠的总质量为0.04mol×248g/mol+0.01mol×126g/mol=11.18g<12.6g,
故含有硫酸钠,即含有Na2S2O3、Na2SO3和Na2SO4三种成分,
故答案为:C;
(3)由(2)分析可知,12.6g样品中,含有硫代硫酸钠为0.04mol、Na2SO3为0.01mol,硫代硫酸钠晶体与亚硫酸钠的总质量为0.04mol×248g/mol+0.01mol×126g/mol=11.18g,故硫酸钠的质量为12.6g-11.18g=1.42g,物质的量为[1.42g/142g/mol]=0.01mol,
故n(Na2S2O3•5H2O):n(Na2SO3):n(Na2SO4)=0.04mol:0.01mol:0.01mol=4:1:1,
故答案为:n(Na2S2O3•5H2O):n(Na2SO3):n(Na2SO4)=0.04mol:0.01mol:0.01mol=4:1:1;
(4)由(2)中分析可知,第三份硫酸不足,硫酸完全反应.由S2O32-+2H+=S↓+SO2↑+H2O;SO32-+2H+=SO2↑+H2O可知,硫酸的物质的量即为反应生成二氧化硫的物质的量,故n(H2SO4)=n(SO2)=[2.24L/22.4L/mol]=0.1mol,故该硫酸的物质的量浓度为[0.1mol/0.02L]=5mol/L,
故答案为:5mol/L.点评:
本题考点: 有关混合物反应的计算;探究物质的组成或测量物质的含量.
考点点评: 本题考查混合物的有关计算,题目难度较大,注意根据三组数据分析过量问题,根据硫的质量、二氧化硫体积、样品的总质量判断样品中含有的成分是解题关键,(5)中注意方程式的利用.1年前查看全部
- 向过量硝酸银溶液中滴入少量Na2S2O3溶液 现象是什么?化学反应方程式是怎样的?
 暴暴熊1年前1
暴暴熊1年前1 -
 397049151 共回答了19个问题
397049151 共回答了19个问题 |采纳率89.5%首先会看到白色的硫代硫酸银沉淀,该沉淀发生水解,产生黑色硫化银,所以整个过程的现象是,沉淀由白色转为棕色最后变为黑色.方程式为Ag2S2O3+H2O=H2SO4+Ag2S.
相反,如果向硫代硫酸钠溶液中加入少量硝酸银,起初会看到白色絮状物,震荡消失.此时得到的是Ag(S2O3)2 2-配离子.1年前查看全部
- (2009•湛江二模)硫代硫酸钠[Na2S2O3•5H2O]俗称为大苏打,它是一种用途广泛的化工产品,某厂技术人员设计了
(2009•湛江二模)硫代硫酸钠[Na2S2O3•5H2O]俗称为大苏打,它是一种用途广泛的化工产品,某厂技术人员设计了以下生产流程:
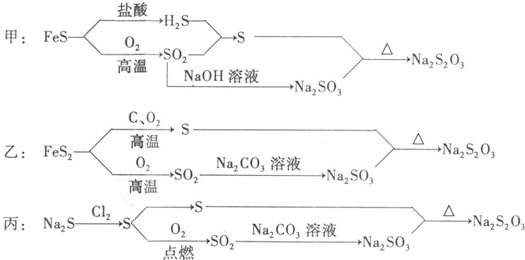
(1)写出FeS2跟O2反应的化学方程式:4FeS2+11O2
2Fe2O3+8SO2高温 .4FeS2+11O2.
2Fe2O3+8SO2高温 .
(2)上述设计生产流程最适合工业制备Na2S2O3的是______(填序号),主要理由是______.
(3)某化学兴趣小组查了有关资料,用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.(Na2S2O3溶解度:10℃为60g,70℃为200g)
取15.1克Na2SO3,溶于80.0毫升水.另取5.00克硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中.用小火加热至微沸,反应约1小时后过滤.…
①若加入的硫粉不用乙醇润湿,对反应的影响是______.(填序号)
(A)会降低反应速率(B)需要提高反应温度
(C)将增大反应体系的pH值(D)会减少产量
②反应1时间后过滤,滤液经______洗涤,干燥可得Na2S2O3•5H2O晶体.(简单写出实验过程)
③滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是______.如果滤液中该杂质的含量不很低,其检测的方法是:______.
④有同学认为当将上述滤液蒸发浓缩至溶液体积约为30mL时,即有Na2S2O3晶体析出,不需冷却结晶,试根据题中所给的数据通过计算说明(要求写出计算过程).若该反应完全得到Na2S2O3:m(Na2S2O3)=15.1g×
=18.9g,若蒸发浓缩得到的30mL溶液为饱和溶液,其所含的Na2S2O3:m(Na2S2O3)=30mL×1.2g/cm3×158g•mol−1 126g•mol−1
=24g,18.9g<24g,则该溶液尚未饱和,70℃时没有晶体析出200g 200g+100g 若该反应完全得到Na2S2O3:m(Na2S2O3)=15.1g×
=18.9g,若蒸发浓缩得到的30mL溶液为饱和溶液,其所含的Na2S2O3:m(Na2S2O3)=30mL×1.2g/cm3×158g•mol−1 126g•mol−1
=24g,18.9g<24g,则该溶液尚未饱和,70℃时没有晶体析出200g 200g+100g
[已知70℃时,Na2S2O3饱和溶液的密度为1.2g/cm3]. 阿湖GOGO1年前1
阿湖GOGO1年前1 -
 jiaco 共回答了22个问题
jiaco 共回答了22个问题 |采纳率86.4%解题思路:(1)FeS2跟O2反应生成氧化铜和二氧化硫,依据氧化还原反应电子守恒和原子守恒配平书写化学方程式;
(2)分析甲、乙、丙流程可知甲中使用氯气,丙中使用硫化氢是有毒气体,甲中的盐酸、氢氧化钠原料价钱高,丙中的氯气制备,碳酸钠原料价钱高;乙中原料来源丰富,价格低,流程简单;
(3)①用乙醇对硫粉湿润,便于硫能被水浸润,题干反应接触面积,增大反应速率,提高反应物利用率;
②溶液中得到晶体的操作是蒸发浓缩,冷却结晶,10℃为60g,冷却到10℃,析出晶体过滤洗涤,干燥得到所需晶体;
③加热过程中亚硫酸钠易被氧化为硫酸钠;依据硫酸根离子的检验方法设计实验进行验证判断;
④依据硫代硫酸钠70℃的溶解度,计算30ml饱和溶液中硫代硫酸钠的质量,和硫元素守恒计算得到的硫代硫酸钠的离子比较分析.(1)FeS2跟O2反应生成氧化铜和二氧化硫,反应的化学方程式为4FeS2+11O2
高温
.
2Fe2O3+8SO2,故答案为:4FeS2+11O2
高温
.
2Fe2O3+8SO2;
(2)由流程中使用的原料和生产过程,从经济效益,流程简便,无污染等因素可知,甲、乙、丙流程可知甲中使用氯气,丙中使用硫化氢是有毒气体,甲中的盐酸、氢氧化钠原理价钱高,丙中的氯气制备,碳酸钠原料价钱高;乙中原料来源丰富,价格低,流程简单,
故答案为:乙;流程乙中原料FeS2来源丰富,价格低,工艺流程简单、技术成熟;
(3)①用乙醇对硫粉湿润,便于硫能被水浸润,题干反应接触面积,增大反应速率,提高反应物利用率,若加入的硫粉不用乙醇润湿会降低反应速率,减少产物的产率;
(A)硫粉不用乙醇润湿会降低反应速率,故A正确;
(B)反应条件是用小火加热至微沸,硫粉不用乙醇湿润不需要提高反应温度,故B错误;
(C)硫粉不用乙醇湿润,对溶液pH无影响,所以不改变反应体系的pH值,故C错误;
(D)硫粉反应少得到产物,会减少产量,故D正确;
故答案为:AD;
②溶液中得到晶体的操作是蒸发浓缩,冷却结晶,10℃为60g,冷却到10°C,析出晶体过滤洗涤,干燥得到所需晶体,可得Na2S2O3•5H2O晶体,
故答案为:蒸发、浓缩、冷却至10℃结晶、过滤;
③加热过程中亚硫酸钠易被氧化为硫酸钠;依据硫酸根离子的检验方法设计实验进行验证判断,实验方法为:取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出S,再往滤液中加BaCl2溶液,如有白色沉淀即可证明含有Na2SO4,
故答案为:Na2SO4;取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出S,再往滤液中加BaCl2溶液,如有白色沉淀即可证明含有Na2SO4;
④若该反应完全得到Na2S2O3:m(Na2S2O3)=15.1g×
158g•mol−1
126g•mol−1=18.9g,
若蒸发浓缩得到的30mL溶液为饱和溶液,其所含的Na2S2O3:m(Na2S2O3)=30mL×1.2g/cm3×
200g
200g+100g=24g,
18.9g<24g,则该溶液尚未饱和,70℃时没有晶体析出,
故答案为:若该反应完全得到Na2S2O3:m(Na2S2O3)=15.1g×
158g•mol−1
126g•mol−1=18.9g,若蒸发浓缩得到的30mL溶液为饱和溶液,其所含的Na2S2O3:m(Na2S2O3)=30mL×1.2g/cm3×
200g
200g+100g=24g,18.9g<24g,则该溶液尚未饱和,70℃时没有晶体析出.点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查了物质制备实验探究,物质性质和生产流程中发生的化学反应的分析判断,晶体析出条件的和离子检验的实验方法设计为解题关键,题目难度较大.1年前查看全部
- 氨水,Na2S2O3,KI,NaCN在AgCl中溶液溶解度最大的是?
 rgirl1年前1
rgirl1年前1 -
 dsfgfdgdfgfdg 共回答了30个问题
dsfgfdgdfgfdg 共回答了30个问题 |采纳率86.7%问题应该是:AgCl在下列哪种溶液中溶解度最大?氨水,Na2S2O3,KI,NaCN.
答案:NaCN.生成的配离子最稳定.1年前查看全部
- 在NaCl 和AgNO3的溶液里,加入 Na2S2O3 5H2O,请问有什么化学反应?请写出反的应方程式.
 康巴汉子的身材1年前3
康巴汉子的身材1年前3 -
 vaknutk988 共回答了18个问题
vaknutk988 共回答了18个问题 |采纳率88.9%反应式如下:
2AgCL+3Na2S2O3(NaAgS2O3)2·H2O+2NaCL1年前查看全部
- 在酸性的KIO3溶液中加入NA2S2O3,有什么反应?
 suijiangmin1年前4
suijiangmin1年前4 -
 olivelu 共回答了20个问题
olivelu 共回答了20个问题 |采纳率85%我不赞同楼上的回答,的确单单硫代硫酸钠在酸性条件下发生自身氧
化还原反应:S2O32-+2H+=H2O+S↓+SO2↑.但是我们知道氟,氯,
溴,碘的氧化性都比硫强,所以当碘酸钾存在时,又有 加强他的氧化
性的氢离子,一定是碘酸钾与硫代硫酸钠发生氧化还原反应.
KIO3+3Na2S2O3+ 6H+ ==KI+3H2O+2Na2SO4+3S↓
离子方程式:IO3- + 3S2SO32- +6H+ ==I-+3H2O + SO42-+3S↓1年前查看全部
- 配制na2s2o3溶液时加入na2co3的作用是什么?
 leo_sh06271年前1
leo_sh06271年前1 -
 calvin到育空去! 共回答了17个问题
calvin到育空去! 共回答了17个问题 |采纳率82.4%在酸性溶液中细菌活跃,可将硫代硫酸钠变成亚硫酸钠和单质硫 Na2S2O3→Na2SO3+S.加入碳酸钠使溶液偏碱性,消除细菌分解的影响.1年前查看全部
- 硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,下列各组实验
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
实验 反应温度/℃ Na2S2O3溶液 稀H2SO4 H2O V/mL c/(mol•L-1) V/mL c/(mol•L-1) V/mL A 10 15 0.2 10 0.2 15 B 10 15 0.4 5 0.4 20 C 35 15 0.2 10 0.2 15 D 35 15 0.4 5 0.4 20
A.A
B.B
C.C
D.D gloria122521年前1
gloria122521年前1 -
 孤独一会 共回答了23个问题
孤独一会 共回答了23个问题 |采纳率87%解题思路:表中给出的数据为浓度和温度的影响,一般来说,浓度越大,温度越高,反应速率越大,以此解答该题.对于该反应来说浓度越大,温度越高,反应速率越大,表中C、D温度较高,则应大于A、B的反应速率,C、D相比较,D的浓度较大,则反应速率较大.
故选D.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查化学反应速率,为高考高频考点,侧重于反应速率的影响因素的考查以及数据处理能力,能较好的培养学生良好的科学素养,难度不大,学习中注意掌握影响化学反应速率的因素.1年前查看全部
- 以 K2Cr2O7 为基准物,用碘量法标定 Na2S2O3 溶液的浓度时,滴定速度过快,并过早读出滴定管读数,会产生正偏
以 K2Cr2O7 为基准物,用碘量法标定 Na2S2O3 溶液的浓度时,滴定速度过快,并过早读出滴定管读数,会产生正偏差还是负偏差 ?为什么?
 carriezjy1年前1
carriezjy1年前1 -
 东方龙哥_xx 共回答了20个问题
东方龙哥_xx 共回答了20个问题 |采纳率100%C指硫代硫酸钠的浓度,m指重铬酸钾的质量,M指重铬酸钾的摩尔质量,V指滴定时消耗硫代硫酸钠的标准溶液体积ml,V0指的是空白试验消耗的硫代硫酸钠标准溶液的体积ml.C=6*1000*m/{(v-V0)*M}滴定度速度过快导致K2Cr2O7基准物与待测物质未反应完全,基准物还残留在待测物质中,在过早度数造成度数V偏大,从而计算的浓度偏小,产生负偏差.1年前查看全部
- Na2S2O3中S的化合价是怎样的,
Na2S2O3中S的化合价是怎样的,
S-S键是不是配位键 如果是由哪个S原子提供孤对电子 蓝宣1年前3
蓝宣1年前3 -
 白杨非杨 共回答了25个问题
白杨非杨 共回答了25个问题 |采纳率96%硫代硫酸钠,相当于硫酸钠中一个氧原子被硫原子取代.中间的那个硫原子和另一个硫原子和一个氧原子成双键,和两个氧原子成单键.
所以一个硫原子的化合价是0,另一个硫原子化合价是+4.
应该不是配位键.1年前查看全部
- Na2S2O3叫什么名字?其中硫元素的化合价是多少?
 LJWTT081年前6
LJWTT081年前6 -
 hua0213 共回答了16个问题
hua0213 共回答了16个问题 |采纳率93.8%Na2S2O3是硫代硫酸钠,俗名是海波,是晶体,熔点是84摄氏度.
对不起,是一个+6,一个-21年前查看全部
- 四个试管中都装有5mL 0.1mol/LNa2S2O3溶液,分别在不同温度下加入0.1mol/L硫酸和一定量水
四个试管中都装有5mL 0.1mol/LNa2S2O3溶液,分别在不同温度下加入0.1mol/L硫酸和一定量水,最先出现浑浊的是( )
A. 20℃10 mL硫酸
B. 20℃5 mL硫酸 5 mL水
C. 30℃10 mL硫酸
D. 30℃5 mL硫酸 5 mL水 齐方朝夕1年前5
齐方朝夕1年前5 -
 胡之适 共回答了18个问题
胡之适 共回答了18个问题 |采纳率88.9%解题思路:根据温度和浓度对反应速率的影响,温度的影响比浓度对反应速率的影响更大,所以先看温度,再看浓度,温度对反应速率的影响比浓度对反应速率的影响更大,所以温度越高,速率越大;温度相同时,浓度越大速率越大;30℃10 mL硫酸时温度最高,浓度最大,所以速率最快,最先出现浑浊,故C符合题意,
故选C.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查了温度、浓度对反应速率的影响,注意温度对反应速率的影响比浓度对反应速率的影响更大,题目难度不大.1年前查看全部
- (2014•德化县一模)用自来水养鱼时,残留在水中的氯气会对鱼造成危害,常加入大苏打Na2S2O3来除去水中的氯气.下列
(2014•德化县一模)用自来水养鱼时,残留在水中的氯气会对鱼造成危害,常加入大苏打Na2S2O3来除去水中的氯气.下列有关大苏打的叙述错误的是( )
A.大苏打的相对分子质量是158
B.大苏打由三种元素组成
C.大苏打是混合物
D.大苏打中钠、氧元素质量比为23:24 细语yy1年前1
细语yy1年前1 -
 tancailing 共回答了20个问题
tancailing 共回答了20个问题 |采纳率95%解题思路:A、利用相对分子质量是各元素原子相对原子质量之和的比进行分析;
B、根据大苏打化学式的意义进行分析;
C、根据混合物的概念进行分析;
D、利用化学式可求出元素的质量比.A、大苏打的相对分子质量是23×2+32×2+16×3=158,故此选项说法正确;B、由化学式可知大苏打由钠、硫、氧三种元素组成,故此选项说法正确;C、大苏打中只含有一种物质,属于纯净物,故此选项说法错误;D、大苏打中...
点评:
本题考点: 化学式的书写及意义;纯净物和混合物的判别;相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 此题是对化学式的意义及化学式的计算进行的考查,对培养学生基本的计算能力及分析能力有一定帮助.1年前查看全部
- 硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100mol•L-1 Na2S2O3溶液恰好把224m
硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100mol•L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成( )
A. S2-
B. S
C. SO32-
D. SO42- 我de故事1年前2
我de故事1年前2 -
 远耕 共回答了27个问题
远耕 共回答了27个问题 |采纳率88.9%解题思路:根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等列式计算.n(Na2S2O3)=0.025L×0.100mol/L=0.0025mol,n(Cl2)=[0.224L/22.4L/mol]=0.01mol,
设S2O32-被氧化后的S元素的化合价为n,
根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等,则
0.0025×2×(n-2)mol=2×0.01mol
n=6
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应的计算,题目难度不大,注意从氧化剂、还原剂得失电子数目相等的角度解答.1年前查看全部
- AgBr和 Na2S2O3的反应式
 lillee1年前2
lillee1年前2 -
 不爱我的人 共回答了16个问题
不爱我的人 共回答了16个问题 |采纳率87.5%S2O3 2-的配位作用使AgBr溶解
AgBr+2S2O32- = Ag(S2O3)2 3- + Br-1年前查看全部
- Na2S2O3+AgNO3的实验现象是什么?
Na2S2O3+AgNO3的实验现象是什么?
恩,和硫代硫酸盐的配位性有关的... 21130491年前1
21130491年前1 -
 金色天空 共回答了19个问题
金色天空 共回答了19个问题 |采纳率94.7%有白色沉淀产生1年前查看全部
- 配制KI(0.100mol·L-1)–I2的水溶液,用0.100mol·L-1 Na2S2O3标准溶液测得c(I2)=4
配制KI(0.100mol·L-1)–I2的水溶液,用0.100mol·L-1 Na2S2O3标准溶液测得c(I2)=4.85×10-3 mol·L-1.量取50.0mL KI-I2溶液和50.0mL CCl4置于分液漏斗中振荡达平衡,分液后测知CCl4相中c(I2)=2.60×10-3 mol·L-1.已知实验温度下CCl4从水溶液中萃取I2的分配比为85 :1.求水溶液中I2+I¯=I¯3的平衡常数
设萃取平衡时,水溶液中c(I2)为x c(I2,CCl4)/c(I2,H2O)=2.60x10-3 mol·L-1/x=85
x=2.60x10-3 mol·L-1/85=3.06×10-5 mol·L-1 (2分)
水溶液中 I2 +I¯ = I3¯
平衡浓度(mol·L-1):
I2:3.06×10-5 ; I¯ :0.100-2.22×10-3=0.098 (1分) (1分)
I¯3:(4.85-2.60)×10-3-3.06×10-5=2.22×10-3 (1分)
K=2.22×10-3 mol·L-1/(0.098 mol·L-1×3.06×10-5 mol·L-1)=7.4×102 L·mol-1(不写单位不扣分)(1分)
我看不懂 I- :0.100-2.22×10-3=0.098这里为什么只减i2的浓度,水相里不应该还有i3-么,同样道理I-3:(4.85-2.60)×10-3-3.06×10-5=2.22×10-3 这里只减了ccl4和水里i2的浓度,没有减去i-的浓度 坚持到明天1年前2
坚持到明天1年前2 -
 rivaldo118 共回答了19个问题
rivaldo118 共回答了19个问题 |采纳率84.2%06年初赛题啊~
是这样,你的思考方法是有问题的,I2和I-是分别与I3-发生关系的.可以看这样一个式子:
I2 + I- = I3-
起始 C11 C12 0
平衡 C21-X C12-X X
转化 略 X X (略=C11-C21+X)
K=[X]/[C12-X][C21-X],
C21-X=2.60x10-3 mol·L-1/85=3.06×10-5 mol·L-1,
而损失的I2的量就是转化为I3-的量(由反应式,I2只会转化为I3-,且变化量是1:1,所以损失掉的I2都转化为了I3-【水中的和CCl4中的I2和与原始浓度的差】),即 (4.85-2.60)×10-3-3.06×10-5(I2与I3-的转化是1:1的关系,I2的减少量就是I3-的增
加量)
同样,I-与I2的转化也是1:1的关系,也就是说I3-的增量就是I-的减量,则C12-X= 0.100-2.22×10-3=0.098
你所说的“这里只减了ccl4和水里i2的浓度,没有减去i-的浓度”是你想错了,I2与I-不是互相转化的,虽然它们的减量总是相等
,但他们的减量是直接与I3-相关的,因为他们均与I3-保持1:1的转化比,即每生成1MOL I3-就用掉1MOL I2,1MOL I-.
我觉得你对平衡常数的理解可能有偏差,物料守恒确实是基础,但是更重要的是搞清楚变化之间的关系.建议看看无机化学上吧.
我们老师下午讲这道题的时候我就没听,但看几眼就明白了.初赛的分析题都是很简单的,基本上就是基础知识的运用,没有什么复杂的运算.所以要打好基础.
还有,这道题本身有问题,应该是“分配系数”,不是“分配比”(答案是按照分配系数给的)
我希望我说清楚了,没说清楚的话发PM1年前查看全部
- 急求生成物是Na2S2O3的化合反应化学方程式········
 米熊1年前1
米熊1年前1 -
 八蕉扇_hh 共回答了19个问题
八蕉扇_hh 共回答了19个问题 |采纳率84.2%2Na2S+S+3O2==Na2S2O3
Na2SO3+S==Na2S2O3
我也是随着你的问题刚学的,1年前查看全部
- 化学试剂的鉴别.第一组 NaCl KBr KI第二组 Na2SO4 Na2S2O3 Na2S K2S2O8 第三组 Na
化学试剂的鉴别.
第一组 NaCl KBr KI
第二组 Na2SO4 Na2S2O3 Na2S K2S2O8
第三组 NaNO2 NaNO3 Na2co3 Na3PO4
现在是试剂在眼前 不知道哪瓶对应哪瓶 pannisi1年前1
pannisi1年前1 -
 阿程83 共回答了18个问题
阿程83 共回答了18个问题 |采纳率88.9%(1)分别滴加稀HNO3+AgNO3,生成白色沉淀的为NaCl,淡黄色沉淀的为KBr,黄色沉淀的为KI.
(2)分别滴加稀H2SO4,生成黄色或白色沉淀的为Na2S2O3,生成臭鸡蛋味气体的为Na2S,再往无反应现象的两瓶中分别滴加MnSO4+少量AgNO3,溶液变紫红色的为K2S2O8,无反应的为Na2SO4.
(3)分别滴加稀HCl,生成红棕色气体的为NaNO2,无色气体的为Na2CO3,再往无反应现象的两瓶中分别滴加BaCl2,生成沉淀的为Na3PO4,无反应的为NaNO3.
注:过二硫酸盐K2S2O8在Ag+的催化作用下可将Mn2+氧化成最高价态得锰酸根离子MnO4-紫红色.
且AgNO3必须为少量,否则生成Ag2SO4白色沉淀的量会较大,影响观察.
祝愉快1年前查看全部
- 急求LiCoO2+Na2S2O3+H2So4=Li2SO4+CoSO4+Na2SO4+H2O配平!
 binbin331年前1
binbin331年前1 -
 芝士 共回答了19个问题
芝士 共回答了19个问题 |采纳率84.2%Co:+3→+2,S:平均+1→+6
10LiCoO2 + Na2S2O3 + 15H2SO4 = 5Li2SO4 + 10CoSO4 + 2Na2SO4 + 15H2O1年前查看全部
- 同时鉴别六种Na2S、Na2S2O3、Na2SO4、Na2SO3、Na3SbS3和Na2SiO3的试剂
 网络邂逅1年前3
网络邂逅1年前3 -
 原来她 共回答了12个问题
原来她 共回答了12个问题 |采纳率83.3%倒数第二个是硫代亚铋酸钠吗?
不知道你要的同时是什么概念……是只要一种试剂,分别加进各个溶液中就把各种东西分辨出来吗?还是允许试剂间的相互鉴别……
你看看这样可不可以:
用稀硫酸.硫化钠会产生一种臭鸡蛋味道的气体,硫代硫酸钠会产生浅黄色沉淀和气体,气体刺激性.硫酸钠无现象,亚硫酸钠会产生刺激性气体,区别与硫化钠的臭鸡蛋气味,容易区分硫代亚铋酸钠会长生橙红色的硫化铋沉淀,不溶于酸.最后硅酸钠会产生白色沉淀.六种物质现象不同,所以呢,就区别出来了.1年前查看全部
- 只用一种试剂鉴别Na2S、NaCl、Na2SiO3、Na2S2O3
 幽灵飞劲1年前2
幽灵飞劲1年前2 -
 sa花花 共回答了14个问题
sa花花 共回答了14个问题 |采纳率100%盐酸
加入Na2S有臭鸡蛋气味气体
加入NaCl无现象
加入Na2SiO3白色胶状沉淀(硅酸)
加入Na2S2O3既有气体有有沉淀1年前查看全部
- 将0.1936g的k2cr2o7溶 于水酸化后加入过量的ki,析出的I2用na2s2o3滴定,i消耗 33.
将0.1936g的k2cr2o7溶 于水酸化后加入过量的ki,析出的I2用na2s2o3滴定,i消耗 33.
求c(na2s2o3)= LOVE万人迷1年前1
LOVE万人迷1年前1 -
 红头山木 共回答了9个问题
红头山木 共回答了9个问题 |采纳率100%消耗33.61 mL?应该是这个题吧?
Cr2O7 2- +6I- + 14H+ = 2 Cr3+ +3 I2 + 7 H2O
I2 + 2 S2O32- = 2 I- + S4O62-
1 K2Cr2O7 3 I2 6 Na2S2O3
所以(cV)硫代硫酸钠 ÷ (m/M)重铬酸钾 ÷1000 = 6/1
所以c(Na2S2O3) = 6×0.1936 ÷(294.19×33.61)×1000 = 0.1175 mol/L1年前查看全部
- I2+Na2S2O3反应的方程式是什么 (要配平)
I2+Na2S2O3反应的方程式是什么 (要配平)
注意:反应物是I2+Na2S2O3 wuwu19801年前2
wuwu19801年前2 -
 jsfhaiu 共回答了16个问题
jsfhaiu 共回答了16个问题 |采纳率81.3%2Na2S2O3 + I2 == 2NaI + Na2S4O61年前查看全部
- S+H2O+HClO反应吗?偶然突发奇想,望高手出现,原是由于Na2S2O3+Cl2+H2O生成过程想到,望高手明白我的
S+H2O+HClO反应吗?
偶然突发奇想,望高手出现,原是由于Na2S2O3+Cl2+H2O生成过程想到,望高手明白我的意思, 139598651年前1
139598651年前1 -
 XHD1 共回答了13个问题
XHD1 共回答了13个问题 |采纳率92.3%不反应1年前查看全部
- 配平Na2Cr2O7+Na2S+H2O---Na2S2O3+NaOH+Cr(OH)3
 ybbyid1年前1
ybbyid1年前1 -
 vbnm981733 共回答了17个问题
vbnm981733 共回答了17个问题 |采纳率94.1%4Na2Cr2O7+6Na2S+19H2O=3Na2S2O3+14NaOH+8Cr(OH)31年前查看全部
- 判别下列白色固体是哪种钠盐:NaCl NaHCO3 Na2CO3 Na2SO3 Na2SO4 Na2S2O3 Na3PO
判别下列白色固体是哪种钠盐:NaCl NaHCO3 Na2CO3 Na2SO3 Na2SO4 Na2S2O3 Na3PO4 NaH2PO4 Na4P2O7
 小熊20001年前1
小熊20001年前1 -
 armorkang 共回答了20个问题
armorkang 共回答了20个问题 |采纳率95%将所有固体分别加水溶解,用pH广泛试纸(1~14)检测溶液,
pH小于7:NaH2PO4
pH=7:NaCl,Na2SO4
pH大于7:NaHCO3 ,Na2CO3 ,Na2SO3,Na2S2O3,Na3PO4,Na4P2O7
1、对于pH大于7的溶液,加HCl溶液区别:
(1)有气体产生的是:Na2SO3(有SO2,SO2用品红褪色检验),
NaHCO3 ,Na2CO3 (二者都有CO2,CO2用澄清饱和石灰水变浊检验).
区别NaHCO3 ,Na2CO3 :
在水中溶解度大的是Na2CO3,溶解度小的是NaHCO3;
或加热分受热易分解的是NaHCO3(分解温度270摄氏度),难分解的是Na2CO3(850摄氏度以上).
(2)有气体还有沉淀(浑浊)的: Na2S2O3(有SO2+S生成)
(3)无现象:Na3PO4 ,Na4P2O7 .二者再分别加AgNO3溶液,有黄色沉淀(Ag3PO4)的是Na3PO4 ,有白色沉淀(Ag4P2O7)的是Na4P2O7 .
2、pH=7者加BaCl2溶液
有白色沉淀:Na2SO4(BaSO4)
无现象:NaCl1年前查看全部
- 用硫酸鉴别氯化钠,碳酸钠,亚硫酸钠,硅酸钠和 Na2S2O3五种溶液的原理 是什么?最好有方程式.
 lili198806011年前2
lili198806011年前2 -
 791005 共回答了22个问题
791005 共回答了22个问题 |采纳率81.8%NaCl,混合不反应,无现象
Na2CO3,Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2,生成无色无味使澄清石灰水浑浊的气体
Na2SO3,Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2,生成无色有刺激性气味,使品红褪色的气体
Na2SiO3,Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3,生成白色沉淀
Na2S2O3,Na2S2O3 + H2SO4 = Na2SO4 + S + SO2 + H2O,生成黄色浑浊S和无色有刺激性气味的气体SO21年前查看全部
- 来下化学高手速度.0.1摩尔毎升的Na2S2O3溶液10ml和0.01摩尔毎升的硫酸溶液10ml混合,2分钟后溶液出现浑
来下化学高手速度.
0.1摩尔毎升的Na2S2O3溶液10ml和0.01摩尔毎升的硫酸溶液10ml混合,2分钟后溶液出现浑浊.已知温度每升高10摄氏度,化学反应速率增大到原来的两倍,那么50摄氏度时,同样的反应要看到同样的浑浊,需要的时间是?
本人这么写.因为每升高10度,速率是原来的两倍.所以20到50应该是2的3次方倍.2分钟等于60秒. 所以,需要的时间是60乘上八分之一等于7.5秒.
但是我看答案确和我不一样.它是这样的,2乘上60乘上八分之一等于15秒.解释下,谢谢.为什么要乘上2? daidtown1年前3
daidtown1年前3 -
 布兰特 共回答了18个问题
布兰特 共回答了18个问题 |采纳率83.3%两分钟是120秒,不是60秒,很低级的错误1年前查看全部
- 某同学你用如下实验标定0.02mol/L Na2S2O3,请指出三处错误并改正
某同学你用如下实验标定0.02mol/L Na2S2O3,请指出三处错误并改正
称取0.2315g分析纯K2Cr2O7,加适量水溶解后,加入1g碘化钾,然后立即加入淀粉指示剂,用 Na2S2O3滴定之蓝色退去,记下Na2S2O3消耗的体积,计算Na2S2O3浓度.[Mr(K2Cr2O7)=294.2] 日森子林1年前1
日森子林1年前1 -
 一雪松 共回答了22个问题
一雪松 共回答了22个问题 |采纳率100%1、标定用试剂应选用基准试剂,分析纯是不对的.
2、淀粉指示剂应在标定近终点时加入,立即加入是不对的.
3、滴定终点蓝色不会退去,而是溶液颜色变为亮绿色.1年前查看全部
- Na2S和Na2S2O3混合溶液中加入足量的稀硫酸,依次会发生哪些反应?
 方南成1年前2
方南成1年前2 -
 yaoyaomm 共回答了22个问题
yaoyaomm 共回答了22个问题 |采纳率90.9%Na2S+H2SO4=H2S↑+Na2SO4
Na2S2O3+H2SO4=Na2SO4+S↓+H2SO31年前查看全部
- 将含a mol Na2S的溶液和含b mol Na2S2O3 溶液混合,然后加入硫酸酸化,算化后的溶液无任何气体逸出
将含a mol Na2S的溶液和含b mol Na2S2O3 溶液混合,然后加入硫酸酸化,算化后的溶液无任何气体逸出
由此推知a:b为
A.1:2 B.2:1 C.2:3 D.1:3
请给出答案,可能多选
并且请给出详细的过程和方程式 天湖骄子1年前1
天湖骄子1年前1 -
 ungkg 共回答了18个问题
ungkg 共回答了18个问题 |采纳率88.9%不能有SO2?那就应该生成S单质了,S是0价态,处于Na2S(-2价)与Na2S2O3(+2价)之间,经典的归中.因为0价与-2和+2之间的差相等,所以……呵呵,化学老师说见到偏题难题就要勇敢的舍弃,我也把这句话送给你吧!1年前查看全部
- 硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,
可以通过出现浑浊的快慢来判断反应的快慢程度,下列各组实验中最先出现浑浊的是
实验x09反应温度/℃x09Na2S2O3溶液x09稀H2SO4x09H2O
x09x09V/mLx09c/(mol•L-1)x09V/mLx09c/(mol•L-1)x09V/mL
Ax0925x095x090.1x0910x090.1x095
Bx0925x095x090.2x095x090.2x0910
Cx0935x095x090.1x0910x090.1x095
Dx0935x095x090.2x095x090.2x0910、
为何选D? 有多少泪要流1年前4
有多少泪要流1年前4 -
 对猫儿 共回答了11个问题
对猫儿 共回答了11个问题 |采纳率100%因为影响化学反应快慢的外因主要有温度、浓度、催化剂等;本题中主要影响因素是温度和浓度.
当其他条件相同时,温度越高反应速度越快;同理,当其他条件相同时,浓度越大反应速度越快.1年前查看全部
- Na2S2O3•5H2O(俗称海波)是照相业常用的一种定影剂.
Na2S2O3•5H2O(俗称海波)是照相业常用的一种定影剂.
工业上制得的Na2S2O3•5H2O晶体中可能含有少量的Na2SO4杂质.为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液20mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出.
测得有关实验数据如下(标准状况):
第一份 第二份 第三份
样品的质量/g 12.60 18.90 28.00
二氧化硫的体积/L 1.12 1.68 2.24
硫的质量/g 1.28 1.92 2.56
(摩尔质量:Na2S2O3•5H2O 248g/mol;Na2SO3 126g/mol;Na2SO4 142g/mol)
(1)计算所用硫酸溶液的物质的量浓度
(2)试确定该样品的成分并计算各成分的物质的量之比 赌一把幸福1年前1
赌一把幸福1年前1 -
 西柚80 共回答了18个问题
西柚80 共回答了18个问题 |采纳率88.9%(1)Na2S2O3+H2SO4=S+Na2SO4+SO2+H2O
第一份 n(s)=0.04mol n(so2)=0,05mol 很明显SO2多了0.01m0l,说明还有Na2SO3
Na2SO3+H2SO4=SO2+Na2SO4
0.01 0.01
m(na2so4)=12.60-0,04*248-0.01*126=1.42g
第三份硫酸反应完且为第一份的两倍即n(H2SO4)=0.10mol
所以c(H2SO4)=0.1/0.02=5mol/L
(2)n(NA2SO4)=1.42/142=0.01mol
所以各物质的比:海波:亚硫酸钠:硫酸钠=0.04:0.01:0.01=4:1:11年前查看全部
- 硫代硫酸钠是不是正盐?化学式Na2s2o3,两个硫化合价不同,一个0价,一个+4价。
 quii1年前2
quii1年前2 -
 ol_mq69fsr209f__ 共回答了18个问题
ol_mq69fsr209f__ 共回答了18个问题 |采纳率83.3%是正盐. 是硫代硫酸H2S2O3的钠盐.1年前查看全部
- 可用于滴定碘的标准溶液是: A H2SO4 B KBrO3 C Na2S2O3 D K2Cr2O7
 zxyouygq19831年前1
zxyouygq19831年前1 -
 tsui_james 共回答了18个问题
tsui_james 共回答了18个问题 |采纳率100%明显是B,滴定碘只能有一个正离子,还不能沉淀1年前查看全部
- Na2S2O3+H2SO4=Na2SO4+H2O+X+S,求X,要经过(怎么配平)
 duxingke1年前4
duxingke1年前4 -
 子巴人也 共回答了20个问题
子巴人也 共回答了20个问题 |采纳率80%X是SO2
Na2S2O3+H2SO4=Na2SO4+H2O+SO2+S
已配平1年前查看全部
- 请问Na2S2O3+H2SO4的反应,谁还原谁?谁氧化谁?说明了什么性质?
请问Na2S2O3+H2SO4的反应,谁还原谁?谁氧化谁?说明了什么性质?
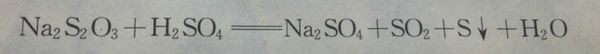
请问这个反应,谁还原谁?谁氧化谁?说明了什么性质?就是说从这个反应我们可以分析出来什么? Sadler1年前1
Sadler1年前1 -
 捞面条 共回答了11个问题
捞面条 共回答了11个问题 |采纳率90.9%歧化反应,硫代硫酸钠中+2价S一个还原成单质S,一个氧化成S(IV)1年前查看全部
- 化学元素Na2s2o3化合价
 达达尼扬1年前1
达达尼扬1年前1 -
 moon_drifter 共回答了21个问题
moon_drifter 共回答了21个问题 |采纳率95.2%Na是正一价的,两个.
O是负二价的,三个
所以S2的化合价为+4价,平均下来S是+2
这只是平均价态
S没有+2价
有可能是一个-2,一个+6,或者是0和+41年前查看全部
- 0.1mol/LAgNO3溶液中加入1mol/LNa2S2O3溶液
 lying041年前2
lying041年前2 -
 云飘蓝天上 共回答了18个问题
云飘蓝天上 共回答了18个问题 |采纳率94.4%离子方程式吧
Ag+ + 2S2O3^2-=Ag(S2O3)2^3-1年前查看全部
- 1.描述下列实验现象,并列出相应的化学反应方程式:向过量AgNO3溶液中滴入少量Na2S2O3溶液.
1.描述下列实验现象,并列出相应的化学反应方程式:向过量AgNO3溶液中滴入少量Na2S2O3溶液.
2.描述下列实验现象,并列出相应的化学反应方程式:取饱和偏钒酸铵溶液,用6 mol·L-1 HCl酸化,然后加入2粒锌,放置一段时间.
3、MgSe和MnSe的离子间距离均为273 pm,但Mg2+和Mn2+的离子半径又不相同,如何解释此事实?
4、为什么金属铁能置换铜,而三氯化铁溶液又能溶解铜板.(øFe3+Fe2+=0.77 V,øFe2+Fe=-0.44 V,øCu2+Cu=0.34 V).
5、O2+、O2、O2-、O22-的实测键长越来越长,试用分子轨道理论解释之,其中哪几种有顺磁性?为什么?
6、计算d电子组态为d4的八面体强场配合物的晶体场稳定化能(CFSE).
7、一氧化碳分子与醛、酮的羰基相比,键能较大,键长较小,偶极矩则小得多,且方向相反,试从结构的角度作出解释.
8、计算d电子组态为d5的八面体强场配合物的晶体场稳定化能(CFSE).
9、硼砂的水溶液具有缓冲作用,请给予解释.
10、为什么不能从溶液中制得Al2(CO3)3和Cr2S3?
11、试从平衡移动的原理解释为什么在Na2HPO4或NaH2PO4溶液中加入AgNO3溶液,均析出黄色的Ag3PO4沉淀?析出Ag3PO4沉淀后溶液的酸碱性有何变化?写出相应的化学反应方程式.
12、解释从NO2+、NO2、NO2-的键角依次为180o、134.3o、115.4o.
13、在往AgNO3溶液中滴加Na2S2O3溶液时,可观测到先生成白色沉淀,随后沉淀的颜色变深,最后变成黑色,如果往Na2S2O3溶液中滴加AgNO3溶液你能观测到什么现象吗?
14、甘汞的化学式是什么?它是无毒的汞的化合物,可用作轻泻剂,但放置时间过长或在光照下容易变质,变质后的药物有剧毒,
15、根据所述实验现象,写出相应的化学反应方程式:在硫酸铬溶液中,逐渐加入氢氧化钠溶液,开始生成灰蓝色沉淀,继续加碱,沉淀又溶解,再向所得溶液中滴加溴水,直到溶液的绿色转变为黄色.
16、比较O3和O2的氧化性、沸点、极性和磁性的相对大小.
17、红磷长时间放置在空气中逐渐潮解,与CaCl2在空气中潮解,实质上有什么不同?
18、为什么CF4不能水解,而BF3和SiF4都容易水解?
19、为什么ZnCl2的浓溶液可除掉焊接表面的氧化物?
20、在氯气氧化法制单质碘时,将氯气通入KI的溶液中,溶液的颜色先逐渐变深,然后又褪色,用化学反应方程式解释它.
21、如何分离Fe3+、Al3+、Cr3+和Ni2+离子.
22、写出下列实验现象有关的化学式:向含有Fe2+离子的溶液中加入NaOH溶液后生成白绿色沉淀,逐渐变成棕色.过滤后,用盐酸溶解棕色沉淀,溶液呈黄色.加入几滴KSCN溶液后立即变成血红色,通入SO2后红色消失.滴加KMnO4溶液,其紫色会褪去.最后加入黄血盐溶液时,生成兰色沉淀.
23、某绿色固体A溶于水,其水溶液通入CO2即得棕黑色沉淀B和紫红色溶液C.B与HCl溶液共热时放出黄绿色气体D,溶液近乎无色,将此溶液和溶液C混合,即得沉淀B.将气体D通入A溶液,可得C.试判断A是哪种钾盐,并写出有关反应方程式.
24、往硝酸银溶液中滴加KCN溶液时,先生成白色沉淀而后溶解,再加入NaCl溶液时并无AgCl白色沉淀生成,但加入少量Na2S溶液时却析出黑色Ag2S沉淀.用化学方程式表示各现象发生原因.
25、根据所述实验现象,写出相应的化学反应方程式:在硫酸铬溶液中,逐渐加入氢氧化钠溶液,开始生成灰蓝色沉淀,继续加碱,沉淀又溶解,再向所得溶液中滴加溴水,直到溶液的绿色转变为黄色.
26、一种不锈钢是Ni、Cr、Mn、Fe的合金,试设计一种简单的定性分析方法.
27、泡沫灭火剂包括Al2(SO4)3浓溶液与NaHCO3浓溶液,能否用固体NaHCO3或Na2CO3溶液代替NaHCO3浓溶液? 5103676801年前1
5103676801年前1 -
 屁猴子 共回答了25个问题
屁猴子 共回答了25个问题 |采纳率84%10.铝离子电解变成氧化铝,琉璃子变成硫单质.1年前查看全部
- 化学反应速率计算在相同温度下,下列化学反应速率最慢的是( ) A、10mL0.1mol/LNa2S2O3和10mL0
化学反应速率计算
在相同温度下,下列化学反应速率最慢的是( )
A、10mL0.1mol/LNa2S2O3和10mL0.1mol/LH2SO4
B、5mL0.1mol/LNa2S2O3和5mL0.1mol/LH2SO4
C、5mL0.1mol/LNa2S2O3和5mL0.05mol/LH2SO4
D、10mL0.05mol/LNa2S2O3和10mL0.05mol/LH2SO4
请写出解析, ystianshi1年前4
ystianshi1年前4 -
 迁徙的鸟儿1978 共回答了23个问题
迁徙的鸟儿1978 共回答了23个问题 |采纳率95.7%选D
混合后反应物浓度大的反应快,各选项混合后浓度如下
A c(S2O3)=0.05mol/l ,c(H)=0.1mol/l
B c(S2O3)=0.05mol/l ,c(H)=0.1mol/l
C c(S2O3)=0.05mol/l ,c(H)=0.05mol/l
D c(S2O3)=0.025mol/l ,c(H)=0.05mol/l
可以看出D中俩种离子浓度都是最低的,因此D最慢1年前查看全部
- 硫代硫酸钠怎么水解?滴定的时候硫代硫酸钠是怎样反应的?用 碘酸钾 KIO3 滴定 硫代硫酸钠Na2S2O3它不是强碱弱酸
硫代硫酸钠怎么水解?
滴定的时候硫代硫酸钠是怎样反应的?用 碘酸钾 KIO3 滴定 硫代硫酸钠Na2S2O3
它不是强碱弱酸盐吗?为什么不水解?抛开那个滴定的话呢?会水解的吧.
这样的话,会水解请给方程式;不水解请给理由. ZHOUlangui1年前1
ZHOUlangui1年前1 -
 小肥宝宝 共回答了17个问题
小肥宝宝 共回答了17个问题 |采纳率94.1%硫代硫酸钠不水解.1年前查看全部
- I2 + I- == I3- 用Na2S2O3去滴定它,硫代硫酸钠是跟哪个反应?能与I3-反应吗
 巨蟹座的我1年前1
巨蟹座的我1年前1 -
 yantao2004 共回答了10个问题
yantao2004 共回答了10个问题 |采纳率90%是和碘反应,和别的没关系.连四硫酸钠和碘化钠:2 Na2S2O3 + I2 = Na2S4O6 + 2 NaI1年前查看全部
- 以纯铜标定Na2S2O3溶液时,滴定到达终点后又返回到蓝色!
 eqq的额头1年前1
eqq的额头1年前1 -
 虎啸aaa 共回答了22个问题
虎啸aaa 共回答了22个问题 |采纳率81.8%四水合铜离子为蓝色1年前查看全部
- Na2S2O3+Cl2=H2SO4+NaCl+HCl配平,
 angela02061年前2
angela02061年前2 -
 32的yy家族36 共回答了21个问题
32的yy家族36 共回答了21个问题 |采纳率90.5%按照氧化还原反应得失电子数守恒规律配平 将两个硫原子看成平均+2价 这样1分子Na2S2O3需要升高8价从而转化为2分子硫酸;一份子Cl2降低2价 故两者分子数之比为1:4.根据这个比例 Na2S2O3+4Cl2 确定硫酸的计量数为2;共生成8分子Cl 所以后两种物质计量比之和为8 钠离子数为2 所以两种物质计量数分别为2和6 不足的氢氧原子由水提供 用水补齐后 得方程式 Na2S2O3+4Cl2+5H2O=2H2SO4+2NaCl+6HCl.1年前查看全部
大家在问
- 1公主和蜜蜂 作文
- 2thanks for your order
- 3求指导~1.It is not simply to raise everyone's job prospects tha
- 4重结晶碳化硅与反映烧结碳化硅有什么区别呢?好像一个比较老,一个比较新是吧?我想详细了解一下,哪位知道说说啊.多少无妨.谢
- 5wish for you good
- 6英语翻译Очень много раз я себезадавал вопросДля чего родился на
- 7怎样复习英语
- 8寻找一种非电解质或不导电液体,要常温下成液态,无毒,安全不易燃烧,容易获得,没有腐蚀性,强氧化性,不是酸或碱
- 9不是无缘,只是不到时候而已!(1) 作文
- 10用一根长50厘米的铁丝制成一个长方形框架,设长方形的一边长x厘米,面积为y平方厘米,求y关于x的函数解析式
- 11已知a+2b=0,你能求出式子a的立方+2ab[a+b]+4b的三次方的值吗?
- 12I'm working _ my computer,用in or on?
- 13麻烦你再帮我分析下这几句话吧!As the war continued and the casualty figures
- 14(2005•闵行区二模)如图所示,在大气压强为76cmHg,温度为27℃时,容器中活塞C左方A封闭有3L空气,活塞C右方
- 15英语翻译Let me sail,let me sail,let the Orinoco flow,let me reac
