Fe(OH)3为什么是胶体不是浊液
 绿茵守望者2022-10-04 11:39:542条回答
绿茵守望者2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 anjicxt 共回答了12个问题
anjicxt 共回答了12个问题 |采纳率100%- 你好:
分散质的粒度>100nm(10^-7m)之间的分散系叫浊液.
固体小颗粒悬浮于液体里形成的混合物,叫做悬浊液.
小液滴分散在液体里形成的混合物,叫做乳浊液.
胶状分散体,是一种均匀混合物.在胶体中含有两种不同状态的物质,一种分散,另一种连续.分散的一部分是由微小的粒子或液滴所组成,分散质粒子直径在1nm—100nm之间的分散系.
其区别在于分散质的粒度.Fe(OH)3粒子大小在1nm到100nm之间时会形成胶体,再多生成Fe(OH)3后,当粒子大小超过100nm就形成悬浊液. - 1年前
 jxboy3721 共回答了40个问题
jxboy3721 共回答了40个问题 |采纳率- 你的题目就不是很正确,Fe(OH)3要看你是如何制备,你要是像高中实验课本那样向沸水中滴加氯化铁,那样制备的就是Fe(OH)3胶体;如果说是向氢氧化钠溶液中滴加氯化铁,那样制备的就是Fe(OH)3沉淀,就属于浊液了。所以不能说Fe(OH)3是胶体而不是浊液,要看你制备的方式啊。...
- 1年前
相关推荐
- 以下与盐类水解无关的 ( )1.将饱和氯化铁溶液滴入沸水制备Fe(OH)3胶体 2.草木灰不能和氮肥同时使用 3.正常雨
以下与盐类水解无关的 ( )
1.将饱和氯化铁溶液滴入沸水制备Fe(OH)3胶体 2.草木灰不能和氮肥同时使用 3.正常雨水的PH=5.6 4.将FeCl3固体溶于浓盐酸配制FeCl3溶液 感冒不好1年前5
感冒不好1年前5 -
 潇柠 共回答了11个问题
潇柠 共回答了11个问题 |采纳率90.9%c错,不是水解而是电离1年前查看全部
- 将饱和溶液FeCl3加入沸水中能制得Fe(OH)3胶体,下列有关说法正确的是( )
将饱和溶液FeCl3加入沸水中能制得Fe(OH)3胶体,下列有关说法正确的是( )
A.溶液和胶体的本质区别是能否发生丁达尔效应
B.含0.1mol FeCl3溶质的溶液形成胶体后,胶体粒子为0.1mol
C.分散系中分散质粒子的直径:Fe(0H)3悬浊液>Fe(0H)3胶体>FeCl3溶液
D.可通过观察液体是否澄清透明,来区别溶液和胶体 longkaxin1年前1
longkaxin1年前1 -
 乡下车夫 共回答了12个问题
乡下车夫 共回答了12个问题 |采纳率83.3%解题思路:A、胶体区别于其他分散系的本质特征是分散质微粒直径的大小不同;
B、胶体粒子是大量氢氧化铁的聚集体;
C、根据分散系的分类依据判断;
D、有的胶体也是澄清透明的.A、胶体区别于其他分散系的本质特征是分散质微粒直径的大小不同,分散质微粒直径介于1-100nm的为胶体,故A错误;
B、胶体粒子是大量氢氧化铁的聚集体,所以含0.1mol FeCl3溶质的溶液形成胶体后,胶体粒子小于0.1mol,故B错误;
C、根据分散质微粒直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以分散系中分散质粒子的直径:Fe(0H)3悬浊液>Fe(0H)3胶体>FeCl3溶液,故C正确;
D、有的胶体也是澄清透明的,可以根据能否发生丁达尔效应来区别溶液和胶体,故D错误;
故选C.点评:
本题考点: 胶体的重要性质.
考点点评: 本题考查了分散系溶液、浊液、胶体的区别,胶体的性质及鉴别等,注意相关基础知识的积累,题目难度不大.1年前查看全部
- (2011•南平二模)某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡
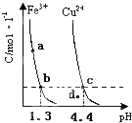 (2011•南平二模)某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳
(2011•南平二模)某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳
离子浓度随溶液pH的变化如图所示.下列判断正确的是( )
A.加适量浓NH3•H2O可使溶液由a点变到b点
B.c、d两点代表的溶液中c(H+)与c(OH-)乘积不相等
C.Cu(OH)2在c点比在d点代表的溶液中溶解程度小
D.该温度下,氢氧化铁的Ksp[Fe(OH)5大于氢氧化铜的Ksp[Cu(OH)2] 苦涩的小草1年前1
苦涩的小草1年前1 -
 kafeiggw9 共回答了21个问题
kafeiggw9 共回答了21个问题 |采纳率95.2%解题思路:A.由a点变到b点,pH增大;
B.Kw只与温度有关,与溶液的酸碱性无关;
C.注意分析处在曲线上的点与曲线外的点有什么区别;
D.根据图象找出可用来比较Fe(OH)3与Cu(OH)2溶度积常数点,可用b、c进行计算.A.向溶液中加入氨水,溶液的pH增大,则铁离子浓度降低,所以可以由a点变到b点,故A正确;
B.只要温度不发生改变,溶液中c(H+)与c(OH-)的乘积(即Kw)就不变.该题中温度条件不变,故c、d两点代表的溶液中c(H+)与c(OH-)的乘积相等,故B错误;
C.在C点表示饱和溶液,在d点表示不饱和溶液,所以Cu(OH)2在c点比在d点代表的溶液中溶解程度大,故C错误;
D.由b、c两点对应数据可比较出KSP[Fe(OH)3]与KSP[Cu(OH)2]的大小,KSP[Fe(OH)3]=c(Fe3+)•(OH-)3=c(Fe3+)•(10-12.7)3,KSP[Cu(OH)2]=c(Cu2+)•(OH-)2=c(Cu2+)•(10-9.6)2,因c(Fe3+)=c(Cu2+),故KSP[Fe(OH)3]<KSP[Cu(OH)2],故D错误;
故选A.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查沉淀溶解平衡、溶度积、pH、水的离子积等知识点,对图象中的数据进行定量或定性处理,找出数据(或坐标点)之间存在的相互关系;明确坐标点所表达的涵义;对溶度积和水的离子积有正确的理解.1年前查看全部
- 下列排列顺序正确的是( )A.固体热稳定性:Na2CO3>CaCO3>NaHCO3B.微粒半径:Fe(OH)3胶粒>K
下列排列顺序正确的是( )
A.固体热稳定性:Na2CO3>CaCO3>NaHCO3
B.微粒半径:Fe(OH)3胶粒>K+>C1->Na+
C.给出质子的能力:CH3COOH>C2H5OH>H2O
D.氢化物的沸点:H2Se>H2S>H2O Henter_Han1年前1
Henter_Han1年前1 -
 volvochuang 共回答了16个问题
volvochuang 共回答了16个问题 |采纳率100%解题思路:A、碳酸钠稳定不分解,碳酸钙高温分解,碳酸氢钠加热分解;
B、Fe(OH)3胶粒是很多Fe(OH)3集合体,大于溶液中离子;电子层排布相同,核电荷数越大离子半径越小,最外层电子数相同,电子层越多,离子半径越大,据此判断;
C、醋酸属于酸,溶于水呈酸性,水为弱电解质,可以电离出氢离子,乙醇是非电解质,不能电离出氢离子;
D、水分子键存在氢键,高于同族其它元素氢化物,沸点最高,H2Se、H2S结构相似,相对分子质量越大,沸点越高.A、碳酸钠稳定不分解,碳酸钙高温分解,碳酸氢钠加热分解,固体热稳定性:Na2CO3>CaCO3>NaHCO3,故A正确;
B、Fe(OH)3胶粒是很多Fe(OH)3集合体,大于溶液离子;电子层排布相同,核电荷数越大离子半径越小,所以C1->K+,最外层电子数相同,电子层越多,离子半径越大,所以K+>Na+,微粒半径:Fe(OH)3胶粒>C1->K+>Na+,故B错误;
C、醋酸属于酸,溶于水呈酸性,水为弱电解质,可以电离出氢离子,呈中性;乙醇是非电解质,不能电离出氢离子,给出质子的能力:CH3COOH>H2O>C2H5OH,故C错误;
D、水分子键存在氢键,高于同族其它元素氢化物,沸点最高,H2Se、H2S结构相似,相对分子质量越大,分子间作用力越强,沸点越高,故氢化物的沸点:H2O>H2Se>H2S,故D错误.
故选A.点评:
本题考点: 微粒半径大小的比较;氢键的存在对物质性质的影响;弱电解质在水溶液中的电离平衡;钠的重要化合物.
考点点评: 本题综合性较大,涉及碳酸盐稳定性比较、微粒大小比较、氢化物沸点比较、电解质电离等,难度中等,旨在考查学生对规律的掌握,D中注意中学中常见存在氢键的物质.1年前查看全部
- 下列物质在水溶液中不存在除水电离之外的电离平衡的是?(NH4)2SO4 NaHCO3 H3PO4 Fe(OH)3
下列物质在水溶液中不存在除水电离之外的电离平衡的是?(NH4)2SO4 NaHCO3 H3PO4 Fe(OH)3
为什么? smlpig1年前1
smlpig1年前1 -
 taojingxinmi 共回答了19个问题
taojingxinmi 共回答了19个问题 |采纳率100%是(NH4)2SO4
(NH4)2SO4完全电离:(NH4)2SO4 == 2NH4+ + SO4^2-
NaHCO3中HCO3-存在电离平衡:HCO3- H+ + CO3^2-
H3PO4是弱酸,Fe(OH)3是弱碱,弱酸和弱碱的电离都存在平衡.1年前查看全部
- 溶液中有Cu2+,Cl-,Fe3+加入物质y过滤得到沉淀Fe(OH)3和溶液,将此溶液蒸发结晶得CuCl2.2H2O(纯
溶液中有Cu2+,Cl-,Fe3+加入物质y过滤得到沉淀Fe(OH)3和溶液,将此溶液蒸发结晶得CuCl2.2H2O(纯).
(已知完全生成氢氧化物所需PH值:Fe3+为3.7,Cu为6.4)
问物质y为( ) 纤手49号1年前5
纤手49号1年前5 -
 你也好不到哪里去 共回答了24个问题
你也好不到哪里去 共回答了24个问题 |采纳率87.5%三价铁离子易水解使溶液显酸性
FeCl3+3H2O=Fe(OH)3+3HCl
溶液蒸发结晶得纯CuCl2.2H2O
所以加入的试剂不应该引入其他阴离子
加入CuO和Cu(OH)2 Cu2(OH)2CO3
它可以反应消耗H+
促使三铁离子水解完全
生成Fe(OH)3
从而铁离子水解生成Fe(OH)3析出1年前查看全部
- 碱能使酚酞溶液变红对不对?还有、Fe(OH)3不能电离,Fe2+ 表示一个铁离子带两个单位正电荷
碱能使酚酞溶液变红对不对?还有、Fe(OH)3不能电离,Fe2+ 表示一个铁离子带两个单位正电荷
这些对不对、快点嘛大哥大姐们后天考试了 jasonlee751年前1
jasonlee751年前1 -
 陈留儒生 共回答了17个问题
陈留儒生 共回答了17个问题 |采纳率88.2%碱能使酚酞溶液变红是对的,Fe(OH)3并不是不能电离,而是电离程度很小而已,符合碱的定义,电离出的阴离子全是氢氧根离子.e2+ 表示一个铁离子带两个单位正电荷是对的.1年前查看全部
- 请问怎样从Fe(OH)3制备FeCl2?写出其反应方程式
 韩韩5201年前1
韩韩5201年前1 -
 sglibo 共回答了15个问题
sglibo 共回答了15个问题 |采纳率100%Fe(OH)3 + 3 HCl ===FeCl3 + 3H2O
2FeCl3 + Fe=======3FeCl21年前查看全部
- (Ⅰ)已知常温下,Ksp[Fe(OH)3]=4.0×10-38,在FeCl3溶液中加入NaHCO3溶液产生沉淀和气体,反
(Ⅰ)已知常温下,Ksp[Fe(OH)3]=4.0×10-38,在FeCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:______;若将所得悬浊液的pH调整为4,则溶液中Fe3+浓度为______mol•L-1
(Ⅱ)常温下,如果取0.20mol•L-1HA溶液与0.10mol•L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合后溶液的pH=8,试回答以下问题:
(1)混合溶液显碱性的原因是______.
(2)求出混合液中下列算式的精确计算结果(填具体数值).
①c(Na+)-c(A-)=______ mol•L-1;
②c(A-)+c(HA)=______ mol•L-1;
③c(HA)-c(A-)=______ mol•L-1. 冬冷夏熟1年前1
冬冷夏熟1年前1 -
 烛影摇红i 共回答了23个问题
烛影摇红i 共回答了23个问题 |采纳率95.7%解题思路:(Ⅰ)NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体;
已知溶液pH=4,即c(H+)=10-4mol/L,则c(OH-)=10-10mol/L,根据Ksp[Fe(OH)3]求出Fe3+浓度;
(Ⅱ)(1)常温下,如果取0.20mol•L-1HA溶液与0.10mol•L-1NaOH溶液等体积混合,生成等浓度的NaA和HA,溶液中存在NaA的水解和HA的电离,溶液的pH=8说明以电离为主;
(2)0.20mol•L-1HA溶液与0.10mol•L-1NaOH溶液等体积混合,NaA浓度为0.05mol/L,HA的浓度为0.05mol/L,溶液的pH=8,则c(H+)=10-8mol/L,c(OH-)=10-6mol/L,
①根据溶液中电荷守恒分析;
②根据溶液中物料守恒即A元素守恒分析;
③根据溶液中电荷守恒和物料守恒综合分析.(Ⅰ)NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体;
反应的离子方程式为Fe3++3HCO3-═Fe(OH)3↓+3CO2↑,已知溶液pH=4,即c(H+)=10-4mol/L,
则c(OH-)=10-10mol/L,
已知Ksp[Fe(OH)3]=4.0×10-38,
所以c(Fe3+)=
Ksp[Fe(OH)3]
[c(OH−)]3=
4.0×10−38
(10−10)3=4.0×10-8mol•L-1,
故答案为:Fe3++3HCO3-═Fe(OH)3↓+3CO2↑;4.0×10-8;
(Ⅱ)(1)常温下,如果取0.20mol•L-1HA溶液与0.10mol•L-1NaOH溶液等体积混合,生成等浓度的NaA和HA,溶液中存在NaA的水解和HA的电离,溶液的pH=8说明以电离为主,即A-水解程度大于同浓度的HA的电离程度,
故答案为:A-水解程度大于同浓度的HA的电离程度;
(2)0.20mol•L-1HA溶液与0.10mol•L-1NaOH溶液等体积混合,NaA浓度为0.05mol/L,HA的浓度为0.05mol/L,溶液的pH=8,则c(H+)=10-8mol/L,c(OH-)=10-6mol/L,
①根据电荷守恒,c(Na+)+c(H+)=c(A-)+c(OH-),故c(Na+)-c(A-)=c(OH-)-c(H+)=10-6-10-8=9.9×10-7mol•L-1;
故答案为:9.9×10-7;
②0.20mol•L-1HA溶液与0.10mol•L-1NaOH溶液等体积混合后,NaA浓度为0.05mol/L,HA的浓度为0.05mol/L,根据A元素守恒c(A-)+c(HA)=0.05+0.05=0.10mol•L-1,
故答案为:0.10;
③c(A-)+c(HA)+2[c(Na+)-c(A-)]=0.10mol•L-1+2(9.9×10-7mol•L-1),
所以c(HA)-c(A-)=0.10mol•L-1+2(9.9×10-7mol•L-1)-2c(Na+),
已知c(Na+)=0.05mol•L-1;
故c(HA)-c(A-)=1.98×10-6mol•L-1,
故答案为:1.98×10-6.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;离子浓度大小的比较;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查盐的水解,涉及内容较多,利用了电荷守恒和物料守恒,难度中等,需要细致分析,方能得到正确结果.1年前查看全部
- 向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体.
向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体.
为什么这句话是不对的? 阁内婷影12211年前3
阁内婷影12211年前3 -
 qijin666 共回答了17个问题
qijin666 共回答了17个问题 |采纳率100%得到的不是胶体,而是沉淀,要想得到胶体,应该是向沸水中(而不是碱液)滴加几滴FeCl3饱和溶液即可,注意Fe(OH)3胶体非常容易聚沉成为沉淀1年前查看全部
- 按要求完成下列方程式.(1)Fe(OH)3与KClO在强碱性条件下制取K2FeO4的离子方程式______.(2)与Mn
按要求完成下列方程式.
(1)Fe(OH)3与KClO在强碱性条件下制取K2FeO4的离子方程式______.
(2)与MnO2•Zn电池类似,K2FeO4•Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为______.
(3)用氯仿(CHCl3)与双氧水反应制光气(COCl2)的化学方程式______.
(4)用惰性电极电解AlCl3溶液的离子方程式______.
(5)向NH4Fe(SO4)2溶液中滴加Ba(OH)2溶液至铁离子恰好沉淀的离子方程式______. qsmx1年前1
qsmx1年前1 -
 zfz7852 共回答了15个问题
zfz7852 共回答了15个问题 |采纳率93.3%解题思路:(1)Fe(OH)3与KClO在强碱性条件下发生氧化还原反应生成K2FeO4、氯化钾和水,根据化合价升降相等配平并写出反应的离子方程式;(2)K2FeO4•Zn成碱性电池中,Zn为负极,则为K2FeO4正极,+6价的铁得到电子生成氢氧化铁,据此写出电极反应式;(3)CHCl3中碳为+2价,COCl2中碳为+4价,故H2O2中氧元素化合价由-1价降低为-2价,生成H2O,由电子转移守恒与原子守恒可知可知,CHCl3、H2O2、COCl2、H2O的化学计量数为1:1:1:1,根据原子守恒故含有HCl生成;(4)惰性电极电解氯化铝溶液,阳极氯离子放电生成氯气、阴极水电离的氢离子得到电子生成氢气,同时生成的氢氧根离子与铝离子反应生成氢氧化铝沉淀;(5)当铁离子恰好生成氢氧化铁沉淀时,NH4Fe(SO4)2与氢氧化钡的物质的量之比为2:3,铵根离子没有参与反应.(1)次氯酸根离子具有强氧化性,能够将氢氧化铁氧化成FeO42-,FeO42-中铁元素的化合价为+6价,氢氧化铁中铁的化合价为+3价,铁化合价升高了3价,次氯酸根离子中Cl盐酸的化合价为+1价,被还原变成-1价的氯离子,化合价降低了2价,化合价变化的最小公倍数为6,则氢氧化铁的计量数为2、次氯酸根离子的计量数为3,然后根据观察法配平,该反应的离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-;
(2)K2FeO4•Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,负极为锌失电子发生氧化反应,电极反应Zn-2e-+2OH-=Zn(OH)2;依据产物和电子守恒写出正极反应:FeO42-+3e-+4H2O=Fe(OH)3↓+5OH-,
故答案为:FeO42-+3e-+4H2O=Fe(OH)3↓+5OH-;
(3)CHCl3中碳为+2价,COCl2中碳为+4价,故H2O2中氧元素化合价由-1价降低为-2价,生成H2O,由电子转移守恒与原子守恒可知可知,CHCl3、H2O2、COCl2、H2O的化学计量数为1:1:1:1,根据原子守恒故含有HCl生成,故反应方程式为CHCl3+H2O2=HCl+H2O+COCl2,
故答案为:CHCl3+H2O2=HCl+H2O+COCl2;
(4)惰性电极电解氯化铝溶液时,阳极放电的为氯离子,氯离子失去电子生成氯气,阴极氢离子得到电子生成氢气,生成的氢氧根离子与氯离子反应生成氢氧化铝沉淀,反应达到离子方程式为:2Al3++6Cl-+6H2O=3H2↑+2Al(OH)3↓+3Cl2↑,
故答案为:2Al3++6Cl-+6H2O=3H2↑+2Al(OH)3↓+3Cl2↑;
(5)向NH4Fe(SO4)2溶液中滴加Ba(OH)2溶液至铁离子恰好沉淀,此时铵根离子没有参与反应,NH4Fe(SO4)2与Ba(OH)2的物质的量之比为2:3,反应生成硫酸钡沉淀和氢氧化铁沉淀,反应的离子方程式为:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓,
故答案为:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓.点评:
本题考点: 离子方程式的书写;电极反应和电池反应方程式.
考点点评: 本题考查了离子方程式、化学方程式的书写,电极反应式的书写,题目难度中等,试题题量稍大,知识点较多,考查较为综合,注意掌握离子方程式、化学方程式的书写原则,明确电解原理及其应用方法,试题培养了学生的分析、理解能力及灵活应用所学知识都能力.1年前查看全部
- (1)已知Fe(OH)3能与次氯酸盐发生如下反应(未配平):Fe(OH)3+ClO-+OH-→FeO4n-+Cl-+H2
(1)已知Fe(OH)3能与次氯酸盐发生如下反应(未配平):Fe(OH)3+ClO-+OH-→FeO4n-+Cl-+H2O
①已知有10.7g Fe(OH)3参加反应,共转移了0.3NA个电子,则n=______,FeO4n-中铁元素的化合价为______.
②根据所学的知识,推测FeO4-能和下列______(填序号)物质反应.
A.KMnO4 B.SO2 C.H2S D.O2
(2)一定条件下,向含硝酸的废水中加入CH3OH,将HNO3还原成N2.若该反应消耗32g CH3OH,转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是______. tcsujdr1年前1
tcsujdr1年前1 -
 阴阳两茫茫 共回答了11个问题
阴阳两茫茫 共回答了11个问题 |采纳率81.8%解题思路:(1)反应中Fe元素化合价升高,被氧化,Cl元素化合价降低,被还原,结合氧化还原反应中氧化剂、还原剂得失电子数目相等计算;
(2)32gCH30H转移6mol电子,即1mol还原剂参加反应转移6mol电子,根据消耗甲醇的量和转移电子的量来书写方程式,并确定氧化剂和还原剂的量的多少;.(1)①n(Fe(OH)3)=[10.7g/107g/mol]=0.1mol,设Fe被氧化生成的FeO4n-中Fe元素化合价为x,
则0.1mol×(x-3)=0.3mol,x=6,由化合价代数和为0可知,n=2,
故答案为:2;+6;
②FeO42-中Fe为+6价,具有强氧化性,可与还原性物质反应,B、C符合,
故答案为:B、C;
(2)消耗32g(1mol)CH3OH转移6mol电子,由CH3OH中碳原子的化合价升高6,所以反应后碳的化合价为+4,产物为CO2,根据质量守恒和化合价升降总数相等得:5CH3OH+6HNO3═5CO2+3N2+13H2O,反应中氧化剂是硝酸,还原剂是甲醇,参加反应的还原剂和氧化剂的物质的量之比是5:6,
故答案为:5:6.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度解答该题,难度中等.1年前查看全部
- 用什么方法精制Fe(OH)3胶体?
用什么方法精制Fe(OH)3胶体?
注意不是向蒸馏水中加入Fecl3那种方法 是精制
 45fdsa561年前1
45fdsa561年前1 -
 mingh0505 共回答了19个问题
mingh0505 共回答了19个问题 |采纳率100%渗析的方法.即用半透膜“过滤”将Fe(OH)3胶体置于半透膜内,然后将半透膜置于蒸馏水中,再更换蒸馏水多次,即可1年前查看全部
- 电泳实验说明Fe(OH)3胶体带正电荷.
电泳实验说明Fe(OH)3胶体带正电荷.
这句话为什么是错的?
是应该说胶体粒子带正电荷吗? wuqian19761年前2
wuqian19761年前2 -
 7peg01c 共回答了18个问题
7peg01c 共回答了18个问题 |采纳率100%Fe(OH)3胶体是指总体,总体呈现中性,并不带电,应该说胶体粒子带正电荷.1年前查看全部
- 关于化学实验操作的1制备Fe(OH)3胶体,向盛有废水的烧杯中滴加FeCl3饱和溶液并长时间煮沸2为鉴别KCl、AlCl
关于化学实验操作的
1制备Fe(OH)3胶体,向盛有废水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
2为鉴别KCl、AlCl3、和MgCl2溶液,分别向三种溶液中滴加NaOH至过量
以上两个哪个错了 错在哪里 为什么 yutiandegu1年前3
yutiandegu1年前3 -
 lichu_as 共回答了18个问题
lichu_as 共回答了18个问题 |采纳率83.3%第一个错了,不应长时间煮沸,而是继续煮沸至溶液呈红褐色【还有,你打错字了,“废水”应为“沸水”,就不算了^_^】
第二个没问题,无现象的是KCl溶液,有沉淀生成且不消失的是MgCl2溶液,生成沉淀又逐渐消失的是AlCl3溶液1年前查看全部
- 漂白剂漂白粉有漂白作用,众所周知,Fe(OH)3有红色,如果直接把漂白剂加入Fe(OH)3中,
 Catherine云1年前2
Catherine云1年前2 -
 然_后是什么 共回答了16个问题
然_后是什么 共回答了16个问题 |采纳率87.5%Fe(OH)3是红褐色,加入漂白剂不会变白,因为漂白剂漂白是因为其会生成次氯酸,利用次氯酸的强氧化性漂白,而Fe(OH)3根本没有还原性.1年前查看全部
- fe(oh)3+3hcl反应现象是什么
 brucelix1年前1
brucelix1年前1 -
 xwqqs 共回答了21个问题
xwqqs 共回答了21个问题 |采纳率81%沉淀溶解,生成黄褐色溶液1年前查看全部
- 为什么FeCl3溶液会产生HCl?照理说FeCl3电解产生的Cl-和H+不反映啊,只是水解Fe3+产生Fe(OH)3不是
为什么FeCl3溶液会产生HCl?照理说FeCl3电解产生的Cl-和H+不反映啊,只是水解Fe3+产生Fe(OH)3不是吗?
 dboy02011年前3
dboy02011年前3 -
 1234- 共回答了14个问题
1234- 共回答了14个问题 |采纳率92.9%强酸弱碱盐
强酸弱碱盐是强酸和弱碱反应生成的盐.因为金属离子或铵根离子在水解中消耗一部分的氢氧根离子,电离出氢离子,所以溶液呈弱酸性.
溶液之所以程酸性是因为溶液H+比OH-多.原来溶液H+=OH-,因为一部分OH-和Fe反应,生成Fe(OH)3,所以H+比OH-多,溶液程酸性.1年前查看全部
- Fe(OH)3是强电解质吗
 将d领师0来1年前1
将d领师0来1年前1 -
 啥时候变睿智 共回答了18个问题
啥时候变睿智 共回答了18个问题 |采纳率88.9%氢氧化铁不是强碱,所以它不是强电解质,但是它是电解质.1年前查看全部
- 向Fe(OH)3胶体中加入MgCl2后会怎样?
向Fe(OH)3胶体中加入MgCl2后会怎样?
书上说会聚沉生成红褐色沉淀 请具高手体详细说一下 越疯越RP1年前3
越疯越RP1年前3 -
 春风锦 共回答了19个问题
春风锦 共回答了19个问题 |采纳率94.7%MgCl2是电解质,导致胶体的聚沉现象1年前查看全部
- 下列溶液对Fe(OH)3胶体聚沉能力强弱顺序?NaCL,MgCL2,ALCL3.
下列溶液对Fe(OH)3胶体聚沉能力强弱顺序?NaCL,MgCL2,ALCL3.
我认为是NaCL>MgCL2>ALCL3, fycherry1年前2
fycherry1年前2 -
 mouseye2000 共回答了18个问题
mouseye2000 共回答了18个问题 |采纳率77.8%等物质的量的情况下AlCl3的聚沉能力最强,其次是氯化镁、氯化钠,因为氢氧化铁胶体粒子带正电荷,负电荷数越多,中和效果越好,将粒子间的斥力消除,聚沉能力越强1年前查看全部
- 如何判断物质是溶液或者是胶体?例如,如何判断淀粉溶液是胶体还是溶液?还有Fe(OH)3溶液?
 2000cici1年前3
2000cici1年前3 -
 薄菏花开 共回答了25个问题
薄菏花开 共回答了25个问题 |采纳率92%胶体有明显的丁达尔现象啊.是一种均匀混合物,在胶体中含有两种不同状态的物质,一种分散,另一种连续.分散的一部分是由微小的粒子或液滴所组成,分散质粒子直径在1nm—100nm之间的分散系;胶体是一种分散质粒子直径介于粗分散体系和溶液之间的一类分散体系,这是一种高度分散的多相不均匀体系.能发生丁达尔现象[1],产生聚沉,电泳现象,渗析作用,吸附性等性质.淀粉和Fe(OH)3都是典型的胶体.1年前查看全部
- 铁与水蒸气反应生成Fe(OH)3的电极反应方程式
 L阿长B1年前1
L阿长B1年前1 -
 想法勇气做 共回答了22个问题
想法勇气做 共回答了22个问题 |采纳率95.5%气体反应
没有电极反应
不是电解过程1年前查看全部
- 淀粉胶体中加入电解质溶液会否发生聚沉?为什么?Fe(OH)3胶体呢?
 legy88481年前2
legy88481年前2 -
 caval 共回答了13个问题
caval 共回答了13个问题 |采纳率84.6%应该会i!胶体是不带电的,可是胶粒带点,电解质溶液破坏了平衡,于是就发生沉降!比如,卤水点豆腐.氢氧化铁胶体现象明显,这个是教学的实验.1年前查看全部
- 如何分离fe(oh)3胶体和fecl3溶液的混合物,用什么方法
 当当19831041年前1
当当19831041年前1 -
 天娱很生气 共回答了16个问题
天娱很生气 共回答了16个问题 |采纳率93.8%直接答渗析,用半透膜,因为胶体不能通过半透膜,而氯化铁溶液能够通过半透膜.1年前查看全部
- 这种检测铁离子的方法对吗?用生成Fe(OH)3的方法来测定某溶液中Fe+的含量在较高温度下保温一段时间以进行陈化这种做法
这种检测铁离子的方法对吗?
用生成Fe(OH)3的方法来测定某溶液中Fe+的含量在较高温度下保温一段时间以进行陈化这种做法对吗? 小米的棒棒糖1年前1
小米的棒棒糖1年前1 -
 cly860301 共回答了9个问题
cly860301 共回答了9个问题 |采纳率100%LZ说的这种方法,我没有试过,我介绍一种方法可以试一试:取一百毫升的锥形瓶,加入五毫升试样蒸馏数分钟到冒白气为止;加入一比三十五的硫酸,加入五毫升的过硫酸钾和剩下的蒸馏水使锥形瓶容量至五十毫升,加热至二十毫升左右.移入比色管管中再加三毫升抗坏血酸和十五毫升PH值为4.5的乙酸-乙酸钠溶液,加入五毫升的邻菲啰啉.放置十五分钟后比色,最后计算即可.查看原帖1年前查看全部
- 将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是( )
将某溶液逐滴加入Fe(OH)3溶胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是( )
A. 2mol•L-1 H2SO4溶液
B. 2mol•L-1 NaOH溶液
C. 2mol•L-1 MgSO4溶液
D. 硅酸溶胶 chorn1年前2
chorn1年前2 -
 竹青林 共回答了16个问题
竹青林 共回答了16个问题 |采纳率87.5%解题思路:根据胶体的性质及所加物质的性质分析,胶体和电解质溶液能发生聚沉现象.能使胶体聚沉的物质有电解质溶液和带相反电荷的胶体.
A、稀硫酸是电解质溶液能使Fe(OH)3溶胶聚沉,但H2SO4可使Fe(OH)3沉淀溶解,故A正确;
B、氢氧化钠能使Fe(OH)3溶胶聚沉,但不能溶解沉淀,故B错误;
C、MgSO4溶液能使Fe(OH)3溶胶聚沉,但不能溶解沉淀,故C错误;
D、硅酸溶液的胶粒带负电荷,能使Fe(OH)3溶胶聚沉,但不能溶解沉淀,故D错误.
故选A.点评:
本题考点: 胶体的重要性质.
考点点评: 本题考查了胶体的性质,胶体区别于其它分散系的本质特征是胶体粒子直径介于1-100nm之间,而不是丁达尔效应,丁达尔效应是物理变化不是化学变化.1年前查看全部
- Fe(OH)3胶体为什么带正电荷
 philipice1年前1
philipice1年前1 -
 TC野兽Pie 共回答了22个问题
TC野兽Pie 共回答了22个问题 |采纳率95.5%这是本身一种性质1年前查看全部
- 谢啦:既然胶体带电的原理是优先吸附与其组成相关的离子,那么Fe(OH)3胶体吸附的是什么离子?
 我是九色鹿1年前2
我是九色鹿1年前2 -
 wishk 共回答了19个问题
wishk 共回答了19个问题 |采纳率89.5%都可能. 如果制备环境为碱性,带负电 吸附OH- 因为这时OH-肯定是偏多的.
由于FeO+与氢氧化铁相似,所以制备时优先吸附FeO+(高中的HCl制备)
Fe(OH)3+HCl==FeOCl+2H2O
FeOCl==FeO+ + Cl
(这是少量反应)1年前查看全部
- (2004•宣武区二模)用Fe、Fe2O3、HCl、Fe(OH)3、CuSO4溶液,五种物质两两进行反应,能得到FeCl
(2004•宣武区二模)用Fe、Fe2O3、HCl、Fe(OH)3、CuSO4溶液,五种物质两两进行反应,能得到FeCl3的方法有( )
A.1种
B.2种
C.3种
D.4种 上海建桥学院1年前1
上海建桥学院1年前1 -
 shuxiyouzi 共回答了28个问题
shuxiyouzi 共回答了28个问题 |采纳率96.4%解题思路:五种物质两两混合能够发生化学反应的是:
铁和盐酸反应能生成氯化亚铁和氢气;
铁和硫酸铜反应能生成硫酸亚铁和铜;
氧化铁和盐酸反应能生成氯化铁和水;
盐酸和氢氧化铁反应能生成氯化铁和水;五种物质两两之间能够进行反应的是:铁和盐酸,铁和硫酸铜,氧化铁和盐酸,盐酸和氢氧化铁;
其中能生成氯化铁的是:氧化铁和盐酸,盐酸和氢氧化铁,有2种.
故选:B.点评:
本题考点: 物质的相互转化和制备;酸的化学性质;盐的化学性质.
考点点评: 本题主要考查物质之间反应时的生成物种类,要求对各种化学反应有一个全面的理解,只有这样才能做出正确的解答.1年前查看全部
- FeCl3溶液、Fe(OH)3胶体共同具备的性质是( )
FeCl3溶液、Fe(OH)3胶体共同具备的性质是( )
A.都呈透明的红褐色
B.都比较稳定,密封保存一段时间都不会产生沉淀
C.分散质颗粒直径相同
D.当有光线透过时,都能产生丁达尔效应 爱ps1年前1
爱ps1年前1 -
 seraphim18 共回答了23个问题
seraphim18 共回答了23个问题 |采纳率91.3%解题思路:A.根据FeCl3溶液与Fe(OH)3胶体的颜色分析解答;
B.胶体具有介稳性,溶液具有稳定性;
C.溶液中溶质粒子小胶体粒子直径较大;
D.只有胶体具有丁达尔效应,溶液不具备.A.因FeCl3溶液与Fe(OH)3胶体的颜色分别为棕黄色、红褐色,故A错误;
B.胶体具有介稳性,放置不会产生沉淀,溶液是稳定的,故B正确;
C.Fe(OH)3胶体的分散质颗粒直径在1-100nm之间,FeCl3溶液的分散质颗粒直径小于1nm,分散质颗粒直径不相同,故C错误;
D.只有胶体具有丁达尔效应,所以Fe(OH)3胶体具有丁达尔效应,而FeCl3溶液不具备,故D错误;
故选B.点评:
本题考点: 胶体的重要性质.
考点点评: 本题考查了胶体的性质以及胶体和溶液的区别,题目难度不大,掌握胶体的性质是解题的关键.1年前查看全部
- 1L1mol/L的饱和FeCl3溶液滴入沸水中完全水解生成Fe(OH)3胶体粒子数为NA个?
1L1mol/L的饱和FeCl3溶液滴入沸水中完全水解生成Fe(OH)3胶体粒子数为NA个?
其次:
是否是完全转化成胶体了呢?
如果没有全部转化,那么没有全部转化的原因是什么? 陨石剑1年前1
陨石剑1年前1 -
 志永 共回答了15个问题
志永 共回答了15个问题 |采纳率93.3%错误.
1、Fe3+水解制备胶体时,Fe3+水解是不完全的,1 mol Fe3+不会得到1 mol Fe(OH)3.
2、即使水解完全,胶粒也不是1 mol,因为多个Fe(OH)3抱团形成1个胶粒.
总之,胶粒个数是无法确定的1年前查看全部
- 单质铁与水在高温下反应生成Fe(OH)3+H2 采取怎样措施能使其顺利向右进行?
 其实俺很在意1年前2
其实俺很在意1年前2 -
 windy51E3 共回答了23个问题
windy51E3 共回答了23个问题 |采纳率82.6%向溶液中加酸,使其与氢氧化铁中和就可使平衡向右移动.
由于本题没有给出是否为放热或吸热反应,若为吸热反应,则加热可使反应向右进行1年前查看全部
- 氢氧化铁和聚沉的问题.那个..氢氧化铁Fe(OH)3.什么情况是胶体,什么情况是红褐色沉淀.为什么有些反应的生成胶体,有
氢氧化铁和聚沉的问题.
那个..氢氧化铁Fe(OH)3.什么情况是胶体,什么情况是红褐色沉淀.为什么有些反应的生成胶体,有些反应是沉淀.什么反应生成胶体什么反应生成沉淀.
还有胶体到底是怎样聚沉的,..举例.
(不要复制粘贴) wgt0070071年前1
wgt0070071年前1 -
 非斯 共回答了17个问题
非斯 共回答了17个问题 |采纳率88.2%当氢氧化铁分子聚集在一起为1至100纳米的较大颗粒多相系统时为胶体溶液即溶胶,当它仅仅为分散的分子时就是红褐色沉淀.
区别胶体与沉淀的关键是:由于溶胶粒子的大小介于分散系与分子分散系之间,是一个多相系统,而一般的沉淀为小分子、原子或离子聚集体,处于单一的单相形态.要形成胶体有两种方式:1.分散法,把粗分散系中的物质经过破碎或者研磨成胶体要求;2.聚集法,通过改变溶剂或者利用化学反应手段将分散的小颗粒粒子聚集在一起.氢氧化铁胶体生成属于,化学合成法,是通过一个化学反应生成难溶物,在难溶性化合物从饱和溶液中析出的过程中市值聚合成溶胶粒子.1年前查看全部
- 化学的一些疑问FeSO4与NaOH反应生成Fe(OH)2.可是却又和O2生成Fe(OH)3怎么可以把空气的氧气隔绝,只生
化学的一些疑问
FeSO4与NaOH反应生成Fe(OH)2.可是却又和O2生成Fe(OH)3怎么可以把空气的氧气隔绝,只生成Fe(OH)2 rock_ai1年前2
rock_ai1年前2 -
 goyy 共回答了26个问题
goyy 共回答了26个问题 |采纳率88.5%水要用煮沸的蒸馏水,热的时候配制FeSO4和NaOH溶液,装入试管,表面用油封(苯或比水轻的不溶于水的有机物),隔绝空气冷却.反应的时候用长胶头滴管(也应做除氧处理)吸取氢氧化钠,插入FeSO4液面以下滴出.
其实Fe(OH)2本身不稳定,无法保存,这样做的目的也只是让它能保持时间长一点.我是想说,你这个问题其实没有太大的意义.
还有一些特定的做这个实验的装置,是用Fe与H2SO4反应制取FeSO4,然后利用氢气赶出氧气.1年前查看全部
- 为什么FeCl3不能和水反应?Fe3+不会和H2O电离出来的OH-发生反应生成Fe(OH)3沉淀吗?
 第一vv高长恭1年前1
第一vv高长恭1年前1 -
 只想你的好 共回答了22个问题
只想你的好 共回答了22个问题 |采纳率81.8%可以反应,这个是高中知识,把fecl3一滴一滴滴加到沸水中会生成沉淀1年前查看全部
- 胶体中各直径不同的Fe(OH)3粒子算不同的物质吗?
 keng111年前1
keng111年前1 -
 害老 共回答了18个问题
害老 共回答了18个问题 |采纳率100%不算.胶体中不同直径的Fe(OH)3粒子是指不同数量Fe(OH)3分子凝聚成的小粒子团,因为每个粒子团里粒子总数不同,所以呈现不同直径.然而,他们本质上都是Fe(OH)3,只是大小数量不同,因而是同一种物质.1年前查看全部
- 胶体能透过滤纸.浊液不能透过滤纸.那FE(OH)3胶体和FECL3为什么不能用过滤法分离
胶体能透过滤纸.浊液不能透过滤纸.那FE(OH)3胶体和FECL3为什么不能用过滤法分离
那要怎么分离 老头的汤婆婆1年前1
老头的汤婆婆1年前1 -
 dedicatedto3 共回答了21个问题
dedicatedto3 共回答了21个问题 |采纳率61.9%因为氯化铁的水解,
Fe3++3H2O=可逆=Fe(OH)3+3H+
所以等你分完了,就剩不下多少了
需用半透膜分离,分离时可加适量稀盐酸抑制水解
首先用滤纸过滤出氢氧化铁悬浊液,然后用半透膜过滤出氢氧化铁胶体,就完成了.
因为
氢氧化铁胶体粒子是不能 透过半透膜的
分散质粒子小于1nm是溶液
介于1nm与100nm的是胶体
大于100nm的是悬浊液或者乳浊液
半透膜的孔小于1nm
滤纸的孔大于100nm
因此:只有溶液中的粒子才能透过半透膜
胶体粒子能透过滤纸1年前查看全部
- 氯化铁水解,算它的平衡常数Fe(oH)3沉淀能算进去吗?
 不甘沉默的黑老鸹1年前1
不甘沉默的黑老鸹1年前1 -
 月吻123 共回答了23个问题
月吻123 共回答了23个问题 |采纳率95.7%不能算进去.化学平衡常数的计算只能是气体(g)或者在溶液(l)中进行的.固体物质包括沉淀(s)不计算在内.你可以在仔细看看课本,平衡常数的计算的注意事项中有物质聚集状态的1年前查看全部
- 某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质.
某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质.
(1)若将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是______.
A.冷水B.沸水C.NaOH浓溶液D.NaCl浓溶液
(2)现有甲、乙、丙、丁四名同学进行Fe(OH)3胶体的制备
①甲同学的操作是:取一小烧杯,加入25mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2mL FeCl3饱和溶液,用玻璃棒搅拌,继续煮沸至溶液呈红褐色,停止加热.请评价该操作是否正确______.
②乙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确______.
(3)写出制备Fe(OH)3胶体的化学方程式:______.
(4)怎样检验制备的物质是否为胶体?______.
(5)取少量你制得的胶体加入试管中,加入(NH4)2SO4溶液,现象是______,这种现象称为胶体的______.
(6)氢氧化铁胶体稳定存在的主要原因是______.
A.胶粒直径小于1nmB.胶粒带正电荷
C.胶粒作布朗运动D.胶粒能透过滤纸. 阳小战1年前1
阳小战1年前1 -
 www1www1 共回答了24个问题
www1www1 共回答了24个问题 |采纳率100%解题思路:(1)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液;
(2)制备氢氧化铁胶体时,不能用玻璃棒搅拌,防止胶体聚沉,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉;
(3)制备胶体的原理是利用铁离子水解生成氢氧化铁胶体;
(4)胶体具有丁达尔性质,是区别其它分散系的独特性质;
(5)胶体粒子带有电荷,加入电解质溶液消除粒子所带电荷,会是胶粒之间的排斥力减小,使胶体聚沉;
(6)胶粒带正电荷,相互排斥,而不易产生较大粒子而聚沉.(1)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,
故答案为:B;
(2)制备氢氧化铁胶体时,不能用玻璃棒搅拌,防止胶体聚沉,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,
故答案为:不正确、不正确;
(3)制备胶体的原理是利用铁离子水解生成氢氧化铁胶体,反应的化学方程式为FeCl3+3H2O═Fe(OH)3(胶体)+3HCl,
故答案为:FeCl3+3H2O═Fe(OH)3(胶体)+3HCl;
(4)胶体具有丁达尔效应,当用激光笔照射时,会有一道明亮的光路,是区别其它分散系的独特性质,当让一束光线通过制得的Fe(OH)3胶体,从侧面观察到一条光亮的“通路”,说明已经制得胶体,
故答案为:利用丁达尔效应:让一束光线通过制得的Fe(OH)3胶体,从侧面观察到一条光亮的“通路”,说明已经制得胶体;
(5)胶体粒子带有电荷,加入电解质溶液消除粒子所带电荷,会使胶粒之间的排斥力减小,使胶体聚沉生成红褐色沉淀,
故答案为:产生红褐色沉淀;聚沉;
(6)胶体具有很强的吸附能力,能吸附溶液中的离子而带电荷,胶粒之间相互排斥,而不易产生较大微粒而聚沉,故答案为:B.点评:
本题考点: 胶体的重要性质.
考点点评: 本题考查胶体的制备、性质,题目难度不大,易错点为胶体的制备,本题重点把握胶体的制备.1年前查看全部
- 下列说法中,不正确的是( )A.Na2CO3水溶液呈碱性,所以其热溶液可以除去物品表面的油污B.Fe(OH)3胶体能吸
下列说法中,不正确的是( )
A.Na2CO3水溶液呈碱性,所以其热溶液可以除去物品表面的油污
B.Fe(OH)3胶体能吸附水中的悬浮颗粒并沉降,因而具有净水作用
C.SO2与某些有色物质反应生成的无色物质不稳定,因而不能用于漂白纸浆
D.镁合金密度较小,硬度和强度较大,因而被大量用于制造火箭、导弹和飞机的部件 zhangfeng_09171年前1
zhangfeng_09171年前1 -
 宋永华 共回答了21个问题
宋永华 共回答了21个问题 |采纳率90.5%解题思路:A、油污的主要成分为油脂,在碱性条件下易发生水解;
B、明矾用作废水处理的混凝剂,明矾溶于水可以形成Al(OH)3胶体,胶体具有很大的表面积,吸附悬浮物质而沉降,起净水作用.
C、二氧化硫具有漂白性,与某些有色物质反应生成的无色物质不稳定,加热又恢复原来的颜色;
D、镁合金具有硬度大、耐腐蚀性、密度小等方面的特点.A、油污的主要成分为油脂,在碱性条件下易发生水解,而Na2CO3为强碱弱酸盐,溶液呈碱性,可用于洗去某些物质表面的油污,故A正确;
B、明矾用作废水处理的混凝剂,明矾溶于水可以形成Al(OH)3胶体,胶体具有很大的表面积,吸附悬浮物质而沉降,起净水作用,故B正确;
C、二氧化硫具有漂白性,与某些有色物质反应生成的无色物质不稳定,加热又恢复原来的颜色,可用于漂白纸浆,故C错误;
D、镁合金具有硬度大、耐腐蚀性、密度小等方面的特点,可用于制造火箭、导弹和飞机的部件,故D正确;
故选C.点评:
本题考点: 钠的重要化合物;胶体的应用;二氧化硫的化学性质;镁的化学性质.
考点点评: 本题主要考查了物质的性质,难度不大,注意掌握原理是解题的关键.1年前查看全部
- 室温时,ksp【Fe(OH)3】=2.6*10^-39,求饱和氢氧化铁溶液中,铁离子和氢氧根离子的浓度
 金色指甲油1年前1
金色指甲油1年前1 -
 dtotoo 共回答了17个问题
dtotoo 共回答了17个问题 |采纳率94.1%由反应方程式:
--------------Fe(OH)3 = 3OH- + Fe3+
平衡时:3s s
c(OH-) ^3 c(Fe3+) = Ksp
(3s)^3 s = Ksp
s = (Ksp/ 27)^1/4
s= 9.9*10^-11
c(Fe3+) = s= 9.9*10^-11 mol/L
c(OH-) = 3s = 2.97*10^-10 mol/L1年前查看全部
- Na2O2+FeCl2恰好将二价铁离子全部转化为Fe(OH)3沉淀?
Na2O2+FeCl2恰好将二价铁离子全部转化为Fe(OH)3沉淀?
方程式- -. freeboy_88481年前1
freeboy_88481年前1 -
 kanpu123 共回答了23个问题
kanpu123 共回答了23个问题 |采纳率91.3%4Na2o2 + 6H2O + 4FeCl2 = 8NaCl + 4Fe(OH)3↓ + O2↑1年前查看全部
- 关于电解的化学题以铁为阳极,铜为阴极 对足量NAOH溶液进行电解,一段时间后,得到4MOL FE(OH)3沉淀,此过程中
关于电解的化学题
以铁为阳极,铜为阴极 对足量NAOH溶液进行电解,一段时间后,得到4MOL FE(OH)3沉淀,此过程中消耗的水物质的量是
另:我想问下为什么Fe失电子不直接变成3价铁而是2价铁 lujian73341年前2
lujian73341年前2 -
 iy8hkg3ege 共回答了14个问题
iy8hkg3ege 共回答了14个问题 |采纳率92.9%4*3/2=6molH2O
“我想问下为什么Fe失电子不直接变成3价铁而是2价铁”
对于电极电势大于[电势(3价铁/0价铁)]的电对(如Cl2/Cl-)可以把Fe(0)直接变成3价铁
对于电极电势大于[电势(2价铁/0价铁)]的电对(如Cu2+/Cu)可以把Fe(0)变成2价铁
对于电极电小于[电势(2价铁/0价铁)]的电对(如Zn2+/Zn)不可以把Fe(0)变成2价铁1年前查看全部
- Fe(OH)3胶体和MgCl2溶液共同具备的性质是( )
Fe(OH)3胶体和MgCl2溶液共同具备的性质是( )
A. 两者均有丁达尔现象
B. 两者均能透过半透膜
C. 加入盐酸先沉淀,随后溶解
D. 分散质微粒可通过滤纸 Angel_wl1年前1
Angel_wl1年前1 -
 adasally 共回答了20个问题
adasally 共回答了20个问题 |采纳率80%解题思路:A.胶体有丁达尔效应,溶液无丁达尔效应;
B.胶体不能通过半透膜,溶液可以通过;
C.胶体遇电解质溶液发生聚沉;
D.溶液和胶体都能透过滤纸.A.只有胶体具有丁达尔效应,溶液不具备,故A错误;
B.胶体不能通过半透膜,溶液可以通过,故B错误;
C.胶体遇电解质溶液发生聚沉,过量的盐酸能使Fe(OH)3沉淀溶解,溶液无此性质,故C错误;
D.溶液和胶体都能透过滤纸,故D正确.
故选D.点评:
本题考点: 胶体的重要性质.
考点点评: 本题考查溶液和胶体的性质,难度不大,平时注意知识的积累.1年前查看全部
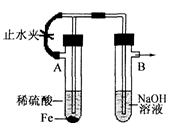
- 已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化成Fe(OH)3红褐色沉淀.右图为Fe(OH)2制备实验的改进
已知Fe(OH)2是白色絮状沉淀,并极易被空气中的氧气氧化成Fe(OH)3红褐色沉淀.右图为Fe(OH)2制备实验的改进装置,使用该装置能在较长时间内观察到生成的Fe(OH)2白色絮状沉淀.
(2)A试管中反应开始时,打开止水夹,B试管中看到的现象是
(3)若要在该装置中得到Fe(OH)2白色絮状沉淀,并在一定时间内放置被氧化成Fe(OH)3红褐色沉淀,下一步的实验操作是
答案是(2)导管口有气泡产生(3)关紧止水夹
分析下
 kuangkuangtang1年前6
kuangkuangtang1年前6 -
 atxdx 共回答了18个问题
atxdx 共回答了18个问题 |采纳率88.9%A试管中反应:Fe+H2SO4=FeSO4+H2,打开止水夹,氢气经左边的支管到B中的溶液中,再从溶液中逸出,赶走了B中的空气
关闭止水夹后,A中氢气在试管A中使得A中压强增大,把FeSO4溶液经中间导管压到B中,与氢氧化钠反应,没有氧气故见到白色沉淀1年前查看全部
- 已知常温下:Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31;Ksp[Zn(O
已知常温下:Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31;Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=5.6×10-12.某溶液中有浓度均为0.0l mol/L的Fe3+、Cr3+、Zn2+、Mg2+等离子,加入氢氧化钠溶液,当溶液的pH=6时,下列叙述不正确的是( )
A.Fe3+ 已经沉淀完全
B.Cr3+已经沉淀完全
C.Zn2+ 已经开始沉淀
D.Mg2+还没开始沉淀 奢侈品ノ1年前1
奢侈品ノ1年前1 -
 专业生产pcb 共回答了12个问题
专业生产pcb 共回答了12个问题 |采纳率83.3%解题思路:加入氢氧化钠溶液,当溶液的pH=6时,溶液中氢氧根离子浓度为10-8mmol/L,依据溶液中的氢氧根离子浓度和金属离子浓度计算浓度积和溶度积常数分析比较判断.A、Q(Fe(OH)3)=c(Fe3+)c3(OH-)=0.01×(10-8)3=10-26>Ksp[Fe(OH)3]=2.6×10-39;说明生成氢氧化铁沉淀;依据Ksp[Fe(OH)3])=c(Fe3+)c3(OH-)=2.6×10-39;离子全部沉淀溶液中的铁离子为10-6,计算c(OH-)=
3
2.6×10−39
10−6
=
32.6×10−33
=<10-8,说明Fe3+离子沉淀完全,故A正确;
B、Q(Cr(OH)3)=c(Cr3+)c3(OH-)=0.01×(10-8)3=10-26>Ksp[Cr(OH)3]=2.6×10-39;说明氢氧化铬沉淀;依据Ksp[Cr(OH)3])=c(Cr3+)c3(OH-)=7.0×10-31;离子全部沉淀溶液中的铁离子为10-6,计算c(OH-)=
3
7.1×10−31
10−6
=
37.1×10−25
<10-8;说明Cr3+离子全部沉淀,故B正确;
C、Q(Zn(OH)2)=c(Zn2+)c2(OH-)=0.01×(10-8)2=10-18<Ksp[Zn(OH)2]=1.0×10-17,此时锌离子没有开始沉淀,故C错误;
D、Q(Mg(OH)2)=c(Mg2+)c2(OH-)=0.01×(10-8)2=10-18<Ksp[Mg(OH)2]=5.6×10-12,此时镁离子没有沉淀,故D正确;
故选C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了沉淀溶解平衡的计算应用,溶度积的分析判断,离子沉淀条件的应用,题目难度较大.1年前查看全部
- 将1mol Fe(OH)3制成胶体,所得胶体中分散质的物质的量______1mol.(填“大于”、“小于”或“等于”)
 stonywood1年前1
stonywood1年前1 -
 雨翔哥哥 共回答了18个问题
雨翔哥哥 共回答了18个问题 |采纳率88.9%解题思路:胶体分散质微粒直径的大小在1nm~100nm之间,所以胶粒由若干个Fe(OH)3分子构成的一个集合体,据此分析解答.Fe(OH)3胶体的胶粒是许多Fe(OH)3微粒的聚集体,Fe(OH)3胶体中,将1mol Fe(OH)3制成胶体,所得胶体中分散质的物质的量小于1mol,
故答案为:小于;点评:
本题考点: 胶体的重要性质.
考点点评: 本题主要考查胶体的胶粒的构成,注意胶体分散质微粒直径的大小在1nm~100nm之间是解答本题的关键,题目较简单.1年前查看全部
- 氧化铁与稀硫酸反应生成?还有Fe(OH)3与盐酸反应生成?Fe在氧气中燃烧生成?最好写一下方程式!
 gmwhran1年前3
gmwhran1年前3 -
 sokrates 共回答了17个问题
sokrates 共回答了17个问题 |采纳率88.2%Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe(OH)3+3HCl=FeCl3+3H2O
3Fe+2O2=Fe3O41年前查看全部
大家在问
- 1为什么胶体Fe(OH)3不是沉淀
- 2一个长方形的底面积是80平方厘米,高是40厘米,它的体积是多少?
- 3三角形ABC的底边BC=10,角A=1/2角B,以B点为极点,BC为极轴,求顶点A的轨迹极坐标方程
- 4一个长方体的宽是8厘米,高是1厘米,表面积是178平方厘米,求这个长方体的长、底面积、体积.
- 5已知△ABC中,A(1,3),AB,AC 边上的中线所在直线方程分别为 x-2y+1=0 ,y-1=0,求△ABC各边所
- 6一个长方形的体积为60平方厘米,高是5厘米,长方形的底面积是()平方厘米.
- 7熊猫妈妈重104千克,熊猫宝宝重8千克,熊猫妈妈的体重是熊猫宝宝的多少倍?
- 8从容不迫的近义词是什么
- 9英语翻译今天是我们新生入学的第一天.首先祝贺第17届毕业生圆满完成学业!
- 10目无全牛 近义词是不是胸有成竹
- 11前半句话怎么解释The Emmys were to have even more of an "Idol" touch,
- 12填空题 11' 12' 13'
- 13一方人说一方话前半句是一句俗语
- 14一根圆柱形木棒底面的周长和高相等,如沿水平方向锯去2cm,表面积就减少12.56cm2,原来木棒的表面积是多少
- 15一根圆柱形木棒,木匠师傅锯下10厘米长的一段,剩下木棒的表面积比原来减少了62.8平方厘米,这根木棒的底面
