酮与格利雅(Grinard)试剂的加成产物,经水解后得到什么
 daidai19802022-10-04 11:39:541条回答
daidai19802022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 来回人间 共回答了16个问题
来回人间 共回答了16个问题 |采纳率93.8%- 生成叔醇,就是格利雅试剂提供的碳负离子和酮的羰基发生亲核加成,水解后,酮的氧变成所生成叔醇的羟基氧~:)
- 1年前
相关推荐
- (1)金属镁有许多重要的用途,法国化学家维多克•格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利
(1)金属镁有许多重要的用途,法国化学家维多克•格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如图:

①标出格氏试剂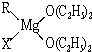 中的配位键.
中的配位键.
②下列比较中正确的是______
A.金属键的强弱:Mg>AlB.基态原子第一电离能:Mg>Al
C.金属性:Mg>AlD.晶格能:KCl>NaCl
(2)将TiCl4在氩气保护下与镁共热得到钛:TiCl4+2Mg
Ti+2MgCl21220~1420K .
①Ti元素在元素周期表中的位置是______,钛原子的外围电子排布式为______.
②TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟.则TiCl4属于______(填“原子”、“分子”或“离子”)晶体.
③二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是______.
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键. 小庭花1年前1
小庭花1年前1 -
 suntern 共回答了22个问题
suntern 共回答了22个问题 |采纳率95.5%解题思路:(1)①含有空轨道的离子和含有孤电子对的原子间易形成配位键,配位键有提供孤电子对的原子指向提供空轨道的离子;
②A.原子半径越小,金属键越强;
B.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第ⅡA族元素大于相邻元素;
C.同一周期元素中,元素的金属性随着原子序数的增大而呈减小的趋势;
D.离子晶体中,离子半径越小、电荷越多,晶格能越大;
(2)①钛原子序数22号元素,核外电子层数与其周期数相等,钛位于第ⅣB族;根据构造原理书写外围电子排布式;
②分子晶体的熔点较低;
③A.原子个数相等价电子数相等的微粒为等电子体;
B.根据价层电子对互斥理论确定杂化方式;
C.分子中正负电荷重心重合的为非极性分子,正负电荷重心不重合的为极性分子;
D.氢键的存在导致物质的沸点升高.(1)①含有空轨道的离子和含有孤电子对的原子间易形成配位键,配位键有提供孤电子对的原子指向提供空轨道的离子,所以其配位键为:
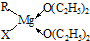 ,
,
故答案为: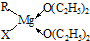 ;
;
②A.原子半径越小,金属键越强,镁原子半径大于铝原子,所以金属键的强弱:Mg<Al,故A错误;
B.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第ⅡA族元素大于相邻元素,所以基态原子第一电离能:Mg>Al,故B正确;
C.同一周期元素中,元素的金属性随着原子序数的增大而呈减小,所以金属性:Mg>Al,故C正确;
D.离子晶体中,离子半径越小、电荷越多,晶格能越大,钠离子电荷等于钾离子,钠离子半径小于钾离子,所以晶格能:NaCl>KCl,故D错误;
故选BC;
(2)①钛原子序数22号元素,钛位于第四周期第ⅣB族;根据构造原理知,其价电子排布式为3d24s2,
故答案为:第四周期、ⅣB族;3d24s2;
②TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟说明TiCl4的熔点较低,属于分子晶体,
故答案为:分子;
③A.原子个数相等价电子数相等的微粒为等电子体,所以苯与B3N3H6互为等电子体,故正确;
B.甲醛、苯分子中碳原子价层电子对个数都是3,所以碳原子均采用sp2杂化,故正确;
C.分子中正负电荷重心重合的为非极性分子,正负电荷重心不重合的为极性分子,苯、二氧化碳分子中正负电荷重心重合,所以是非极性分子,水和甲醛分子中正负电荷重心不重合,所以是极性分子,故正确;
D.氢键的存在导致物质的沸点升高,水的沸点比甲醛高得多,是因为水分子间能形成氢键,故正确;
故选ABCD.点评:
本题考点: 配合物的成键情况;元素周期律的作用;原子核外电子排布.
考点点评: 本题考查较综合,涉及原子杂化方式的判断、等电子体、价电子排布式的书写等知识点,是高考热点题型,注意第一电离能的变化规律及异常现象,注意(1)中配位键标注,为易错点.1年前查看全部
- (《物质结构与性质》)(1)金属镁有许多重要的用途,法国化学家维多克•格利雅因发明了在有机合成方面用途广泛的格利雅试剂而
(《物质结构与性质》)
(1)金属镁有许多重要的用途,法国化学家维多克•格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如图: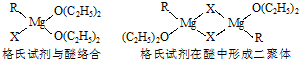
①上述2种结构中均存在配位键,把你认为是配位键的用“→”标出______.
②由原子间的成键特点,可以预测中心原子Mg的杂化类型可能为______;Mg原子的核外电子排布式可表示为______.
③下列比较中正确的是______
A.金属键的强弱:Mg>AlB.基态原子第一电离能:Mg>Al
C.金属性:Mg>AlD.晶格能:NaCl>MgCl2
(2)将TiCl4在氩气保护下与镁共热得到钛:TiCl4+2Mg
Ti+2MgCl21220~1420K .
①Ti元素在元素周期表中的位置是______,钛原子的外围电子排布式为______.
②TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟.则TiCl4属于______(填“原子”、“分子”或“离子”)晶体.
③二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是______.
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键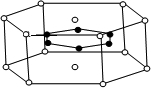
(3)2001年报导的硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录.如图中示意的该化合物的晶体结构单元:镁原子间形成正六棱柱,则棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内,则该化合物的化学式可表示为______
A.MgBB.MgB2C.Mg2BD.Mg3B2. 一无所用1年前1
一无所用1年前1 -
 happynothing 共回答了16个问题
happynothing 共回答了16个问题 |采纳率93.8%解题思路:(1)①含有空轨道的离子和含有孤电子对的原子间易形成配位键,配位键有提供孤电子对的原子指向提供空轨道的离子;
②根据含有的共价键个数确定原子的杂化类型,Mg是12号元素,原子核外有12个电子,根据构造原理书写镁原子核外电子排布式;
③A.原子半径越小,金属键越强;
B.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第ⅡA族元素大于相邻元素;
C.同一周期元素中,元素的金属性随着原子序数的增大而呈减小的趋势;
D.离子晶体中,离子半径越小、电荷越多,晶格能越大;
(2)①钛原子序数22号元素,核外电子层数与其周期数相等,钛位于第ⅣB族;根据构造原理书写外围电子排布式;
②分子晶体的熔点较低;
③A.原子个数相等价电子数相等的微粒为等电子体;
B.根据价层电子对互斥理论确定杂化方式;
C.分子中正负电荷重心重合的为非极性分子,正负电荷重心不重合的为极性分子;
D.氢键的存在导致物质的沸点升高;
(3)利用均摊法确定其化学式.(1)①含有空轨道的离子和含有孤电子对的原子间易形成配位键,配位键有提供孤电子对的原子指向提供空轨道的离子,所以其配位键分别是
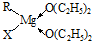 、
、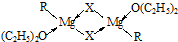 ,
,
故答案为: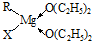 、
、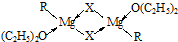 ;
;
②镁原子价层电子对个数是4,所以中心原子Mg的杂化类型为sp3,Mg是12号元素,原子核外有12个电子,根据构造原理知,其原子核外电子排布式为[Ne]3s2 或1s22s22p63s2,
故答案为:sp3;[Ne]3s2 或1s22s22p63s2;
③A.原子半径越小,金属键越强,镁原子半径大于铝原子,所以金属键的强弱:Mg<Al,故错误;
B.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第ⅡA族元素大于相邻元素,所以基态原子第一电离能:Mg>Al,故正确;
C.同一周期元素中,元素的金属性随着原子序数的增大而呈减小,所以金属性:Mg>Al,故正确;
D.离子晶体中,离子半径越小、电荷越多,晶格能越大,所以钠离子半径大于镁离子,且镁离子电荷大于钠离子,所以晶格能:NaCl<MgCl2,故错误;
故选:BC;
(2)①钛原子序数22号元素,钛位于第四周期第ⅣB族;根据构造原理知,其价电子排布式为3d24s2,
故答案为:第四周期、ⅣB族;3d24s2;
②TiCl4的熔点较低,属于分子晶体,
故答案为:分子;
③A.原子个数相等价电子数相等的微粒为等电子体,所以苯与B3N3H6互为等电子体,故正确;
B.甲醛、苯分子中碳原子价层电子对个数都是3,所以碳原子均采用sp2杂化,故正确;
C.分子中正负电荷重心重合的为非极性分子,正负电荷重心不重合的为极性分子,苯、二氧化碳分子中正负电荷重心重合,所以是非极性分子,水和甲醛分子中正负电荷重心不重合,所以是极性分子,故正确;
D.氢键的存在导致物质的沸点升高,水的沸点比甲醛高得多,是因为水分子间能形成氢键,故正确;
故选:ABCD;
(3)镁原子个数=12×[1/6]+2×[1/2]=3,B原子个数=6,所以镁原子和硼原子个数比为3:6=1:2,则其化学式为MgB2,
故选:B.点评:
本题考点: 原子轨道杂化方式及杂化类型判断;原子核外电子排布;晶体的类型与物质熔点、硬度、导电性等的关系;晶胞的计算.
考点点评: 本题考查较综合,涉及晶胞的计算、原子杂化方式的判断、等电子体、价电子排布式的书写等知识点,这些都是考试热点,注意第一电离能的变化规律及异常现象,注意(3)中每个顶点上的原子被6个晶胞共用,为易错点.1年前查看全部
大家在问
- 1y的平方+2等于2倍根号2y
- 2The woman did some washing for the rich and could buy some b
- 3Which season does Ann like best?(改为同义句)____ _____ _____ ____
- 4铁铝矾是什么?铁铝矾中的铁是几价?
- 5六年级简便计算题题目~!速求!
- 6用分别写有0,1,2,3的四张卡片,排成的三位数中,是奇数的概率为
- 7生物体内提供能量的主要物质是?A 糖类 B ATP C 脂肪官方答案给的是 B ,我不太懂,
- 8已知X的平方+根号(2Y)=根号3,Y的平方+根号(2X)=根号3,且X不=Y,求X+Y的值
- 9二次函数过原点 (2,0) (9,9)
- 10y平方-2倍根号2y-4=0怎么算大神们帮帮忙
- 11edgy,controversial,和 contentious的区别和用法,加例句
- 12翻译"他们正在进行一场热烈的讨论(debate)"
- 13东汉末年以及三国时期南北匈奴的主要人物有哪些?
- 14你们说地球转动有自转和公转两种,那么自传是怎么转的?公转又是怎么转的?
- 15朱加女字旁念什么啊
