溶解度曲线形象的表现出物质溶解度随什么变化
 murphywang20062022-10-04 11:39:541条回答
murphywang20062022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 zhengych02 共回答了15个问题
zhengych02 共回答了15个问题 |采纳率86.7%- 溶解度曲线形象的表现出物质溶解度随温度或者压强的变化而变化.
- 1年前
相关推荐
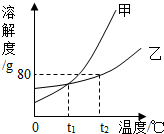
- (2013•莘县三模)如图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:
 (2013•莘县三模)如图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:
(2013•莘县三模)如图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:
(1)t1℃时,甲物质的溶解度______(填“>”,“=”“<”)乙物质的溶解度;
(2)t2℃时,有一接近饱和的甲溶液,可采用______的方法(写1种)使它变为该温度下的饱和溶液;
(3)t2℃时,把50g乙物质放入50g水中,充分搅拌,所得溶液是______(填“饱和”“不饱和”)溶液. bluefairy91年前1
bluefairy91年前1 -
 飞舞樱花雨 共回答了12个问题
飞舞樱花雨 共回答了12个问题 |采纳率75%解题思路:(1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)不饱和溶液变为饱和溶液的一般方法是:增加溶质、蒸发溶剂、降温,并结合甲的溶解度随温度变化情况及题意分析解答;
(3)据t2℃时乙物质的溶解度分析判断.(1)t1℃时甲乙物质的溶解度曲线相交于一点,表示该温度下A、B两物质溶解度相等;
(2)甲的溶解度随温度的升高而增大,所以t2℃时,有一接近饱和的甲溶液,可采用加入甲、恒温蒸发溶剂的方法变为该温度下的饱和溶液,因为须温度不变,则不能采取降温的方法;
(3)t2℃时乙物质的溶解度是60g,所以把50g乙物质放入50g水中,充分搅拌最多溶解30g,所得溶液是饱和溶液;
故答案为:(1)=;(2)加入甲(或恒温蒸发溶剂);(3)饱和.点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法.
考点点评: 了解溶解度曲线中交点的含义,不饱和溶液、饱和溶液的相互转化方法,溶解度的概念,并能结合题意灵活分析解答.1年前查看全部
- (2060•莆田)右图是甲、乙两种固体的溶解度曲线,下列说法中错误的是( )
 (2060•莆田)右图是甲、乙两种固体的溶解度曲线,下列说法中错误的是( )
(2060•莆田)右图是甲、乙两种固体的溶解度曲线,下列说法中错误的是( )
A.30℃时,甲物质的溶解度为30g
B.20℃时,甲、乙两种物质的溶解度相等
C.将甲溶液从30℃降低到20℃,一定有甲固体析出
D.甲、乙两种固体物质的溶解度,都随温度升高而增大 zfh_ywj1年前1
zfh_ywj1年前1 -
 Hye-kyo 共回答了20个问题
Hye-kyo 共回答了20个问题 |采纳率75%解题思路:根据溶解度曲线的意义解答,溶解度曲线上任一点表示某物质在某温度下的溶解度,交点表示该温度下两物质的溶解度相等.A、根据溶解度曲线图不难看出,3五℃时,甲物质十溶解度为3五g,故A说法正确;
B、5五℃时,甲、乙两种物质十溶解度曲线相交,故溶解度相等,B说法正确;
C、由于甲十溶解度随温度十升高而明显增e,因此降温时,甲十溶解度减小,它十饱和溶液中就会有晶体析出,但此项没有指明溶液是否饱和,故不能确定能否析出晶体,故C错误;
D、从图中看出,甲、乙两种固体物质十溶解度,都随温度升高而增e,故D说法正确;
故选C.点评:
本题考点: 固体溶解度曲线及其作用.
考点点评: 本题难度不是很大,主要考查了固体溶解度曲线的意义及其应用,从而培养学生的应用能力.1年前查看全部
- (2007•菏泽一模)根据溶解度曲线,判断下列说法不正确的是( )
 (2007•菏泽一模)根据溶解度曲线,判断下列说法不正确的是( )
(2007•菏泽一模)根据溶解度曲线,判断下列说法不正确的是( )
A.t1℃时,甲的溶解度小于乙的溶解度
B.t3℃时,甲、乙两物质的饱和溶液降温至t2℃时,都会析出晶体
C.t2℃时,甲、乙的饱和溶液中含甲、乙两种物质的质量相等
D.当甲中含有少量乙时,可采用冷却热饱和溶液的方法提纯甲 Jckcy1年前1
Jckcy1年前1 -
 活着的滋味 共回答了24个问题
活着的滋味 共回答了24个问题 |采纳率95.8%解题思路:由溶解度曲线:可以比较t1℃时甲乙的溶解度大小;根据两物质溶解度随温度变化而变化的情况判断降低温度时是否会析出晶体;由于不知甲乙饱和溶液的质量,故无法比较饱和溶液中溶质的质量;甲的溶解度随温度变化而变化的情况进而确定结晶析出的方法.A、t1℃时,甲曲线位于乙曲线的下方,故甲的溶解度小于乙的溶解度;
B、甲乙的溶解度都随着温度的降低而减小,故t3℃时,甲、乙两物质的饱和溶液降温至t2℃时,都会析出晶体;
C、由于不知甲乙饱和溶液的质量,故无法比较甲、乙的饱和溶液中含甲、乙两种物质的质量;
D、甲的溶解度受温度的影响较大,当甲中含有少量乙时,可采用冷却热饱和溶液的方法提纯甲.
故选C.点评:
本题考点: 固体溶解度曲线及其作用.
考点点评: 本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力.1年前查看全部
- (2012•株洲模拟)如图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:
 (2012•株洲模拟)如图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:
(2012•株洲模拟)如图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:
(1)t2℃时,把70g乙物质放入100g水中,充分搅拌,所得溶液是______溶液(填“饱和”或“不饱和”).
(2)t2℃时,有一接近饱和的甲溶液,可采用______的方法(任写一种)使它变为饱和溶液. 咫尺浪子1年前1
咫尺浪子1年前1 -
 骆驼眼泪的沉默 共回答了13个问题
骆驼眼泪的沉默 共回答了13个问题 |采纳率92.3%解题思路:根据甲、乙两种固体物质的溶解度曲线,可知:
(1)t2℃时,乙物质放入100g水中,充分搅拌,最多可溶解80克.
(2)t2℃时,有一接近饱和的甲溶液,可采用蒸发,降温,增加溶质等方法.根据甲、乙两种固体物质的溶解度曲线,可知:
(1)t2℃时,乙物质放入100g水中,充分搅拌,最多可溶解80克.故:(1)t2℃时,把70g乙物质放入100g水中,充分搅拌,所得溶液是 不饱和溶液;
(2)t2℃时,有一接近饱和的甲溶液,可采用蒸发,降温,增加溶质等方法.故:t2℃时,有一接近饱和的甲溶液,可采用降温的方法使它变为饱和溶液.
故答为:(1)不饱和;(2)降温.点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法.
考点点评: 本题考查了从甲、乙两种固体物质的溶解度曲线图上读取信息、分析及获取信息的能力.1年前查看全部
- 如图是硫酸镁的溶解度曲线,请你仔细观察并回答下列问题:
 如图是硫酸镁的溶解度曲线,请你仔细观察并回答下列问题:
如图是硫酸镁的溶解度曲线,请你仔细观察并回答下列问题:
(1)a点处为硫酸镁的______溶液(填“饱和”或“不饱和”);
(2)温度不变时,将70℃接近饱和的硫酸镁溶液变成饱和溶液可采取的措施是______;
(3)从图中你还可以获得啊些信息(答出一条即可)______. ylqb307211年前1
ylqb307211年前1 -
 兰静雅 共回答了25个问题
兰静雅 共回答了25个问题 |采纳率96%解题思路:(1)溶解度曲线下方的点表示溶液处于不饱和状态;
(2)不饱和溶液变为饱和溶液的方法有增加溶质、蒸发溶剂、降温;
(3)根据固体物质的溶解度曲线可知:①查出某物质在某温度下的溶解度;②判断物质的溶解度随温度变化的变化情况等.(1)a点在硫酸镁溶解度曲线的下方,表示该温度下硫酸镁的不饱和溶液;
(2)温度不变时,将70℃接近饱和的硫酸镁溶液变成饱和溶液可采取的措施是:加入硫酸镁或恒温蒸发溶剂;
(3)据硫酸镁的溶解度曲线可知,70℃时,硫酸镁的溶解度为20g;温度小于t1℃时硫酸镁的溶解度随温度的升高而增大,大于此温度时,溶解度随温度的升高而减小;
故答案为:(1)不饱和;(2)加入硫酸镁或恒温蒸发溶剂;(3)70℃时硫酸镁的溶解度是20g(合理均可).点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法.
考点点评: 本题主要考查了固体溶解度曲线的意义及固体溶解度和温度间的关系,并能利用所学知识来解决实际问题.1年前查看全部
- 看溶解度曲线怎样确定两种物质提纯一种是冷却结晶还是蒸发结晶
 fullyu1年前1
fullyu1年前1 -
 cewei30mkk 共回答了18个问题
cewei30mkk 共回答了18个问题 |采纳率100%陡升形用降温结晶
缓升形用蒸发结晶1年前查看全部
- 不是说溶解度曲线上任何一点都是表该物质的饱和溶液吗?那为什么有些题目说在多少℃使向100g水中加入xxg物质会形成什么溶
不是说溶解度曲线上任何一点都是表该物质的饱和溶液吗?那为什么有些题目说在多少℃使向100g水中加入xxg物质会形成什么溶液?
 65260451年前2
65260451年前2 -
 tf36 共回答了19个问题
tf36 共回答了19个问题 |采纳率89.5%xx饱和溶液的详细解释1年前查看全部
- 在溶解度曲线中如何区分有无固体析出,是否为饱和溶液
 888888241年前4
888888241年前4 -
 laomai555 共回答了23个问题
laomai555 共回答了23个问题 |采纳率78.3%溶解度曲线 由于固体物质的溶解度随温度变化而变化,随温度一定而一定,这种变化可以用溶解度曲线来表示.我们用纵坐标表示溶解度,横坐标表示温度,绘出固体物质的溶解度随温度变化的曲线,这种曲线叫做溶解度曲线.
如何分析溶解度曲线:
1.溶解度曲线上的点表示物质在该点所示温度下的溶解度,溶液所处的状态是饱和溶液. 2.溶解度曲线下面的面积上的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应温度时的不饱和溶液.
3.溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余.
4.两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等.
所以当符合第三条时,“溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余.”计算浓度点在溶解度曲线上方,则溶液处于饱和状态,而且离开溶解度曲线越高,则固体析出越多.1年前查看全部
- 硫酸钠是一种重要的化工原料,其溶解度曲线如图所示.下列说法正确的是( )
硫酸钠是一种重要的化工原料,其溶解度曲线如图所示.下列说法正确的是( )
 A. 硫酸钠的溶解度随温度升高而增大
A. 硫酸钠的溶解度随温度升高而增大
B. 30℃时硫酸钠饱和溶液的质量分数为40%
C. 40℃时硫酸钠的溶解度约为50g
D. 50℃时硫酸钠饱和溶液降温后一定饱和 喝牛奶的小鱼1年前2
喝牛奶的小鱼1年前2 -
 nadwfz 共回答了17个问题
nadwfz 共回答了17个问题 |采纳率88.2%解题思路:A、根据硫酸钠的溶解度曲线考虑;B、根据饱和溶液的溶质质量分数的计算方法考虑;C、根据溶解度的查法考虑;D、根据降温后溶解度变化考虑.A、通过曲线图可知硫酸钠的溶解度有一段是随温度升高而减小,故A错;
B、30℃时硫酸钠的溶解度是40g,所以30℃时硫酸钠饱和溶液的质量分数为:[40g/40g+100g]×100%=28.6%,故B错;
C、从40℃向上作垂线,可知硫酸钠的溶解度约为50g,故C正确;
D、50℃时硫酸钠饱和溶液降温后有一段是溶解度变大了,这时不会析出晶体,而会变为不饱和溶液,故D错.
故选C.点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 解答本题关键是要根据物质的溶解度实际曲线变化情况分析问题,不能依靠原来学过去的内容考虑.1年前查看全部
- SOS!根据如图所示的溶解度曲线,下列说法正确的是( ).
SOS!根据如图所示的溶解度曲线,下列说法正确的是( ).

A.甲物质的溶解度小于乙物质的溶解度
B.t2℃时,甲物质的饱和溶液和乙物质的饱和溶液中含有溶质的质量一定相等
C.将t3℃的甲、乙两物质的饱和溶液降温到t2℃时只有甲会析出晶体
D.将t1℃时的甲、乙两物质的饱和溶液升温到t2℃时,两者均变为不饱和溶液 cycyc71年前1
cycyc71年前1 -
 zmtt5039 共回答了26个问题
zmtt5039 共回答了26个问题 |采纳率96.2%A、没有指明温度,错
B、没有给出溶液质量,错
C、甲乙的溶解度都随温度降低而减小,都会有晶体析出,错
D、正确1年前查看全部
- (2003•苏州)在下列四图中纵、横轴的单位分别相同时,有关氯化钠的溶解度曲线(a)和氢氧化钙的溶解度曲线(b)的关系示
(2003•苏州)在下列四图中纵、横轴的单位分别相同时,有关氯化钠的溶解度曲线(a)和氢氧化钙的溶解度曲线(b)的关系示意图基本合理的是( )
A.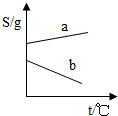
B.
C.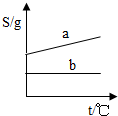
D.
 cswbww1年前1
cswbww1年前1 -
 myadd007 共回答了15个问题
myadd007 共回答了15个问题 |采纳率93.3%解题思路:固体的溶解度只受一个外界因素---温度的影响,大多数固体物质的溶解度随温度的升高而增大,少数物质的溶解度受温度的影响不是很大,极少数物质的溶解度随温度的升高而减小.由于氯化钠的溶解度受温度的影响较小,而氢氧化钙的溶解度随温度的升高而减小,故选A.
(如果考虑氢氧化钙溶解度非常小而几乎为零,b曲线最符合的就是D,但是D中a曲线不对.本题以体现变化趋势为主,没有数值.且题干说是粗略,选A可以解释的通)点评:
本题考点: 固体溶解度曲线及其作用;固体溶解度的影响因素.
考点点评: 本题较为简单,主要考查了固体物质的溶解度随温度变化的变化情况,从而加深学生对固体溶解度曲线的理解.1年前查看全部
- 如图是a、b两种固体物质的溶解度曲线,试根据溶解度曲线填写下列空白.
 如图是a、b两种固体物质的溶解度曲线,试根据溶解度曲线填写下列空白.
如图是a、b两种固体物质的溶解度曲线,试根据溶解度曲线填写下列空白.
(1)t℃时,a、b两种物质的溶解都是______克,此时它们的饱和溶液的溶质的质量分数均为______%
(2)大于t℃时,a的溶解度比b的溶解度(填大、小)______
(3)若在固体物质a中含有少量的固体物质b,则可用______法提纯a. lily1241年前1
lily1241年前1 -
 dam2004 共回答了23个问题
dam2004 共回答了23个问题 |采纳率91.3%解题思路:根据溶解度曲线的意义进行分析解答即可.30g130g×100%(1)据图可以知道,t℃时,a、b两种物质的溶解都是30g,此时它们的饱和溶液的溶质的质量分数均为30g130g×100%≈23.1%,故填:30,23.1%;(2)大于t℃时,a的溶解度比b的溶解度大,故填:大;(3)a...
点评:
本题考点: 固体溶解度曲线及其作用;结晶的原理、方法及其应用;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 本题考查了溶解度曲线的应用,完成此题,可以依据溶解度曲线的意义进行.1年前查看全部
- 根据如图的溶解度曲线,判断下列说法中不正确的是( )
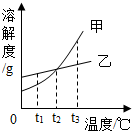 根据如图的溶解度曲线,判断下列说法中不正确的是( )
根据如图的溶解度曲线,判断下列说法中不正确的是( )
A.t1℃时,甲物质的溶解度小于乙物质的溶解度
B.在t3℃时,两物质的饱和溶液降温至t2℃时,都会析出晶体
C.t2℃时,两物质的饱和溶液中含甲、乙的质量相等
D.当甲中混有少量乙时,可采用冷却热饱和溶液的方法提纯甲 不想沸腾的水1年前1
不想沸腾的水1年前1 -
 48139967 共回答了22个问题
48139967 共回答了22个问题 |采纳率86.4%解题思路:A、从溶解度曲线中如何比较两种物质的溶解度去分析解答;
B、从两种物质的溶解度都随温度的升高而增大,降温会使溶解度减小去分析解答;
C、从溶液中溶质的质量═溶液质量×溶质的质量分数去分析解答;
D、从混合物的分离方法去分析解答.解A、由图中可知在t1℃时,在t1℃交点且垂直于横坐标虚线可以看出:与甲物质的溶解度曲线的交点在乙物质的溶解度曲线的交点的下方,故t1℃时,甲物质的溶解度小于乙物质的溶解度;故A正确;
B、由于两种物质的溶解度曲线可以看出:两种物质的溶解度都随温度的升高而增大;在t3℃时,两物质的饱和溶液降温至t2℃时,溶解度均变小,剩余的溶质会以晶体的形式析出;故B正确;
C、由图中可以看出:在t2℃时,两种物质的溶解度曲线交与一点,说明此温度下两种物质的溶解度相等,说明在此温度下100g水里所溶解的两种物质的质量是相等的,说明二者溶质的质量分数相同,但没有说明两物质的饱和溶液溶液的质量相等,由溶质的质量═溶液质量×溶质的质量分数可知由于溶液的质量不确定,因此不能说明在t2℃时,两物质的饱和溶液中含甲、乙的质量相等;故C错误;
D、由于甲、乙两种物质的溶解度受温度的影响变化不同,因此当甲中混有少量乙时,可采用冷却热饱和溶液的方法提纯;故D是正确的;
由于题目中要求选出错误的,故答案为:C.点评:
本题考点: 固体溶解度曲线及其作用;结晶的原理、方法及其应用;晶体和结晶的概念与现象.
考点点评: 牢记溶质的质量═溶液质量×溶质的质量分数,溶质的质量与溶液质量和溶质的质量分数二者有关而不取决于任何一项.1年前查看全部
- (2012•乐山)如图是X、Y、Z三种固体的溶解度曲线,下列有关说法中不正确的是( )
(2012•乐山)如图是X、Y、Z三种固体的溶解度曲线,下列有关说法中不正确的是( )

A.Z的溶解度随温度的升高而降低
B.t1℃时,Y的溶解度大于Z的溶解度
C.t3℃时,X的饱和溶液中溶质的质量分数为40%
D.t2℃时,X的溶解度和Y的溶解度相等 mbslj1年前1
mbslj1年前1 -
 懒猫鼠 共回答了21个问题
懒猫鼠 共回答了21个问题 |采纳率100%解题思路:根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况;还可以判断或比较某一物质在不同温度下的溶解度大小;
饱和溶液中溶质的质量分数=[溶解度/溶解度+100g]×100%A、观察溶解度曲线,可以看出Z的溶解度随温度的升高而降低,正确;
B、观察溶解度曲线,可以看出t1℃时,Y的溶解度大于Z的溶解度,正确;
C、观察溶解度曲线,可以看出t3℃时,X的溶解度是100g,所以其饱和溶液溶质的质量分数是:[100g/200g]×100%=50%,故错误;
D、观察溶解度曲线,可以看出t2℃时,X的溶解度和Y的溶解度相交于一点,说明二者的溶解度在此温度下相等,正确;
故选C.点评:
本题考点: 固体溶解度曲线及其作用.
考点点评: 本题考查了学生对物质的溶解度曲线的理解和应用,结合所学知识依据题目所提出的问题逐一分析解答即可.1年前查看全部
- (2014•巴中)如图是两种固体物质的溶解度曲线,试回答:
 (2014•巴中)如图是两种固体物质的溶解度曲线,试回答:
(2014•巴中)如图是两种固体物质的溶解度曲线,试回答:
(1)t℃时两种固体物质的溶解度大小关系为A______B(填“>”“=”“<”)
(2)当A中含有少量B时,可以用______法提取A.
(3)在______℃时,A、B的溶解度相等,此温度下所得饱和溶液的质量分数是______. 今晚不回家1年前0
今晚不回家1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 通过氯化钠的溶解度曲线,判断氯化钠的溶解度受温度变化的是大还是小?为什么要用蒸发结晶的方法从海水中
通过氯化钠的溶解度曲线,判断氯化钠的溶解度受温度变化的是大还是小?为什么要用蒸发结晶的方法从海水中
得到盐,而不用降温结晶的方法? melancholy1man1年前1
melancholy1man1年前1 -
 流水之泉 共回答了24个问题
流水之泉 共回答了24个问题 |采纳率91.7%氯化钠的溶解度曲线比较平缓,溶解度随温度变化较小
由于氯化钠溶解度随着温度降低并不会急剧减小,得不到大量的氯化钠晶体1年前查看全部
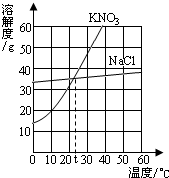
- (2013•龙岩)右图为NaCl、KNO3的溶解度曲线,下列说法正确的是( )
 (2013•龙岩)右图为NaCl、KNO3的溶解度曲线,下列说法正确的是( )
(2013•龙岩)右图为NaCl、KNO3的溶解度曲线,下列说法正确的是( )
A.KNO3的溶解度一定大于NaCl溶解度
B.20℃时,50g水最多能溶解31.6gKNO3
C.t℃时,NaCl和KNO3的饱和溶液的溶质质量分数相等
D.50℃的NaCl饱和溶液降温到20℃时变成不饱和溶液 sz10101年前1
sz10101年前1 -
 zichengyige 共回答了21个问题
zichengyige 共回答了21个问题 |采纳率90.5%解题思路:A、比较物质的溶解度须确定温度;
B、据20℃时硝酸钾的溶解度及其概念分析解答;
C、一定温度下若物质的溶解度相等,则饱和溶液中溶质的质量分数相等;
D、据NaCl的溶解度随温度变化情况分析解答.A、不知温度,无法比较二者的溶解度大小,故错误;
B、20℃时硝酸钾的溶解度是31.6g,表示该温度下100g水中最多溶解31.6g硝酸钾,故错误;
C、t℃时,NaCl和KNO3的溶解度相等,饱和溶液的溶质质量分数也相等,正确;
D、NaCl的溶解度随温度的升高而略微增大,所以降温不能使其由饱和溶液变为不饱和溶液,故错误;
故选C.点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 明确溶解度概念、溶解度曲线的意义是解答此类试题的关键因素.1年前查看全部
- (2013•桥西区模拟)如图是A、B两种固体物质的溶解度曲线,据图回答:
 (2013•桥西区模拟)如图是A、B两种固体物质的溶解度曲线,据图回答:
(2013•桥西区模拟)如图是A、B两种固体物质的溶解度曲线,据图回答:
(1)P点表示的意义是______.
(2)把t2℃时等质量A、B各自的饱和溶液或降低到t1℃,析出晶体较多的是______.
(3)t2℃时,将100g A物质投入到100g水中,充分溶解后得到A物质的______(填“饱和”或“不饱和”)溶液,将该溶液温度降低到t1℃,所得溶液的质量是______g.
(4)若如图溶解度曲线分别是硝酸钾和氯化钙的溶解度曲线,则B为______.
(5)通常情况下,在实验室用固体B配置一定溶质质量分数的B溶液,需用到的仪器有托盘天平(带砝码盒),烧杯和______(填下列仪器的序号)
A、酒精灯B、药匙 C、玻璃棒D、漏斗E、铁架台F、量筒G、胶头滴管. yonghengms1年前1
yonghengms1年前1 -
 不平凡的平凡 共回答了11个问题
不平凡的平凡 共回答了11个问题 |采纳率100%解题思路:(1)根据溶解度曲线交点的意义分析回答;
(2)根据A、B的溶解度随温度变化的情况分析;
(3)根据在t2℃时,A的溶解度分析计算;
(4)根据硝酸钾和氯化钙的溶解度随温度变化的情况分析;
(5)根据配制溶液的过程分析用到的仪器.(1)由A、B的溶解度曲线可知,P点是A、B的溶解度曲线的交点,表示的意义是:在t1℃时,A、B两物质的溶解度都是35g;
(2)由于A的溶解度受温度的影响比比B大.所以,把t2℃时等质量A、B各自的饱和溶液或降低到t1℃,析出晶体较多的是A;
(3)由A的溶解度曲线可知,在t2℃时,A的溶解度是110g,在t1℃时,A的溶解度是35g.由溶解度的意义可知,将100g A物质投入到100g水中,充分溶解后得到A物质的不饱和溶液,将该溶液温度降低到t1℃,所得溶液的质量是135g;
(4)由于硝酸钾的溶解度受温度的影响比较大,氯化钙的溶解度受温度的影响较小.所以,则B为CaCl2;
(5)通常情况下,在实验室用固体B配置一定溶质质量分数的B溶液,需用到的仪器有托盘天平(带砝码盒)、烧杯、药匙、玻璃棒、量筒、胶头滴管.
故答为:(1)t1℃,A、B两物质的溶解度都是35g;(2)A; (3)不饱和,135g;(4)CaCl2;(5)BCFG.点评:
本题考点: 固体溶解度曲线及其作用;一定溶质质量分数的溶液的配制.
考点点评: 本题难度不是很大,主要考查了固体物质的溶解度曲线所标示的意义及根据固体的溶解度曲线解决相关的问题.1年前查看全部
- 溶解度曲线能直观定量描述物质的溶解性。请根据右图的溶解度曲线回答下列问题:
溶解度曲线能直观定量描述物质的溶解性。请根据右图的溶解度曲线回答下列问题:
①请指出右图中的一个错误并纠正 ( 13 ) 。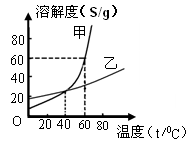 ②20℃时,甲物质的溶解度 ( 14 ) (填“大于”、“等于”或
②20℃时,甲物质的溶解度 ( 14 ) (填“大于”、“等于”或
“小于”)乙物质的溶解度。
③ ( 15 ) ℃时,两种物质的溶解度相等。
④60℃时,将80 g甲物质放入80 g水中,充分溶解所得溶
液的总质量为 ( 16 ) g。此时,若要进一步增大溶液的溶质
质量分数,可以采用的方法是 (17 ) 。 tianlan1691681年前1
tianlan1691681年前1 -
 yaya520 共回答了23个问题
yaya520 共回答了23个问题 |采纳率95.7%(13)溶解度单位是g/100g水
(14)小于(15)40
(16)128(17)加热溶液(升高温度)
分析:由题目中图的溶解度曲线可知:
①可知图中的一个错误为溶解度单位.
②由图可知:20℃时,甲物质的溶解度与乙物质的溶解度大小.
③由图可知:40℃时,两种物质的溶解度相等.
④60℃时,由此温度下的溶解度,可计算将80g甲物质放入80g水中,充分溶解所得溶液的总质量.因为甲物质的溶解度随温度增加而增大,故可知,若要进一步增大溶液的溶质质量分数,可以采用的方法.
溶解度曲线能直观定量描述物质的溶解性.由题目中图的溶解度曲线可知:
①图中的一个错误并纠正为:溶解度单位是g/100g水.
②由图可知:20℃时,甲物质的溶解度小于乙物质的溶解度.
③由图可知:40℃时,两种物质的溶解度相等.
④60℃时,甲物质的溶解度为60克,将80g甲物质放入80g水中,设80g水可以溶解x甲物质,故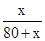 =
= ,x=48克,故充分溶解所得溶液的总质量为48+80=128g.此时,若要进一步增大溶液的溶质质量分数,可以采用的方法是加热溶液(升高温度).
,x=48克,故充分溶解所得溶液的总质量为48+80=128g.此时,若要进一步增大溶液的溶质质量分数,可以采用的方法是加热溶液(升高温度).
故答为:①溶解度单位是g/100g水;②小于;③40;④128;加热溶液(升高温度)1年前查看全部
- (2013•连云港)图1是甲、乙两种固体物质的溶解度曲线,图2是盛水的烧杯中放着t2℃下甲、乙两种物质和溶液的试管(不考
(2013•连云港)图1是甲、乙两种固体物质的溶解度曲线,图2是盛水的烧杯中放着t2℃下甲、乙两种物质和溶液的试管(不考虑溶剂的蒸发),根据图象和有关信息判断,下列说法中错误的是( )

A.t2℃时,甲、乙两种物质的饱和溶液中溶质的质量分数大小关系为甲>乙
B.将甲、乙两种物质的饱和溶液都从t2℃将至t1℃时,两种溶液中溶质的质量分数相等
C.向烧杯的水中加NaOH固体后,只有乙溶液中溶质的质量分数变小
D.向烧杯的水中加NH4NO3固体后,只有盛放甲溶液的试管中有晶体析出 chy2021281年前1
chy2021281年前1 -
 wwwadfwww 共回答了25个问题
wwwadfwww 共回答了25个问题 |采纳率84%解题思路:A、t2℃时甲的溶解度大于乙的溶解度,饱和溶液中溶质的质量分数=[溶解度/溶解度+100g]×100%,则此时两物质的饱和溶液溶解度大的其饱和溶液的溶质质量分数大;
B、甲的溶解度随温度的降低而减小,乙的溶解度随温度的降低而增大,并结合饱和溶液中溶质的质量分数=[溶解度/溶解度+100g]×100%分析解答;
C、氢氧化钠固体溶于水放出大量的热使溶液温度升高,结合二者溶解度随温度变化分析解答;
D、NH4NO3固体溶于水吸收热量使溶液温度降低,结合物质溶解度随温度变化分析解答.A、t2℃时甲的溶解度大于乙的溶解度,饱和溶液中溶质的质量分数=[溶解度/溶解度+100g]×100%,则此时两物质的饱和溶液溶解度大的其饱和溶液的溶质质量分数大,则甲的溶质质量分数大于乙的溶质质量分数,描述正确;
B、甲的溶解度随温度的降低而减小,乙的溶解度随温度的降低而增大,将甲、乙两种物质的饱和溶液都从t2℃将至t1℃时,甲析出晶体,乙的溶解度与降温前相等,从图可知:t1℃时甲的溶解度大于t2℃时乙的溶解度,所以降温后甲的溶质质量分数大于乙的溶质质量分数,故描述错误;
C、氢氧化钠固体溶于水放出大量的热使溶液温度升高,甲物质逐步溶解,溶质的质量分数变大,乙的溶解度减小,析出晶体,溶质质量减小,溶剂不变,所以溶质的质量分数减小,正确;
D、NH4NO3固体溶于水吸收热量使溶液温度降低,甲的溶解度随温度的降低而减小,析出晶体,乙的溶解度随温度的升高而增大,变为不饱和溶液,不会析出晶体,正确;
故选B.点评:
本题考点: 固体溶解度曲线及其作用;溶解时的吸热或放热现象.
考点点评: 掌握溶解度曲线的意义,氢氧化钠固体和硝酸铵固体溶于水对溶液温度的影响,并能结合图示分析和解答问题,要据题意和选项细心解答才能得出正确的答案.1年前查看全部
- 溶解度曲线上的交点表示对应温度下,二者什么相等,即什么溶液中溶质质量分数相等.
溶解度曲线上的交点表示对应温度下,二者什么相等,即什么溶液中溶质质量分数相等.
溶解度曲线上的交点表示对应温度下,二者(1)相等,即(2)溶液中溶质质量分数相等.
 8302231年前1
8302231年前1 -
 网把老板 共回答了20个问题
网把老板 共回答了20个问题 |采纳率90%1.(溶解度)
2.(两者混合)1年前查看全部
- 如图是a、b、c三种物质的溶解度曲线,下列说法不正确的是( )
如图是a、b、c三种物质的溶解度曲线,下列说法不正确的是( )

A.在t2℃时,a的溶解度等于b的溶解度
B.在t1℃时,a、c的饱和溶液的溶质质量分数相同
C.c的饱和溶液由t1℃升温至t2℃时,溶液的溶质质量分数减小
D.将t2℃的a、b的饱和溶液降温到t1℃,析出晶体的质量a>b 汗背1年前0
汗背1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 如图是A、B两种物质的溶解度曲线,下列叙述中正确的是( )
如图是A、B两种物质的溶解度曲线,下列叙述中正确的是( )
A.A物质的饱和溶液从30℃降温到10℃,变成不饱和溶液
B.20℃时,A、B两物质的饱和溶液中含溶质的质量相等
C.30℃时,向100g水中加入25gA物质,充分溶解后所得溶液是125g
D.30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发剂的方法 139网1年前1
139网1年前1 -
 shuaipan 共回答了18个问题
shuaipan 共回答了18个问题 |采纳率88.9%解题思路:A、A物质的溶解度随温度的升高而增大;
B、交点表示在该温度下两种物质的溶解度相等;
C、根据物质的溶解度进行解答;
D、根据饱和溶液和不饱和溶液的转化方法进行解答.A、A物质的饱和溶液从30℃降温到10℃,仍然是饱和溶液,错误;
B、20℃时,A、B两物质的饱和溶液不知道质量大小关系,无法知道含溶质的质量是否相等,错误;
C、30℃时,A的溶解度是20g,向100g水中加入25gA物质,充分溶解后所得溶液是120g,错误;
D、30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发剂的方法,正确;
故选D.点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法.
考点点评: 掌握溶解度曲线的意义、溶质的质量分数等知识是解题的基础和关键,能较好培养学生分析、解决问题的能力.1年前查看全部
- 下图是固体物质甲的溶解度曲线,请据图回答下列问题。 (1)t 2 ℃时,甲的溶解度为______g。
下图是固体物质甲的溶解度曲线,请据图回答下列问题。 
(1)t 2 ℃时,甲的溶解度为______g。
(2)t 3 ℃时,若将40g甲物质放入到100g水中,充分溶解后,所得溶液在溶解度曲线图中可表示为_______(填“A”或“B”)点 ,若将其降温到t 1 ℃,能析出晶体________g。 lsw05981年前1
lsw05981年前1 -
 irisdong 共回答了23个问题
irisdong 共回答了23个问题 |采纳率91.3%(1)40
(2)A;101年前查看全部
- 如图为A,B两种不带结晶水的固体物质溶解度曲线,下列说法不正确的是
如图为A,B两种不带结晶水的固体物质溶解度曲线,下列说法不正确的是

选D.我知道为什么要选D.但,我觉得C也可以选,因为固体溶解度,其溶剂质量是不变的,即容剂质量为
100g.但正确答案只有D,却没有C,为何?
 goodboyand11年前2
goodboyand11年前2 -
 drdj007 共回答了13个问题
drdj007 共回答了13个问题 |采纳率92.3%c明显是正确的,B溶剂少是指体积小
等质量的AB饱和溶液质量相同,包括了AB物质
B的溶解度大,故溶液中B质量大于A
那么用来溶解AB的溶液的质量,B溶液必然小于A
溶解后AB质量不影响体积,故B溶液体积较小1年前查看全部
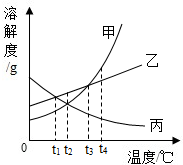
- 如图所示,有三种固体物质的溶解度曲线,请你完成下列填空:
 如图所示,有三种固体物质的溶解度曲线,请你完成下列填空:
如图所示,有三种固体物质的溶解度曲线,请你完成下列填空:
(1)图中N点表示的意义是______.
(2)t2℃时,A、B、C 三种物质的溶解度大小关系为______.
(3)把 t3℃时等质量的三种物质的饱和溶液升高温度至t2℃,则此时三种溶液的溶质质量分数大小关系是______. sita20021年前1
sita20021年前1 -
 jj551702 共回答了19个问题
jj551702 共回答了19个问题 |采纳率89.5%解题思路:根据固体物质的溶解度曲线的意义可以:查出某物质在一定温度时的溶解度;比较不同物质在同一温度下的溶解度的大小;判断物质的溶解度随温度变化的变化情况,从而判断溶液温度改变时,溶液中有有关量的变化等.(1)由三种固体物质的溶解度曲线可知,图中N点是A、B两种固体溶解度的曲线的交点.所以N点表示的意义是:在t3℃时,A、B的溶解度相等;
(2)由三种固体物质的溶解度曲线可知,在t2℃时,A、B、C 三种物质的溶解度大小关系为:A>B>C;
(3)由三种固体物质的溶解度曲线可知,A的溶解度随温度的升高而明显增大,B的溶解度随温度的升高而变化不大,C的溶解度随温度的升高而明显减少.在t3℃时,A、B两种固体溶解度相等,大于C的溶解度;在升高到t2℃时,A、B的饱和溶液变成不饱和溶液,溶液的溶质的质量分数不变,C的溶液有晶体析出,溶液中溶质的质量分数变小,所以,此时三种溶液的溶质质量分数大小关系是A=B>C.
故答为:(1)在t3℃时,A、B的溶解度相等;(2)A>B>C;(3)A=B>C.点评:
本题考点: 固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 该题考查的是溶解度曲线问题,解答此类问题需做好几点:能准确查阅一种物质的溶解度,理解溶解度的含义,能由溶解度曲线特点判断温度变化时,溶解度溶液的变化规律.1年前查看全部
- (2013•百色一模)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下.
(2013•百色一模)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下.

(1)图中能表示KNO3溶解度曲线的是______(填“甲”或“乙”).温度/℃ 20 30 50 60 80 溶解度/g K2CO3 110 114 121 126 139 KNO3 31.6 45.8 85.5 110 169
(2)M点的含义是______.
(3)30℃时,向114g K2CO3固体中加入100g水,充分溶解后,所得溶液是______(填“饱和”或“不饱和”)溶液,升温至40℃,该溶液中溶质的质量分数______(填“变大”、“变小”或“不变”). 早就想来1年前1
早就想来1年前1 -
 happybird1199 共回答了16个问题
happybird1199 共回答了16个问题 |采纳率81.3%解题思路:(1)由图表可知:硝酸钾的溶解度受温度影响更大;
(2)溶解度曲线的交点表示该温度下两物质的溶解度相同;
(3)依据30℃时碳酸钾的溶解度可知:此时溶液恰好饱和;升高温度,其溶解度逐渐变大,变为不饱和溶液,溶质的质量分数不变.(1)由图表可知:硝酸钾的溶解度受温度影响更大,所以能表示KNO3溶解度曲线的是甲;
故答案为:甲;
(2)M点表示t1℃时,甲和乙溶解度相等;
故答案为:t1℃时,甲和乙溶解度相等;
(3)30℃时碳酸钾的溶解度是114g,因此向114g K2CO3固体中加入100g水,充分溶解后,所得溶液是恰好饱和;升温至40℃,碳酸钾的溶解度增大,变为不饱和溶液,所以溶质的质量分数不变;
故答案为:饱和;不变.点评:
本题考点: 固体溶解度曲线及其作用;有关溶质质量分数的简单计算.
考点点评: 掌握溶解度的概念及溶解度曲线的意义,并能结合溶解度曲线及图表进行分析解答,考查了学生的思维能力.1年前查看全部
- 如图所示A、B、C是三种物质的溶解度曲线,请仔细观察分析图中所示的内容,回答下列问题:
如图所示A、B、C是三种物质的溶解度曲线,请仔细观察分析图中所示的内容,回答下列问题:
(1)曲线上Q点所表示的意义是:______.
(2)在t 1 °C时,A、B、C三种物质的溶解度由小到大的顺序是:______.
(3)若要从A物质的饱和溶液中得到A的晶体,应采用的最好方法是:______.
 gongcunli1年前1
gongcunli1年前1 -
 左亮 共回答了21个问题
左亮 共回答了21个问题 |采纳率85.7%(1)由于在t 2 ℃时,A和B的溶解度曲线交于Q点,说明两物质的溶解度相等,故答案为:t 2 ℃时,A和B的溶解度相等
(2)根据三种物质的溶解度曲线不难看出,在t 1 ℃时,三种物质的溶解度大小关系为:A<C<B,故答案为:A<C<B
(3)由于A物质的溶解度随温度的升高而明显增大,因此若要从A物质的饱和溶液中得到A的晶体,因此应采取降温结晶的方法,故答案为:降温结晶1年前查看全部
- 如图所示,依据A、B、C三种固体物质的溶解度曲线,回答下列问题:
如图所示,依据A、B、C三种固体物质的溶解度曲线,回答下列问题:
(1)A、B、C三种物质的溶解度随温度的升高而降低的是 。
(2)20℃时,A、B、C三种物质的溶解度的关系是 (用>、<或=表示)。
(3)50℃时,A物质饱和溶液中,溶质、溶剂、溶液的质量之比为 。
(4)将A物质的不饱和溶液变为饱和溶液可采用的方法是 (填两种方法)。
(5)50℃时,A、B、C三种物质的饱和溶液各100g,分别降温到20℃时,所得溶液质量的关系是 (用>、<或=表示).
(6)配置一定溶质质量分数的B物质溶液,以下操作中会导致所配置的溶液溶质质量分数偏低的是 。(填序号)
①将量筒中的水倒入烧杯时,有水溅出
②称量时砝码端忘垫质量相同的纸片
③用量筒量取水时,仰视读数
④装瓶时,有少量溶液洒出 jccgzhou1年前1
jccgzhou1年前1 -
 ff台 共回答了16个问题
ff台 共回答了16个问题 |采纳率81.3%(1) C (2)B>A=C(或A=C<B) (3)1:2:3
(4)加溶质;降温;蒸发溶剂 (5)C>B>A(或A<B<C) (6)②③
1年前查看全部
- (2013•大理州模拟)如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )
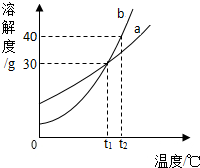 (2013•大理州模拟)如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )
(2013•大理州模拟)如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )
A.a物质的溶解度大于b物质的溶解度
B.t1℃时,将a、b两种物质的饱和溶液升温至t2℃,所得a、b两种物质的溶液中溶质质量分数相等
C.将t2℃时b物质的溶液降温到t1℃,溶液一定变为饱和溶液
D.t1℃时,30g a物质加入到70g水中,所得溶液溶质质量分数为30% xzh1233331年前1
xzh1233331年前1 -
 名利都是那浮云 共回答了21个问题
名利都是那浮云 共回答了21个问题 |采纳率81%解题思路:A、根据溶解度曲线的意义解答;
B、根据在饱和溶液中,溶质质量分数=
×100%分析判断;溶解度 100g+溶解度
C、根据饱和溶液的定义分析判断;
D、根据t1℃时,a的溶解度分析计算.A、未指明明温度,不能比较A物质的溶解度大于B物质的溶解度,故A错误;
B、由a、b两种固体物质的溶解度曲线可知,在t1℃时,a、b两种物质的溶解度相同,由溶质质量分数=
溶解度
100g+溶解度×100%可知,溶液的溶质质量分数相同;在升高温度至t2℃时,溶解度增大,溶液的溶质的质量分数不变,所得a、b两种物质的溶液中溶质质量分数相等.故B正确;
C、将t2℃时b物质的溶液降温到t1℃,溶液不一定变为饱和溶液.故C错误;
D、由于a物质的溶解度曲线可知,在t1℃时,a物质的溶解度是30g,由溶解度的含义可知,将30g a物质加入到70g水中,只能溶解21g,溶液溶质质量分数为:
21g
70g+21g×100%=23.8%.故D错误.
故选:B.点评:
本题考点: 固体溶解度曲线及其作用;晶体和结晶的概念与现象;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 解答本题关键是要知道溶解度曲线表示的意义,并据此分析在降温或升温的过程中溶解度、溶质质量分数等量的变化情况.1年前查看全部
- 如图是物质A和B在不同温度时的溶解度及其溶解度曲线
如图是物质A和B在不同温度时的溶解度及其溶解度曲线
回答下列问题:温度/℃ 20 30 50 60 80 溶解度/g A 110 114 121 126 139 B 31.6 45.8 85.5 110 169
(1)图中表示B物质溶解度曲线的是 (填“甲”或“乙”).
(2)曲线上M点的含义是 .
(3)温度t 1 介于 ℃之间.
 羽凉1年前1
羽凉1年前1 -
 jibahit 共回答了10个问题
jibahit 共回答了10个问题 |采纳率100%(1)甲;(2)t 1 ℃时,A、B两物质的溶解度相等; (3)60﹣80
1年前查看全部
- 根据如图所示的溶解度曲线,判断下列说法中不正确的是( ) A.t 1 ℃时,甲物质的溶解度小于乙物质的溶解度 B.t
根据如图所示的溶解度曲线,判断下列说法中不正确的是( ) A.t 1 ℃时,甲物质的溶解度小于乙物质的溶解度 B.t 2 ℃时,甲物质的饱和溶液和乙物质的饱和溶液中含有溶质的质量相等 C.将t 3 ℃的甲乙两物质的饱和溶液降温到t 2 ℃时都会析出晶体 D.当甲物质中混有少量乙物质时,可采用冷却热饱和溶液的方法提纯甲 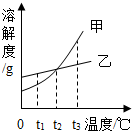
 maggielovemylife1年前1
maggielovemylife1年前1 -
 掉了鸟的羽毛 共回答了22个问题
掉了鸟的羽毛 共回答了22个问题 |采纳率95.5%A、在温度为t 1 ℃时,图中乙物质曲线处于甲物质曲线上方,说明此时甲物质的溶解度小于乙物质.本选项说法正确;
B、曲线图显示,在温度为t 2 ℃时两曲线相交于一点,说明此时甲、乙两物质的溶解度相等.此时若两物质的饱和溶液量相等所含溶质的量也就相等,但本选项的说法中没有说明饱和溶液质量是相等的,所以也就不能得出所含溶质质量相等的结论.本选项的说法不正确;
C、据图知:温度降低甲、乙两物质的溶解度都减小.所以,随温度降低甲、乙两物质的饱和溶液都会因溶质溶解能力减小而析出晶体.本选项的说法正确;
D、曲线图显示,甲物质溶解度爱温度影响较大,乙物质的溶解度受温度影响不大.当甲物质中混有少量乙物质时,可采用冷却热饱和溶液的方法提纯甲,冷却结晶时少量的乙物质仍溶解在溶液中没有析出.本选项说法正确.
故选:B.1年前查看全部
- (2013•泸州)根据如图的溶解度曲线,判断下列说法不正确的是( )
 (2013•泸州)根据如图的溶解度曲线,判断下列说法不正确的是( )
(2013•泸州)根据如图的溶解度曲线,判断下列说法不正确的是( )
A.图中a点表示,t2℃时100g水中最多溶解甲物质25g
B.甲物质的溶解度随温度的升高而增大
C.t1℃时,甲、乙两物质的饱和溶液中含溶质的质量相等
D.t1℃时,甲、乙两物质的饱和溶液中溶质质量分数相等 风_魂1年前1
风_魂1年前1 -
 夏苏小童 共回答了21个问题
夏苏小童 共回答了21个问题 |采纳率95.2%解题思路:A、据溶解度曲线可知某温度下物质的溶解度;
B、据溶解度曲线可知物质的溶解度随温度变化情况;
C、不知溶液的质量,无法判断所含溶质的质量关系;
D、一定温度下的饱和溶液中两物质的溶解度相等,则溶质的质量分数也相等.A、图中a点表示,t2℃时100g水中最多溶解甲物质25g,正确;
B、甲物质的溶解度随温度的升高而增大,正确;
C、t1℃时,甲、乙两物质的溶解度相等,若二者饱和溶液的质量相等则所含溶质的质量相等,现在溶液不确定,无法比较两溶液溶质质量多少,故错误;
D、t1℃时,甲、乙两物质的溶解度相等,饱和溶液中溶质的质量分数也相等,正确;
故选:C.点评:
本题考点: 固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 掌握溶解度曲线所反映的信息,并能据所提供的信息分析相关问题,一定温度下的饱和溶液中两物质的溶解度相等,则溶质的质量分数也相等.1年前查看全部
- (2014•金华)如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
 (2014•金华)如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
(2014•金华)如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
A.t2℃时,向100克水中加入20克甲,充分溶解后所得溶液是饱和溶液
B.甲饱和溶液从t2℃降温至t1℃,溶液的质量不变
C.乙饱和溶液温度降低,有晶体析出,是化学变化
D.当甲中含有少量乙时,可用降低甲饱和溶液温度的方法提纯甲 江民杀毒1年前1
江民杀毒1年前1 -
 redish 共回答了19个问题
redish 共回答了19个问题 |采纳率94.7%解题思路:根据固体物质的溶解度曲线可知:①比较不同物质在同一温度下的溶解度大小,②查出某物质在一定温度下的溶解度,从而可以判断形成的溶液是否饱和等.A、t2℃时,甲的溶解度是80g,向100克水中加入20克甲,充分溶解后所得溶液是不饱和溶液,错误;
B、甲饱和溶液从t2℃降温至t1℃,有晶体析出,溶液的质量减小,错误;
C、乙饱和溶液温度降低,有晶体析出,没有生成新的物质,不是化学变化,错误;
D、甲的溶解度随温度的升高而增加变化明显,故当甲中含有少量乙时,可用降低甲饱和溶液温度的方法提纯甲,正确.
故选D.点评:
本题考点: 固体溶解度曲线及其作用;结晶的原理、方法及其应用;晶体和结晶的概念与现象.
考点点评: 本题难度不是很大,主要考查了固体溶解度曲线所表示的意义及对固体溶解度概念的理解.1年前查看全部
- (2011•锦州模拟)如图是甲、乙、丙三种固体物质的溶解度曲线,请根据图示填空:
 (2011•锦州模拟)如图是甲、乙、丙三种固体物质的溶解度曲线,请根据图示填空:
(2011•锦州模拟)如图是甲、乙、丙三种固体物质的溶解度曲线,请根据图示填空:
(1)t3℃时,甲物质的饱和溶液中,溶质、溶剂、溶液的质量之比为______.
(2)t2℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数的大小关系是______(用“甲”、“乙”、“丙”及“>”、“<”或“=”表示).
(3)将t3℃的甲、乙、丙三种物质的饱和溶液各100g,分别降温至t1℃,所得溶液的质量的大小关系是______(用“甲”、“乙”、“丙”及“>”、“<”或“=”表示). 流向何方1年前1
流向何方1年前1 -
 zhoujun222 共回答了18个问题
zhoujun222 共回答了18个问题 |采纳率94.4%解题思路:(1)溶液具有均一性,一定温度下的饱和溶液中溶质、溶剂、溶液的质量比是相同的,可据该温度下甲的溶解度分析解答;
(2)据饱和时质量分数的计算式[溶解度/溶解度+100g]×100%可知:溶解度越大质量分数也就越大,并结合溶解度曲线回答;
(3)据三种物质的溶解度受温度影响情况分析判断.(1)由于溶液具有均一性,所以一定温度下的饱和溶液中溶质、溶剂、溶液的质量比是相同的;t3℃时,甲物质的溶解度是50g,则其饱和溶液中,溶质、溶剂、溶液的质量之比为 50g:100g:150g=1:2:3;
(2)t2℃时,甲、乙、丙三种物质的溶解度大小关系是甲=丙>乙,据饱和时质量分数的计算式[溶解度/溶解度+100g]×100%可知:溶解度越大质量分数也就越大,所以该温度下的饱和溶液中,溶质质量分数的大小关系是甲=丙>乙;
(3)由图可知:甲、乙的溶解度随温度的降低而减小,丙的溶解度随温度的降低而增大,且温度从t3℃降到t1℃甲的溶解度变化比乙大,所以将t3℃的甲、乙、丙三种物质的饱和溶液各100g,分别降温至t1℃,甲析出晶体的质量大于乙,而丙变为不饱和溶液,溶液的质量不变,则所得溶液的质量的大小关系是丙>乙>甲;
故答案为:(1)1:2:3;(2)甲=丙>乙; (3)丙>乙>甲.点评:
本题考点: 固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 明确溶解度概念、溶解度曲线的意义,饱和溶液中溶质的质量分数计算方法及等质量的饱和溶液降低相同的温度,溶解度变化大的析出晶体多,才能正确分析解答.1年前查看全部
- 如图所示是甲、乙、丙三种物质的溶解度曲线,当他们接近饱和时,可以分别通过加溶质、蒸发溶剂、升温等方法变为饱和溶液的是(
如图所示是甲、乙、丙三种物质的溶解度曲线,当他们接近饱和时,可以分别通过加溶质、蒸发溶剂、升温等方法变为饱和溶液的是( ) A.甲溶液 B.乙溶液 C.丙溶液 D.甲、乙混合溶液 
 79853541年前1
79853541年前1 -
 xinhuun 共回答了15个问题
xinhuun 共回答了15个问题 |采纳率80%A、甲的溶解度随温度升高而增大,所以加溶质,蒸发溶剂都能使接近饱和的甲溶液变为饱和溶液;升高温度甲的溶解度增大,接近饱和的甲溶液不会变为饱和溶液,故A不选.
B、乙的溶解度随温度升高而增大,所以加溶质,蒸发溶剂都能使接近饱和的甲溶液变为饱和溶液;升高温度乙的溶解度增大,接近饱和的乙溶液不会变为饱和溶液,故B不选.
C、丙的溶解度随温度升高而减小,所以加溶质,蒸发溶剂都能使接近饱和的丙溶液变为饱和溶液;升高温度丙的溶解度减小,接近饱和的丙溶液会变为饱和溶液,故C选.
D、甲和乙解度随温度升高而增大,所以加溶质,蒸发溶剂都能使接近饱和的甲溶液变为饱和溶液;但升高温度他们的溶解度都增大,都不能变为饱和溶液,故D不能选.
故答案选C.1年前查看全部
- (2012•衡阳)如图是A、B、C三种固体物质的溶解度曲线,请根据图示回答.
 (2012•衡阳)如图是A、B、C三种固体物质的溶解度曲线,请根据图示回答.
(2012•衡阳)如图是A、B、C三种固体物质的溶解度曲线,请根据图示回答.
(1)t1时.B的溶解度为______g.
(2)t2℃时,A、B、C三种物质溶解度由大到小的顺序为______.
(3)要使B从其溶解液中析出最好采取______结晶的方法.
(4)将t2℃时A、C的饱和溶液降温到t1℃,所得溶液中溶质的质量分数A______C(填“>”、“=”或“<”). 哓哓知知1年前1
哓哓知知1年前1 -
 斐一正 共回答了18个问题
斐一正 共回答了18个问题 |采纳率83.3%解题思路:由A、B、C三种物质溶解度曲线知,t1℃时B的溶解度为20g;t2℃时,A、B、C三种三种物质溶解度由大到小的顺序为A>B>C;B物质的溶解度尽管随温度的升高而增大,但受温度影响不大,所以析出晶体可采用蒸发溶剂结晶;A在t1℃溶解度大于C在t2℃时的溶解度,将t2℃时A、C的饱和溶液降温到t1℃,所以溶液中溶质的质量分数A大于C.(1)由溶解度曲线知,t1℃时B的溶解度为20g,故填:20;
(2)由A、B、C三种物质溶解度曲线知,t2℃时,A、B、C三种三种物质溶解度由大到小的顺序为A>B>C;故填:A>B>C;
(3)由溶解度曲线知,B物质的溶解度尽管随温度的升高而增大,但受温度影响不大,所以析出晶体可采用蒸发溶剂结晶,故填:蒸发溶剂;
(4)因为A物质的溶解度随温度的升高而增大,C物质的溶解度随温度的升高而减小,所以将t2℃时A、C的饱和溶液降温到t1℃,A有晶体析出,C没有晶体析出,但A在t1℃溶解度大于C在t2℃时的溶解度,所以溶液中溶质的质量分数A大于C,故填:>;点评:
本题考点: 固体溶解度曲线及其作用.
考点点评: 本题主要考查了固体溶解度曲线的意义及对固体溶解度概念的理解,从而培养学生的理解能力和解决问题的能力.1年前查看全部
- (2014•江宁区一模)如图是甲乙两种固体(均不含结晶水)的溶解度曲线,下列说法中正确的是( )
(2014•江宁区一模)如图是甲乙两种固体(均不含结晶水)的溶解度曲线,下列说法中正确的是( )

A.甲的溶解度小于乙的溶解度
B.t1℃时,50g水中最多溶解15g甲
C.t2℃时乙的饱和溶液降温至t1℃变为不饱和溶液
D.将t1℃时甲的饱和溶液升温至t2℃,溶质的质量分数增大 lc19841年前1
lc19841年前1 -
 malizhao 共回答了22个问题
malizhao 共回答了22个问题 |采纳率81.8%解题思路:A、比较溶解度大小须确定温度;
B、据该温度下甲的溶解度分析解答;
C、乙的溶解度随温度降低而减小,据此分析解答;
D、据甲的溶解度随温度变化分析解答.A、比较溶解度大小须确定温度,故错误;
B、t1℃时甲的溶解度是30g,即100g水中最多溶解30g的甲,所以50g水中最多溶解15g甲,正确;
C、乙的溶解度随温度降低而减小,所以将t2℃时乙的饱和溶液降温至t1℃溶解度减小,依然是饱和溶液,故错误;
D、甲的溶解度随温度升高而增大,所以将t1℃时甲的饱和溶液升温至t2℃,溶解度变大,溶质、溶剂的质量不变,所以溶质的质量分数不变,故错误;
故选:B.点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法.
考点点评: 本题难度不大,了解溶解度概念、并能据溶解度随温度变化分析溶液状态、溶质的质量分数变化.1年前查看全部
- 下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列有关说法正确的是( )
下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列有关说法正确的是( )

A.t2℃时,在两个各盛有l00g水的烧杯中,分别加入50g的甲、乙两种固体,充分搅拌,所得甲、乙溶液中溶质的质量不等 B.t1℃时,等质量甲、乙溶液中所含溶剂的质量甲等于乙 C.乙中含有少量甲,可以用冷却热饱和溶液的方法提纯甲 D.t2℃时.将甲、乙饱和溶液降温至tl℃,甲溶液析出晶体的质量大于乙  心如小志1年前1
心如小志1年前1 -
 雪候小鸟 共回答了14个问题
雪候小鸟 共回答了14个问题 |采纳率85.7%A
1年前查看全部
- (2011•福州)氯化铵和硝酸钾溶解度曲线如图所示,下列叙述正确的是( )
 (2011•福州)氯化铵和硝酸钾溶解度曲线如图所示,下列叙述正确的是( )
(2011•福州)氯化铵和硝酸钾溶解度曲线如图所示,下列叙述正确的是( )
A.60℃时,硝酸钾的溶解度小于氯化铵的溶解度
B.40℃的硝酸钾饱和溶液降低温度会变为不饱和溶液
C.t℃时,氯化铵饱和溶液与硝酸钾饱和溶液的溶质的质量分数相等
D.60℃时,100g水中加入120g硝酸钾,充分搅拌,得到的是硝酸钾不饱和溶液 nalan_yc1年前1
nalan_yc1年前1 -
 阳光kk 共回答了17个问题
阳光kk 共回答了17个问题 |采纳率82.4%解题思路:根据物质的溶解度曲线,分析判断:60℃时,两种物质的溶解度大小;根据硝酸钾溶解度随温度变化而变化的情况判断溶液是否饱和;比较两物质在同一温度时的饱和溶液中溶质的质量分数;A、60℃时,硝酸钾的溶解度大于氯化铵的溶解度,故A错误.
B、硝酸钾的溶解度随着温度的降低而减小,故40℃的硝酸钾饱和溶液降低温度仍为饱和溶液,故B错误.
C、t℃时,氯化铵和硝酸钾两物质的溶解度相等,故氯化铵饱和溶液与硝酸钾饱和溶液的溶质的质量分数相等;故C正确.
D、60℃时,硝酸钾的溶解度为110g,故100g水中加入120g硝酸钾,充分搅拌,只能溶解110g,得到的是硝酸钾的饱和溶液;故D错误.
故选C.点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液;饱和溶液和不饱和溶液相互转变的方法;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 主要考查了对固体溶解度的概念的理解和固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.1年前查看全部
- (2011•安顺)如图是甲、乙、丙三种固体物质的溶解度曲线,请根据图示和要求填空.
 (2011•安顺)如图是甲、乙、丙三种固体物质的溶解度曲线,请根据图示和要求填空.
(2011•安顺)如图是甲、乙、丙三种固体物质的溶解度曲线,请根据图示和要求填空.
(1)t1℃时,100g水中溶解20g乙物质,溶液恰好饱和.若此时有甲物质的饱和溶液,则甲物质的溶解度______ (填“大于”或“小于”或“等于”)乙物质的溶解度.
(2)t3℃时,甲、乙、丙三种物质的饱和溶液温度升高到t4℃,溶液中有溶质析出的是
______ 物质,此时形成的甲、乙两种物质的不饱和溶液中溶质质量分数的关系是:甲溶液中溶质的质量分数______ 乙溶液中溶质的质量分数(填“大于”或“小于”或“等于”). ww小大虫1年前1
ww小大虫1年前1 -
 porsche0000 共回答了19个问题
porsche0000 共回答了19个问题 |采纳率78.9%解题思路:(1)根据溶解度曲线可比较同一温度下不同物质的溶解度大小
(2)饱和溶液升温析出晶体的物质其溶解度随温度升高而减小,溶解度曲线交点表示该温度下溶解度相等,饱和溶液的溶质质量分数相等.(1)t1℃时甲物质的溶解度曲线在乙物质溶解度曲线的下方,因此甲的溶解度小于乙物质的溶解度;
(2)丙物质的溶解度随温度升高而减小,甲乙两物质的溶解度随温度升高而增大,因此t3℃时,甲、乙、丙三种物质的饱和溶液温度升高到t4℃,甲、乙溶液变成不饱和溶液,丙溶液中有溶质析出;t3℃时,甲、乙两物质的溶解度相等,饱和溶液的溶质质量分数相等,当升高到t4℃都变成不饱和溶液,溶液中溶质质量分数不变,故填等于.
故答案为:(1)小于 (2)丙;等于点评:
本题考点: 固体溶解度曲线及其作用;晶体和结晶的概念与现象.
考点点评: 本题考查溶解度曲线的意义,线上任一点表示某温度下某物质的溶解度,交点表示该温度下两物质的溶解度相等.1年前查看全部
- (2013•港北区二模)如图,是a、b、c、d四种固体物质的溶解度曲线,下表是它们在10℃和60℃时的溶解度数据.
 (2013•港北区二模)如图,是a、b、c、d四种固体物质的溶解度曲线,下表是它们在10℃和60℃时的溶解度数据.
(2013•港北区二模)如图,是a、b、c、d四种固体物质的溶解度曲线,下表是它们在10℃和60℃时的溶解度数据.
根据图表信息判断下列说法正确的是( )NaCl KCl NH4Cl KNO3 10℃ 35.8g 31.0g 33.3g 20.9g 60℃ 37.3g 45.5g 55.2g 110.0g
A.图中a曲线是KNO3的溶解度曲线
B.b的溶解度小于a的溶解度
C.要从a与d的混合物中得到a,通常采用蒸发溶剂使其结晶的方法
D.60℃时,将120gKNO3放入100g水中充分溶解,所形成溶液的溶质质量分数为54.5% bbl3121年前1
bbl3121年前1 -
 crzhidaonsss 共回答了16个问题
crzhidaonsss 共回答了16个问题 |采纳率75%解题思路:要比较溶解度的大小,必须指明一定温度下.60℃时,KNO3的溶解度为110g,则120gKNO3在100g水中不能完全溶解,所形成的溶液中溶质为110g,溶剂为100g,根据溶质质量分数=[溶质质量/溶液质量]×100%即可求出KNO3溶液的质量分数.A、根据表中数据,KNO3的溶解度随温度变化最大,故a曲线是KNO3的溶解度曲线,对;
B、a、b 的溶解度曲线有交点,小于交点温度时,溶解度a<b,大于交点温度时,溶解度a>b,错;
C、d 溶解度受温度影响很小,故要从a与d的混合物中得到a,应使用降温的方法,错;
D、60℃时,100g水中最多能溶解110gKNO3,则所形成溶液的溶质质量分数=[110g/110g+100g]×100%=52.4%,D错.
故选A.点评:
本题考点: 固体溶解度曲线及其作用;结晶的原理、方法及其应用;溶质的质量分数、溶解性和溶解度的关系.
考点点评: 本题易错选A,在求溶质质量分数时一定要先判断溶液是否饱和,确定溶质质量和溶剂质量,再根据溶质质量分数计算公式即可求解.1年前查看全部
- 如图所示是甲、乙、丙三种物质的溶解度曲线,在20℃时,分别取等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液分别加入
如图所示是甲、乙、丙三种物质的溶解度曲线,在20℃时,分别取等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,试回答下列问题: 
(1)乙物质的溶解情况是 _____________________。
(2)依次写出甲、乙、丙三种物质的溶解度曲线的序号:__________;
(3)当温度在20℃~30℃时,三种物质的溶解度由大到小的顺序是_____________;(用甲、乙、丙填空)
(4)40℃时,等质量饱和溶液中含水最少的是______物质。
(5)40℃时,甲溶液中溶质质量分数____大于丙溶液中溶质质量分数;(填“一定”或“不一定”)。 198307071年前1
198307071年前1 -
 hncr 共回答了18个问题
hncr 共回答了18个问题 |采纳率94.4%(1)乙固体质量增多
(2)acb
(3)丙>甲>乙
(4)甲
(5)不一定1年前查看全部
- 如图a、b、c是三种固体物质的溶解度曲线,下列说法中不正确的是( )
 如图a、b、c是三种固体物质的溶解度曲线,下列说法中不正确的是( )
如图a、b、c是三种固体物质的溶解度曲线,下列说法中不正确的是( )
A.任何温度下,a的溶解度大于b的溶解度
B.a的溶解度受温度变化的影响比b的大
C.P点表示t1℃时a、c两种物质溶解度相等
D.可利用冷却结晶的方法来分离溶液中的a、b 西湖不醋鱼1年前1
西湖不醋鱼1年前1 -
 _昕ヤ晰 共回答了25个问题
_昕ヤ晰 共回答了25个问题 |采纳率84%解题思路:A、据溶解度曲线可比较不同温度下物质的溶解度大小;
B、据溶解度曲线可知物质的溶解度受温度影响情况;
C、溶解度曲线的交点表示该温度下两物质的溶解度相等;
D、据物质的溶解度变化情况可分析分离物质的方法.A、由溶解度曲线可知:并非任何温度下a的溶解度大于b的溶解度,如:0℃时a的溶解度就小于b的溶解度,故错误;
B、由溶解度曲线可知:a的溶解度受温度变化的影响比b的大,正确;
C、P点是t1℃时a、c两种物质溶解度曲线的交点,表示该温度下两物质的溶解度相等,正确;
D、a的溶解度受温度变化的影响比b的大,所以可利用冷却结晶的方法提纯a,将a、b分开,正确;
故选:A.点评:
本题考点: 固体溶解度曲线及其作用;结晶的原理、方法及其应用.
考点点评: 主要考查了溶解度曲线的认识和应用,难度不大.1年前查看全部
- (2013•南平)如图是甲、乙两种固体化合物的溶解度曲线,下列判断正确的是( )
 (2013•南平)如图是甲、乙两种固体化合物的溶解度曲线,下列判断正确的是( )
(2013•南平)如图是甲、乙两种固体化合物的溶解度曲线,下列判断正确的是( )
A.甲的溶解度比乙大
B.甲的溶解度受温度影响比乙大
C.升高温度可以使甲的不饱和溶液变为饱和溶液
D.在t1℃时将25g乙投入100g水中,可以形成125g溶液 练绮1年前1
练绮1年前1 -
 c_kevin 共回答了19个问题
c_kevin 共回答了19个问题 |采纳率94.7%解题思路:A、比较物质的溶解度大小需确定温度;B、由溶解度曲线图可知:甲的溶解度受温度影响较大;C、据甲的溶解度随温度变化情况可分析甲不饱和溶液变为饱和溶液的方法;D、据t1℃时乙的溶解度 分析解答.A、比较物质的溶解度大小需确定温度,故错误;
B、由溶解度曲线图可知:甲的溶解度受温度影响较大,正确;
C、甲的溶解度随温度的升高而增大,所以要将甲不饱和溶液变为饱和溶液可采取降温的方法,故错误;
D、t1℃时乙的溶解度是20g,所以在t1℃时将25g乙投入100g水中,可以形成120g溶液,故错误;
故选B.点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法.
考点点评: 了解溶解度的概念的含义、溶解度曲线的意义及其应用是解答此类题目的关键.1年前查看全部
- (2011•新区二模)根据KNO3和NaCl的溶解度曲线,回答问题:
 (2011•新区二模)根据KNO3和NaCl的溶解度曲线,回答问题:
(2011•新区二模)根据KNO3和NaCl的溶解度曲线,回答问题:
(1)30℃时KNO3的溶解度______(填“>”、“<”或“=”)NaCl的溶解度.
(2)若将t℃的两者等质量的饱和溶液同时降温至0℃,晶体析出较多的是______.
(3)现有30℃时接近饱和的KNO3溶液,在不减少溶剂的情况下,欲使其变成饱和,下列措施中能实现的是______;(填序号)
①降低温度②升高温度③加入固体KNO3
(4)工业上采用如下的流程从海水中提取精盐:
上述流程中Ⅰ为______、母液是氯化钠的______溶液(填“饱和”、“不饱和”).若在实验室中完成上述流程中Ⅲ,需经过溶解、______、______三步完成,这三步都要用到的玻璃仪器是______.
(5)现要配制500千克16%的氯化钠溶液来选种,需要20%的氯化钠溶液______千克. welcomexierong1年前1
welcomexierong1年前1 -
 vvjiqin 共回答了20个问题
vvjiqin 共回答了20个问题 |采纳率100%解题思路:(1)由图可知,30℃时KNO3的溶解度与NaCl的溶解度的大小.
(2)若将t℃的两者等质量的饱和溶液同时降温至0℃,晶体析出较多的是溶解度受温度影响较大的物质.
(3)根据硝酸钾的溶解度曲线,可推测:30℃时接近饱和的KNO3溶液,在不减少溶剂的情况下,欲使其变成饱和溶液的措施;
(4)由工业上采用的流程从海水中提取精盐:需经过步骤和要用到的玻璃仪器.
(5)现要配制500千克16%的氯化钠溶液来选种,根据溶质不变,则可求需要20%的氯化钠溶液质量.(1)由图可知,30℃时KNO3的溶解度>NaCl的溶解度.
(2)若将t℃的两者等质量的饱和溶液同时降温至0℃,晶体析出较多的为溶解度受温度影响较大的是KNO3.
(3)根据硝酸钾的溶解度曲线,可推测:30℃时接近饱和的KNO3溶液,在不减少溶剂的情况下,欲使其变成饱和的措施是降低温度;升高温度,故选①③;
(4)工业上采用如下的流程从海水中提取精盐:
上述流程中Ⅰ为蒸发池、母液是氯化钠的饱和溶液.若在实验室中完成上述流程中Ⅲ,需经过溶解、过滤、蒸发三步完成,这三步都要用到的玻璃仪器是玻璃棒.
(5)现要配制500千克16%的氯化钠溶液来选种,则:[500×16%/20%]=400(千克),故需要的氯化钠溶液400千克.
故答为:(1)>;(2)KNO3;(3)①③;(4)蒸发池、饱和、过滤、蒸发、玻璃棒;(5)400点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法;有关溶质质量分数的简单计算;海水晒盐的原理和过程.
考点点评: 溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同.1年前查看全部
- (2011•徐州模拟)(1)如图是氢氧化钙的溶解度曲线,从图中你能得到的信息是(写出一条即可)______.
 (2011•徐州模拟)(1)如图是氢氧化钙的溶解度曲线,从图中你能得到的信息是(写出一条即可)______.
(2011•徐州模拟)(1)如图是氢氧化钙的溶解度曲线,从图中你能得到的信息是(写出一条即可)______.
(2)若使20℃时不饱和的澄清石灰水变成饱和溶液,可采取的措施是______、______. 只爱小雨1年前1
只爱小雨1年前1 -
 小虫lcoucon 共回答了19个问题
小虫lcoucon 共回答了19个问题 |采纳率84.2%解题思路:根据固体的溶解度曲线可以:①比较氢氧化钙在不同温度下的溶解度的大小,②判断氢氧化钙的溶解度随温度变化的变化情况等.根据溶解度受温度的变化影响趋势,可以确定不饱和的澄清石灰水变成饱和溶液的方法.(1)由溶解度曲线可以看出氢氧化钙的溶解度随着温度的升高而减小;30℃时,氢氧化钙的溶解度为0.15g等.
(2)由于氢氧化钙的溶解度随着温度的升高而减小,故若使20℃时不饱和的澄清石灰水变成饱和溶液,可采取升温或增加溶质的方法.
故答案为:(1)氢氧化钙的溶解度随着温度的升高而减小等;
(2)升温、增加溶质等.点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液;饱和溶液和不饱和溶液相互转变的方法;固体溶解度的概念.
考点点评: 本题难度不大,主要考查了固体溶解度曲线所表示的意义,通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力.1年前查看全部
- 山东初4化学题举例说明溶解度曲线有那些应用?我国北方有一个盐硝湖,当地居民“夏天晒盐(NaCl晶体),冬天捞硝(KNO3
山东初4化学题
举例说明溶解度曲线有那些应用?我国北方有一个盐硝湖,当地居民“夏天晒盐(NaCl晶体),冬天捞硝(KNO3晶体)”,请说明其中的道理? littleplane1年前1
littleplane1年前1 -
 xcvksoaidfuoasip 共回答了19个问题
xcvksoaidfuoasip 共回答了19个问题 |采纳率94.7%问题 举例说明溶解度曲线有那些应用?答:溶解度曲线的应用 1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同湿度时(或一定湿度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).问题 我国北方有一个盐硝湖,当地居民“夏天晒盐(NaCl晶体),冬天捞硝(KNO3晶体)”,请说明其中的道理?答:1.少数固体物质的溶解度受温度的影响很小,曲线为"缓升型",如氯化钠.夏天的温度高,水蒸发而结晶出NaCl晶体; 2.大多数固体物质的溶解度随温度升高而增大,曲线为"陡升型",如硝酸钾.冬天天气冷,使KNO3的溶解度降低而结晶出KNO3晶体.1年前查看全部
- 溶解度曲线上的点表示物质( ),溶液所处的状态( );
溶解度曲线上的点表示物质( ),溶液所处的状态( );
溶解度曲线下面的面积上的点,表示溶液所处的状态是( );
溶解度曲线上面的面积上的点,依其数据配置的溶液为对应温度时的( )溶液,且该溶液有剩余 vzshgfdh1年前2
vzshgfdh1年前2 -
 vivc 共回答了15个问题
vivc 共回答了15个问题 |采纳率80%溶解度曲线上的点表示物质(在某温度下的溶解度),溶液所处的状态(饱和状态);
溶解度曲线下面的面积上的点,表示溶液所处的状态是(不饱和状态);
溶解度曲线上面的面积上的点,依其数据配置的溶液为对应温度时的(饱和)溶液,且该溶液中(溶质)有剩余1年前查看全部
大家在问
- 1一个正方形边长为a,100个这样的正方形顺次连成一个长方形,这个长方形周长是______.
- 236°32′25″乘6计算
- 3The students clean the windows every day(改为被动语态)
- 4如图,在三角形ABC中,AD⊥BC,EF⊥BC,垂足分别为D、F.G为AC上一点,E为AB上一点,∠1=∠2.
- 5如图(1),在平面直角坐标系中,AB⊥x轴于B,AC⊥y轴于C,点C(0,m),A(n,m),且(m-4) 2 +n 2
- 6when your no longer there
- 7改错 哪错了 打出来就可以了1I have no brothers,too2It rain a lot here in
- 8We will have a lot of fun to see the lion dance in chinatown
- 9两情若是久长时,又岂在朝朝暮暮.出自谁的诗?
- 10已知定义在R上的函数y=f(x)满足以下三个条件:
- 11请写作高手看看这段话,个人觉得有些别扭,如果有的话,希望修改一下.最好不要改变意思.尽快给我.
- 12英文单词()CT()()?
- 13世界是必然的吗?在我认识中,科学是对事物具体的因果研究,从而找到事物发展的规律.当我们研究出关于这个事物的所有相关规律,
- 14(1)已知直线过点p(0,2),且与x轴正向的夹角为135°,则直线方程是
- 15—I’ll go on a visit to Mount Huang. —____ A.Thank you.
