能让紫色石蕊试液变蓝的物质一定是碱溶液
 interfjs2022-10-04 11:39:541条回答
interfjs2022-10-04 11:39:541条回答Na2CO3的溶液是不是可以认为是碱性溶液

已提交,审核后显示!提交回复
共1条回复
 独沐烟雨 共回答了17个问题
独沐烟雨 共回答了17个问题 |采纳率100%- 是显碱性的溶液,而不是碱溶液..
有问题就问我吧,我学的没问题,今年也高考^ - 1年前
相关推荐
- 将CO2通入紫色石蕊试液中,试液中的水会不会和CO2反应?
 朔朔1年前3
朔朔1年前3 -
 chuhj122 共回答了21个问题
chuhj122 共回答了21个问题 |采纳率85.7%有反应 会变红(不是很明显) CO2会与水生成H2CO31年前查看全部
- 使紫色石蕊试液变红的溶液那说明是酸性溶液,其中为什么不能同时共存铁离子镁离子硝酸根离子氯离子
 ljiang6668881年前2
ljiang6668881年前2 -
 万家福 共回答了20个问题
万家福 共回答了20个问题 |采纳率85%硝酸根在酸性环境下具有强氧化性,可以把二价铁氧化为三价铁1年前查看全部
- 为什么Cl2 通入紫色石蕊试液中不会先变红再褪色?
为什么Cl2 通入紫色石蕊试液中不会先变红再褪色?
而通入新制的氯水却可以?
我的意思是这样的
Cl2通入紫色石蕊试液中 会令其褪色而不变红
新制的氯水 却能令其先变红再褪色
为什么Cl2通入到紫色石蕊试液中 与其中的水反应生成的HClO 不能和新制的氯水中的HClO一样 令紫色石蕊试液先变红再褪色呢?
我的语文功底是在是差 这么多人没理解我的意思
照“传说ぜ永恒 ”来说 HClO的氧化性比酸性表现得要更快是么? 简单的日子1年前4
简单的日子1年前4 -
 郑州王老5 共回答了19个问题
郑州王老5 共回答了19个问题 |采纳率94.7%这个时间是很短暂的,氯气先和水反应生成HClO,HClO的氧化性使其褪色1年前查看全部
- 紫色石蕊试液中通入二氧化碳的化学方程式
 gritmei1年前2
gritmei1年前2 -
 我的天mygod 共回答了18个问题
我的天mygod 共回答了18个问题 |采纳率94.4%二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3
现象:石蕊试液由紫色变成红色.1年前查看全部
- 将紫色石蕊试液滴入装有滤液的试管,溶液呈红色;再用ph试纸在1至2之间.说明维生素C具有什么性
 眷林潴1年前1
眷林潴1年前1 -
 them 共回答了18个问题
them 共回答了18个问题 |采纳率88.9%将紫色石蕊试液滴入装有滤液的试管,溶液呈红色;再用ph试纸在1至2之间.说明维生素C具酸性1年前查看全部
- 一道计算题目.其他可以滴.(29分)在80克10%的氢氧化钠溶液里,如果分别加入下列溶液,再用紫色石蕊试液来检验,会有什
一道计算题目.其他可以滴.
(29分)在80克10%的氢氧化钠溶液里,如果分别加入下列溶液,再用紫色石蕊试液来检验,会有什么现象发生?(根据计算来回答)
① 100克9.8%的硫酸溶液.
② 67.5克10%的氯化铜溶液. lonkylan1年前1
lonkylan1年前1 -
 冬祎 共回答了14个问题
冬祎 共回答了14个问题 |采纳率92.9%1 紫色石蕊试液变红
2 产生蓝色沉淀 Cu(OH)21年前查看全部
- 现将100g10%盐酸跟100g10%的氢氧化钠溶液混合,再滴入紫色石蕊试液,溶液呈什么色
 100011101年前1
100011101年前1 -
 gaoyingyu 共回答了16个问题
gaoyingyu 共回答了16个问题 |采纳率93.8%溶液呈红色
解设100g10%的氢氧化钠溶液与10%盐酸发生中和反应时,需要盐酸的质量为X
HCl + NaOH = NaCl +H2O
36.5 40
X×10% 100g×10%
解得X=91.25g<100g 所以盐酸过量,酸使紫色石蕊试液变红1年前查看全部
- 下列物质能是紫色石蕊试液由紫色变为红色又退色
下列物质能是紫色石蕊试液由紫色变为红色又退色
①氯气②盐酸③氯水④盐酸酸化的漂白粉溶液⑤木炭
1.①②③2.①③④3.②③④4.①③④⑤ 枭啸1年前3
枭啸1年前3 -
 hmmliyh 共回答了11个问题
hmmliyh 共回答了11个问题 |采纳率100%41年前查看全部
- 13.如图l所示,在U形管中装入滴有紫色石蕊试液且混合均匀的某溶液,通直流电一段时间后,U形管内会形成一
13.如图l所示,在U形管中装入滴有紫色石蕊试液且混合均匀的某溶液,通直流电一段时间后,U形管内会形成一
13.如图l所示,在U形管中装入滴有紫色石蕊试液且混合均匀的某溶液,通直流电一段时间后,U形管内会形成一个倒立的“彩虹”,则U形管内的溶液可能为 ( )
A.NaC1溶液
B.NaOH溶液
C.CuSO4溶液
D.Na2SO4溶液 被dd发现了1年前3
被dd发现了1年前3 -
 百合花园 共回答了15个问题
百合花园 共回答了15个问题 |采纳率93.3%A,电解氯化钠水溶液生成氯气、氢气和氢氧化钠,氯气与水反应呈酸性,氢氧化钠呈碱性,分布在两个电极周围,随ph值变化形成彩虹样的颜色过渡1年前查看全部
- 在实验室制得1毫升乙酸乙酯后,沿器壁加入0.5毫升紫色石蕊试液,这时紫色石蕊溶液将存在于Na2CO3溶液层与乙酸乙酯之间
在实验室制得1毫升乙酸乙酯后,沿器壁加入0.5毫升紫色石蕊试液,这时紫色石蕊溶液将存在于Na2CO3溶液层与乙酸乙酯之间(整个过程不震荡试管),将会出现分层现象,分为几层?颜色如何?为什么?
 草民李四1年前1
草民李四1年前1 -
 万柃 共回答了22个问题
万柃 共回答了22个问题 |采纳率95.5%四层.最上层是乙酸乙酯,无色,因为它密度最小.
下层是紫色石蕊试液,紫色.
再下层是紫色石蕊试液与碳酸钠溶液交界,由于碳酸钠溶液显碱性,此层呈蓝色.
最下层是碳酸钠溶液,无色1年前查看全部
- 某无色透明溶液能使紫色石蕊试液变红,该溶液中能大量共存的离子组是( )
某无色透明溶液能使紫色石蕊试液变红,该溶液中能大量共存的离子组是( )
某无色透明溶液能使紫色石蕊试液变红,该溶液中能大量共存的离子组是( )
A.Na+、NH4+、Cl-、SO32-
B.K+ 、Cu2+、SO42-、NO3-
C.Na+、Ba2+、NO3-、Cl-
D.K+、MnO4-、Na+、NO3-
选什么?为什么? hlrzfp1年前3
hlrzfp1年前3 -
 zz咋了 共回答了12个问题
zz咋了 共回答了12个问题 |采纳率83.3%选C
根据颜色排除B(CuSO4)和D(高锰酸钾).
A的话(NH4)2SO3的水溶液为碱性,不能只考虑NH4+水解的情况,SO32-也会水解.而且在酸性条件下H+和SO32-不共存.
C的话4种离子在酸性条件下能共存.1年前查看全部
- SO2加入紫色石蕊试液中有什么变化会褪色吗
 劈刀浪人1年前5
劈刀浪人1年前5 -
 微酸的橘子 共回答了14个问题
微酸的橘子 共回答了14个问题 |采纳率78.6%只有品红才行.
石蕊会变红1年前查看全部
- (2013•北京模拟)老师用如图所示装置为同学们做了一个兴趣实验.已知装置B、C、D中依次盛有紫色石蕊试液、足量的澄清石
(2013•北京模拟)老师用如图所示装置为同学们做了一个兴趣实验.已知装置B、C、D中依次盛有紫色石蕊试液、足量的澄清石灰水和稀盐酸.小资料:HCl气体极易溶于水.
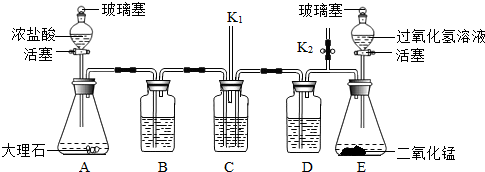
(1)打开A中的玻璃塞和活塞,C中反应的化学方程式为______.小聪认为通过B中的现象能说明二氧化碳与水反应生成了碳酸,你认为他的看法是否合理,并说明原因______.
(2)一段时间后,关闭A中的活塞和玻璃塞,打开弹簧夹K2及E中的玻璃塞和活塞,待足量的过氧化氢溶液流入锥形瓶后,立即关闭E中的活塞,并用弹簧夹K2夹紧橡皮管.E中反应的化学方程式为2H2O2
2H2O+O2↑MnO2 .2H2O2;C中可能出现的现象是______.
2H2O+O2↑MnO2 .
(3)上述实验过程中,C中玻璃管K1的作用是______. peic1年前1
peic1年前1 -
 蠢笨如牛 共回答了30个问题
蠢笨如牛 共回答了30个问题 |采纳率86.7%解题思路:(1)A中反应生成二氧化碳,与C中澄清石灰水反应,根据化学方程式书写的要求:写配注等,写出C中反应的化学方程式;根据浓盐酸挥具有挥发性,HCl气体极易溶于水,会使紫色石蕊变红;进行解答;
(2)根据化学方程式书写的要求:写配注等,写出E中反应的化学方程式;由于E中氧气放出,使D中压强增大,D中的稀盐酸流入C,则稀盐酸与沉淀反应,观察反应现象;
(3)因A,E中都产生气体,则C中玻璃管K1的作用是排出装置中气体,减小压强.(1)A中反应生成二氧化碳,与C中澄清石灰水反应,则C中反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
根据浓盐酸挥具有挥发性,HCl气体极易溶于水,会使紫色石蕊变红;所以说小聪认为通过B中的现象能说明二氧化碳与水反应生成了碳酸,不合理;
故答案为:CO2+Ca(OH)2=CaCO3↓+H2O;不合理,浓盐酸挥发出来的HCl气体溶解在水中形成的盐酸也可以使紫色石蕊变红;
(2)E中反应的化学方程式为:2H2O2
MnO2
.
2H2O+O2↑;
由于E中氧气放出,使D中压强增大,D中的稀盐酸流入C,则稀盐酸与C中沉淀反应,观察反应现象为:液面上升,白色固体逐渐溶解,有无色气泡产生;
故答案为:2H2O2
MnO2
.
2H2O+O2↑;液面上升,白色固体逐渐溶解,有无色气泡产生;
(3)因A,E中都产生气体,则C中玻璃管K1的作用是排出装置中气体,减小压强;
故答案为:排出A、B、C装置中气体,避免装置中压强过大.点评:
本题考点: 二氧化碳的实验室制法;空气对人类生活的重要作用;探究二氧化碳的性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 紫色石蕊试液加入二氧化碳之后加热颜色怎么变化
 阿盟可可1年前1
阿盟可可1年前1 -
 xujun6174 共回答了27个问题
xujun6174 共回答了27个问题 |采纳率85.2%先变红 后二氧化碳挥发,红色消失,变为紫色1年前查看全部
- 在实验室里,小刚想用紫色石蕊试液鉴别稀硫酸、氢氧化钠和碳酸钠三瓶无色溶液,请你帮助他完成实验.
在实验室里,小刚想用紫色石蕊试液鉴别稀硫酸、氢氧化钠和碳酸钠三瓶无色溶液,请你帮助他完成实验.
(1)首先被鉴别出的一种溶液是 ,依据的现象是 .
(2)利用现有条件将另外两种溶液鉴别出来,实验操作过程如下:
实验现象与结论
有关反应的化学方程式
原溶液是 ;
原溶液是 太阳191年前1
太阳191年前1 -
 lsf7p97 共回答了23个问题
lsf7p97 共回答了23个问题 |采纳率95.7%(1)首先被鉴别出来的一种溶液是稀硫酸,依据的现象是:紫色石蕊试液变红色.
(2)利用现有条件将另外两种溶液鉴别出来,实验操作过程如下:
实验步骤
分别另取两种溶液各少许于试管中,再分别向两支试管中滴加稀硫酸.
实验现象及结论
有气体生成的原溶液是碳酸钠溶液;没有明显现象的原溶液是氢氧化钠溶液 .
Na2CO3 + H2SO4= Na2SO4+ CO2(气体)+H2O
注意:此方程式的气体溢出和那些小2、3的下标没有标注.这些符号不太容易打出来.1年前查看全部
- 紫色石蕊试液遇到酸性物质变红,遇到碱性物质变蓝,它们是怎么反应的?
紫色石蕊试液遇到酸性物质变红,遇到碱性物质变蓝,它们是怎么反应的?
化学方程式加文字说明! banyingchun1年前4
banyingchun1年前4 -
 johnson108 共回答了14个问题
johnson108 共回答了14个问题 |采纳率78.6%分子式(C7H7O4N)n
性状为蓝紫色粉末,是从植物中提取得到的蓝色色素,能部分地溶于水而显蓝色.
石蕊是一种常用的酸碱指示剂,变色范围是pH=5.0-8.0之间.
石蕊(Litmus)是一种弱的有机酸,相对分子质量为3300,在酸碱溶液的不同作用下,发生共轭结构的改变而变色.
也就是说,在溶液中,随着溶液酸碱性的变化,其分子结构发生改变而呈现出不同的颜色变化:
在酸性溶液里,分子是其存在的主要形式,使溶液呈红色;(由于[H+]增大,平衡向左移)
在碱性溶液里,石蕊水解发生的电离平衡向右移动,电离产生的酸根离子是其存在的主要形式,故使溶液呈蓝色;(由于[OH-]增大,平衡右移)
在中性溶液里,分子和酸根离子共存,因而溶液呈紫色.([HZ]=[Z-])
总结:变色原因是形成了不同的共轭体系,也就是共轭集团发生改变1年前查看全部
- 为什么FeCL3 溶液与 紫色石蕊试液发生反应其中与Fe3+水解有关 .
 睛和夺取1年前1
睛和夺取1年前1 -
 wuhy050 共回答了10个问题
wuhy050 共回答了10个问题 |采纳率90%是的,FeCL3 溶液水解呈酸性,所以使石蕊变红.
Fe3++3H2OFe(OH)3+3H+1年前查看全部
- 盐使紫色石蕊试液变色吗?紫色石蕊试液遇酸变红遇碱变蓝那遇盐呢?
 yunfeishow111年前1
yunfeishow111年前1 -
 helengfeng 共回答了20个问题
helengfeng 共回答了20个问题 |采纳率85%盐是酸碱中和反应的产物.盐在水中可以发生水解反应,是可逆反应,可以生成少量的酸和碱.
遇中式盐不变色;遇碱式盐变蓝色;遇酸式盐变红色.
碱式盐:水解后显碱性即碱性>酸性(强碱弱酸盐Na2CO3);
酸式盐:水解后显酸性即酸性>碱性(强酸弱碱盐MgSO4);
中式盐:水解后显中性(强酸强碱盐『不水解』NaCl、弱酸弱碱盐-水解反应剧烈,较为彻底,所以,弱酸、弱碱离子在水中不能共存).1年前查看全部
- 红色石蕊试纸和紫色石蕊试液和酚酞试液三者有那样区别
 财务ee1年前1
财务ee1年前1 -
 为梦而活 共回答了7个问题
为梦而活 共回答了7个问题 |采纳率100%石蕊试纸有红色石蕊试纸和蓝色石蕊试纸两种.红色用来检验碱性物质,蓝色用来检验酸性物质.碱性溶液使红色试纸变蓝,酸性溶液使蓝色试纸变红.石蕊试纸可以检验气体的酸碱性.
紫色石蕊试液用于帮助判断液体的酸碱性.滴入紫色石蕊试液,如果试液显红色,则说明液体显酸性;如果试液显蓝色,则说明液体显碱性.
酚酞遇酸溶液不变色,遇中性溶液也不变色,遇碱溶液变红色.用来检验碱性物质.1年前查看全部
- 二氧化碳酸碱性是什么?将二氧化碳气体通入紫色石蕊试液中,会有什么变化?我指的是单纯的二氧化碳啊,没水的!有没有没水的石蕊
二氧化碳酸碱性是什么?
将二氧化碳气体通入紫色石蕊试液中,会有什么变化?
我指的是单纯的二氧化碳啊,没水的!
有没有没水的石蕊试液? 银魔像1年前3
银魔像1年前3 -
 诺亚与方舟 共回答了17个问题
诺亚与方舟 共回答了17个问题 |采纳率94.1%但是 紫色石蕊试液中有水啊
二氧化碳溶于溶液中产生碳酸
变红了就
那就不是试液啦
倒是有石蕊试纸 可是干燥的石蕊试纸放在二氧化碳中没有变化 只有湿润后才能看出来 说明二氧化碳其实算酸性氧化物1年前查看全部
- 稀氯化钠溶液中加入紫色石蕊试液变什么色
 AODEHUAGS1年前1
AODEHUAGS1年前1 -
 Rain_y 共回答了15个问题
Rain_y 共回答了15个问题 |采纳率93.3%因为氯化钠溶液中 是中性的
所以紫色石蕊试液不变色,还是紫色的.1年前查看全部
- 能使紫色石蕊试液变为红色的溶液是酸性溶液?
 fish69691年前2
fish69691年前2 -
 退潮之海 共回答了10个问题
退潮之海 共回答了10个问题 |采纳率100%是的
酸性溶液有多种,包括酸的溶液如:食醋、盐酸、硫酸、碳酸、酸的果汁等
某些盐的水溶液也呈酸性,如硫酸铜溶液、硫酸氢钠溶液等1年前查看全部
- 初三化学用试管收集满二氧化碳,倒扣于盛有水的水槽中,将观察到试管液面会上升还是不变,向溶液中滴加紫色石蕊试液,溶液显示什
初三化学
用试管收集满二氧化碳,倒扣于盛有水的水槽中,将观察到试管液面会上升还是不变,向溶液中滴加紫色石蕊试液,溶液显示什么颜色,为什么?
液面为什么会上升? gxiao6225111年前1
gxiao6225111年前1 -
 163888net 共回答了22个问题
163888net 共回答了22个问题 |采纳率86.4%液面会上升,紫色石蕊试液会变红.
原因:二氧化碳与水反应生成碳酸,试管中二氧化碳减少,导致试管内的气压变低,于是试管内液面上升.生成物碳酸显酸性,故作为酸碱指示剂的紫色石蕊试液变红.1年前查看全部
- 下列溶液的PH值最大A.滴入紫色石蕊试液呈红色的溶液 B.滴入紫色石蕊试液呈紫色的溶液C.滴入无色酚酞试液呈红色的溶液
下列溶液的PH值最大
A.滴入紫色石蕊试液呈红色的溶液 B.滴入紫色石蕊试液呈紫色的溶液
C.滴入无色酚酞试液呈红色的溶液 D.滴入无色酚酞试液呈无色的溶液
为什么? emma_1211年前4
emma_1211年前4 -
 zjw327 共回答了14个问题
zjw327 共回答了14个问题 |采纳率71.4%石蕊试液
pH ------------5-----------8-----------------------
红 紫 蓝
pH ----------------------------8------------10---------
无色 浅红 红色
A.滴入紫色石蕊试液呈红色的溶液 pH1年前查看全部
- 能使紫色石蕊试液变红的一定是酸性溶液吗?
能使紫色石蕊试液变红的一定是酸性溶液吗?
那位老师能举一个反例,说明能使石蕊试液变红的不一定是酸溶液? 萨林1年前5
萨林1年前5 -
 fuyinan 共回答了20个问题
fuyinan 共回答了20个问题 |采纳率85%不一定.
显酸性的溶液能够使紫色石蕊溶液变红.但显酸性的溶液不一定是酸,有可能是盐,比如硫酸铝、硝酸铵等.1年前查看全部
- 100克8%的氢氧化钠溶液和等质量等浓度的盐酸充分混合,所得溶液能使紫色石蕊试液变什么颜色?
 wenai8181年前3
wenai8181年前3 -
 木子12520 共回答了20个问题
木子12520 共回答了20个问题 |采纳率85%NaOH溶质的质量是100*8%=8g
设8g NaOH能消耗HCl的质量是x.
NaOH+HCl=NaCl+H2O
40 36.5
8g x
40/8=36.5/x
x=7.3g
所以如果是8g的HCl,还会有8-7.3=0.7g的HCl未反应,所以HCl剩余,溶液是酸性的,所得溶液能使紫色石蕊试液变红色.1年前查看全部
- NaOH与CO2反应,检验NaOH是否剩余,先加BaCl2再加紫色石蕊试液或无色酚酞溶液
NaOH与CO2反应,检验NaOH是否剩余,先加BaCl2再加紫色石蕊试液或无色酚酞溶液
怎么回事 聪哥哥仔1年前1
聪哥哥仔1年前1 -
 lhksupeng 共回答了13个问题
lhksupeng 共回答了13个问题 |采纳率84.6%由于是验证NaOH是否过量,则应是生成了Na2CO3,那么加BaCl2与Na2CO3反应生成沉淀和NaCl(PH=7),则有NaoH时溶液碱性,用紫色石蕊试液(变蓝)或无色酚酞溶液(变红)的变色来说明是否剩余1年前查看全部
- 为什么可以用溴水和紫色石蕊试液鉴别乙醇、己烯、己烷、乙酸、乙醛溶液、苯酚溶液
 dearmaomao1年前2
dearmaomao1年前2 -
 我是地皮 共回答了21个问题
我是地皮 共回答了21个问题 |采纳率81%溴水可以与苯酚生成白色沉淀,三溴苯酚,其实便是TNT炸药的原料,溴水可以使己烯褪色,紫色石蕊可以使乙酸变红,溴水中有Br2,HBr还有HBrO,HBrO的强氧化性有可能氧化乙醇上的羟基,而使Br2+H2OHBr+HBrO的平衡向右移动而褪色,乙醛可与溴水发生氧化反应.
溴水是一种强氧化剂,能把乙醛氧化成乙酸
具体反应式为:
Br2+H2O=HBr+HBrO
CH3CHO+HBrO=CH3COOH+HBr
注意:很多人都会以为乙醛之所以会让溴水褪色是因为发生加成反应,这是错误的.C=C能与Br2加成,而C=O不能与Br2加成!剩下的是己烷
希望有用1年前查看全部
- 二氧化碳通入紫色石蕊试液为什么能生成酸(又没有遇水)紫色石蕊试液只是一种物质啊
 familyradio1年前10
familyradio1年前10 -
 monster翊 共回答了20个问题
monster翊 共回答了20个问题 |采纳率80%石蕊是一种物质不错,可现在是石蕊试液,那是溶液当然有水了.1年前查看全部
- ph8.5的水遇紫色石蕊试液显什么色
 hasi02091年前1
hasi02091年前1 -
 冤冤冤冤冤 共回答了20个问题
冤冤冤冤冤 共回答了20个问题 |采纳率95%石蕊是一种常用的酸碱指示剂,变色范围是pH=5.0-8.0之间;
是一种弱的有机酸,相对分子质量为3300,在酸碱溶液的不同作用下,发生共轭结构的改变而变色.
也就是说,在溶液中,随着溶液酸碱性的变化,其分子结构发生改变而呈现出不同的颜色变化:
在酸性溶液里,分子是其存在的主要形式,使溶液呈红色;(由于[H+]增大,平衡向左移)
在碱性溶液里,石蕊水解发生的电离平衡向右移动,电离产生的酸根离子是其存在的主要形式,故使溶液呈蓝色;(由于[OH-]增大,平衡右移)
在中性溶液里,分子和酸根离子共存,因而溶液呈紫色. [1]1年前查看全部
- 10g10%的KOH和10g10%的稀硫酸混合,充分反应后,滴入紫色石蕊试液,溶液呈什么颜色?
 2004060321631年前3
2004060321631年前3 -
 这个号是假的 共回答了19个问题
这个号是假的 共回答了19个问题 |采纳率68.4%解法一:
2KOH+H2SO4=K2SO4+2H2O
112 98
1g X1年前查看全部
- 紫色石蕊试液遇碱的颜色,酚酞试液遇碱的颜色?
 有生之年相逢1年前1
有生之年相逢1年前1 -
 zhsqce 共回答了22个问题
zhsqce 共回答了22个问题 |采纳率81.8%紫色石蕊试液遇碱变蓝,酚酞遇碱变红1年前查看全部
- 简答题,(1)实验室为什么不能用稀硫酸跟碳酸钙反应制取二氧化碳?______(2)把二氧化碳通入紫色石蕊试液,会产生什么
简答题,
(1)实验室为什么不能用稀硫酸跟碳酸钙反应制取二氧化碳?______
(2)把二氧化碳通入紫色石蕊试液,会产生什么现象?此试液加热煮沸后,会发生什么变化?冷却后向上述试液投入活性炭并振荡,又发生什么变化?______
(3)为什么干冰可作制冷剂和人工降雨?______
(4)为什么用石灰浆粉刷的墙壁几天后就变硬了?______
(5)为什么有时人走进菜窖会突然晕倒?进入菜窖前应怎样检验并避免发生这种事故?______. morlen1年前1
morlen1年前1 -
 小刀的小刀 共回答了13个问题
小刀的小刀 共回答了13个问题 |采纳率100%解题思路:(1)大理石与稀硫酸反应,生成阻碍反应进行的硫酸钙;
(2)根据石蕊试液遇酸变红和二氧化碳溶于水生成碳酸,以及碳酸易分解、活性炭具有吸附性考虑;
(3)根据干冰升华可吸收周围的热量考虑;
(4)根据石灰浆的成分氢氧化钙与空气中的二氧化碳反应能生成碳酸钙考虑;
(5)从二氧化碳的密度大于空气的密度,并不支持人的呼吸作用和不支持燃烧考虑.(1)实验室制备二氧化碳气体应用大理石和盐酸反应,不宜用硫酸,因为硫酸与碳酸钙反应生成的硫酸钙是微溶于水的物质,当反应进行到一定程度时,硫酸钙会包住碳酸钙表面,使碳酸钙与硫酸不再接触而反应停止,所以实验室一般用盐酸而不用硫酸与大理石反应制取二氧化碳.
(2)将二氧化碳通入紫色石蕊试液,石蕊试液由紫变红,因为二氧化碳与水反应,生成碳酸(H2CO3),碳酸能使紫色石蕊试液变红.CO2+H2O═H2CO3,当加热煮沸后,石蕊试液由红变紫,因为碳酸不稳定,加热后,又分解成水和二氧化碳.H2CO3
△
.
.H2O+CO2↑.当加入活性炭后,石蕊试液的紫色褪去,这是因为活性炭具有吸附性,可以吸附色素.
(3)干冰可以做制冷剂,用来保存容易腐败的食品.因为干冰蒸发后,没有液体留下,不会使食品潮湿.用飞机从高空撒布干冰,能够使空气里的水蒸气凝结,变成水滴下降.这是人工降雨的一种措施.
(4)石灰浆的成分是氢氧化钙,抹到墙壁上后,接触到空气中的二氧化碳生成难溶的碳酸钙,从而使石灰墙壁硬化.
CO2+Ca(OH)2=CaCO3↓+H2O
(5)菜窖的底部二氧化碳的浓度较大,由于二氧化碳不能供给呼吸,所以有时人走进菜窖会突然晕倒.因此,在进去之前,须先用烛火试验,如烛火熄灭或燃烧不旺就不要入内.点评:
本题考点: 二氧化碳的实验室制法;二氧化碳的物理性质;二氧化碳的化学性质;二氧化碳的用途.
考点点评: 化学来源于生产、生活,又服务于生产、生活,体现化学与生活的联系,此类考题经常出现.1年前查看全部
- so2和cl2的漂白原理相同吗?它能使紫色石蕊试液变色吗?为什么?
 mixxion1年前1
mixxion1年前1 -
 秋木哈骨 共回答了23个问题
秋木哈骨 共回答了23个问题 |采纳率100%SO2与Cl2的漂泊原理不同.SO2是与有色物质结合生成不稳定的无色物质;Cl2是将色素氧化成无色物质.
SO2和Cl2都能使紫色石蕊试剂变色.原理是:SO2与水反应生成的亚硫酸使石蕊变红;Cl2与水反应生成HCl和HClO,石蕊先变红(酸使之变红),然后变成白色(HClO将石蕊氧化成白色).1年前查看全部
- 下列说法正确的是( )A. 能使紫色石蕊试液变蓝的物质一定是碱B. 与酸反应生成气体的物质一定是碳酸盐C. 与熟石灰共
下列说法正确的是( )
A. 能使紫色石蕊试液变蓝的物质一定是碱
B. 与酸反应生成气体的物质一定是碳酸盐
C. 与熟石灰共热产生有刺激性气味气体的化肥一定是铵态氮肥
D. 与氯化钡溶液反应生成白色沉淀的物质一定是硫酸钠 娄邵之邦1年前1
娄邵之邦1年前1 -
 阿里夫 共回答了20个问题
阿里夫 共回答了20个问题 |采纳率85%解题思路:A、根据碱与碱性的不同点进行分析;
B、根据酸的化学性质解答;
C、根据铵根离子的鉴别方法解答;
D、根据硫酸根离子与氯离子的检验方法解答.A、碱性溶液都能使紫色石蕊试液变蓝,碱性溶液不一定是碱溶液,如碳酸钠溶液呈碱性,而是盐,故A错误;B、活泼金属与酸反应生成氢气,碳酸盐与酸反应生成二氧化碳,故B错误;C、铵态氮肥与熟石灰共热产生氨气,这是...
点评:
本题考点: 酸碱指示剂及其性质;证明硫酸和可溶性硫酸盐;酸的化学性质;铵态氮肥的检验.
考点点评: 碱溶液一定显碱性而碱性溶液不一定是碱溶液;与酸反应产生气体的物质有活泼金属和碳酸盐;熟练记住硫酸根离子、氯离子、铵根离子的检验方法.1年前查看全部
- 下列有关新制氯水的叙述,正确的是( ) A.氯水放置数天后,其酸性逐渐增强 B.新制氯水可使紫色石蕊试液先变红后褪色,
下列有关新制氯水的叙述,正确的是( ) A.氯水放置数天后,其酸性逐渐增强 B.新制氯水可使紫色石蕊试液先变红后褪色,说明Cl 2 具有漂白性 C.氯水光照时有气泡逸出,该气体的主要成分是氯气 D.加入一定量CaCO 3 ,盐酸、次氯酸的浓度都将减小  娃哈哈cc21年前1
娃哈哈cc21年前1 -
 非著名影评人 共回答了15个问题
非著名影评人 共回答了15个问题 |采纳率86.7%A、氯气和水反应生成盐酸和次氯酸,次氯酸是弱酸,酸性比碳酸还弱,但次氯酸不稳定见光易分解,次氯酸分解生成盐酸和氧气,导致溶液中盐酸浓度增大,酸性增强,故A正确.
B、氯气和水反应生成盐酸和次氯酸,溶液呈酸性,向新制氯水中加紫色石蕊试液,溶液呈红色;但次氯酸有漂白性,能使有色物质褪色,所以红色逐渐褪去,起漂白性的物质是次氯酸不是氯气,故B错误.
C、次氯酸不稳定,见光易分解生成盐酸和氧气,所以氯水光照时有气泡逸出,该气体的主要成分是氧气,故C错误.
D、氯气和水的反应方程式为:Cl 2 +H 2 O?HCl+HClO,该反应是可逆反应,盐酸和碳酸钙反应导致盐酸浓度变小,平衡向正反应方向移动,次氯酸和碳酸钙不反应,所以导致次氯酸浓度增大,故D错误.
故选A.1年前查看全部
- 氢氧化钙在工农业生产上应用很广,下列关于氢氧化钙的描述错误的是( ) A.其水溶液能使紫色石蕊试液变红 B.俗称熟石灰
氢氧化钙在工农业生产上应用很广,下列关于氢氧化钙的描述错误的是( ) A.其水溶液能使紫色石蕊试液变红 B.俗称熟石灰或消石灰 C.可用于改良酸性土壤 D.对皮肤、衣服等有腐蚀作用  benmaogao1年前1
benmaogao1年前1 -
 xq279 共回答了18个问题
xq279 共回答了18个问题 |采纳率83.3%A、氢氧化钙为碱,其水溶液可以使紫色石蕊变蓝,故A描述错误;
B、氢氧化钙俗称熟石灰或消石灰,故B描述正确;
C、氢氧化钙为碱性物质,常用来改良酸性土壤,故C描述正确;
D、氢氧化钙为碱性物质,对皮肤或衣服有一定的腐蚀能力,故D描述正确.
故选A.1年前查看全部
- 浓盐酸和石灰石反应用浓盐酸与石灰石反应制取的二氧化碳,通入紫色石蕊试液变红的原因是什么?加热红色不褪色的原因是什么?
 7612111年前1
7612111年前1 -
 linlin_138 共回答了20个问题
linlin_138 共回答了20个问题 |采纳率80%关键词,浓盐酸,这个是放热反应,会生成碳酸,同时挥发出氯化氢气体,通入石蕊试液变红是因为碳酸和盐酸显酸性,加热不褪色是因为氯化氢气体溶于水,盐酸加热不分解.1年前查看全部
- 鉴别稀盐酸和稀硫酸最好选用 A紫色石蕊试液B无色酚酞试液C硝酸银溶液C氯化钡溶液
 老庄v1年前4
老庄v1年前4 -
 哎呀疯了25 共回答了26个问题
哎呀疯了25 共回答了26个问题 |采纳率96.2%选最后一个,氯化钡溶液,稀盐酸和稀硫酸遇到紫色石蕊试液,和无色酚酞现象都一样,因为他们都是酸性溶液,和硝酸银反应都有白色沉淀,只有稀盐酸和氯化钡没有反应,但稀硫酸和氯化钡会有沉淀,就是硫酸钡了.1年前查看全部
- 下列变化中属于物理变化的是 A co2使紫色石蕊试液变红色 b co2变成干冰 C co2使澄清石灰水变浑浊 d co2
下列变化中属于物理变化的是 A co2使紫色石蕊试液变红色 b co2变成干冰 C co2使澄清石灰水变浑浊 d co2溶
下列变化中属于物理变化的是
A co2使紫色石蕊试液变红色 b co2变成干冰
C co2使澄清石灰水变浑浊 d co2溶于水且与水发生反应
No2 So2 03 Co 总颗粒物 可吸入颗粒物
浓度以【mg.m3】计算
某市 一年平均 80 80 5 12 80 55
某小区 40 132 2 13 150 80
下列有关说法正确的是
A该小区汽车的人均拥有量比该市其他小区多
B该小区可能使用煤作为主要燃料
C 该小区可能天然气作为主要燃料
D 该小区使用煤气作为主要燃料 zkydown1年前1
zkydown1年前1 -
 id4peaceb 共回答了22个问题
id4peaceb 共回答了22个问题 |采纳率86.4%干冰是固态的二氧化碳,在常温和压强为6079.8千帕压力下,把二氧化碳冷凝成无色的液体,再在低压下迅速蒸发,便凝结成一块块压紧的冰雪状固体物质,其温度是零下78.5℃,这便是干冰.于是选b
第二个选B SO2多1年前查看全部
- 鉴别氯化钾 氢氧化钙 稀硫酸方法(除了碳酸钠 紫色石蕊试液)
 tggk1年前1
tggk1年前1 -
 fhashw 共回答了19个问题
fhashw 共回答了19个问题 |采纳率84.2%碳酸钾,原理和碳酸钠一样.
碳酸氢钠也可以,现象和碳酸钠一样.1年前查看全部
- 一个集气瓶里放过量红磷燃烧,通入紫色石蕊试液的实验是什么?
 xb4og1年前1
xb4og1年前1 -
 应山正红 共回答了14个问题
应山正红 共回答了14个问题 |采纳率85.7%磷在少量氧气条件下的燃烧产物1年前查看全部
- 实验室均可选择①带火星的木条、②燃着的木条、③澄清石灰水、④紫色石蕊试液四种实验用品中的任意一种来鉴别的两种常见气体是(
实验室均可选择①带火星的木条、②燃着的木条、③澄清石灰水、④紫色石蕊试液四种实验用品中的任意一种来鉴别的两种常见气体是(写物质名称)______.
(1)在实验室都可以利用如图中的A装置制取上述两种气体(图中的分液漏斗可以通过调节活塞控制液体的滴加速度).如图所示,回答问题:
①分别写出实验室利用A装置制取上述两种气体的化学方程式:2H2O2
2H2O+O2↑、CaCO3+2HCl=CaCl2+H2O+CO2↑MnO2 .2H2O2.
2H2O+O2↑、CaCO3+2HCl=CaCl2+H2O+CO2↑MnO2 .
②制取这两种气体,只能用B装置收集的是(写化学式)______;既能用B装置又能用D装置收集的是(写化学式)______,其中用______(填字母)装置收集的气体更纯净;这两种气体都不能用C装置收集的原因是______.
③前文提到,用澄清石灰水可以鉴别这两种气体,写出其中一种气体跟澄清石灰水反应的化学方程式______
④在催化剂作用下制取上述的某种气体时,装置A中反应很剧烈,据此提出实验安全的注意事项是______(填序号).
A.控制液体的滴加速度B.用体积较小的锥形瓶C.加热反应物
(2)实验室还可以利用下图装置制取其中的某一种气体.
①任意写出一个可利用此装置制取这种气体的化学方程式2KMnO4
K2MnO4+MnO2+O2↑△ .2KMnO4.
K2MnO4+MnO2+O2↑△ .
②实验室制取这种气体的步骤主要分以下七步,请按正确操作顺序,把序号填在横线上.______.
A.将药品装入试管,并塞上塞子.
B.移开并熄灭酒精灯.
C.点燃酒精灯,先给试管预热,再集中给药品加热.
D.用铁架台和铁夹把盛有药品的试管固定起来.
E.检查装置的气密性.
F.气泡连续且均匀放出来时,收集一瓶气体.
G.将导气管从水槽内取出来. 丢泥巴1年前1
丢泥巴1年前1 -
 扑一刀 共回答了14个问题
扑一刀 共回答了14个问题 |采纳率85.7%解题思路:做好此题要了解氧气和二氧化碳的化学性质、物理性质,以及实验室制法,实验步骤以及注意事项.氧气助燃,二氧化碳灭火,二氧化碳使石灰水变浑浊,二氧化碳溶于水后使紫色石蕊试液变红.而氧气不能使石灰水和石蕊试液发生变化.故两种常见气体是:氧气、二氧化碳
(1)①实验室制取氧气常用二氧化锰作催化剂来使双氧水分解制得氧气.二氧化碳则用大理石和盐酸反应得到.反应方程式分别为:2H2O2
MnO2
.
2H2O+O2↑、CaCO3+2HCl=CaCl2+H2O+CO2↑
②二氧化碳和氧气的密度都大于空气,都可用向上排气法收集.但二氧化碳易溶于水,不可用排水法收集.氧气不易溶于水,也可用排水法收集,收集的气体更纯净.
故答案分别为:CO2O2D 它们的密度都比空气的密度大
③二氧化碳与澄清石灰水反应生成沉淀,反应式为:Ca(OH)2+CO2═CaCO3↓+H2O
④为防止反应过于激烈损伤锥形瓶,应控制液体的滴加速度.故选A
(2)①实验室中可用加热高锰酸钾来制取氧气.反应式为:2KMnO4
△
.
K2MnO4+MnO2+O2↑②试验过程中一定要先检查装置的气密性,加入药品后再固定试管,为防止试管炸裂一定要先均匀加热试管,再加热药品.带气泡均匀冒出再收集气体.为防止水倒流入试管,一定要先移出导管再熄灭酒精灯.故试验步骤为:EADCFGB点评:
本题考点: 实验室制取气体的思路;制取气体的反应原理的探究;实验操作注意事项的探究;常用气体的发生装置和收集装置与选取方法;常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题以实验探究的形式考查了氧气和二氧化碳的实验室制法,气体的收集和反应方程式以及实验步骤.培养了学生的动手动脑的能力.1年前查看全部
- 一只软塑料中充满二氧化碳,向瓶中倒入少量水后迅速拧紧瓶盖,振荡,观察到瓶子瘪了,再倒入紫色石蕊试液,观察到溶液变为红色.
一只软塑料中充满二氧化碳,向瓶中倒入少量水后迅速拧紧瓶盖,振荡,观察到瓶子瘪了,再倒入紫色石蕊试液,观察到溶液变为红色.如果倒入相同体积的澄清石灰水,发现瓶子更瘪,为什么?
 兰心雅韵1年前5
兰心雅韵1年前5 -
 淡蓝色爱恋 共回答了21个问题
淡蓝色爱恋 共回答了21个问题 |采纳率90.5%一只软塑料中充满二氧化碳,向瓶中倒入少量水后迅速拧紧瓶盖,振荡,观察到瓶子瘪了,
是由于CO2溶于水,造成瓶内压强变小,瓶子瘪了.
再倒入紫色石蕊试液,观察到溶液变为红色.
CO2与水反应,生成碳酸,紫色石蕊试液变成红色.
如果倒入相同体积的澄清石灰水,发现瓶子更瘪,为什么?
CO2和澄清的石灰水反应,使瓶子内的压强变得更小,所以瓶子更瘪了.1年前查看全部
- 无色酚酞与紫色石蕊试液反应吗
 jeson5181年前6
jeson5181年前6 -
 huangsdy 共回答了16个问题
huangsdy 共回答了16个问题 |采纳率100%不能,石蕊和酚酞都是酸碱指示剂,它们都是一种弱的有机酸.在溶液里,随着溶液酸碱性的变化,指示剂的分子结构发生变化而显示出不同的颜色.1年前查看全部
- CsH + H2O = CsOH + H2↑同时滴入紫色石蕊试液的离子方程式是
 龙行剑客1年前1
龙行剑客1年前1 -
 云清淡 共回答了20个问题
云清淡 共回答了20个问题 |采纳率95%化合反应
1、镁在空气中燃烧:2Mg + O2 点燃 2MgO
2、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3、铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
4、氢气在空气中燃烧:2H2 + O2 点燃 2H2O
5、红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
6、硫粉在空气中燃烧: S + O2 点燃 SO2
7、碳在氧气中充分燃烧:C + O2 点燃 CO2
8、碳在氧气中不充分燃烧:2C + O2 点燃 2CO
9、二氧化碳通过灼热碳层: C + CO2 高温 2CO
10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3
12、生石灰溶于水:CaO + H2O === Ca(OH)2
13、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O
14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl
分解反应
15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑
16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
17、水在直流电的作用下分2H2O 通电 2H2↑+ O2 ↑
18、碳酸不稳定而分H2CO3 === H2O + CO2↑
19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温 CaO + CO2↑
置换反应
20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑
22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑
23、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
24、木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
25、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
26、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO
27、焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
其他
28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4
29、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
30、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
31、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
32、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
33、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O
35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
一. 物质与氧气的反应:
(1)单质与氧气的反应:
1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2 加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2 点燃 SO2
8. 碳在氧气中充分燃烧:C + O2 点燃 CO2
9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
二.几个分解反应:
13. 水在直流电的作用下分2H2O 通电 2H2↑+ O2 ↑
14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热 2CuO + H2O + CO2↑
15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑
16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
17. 碳酸不稳定而分H2CO3 === H2O + CO2↑
18. 高温煅烧石灰石:CaCO3 高温 CaO + CO2↑
三.几个氧化还原反应:
19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑
23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
24. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
25. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2
四.单质、氧化物、酸、碱、盐的相互关系
(1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑
30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑
31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑
32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑
33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑
(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐
34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu
36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg
(3)碱性氧化物 +酸 -------- 盐 + 水
37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O
38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O
39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O
40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O
41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O
42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O
(4)酸性氧化物 +碱 -------- 盐 + 水
43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O
44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O
45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O
46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O
(5)酸 + 碱 -------- 盐 + 水
48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O
49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O
50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O
51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O
53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O
54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O
55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O
56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O
57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O
58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O
(6)酸 + 盐 -------- 另一种酸 + 另一种盐
59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑
62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO3
63.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑
64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl
(7)碱 + 盐 -------- 另一种碱 + 另一种盐
65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4
66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl
67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl
68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ====1年前查看全部
- 1.某盐酸与氢氧化钠溶液混合后,向其中滴加紫色石蕊试液,溶液变红为什么混合溶液的质量是混合前两种溶液的质量之和?为什么混
1.某盐酸与氢氧化钠溶液混合后,向其中滴加紫色石蕊试液,溶液变红为什么混合溶液的质量是混合前两种溶液的质量之和?为什么混合后溶液中水的质量大于混合前两种溶液中水的质量之和?
2.如图,有HCl,Cacl2的混合溶液,想起逐滴加入过量某物质X的量得变化关系为什么只有纯碱溶液?不能澄清石灰水?

 shiyanhaoma1年前3
shiyanhaoma1年前3 -
 65552392j 共回答了26个问题
65552392j 共回答了26个问题 |采纳率88.5%我先回答你的第一个问题:盐酸和氢氧化钠溶液混合后发生中和反应生成水和氯化钠,相信这个知识点你是懂的.根据质量守恒定律,化学反应前后质量不变.由于发生反应后有水产生,所以混合后溶液中的水质量就增加了.
第二个问题:因为在加入X物质的过程中,溶液的PH有一段是呈中性的,这是因为纯喊溶液和Cacl2反应生成碳酸钙的过程.如果是石灰水的话,不会有一段呈中性的过程,而是直接变碱性了.
能明白吗?不明白的话我再详细解释.1年前查看全部
- 33.如图是一个用来测定液密度的装置,A管插人的甲烧杯中,B管插人盛放加有紫色石蕊试液的稀硫酸的乙烧杯中
 nnlx1年前1
nnlx1年前1 -
 然犯 共回答了24个问题
然犯 共回答了24个问题 |采纳率91.7%A为两端开口的试管,B为一轻塑料片,烧杯中装有盐水,B在盐水中的深度是你的问题说清楚了吗?如果开始时将B堵在试管的一段,放在盐水中,由于盐水1年前查看全部
- 某无色溶液用酚酞试液检测,发现无色酚酞未变红,用紫色石蕊试液检验,未变色.说明该溶液的PH值不可能为()
某无色溶液用酚酞试液检测,发现无色酚酞未变红,用紫色石蕊试液检验,未变色.说明该溶液的PH值不可能为()
A.>7 B.=7 C.<7 D.=3
理由! 3L公主1年前2
3L公主1年前2 -
 gs841219 共回答了19个问题
gs841219 共回答了19个问题 |采纳率94.7%酚酞变色范围为8-10,石蕊变色范围5-8,说明小于5,只能选D1年前查看全部
大家在问
- 1得与失 作文
- 2适当形式填空 The sharks ______ on fish or other sea animals.(feed)
- 3【1】已知抛物线y=-x^2+(m-4)x+2m+4与x轴交于点A(x1,0),B(x2,0)两点,与y轴交于点C,且x
- 4the only ,the very,the last是什么意思?
- 5小明期末考试时语文和数学的平均分是94分,,数学比语文多8分,问语文和数学各得几分?
- 6例:问How ofen do you watch television?答I watch television ever
- 74比0.44的最简整数比是多少
- 8巧填国名蒙 () ()()西 () ()()()加 () ()要求横竖都是国名
- 9如图是米勒关于原始地球的模拟实验装置,请尝试对他的实验过程进行总结.
- 101、甲乙两车站相距190千米,一辆摩托车以30千米每小时的速度从甲地开往乙地,出发2小时后,一辆汽车以50千米每小时的速
- 11生活中常碰到某些问题,常涉及到化学知识,下列分析正确的是……( ) A.加酶洗衣粉是在洗衣粉中加入能使蛋白质水解的碱性蛋
- 12自行车用到了哪些物理知识,举三个例子并说明用了什么原理
- 13所有n阶非可逆矩阵的集合为全矩阵空间Mn(R)的子空间.(×)请问老师这道题为何错误!
- 14线性代数 矩阵,答案到底是-1/√2还是1/√2?
- 15甲、乙、丙三辆汽车以相同的速度同时经过某一路标,从此时开始,甲一直做匀速直线运动,乙先加速后减速,丙先减速后加速,它们经
