0.1000mol/L的硝酸银是否等于1mg/mL
 紫陌冰蓝2022-10-04 11:39:543条回答
紫陌冰蓝2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 海纳99 共回答了14个问题
海纳99 共回答了14个问题 |采纳率85.7%- 1mg/m=l1g/l,0.1mol*169.87g/l=16.987mg/ml
所以不等. - 1年前
 杨臣刚大哥哥 共回答了2个问题
杨臣刚大哥哥 共回答了2个问题 |采纳率- 不等于,没有这种直接对应的关系,需要由定义去计算
- 1年前
 yutungtung 共回答了1个问题
yutungtung 共回答了1个问题 |采纳率- ;
- 1年前
相关推荐
- 0.1000MOL.L-1氢氧化钠溶液测定食醋总算含量如果氢氧化钠溶液滴加过量只能重新实验为什么错了
0.1000MOL.L-1氢氧化钠溶液测定食醋总算含量如果氢氧化钠溶液滴加过量只能重新实验为什么错了
在用0.1000mol/LNaOH溶液测定食醋总酸含量的实验中,下列说法正确的是:A用移液管移取一定体积食醋时应将移液管垂直放入稍倾斜的容器中,并将尖嘴紧贴容器内壁
B如果NaOH溶液滴加过量,只能重新实验
我能理解 但是B哪里错了不知道 缠绵正乱坠1年前1
缠绵正乱坠1年前1 -
 luoshisong 共回答了12个问题
luoshisong 共回答了12个问题 |采纳率75%氢氧化钠过量,可向锥形瓶中加入定量的醋酸,重新滴定.
比如开始移取20ml醋酸进行滴定,现在氢氧化钠过量,你可以再移取5ml醋酸到锥形瓶中,相当于滴定25ml 的醋酸.所以不需要重做.1年前查看全部
- 称取含Na2CO3( Mr =106.0)为50.00%的试样0.4240g,滴定时消耗 0.1000mol/LHCl4
称取含Na2CO3( Mr =106.0)为50.00%的试样0.4240g,滴定时消耗 0.1000mol/LHCl40.10ml
称取含Na2CO3( Mr =106.0)为50.00%的试样0.4240g,滴定时消耗
0.1000mol/LHCl 40.10ml 求该次测定的相对误差是多少?要具体解析, 接龙3061年前1
接龙3061年前1 -
 s37zz95 共回答了16个问题
s37zz95 共回答了16个问题 |采纳率87.5%通过滴定分析,计算出碳酸钠的含量=0.1000*0.04010*106.0/(2*0.4240)=50.12%
该次测定的相对误差=(50.12%-50.00%)/50.00%=0.24%1年前查看全部
- 用量筒量取20mL0.5000mol•L-1 H2SO4溶液于烧杯中,加水80mL,配制成0.1000mol
用量筒量取20mL0.5000mol•L-1 H2SO4溶液于烧杯中,加水80mL,配制成0.1000mol•L-1H2SO4溶液 这个为什么错的?为什么它们加到一起体积不是100了,什么原因?
 guten20071年前1
guten20071年前1 -
 嗳硪自嘎127 共回答了15个问题
嗳硪自嘎127 共回答了15个问题 |采纳率93.3%简单来说就是1L的水喝1立方分米的沙子一起放着会小于2一样.硫酸分子和水分子的间隙不同,所以加在一起会小于21年前查看全部
- 15.一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O.若用0.1000mol·L-1的
15.一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O.若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008889 B.0.08000 C.0.1200 D.0.2400
另,我算的0.12是错的额 ststwei1年前3
ststwei1年前3 -
 劲羊 共回答了21个问题
劲羊 共回答了21个问题 |采纳率100%10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
可得
10[KHC2O4·H2C2O4]~8KMnO4①
而H2C2O4是二元弱酸,则10[KHC2O4·H2C2O4]是三元酸,可以消耗三份的NaOH.即
[KHC2O4·H2C2O4]~3NaOH②
由于两个反应中消耗的KHC2O4·H2C2O4量相等.联立两式子,则有
[KHC2O4·H2C2O4]]~8/10KMnO4~3NaOH
0.8 3
C1V1 C2V2
V1:V2=1:3
0.8:C1V1 = 3 :C2V2
解得:C1=0.8C2=0.08000mol/l1年前查看全部
- (2013•浙江)25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol
 (2013•浙江)25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )
(2013•浙江)25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)=
+c(Z-)+c(OH-)Ka(HY)•c(HY) c(Y−)  baobeilili1年前1
baobeilili1年前1 -
 ainixiao123 共回答了21个问题
ainixiao123 共回答了21个问题 |采纳率85.7%解题思路:A、根据图象分析,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1;
B、根据氢氧化钠滴到10mL,c(HY)≈c(Y-),Ka(HY)≈c(H+);
C、HX恰好完全反应时,HY早已经反应完毕;
D、由于溶液中的c(H+)=c(Y-)+c(Z-)+c(OH-);A、氢氧化钠体积为0时,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1,故酸性大小为HX<HY<HZ,故导电性HZ>HY>HX,故A错误;
B、当NaOH溶液滴到10mL时,溶液中c(HY)≈c(Y-),即Ka(HY)≈c(H+)=10-PH=10-5,故B正确;
C、HX恰好完全反应时,HY早已经完全反应,所得溶液为NaX和NaY混合液,酸性 HX<HY,NaY水解程度小于NaX,故溶液中c(X-)<c(Y-),故C错误;
D、HY与HZ混合,溶液中电荷守恒为c(H+)=c(Y-)+c(Z-)+c(OH-);再根据HY的电离平衡常数,c(Y-)≠
Ka(HY)•c(HY)
c(Y−),故D错误;
故选B.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查利用中和滴定图象,分析数据,用到了电荷守恒知识,难度适中.1年前查看全部
- (2014?郑州一模)25℃时,用浓度为0.1000mol?L-1的NaOH溶液分别滴定20.00mL浓度均为0.100
(2014?郑州一模)25℃时,用浓度为0.1000mol?L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol?L-1的三种
 (2014?郑州一模)25℃时,用浓度为0.1000mol?L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol?L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
(2014?郑州一模)25℃时,用浓度为0.1000mol?L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol?L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
A.相同浓度时,三种酸的酸性强弱顺序是:HX>HY>HZ
B.根据滴定曲线,可得Ka(HX)=10-3mol?L-1
C.滴定HY,V(NaOH)=20mL时,c(Na+)=c(Y-)>c(OH-)=c(H+)
D.滴定HZ,V(NaOH)=10mL时,c(Z-)>c(H+)>c(Na+)>c(OH-)
 chris06661年前1
chris06661年前1 -
 当时的稀饭 共回答了21个问题
当时的稀饭 共回答了21个问题 |采纳率100%A、氢氧化钠体积为0时,0.1000mol?L-1的三种酸HX、HY、HZ的pH分别为4、3、1,故酸性大小为HX<HY<HZ,故A错误;
B、当NaOH溶液滴到10mL时,溶液中c(HX)≈c(X-),即Ka(HX)≈c(H+)=10-pH,由于pH>4,则Ka(HX)<10-4,故B错误;
C、V(NaOH)=20mL时,HY与氢氧化钠恰好完全反应生成NaY,HY为弱电解质,Y-水解溶液显示碱性,c(OH-)>c(H+),故C错误;
D、V(NaOH)=10mL时,HZ有一半与氢氧化钠反应,且HZ为强电解质,溶液中氢离子浓度大于钠离子浓度,浓度关系为:c(Z-)>c(H+)>c(Na+)>c(OH-),故D正确;
故选D.1年前查看全部
- 请问怎样配置0.1000mol/LEDTA标准溶液呢?
 trueben1年前2
trueben1年前2 -
 魔女200 共回答了18个问题
魔女200 共回答了18个问题 |采纳率94.4%配置:取40克乙二胺四乙酸二钠,加少量水加热溶解,冷却后稀释至1000毫升
标定:准确称取0.3克于800℃士50℃的高温炉中灼烧至恒重的工作基准试剂氧化锌,用少量水湿润,加2 ml盐酸溶液(20%)溶解,加100 ml水,用氨水溶液(10%)调节溶液pH至7--8,加10 ml氨-氯化铵缓冲溶液 (PH-10)及5滴铬黑T指示液(5 g/L),用配制好的乙二胺四乙酸二钠溶液滴定至溶液由紫色变为纯蓝色.同时做空白试验.
配制时精度要求不高,但要精确地标定1年前查看全部
- 用0.1000mol盐酸标准溶液滴定碳酸钠试样,称取0.1500g,滴定耗去27.00ml标准液,计算碳酸钠百分含量
用0.1000mol盐酸标准溶液滴定碳酸钠试样,称取0.1500g,滴定耗去27.00ml标准液,计算碳酸钠百分含量
(Na2Co3=106) gaoj245461年前1
gaoj245461年前1 -
 汶渊 共回答了14个问题
汶渊 共回答了14个问题 |采纳率92.9%0.100*0.027*106/0.15*2 = 95.4%1年前查看全部
- 用0.1000mol/lHCL溶液滴定0.10mol/lNa3PO4,计算滴定至第一化学计量点时的PH
用0.1000mol/lHCL溶液滴定0.10mol/lNa3PO4,计算滴定至第一化学计量点时的PH
54 纸上烟云过眼多1年前1
纸上烟云过眼多1年前1 -
 dingqi617 共回答了20个问题
dingqi617 共回答了20个问题 |采纳率95%滴定至第一化学计量点时的PH的产物 为Na2HPO4 ,其c(H+)= Ka2 * Ka3 开平方
PH=(pKa2 + pKa3)/2 =9.541年前查看全部
- 常温下,用0.1000mol/L HCl溶液滴定 20.00mL 0.1000mol/L&
常温下,用0.1000mol/L HCl溶液滴定 20.00mL 0.1000mol/L NH 3 •H 2 O溶液滴定曲线如图.下列说法正确的是( ) A.点①溶液中:c(Cl - )>c(NH 4 + )>c(OH - )>c(H + ) B.点②溶液中:c(NH 4 + )>c(Cl - )>c(OH - )>c(H + ) C.点③溶液中:c(Cl - )>c(H + )>c(NH 4 + )>c(OH - ) D.滴定过程中可能出现:c(NH 3 •H 2 O)>c(NH 4 + )>c(OH - )>c(Cl - )>c(H + ) 
 南在南方1年前1
南在南方1年前1 -
 hh天使YOYO 共回答了18个问题
hh天使YOYO 共回答了18个问题 |采纳率88.9%A、由图象可知,点①反应后溶液是NH 4 C1与NH 3 •H 2 O物质的量之比为1:1的混合物,溶液呈碱性,说明NH 3 •H 2 O电离程度大于NH 4 C1的水解程度,故c(NH 4 + )>c (C1 - )>c(OH - )>c(H + ),故A错误;
B、由图象可知,点②pH=7,即c(H + )=c(OH - ),由电荷守恒可知:c(C1 - )+c(OH - )=c(NH 4 + )+c(H + ),故c(NH 4 + )=c(C1 - )>c(OH - )=c(H + ),故B错误;
C、由图象可知,点③体积相同,则恰好完全反应生成NH 4 C1,NH 4 C1水解溶液呈酸性,则c(C1 - )>c(NH 4 + )>c(H + )>c(OH - ),故C错误;
D、当NH 3 •H 2 O较多,滴入的 HCl较少时,生成NH 4 C1少量,溶液中NH 3 •H 2 O浓度远大于NH 4 C1浓度,可能出现c(NH 3 •H 2 O)>c(NH 4 + )>c(OH - )>c(Cl - )>c(H + ),故D正确;
故选D.1年前查看全部
- 高锰酸钾与双氧水、硫酸锰的反应计算个需要多少毫升0.1000mol/l高锰酸钾溶液才能分别与10.00ml 0.2000
高锰酸钾与双氧水、硫酸锰的反应
计算个需要多少毫升0.1000mol/l高锰酸钾溶液才能分别与10.00ml 0.2000mol/l过氧化氢及50.00ml、0.2000mol/l硫酸锰溶液反应完全?
酸性时 分别是8.00ml 40.00ml
中性时 分别是 13.33ml 66.67ml 但不知道具体的计算过程是怎么样的? sjc1131年前2
sjc1131年前2 -
 zhangxuelan 共回答了15个问题
zhangxuelan 共回答了15个问题 |采纳率93.3%酸性:2MnO4(-)+3H(+)+5H2O2===2Mn(2+)+5O2+8H2O
2 5
x*0.1 10*0.2
x=8ml
中性:2MnO4(-)+2H2O+3H2O2===2MnO2+3O2+10 OH(-)
同理,x=13.33ml
碱性:2MnO4(-)+2OH(-)+H2O2===2MnO4(2-)+O2+2H2O
和硫酸锰
酸性不清楚.在酸性条件下MnO4(-)氧化性更强自身还原成Mn2+(此反应中氢离子通常与氧结合生成水).
中性:2MnO4(-)+2H2O+3Mn(2+)===5MnO2+4H(+)
x=66.67ml1年前查看全部
- 常温下,用0.1000mol/L HCl溶液滴定 20.00mL 0.1000mol/L&
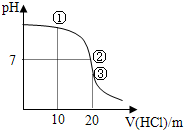 常温下,用0.1000mol/L HCl溶液滴定 20.00mL 0.1000mol/L NH3•H2O溶液滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L HCl溶液滴定 20.00mL 0.1000mol/L NH3•H2O溶液滴定曲线如图.下列说法正确的是( )
A.点①溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.点②溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.点③溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定过程中可能出现:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) 123guo1年前1
123guo1年前1 -
 guohuigh1 共回答了25个问题
guohuigh1 共回答了25个问题 |采纳率80%解题思路:A、由图象可知,点①反应后溶液是NH4C1与NH3•H2O物质的量之比为1:1的混合物,溶液呈碱性,说明NH3•H2O电离程度大于NH4C1的水解程度,故c(NH4+)>c (C1-)>c(OH-)>c(H+);
B、由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),由图象可知,点②pH=7,即c(H+)=c(OH-),故c(NH4+)=c(C1-)>c(OH-)=c(H+);
C、由图象可知,点③体积相同,则恰好完全反应生成NH4C1,利用盐的水解来分析溶液呈酸性,则c(C1-)>c(NH4+)>c(H+)>c(OH-);
D、当NH3•H2O较多,滴入的 HCl较少时,生成NH4C1少量,溶液中NH3•H2O浓度远大于NH4C1浓度,可能出现.A、由图象可知,点①反应后溶液是NH4C1与NH3•H2O物质的量之比为1:1的混合物,溶液呈碱性,说明NH3•H2O电离程度大于NH4C1的水解程度,故c(NH4+)>c (C1-)>c(OH-)>c(H+),故A错误;
B、由图象可知,点②pH=7,即c(H+)=c(OH-),由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),故c(NH4+)=c(C1-)>c(OH-)=c(H+),故B错误;
C、由图象可知,点③体积相同,则恰好完全反应生成NH4C1,NH4C1水解溶液呈酸性,则c(C1-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D、当NH3•H2O较多,滴入的 HCl较少时,生成NH4C1少量,溶液中NH3•H2O浓度远大于NH4C1浓度,可能出现c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+),故D正确;
故选D.点评:
本题考点: 中和滴定;离子浓度大小的比较.
考点点评: 本题以HCl溶液滴定NH3•H2ON曲线为载体,考查盐类的水解、溶液离子浓度的大小比较等,难度中等,注意离子浓度大小比较中电荷守恒、质子恒等式、物料守恒等量关系式的利用.1年前查看全部
- (2014•江西一模)25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol
 (2014•江西一模)25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
(2014•江西一模)25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.在HZ中加入NaOH至恰好完全反应时,溶液中各离子浓度大小顺序:c(Na+)>c(Z-)>c(OH-)>c(H+)
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)+c(Y-)+c(OH-)=c(Na+)+c(H+)
D.将HX和HZ溶液混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Na+)=c(X-)+c(Z-) 恋爱一个人1年前1
恋爱一个人1年前1 -
 gnbkuf 共回答了15个问题
gnbkuf 共回答了15个问题 |采纳率93.3%解题思路:A.由图象可知0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1,由此可确定酸的强弱;
B.0.1000mol/L的HZ的pH=1,则HZ为强电解质,与氢氧化钠恰好反应时溶液的pH=7,据此进行判断溶液中各离子浓度大小关系;
D.根据反应后的混合液中电荷守恒进行判断;
C.HX为为弱电解质,当HX恰好反应时,HZ已经完全反应,根据物料守恒进行判断.A.氢氧化钠体积为0时,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1,故酸性大小为HX<HY<HZ,相同温度和浓度时导电性强弱为:HZ>HY>HX,故A错误;
B.根据图象可知,0.1000mol/L的HZ的pH=1,说明HZ为强酸,在HZ中加入NaOH至恰好完全反应时,溶液显示中性,溶液中c(OH-)=c(H+),根据电荷守恒可得:c(Na+)=c(Z-),所以溶液中离子浓度大小关系为:c(Na+)=c(Z-)>c(OH-)=c(H+),故B错误;
C.酸性HY>HX,当HX恰好完全反应时,HY早已经完全反应,所得溶液为NaX和NaY混合液,根据溶液中电荷守恒可知:c(X-)+c(Y-)+c(OH-)=c(Na+)+c(H+),故C正确;
D.HZ为强酸,HZ>HX,当用NaOH溶液滴定至HX恰好完全反应时,HZ已经完全反应,根据物料守恒可知:c(Na+)=c(X-)+c(Z-)+c(HZ)+c(HX),故D错误;
故选C.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱混合时的定性判断及有关pH的计算,题目难度中等,根据图象数据判断电解质强弱是解题关键,注意掌握根据溶液pH判断电解质强弱的方法.1年前查看全部
- 某学生用滴定的方法测定含有少量NaCl的小苏打固体中NaHCO3的质量分数,所用标准盐酸的浓度为0.1000mol/L.
某学生用滴定的方法测定含有少量NaCl的小苏打固体中NaHCO3的质量分数,所用标准盐酸的浓度为0.1000mol/L.关于该实验的叙述正确的是( )
A. 用烧杯准确配制100mL待测小苏打的溶液
B. 用酚酞为指示剂
C. 当滴至待测液变色并能将该颜色保持半分钟即为滴定终点
D. 盛盐酸的滴定管未润洗会造成实验结果偏低 f3061年前1
f3061年前1 -
 shimmy_S 共回答了12个问题
shimmy_S 共回答了12个问题 |采纳率100%解题思路:A、根据烧杯只能粗略配制溶液;
B、根据NaHCO3完全反应应选择甲基橙作指示剂;
C、根据滴定终点时溶液颜色由黄色突变为橙色,且保持半分钟不变色;
D、根据c(待测)=
来分析.c(标准)×V(标准) V(待测) A、烧杯只能粗略配制溶液,不能杯准确配制100mL待测小苏打的溶液,故A错误;
B、NaHCO3要完全反应应选择甲基橙作指示剂,故B错误;
C、滴定终点时溶液颜色由黄色突变为橙色,且保持半分钟不变色,故C正确;
D、盛盐酸的滴定管未润洗,标准液的浓度降低,造成V(标)偏大,根据c(待测)=
c(标准)×V(标准)
V(待测),可知c(待测)偏大,故D错误;
故选:C.点评:
本题考点: 中和滴定.
考点点评: 本题考查中和滴定的操作以及注意事项,在误差分析时,无论哪一种类型的误差,都可以归结为对标准溶液体积的影响,其标准溶液的体积偏小,那么测得的物质的量的浓度也偏小;其标准溶液的体积偏大,那么测得的物质的量的浓度也偏大.1年前查看全部
- 用0.1000mol/lHCl滴定20.00ml0.1000mol/l NH3溶液时,计算(1)等量点,(2)等量点前后
用0.1000mol/lHCl滴定20.00ml0.1000mol/l NH3溶液时,计算(1)等量点,(2)等量点前后±0.1%相对误差范围内溶液的PH值.选用何种指示剂?
 品牌专卖1年前2
品牌专卖1年前2 -
 孤单的夜灯 共回答了21个问题
孤单的夜灯 共回答了21个问题 |采纳率95.2%一、化学计量点:
此时NH3全部被中和,生成的氨根发生水解,电离出部分氢离子,此时的CNH4+=00.05mol/l
故根据Kb=1.8*10^-5,有Ka=Kw/Ka=1*10^-9.26,可求得H+=√CKa=5.3*10^-5
所以,PH=5.28
化学计量点是PH为5.28
二、化学计量点前
此时形成的氯化铵和剩余的氨水,溶液显碱性,当滴入19.98ml(-0.1%)HCl时,溶液的[OH-]=Kb*CNH3/CNH4+=1.8*10^-8mol/l
所以PH=14-lg[OH-]=14-7.75=6.25
即化学计量点前PH为6.25
三、化学计量点后,
此阶段盐酸过量,溶液显酸性,当加入20.02ml(+0.1%)HCl时,
此时的[H+]=0.02*0.1/40.02=5*10^-5,
所以,PH=4.30
故化学突跃点从PH6.25到4.30,
可选择甲基红和溴甲酚绿做指示剂
溴甲酚绿指示剂,但pH=3.8时呈黄色,pH=5.4时呈蓝绿色,pH=4.5时开始有颜色的明显变化.
甲基红指示剂:pH变色范围4.4(红)~6.2(黄).1年前查看全部
- 用0.1000mol.L-NaOH溶液滴定20.00ml0.1000mol/L HCOOH溶液,计算化学计量点时pH和p
用0.1000mol.L-NaOH溶液滴定20.00ml0.1000mol/L HCOOH溶液,计算化学计量点时pH和pH突跃范围(已知甲酸Ka=1.8×10-4)
 ljy513201年前1
ljy513201年前1 -
 烂番茄19个 共回答了12个问题
烂番茄19个 共回答了12个问题 |采纳率91.7%答:
【1】突越范围 pH = 6.74 - 9.7 的计算:
1、计量点前(19,98 ml):pH = pKa + lg[(19.98/0.02)] = 3.74+3 = 6.74
2、计量点前(20,02 ml):pH = 14 - pOH = 14- (20.02-20.00/40.02)
=14 - 4.3 = 9.70
【2】化学计量点时pH = 8.22的计算:
pH =14 -pOH = 14 - p(CKa)^0.5p = 14 - p[(0.05x5.6x10^-11)^0.5] = 14 - 5.78 = 8.221年前查看全部
- 配制0.1000mol/l的1/2草酸标准溶液250ml需要多少质量的草酸
 有坏毛病好1年前1
有坏毛病好1年前1 -
 比萨晓曦 共回答了22个问题
比萨晓曦 共回答了22个问题 |采纳率95.5%1/2(H2C2O4.2H2O)的摩尔质量是63.04
0.1000*250/1000=m/63.04
m=1.576g1年前查看全部
- 0.1000mol/,NaOH溶液滴定20.00ml 0.1mol/L HCl溶液
 _逍遥1年前2
_逍遥1年前2 -
 空气里的小鱼 共回答了21个问题
空气里的小鱼 共回答了21个问题 |采纳率85.7%答:
【1】 化学计量点时,滴定的体积是20.00 ml
【2】化学计量点时,溶液的PH值是7.00
【3】滴定的 突跃范围 PH 4.30 - 9.70
【4】可以采用甲基橙、酚酞为指示剂1年前查看全部
- 2准确移取氯化钠溶液20.00ml,加入铬酸钾指示剂,用0.1000mol/L的硝酸银标准溶液滴定,终点时消耗硝酸银溶液
2准确移取氯化钠溶液20.00ml,加入铬酸钾指示剂,用0.1000mol/L的硝酸银标准溶液滴定,终点时消耗硝酸银溶液25.00ml,计算氯化钠的物质的量浓度及其量浓度.
 语美人1年前1
语美人1年前1 -
 葵葵巫 共回答了20个问题
葵葵巫 共回答了20个问题 |采纳率90%根据反应方程式:
NaCl+AgNO3=AgCl(沉淀)+NaNO3
反应的NaCl和AgNO3的物质的量相等,因此:
氯化钠的物质的量浓度=0.1000*25.00/20.00=0.1250mol/L1年前查看全部
- 检验苯甲酸的含量,称取试样1.220克,溶解后容量瓶中定容至100毫升,移取25.00毫升试样溶液,用0.1000mol
检验苯甲酸的含量,称取试样1.220克,溶解后容量瓶中定容至100毫升,移取25.00毫升试样溶液,用0.1000mol*L-1NaOH溶液滴定,滴定至终点时NaOH溶液共消耗24.65毫升,求试样中苯甲酸的含量
 ling79101011年前1
ling79101011年前1 -
 czxsmltz 共回答了14个问题
czxsmltz 共回答了14个问题 |采纳率92.9%苯甲酸的质量:122*0.1*24.65/1000*4=1.20292g
百分比为:1.20292/1.22*100%=98.6%1年前查看全部
- 用0.1000mol?L-1NaOH滴定HCL最适合的指示剂是A酚酞B甲基橙C甲基红D以上三种指示剂均不行
 飞翔理想1年前2
飞翔理想1年前2 -
 tulip678 共回答了19个问题
tulip678 共回答了19个问题 |采纳率94.7%这个肯定是A酚酞了,因为是用强碱来滴定.就举个例子,应该滴到20ML是刚好终点,但是临到终点的最后一滴往往不仅到了滴定终点,而且还会令PH稍显碱性,一般都是8以上的,而酚酞的测定范围大概是8以上,因此就要用酚酞啦.1年前查看全部
- 常温下,用0.1000mol·L -1 NaOH溶液滴定20.00mL 0.1000mol·L -1 CH 3 COOH
常温下,用0.1000mol·L -1 NaOH溶液滴定20.00mL 0.1000mol·L -1 CH 3 COOH溶液,滴定曲线如右图。下列说法正确的是

[H + ]>[Na + 」>[OH - ]A.点①所示溶液中:[CH 3 COO - ]+[OH - ]=[CH 3 COOH] +[H + ] B.点②所示溶液中:[Na + ]=[CH 3 COOH]+[CH 3 COO - ] C.点③所示溶液中:[Na + ]>[OH - ]>[CH 3 COO - ]>[H + ] D.滴定过程中可能出现:[CH 3 COOH]>[CH 3 COO - ]>  ainia30001年前1
ainia30001年前1 -
 天之痕31 共回答了19个问题
天之痕31 共回答了19个问题 |采纳率89.5%D
A 错误,应遵循电荷守恒,[CH 3 COO - ]+[OH - ]=[Na + ]+[H + ]
B 错误,点②所示溶液PH=7,显中性,[Na + ]=[CH 3 COO - ]
C 错误,点③所示溶液中:[Na + ]>[CH 3 COO - ]>[OH - ]>[H + ]
D 正确。在CH 3 COOH溶液中开始滴入很少量的NaOH溶液时出现此种情况。1年前查看全部
- 用0.1000mol·L-1NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线如下图.其中①点所示溶液中c(C
用0.1000mol·L-1NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线如下图.其中①点所示溶液中c(CH3COO-)=2c(CH3COOH),③点所示溶液中存在:c(CH3COO-)+c(CH3COOH)=c(Na+).则CH3COOH的电离平衡常数Ka= ,醋酸的实际浓度为(保留四位有效数字).
答案:2×10 -5 mol·L -1;0.1006 mol ·L -1
求详细解答过程.

 a9db1年前2
a9db1年前2 -
 exiaoran 共回答了20个问题
exiaoran 共回答了20个问题 |采纳率90%分析化学的解题思路:
第一题,首先看到1点,确定在1点时候,溶液为缓冲溶液,那么根据定义式
pka=pH+lg(c碱/c酸),题中c(CH3COO-)=2c(CH3COOH),从而得到答案,
第二题,在3点时达到滴定计量点,此时计算浓度为0.1006mol/L
2点什么都不是,滴定恰好完全反应时,醋酸钠是呈碱性的,所以3点才是化学计量点1年前查看全部
- 称取NaCl样品0.2000g,加入0.1000mol/LAgNO3溶液30.00ml,过量的AgNo3用0.1020m
称取NaCl样品0.2000g,加入0.1000mol/LAgNO3溶液30.00ml,过量的AgNo3用0.1020mol/LNH4SCN滴定液滴定
,终点时用去10.00ml,计算样品中NaCl的含量.(已知NaCl的分子量为58.44)
请写公式同计算过程! 66island11年前1
66island11年前1 -
 yangshao 共回答了15个问题
yangshao 共回答了15个问题 |采纳率86.7%1mol AgNO3消耗1mol NH4SCN,所以过量的AgNO3为 0.102mol/L*0.01L=0.00102mol,所以NaCl消耗的AgNO3为0.03*0.1-0.00102=0.00198mol,那么NaCl的质量则为58.44*0.00198=0.1157g,即质量分数为0.1157/0.2=57.85%.1年前查看全部
- 水分析化学试题取水样100.0ml,加入酚酞指示剂,用0.1000mol/LHCI溶液滴定至终点,用去HCI溶液11.0
水分析化学试题
取水样100.0ml,加入酚酞指示剂,用0.1000mol/LHCI溶液滴定至终点,用去HCI溶液11.00ml:接着加入甲基橙指示剂,继续用0.1000mol/LHCI溶液滴定至终点.又消耗HCI11.00ml.问:水样中有何种碱度?其含量为多少?(以mmol/L表示) ljt3011年前2
ljt3011年前2 -
 曾无缘无故 共回答了16个问题
曾无缘无故 共回答了16个问题 |采纳率100%HCO3-溶液pH为8左右,而酚酞的变色点也在8左右.
用盐酸滴定碳酸根溶液,当溶液全部转变为碳酸氢根,CO32- + H+ = HCO3-,此时酚酞指示剂由红色变为无色到达终点.再用甲基橙做指示剂,HCO3- + H+ = H2O + CO2,终点变成红色.两者消耗的酸的体积恰好相等.则说明正好为碳酸根溶液.
原因分析:
OH-溶液,OH- + H+ = H2O以酚酞为指示剂,即达到反应终点,再以甲基橙作指示剂,基本不再消耗酸.
HCO3-溶液,加入酚酞,溶液为无色,再滴加盐酸,溶液仍未无色,没有反应终点(酚酞在pH为8以上显红色,8以下无色).
CO32-溶液,前后两个突变点,且消耗的酸一样.
OH-和CO32-混合溶液,以酚酞为指示剂时消耗的酸更多.
OH-和HCO3-不能共存,OH- + HCO3- = H2O + CO32.
CO32-和HCO32-混合溶液,以甲基橙为指示剂时消耗的酸更多.
OH-、HCO3-、CO32-不能共存,OH- + HCO3- = H2O + CO32.
所以水中的碱为CO32-,CO32- + H+ = HCO3-,可算出CO32-的物质的量为11mL*0.1mol/L=1.1mmol
[CO3]=1.1mmol/0.1L=11mmol/L.1年前查看全部
大家在问
- 1青玉案 元夕中元夕是正月十五,也是这首诗的什么
- 2如图,反比例函数Y=3/X的图像与一次函数y=kx+b的图像交于A(m,3)B(-3,n)两点(1)求一次函数的解析式及
- 3遇到不会的题,忽然有了灵感,是什么诗句?
- 4我看到您回答那个有关环氧树脂固化的问题中说到用二甲苯和正丁醇7:1,这个比是体积比还是质量比?
- 5各种植物激素的作用原理
- 6求方程ylnydx+(x-lny)dy=0的通解.
- 7(2012•淄博一模)某人因病作了胃肠消化道切除手术,医生对他进行全静脉注射方式补给营养,那么配制的消化液应含有( )
- 8大年夜的爆竹声把旧年送走,在春风里畅饮屠苏美酒,写出诗句
- 9Would you mind _________ the piano softly ? A.to play B.play
- 10一张试卷一共只有25道选择题,做对一题得4分,做错一题倒扣2分,李明同学做完全部试题,得了88分,那么他做对了( )
- 11英语试题求解答根据上句写下句,或根据下句写出上句.1、A: ?B:We have fish and tomatoes.2
- 12市实验小学五年级有学生240人,六年级的学生是五年级的六分之五,
- 13(2011•日照)小强在验证杠杆平衡条件的实验中
- 14let is ( ) school.选折 1.walk to 2 on foot to
- 15《静是一种美的享受》,写一段话,现在就要!
