煅烧碳酸钴生成四氧化三钴化学程式
 灰砖2022-10-04 11:39:542条回答
灰砖2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 愚人萧 共回答了16个问题
愚人萧 共回答了16个问题 |采纳率81.3%- 化学方程式如下:6CoCO3 + O2 = 2[Co2O3●CoO] + 6CO2↑,四氧化三钴和Fe3O4类似.
- 1年前
 bbv-liu 共回答了5个问题
bbv-liu 共回答了5个问题 |采纳率- 高温
6CoCO3+O2=6CO2+2Co3O4 - 1年前
相关推荐
- 工业上用煅烧石灰石的方法生产生石灰,在石灰窑中煅烧2.5吨的石灰石(假设为纯净物),问:
工业上用煅烧石灰石的方法生产生石灰,在石灰窑中煅烧2.5吨的石灰石(假设为纯净物),问:
1)能得到多少吨生石灰?
2)能得到多少吨二氧化碳?此二氧化碳气体在标况下体积是多少升?
3)假设所产生气体贮放在一个体积为100m3 的气罐中,在27℃下气罐要承受多大的压强
(Pa)? 豁然开朗的心情1年前1
豁然开朗的心情1年前1 -
 菜鸟vs菜鸟 共回答了11个问题
菜鸟vs菜鸟 共回答了11个问题 |采纳率72.7%石灰石是碳酸钙,摩尔质量是100g/mol;
生石灰是氧化钙,摩尔质量是56g/mol;
二氧化碳的摩尔质量是44g/mol;
煅烧石灰石是分解反应,反应过程中1mol碳酸钙CaCO3分解出1molCaO和1molCO2,并且没有其他成分生成
所以,
1、能得到2.5*56/100=1.4t生石灰
2、能得到2.5-1.4=1.1t二氧化碳气体,这些气体在标况下的体积是1.1*1000*1000/44*22.4=560000L=560m3
3、这一题要用到理想气体状态方程PV=nRT
标况下,这些CO2的压力P1是一个大气压(标况的压力,101325Pa),体积V1是560m3,温度T1是标况温度273K
气罐中,这些CO2的体积V2=100m3,温度T2=273+27=250K,求P2
n是气体的物质的量,n1=n2;R是常数
由上述方程得,P1*V1=n1*R*T1,所以,n1*R=P1*V1/T1
而P2*V2=n2*R*T2,
所以P2=n2*R*T2/V2=n1*R*T2/V2=P1*V1*T2/(T1*V2)
=P1*(560*250)/(100*273)=5.13*P1=519615.38Pa1年前查看全部
- 利用重晶石(BaSO4)制备其他钡盐,需要先将其转化成BaCO3.工业上一般采用高温煅烧还原法,实验室可以采用沉淀转化法
利用重晶石(BaSO4)制备其他钡盐,需要先将其转化成BaCO3.工业上一般采用高温煅烧还原法,实验室可以采用沉淀转化法实现这种转化.
Ⅰ.高温煅烧还原法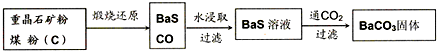
(1)煅烧还原的热化学方程式为:______.
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H1=-1473.2kJ•mol-1
C(s)+[1/2]O2(g)=CO(g);△H2=-110.5kJ•mol-1
Ba(s)+S(s)=BaS(s);△H3=-460kJ•mol-1
(2)实验测得水浸取液呈强碱性,为什么?(用离子方程式表示)______.
Ⅱ.沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液时,会有如下转化:
BaSO4(s)+CO
(aq)⇌BaCO3(s)+SO2−3
(aq)(平衡常数K=0.042).2−4
BaSO4沉淀转化为BaCO3沉淀的一般过程,是把BaSO4置于一定量的饱和Na2CO3溶液中浸泡,再充分搅拌,静止后弃去上层清液;如此处理多次,可使BaSO4全部转化为BaCO3.
(3)向足量BaSO4沉淀中加入一定量 c mol/L Na2CO3溶液充分搅拌后,溶液中SO
的浓度是多少?(写出计算过程,结果用含c的代数式表示)2−4
(4)现有0.40mol BaSO4,欲使之全部转化为BaCO3.若每次用1.00L 2.0mol•L-1饱和Na2CO3溶液处理,至少需要处理______次.
(5)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法,相对于高温煅烧还原法的优点是:______(至少写2点). 222qw881年前1
222qw881年前1 -
 tnntt 共回答了29个问题
tnntt 共回答了29个问题 |采纳率86.2%解题思路:(1)根据盖斯定律结合题目中已知的热化学方程式来计算;
(2)在溶液中,硫离子水解导致溶液显示碱性;
(3)根据化学方程式和化学平衡常数进行计算;
(4)根据化学方程式和化学平衡常数进行计算;
(5)根据所发生的化学反应来判断分析方法的优点;(1)a、Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ•mol-1
b、C(s)+[1/2]O2(g)=CO(g);△H=-110.5kJ•mol-1
c、Ba(s)+S(s)=BaS(s);△H=-460kJ•mol-1,
根据盖斯定律:反应BaSO4(s)+4C(s)=BaS(s)+4CO(g)和a、b、c之间的关系是4b-a+c,
所以BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1,
故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ•mol-1;
(2)在硫化钡中,硫离子水解而使得硫化钡显碱性,即S2-+H2O⇌HS-+OH-,故答案为:S2-+H2O⇌HS-+OH-;
(3)设每次用1.00L c mol•L-1饱和Na2CO3溶液能处理xmol BaSO4,
BaSO4 +CO32-=BaCO3 +SO42
(c-x)mol•L-1 x mol•L-1
根据K=
c(SO42−)
c(CO32−)=[x/c−x]=0.042
解得:x=[0.042c/1.042]mol
溶液中硫酸根离子浓度为:[0.042c/1.042]mol/L;
答;溶液中硫酸根离子浓度为:[0.042c/1.042]mol/L;
(4)设每次用1.00L 2.0 mol•L-1饱和Na2CO3溶液能处理xmol BaSO4,
BaSO4 +CO32-=BaCO3 +SO42
(2.0-x)mol•L-1 x mol•L-1
根据K=
c(SO42−)
c(CO32−)=[x/2.0−x]=0.042
解得:x=0.081,处理次数=[0.4mol/0.081]=4.9,所以至少处理5次;
故答案为:5次;
(5)用饱和Na2CO3溶液沉淀转化法的优点是节能、环保,故答案为:节能,环保;点评:
本题考点: 热化学方程式;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了学生用盖斯定律计算反应热、盐类水解的离子方程式的书写、化学方程式的书写以及沉淀转化的有关知识,侧重于对学生计算能力的考查,难度中等.1年前查看全部
- 将含杂质10%的100 g石灰石样品经高温煅烧一段时间后,冷却,称得剩余固体的质量为78 g.(设杂
将含杂质10%的100 g石灰石样品经高温煅烧一段时间后,冷却,称得剩余固体的质量为78 g.(设杂质不含钙元素,也不发生反应).
计算(1)样品中碳酸钙的分解率.
(2)剩余固体中钙的质量分数. 白天无法拥抱黑夜1年前1
白天无法拥抱黑夜1年前1 -
 mygrains 共回答了15个问题
mygrains 共回答了15个问题 |采纳率80%解题思路:固体减少的质量为二氧化碳的质量,由二氧化碳的质量根据碳酸钙分解的化学方程式可以计算出发生分解的碳酸钙的质量.
由石灰石的质量和含杂质的质量分数可以计算出石灰石中原有碳酸钙的质量.
(1)样品中碳酸钙的分解率是已经分解的碳酸钙与样品中原有的碳酸钙的质量比.
(2)样品的质量乘以样品中碳酸钙的质量分数就是样品中碳酸钙的质量.
碳酸钙中钙元素的质量分数可以通过碳酸钙的化学式计算得到.
样品中碳酸钙的质量乘以碳酸钙中钙元素的质量分数就是样品中钙元素的质量.
剩余固体中钙元素的质量就是样品中钙元素的质量.
剩余固体中钙元素的质量与剩余固体的质量之比就是剩余固体中钙元素的质量分数.(1)设发生分解的碳酸钙的质量为x.
CaCO3
高温
.
CaO+CO2↑
100 44
x100g-78g=22g
[100/44]=[x/22g],x=50g
样品中碳酸钙的分解率为
[50g
100g×(1−10%)×100%≈55.6%
(2)碳酸钙中钙元素的质量分数为
40/100]×100%=40%
剩余固体中钙元素的质量分数为
100g×(1−10%)×40%
78g×100%≈46.2%
答:(1)样品中碳酸钙的分解率为55.6%.
(2)剩余固体中钙元素的质量分数为46.2%.点评:
本题考点: 含杂质物质的化学反应的有关计算;混合物中某元素的质量计算;质量守恒定律及其应用.
考点点评: 本题主要考查有关含杂质物质的化学方程式计算,难度较大.1年前查看全部
- (我不会做的)1 哺乳动物成分与人类相似,现在提取某种哺乳动物的骨2.4克,放在酒精灯上煅烧,煅烧至只留下灰白色粉末,称
(我不会做的)
1 哺乳动物成分与人类相似,现在提取某种哺乳动物的骨2.4克,放在酒精灯上煅烧,煅烧至只留下灰白色粉末,称其重量1.6克,该动物约处于___A老年期B幼年期C成年期D不可确定
2下列各项中属于食物链的是____A草→食草昆虫→青蛙B空气→青蛙→蛇→猫头鹰C阳光→草→食草昆虫D草←食草昆虫←青蛙
3俗话说“种豆得豆,种瓜得瓜”“一树结果 酸甜各异”这说明生物界普遍存在着______和_____的现象
4“大鱼吃小鱼小鱼吃虾米虾米吃泥巴”,这说明自然界中各种生物是通过_____与_______的关系,形成食物链的.
因为本人比较笨 多多海涵! jxfeng19851年前6
jxfeng19851年前6 -
 我rr都BH 共回答了18个问题
我rr都BH 共回答了18个问题 |采纳率100%AA,遗传和变异.食物链和食物网1年前查看全部
- 将碳酸锌、氧化铜和木炭在800度的高温下煅烧,最后生成表面像金子一样的金属,问它的主要成分是啥.
 ebay13381年前3
ebay13381年前3 -
 jsmtmk81409 共回答了16个问题
jsmtmk81409 共回答了16个问题 |采纳率93.8%是药金
“药金”从外观上看和金(Au)相似,常被误认为是黄金,其主要成份是铜锌合金.
黄白术黄白术是炼丹术的重要组成部分.古代以黄喻金,以白喻银,总称“黄白”.企图通过药物的点化,变贱金属(铜、铅、锡等)为金黄色、或银白色的假金银,又称 “药金”或“药银”(即各种合金).制取“黄白”的方技,即称“黄白术”.
我国黄白术的起源、发展与外丹术同步,源于战国燕齐方士之神仙方技.史载,西汉文帝时,造假黄金者甚多,景帝前元六年(前151)曾下诏:“定铸钱伪黄金弃市律”.武帝时淮南王刘安撰《中篇》八卷,言神仙黄白之术二十余万言.
另传方士李少君能化丹砂为黄金.检索史书,东汉皇室及新莽均拥有大量“黄金”,社会上颇多造“药金”致富或制“延年药”的故事.清赵翼《廿二史札记》有“汉代多黄金”之说.可知两汉乃黄白术盛行时代,尤以“药金”的制取为其特色.千余年来,
虽然没有实现变贱金属为贵金属的设想,但经长期的实践,却对我国古代冶金学、合金学作出了贡献.西汉成书的《神农本草经》曾总结出:水银“能杀金、银、铜、锡毒”,即指水银能与多种金属生成合金.
道教创立后,继承了以往的黄白术成就,与外丹术同步发展.在魏伯阳《参同契》中,就多次隐喻了铅与水银生成铅汞齐(铅汞合金)的事实.而著名的黄白师狐刚子在其《出金矿图录》中,对金银矿种类、分布、品位、真伪辨识、冶炼等方面均有详细的论述.为减少金、银毒,首创了“炼金银粉”法,并相沿至明代,后因医学禁用而被淘汰.早期黄白术中使用的“点化药”是“三黄”,即三种含砷的硫化物——雄黄、雌黄、砒黄.狐刚子在其《五金诀》中,总结了“三黄”经“伏火处理”,可提高点化效果,且描述了其与五金合炼为合金时的物件变化.东晋葛洪在《抱朴子内篇·黄白》中指出,当时有《神仙经黄白之方》二十五卷,千有余首.他先从其师郑隐受《金银液经》,后复求受《黄白中经》五卷.《黄白》篇还叙述了道士李根、程伟妻等造“药金”、“药银”的故事.更重要的是葛洪第一次详细记录了从武都雄黄等物冶炼一种金黄色的“铜砷合金”(简称“砷黄铜”)的方法和技术.前述两汉时期所拥有的大量“黄金”中,必有相当部分由此法制得(药金).梁陶弘景撰有《集金丹黄白方》一卷,惜早已失传,但其《名医别录》中曾指出:矾石“火炼百日……不炼服,则杀人及百兽”.这是继狐刚子之后又一次关于“伏火处理”的论述.1年前查看全部
- 煅烧硫铁矿使用的沸腾炉的主要优点是什么?
 娃哈哈l3451年前1
娃哈哈l3451年前1 -
 kx32165498 共回答了18个问题
kx32165498 共回答了18个问题 |采纳率100%首先所谓 硫铁矿 貌似叫 黄铁矿
答:使黄铁矿充分与空气接触 提高SO2的产量 沸腾炉还可以加热.1年前查看全部
- 石灰石(主要成分是CaCO3)要经过高温煅烧才能变成生石灰(CaO),高温条件提供的热能在石灰石的分解反应中起什么作用?
 zxwtq1年前1
zxwtq1年前1 -
 与猪散步 共回答了18个问题
与猪散步 共回答了18个问题 |采纳率94.4%使化合键断裂1年前查看全部
- 初三化学方程式计算题150g 碳酸钙高温煅烧一段时间后,测得剩余固体中钙元素的质量分数为46.875%,求碳酸钙的分解率
 烂电吉他1年前1
烂电吉他1年前1 -
 天1涯剑客 共回答了20个问题
天1涯剑客 共回答了20个问题 |采纳率90%设分解的碳酸钙的质量为X
150克碳酸钙中含钙元素的质量=150g*40/100*100%=60g
剩余固体的质量=60g/46.875%=128g
根据质量守恒定律得生成二氧化碳的质量=150g-128g=22g
CaCO3 =高温 =CaO + CO2↑
100 44
X 22g
100:44=X:22g
X=50g
碳酸钙的分解率=50g/150g*100%=33.3%
答:碳酸钙的分解率33.3%1年前查看全部
- 工业上高温煅烧100t含杂质的石灰石(主要成分是CaCO3),充分反应后,测得剩余物质的质量为91.2t,求生成CO2多
工业上高温煅烧100t含杂质的石灰石(主要成分是CaCO3),充分反应后,测得剩余物质的质量为91.2t,求生成CO2多
少吨?生成CaO多少吨?求石灰石中CaCO3的质量分数是多少? woolala_lay1年前1
woolala_lay1年前1 -
 wglsr 共回答了19个问题
wglsr 共回答了19个问题 |采纳率100%生成的CO2的质量=100t-91.2t=8.8t设石灰石中CaCO3的质量为X,生成的CaO的质量为YCaCO3=高温=CaO + CO2↑100 56 44X Y 8.8t100/X=56/Y=44/8.8tX=20t ...1年前查看全部
- 工业上高温煅烧石灰石,克制的生石灰石和二氧化碳,若要治取5.6吨氧化钙,需要碳酸钙多少吨
 楚云湘雨1年前1
楚云湘雨1年前1 -
 solar 共回答了20个问题
solar 共回答了20个问题 |采纳率90%CaCO3=高温=CaO+CO2↑
100 56
m(CaCO3) 5.6t
m(CaCO3)=100*5.6/56=10t
答:需要碳酸钙10吨.1年前查看全部
- 煅烧纯度为90%的石灰石150吨,可以制得生石灰多少吨?(杂质不反应)
 笨笨猫之鱼1年前2
笨笨猫之鱼1年前2 -
 TMD呀呀 共回答了26个问题
TMD呀呀 共回答了26个问题 |采纳率92.3%m(CaCO3)=150*90%=135t
m(CaO)=135*(56/100)=75.6t1年前查看全部
- 有150g碳酸钙高温煅烧,一段时间后冷却,测得生成二氧化碳气体2.2g,则反应后剩余固体中氧元素的质量
有150g碳酸钙高温煅烧,一段时间后冷却,测得生成二氧化碳气体2.2g,则反应后剩余固体中氧元素的质量
这是一个选择题:A.8g B.28g C.48g D.56g evething_都会变1年前3
evething_都会变1年前3 -
 94695 共回答了21个问题
94695 共回答了21个问题 |采纳率85.7%原来的150gCaCO3中有氧元素72g,CO2中有氧1.6g,元素守恒,所以剩余氧元素70.4g1年前查看全部
- 充分煅烧50g硫铁矿样品,将生成的so2和24go2混合,并在一定条件下反应,将反应后的混合气体用冰水冷却得40g无色晶
充分煅烧50g硫铁矿样品,将生成的so2和24go2混合,并在一定条件下反应,将反应后的混合气体用冰水冷却得40g无色晶体,剩余气体和过量h2s充分反应得44g固体,求(1)so2转化成so3的百分率(2)样品中含fes2的百分含量
 怕我1年前2
怕我1年前2 -
 songheqiu 共回答了16个问题
songheqiu 共回答了16个问题 |采纳率100%设样品中含 S 元素 x gS+O2==SO2(此式不是化学反应方程式,表示硫元素转化而已)则生成 SO2 2x g第二步反应生成 SO3 40 g(冰水只是冷却作用,没跟SO3反应)2SO2+O2==2SO3则有32 g SO2 和16g O2 参与反应第三步反应生...1年前查看全部
- 将CuS,Cu2S在空气中煅烧,都转化为氧化铜和二氧化硫.取等质量的CuS,Cu2S和CuO在空气中充分煅烧,剩余固体残
将CuS,Cu2S在空气中煅烧,都转化为氧化铜和二氧化硫.取等质量的CuS,Cu2S和CuO在空气中充分煅烧,剩余固体残渣的质量分别为W1,W2,W3.求质量关系
 沼泽上的木板1年前3
沼泽上的木板1年前3 -
 水果布丁222 共回答了20个问题
水果布丁222 共回答了20个问题 |采纳率75%生成CuO剩下,所以比较化合物中Cu的质量分数即可.得:W2=W3>W11年前查看全部
- 煅烧粉碎的硫铁矿有利二氧化硫的生成为什么不能用勒沙特列原理解释
 dafwe3321年前1
dafwe3321年前1 -
 cchoonrain 共回答了11个问题
cchoonrain 共回答了11个问题 |采纳率81.8%勒沙特列原理是讲平衡反应的,而硫铁矿燃烧不是一个平衡反应,这个反应很彻底.
粉碎硫铁矿只加速了燃烧过程,没有影响平衡.
另外,通常认为固相的浓度是恒定的,与加入数量无关.因此,即便是一个平衡反应,改变固相的数量和形态通常都不会影响化学平衡.1年前查看全部
- 煅烧石灰石产生石灰的化学方程式方程式是什么?
 hohoye1年前2
hohoye1年前2 -
 醉花缘 共回答了25个问题
醉花缘 共回答了25个问题 |采纳率80%CaCO3=CaO+CO2
即碳酸钙加热分解为氧化钙和二氧化碳1年前查看全部
- ⑴下列属于物理变化的是( )(A)煅烧石灰石 (B)钢铁生锈(C)二氧化碳使澄清石灰水变浑浊 (D)水加热变水蒸气⑵下面
⑴下列属于物理变化的是( )
(A)煅烧石灰石
(B)钢铁生锈
(C)二氧化碳使澄清石灰水变浑浊
(D)水加热变水蒸气
⑵下面属于铁的物理性质的是( )
(A)铁易生锈
(B)铁能被磁铁吸引
(C)铁粉能与硫粉混合燃烧
(D)铁在一定条件下能在氧气中燃烧
⑶下列属于物质的化学性质的是( )
(A)酒精的挥发性 (B)铝的延展性
(C)镁的易折性 (D)二氧化碳能使澄清石灰水变浑浊
⑷下列说法正确的是( )
(A)物理变化中一定伴随着化学变化
(B)化学变化中一定伴随着物理变化
(C)生成沉淀的变化一定是化学变化
(D)有发光发热现象的变化一定是化学变化
⑸下列说法中属于物理变化的是_______________属于化学变化的是_________________属于物理性质的是______________属于化学性质的是____________________
(A)石蜡的可燃性
(B)冰水烧杯外凝结有多少小水滴
(C)镁带燃烧生成白色物质
D)玻璃易打碎 zyqyyf1年前1
zyqyyf1年前1 -
 yk560301 共回答了15个问题
yk560301 共回答了15个问题 |采纳率86.7%DBDB BCDA
第四题不是太肯定,我大三了,忘得差不多了=.=1年前查看全部
- 某石灰厂有一批石灰石原料,为了测定该石灰石的纯度,厂化验室技术员称取6.25g研碎的石灰石粉末,进行四次高温煅烧(杂质没
某石灰厂有一批石灰石原料,为了测定该石灰石的纯度,厂化验室技术员称取6.25g研碎的石灰石粉末,进行四次高温煅烧(杂质没有变化)、冷却、称量剩余固体质量的重复操作,记录数据如下:(提示:碳酸钙在高温下分解,生成氧化钙和二氧化碳气体)
试计算:操作次序 第一次 第二次 第三次 第四次 剩余固体质量 5.55g 4.35g 4.05g 4.05g
(1)完全反应后生成二氧化碳______g;
(2)石灰石样品中碳酸钙的质量分数.
(3)充分煅烧20t这种石灰石,可制得含杂质的生石灰的质量. zhendexiangni11年前1
zhendexiangni11年前1 -
 不知道叫啥名字好 共回答了16个问题
不知道叫啥名字好 共回答了16个问题 |采纳率93.8%解题思路:反应前后固体的质量差即为反应生成二氧化碳的质量,根据二氧化碳的质量可以计算碳酸钙的质量,进一步可以计算石灰石样品中碳酸钙的质量分数;
根据石灰石的质量和碳酸钙的质量分数可以计算制得含杂质的生石灰的质量.(1)完全反应后生成二氧化碳的质量为:6.25g-4.05g=2.2g,
故填:2.2.
(2)设碳酸钙的质量为x,
CaCO3
高温
.
CaO+CO2↑,
10044
x 2.2g
[100/x]=[44/2.2g],
x=5g,
石灰石样品中碳酸钙的质量分数为:[5g/6.25g]×100%=80%,
答:石灰石样品中碳酸钙的质量分数为80%.
(3)设生成二氧化碳的质量为y,
CaCO3
高温
.
CaO+CO2↑,
10044
20t×80% y
[100/20t×80%]=[44/y],
y=7.04t,
充分煅烧20t这种石灰石,可制得含杂质的生石灰的质量为:20t-7.04t=12.96t,
答:充分煅烧20t这种石灰石,可制得含杂质的生石灰的质量为12.96t.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.1年前查看全部
- 请问碳酸钙煅烧和 电解饱和食盐水 反应过陈中有没有化学键变化破坏的?
请问碳酸钙煅烧和 电解饱和食盐水 反应过陈中有没有化学键变化破坏的?
顺便告诉我下怎么看有没有化学键破坏. 多久时间1年前8
多久时间1年前8 -
 得力伙伴 共回答了15个问题
得力伙伴 共回答了15个问题 |采纳率86.7%CaCO3===CaO+CO2 条件:煅烧
2NaCl + 2H2O = 2NaOH + Cl2 + H2 条件:通电
这化学物质发生了化学变化
先有旧化学键的断裂,后有新化学键的形成
所以反应过程中有化学键的破坏
希望这个能帮到你
over~1年前查看全部
- 250吨石灰石煅烧后使碳酸钙完全分解,质量变为151吨 1,该石灰石杂质的质量
 乔楼双双1年前3
乔楼双双1年前3 -
 brenbren 共回答了19个问题
brenbren 共回答了19个问题 |采纳率84.2%M(CO2)=250-151=99吨
设生成99吨需碳酸钙的质量为X
CaCO3== CO2 ↑+ CaO
100 44
X 99t
100/X=44/99t
X=225t
石灰石杂质的质量为250-225=25吨
答:石灰石杂质的质量为25吨1年前查看全部
- 在水中加酚酞,再将煅烧后的石灰石放入其中 酚酞变红色 若先把煅烧后的石灰石放入水中 再加酚酞 现象一样
在水中加酚酞,再将煅烧后的石灰石放入其中 酚酞变红色 若先把煅烧后的石灰石放入水中 再加酚酞 现象一样
哪种操作更科学? 幸兴1年前3
幸兴1年前3 -
 T0T552 共回答了19个问题
T0T552 共回答了19个问题 |采纳率94.7%我认为先在水中加酚酞,再将煅烧后的石灰石放入其中,使酚酞变红,更科学.
因为,先加酚酞,验证了水中原先没有碱性物质,只有把煅烧后的石灰石放入进去后,液体呈现出红色,表明液体为碱性.说明加入的物质与水反应生成Ca(OH)2,进而说明煅烧后的石灰石含有氧化钙,煅烧前的石灰石主要成份为碳酸钙.
若先把煅烧后的石灰石放入水中再加酚酞,只能说明液体为碱性.1年前查看全部
- 工业上高温煅烧石灰石(主要成分是CaCO3)制取CO2.取含杂质20%的石灰石125t进行煅烧,若煅烧一段时间后测得剩余
工业上高温煅烧石灰石(主要成分是CaCO3)制取CO2.取含杂质20%的石灰石125t进行煅烧,若煅烧一段时间后测得剩余固体质量为81t,求产生二氧化碳的质量为多少?(不考虑杂质质量的减少)
 geo81年前1
geo81年前1 -
 我就是欢喜坨 共回答了29个问题
我就是欢喜坨 共回答了29个问题 |采纳率86.2%解题思路:由质量守恒定律,固体物质的减少的质量即生成的二氧化碳质量.由质量守恒定律,固体物质的减少的质量即生成的二氧化碳质量,则产生二氧化碳的质量是125t-81t=44t.
答:生成二氧化碳44g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题难度不大,根据质量守恒定律计算出二氧化碳的质量是简便可行的方法,只要熟练掌握工业制取二氧化碳的反应原理即可明白固体减轻的质量就是生成的二氧化碳的质量.1年前查看全部
- 工业上,高温煅烧石灰石可制的生石灰和二氧化碳,如果要制取5t氧化钙,需要碳酸钙多少吨?需要含CaCO3.80%的石灰石多
工业上,高温煅烧石灰石可制的生石灰和二氧化碳,如果要制取5t氧化钙,需要碳酸钙多少吨?需要含CaCO3.80%的石灰石多少吨?
 木易雪1年前1
木易雪1年前1 -
 jasonwuhan 共回答了18个问题
jasonwuhan 共回答了18个问题 |采纳率94.4%5x100然后除以56再除以0.8等于111.6t1年前查看全部
- 固体AB都有两种相同元素组成A,B中两种元素的原子个数比1:1和1:2将它们高温煅烧,产物均为一种固体和气体二氧化硫.A
固体AB都有两种相同元素组成
A,B中两种元素的原子个数比1:1和1:2将它们高温煅烧,产物均为一种固体和气体二氧化硫.A与B是什麽? 899sfsljk1年前1
899sfsljk1年前1 -
 gaojun_bnu 共回答了18个问题
gaojun_bnu 共回答了18个问题 |采纳率83.3%方法一:根据“固体A和B都由两种相同的元素组成.在A、B中两种元素的原子个数比分别为1/1和1/2”,可从中学所学的组成关系类似的物质中寻找,以缩小范围.A、B可能是FeS和FeS2.方法二:根据“A和B煅烧时都生成C(固体)...1年前查看全部
- 在牙膏和一些药品中,常用轻质碳酸钙粉末作为填充剂或载体.工业上通常将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳[主要
在牙膏和一些药品中,常用轻质碳酸钙粉末作为填充剂或载体.工业上通常将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳[主要成分是Ca(OH)2],然后将净化后的石灰乳与二氧化碳作用得到纯净的碳酸钙粉末.请用化学方程式表示上述反应的原理.
 ip4w1年前2
ip4w1年前2 -
 cnlilang 共回答了21个问题
cnlilang 共回答了21个问题 |采纳率81%解题思路:根据物质的性质进行分析,石灰石高温能分解生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙.碳酸钙高温能分解生成氧化钙和二氧化碳,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙和水,所以本题答案为:CaCO3
高温
.
CaO+CO2↑,
CaO+H2O═Ca(OH)2,CO2+Ca(OH)2═CaCO3↓+H2O.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了常见物质的性质和有关化学方程式的书写,完成此题,可以依据应用的知识进行,要求同学们加强对化学方程式的识记,以便应用.1年前查看全部
- 在牙膏和一些药品中,常用轻质碳酸钙粉末作为填充剂或载体.工业上通常将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳[主要
在牙膏和一些药品中,常用轻质碳酸钙粉末作为填充剂或载体.工业上通常将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳[主要成分是Ca(OH)2],然后将净化后的石灰乳与二氧化碳作用得到纯净的碳酸钙粉末.请用化学方程式表示上述反应的原理.
 会飞的小鼠1年前2
会飞的小鼠1年前2 -
 男人的样子 共回答了17个问题
男人的样子 共回答了17个问题 |采纳率88.2%解题思路:根据物质的性质进行分析,石灰石高温能分解生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙.碳酸钙高温能分解生成氧化钙和二氧化碳,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与二氧化碳反应生成碳酸钙和水,所以本题答案为:CaCO3
高温
.
CaO+CO2↑,
CaO+H2O═Ca(OH)2,CO2+Ca(OH)2═CaCO3↓+H2O.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了常见物质的性质和有关化学方程式的书写,完成此题,可以依据应用的知识进行,要求同学们加强对化学方程式的识记,以便应用.1年前查看全部
- 详解化学题目.要求有步骤. 已知石灰石的主要成分是碳酸钙(CaCO3)还有少量其他杂质.工业上利用高温煅烧石灰石的方法生
详解化学题目.要求有步骤. 已知石灰石的主要成分是碳酸钙(CaCO3)还有少量其他杂质.工业上利用高温煅烧石灰石的方法生产石灰(CaO),同时得到另一种产物CO2(其中杂质不参加反映,回答:1000t石灰石中CaCO3的质量是多少?
能生产石灰的质量是多少? 桦甸1年前1
桦甸1年前1 -
 墨月轩 共回答了22个问题
墨月轩 共回答了22个问题 |采纳率86.4%缺少数据1年前查看全部
- 硫酸工业上大多用接触法制硫酸(设空气中氧气的体积分数为20%),为使黄铁矿煅烧充分,常通入过量40%的空气,将上述炉气经
硫酸工业上大多用接触法制硫酸(设空气中氧气的体积分数为20%),为使黄铁矿煅烧充分,常通入过量40%的空气,将上述炉气经净化除尘后直接送入接触室,气体体积减少了5%(同温同压下测定),试计算SO2的转化率
 端木秋1年前1
端木秋1年前1 -
 testing33333 共回答了18个问题
testing33333 共回答了18个问题 |采纳率94.4%解析:
相关反应方程式:
4FeS2 + 11O2 ―(高温煅烧)→ 2Fe2O3 + 8SO2
2SO2 + O2 =(400℃~500℃,V2O5)= 2SO3 (=表示可逆符号)
通入过量40%的空气,那么氧气也同样过量40%,
则氧气初始计量 = 11 * 1.4 = 15.4,反应掉11体积的O2,剩余4.4体积O2
反应前空气总量 = 15.4 / 0.2 = 77 体积
第一步反应:消耗11体积O2,生成8体积SO2,反应后气体总量 = 77 - 11 + 8 = 74体积
第二步反应:气体体积减少了5%
设反应掉的SO2 体积 为 x,反应掉的O2 体积 为 y,生成的SO3体积 为 z,则有:
2SO2 + O2 =(400℃~500℃,V2O5)= 2SO3 (=表示可逆符号)………… △V
2 1 2 (2+1-2)
x y z 5%
解得:x = 10%,y = 5%,z = 10%
则SO2转化率 = (74*10%)*100% / 8 = 92.5 %1年前查看全部
- 鸡蛋壳的主要成分是碳酸钙,某化学兴趣小组为了测定鸡蛋壳中碳酸钙的质量分数,称取50g样品,磨成粉末后,放在电炉上高温煅烧
鸡蛋壳的主要成分是碳酸钙,某化学兴趣小组为了测定鸡蛋壳中碳酸钙的质量分数,称取50g样品,磨成粉末后,放在电炉上高温煅烧至质量不再发生变化,称量剩余物质量为30.2g.(有关反应的化学方程式为CaCO3
CaO+CO2↑假设鸡蛋壳样品中杂质不参加反应)据此计算:高温 .
(1)生成二氧化碳气体的质量;
(2)此鸡蛋壳样品中碳酸钙的质量分数. 我是分清1年前1
我是分清1年前1 -
 我找不到你了 共回答了19个问题
我找不到你了 共回答了19个问题 |采纳率89.5%解题思路:根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.注意事项有:设未知数不带单位,计算过程中要带单位,结果要带单位.在本题中,分析题目信息和数据可知,减少的质量是二氧化碳的质量,根据二氧化碳的质量可以求出碳酸钙的质量,然后再求碳酸钙的质量分数.(1)生成CO2的质量:50g-30.2g=19.8g
答:生成二氧化碳气体的质量为19.8g.
(2)设50g样品中含CaC03的质量为x
CaCO3
高温
.
CaO+CO2↑
100 44
x19.8g
[100/x=
44
19.8g]
x=45g
[45g/50g]×100%=90%
答:鸡蛋壳样品中碳酸钙的质量分数90%点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本考点考查了根据化学方程式的计算和物质的质量分数,是根据质量守恒定律求气体,记住遇到固体的差求气体.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律在计算题中的应用,本考点主要出现在计算题中.1年前查看全部
- 高温煅烧含碳酸钙80%的石灰石100kg,求碳酸钙完全分解后所得生石灰的纯度
 枕着忧伤入睡1年前1
枕着忧伤入睡1年前1 -
 12gaoyuan 共回答了14个问题
12gaoyuan 共回答了14个问题 |采纳率92.9%据题意可知,碳酸钙在石灰石中的含量是80Kg
CaCO3====CaO+CO2
100 56
80 X
X=44.8 Kg
故碳酸钙完全分解后所得生石灰纯度为:44.8/(44.8+20)=69.1%1年前查看全部
- 氧化铝能高温煅烧生成铝吗?条件是什么?
 -分花拂柳-1年前1
-分花拂柳-1年前1 -
 taopingan 共回答了15个问题
taopingan 共回答了15个问题 |采纳率93.3%不能,要电解氧化铝才能得到单质铝.应为铝离子不容易被还原.1年前查看全部
- (2014•历下区模拟)将150g碳酸钙高温煅烧,一段时间后冷却,测得生成二氧化碳气体22g,则反应后剩余固体中氧元素的
(2014•历下区模拟)将150g碳酸钙高温煅烧,一段时间后冷却,测得生成二氧化碳气体22g,则反应后剩余固体中氧元素的质量是( )
A.8g
B.28g
C.48g
D.56g melodyxiep1年前1
melodyxiep1年前1 -
 我们的二年之约 共回答了28个问题
我们的二年之约 共回答了28个问题 |采纳率89.3%解题思路:根据化学变化前后元素质量不变,可得反应前后固体物质中氧元素的质量相等,反应后固体中氧元素的质量由反应前碳酸钙中所含量氧元素的质量减去二氧化碳中氧元素的质量即可;反应后剩余固体中氧元素的质量:150g×
16×3
100×100%-22g×
16×2
44×100%=56g;
故答案:D点评:
本题考点: 根据化学反应方程式的计算;化合物中某元素的质量计算.
考点点评: 灵活地运用质量守恒定律,对于解答本题尤为重要,.考查了对质量守恒定律的理解与应用1年前查看全部
- 充分煅烧某碳充分煅烧某碳酸镁和碳酸钙混合
充分煅烧某碳充分煅烧某碳酸镁和碳酸钙混合
充分煅烧某碳酸镁和碳酸钙混合物,可得到由两种氧化物组成的固体残留物.固体残留物无损失,经称量知其质量是原混合物质量的一半.求残留物中镁元素与钙元素的最简整数比 x3084293781年前1
x3084293781年前1 -
 荷锄戴月 共回答了17个问题
荷锄戴月 共回答了17个问题 |采纳率82.4%设Mg的物质的量为x(mol),Ca的物质的量为y(mol),得
40x+56y=0.5*(84x+100y)
6y=2x
x:y=3:1 (也是个数比)
碳酸镁失重0.52
碳酸钙0.44
用十字交叉法得碳酸镁:碳酸钙=3:1
镁元素与钙元素的最简整数比=72:40=9:5
这个是质量比1年前查看全部
- 石灰石煅烧制生石灰 的化学式咱写
 穿着草鞋mm1年前1
穿着草鞋mm1年前1 -
 smile_fj530 共回答了20个问题
smile_fj530 共回答了20个问题 |采纳率95%CaCO3(高温)=CaO+CO2(气体) 151年前查看全部
- FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是(acd) a.Ba(NO3)2 b.BaCl2 c.Ba
FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是(acd) a.Ba(NO3)2 b.BaCl2 c.Ba(OH)2 d.溶有NH3的BaCl2溶液
 as_msr1年前2
as_msr1年前2 -
 29962972 共回答了16个问题
29962972 共回答了16个问题 |采纳率93.8%答:其中主要就是考一个知识点:BaSO4不溶于酸和水,而BaSO3不溶于水溶于酸.
a、当SO2进入Ba(NO3)2溶液,其中硝酸根离子和氢离子就可以将亚硫酸根离子氧化成硫酸根离子.就形成硫酸钡沉淀.
b、当SO2进入BaCl2溶液,其中氯离子和氢离子不能氧化亚硫酸根离子.所以不能形成沉淀(酸性条件下).
c、当SO2进入Ba(OH)2溶液,其中SO2与H2O形成亚硫酸与Ba(OH)2 进行反应,然后形成亚硫酸钡和水.亚硫酸钡为沉淀.
d、当SO2进入溶有NH3的BaCl2溶液,其中SO2与H2O形成亚硫酸,与其中的Ba(OH)2(溶有NH3的BaCl2溶液中形成了Ba(OH)2和NH4Cl)反应形成亚硫酸钡和水.亚硫酸钡为沉淀.
以上是我的大概解题过程,希望能够帮助到你.1年前查看全部
- 把100g大理石(杂质不参加反应)高温煅烧一段时间,固体质量减轻22g,把剩下的固体加入到过量的稀盐酸中,又产生气体11
把100g大理石(杂质不参加反应)高温煅烧一段时间,固体质量减轻22g,把剩下的固体加入到过量的稀盐酸中,又产生气体11g,求此大理石中碳酸钙的质量分数.
 牛奶小雨1年前1
牛奶小雨1年前1 -
 vv刀锋 共回答了22个问题
vv刀锋 共回答了22个问题 |采纳率86.4%解题思路:根据题意可以知道所发生的反应为碳酸钙高温分解及碳酸钙和盐酸的反应,依据质量守恒定律及方程式可知碳酸钙和二氧化碳的质量关系,利用关系式可以计算碳酸钙的质量,进而求算出碳酸钙的质量分数.碳酸钙反应共生成二氧化碳33g,设大理石中碳酸钙的质量是x
由CaCO3
高温
.
CaO+CO2↑,CaCO3+2HCl═CaCl2+CO2↑+H2O可知:
CaCO3~CO2
10044
x33g
[100/x]=[44/33g]
x=75g
所以原固体中含碳酸钙的质量分数为:[75g/100g]×100%=75%
答:大理石中碳酸钙的质量分数为75%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题考查学生利用化学反应方程式的计算,根据方程式及物质之间的关系,利用二氧化碳的质量代入计算是关键,同时要熟悉质量分数的计算.1年前查看全部
- 将500g石灰石矿样品高温煅烧,完全分解后测得剩余物为302g,计算该样品中碳酸钙的质量分数.
将500g石灰石矿样品高温煅烧,完全分解后测得剩余物为302g,计算该样品中碳酸钙的质量分数.
(杂质在高温下不发生变化). frog-li1年前1
frog-li1年前1 -
 salt0514 共回答了17个问题
salt0514 共回答了17个问题 |采纳率88.2%解设 碳酸钙的质量为x
CaCO3====Cao+CO2
100 44
x 500g-302g
100/x==44/198
x=450g
碳酸钙的质量分数为450/500*100%=90%1年前查看全部
- 鱼肋骨经过煅烧后,剩余下的是( ),此实验证明骨中含有( ),它与骨的( )有关,这个你知道吗
鱼肋骨经过煅烧后,剩余下的是( ),此实验证明骨中含有( ),它与骨的( )有关,这个你知道吗
鱼肋骨经过煅烧后,剩余下的是( ),此实验证明骨中含有( ),它与骨的( )有关,
这个你知道吗 donghuilei1年前3
donghuilei1年前3 -
 vv辅导员 共回答了19个问题
vv辅导员 共回答了19个问题 |采纳率84.2%鱼肋骨经过煅烧后,剩余下的是(无机盐 ),此实验证明骨中含有(无机物 ),它与骨的( 坚固性)有关,1年前查看全部
- (2005•朝阳区二模)一个地处海边的化工厂按如下步骤进行生产,(1)以煤为燃料煅烧石灰石,(2)用加压降温的方法使产生
(2005•朝阳区二模)一个地处海边的化工厂按如下步骤进行生产,(1)以煤为燃料煅烧石灰石,(2)用加压降温的方法使产生的CO2气体变成雪状的固体,(3)将得到的生石灰与水反应,(4)将海水引入水池中,加入熟石灰,使熟石灰与海水中所含氯化镁发生反应,(5)用盐酸溶解氢氧化镁,再将所得溶液浓缩,得到一种晶体.
(1)该厂用于生产的原料是______.
(2)该厂生产的产品是______.
(3)该厂生产过程中,涉及到的化学反应方程式有:CaCO3
CaO+CO2↑;CaO+H2O=Ca(OH)2 ;Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;2HCl+Mg(OH)2=MgCl2+2H2O.高温 .CaCO3.
CaO+CO2↑;CaO+H2O=Ca(OH)2 ;Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;2HCl+Mg(OH)2=MgCl2+2H2O.高温 . 69051年前0
69051年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 为测定石灰石中碳酸钙的纯度,取一定质量的石灰石(杂质不溶于水,也不与酸反应)高温煅烧一段时间后得78g固体向其中加入40
为测定石灰石中碳酸钙的纯度,取一定质量的石灰石(杂质不溶于水,也不与酸反应)高温煅烧一段时间后得78g固体向其中加入400g质量分数为14.6%的稀盐酸充分反应后发现固体质量不再减少,过滤得一定质量的中性溶液和20g不溶物(滤渣),则原石灰石样品中碳酸钙的纯度为( )
A. 50%
B. 75%
C. 80%
D. 90% 闹静静1年前1
闹静静1年前1 -
 生命痕迹 共回答了14个问题
生命痕迹 共回答了14个问题 |采纳率100%解题思路:石灰石高温锻烧,碳酸钙分解生成氧化钙和二氧化碳,锻烧后固体与盐酸反应,碳酸钙与盐酸反应生成氯化钙、水、二氧化碳而氧化钙与盐酸生成氯化钙和水,且反应后溶液呈中性,说明恰好完全反应,因此,反应后所得溶液一定是氯化钙,其中钙元素质量即石灰石中碳酸钙中钙元素的质量、氯元素质量即所加盐酸中氯元素质量;利用氯化钙中氯元素与钙元素质量关系,可由盐酸中所含氯元素质量求得碳酸钙中钙元素质量,进而计算出碳酸钙的质量,最终根据题意完成原石灰石样品中碳酸钙的纯度的计算.400g质量分数为14.6%的稀盐酸中所含氯元素质量=400g×14.6%×[35.5/36.5]×100%=56.8g
氯化钙中钙元素与氯元素质量比=40:(35.5×2)=40:71,则氯化钙中氯元素质量为56.8g时钙元素质量=[56.8g/71×40=32g
石灰石中碳酸钙的质量=32g÷
40
100]×100%=80g
原石灰石样品中碳酸钙的纯度=[80g/80g+20g]×100%=80%
故选C.点评:
本题考点: 根据化学反应方程式的计算;含杂质物质的化学反应的有关计算.
考点点评: 根据化学变化前后元素质量不变,通过氯化钙中氯元素与钙元素质量关系,建立盐酸与碳酸钙的质量关系,这是解答本题的技巧所在.1年前查看全部
- 煅烧50t含碳酸钙85%的石灰石能得多少二氧化碳
煅烧50t含碳酸钙85%的石灰石能得多少二氧化碳
要花学式和计算过程 荒废二十年1年前3
荒废二十年1年前3 -
 MARGARITA_ICE 共回答了19个问题
MARGARITA_ICE 共回答了19个问题 |采纳率100%50*85%=42.5T
CaCO3=高温=CaO+CO2↑ 碳酸钙分子量 100.09 二氧化碳分子量44.01
42.5*44.1/100.09=18.7t
可以得到18.7吨二氧化碳1年前查看全部
- 高温煅烧石灰石的化学方程式是
 2794840311年前4
2794840311年前4 -
 砸你是看地起你 共回答了18个问题
砸你是看地起你 共回答了18个问题 |采纳率94.4%CaCO3---------->(上面写高温)CaO+O2向上箭头1年前查看全部
- 化学含杂质物质计算今有10t含杂质10%的石灰石,经高温煅烧可生成多少吨含氧化钙为80%的不纯的生石灰
 xiaosi108a1年前2
xiaosi108a1年前2 -
 babylan1985 共回答了3个问题
babylan1985 共回答了3个问题 |采纳率66.7%用关系式法求解CaCO3-------------CaO
100 56
10t*90% x*80%
列比例求解即可 x=6.3t1年前查看全部
- 工业上用高温煅烧石灰石(主要成分CaCO3)可制得生石灰(CaO)和二氧化碳,如果煅烧含杂质百分之5的石灰石100吨,可
工业上用高温煅烧石灰石(主要成分CaCO3)可制得生石灰(CaO)和二氧化碳,如果煅烧含杂质百分之5的石灰石100吨,可得到石灰石多少吨?(提示:CaCO3=CaO+CO3)
 757968041年前1
757968041年前1 -
 cs_skybaotou 共回答了13个问题
cs_skybaotou 共回答了13个问题 |采纳率92.3%可得到生石灰吧?
CaCO3 = CaO + CO2
100 56
100 X 95% x
直接按比例得出生石灰53.2吨.
很简洁的.1年前查看全部
- 用含FeS2 72%的黄铁矿制硫酸,煅烧时有1.5%的硫烧到损失混入炉渣.二氧化硫转化为三氧化硫的转化率97%,求一吨黄
用含FeS2 72%的黄铁矿制硫酸,煅烧时有1.5%的硫烧到损失混入炉渣.二氧化硫转化为三氧化硫的转化率97%,求一吨黄铁矿可产生98%硫酸多少吨?
 心跳乱了节奏1年前4
心跳乱了节奏1年前4 -
 skchenglong 共回答了20个问题
skchenglong 共回答了20个问题 |采纳率95%就是计算最后进入硫酸的硫的重量,进而换算成硫酸就可以了,因为硫元素是守恒的.
1t FeS2含有FeS2 720kg,FeS2中硫元素的质量分数是64/(64+56)=0.5333,所以S元素的质量就是384kg ,损失1.5%那么还剩下384×0.985=378.24kg,在转换三氧化硫的时候转化率是97%,所以这时候能转化成SO3的S的重量就是378.24×0.97=367kg,好了,现在知道变成硫酸的硫元素的质量,进而计算三氧化硫转化的纯硫酸质量:(367/32)×98=1123kg,因为硫酸是98%,所以再除以0.98,得到硫酸重量是1146.54kg
实际上运用守恒是很简单的,我写得很复杂,因为要介绍思想,如果你很熟悉,可以一步写齐所有算式,这样其中数字运算的约分等等能让计算更加简单,元素守恒、质量守恒、电荷守恒、能量守恒等等的应用有时候会让人视野更加开阔,看问题更宏观全面,简化思考和计算过程,十分有用.无论是做题还是研究,这都是很重要的思想和思考方法.1年前查看全部
- 现含有CaCO3质量分数为90%的石灰石100克,高温煅烧至完全反应,计算标准状况下产生二氧化碳多少升?(二氧化碳的密度
现含有CaCO3质量分数为90%的石灰石100克,高温煅烧至完全反应,计算标准状况下产生二氧化碳多少升?(二氧化碳的密度是 1.98克/升)
 1周间1年前1
1周间1年前1 -
 zxc_vbn 共回答了21个问题
zxc_vbn 共回答了21个问题 |采纳率95.2%CaCO3=CaO十CO2
100 44
100*90% x
100/90=44/x
x=39.6g
v=39.6/1.98=20升1年前查看全部
- 1000t含碳酸钙80%的石灰石煅烧后得到的二氧化碳,通入澄清的石灰水中,得到的沉淀质量是多少?
 yingyi0091年前2
yingyi0091年前2 -
 lyf19851006 共回答了19个问题
lyf19851006 共回答了19个问题 |采纳率100%如果按照通入澄清石灰水的CO2全部跟石灰水反应并且没有再次溶解的话,其实就是等于1000x80%=800t,因为煅烧:CaCO3=CaO+CO2,与石灰水:CO2+Ca(OH)2=CaCO3+H2O,也就是一个CaCO3生成一个CO2,一个CO2再与石灰水反应,生成一个CaCO3,所以不变.
不过实际情况不是这样,CaCO3煅烧是不能全部生成CO2和CaO,是可逆反应,还有CO2与澄清石灰水反应也不是这么简单是两个过程CO2+Ca(OH)2=CaCO3+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,那会使得CaCO3沉淀减少,如果想求得较准确的值,还需要知道澄清石灰水的物质百分比,和其他一些数据.1年前查看全部
- 由CaO和CaCO3组成的混合物mg在高温下充分煅烧,所得固体质量是原混合物质量的67%,则原混合物中CaO与CaCO3
由CaO和CaCO3组成的混合物mg在高温下充分煅烧,所得固体质量是原混合物质量的67%,则原混合物中CaO与CaCO3的质量比为多少?
 幸福貝宝1年前3
幸福貝宝1年前3 -
 飞翼hj 共回答了19个问题
飞翼hj 共回答了19个问题 |采纳率94.7%解题思路:根据题干提供的数据结合反应的化学方程式进行分析解答即可.高温煅烧碳酸钙和氧化钙的混合物,会生成二氧化碳,故减少的质量为二氧化碳,其数值为:mg×(1-67%)=0.33mg,
设碳酸钙的质量为x
CaCO3
高温
.
CaO+CO2↑
100 44
x 0.33mg
[100/x=
44
0.33mg] x=0.75mg
故氧化钙的质量为:mg-0.75mg=0.25mg
氧化钙与碳酸钙的质量比为:0.25mg:0.75mg=1:3
答:原混合物中氧化钙与碳酸钙的质量比为1:3.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题考查了根据化学方程式的计算,完成此题,可以依据题干提供的数据结合反应的化学方程式进行.1年前查看全部
大家在问
- 1根据不同的语言环境造句1,琢磨(雕琢、打磨):琢磨(思考):2,沉重(重、分量大):沉重(心情低落):
- 2(2004•闵行区模拟)图表示绳OA下挂着一个重20牛的球.请用力的图示法画出绳对球的拉力T.
- 3屋檐下面要形成冰挂为什么必须气温低于零摄氏度
- 4在△ABC中,AB=AC=10cm,BD是高,且∠ABD=30°,求CD的长(提示:在直角三角形中,如果一个锐角等于30
- 5下列关于保护水资源的说法中正确的是( )
- 61.y=100+0.8Yd,t=0.25,G=200,TR=62.5.I=50.T=ty 求均衡收入是多少?边际税率的成
- 7为什么金属元素没有负价,非金属一般既有负价,又有正价.
- 8【18/5-(5/1+10/3)】*14/15的简算
- 9i think he is ------(funny)of us two
- 10载重100吨的卡车有多长
- 11周记200~300字不要重复的
- 12阅读下面一首宋诗,完成后面的问题。(6分)
- 13牵牛织女北斗星组成句子怎么组
- 14阅读下面语段,完成问题。 苏州园林里都有假山和池沼。假山的堆叠,可以说是一项艺术而不仅是技术。或者是重峦叠嶂,或者是几
- 15一.用and,both...and,neither...nor,not only...but also,as well
