三草酸合铁酸钾晶体K3[Fe(C2O4)3]•3H2O可用于摄影和蓝色印刷.某化学兴趣小组将无水三草酸合铁酸钾按如图所示
 心碎离开112022-10-04 11:39:541条回答
心碎离开112022-10-04 11:39:541条回答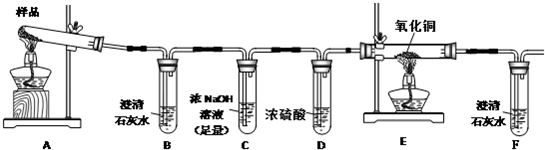
限选试剂:浓硫酸、1.0mol/LHNO3、1.0mol/L盐酸、1.0mol/LNaOH、3% H2O2、0.1mol/LKI、0,1mol/LCuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)若实验中,观察到B、F中溶液均变浑浊,则E中的现象是______,推测三草酸合铁酸钾分解的气体产物是______.
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是______,现象是______.
(3)固体产物中铁元素存在形式的探究.
提出合理假设:假设1:______;假设2:______;假设3:______.
设计实验方案证明你的假设(不要在答题卷上作答)
实验过程
根据上述实验方案进行实验.在答题卷上填写实验步骤、预期现象与结论中的空格.
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解.分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体. | 固体产物部分溶解. |
| 步骤2:向试管中加入适量______溶液,再加入少量不溶固体,充分振荡. | (1)若溶液颜色及加入的不溶固体无明显变化,则假设______成立. (2)若溶液颜色明显改变,且有______色固体生成,则证明有______存在 |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色.取少量固体于试管中,滴加过量______,静置,取上层清液,滴加适量______,充分振荡后滴加______. | 结合步骤2中的(2): (1)若溶液基本无色,则假设______成立 (2)若溶液呈血红色,则假设______成立 |

已提交,审核后显示!提交回复
共1条回复
 南方007 共回答了23个问题
南方007 共回答了23个问题 |采纳率95.7%- 解题思路:(1)二氧化碳能使石灰水变浑浊,一氧化碳还原氧化铜会生成二氧化碳和金属铜;
(2)钾离子的检验可以采用焰色反应的方法;
(3)固体产物中铁元素存在形式的探究:金属铁单质的化合价为零价,氧化亚铁中铁元素化合价为+2价,根据不含有三价铁元素来提出假设;
实验过程:金属铁能从铜盐中置换出金属铜,氧化亚铁能和酸反应生成亚铁盐,亚铁离子具有还原性易被氧化剂氧化,硫氰酸钾可以检验三价铁离子的生成.(1)根据实验现象B中有沉淀出现,则证明有二氧化碳产生,F中溶液均变浑浊,则E中发生一氧化碳还原氧化铜的反应,现象是粉末由黑色变为红色,故答案为:CO和CO2;
(2)钾离子的检验可以采用焰色反应的方法,现象是透过蓝色钴玻璃观察到紫色火焰,故答案为:利用焰色反应;透过蓝色钴玻璃观察到紫色火焰;
(3)根据产物中不含有三价铁元素,所以提出假设:全部为铁单质,或者全部是氧化亚铁,或者是氧化亚铁和金属铁的混合物,故答案为:全部为铁单质;全部为FeO;同时存在铁单质和FeO;
实验过程:根据金属铁能从铜盐中置换出金属铜,可以向混合物中加入硫酸铜溶液,看硫酸铜溶液颜色的变化来确定是否含有金属单质铁,氧化亚铁可以和盐酸反应生成氯化亚铁和水,亚铁离子的检验方法:加入硫氰酸钾溶液,溶液中再加入双氧水来检验,故答案为:CuSO4;2;暗红;铁单质;HCl;KSCN;H2O2;1;3(注意第三小题假设与结论要对应).点评:
本题考点: 物质检验实验方案的设计.
考点点评: 本题是一道实验设计题,考查学生分析和解决问题的能力,综合性较强,难度大. - 1年前
相关推荐
- 三草酸合铁酸钾晶体2K3 [Fe(C2O4 )3]·3H2O受热分解产物
三草酸合铁酸钾晶体2K3 [Fe(C2O4 )3]·3H2O受热分解产物
三草酸合铁酸钾晶体2K3 [Fe(C2O4 )3]·3H2O可用于摄影和蓝色印刷,该物质在一定条件下可以受热分解,分解产物是什么?怎么设计实验来证明 西瓜厉害961年前3
西瓜厉害961年前3 -
 happybaby031626 共回答了15个问题
happybaby031626 共回答了15个问题 |采纳率86.7%CO CO2 K2CO3 Fe FeO H2O1年前查看全部
- (2012•长宁区二模)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,可用于摄影和蓝色印刷.
 (2012•长宁区二模)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(2012•长宁区二模)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)查资料得该晶体在110℃可完全失去结晶水.于是将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;恒温在110℃一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误:______,______.
(2)已知2KMnO4+5H2C2O4+3H2SO4→K2SO4+10CO2↑+2MnSO4+8H2O,现称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液,取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳.向反应后的溶液中加入一小匙锌粉,加热至浅黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.加入锌粉的目的是______.
(3)用0.010mol/L KMnO4溶液滴定上一步骤所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-被还原成Mn2+.写出发生反应的离子方程式______.
(4)上述实验滴定时,指示剂应该______(填“加”或“不加”),如何判断滴定终点:______.
(5)在(2)题步骤中,若加入的KMnO4的溶液的量不足,可导致测得的铁含量______.(选填“偏低”“偏高”“不变”)
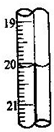
(6)重复(2)(3)步骤操作,滴定消耗0.010mol/L KMnO4溶液19.98ml.则实验测得该晶体中铁的质量分数为______.若蓝色手柄滴定管滴定后读数如右图所示,则以下记录的数据正确的是______
A.20.00mLB.20.0mLC.20.10mLD.20.1mL. scad1年前1
scad1年前1 -
 小杰pp 共回答了24个问题
小杰pp 共回答了24个问题 |采纳率100%解题思路:(1)加热后没有在干燥器中冷却;晶体加热后,没有进行恒重操作;
(2)由(3)操作可知,利用高锰酸钾测定亚铁离子,故加入锌粉的目的是将Fe3+恰好还原成Fe2+,为进一步测定铁元素的含量做准备;
(3)亚铁离子与高锰酸根在酸性条件下反应生成铁离子、锰离子与水,配平书写方程式;
(4)KMnO4溶液本身为紫红色,当待测液中出现紫红色,且振荡后半分钟内不再褪色,就表明到了终点;
(5)加入的KMnO4的溶液的量不足,导致草酸根有剩余,再滴定亚铁离子时,进行与高锰酸钾反应,使的滴定亚铁离子消耗的高锰酸钾的体积偏大;
(6)根据离子方程式计算n(Fe2+),根据元素守恒,利用m=nM计算晶体中铁元素的质量,再根据质量分数定义计算;由图可知,右侧的读数比左侧小0.01,故右侧滴定的读数为20.00mL.(1)实验过程中的两处错误:加热后没有在干燥器中冷却;晶体加热后,没有进行恒重操作,
故答案为:加热后没有在干燥器中冷却;晶体加热后,没有进行恒重操作;
(2)由(3)操作可知,利用高锰酸钾测定亚铁离子,故加入锌粉的目的是将Fe3+恰好还原成Fe2+,为进一步测定铁元素的含量做准备,
故答案为:将Fe3+还原成Fe2+,为进一步测定铁元素的含量做准备;
(3)高锰酸钾在酸性溶液中具有强氧化性能氧化亚铁离子为铁离子,本身被还原为锰离子,发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(4)高锰酸钾溶液为紫红色,可以利用溶液颜色变化来指示反应的终点,不需要指示剂,高锰酸钾溶液呈紫色和亚铁离子反应到恰好反应后滴入最后一滴高锰酸钾溶液紫色半分钟不褪色证明反应终点;
故答案为:不加;当待测液中出现紫红色,且振荡后半分钟内不再褪色,就表明到了终点;
(5)加入的KMnO4的溶液的量不足,导致草酸根有剩余,再滴定亚铁离子时,进行与高锰酸钾反应,使的滴定亚铁离子消耗的高锰酸钾的体积偏大,导致测定的亚铁离子的物质的量偏大,故铁元素的质量偏大,计算测定的铁元素的质量分数偏高,
故答案为:偏高;
(6)再重复(2)、(3)步骤,滴定消耗0.01moL/KMnO4溶液平均体积为19.98mL;
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5mol 1mol
n(Fe2+)0.010×0.01998mol
配制成250moL溶液,取所配溶液25.00moL进行的中和滴定实验,含亚铁离子物质的量n(Fe2+)=5×0.010×0.01998mol,所以250ml溶液中亚铁离子物质的量为:10×5×0.010×0.01998mol,铁的质量分数ω(Fe)=(10×5×0.010×0.01998mol×56 g/mol)÷5.000 g×100%=11.12%;
由图可知,右侧的读数比左侧小0.01,故右侧滴定的读数为20.00mL,故选A,
故答案为:11.12%;A.点评:
本题考点: 配制一定物质的量浓度的溶液;中和滴定.
考点点评: 本题考查较为综合,涉及到溶液的配制、滴定操作的指示剂选择,氧化还原反应的离子方程式的书写,化学方程式的计算,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题.1年前查看全部
- 求化学英文论文(高分)谁能给我篇 英文版的论文 三草酸合铁酸钾(potassium trioxalatoferrate)
求化学英文论文(高分)
谁能给我篇 英文版的论文 三草酸合铁酸钾(potassium trioxalatoferrate)的制备与组成测定,格式标准,有翻译的加分.
我要的是标准的论文,不是实验! dizizuiai1年前1
dizizuiai1年前1 -
 ewrer34 共回答了20个问题
ewrer34 共回答了20个问题 |采纳率85%实验11 三草酸合铁(Ⅲ)酸钾的制备和组成测定
一,实验目的
1.掌握合成K3Fe[(C2O4)3]·3H2O的基本原理和操作技术;
2.加深对铁(Ⅲ)和铁(Ⅱ)化合物性质的了解;
3.掌握容量分析等基本操作.
二,实验原理
本实验以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉淀,然后再用草酸亚铁在草酸钾和草酸的存在下,以过氧化氢为氧化剂,得到铁(Ⅲ)草酸配合物.主要反应为:
改变溶剂极性并加少量盐析剂,可析出绿色单斜晶体纯的三草酸合铁(Ⅲ)酸钾,通过化学分析确定配离子的组成.用KMnO4标准溶液在酸性介质中滴定测得草酸根的含量.Fe3+ 含量可先用过量锌粉将其还原为Fe2+,然后再用KMnO4标准溶液滴定而测得,其反应式为:
5C2O42-+2MnO4-+16H+ ===10CO2↑+2Mn2+ + 8H2O
5Fe2+ + MnO4- +8H+ ===5Fe3+ + Mn2+ + 4H2O
(NH4)2Fe(SO4)2 + H2C2O4 + 2H2O ===FeC2O4·2H2O↓+ (NH4)2SO4 + H2SO4
2FeC2O4·2H2O + H2O2 + 3K2C2O4 + H2C2O4 ===2K3[Fe(C2O4)3]·3H2O
三,实验仪器与试剂
托盘天平,分析天平,抽滤装置,烧杯(100mL),电炉,移液管(25mL),容量瓶(50mL, 100mL),锥形瓶(250mL).
(NH4)2Fe(SO4)2·6H2O,H2SO4(1mol·L-1),H2C2O4(饱和),K2C2O4(饱和),KCl (A. R),KNO3(300g·L-1),乙醇(95%),乙醇—丙酮混合液(1 : 1),K3[Fe(CN)6] (5%),H2O2 (3%).
四,实验步骤
1.三草酸合铁(Ⅲ)酸钾的制备
① 草酸亚铁的制备: 称取5g硫酸亚铁铵固体放在100mL烧杯中,然后加15mL蒸馏水和5~6滴1mol·L-1 H2SO4,加热溶解后,再加入25mL饱和草酸溶液,加热搅拌至沸,然后迅速搅拌片刻,防止飞溅.停止加热,静置.待黄色晶体FeC2O4·2H2O沉淀后倾析,弃去上层清液,加入20mL蒸馏水洗涤晶体,搅拌并温热,静置,弃去上层清液,即得黄色晶体草酸亚铁.
② 三草酸合铁(Ⅲ)酸钾的制备:往草酸亚铁沉淀中,加入饱和K2C2O4溶液10mL,水浴加热313K,恒温下慢慢滴加3%的H2O2溶液20mL,沉淀转为深棕色.边加边搅拌,加完后将溶液加热至沸,然后加入20mL饱和草酸溶液,沉淀立即溶解,溶液转为绿色.趁热过滤,滤液转入100mL烧杯中,加入95%的乙醇25mL,混匀后冷却,可以看到烧杯底部有晶体析出.为了加快结晶速度,可往其中滴加KNO3溶液.晶体完全析出后,抽滤,用乙醇—丙酮的混合液10mL淋洒滤饼,抽干混合液.固体产品置于一表面皿上,置暗处晾干.称重,计算产率.
①KMnO4溶液的标定
准确称取0.13~0.17gNa2C2O4三份,分别置于250mL锥形瓶中,加水50mL使其溶解,加入10mL 3 mol·L-1H2SO4溶液,在水浴上加热到75~85℃,趁热用待标定的KMnO4溶液滴定,开始时滴定速率应慢,待溶液中产生了Mn2+后, 滴定速率可适当加快,但仍须逐滴加入,滴定至溶液呈现微红色并持续30s内不褪色即为终点.根据每份滴定中Na2C2O4的质量和消耗的KMnO4溶液体积,计算出KMnO4溶液的浓度.
2.三草酸合铁酸钾组成的测定
②草酸根含量的测定: 把制得的K3Fe[(C2O4)3]·3H2O在50-60℃于恒温干燥箱中干燥1h,在干燥器中冷却至室温,精确称取样品约0.2-0.3g,放入250mL锥形瓶中,加入25mL水和5mL 1mol·L-1 H2SO4,用标准0.02000 mol·L-1 KMnO4溶液滴定.滴定时先滴入8mL左右的 KMnO4标准溶液,然后加热到343~358K(不高于358K)直至紫红色消失.再用KMnO4滴定热溶液,直至微红色在30s内不消失.记下消耗KMnO4标准溶液的总体积,计算K3Fe[(C2O4)3]·3H2O中草酸根的质量分数 ,并换算成物质的量.滴定后的溶液保留待用.
③铁含量测定: 在上述滴定过草酸根的保留液中加锌粉还原,至黄色消失.加热3min,使Fe3+ 完全转变为Fe2+,抽滤,用温水洗涤沉淀.滤液转入250mL锥形瓶中,再利用KMnO4溶液滴定至微红色,计算K3Fe[(C2O4)3]中铁的质量分数 ,并换算成物质的量.
结论:在1mol产品中含C2O42- mol,Fe3+ mol,该物质的化学式为 .
五,注意事项
1. 水浴40℃下加热,慢慢滴加H2O2.以防止H2O2分解.
2. 减压过滤要规范.尤其注意在抽滤过程中,勿用水冲洗粘附在烧杯和布氏滤斗上的少量绿色产品,否则,将大大影响产量.
Experiment 11 3 ferrous oxalate (Ⅲ) Determination of potassium in the preparation and composition
One purpose of the experiment
1. Grasp synthesis K3Fe [(C2O4) 3] · 3H2O basic principles and operating techniques;
2. Deepen their understanding of iron (Ⅲ) and iron (Ⅱ) compounds understanding of the nature;
3. Master the basic operations such as capacity analysis.
Second, the experimental principle
In this experiment, ferrous ammonium sulfate as raw material, and oxalic acid in acidic solution of ferrous oxalate precipitation was obtained first, and then use potassium oxalate and ferrous oxalate in the presence of oxalic acid, hydrogen peroxide as the oxidant by iron (Ⅲ) oxalate complex. main reaction is:
Change in solvent polarity and add a small amount of salt agents may precipitate the green monoclinic crystals of pure three-ferrous oxalate (Ⅲ) potassium ions by chemical analysis to determine the composition distribution. Standard solution with KMnO4 in acid medium oxalic acid titrated the content of the root. Fe3 + content can be the first to use excessive zinc reduced to Fe2 +, and then use the standard solution of KMnO4 titration and measured, their reaction is:
5C2O42-+2 MnO4-+16 H + === 10CO2 ↑ +2 Mn2 + + 8H2O
5Fe2 + + MnO4-+8 H + === 5Fe3 + + Mn2 + + 4H2O
(NH4) 2Fe (SO4) 2 + H2C2O4 + 2H2O === FeC2O4 · 2H2O ↓ + (NH4) 2SO4 + H2SO4
2FeC2O4 · 2H2O + H2O2 + 3K2C2O4 + H2C2O4 === 2K3 [Fe (C2O4) 3] · 3H2O
Third, experimental equipment and reagents
Pallet scale, analytical balance, filtration devices, beaker (100mL), electric stove, pipette (25mL), volumetric flask (50mL, 100mL), Erlenmeyer flask (250mL).
(NH4) 2Fe (SO4) 2.6 H2O, H2SO4 (1mol · L-1), H2C2O4 (saturated), K2C2O4 (saturated), KCl (A. R), KNO3 (300g · L-1), ethanol (95% ), ethanol - acetone mixture (1: 1), K3 [Fe (CN) 6] (5%), H2O2 (3%).
4, experimental procedures
1. 3 ferrous oxalate (Ⅲ) Preparation of potassium
① Preparation of Ferrous Oxalate: Weigh 5g of solid ammonium ferrous sulfate on the 100mL beaker, then add 15mL of distilled water and 5 to 6 drops of 1mol · L-1 H2SO4, heating dissolved, then add 25mL saturated acid solution, heating and agitating to boiling, then quickly stir a moment, to prevent splashing. stop heating, standing. to be yellow crystals FeC2O4 · 2H2O precipitated decantation, discard supernatant liquid, adding 20mL distilled water crystals, stir and warm, standing, discard supernatant liquid, which was yellow ferrous oxalate crystals.
② Three ferrous oxalate (Ⅲ) Preparation of Potassium: ferrous oxalate to precipitate, by adding saturated K2C2O4 solution 10mL, water bath 313K, constant temperature slowly dropping to 3% H2O2 solution of 20mL, to dark brown precipitate. Edge Bordered stirring, add After the solution was heated to boiling, then add 20mL saturated oxalic acid solution, precipitate immediately dissolved, the solution turns green. hot filtration, the filtrate into 100mL beaker, add 95% ethanol, 25mL, after mixing cooling, you can see the bottom of the beaker and precipitate. In order to accelerate the crystallization rate, which may be dropping to the KNO3 solution. crystal after complete precipitation and filtered, ethanol - acetone mixture of 10mL sprinkling cream cake, drain the mixture. the surface of solid product in a pan, turning the dark to dry. weighing, calculating the yield.
① KMnO4 solution calibration
Weigh accurately 0.13 ~ 0.17gNa2C2O4 three were placed in 250mL conical flask, add 50mL of water to dissolve, adding 10mL 3 mol · L-1H2SO4 solution in a water bath heated to 75 ~ 85 ℃, hot to be calibrated with the KMnO4 titration, titration rate should start slowly, until the solution had a Mn2 +, the titration rate may be appropriate to speed up, but still drops by to join, titration to the solution and continue to 30s showed reddish discoloration shall not end in. According Each titration Na2C2O4 quality and consumption volume of KMnO4 solution, calculate the concentration of KMnO4 solution.
2. 3 ferrous potassium oxalate determination of the composition of
② oxalate content: the system was the K3Fe [(C2O4) 3] · 3H2O at 50-60 ℃ in temperature oven drying 1h, cooled to room temperature in the dryer, accurately weighed sample of about 0.2-0.3g Put 250mL conical flask, add 25mL of water and 5mL 1mol · L-1 H2SO4, with standard 0.02000 mol · L-1 KMnO4 solution titration. titrated around when the first trickle 8mL KMnO4 standard solution, then heated to 343 ~ 358K (not more than 358K) until the purple disappears. then KMnO4 titration hot solution until the reddish does not disappear within in the 30s. note the total consumption volume of standard solution of KMnO4 calculated K3Fe [(C2O4) 3] · 3H2O oxalate root mass fraction, and converted into amount of substance. titration solution retained after the stand-by.
③ Determination of iron content: in the titration of oxalate retention over adding zinc dust reduction solution to the yellow color disappears. Heated 3min, so that the complete transformation of Fe3 + Fe2 +, and filtered, washing with warm water sedimentation. Filtrate into 250mL Erlenmeyer flask , re-use KMnO4 titration to reddish calculated K3Fe [(C2O4) 3] content of iron, and converted into amount of substance.
Conclusion: 1mol products containing C2O42-mol, Fe3 + mol, the substance of the chemical formula.
V. Notes
1. 40 ℃ water bath heating, slowly dropping H2O2. To prevent the H2O2 decomposition.
2. Decompression filter to regulate. Particular attention to the filtration process, do not wash with water in the beaker and Brandt adhesion filter a small amount of green products on the fight, otherwise, it will greatly affect the output.1年前查看全部
- 三草酸合铁酸钾晶体[K 3 Fe(C 2 O 4 ) 3 •xH 2 O]是一种光敏材料,为测定该晶体中草酸根的含量和结
三草酸合铁酸钾晶体[K 3 Fe(C 2 O 4 ) 3 •xH 2 O]是一种光敏材料,为测定该晶体中草酸根的含量和结晶水的含量,某实验小组实验步骤为:
(1)称量9.820g三草酸合铁酸钾晶体,配制成250mL溶液.
(2)取所配溶液25.00mL于锥形瓶中,滴加酸性KMnO 4 溶液至C 2 O 4 2- 全部转化成CO 2 ,同时MnO 4 - 被转化成Mn 2+ ,恰好消耗0.1000mol/LKMnO 4 溶液24.00mL.[K 3 Fe(C 2 O 4 ) 3 的相对分子质量为437]
下列说法正确的是( )A.步骤(2)中KMnO 4 表现还原性 B.配制三草酸合铁酸钾溶液玻璃仪器只需烧杯和玻璃棒 C.样品中结晶水的物质的量为0.03mol D.该晶体的化学式为K 3 Fe(C 2 O 4 ) 3 •3H 2 O  两线之间1年前1
两线之间1年前1 -
 小泉yy的 共回答了18个问题
小泉yy的 共回答了18个问题 |采纳率83.3%A、同时MnO 4 - 被转化成Mn 2+ ,锰元素化合价由+7→+2,化合价降低被还原,作氧化剂,故A错误;
B、需要配制成250mL溶液,必须使用到250容量瓶和胶头滴管,故B错误;
C、高锰酸钾得到电子等于C 2 O 4 2- 失去的电子,n 得 =0.1000mol/L×0.024L×(7-2)=0.012mol;
C 2 O 4 2- 全部转化成CO 2 ,化合价变化+3→+4,根据电子守恒 n(C 2 O 4 2- )=
0.012mol
(2-1)×2 =0.006mol;
250mL原溶液C 2 O 4 2- 的物质的量为0.006mol×10=0.06mol,故n[K 3 Fe(C 2 O 4 ) 3 ]=0.06mol×
1
3 =0.02mol,
9.820g三草酸合铁酸钾晶体中结晶水的质量为:9.820-437×0.02=1.08(g),故n(H 2 O)=
1.08g
18g.mo l -1 =0.06mol,故C错误;
D、根据C项计算结果,0.02molK 3 Fe(C 2 O 4 ) 3 中还有0.06molH 2 O,结晶水数目为3,故该晶体的化学式为K 3 Fe(C 2 O 4 ) 3 •3H 2 O,故D正确;
故选D.1年前查看全部
- 三草酸合铁酸钾测定的时候草酸根测定值偏大,三价铁离子测定值偏小是什么原因?
 dingojo1年前3
dingojo1年前3 -
 mumbumutu 共回答了17个问题
mumbumutu 共回答了17个问题 |采纳率94.1%它们之间本来就可以发生氧化还原反应.1年前查看全部
- 三草酸合铁酸钾的制备实验中,为什么采用标准加入法测定K+含量?
 孙悟空帅呆了1年前1
孙悟空帅呆了1年前1 -
 wisdom_chj 共回答了18个问题
wisdom_chj 共回答了18个问题 |采纳率100%因为三草酸和铁酸钾中有干扰物,所以选用标准加入法1年前查看全部
- 三草酸合铁酸钾晶体K 3 [Fe(C 2 O 4 ) 3 ]•3H 2 O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸
三草酸合铁酸钾晶体K 3 [Fe(C 2 O 4 ) 3 ]•3H 2 O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究.请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程.
限选试剂:浓硫酸、1.0mol•L -1 HNO 3 、1.0mol•L -1 盐酸、1.0mol•L -1 NaOH、3% H 2 O 2 、0.1mol•L -1 KI、0.1mol•L -1 CuSO 4 、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是______.
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K 2 CO 3 .验证固体产物中钾元素存在的方法是______,现象是______.
(3)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:______;假设2:______;假设3:______.
②设计实验方案证明你的假设______
③实验过程
根据②中方案进行实验.在答题卡上按下表的格式写出实验步骤、预期现象与结论.
实验步骤 预期现象与结论 步骤1: ______ 步骤2: ______ 步骤3: ______ …  yyqh1年前1
yyqh1年前1 -
 bi2ci 共回答了24个问题
bi2ci 共回答了24个问题 |采纳率79.2%(1)气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A中澄清石灰水变浑浊,证明有二氧化碳,观察到C中澄清石灰水变浑浊、B中有红色固体生成,则证明有一氧化碳生成,故答...1年前查看全部
- 三草酸合铁酸钾的制备中加完过氧化氢后为何再加入草酸,然后为何要趁热过滤
 qingxianzhang1年前1
qingxianzhang1年前1 -
 阿坷 共回答了17个问题
阿坷 共回答了17个问题 |采纳率94.1%3H2O的基本原理和操作技术; 二、另外它是制备某些活性铁催化剂的主要与草酸在酸性溶液中先制得草酸亚铁1年前查看全部
- (16分)三草酸合铁酸钾晶体(K 3 [Fe(C 2 O 4 ) 3 ]· x H 2 O)是一 种光敏材料,在110℃
(16分)三草酸合铁酸钾晶体(K 3 [Fe(C 2 O 4 ) 3 ]· x H 2 O)是一
 种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H 2 SO 4 酸化,滴加KMnO 4 溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO 4 - 被还原成Mn 2+ 。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO 4 溶液滴定步骤二所得溶液至终点,消耗KMnO 4 溶液20.02ml,滴定中MnO 4 - ,被还原成Mn 2+ 。
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO 4 溶液19.98ml
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是: 称量、__ ▲ _____、转移、洗涤并转移、____ ▲ ____摇匀。
称量、__ ▲ _____、转移、洗涤并转移、____ ▲ ____摇匀。
②加入锌粉的目的是___ ▲ _____。
③写出步骤三中发生反应的离子方程式___ ▲ _____。
④实验测得该晶体中铁的质量分数为_____ ▲ ____。在步骤二中,若加入的KMnO 4 的溶液的量不够,则测得的铁含量___ ▲ ____。(选填“偏低 ”“偏高”“不变”)
”“偏高”“不变”)
(2)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录 质量;计算结晶水含量。请纠正实验过程中的两处错误;___ ▲ _____;_____ ▲ ____。
质量;计算结晶水含量。请纠正实验过程中的两处错误;___ ▲ _____;_____ ▲ ____。 3964079941年前1
3964079941年前1 -
 古木烟灰 共回答了21个问题
古木烟灰 共回答了21个问题 |采纳率90.5%1年前查看全部
- 三草酸合铁酸钾内界和外界分别是什么?
 酒能乱性1年前1
酒能乱性1年前1 -
 一聪虫虫 共回答了14个问题
一聪虫虫 共回答了14个问题 |采纳率85.7%钾是外界,剩下的内界1年前查看全部
- 三草酸合铁酸钾的制备,设计实验方案,定性说明产物中铁离子和草酸根离子是处在配合物外界还是内界?
 HONGYUN20061年前1
HONGYUN20061年前1 -
 sguoz 共回答了22个问题
sguoz 共回答了22个问题 |采纳率77.3%a.检定K+时分别取少量l mol·L-1 K2C2O4及产品溶液,分别与饱和酒石酸氢钠NaHC4H4O6溶液作用.充分摇匀.观察现象是否相同.如果现象不明显,可用玻璃棒摩擦试管内壁.
b.检定C2O42-.在少量l mol·L-1K2C2O4 及产品溶液中.分别加入2滴0.5 mol·L-1
CaCl2溶液,观察现象有何不同.
c.检定Fe3+.在少量0.2 mol·L-1FeCl3及产品溶液中.分别加入1滴l mol·L-1KSCN溶液,观察现象有何不同.
综合以上实验现象.确定所制得的配合物中.哪种离子在内界,哪种离子在外界.1年前查看全部
- 三草酸合铁酸钾用哪一种试剂的用量计算产率?
三草酸合铁酸钾用哪一种试剂的用量计算产率?
自制的(NH4)2SO4.FeSO4.6H2O 5.0g
H2C2O4.2H2O 1.7g
K2C2O4.H2O 3.5g
所得的K3[Fe(C2O4)3].3H2O 有4.50g
可是我算出来K离子的量比较少啊.....如果用Fe离子算是0.01275mol 用K离子算是0.0126mol 爆一爆1年前1
爆一爆1年前1 -
 honolulu813 共回答了17个问题
honolulu813 共回答了17个问题 |采纳率100%这个没有固定的标准,看具体题目的要求了.
一般使用主要反应物或者中心原子所在的反应物,比如FeSO4.6H2O 5.0g.
仅供参考!1年前查看全部
- 三草酸合铁酸钾晶体制备中,k3[Fe(C2O4)3]溶液中存在几种平衡,讨论PH对产品质量影响
 aedk1年前1
aedk1年前1 -
 石林人海只影 共回答了22个问题
石林人海只影 共回答了22个问题 |采纳率81.8%有三个平衡:[Fe(C2O4)3]3-分三级电离的电离平衡;C2O42-水解的水解平衡;Fe3+水解的水解平衡.
当溶液中PH减小时,草酸根与氢离子生成草酸氢根和草酸;当溶液中PH增大时,铁离子会水解成1、2、3羟基合铁;都对质量有影响.1年前查看全部
- 三草酸合铁酸钾加热分解产物是什么?
 a8wbge5b1年前1
a8wbge5b1年前1 -
 布纯再 共回答了21个问题
布纯再 共回答了21个问题 |采纳率85.7%2K3·[Fe(C2O4)3]·3H2O=3K2C2O4 + 2FeC2O4 + 2CO2↑ + 6H2O
加热至100℃时失去全部结晶水,加热至230℃时或者光照分解.1年前查看全部
- 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量,
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量,某实验小组做了如下实验:
(1)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O,现称量5.000g三草酸合铁酸钾晶体,配制成250moL溶液,取所配溶液25.00moL与锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳.向反应后的溶液中加入一小匙锌粉,加热至溶液完全由黄色变为浅绿色时,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍成酸性.加入锌粉的目的是______.
(2)向(1)锥形瓶中先加入足量稀硫酸,后用0.01mol/LKnMO4溶液滴定上一步骤所得的溶液至终点,消耗KMnO4溶液20.02moL,滴定中MnO4−被还原成Mn2+.写出发生反应的离子方程式:______
(3)上述实验滴定时,指示剂应该______(填“加”或“不加”),判断滴定终点的现象是:______
(4)再重复(1)、(2)步骤两次,滴定消耗0.01moL/KMnO4溶液平均体积为19.98moL.计算确定该晶体中铁的质量分数(写出计算过程,结果保留两位小数) sonic11221年前1
sonic11221年前1 -
 414222373 共回答了16个问题
414222373 共回答了16个问题 |采纳率87.5%解题思路:(1)锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
(2)依据氧化还原反应的电子守恒和原子守恒分析,高锰酸钾在酸性溶液中具有强氧化性能氧化亚铁离子为铁离子,本身被还原为锰离子;
(3)依据滴定实验的原理和指示剂选择分析,高锰酸钾溶液为紫红色,滴入高锰酸钾溶液最后一滴紫色不变证明反应到终点;
(4)依据化学方程式或离子方程式计算,注意配制溶液的体积变化;(1)向反应后的溶液中加入一小匙锌粉,加热至溶液完全由黄色变为浅绿色,说明加入锌粉的目的是将Fe3+恰好还原成Fe2+;
故答案为:将Fe3+还原成Fe2+,为进一步测定铁元素的含量做准备;
(2)高锰酸钾在酸性溶液中具有强氧化性能氧化亚铁离子为铁离子,本身被还原为锰离子,发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(3)高锰酸钾溶液为紫红色,可以利用溶液颜色变化来指示反应的终点,不需要指示剂,高锰酸钾溶液呈紫色和亚铁离子反应到恰好反应后滴入最后一滴高锰酸钾溶液紫色半分钟不褪色证明反应终点;
故答案为:不加;当待测液中出现紫红色,且振荡后半分钟内不再褪色,就表明到了终点;
(4)再重复(1)、(2)步骤两次,滴定消耗0.01moL/KMnO4溶液平均体积为19.98mL;
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5mol 1mol
n(Fe2+)0.010×0.01998mol
配制成250moL溶液,取所配溶液25.00moL进行的中和滴定实验,含亚铁离子物质的量n(Fe2+)=5×0.010×0.01998mol:所以250ml溶液中亚铁离子物质的量为:10×5×0.010×0.01998mol:铁的质量分数ω(Fe)=[10×5×0.010×0.01998mol×56 g/mol]÷5.000 g×100%=11.12%;
故答案为:11.12%;点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查较为综合,涉及到溶液的配制、滴定操作的指示剂选择,氧化还原反应的离子方程式的书写,化学方程式的计算,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题.1年前查看全部
- 三草酸合铁酸钾用途和意义
 人强韧1年前1
人强韧1年前1 -
 qingshuijiu 共回答了22个问题
qingshuijiu 共回答了22个问题 |采纳率90.9%实验四十一 三草酸合铁(Ⅲ)酸钾的合成及组成测定
一、实验目的
1. 通过学习三草酸合铁(Ⅲ)酸钾的合成方法,掌握无机制备的一般方法.
2. 学习用 法测定 与Fe3+的原理和方法.
3. 综合训练无机合成、滴定分析的基本操作,掌握确定化合物组成的原理和方法.
二、实验原理
三草酸合铁(Ⅲ)酸钾,即 ,为绿色单斜晶体,溶于水,难溶于乙醇.110℃下失去三分子结晶水而成为 ,230℃时分解.该配合物对光敏感,光照下即发生分解.
三草酸合铁(Ⅲ)酸钾是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂,因而具有工业生产价值.
目前,合成三草酸合铁(Ⅲ)酸钾的工艺路线有多种.例如可以铁为原料制得硫酸亚铁胺,加草酸钾制得草酸亚铁后经氧化制得三草酸合铁(Ⅲ)酸钾;或以硫酸铁与草酸钾为原料直接合成三草酸合铁(Ⅲ)酸钾,亦可以三氯化铁或硫酸铁与草酸钾直接合成三草酸合铁(Ⅲ)酸钾.本实验采用硫酸亚铁加草酸钾形成草酸亚铁经氧化结晶得三草酸合铁(Ⅲ)酸钾,其反应式如下:
用 法测定三草酸合铁(Ⅲ)酸钾中Fe3+含量和 含量,并可确定Fe3+和 的配位比.
在酸性介质中,用 标准溶液滴定试液中的 ,根据 消耗量可直接计算出 的含量,其滴定反应式为:
测铁时,用SnCl3-TiCl3联合还原法,先将Fe3+还原为Fe2+,然后在酸性介质中,用 标准溶液滴定试液中Fe3+和 总量,根据 标准溶液的消耗量,可计算出Fe3+的含量,其滴定反应式为:
最后,根据 ,可确定Fe3+与 的配合比.
三、仪器和试剂
仪器: 托盘天平,分析天平,烧杯(100mL,250mL),量筒(10mL,100mL),长颈漏斗,布氏漏斗,抽滤瓶,表面皿,称量瓶,干燥器,烘箱,锥形瓶(250mL),酸式滴定管(50mL).
试剂: FeSO4(s),1mol·L-1H2SO4溶液,1 mol·L-1H2C2O4溶液,饱和K2C2O4溶液,3%H2O2溶液,MnSO4滴定液,6 mol·L-1HCl溶液,15%SnCl2溶液,2.5%NaWO4溶液,6%TiCl3溶液,0.4%CuSO4溶液,0.01 mol·L-1KMnO4标准溶液(自行配制和标定).
四、实验方法
1. 三草酸合铁(Ⅲ)酸钾的制备
(1) 溶解 在托盘天平上称取4.0gFeSO4·7H2O晶体,放入250mL烧杯中,加入1 mol·L-1H2SO4 1mL,再加入H2O 15mL,加热使其溶解.
(2) 沉淀 在上述溶液中加入1 mol·L-1H2C2O4 20mL,搅拌并加热煮沸,使形成FeC2O4·2H2O黄色沉淀,用倾泻法洗涤该沉淀3次,每次使用25 mLH2O去除可溶性杂质.
(3) 氧化 在上述沉淀中加入10 mL饱和K2C2O4溶液,水浴加热至40℃,滴加3%H2O2溶液20mL,不断搅拌溶液并维持温度在40℃左右,使Fe(Ⅱ)充分氧化为Fe(Ⅲ).滴加完后,加热溶液至沸以去除过量的H2O2.
(4) 生成配合物 保持上述沉淀近沸状态,先加入1 mol·L-1 H2C2O4 7mL,然后趁热滴加1 mol·L-1 H2C2O41~2mL使沉淀溶解,溶液的pH值保持在4~5,此时溶液呈翠绿色,趁热将溶液过滤到一个150mL烧杯中,并使滤液控制在30mL左右,冷却放置过夜、结晶、抽滤至干即得三草酸合铁(Ⅲ)酸钾晶体.称量,计算产率,并将晶体置于干燥器内避光保存.
2. 三草酸合铁(Ⅲ)酸钾组成测定
(1) 称量 称取已干燥的三草酸合铁(Ⅲ)酸钾1~1.5g于250mL小烧杯中,加H2O溶解,定量转移至250mL容量瓶中,稀释至刻度,摇匀,待测.
(2) 的测定 分别从容量瓶中吸取3份25.00mL试液于锥形瓶中,加入MnSO4滴定液5mL及1mol·L-1H2SO4 5mL,加热至75~80℃(即液面冒水蒸气),用0.01 mol·L-1KMnO4标准溶液滴定至淡粉红即为终点,记下KMnO4体积,计算 含量.
(3) Fe3+的测定 分别从容量瓶中吸取3份25.00mL试液于锥形瓶中,加入6 mol·L-1HCl 10mL,加热至70~80℃,此时溶液为深黄色,然后趁热滴加SnCl2至淡黄色,此时大部分Fe3+已被还原为Fe2+,继续加入25% Na2WO4 1mL,滴加TiCl3至溶液出现蓝色,再过量一滴,保证溶液中Fe3+完全被还原.加入0.4%CuSO4溶液2滴作催化剂,加H2O 20mL,冷却振荡直至蓝色褪去,以氧化过量的TiCl3和W(V).
Fe3+还原后,继续加入MnSO4滴定液10mL,用KMnO4滴定约4mL后,加热溶液至75~80℃,随后继续滴定至溶液呈微红即为终点,记下消耗KMnO4体积,计算Fe3+的含量.
五、注意事项
1. 氧化FeC2O4·2H2O时,氧化温度不能太高(保持在40℃),以免H2O2分解,同时需不断搅拌,使Fe2+充分被氧化.
2. 配位过程中,H2C2O4应逐滴加入,并保持在沸点附近,这样使过量草酸分解.
3. KMnO4滴定 时,升温以加快滴定反应速率 ,但温度不能超过85℃,否则草酸易分
4. KMnO4滴定Fe2+或 时,滴定速度不能太快,否则部分KMnO4在热溶液中按下式分
5. MnSO4滴定液不同于MnSO4溶液,它是MnSO4,H2SO4和H3PO4的混合液,其配制方法为:称取45gMnSO4溶于500mL水中,缓慢加入浓H2SO4130mL,再加入浓H3PO4(85%)300mL,加水稀释至1L.
6. 还原Fe3+时,须注意SnCl2的加入量.一般以加入至溶液呈淡黄色为宜,以免过量.
六、思考与讨论
1. 试比较讨论4种制备三草酸合铁(Ⅲ)酸钾工艺路线的优缺点.
2. 如何提高产品的质量?如何提高产量?
3. MnSO4滴定液的作用是什么?
4. SnCl2还原剂加过量后有何影响?怎样补救?
5. 在合成的最后一步能否用蒸干溶液的办法来提高产量?为什么?
6. 根据三草酸合铁(Ⅲ)酸钾的性质,应如何保存该化合物?
附:高锰酸钾标准溶液的配制于标定
一、实验目的
1. 了解并掌握高锰酸钾标准溶液的配制及标定方法.
2. 掌握标定KMnO4溶液浓度的原理、方法及滴定条件.
二、实验原理
KMnO4试剂中常含有少量MnO2和其他杂质,配成的标准溶液易在杂质作用下分解;KMnO4是强氧化剂,易与水中的有机物、空气中的尘埃等还原性物质作用;KMnO4溶液会自行分解.因此,KMnO4标准溶液不能直接配制.
KMnO4的分解速度随溶液的pH值而改变.在中性溶液中分解很慢.Mn2+,MnO2和光照均能加速其分解.因此,配制与保存时必须使溶液保持中性,避光、防尘.这样,KMnO4的浓度就比较稳定,但使用一段时间后仍需要定期标定.
一般用于标定KMnO4溶液浓度的基准物是NaC2O4,因为Na2C2O4不含结晶水,性质稳定、容易提纯、操作简便.Na2C2O4标定KMnO4的反应如下:
标定时,应从温度、酸度及催化剂等方面严格控制反应条件.滴定温度低于60℃,反应速度较慢;超过90℃,草酸按下式分
因此,滴定温度控制在75~85℃为宜.
溶液酸度过低,会有部分 还原为MnO2;酸度过高,会促使H2C2O4分解.由于 离子有一定还原性,可能被 氧化,而HNO3又有一定氧化性,可能干扰 与还原物质的反应,故常用硫酸控制酸度.溶液的酸度约为0.5~1.0mol·L-1.
与 的反应是自动催化反应,反应开始速度较慢,随着反应的进行,不断产生Mn2+,由于Mn2+的催化作用使反应速率加快.因此,滴定速度应先慢后快,尤其是开始滴定时,滴定速度一定要慢,在第一滴KMnO4紫红色没有褪去时,不要加入第二滴KMnO4溶液,否则过多的KMnO4溶液来不及和H2C2O4反应,而在热的酸性溶液中分
KMnO4本身具有紫红色,是“自身”指示剂,因此,在滴定无色或浅色溶液时,不需要另外加指示剂,可利用KMnO4自身的颜色指示滴定终点.
三、试剂和仪器
仪器 台秤,分析天平,酸式滴定管,锥形瓶(250mL),烧杯(100mL),漏斗(6mL),量筒(100mL)棕色试剂瓶(1000mL).
试剂 固体KMnO4(C.P.),Na2C2O4(A.R.或G.R.);3mol·L-1H2SO4
四、实验方法
1. 0.01mol·L-1 KMnO4标准溶液的配制
称取计算量的KMnO4溶于1000mL去离子水中,盖上表面皿,加热至沸并保持20~30min,随时加水补充蒸发损失.冷却后,在暗处放置7~10min天,然后用玻璃棉过滤除去MnO2等杂质.滤液贮于洗净的棕色瓶中,摇匀,放置暗处保存.若溶液煮沸后在水浴上保持1h,冷却后过滤,则不必放置7~10min天,可立即标定其浓度.
2. 0.01mol·L-1 KMnO4标准溶液浓度的标定
准确称取计算量的Na2C2O4 3份于250mL锥形瓶中,加去离子水40mL及10mL3mol·L-1H2SO4,加热至75~85℃(瓶口开始冒热气),趁热用待标定的KMnO4溶液进行滴定,滴定至溶液呈微红色,半分钟内不褪色即为终点.平行测定3次.根据Na2C2O4的质量和消耗KMnO4的体积,计算KMnO4标准溶液的准1年前查看全部
- 三草酸合铁酸钾晶体(K 3 [Fe(C 2 O 4 ) 3 ]·xH 2 O)是一种光敏材料,在110℃可完全失去结晶水
三草酸合铁酸钾晶体(K 3 [Fe(C 2 O 4 ) 3 ]·xH 2 O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1) 铁含量的测定步骤一:称量5.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H 2 SO 4 酸化,滴加KMnO 4 溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO 4 - 被还原成Mn 2+ 。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010 mol/L KMnO 4 溶液滴定步骤二所得溶液至终点,消耗KMnO 4 溶液20.02 mL,滴定中MnO 4 - 被还原成Mn 2+ 。重复步骤二、步骤三操作,滴定消耗0.010 mol/L KMnO 4 溶液19.98 mL。请回答下列问题:
① 配制三草酸合铁酸钾溶液的操作步骤依次是:称量、__________、转移、洗涤并转移、__________、摇匀。
② 加入锌粉的目的是____________________。
③ 写出步骤三中发生反应的离子方程式:____________________________________。
④ 实验测得该晶体中铁的质量分数为__________。在步骤二中,若加入的KMnO 4 溶液的量不够,则测得的铁含量__________。(选填“偏低”、“偏高”、“不变”)
(2) 结晶水的测定将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误:__________________________________________;____________________________________。 zhoucaoj11年前1
zhoucaoj11年前1 -
 天生没蛋踩母鸡 共回答了19个问题
天生没蛋踩母鸡 共回答了19个问题 |采纳率84.2%(1)①溶解;定容②将Fe 3+ 还原为Fe 2+ ③5Fe 2+ +MnO 4 - +8H + = 5Fe 3+ +Mn 2+ +4H 2 O④11.20%或0.112;偏高 (2) 加热后在干燥器中冷却;对盛有样品的坩埚进行多次加热、干燥器中冷却、称量并记录质量,直至称量质量几乎相等1年前查看全部
- 请问“如何提高三草酸合铁酸钾的产率”?
 蓝色安琪儿1年前1
蓝色安琪儿1年前1 -
 eyes-king 共回答了14个问题
eyes-king 共回答了14个问题 |采纳率85.7%三草酸根合铁酸钾制备的反应原理:
一、草酸亚铁的制备
(NH4)2Fe(SO4)2·6H2O + H2C2O4 = FeC2O4·2H2O↓ + (NH4)2SO4 + H2SO4 + 4H2O
二、三草酸根合铁酸钾的制备
FeC2O4·2H2O + 3H2O2 + 6K2C2O4 = 4K3[Fe(C2O4)3] + 2Fe(OH)3↓ + 6H2O
2Fe(OH)3 +3H2C2O4 +3K2C2O4 = 4K3[Fe(C2O4)3] + 6H2O
影响三草酸根合铁酸钾产率的因素:
1、温度:①FeC2O4·2H2O 在冷水中的溶解度较热水中大,所以用冷水洗涤 FeC2O4·2H2O 晶体损失较大; ②H2O2氧化Fe2+过程温度需保持在40℃,温度过高H2O2分解、过低氧化速率过低,都会影响Fe2+的氧化结果,氧化不完全,Fe2+ 会留在 FeC2O4·2H2O 是而降低 Fe3+ 产率.
2、酸度:①用蒸馏水溶解摩尔盐,并加热,这会导致 Fe2+ 过早氧化而不能进入 FeC2O4·2H2O 沉淀,造成损失,所以要用溶解酸性水溶解摩尔盐;② 在第二步加入饱和草酸溶液时,草酸的加入量会影响溶液的 pH 值,pH 过低,生成 K2C2O4 副反应严重,pH 过高,Fe(OH)3 溶解不充分,导致产率下降.
从以上分析可知,实验过程中,严格控制温度和酸度,是提高产率的关键.
以上回答,1年前查看全部
- 三草酸合铁酸钾的综合实验中,草酸跟和三价铁离子的测定值均高于理论值,是什么原因?
三草酸合铁酸钾的综合实验中,草酸跟和三价铁离子的测定值均高于理论值,是什么原因?
我测出来的数据是:w(C2O42-)=54.09%,w(Fe3+)=12.56%,而理论值为:w(C2O42-)=53.75%,w(Fe3+)=11.37% 扛扛1231年前2
扛扛1231年前2 -
 bulgaria 共回答了22个问题
bulgaria 共回答了22个问题 |采纳率100%主要的原因是因为该化合物含有结晶水 2K3·[Fe(C2O4)3]·3H2O,但是你可能干燥过了一些,导致结晶水偏少,铁与草酸的比例自然相应就偏高了.1年前查看全部
- 三草酸合铁酸钾晶体k3[Fe(C3O4)]`3H2O可用于摄影和蓝色印刷.某研究小组将无水三草酸合铁钾在一定条件下加热分
三草酸合铁酸钾晶体k3[Fe(C3O4)]`3H2O可用于摄影和蓝色印刷.某研究小组将无水三草酸合铁钾在一定条件下加热分解后,着手探究所得含碳元素体产物的成分.
1.提出合理假设
假设1 _________ 假设2____________ 假设3:同时含有CO和CO2
2.设计实验方案证明"假设3"成立
3.
根据2中方案进行实验.按下表的格式写出实验步骤、预期现象与结论.
预期现象与结论 youyulangmm1年前1
youyulangmm1年前1 -
 zzr851018 共回答了22个问题
zzr851018 共回答了22个问题 |采纳率86.4%假设1、只有CO
假设2、只有CO2
实验步骤1、将气体通入澄清石灰水,产生沉淀.
步骤2、剩余气体通入NaOH(除CO2),浓H2SO4(除水蒸气),一个有CuO的大试管,下面加热,后面接一个澄清石灰水,最后面导管接燃着的酒精灯.
结果CuO变红,后一个澄清石灰水变浑浊.1年前查看全部
- 三草酸合铁酸钾晶体K3[Fe(C2O4)3]•3H2O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸钾在一定条件
三草酸合铁酸钾晶体K3[Fe(C2O4)3]•3H2O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸钾在一定条件
下加热分解,对所得气体产物和固体产物进行实验和探究.该小组同学查阅资料知,固体产物中铁元素不可能以三价形式存在,而盐只有K2CO3,产生的气体中含有CO、CO2.
限选试剂:①蒸馏水②3%H2O2溶液③氧化铜④1.0mol•L-1盐酸⑤浓硫酸⑥1.0mol•L-1NaOH溶液⑦澄清石灰水⑧0.5mol•L-1CuSO4溶液⑨2%KSCN溶液⑩苯酚溶液
Ⅰ.若用一套连续实验装置检验气体产物中CO的存在,并验证检验过程中有CO2生成,应选用的试剂为(按先后顺序把所选试剂的标号填入空格内):⑥→⑦______→______→______.
Ⅱ.探究固体产物中铁元素的存在形式.
(1)提出合理假设
假设1:只有Fe;假设2:只有FeO;假设3:含有Fe和FeO
(2)设计实验方案并实验验证:
(3)问题讨论实验步骤 预期现象和结论 步骤1:取适量固体产物于试管中,加入足量蒸馏水溶解,过滤,分离出不溶固体 步骤2:取少量上述不溶固体放入试管中,加入足量CuSO4溶液,充分振荡. 若固体无明显变化,则假设
______成立,若有暗红色固体生成,则反应的离子方程式为______.步骤3:
______若溶液基本无色,则假设Ⅰ成立,若溶液呈浅绿色,则假设3成立
若固体产物中FeO含量较少,用步骤3方法难以确定.请你设计实验方案证明假设3成立(写出实验的操作步骤、现象与结论):______.
Ⅲ.定量探究
取受热后所得固体于试管中,加入足量蒸馏水,过滤、洗涤、干燥得到黑色粉末,取4.4g黑色粉末溶与足量稀硝酸中,收集到标准状况下NO1.12L,通过计算判断黑色粉末的成分为______(填化学式).写出黑色粉末溶于足量稀硝酸发生反应的离子方程式______. sunny801271年前1
sunny801271年前1 -
 半杯咖啡boy 共回答了21个问题
半杯咖啡boy 共回答了21个问题 |采纳率90.5%解题思路:Ⅰ.检验产生的气体中产生的气体中含有CO,应该先通过氢氧化钠溶液除去二氧化碳,再利用澄清石灰水检验二氧化碳已经除尽,然后用氧化铜将Co转化成二氧化碳,再通过澄清石灰水检验有二氧化碳生成,从而得出产生的气体中含有CO,据此选出试剂并进行排序;
Ⅱ.(2)用过量硫酸铜溶液检验金属铁的存在情况;由于硫酸铜过量,铁完全反应,利用盐酸溶解骤2所得暗红色固体,根据反应现象判断铁元素的存在形式;
(3)根据检验亚铁离子的方法判断是否存在氧化亚铁;
Ⅲ.先根据n=
计算出NO的物质的量,再根据化合价变化计算出生成一氧化氮转移的电子的物质的量,然后利用极值法和电子守恒判断4.4g固体的组成,最后写出反应的离子方程式.V Vm Ⅰ.将气体产物通过⑥1.0 mol•L-1NaOH溶液除去二氧化碳,然后通过⑦澄淸石灰水,证明二氧化碳已经除尽,再用⑤浓硫酸干燥气体,将干燥的气体通入灼热的③氧化铜,试管中有红色物质生成,同时生成了能够使⑦澄淸石灰水变浑浊的气体,证明原氧气中有一氧化碳,所以加入试剂的顺序为:⑥⑦⑤③⑦,
故答案为:⑤③⑦;
Ⅱ.(2)步骤2.金属铁不溶于水中,但是可以和硫酸铜发生置换反应,生成金属铜和硫酸亚铁,所以取少置上述不溶固体放入试管中,加入足量CuSO4溶液,若蓝色溶液颜色及加入的固体无明显变化,则假设2成立;若蓝色溶液颜色明显改变,且有暗红色固体生成,则证明有铁单质存在,发生反应的离子方程式为:Fe+Cu2+=Cu+Fe2+,
故答案为:2;Fe+Cu2+=Cu+Fe2+;
步骤3.氧化亚铁不溶于水,可以和盐酸反应生成氯化冶铁和水,可以检验亚铁离子的存在进而确定氧化亚铁的存在,方法为:取取步骤2所得暗红色固体于试管中,滴加过量HCl,静置,振荡后静置;若溶液基本无色,则假设1成立;若溶液呈浅绿色,则证明假设3成立,
故答案为:取取步骤2所得暗红色固体于试管中,滴加过量HCl,静置,振荡后静置;
(3)可以所以硫酸氢钾溶液和双氧水检验步骤3中是否存在亚铁离子,方法为:取步骤3静置后的上层溶液,滴加几滴硫氰化钾溶液无红色出现,再滴加1-2滴双氧水,充分振荡,若溶液变红,则证明假设3成立,
故答案为:取步骤3静置后的上层溶液,滴加几滴硫氰化钾溶液无红色出现,再滴加1-2滴双氧水,充分振荡,若溶液变红,则证明假设3成立;
Ⅲ.标况下1.12L一氧化氮的物质的量为:n(NO)=[1.12L/2.24L/mol]=0.05mol,生成0.05mol电子需要转移的电子的物质的量为:(5-2)×0.05mol=0.15mol,根据电子守恒,如果固体完全为铁,则固体的质量为:56gmol×[0.15mol/3]=2.8g;
如果固体为FeO,则固体的质量为:72g/mol×[0.15mol/3−2]=10.8g,
所以4.4g为Fe和FeO的混合物,
Fe与硝酸反应的离子方程式为:3FeO+NO3-+10H+═3Fe3++5H2O+NO↑,
FeO与硝酸反应的离子方程式为:Fe+NO3-+4H+═Fe3++2H2O+NO↑,
故答案为:Fe和FeO;3FeO+NO3-+10H+═3Fe3++5H2O+NO↑、Fe+NO3-+4H+═Fe3++2H2O+NO↑.点评:
本题考点: 性质实验方案的设计.
考点点评: 本题考查物质性质实验方案的设计,涉及了元素及其化合物性质、离子方程式书写等知识,题目难度较大,试题知识点较大,综合性较强,是一道质量较好的题目,有利于提高学生运用所学知识的能力及化学实验能力.1年前查看全部
- (2011•四川)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,在110℃可完全失去结晶水.
(2011•四川)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中计入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL滴定中MnO4-被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是:称量、______、转移、洗涤并转移、______摇匀.
②加入锌粉的目的是______.
③写出步骤三中发生反应的离子方程式______.
④实验测得该晶体中铁的质量分数为______.在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量______.(选填“偏低”“偏高”“不变”)
(2)结晶水的测定
加热晶体,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误;______;______. xiaokui12311年前1
xiaokui12311年前1 -
 lyangi1004 共回答了20个问题
lyangi1004 共回答了20个问题 |采纳率90%解题思路:(1)①根据配制一定物质的量浓度的溶液的操作步骤判断:在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
②锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
③根据物质的性质和书写离子方程式的有关要求书写离子方程式;
④根据离子方程式计算,n(Fe)=5n(MnO4-)=5×[20.02mL+19.98mL/2]×0.01 mol•L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g•mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数=[0.56g/5g]×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.
(2)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g.(1)①在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤,故答案为:溶解;定容;
②加入锌粉的目的是将Fe3+恰好还原成Fe2+,故答案为:将Fe3+恰好还原成Fe2+;
③在步骤三中发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
④根据步骤三中的离子反应可知:n(Fe)=5n(MnO4-)=5×[20.02mL+19.98mL/2]×0.01 mol•L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g•mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数=[0.56g/5g]×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.故答案为:11.2%;偏高;
(2)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g,故答案为:加热后的晶体要在干燥器中冷却; 两次称量质量差不超过0.1 g.点评:
本题考点: 探究物质的组成或测量物质的含量;氧化还原反应;溶液的配制.
考点点评: 本题考查较为综合,涉及到溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题.1年前查看全部
- 三草酸合铁酸钾的制备时,水浴加热为什么要控制在40摄氏度左右
 2aflnb61年前1
2aflnb61年前1 -
 fly8632902 共回答了15个问题
fly8632902 共回答了15个问题 |采纳率86.7%硫酸亚铁加草酸钾形成草酸亚铁经氧化结晶得三草酸合铁(Ⅲ)酸钾
温度过高,硫酸亚铁易氧化为硫酸铁,同时,温度过高了,硫酸亚铁加速水解,形成胶体,不利于反应的进一步进行1年前查看全部
- 三草酸合铁酸钾分解产物为什么没有+3价铁
 地狱PK天使1年前1
地狱PK天使1年前1 -
 8643 共回答了19个问题
8643 共回答了19个问题 |采纳率94.7%因为草酸根是一个很典型的还原性离子,
分解时,Fe3+被C2O42-还原为Fe2+了.
分解产物是K2C2O4、FeC2O4、CO2
三草酸合铁酸钾晶体,由于特殊的结构,使得Fe3+能与C2O42-同时存在1年前查看全部
- (2013•合肥二模)三草酸合铁酸钾晶体K3[Fe(C2O4)3•3H2O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸
(2013•合肥二模)三草酸合铁酸钾晶体K3[Fe(C2O4)3•3H2O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究.该小组同学查阅资料知,固体产物中铁元素不可能以三价形式存在,而盐只有 K2CO3,产生的气体中含有CO CO2
请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程.
限选试剂:①蒸馏水②3% H2O2溶液③氧化铜④1.0 mol•L-1盐酸 ⑤浓硫酸⑥1.0 mol•L-1 NaOH溶液⑦澄淸石灰水 ⑧0.5mol•L-1CuSO4溶液⑨2%KSCN溶液⑩苯酚溶液
Ⅰ.若用一套连续实验装置检验气体产物中CO的存在,并验证检验过程中有CO2生成,应选用的试剂为(按先后顺序把所选试剂的标号填入空格内)______.
Ⅱ.探究固体产物中铁元素的存在形式.
(1)提出合理假设
假设1:只有Fe;
假设2:只有FeO;
假设3:______.
(2)设计实验方案并实验验证:
步骤1:取通量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体.
步骤2;取少置上述不溶固体放入试管中,加入足量______溶液,充分振荡.若固体无明显变化,则假设______成立;若有暗红色固体生成,则反应的离子方程式为______.
步骤3;取步骤2所得暗红色固体于试管中,滴加过量______,振荡后静置.若溶液基本无色,则假设______成立;若溶液呈______,则假设3成立.
(3)问题讨论
若固体产物中FeO含量较少,用步骤3方法难以确定.请你设计实验方案证明假设3成立(写出实验的操作步骤、现象与结论):______
Ⅲ.拓展与延伸.有资料介绍“在含Fe2+的溶液中,先滴加少量新制饱和氯水,然后滴加KSCN溶液,溶液呈红色;若再滴加过量氯水,却发现红色褪去”.假设溶液中的+3价铁还能被氯水氧化为更高价的FeO42-,试写出该反应的离子方程式______. 幽灵的礼物1年前1
幽灵的礼物1年前1 -
 愤怒的大地 共回答了11个问题
愤怒的大地 共回答了11个问题 |采纳率81.8%解题思路:Ⅰ.检验产生的气体中产生的气体中含有CO、CO2,应该先通过澄清石灰水检验二氧化碳,然后通过还原氧化铜检验一氧化碳,据此选出试剂并进行排序;
将气体产物依次通过⑦澄淸石灰水、⑥1.0 mol•L-1 NaOH溶液、⑤浓硫酸、③氧化铜、⑦澄淸石灰水,观察到澄清石灰水都变浑浊,③中有红色固体生成;
Ⅱ.(1)依据信息:固体产物中,铁元素不可能以三价形式存在,可推测铁元素只能以亚铁及铁单质的形式存在;
(2)用过量硫酸铜溶液检验金属铁的存在情况;由于硫酸铜过量,铁完全反应,利用盐酸溶解骤2所得暗红色固体,根据反应现象判断铁元素的存在形式;
(3)根据检验亚铁离子的方法判断是否存在氧化亚铁;
Ⅲ.根据反应为铁离子和氯气,生成物FeO42-写出反应的离子方程式.Ⅰ.将气体产物依次通过⑦澄淸石灰水,石灰水变浑浊,证明产物中有 二氧化碳,然后通过⑥1.0 mol•L-1 NaOH溶液除去二氧化碳,再用⑤浓硫酸干燥气体,将干燥的气体通入灼热的③氧化铜,试管中有红色物质生成,同时生成了能够使⑦澄淸石灰水变浑浊的气体,证明原氧气中有一氧化碳,所以加入试剂的顺序为:⑦⑥⑤③⑦,
故答案为:⑦⑥⑤③⑦;
Ⅱ.(1)根据题意“固体产物中,铁元素不可能以三价形式存在”,所以存在的可能是零价铁或亚铁,可能情况有三种:只有Fe;只有FeO;含有Fe和FeO,
故答案为:含有Fe和FeO;
(2)步骤2.金属铁不溶于水中,但是可以和硫酸铜发生置换反应,生成金属铜和硫酸亚铁,所以取少置上述不溶固体放入试管中,加入足量CuSO4溶液,若蓝色溶液颜色及加入的不溶固体无明显变化,则假设2成立;若蓝色溶液颜色明显改变,且有暗红色固体生成,则证明有铁单质存在,发生反应的离子方程式为:Fe+Cu2+=Cu+Fe2+,
故答案为:CuSO4;2;Fe+Cu2+=Cu+Fe2+;
步骤3.氧化亚铁不溶于水,可以和盐酸反应生成氯化冶铁和水,可以检验亚铁离子的存在进而确定氧化亚铁的存在,方法为:取取步骤2所得暗红色固体于试管中,滴加过量HCl,静置,振荡后静置.若溶液基本无色,则假设1成立;若溶液呈浅绿色,则证明假设3成立,
故答案为:HCl;1;浅绿色;
(3)可以所以硫酸氢钾溶液和双氧水检验步骤3中是否存在亚铁离子,方法为:取步骤3静置后的上层溶液,滴加几滴硫氰化钾溶液无红色出现,再滴加1-2滴双氧水,充分振荡,若溶液变红,则证明假设3成立,
故答案为:取步骤3静置后的上层溶液,滴加几滴硫氰化钾溶液无红色出现,再滴加1-2滴双氧水,充分振荡,若溶液变红,则证明假设3成立;
Ⅲ.根据信息可知,铁离子被氯气氧化成FeO42-,根据化合价升降相等配平,配平后的离子方程式为:2Fe3++8H2O+3Cl2=2FeO42-+16H++6Cl-,
故答案为:2Fe3++8H2O+3Cl2=2FeO42-+16H++6Cl-.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查学生对元素及其化合物性质的掌握、对物质进行检验的实验技能,题目难度较大,有利于提高学生运用相关知识对实验提出假设及设计方案的能力.1年前查看全部
- 化学实验报告我用的书是 大学基础化学实验(I)第二版 方国女/王燕 有个综合实验报告是三草酸合铁酸钾的合成,谁能给我发个
化学实验报告
我用的书是 大学基础化学实验(I)第二版 方国女/王燕 有个综合实验报告是三草酸合铁酸钾的合成,谁能给我发个实验报告啊,部分也行,如原理等,越细越好, louyiesly1年前1
louyiesly1年前1 -
 savvyme 共回答了20个问题
savvyme 共回答了20个问题 |采纳率80%自己动手,丰衣足食1年前查看全部
- 如何计算三草酸合铁酸钾产率取了5g(NH4)2Fe(SO4)2,产品4.1g,求产率
 万水千山只等娴1年前1
万水千山只等娴1年前1 -
 wt44ds 共回答了18个问题
wt44ds 共回答了18个问题 |采纳率88.9%产率=(实际产量/理论产量)*100%
用你给的数据时计算不出来的.1年前查看全部
- 三草酸合铁酸钾制备最后为什么加乙醇
 skydreams19791年前1
skydreams19791年前1 -
 poxukong 共回答了16个问题
poxukong 共回答了16个问题 |采纳率100%加入乙醇使得产物的溶解度减小 ,杂质的溶解度增大,目的是提纯产物,增大产率.1年前查看全部
- 三草酸合铁酸钾的制备中滴加硝酸钾起到什么作用
 家有9凤1年前1
家有9凤1年前1 -
 wangyulaory 共回答了27个问题
wangyulaory 共回答了27个问题 |采纳率92.6%三草酸合铁酸钾最后的析出,是通过以下反应进行的:
Fe3+ + 3C2O42- = [Fe(C2O4)3]3-
3K+ + [Fe(C2O4)3]3- = K3[Fe(C2O4)3]
一由于 K3[Fe(C2O4)3] 在水中有不可忽视的溶解度,二由于 Fe3+、C2O42-、[Fe(C2O4)3]3-、
K+ 在水中是溶剂化的,这对 Fe3+ 与 C2O42- 结合成 [Fe(C2O4)3]3- 及 K+ 与 [Fe(C2O4)3]3- 结合成 K3[Fe(C2O4)3] 是不利的.实验中,通过加乙醇和硝酸钾来促进 K3[Fe(C2O4)3] 的结晶析出.乙醇的作用是减小溶剂的极性,以减小三草酸合铁酸钾的溶解性;硝酸钾是充当盐析剂的,其作用:
① 通过 K+ 和 NO3- 的强溶剂化作用,与原有离子争夺溶剂化水,同时也减少未溶剂化水分子数,使可参与原有离子的溶剂化的水分子减少;
② 由于溶剂化作用等原因,使水的介电常数减低,从而有利于异性离子间的结合.
③ K+ 同离子效应的存在有利于 K3[Fe(C2O4)3] 结晶的析出.1年前查看全部
- 三草酸合铁酸钾的溶解度是多少
 cifn1_67_ma56ee1年前1
cifn1_67_ma56ee1年前1 -
 八神我最狂 共回答了8个问题
八神我最狂 共回答了8个问题 |采纳率100%三草酸合铁(Ⅲ)酸钾溶于水,0℃时,4.7g-100g水;100℃时117.7-100g水1年前查看全部
- 三草酸合铁酸钾的光敏性有何应用三草酸合铁酸钾具有光敏性 请问这一性质有何实际应用?
 爬树看月亮511年前1
爬树看月亮511年前1 -
 xiaorian 共回答了22个问题
xiaorian 共回答了22个问题 |采纳率95.5%三草酸合铁(Ⅲ)酸钾是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂,因而具有工业生产价值.1年前查看全部
- 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中计入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL滴定中MnO4-被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是:称量、______、转移、洗涤并转移、______摇匀.
②加入锌粉的目的是______.
③写出步骤三中发生反应的离子方程式______.
④实验测得该晶体中铁的质量分数为______.在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量______.(选填“偏低”“偏高”“不变”)
(2)结晶水的测定
加热晶体,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误;______;______. whl45871年前1
whl45871年前1 -
 天妒我才2006 共回答了20个问题
天妒我才2006 共回答了20个问题 |采纳率90%解题思路:(1)①根据配制一定物质的量浓度的溶液的操作步骤判断:在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
②锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
③根据物质的性质和书写离子方程式的有关要求书写离子方程式;
④根据离子方程式计算,n(Fe)=5n(MnO4-)=5×[20.02mL+19.98mL/2]×0.01 mol•L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g•mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数=[0.56g/5g]×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.
(2)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g.(1)①在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤,故答案为:溶解;定容;
②加入锌粉的目的是将Fe3+恰好还原成Fe2+,故答案为:将Fe3+恰好还原成Fe2+;
③在步骤三中发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
④根据步骤三中的离子反应可知:n(Fe)=5n(MnO4-)=5×[20.02mL+19.98mL/2]×0.01 mol•L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g•mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数=[0.56g/5g]×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.故答案为:11.2%;偏高;
(2)加热后的晶体要在干燥器中冷却,防止重新吸收空气中的水分.另外在加热时至少要称量两次质量差,到两次称量质量差不超过0.1 g,故答案为:加热后的晶体要在干燥器中冷却; 两次称量质量差不超过0.1 g.点评:
本题考点: 探究物质的组成或测量物质的含量;氧化还原反应;溶液的配制.
考点点评: 本题考查较为综合,涉及到溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题.1年前查看全部
- 采用饱和酒石酸氢钠检验三草酸合铁酸钾中钾是否外界的原理是
 vv老顽童1年前1
vv老顽童1年前1 -
 jy129687 共回答了16个问题
jy129687 共回答了16个问题 |采纳率87.5%如果钾是外界,在三草酸和铁酸钾的溶液中就处于游离态,这是加入饱和酒石酸氢钠就能与钾离子反应生成酒石酸钾钠;如果钾是内界,该反应就不能发生1年前查看全部
- (2013•连云港一模)K3[Fe(C2O4)3]•3H2O(三草酸合铁酸钾晶体)是制备负载型活性铁催化剂的主要原料.实
(2013•连云港一模)K3[Fe(C2O4)3]•3H2O(三草酸合铁酸钾晶体)是制备负载型活性铁催化剂的主要原料.实验室利用(NH4)2Fe(SO4)2•6H2O(硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、双氧水等为原料制备三草酸合铁酸钾晶体的部分实验过程如下:

反应的原理为:
沉淀:(NH4)2Fe(SO4)2•6H2O+H2C2O4═FeC2O4•2H2O↓+(NH4)2SO4+H2SO4+4H2O
氧化:6FeC2O4+3H2O2+6K2C2O4═4K3[Fe(C2O4)3]+2Fe(OH)3
转化:2Fe(OH)3+3H2C2O4+3K2C2O4═2K3[Fe(C2O4)3]+6H2O
(1)溶解的过程中要加入几滴稀硫酸,目的是______.
(2)沉淀过滤后,用蒸馏水洗涤,检验洗涤是否完全的方法是______.
(3)在沉淀中加入饱和K2C2O4溶液,并用40℃左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌.此过程需保持温度在40℃左右,可能的原因是______.
(4)为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根离子恰好全部氧化成二氧化碳.向反应后的溶液中加入足量锌粉,加热至黄色消失.然后过滤、洗涤,将滤液及洗涤液一并转入锥形瓶,此时溶液仍呈酸性.
步骤三:用标准KMnO4溶液滴定步骤二所得溶液至终点,记录消耗KMnO4溶液的体积(滴定中MnO4−被还原成Mn2+).
步骤四:….
步骤五:计算,得出结论.
请回答下列问题:
①步骤一中需要用到的玻璃仪器有烧杯、量筒、玻璃棒、______、______.
②步骤二中若加入KMnO4的量不足,则测得铁含量______(填“偏低”“偏高”或“不变”);加入锌粉的目的是______.
③写出步骤三中发生反应的离子方程式:______.
④请补充步骤四的操作:______. liyt10101年前1
liyt10101年前1 -
 oldpigon 共回答了17个问题
oldpigon 共回答了17个问题 |采纳率76.5%解题思路:(1)亚铁离子在水溶液中水解,加入稀硫酸抑制水解;
(2)沉淀过滤后,用蒸馏水洗涤,检验洗涤是否完全的方法是检验硫酸根的存在,依据硫酸根离子检验方法检验;
(3)温度较高时,H2O2分解;
(4)①根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
②若在步骤2中滴入酸性高锰酸钾溶液不足,则会有部分草酸根未被氧化,在步骤3中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多;
根据锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+全部还原成Fe2+;
③根据物质的性质和书写离子方程式的要求来分析;
④为准确测定需要重复进行实验操作.(1)溶解的过程中要加入几滴稀硫酸,目的是亚铁离子在水溶液中水解,加入稀硫酸抑制水解,故答案为:抑制Fe2+水解;
(2)淀过滤后,用蒸馏水洗涤,检验洗涤是否完全的方法是,取最后一次洗涤液少许于试管中,滴入氯化钡溶液,无白色沉淀,则洗涤完全,否则不完全,
故答案为:取最后一次洗涤液少许于试管中,滴入氯化钡溶液,无白色沉淀,则洗涤完全,否则不完全;
(3)温度较高时,H2O2分解,加6%的H2O2时,温度不能过高,温度过低反应速率小,故答案为:温度太高双氧水容易分解或温度太低反应速率太慢等;
(4)①配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
故答案为:250ml容量瓶;胶头滴管;
②若在步骤2中滴入酸性高锰酸钾溶液不足,则会有部分草酸根未被氧化,在步骤3中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高,加入锌粉的目的是将Fe3+全部还原成Fe2+,故答案为:偏高;将Fe3+全部还原成Fe2+;
③MnO4-能氧化Fe2+得到Fe3+和Mn2+,在步骤3中发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
④测定实验需要重复进行几次去几次的平均值,避免实验误差的产生;需要重复步骤二、步骤三操作1~2次,故答案为:重复步骤二、步骤三操作1~2次.点评:
本题考点: 铁的氧化物和氢氧化物;探究物质的组成或测量物质的含量.
考点点评: 本题主要考查溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题.1年前查看全部
- 三草酸合铁酸钾如何测草酸根含量
 rebecca9251年前1
rebecca9251年前1 -
 苍耳刺 共回答了10个问题
苍耳刺 共回答了10个问题 |采纳率90%1.制备三草酸根合铁(III)酸钾
称取6克草酸钾置于100mL烧杯中,注入10mL蒸馏水,加热,使草酸钾全部溶解,继续加热至近沸时,边搅拌边加入4mL三氯化铁溶液(0.40g / mL).将此液置于冰水中冷却至5℃以下,即有大量晶体析出,以布氏漏斗抽滤,得粗产品.
将粗产品溶于10mL热的蒸馏水中,趁热过滤,将滤液在冰水中冷却,待结晶完全后,抽滤,并用少量冰蒸馏水洗涤晶体.取下晶体,用滤纸吸干,并在空气中干燥片刻,称重,计算得率.
2.C2O42– 含量的测定:
精确称取0.18~0.20g K3[Fe(C2O4)3]·3H2O(精确至±0.0002g)于250mL锥形瓶中,加入50mL水溶解,再加12mL 1:5 H2SO4,加热至70~80℃左右,用0.15mol / L KMnO4标准溶液滴定至浅红色,30秒钟不褪色为止.记下读数,计算结果.平行二份.(要求级差≤0.4%)1年前查看全部
- 三草酸合铁酸钾制备实验在FeSO4.7H2O溶液中加入H2SO4酸化的目的是什么?酸性太强会产生什么影响?
 godnonland1年前1
godnonland1年前1 -
 雪舞清歌 共回答了13个问题
雪舞清歌 共回答了13个问题 |采纳率76.9%防止水解.最后应该是加热浓缩结晶的过程,酸性太强估计会有浓硫酸氧化草酸跟1年前查看全部
大家在问
- 191-0.6x=77.2方程.快
- 2结合你对可以鸣笛的电热水壶的了解,就电热水壶的结构和使用过程中出现的一些现象,提出一个与物理有关的问题.
- 3一个N边形的每个内角都是150°,则这个多边形的内角和为
- 4海洋是一个巨大的宝藏.下列物质不经过化学变化就能从海水中获得的是( )
- 5牛奶的英语怎么说
- 6总面积250平方.地基8米深全是多年的回填土,基础是2*2米的亭台,3米跨度能承高16米5层
- 7读大洲大洋分布图,回答下列问题.
- 8think sweater I my smaller his is than.整成一句话
- 9街道办事处是派出机关吗 他是一级行政机关吗
- 10下面这首唐诗可以想象成两个场景画面,第一个画面已经写好,请你续写第二个。要求:①按照诗意来进行合理想象,描写环境和人物情
- 11(2014•红桥区一模)在△ABC中,BC=5,AC=3,sinC=2sinA.
- 12排水管流速的问题在做印染废水处理工程 关于排水自流管管子大小的计算请教一下:Q=SV我知道 但是一般v取多少的?手册上说
- 13一年级小孩子玩得兴高采烈,兴致勃勃.【修改病句】
- 14经过任意三点中的两点共可以画出的直线条数是______条.
- 15真诚交往 和谐相处 倡议书学校的老师叫我们写一份“真诚交往 和谐相处”的倡议书,只是我们没有突破点去写这个倡议书,有关心

