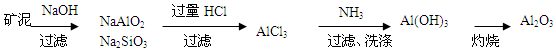锂离子电池回收具有重要意义.重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有
 芙蓉小子2022-10-04 11:39:541条回答
芙蓉小子2022-10-04 11:39:541条回答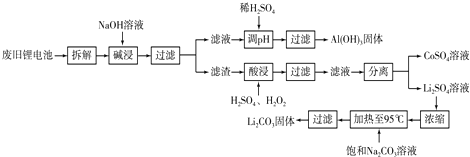
(1)上述工艺回收到的产物有______;
(2)碱浸时主要反应的离子方程式为______;
(3)酸浸时反应的化学方程式为______.

已提交,审核后显示!提交回复
共1条回复
 1123322 共回答了18个问题
1123322 共回答了18个问题 |采纳率83.3%- 解题思路:铝钴膜废料中含有LiCo02和铝箔,将废料先用碱液浸泡,将Al充分溶解,过滤后得到的滤液为含有偏铝酸钠,滤渣为LiCo02;通过调节滤液的pH,将偏铝酸钠转化成氢氧化铝沉淀;将滤渣用双氧水、硫酸处理后生成Li2SO4、CoSO4,反应的离子方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,通过操作分别分离出Li2SO4、CoSO4,通过浓缩、加入饱和碳酸钠溶液后过滤,最后得到碳酸锂固体,
(1)根据工艺流程的最终产物可判断回收到的产物,应为Al(OH)3、CoSO4、Li2CO3;
(2)根据所加入的反应物以及生成物结合质量守恒定律和电荷守恒定律来书写离子方程式;
(3)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式.题干工艺流程为:铝钴膜废料中含有LiCo02和铝箔,将废料先用碱液浸泡,将Al充分溶解,过滤后得到的滤液为含有偏铝酸钠,滤渣为LiCo02;通过调节滤液的pH,将偏铝酸钠转化成氢氧化铝沉淀;将滤渣用双氧水、硫酸处理后生成Li2SO4、CoSO4,反应的离子方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,通过操作分别分离出Li2SO4、CoSO4,通过浓缩、加入饱和碳酸钠溶液后过滤,最后得到碳酸锂固体,
(1)根据生成流程可知,工艺流程的最终产物有:Al(OH)3、CoSO4、Li2CO3,故答案为:Al(OH)3、CoSO4、Li2CO3;
(2)铝能与碱反应生成AlO2-,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题通过生产流程考查了金属的回收、氧化还原反应、物质的分离提纯和除杂等知识,题目难度中等,涉及的知识点较为综合,做题时注意仔细审题,从题目中获取关键信息. - 1年前
相关推荐
- 下列有关电池的说法不正确的是 A.手机上用的锂离子电池属于二次电池 B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池 B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 C.氢氧燃料电池可把化学能转化为电能 D.锌锰干电池中,锌电极是负极  绿谷小溪1年前1
绿谷小溪1年前1 -
 ZHLZH201314 共回答了17个问题
ZHLZH201314 共回答了17个问题 |采纳率76.5%B
锂离子电池中能循环使用,属于二次电池,A正确;铜锌原电池中,锌易失电子而作负极,铜作正极,电子从负极沿导线流向正极,B错;燃料电池属于原电池,是将化学能转变为电能的装置,C正确;锌锰干电池中,锌易失电子发生氧化反应而作负极,故D正确。1年前查看全部
- 求问磷酸铁锂离子电池正负极材料 密度,比热容和导热系数等物性参数.
求问磷酸铁锂离子电池正负极材料 密度,比热容和导热系数等物性参数.
您好~我在百度知道里看到您回答别人的一个问题,您说您是从事锂电工作的~我现在有个题目在做磷酸铁锂离子电池的温度场分析,但是现在有个问题是,我查不到有关于磷酸铁锂离子电池正负极材料的一些物性参数,比如磷酸铁锂的密度,比热容,导热系数等参数,请问您知道这些信息嘛?或者可以通过什么途径的查到呢? yeux1年前1
yeux1年前1 -
 小燕子超市 共回答了18个问题
小燕子超市 共回答了18个问题 |采纳率94.4%肯定查不到了,所有电池材料的密度都是要根据设计方案、配方得来的!举个例子,我们拿桶装水与装空气,我们都达到了把桶装满的目的…这个材料的比容应该为一百一左右,当然比容不可能完全发挥作业!1年前查看全部
- 锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时电极反应式为负极反应:C 6
锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时电极反应式为负极反应:C 6 Li-xe-==C 6 Li 1-x +xLi + (C 6 Li表示锂原子嵌入石墨形成复合材料)正极反应:Li 1-x MO 2 +xLi + +xe-==LiMO 2 (LiMO 2 表示含锂的过渡金属氧化物)下列有关说法正确的是
A.锂离子电池充电时电池反应为C 6 Li+Li 1-x MO 2 ==LiMO 2 +C 6 Li 1-x B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小 C.锂离子电池放电时电池内部Li + 向负极移动 D.锂离子电池充电时阴极反应为C 6 Li 1-x +xLi + +x e-==C 6 Li  kishiyo1年前1
kishiyo1年前1 -
 为了吃饭的nn 共回答了14个问题
为了吃饭的nn 共回答了14个问题 |采纳率92.9%B、D
由负极反应:C 6 Li-xe - ==C 6 Li 1 -x +xLi + 和正极反应:Li 1 -x MO 2 +xLi + +xe - ==LiMO 2 得原电池总反应为C 6 Li+ Li 1 -x MO 2 ==C 6 Li 1 -x +LiMO 2 ,而充电时电池反应与此相反,故A错D对,又因原电池内电路中电流方向是由负极流向正极,阳离子应向正极移动,故C错误。锂摩尔质量很小,故锂失去1mol电子,锂所消耗的质量最小。]1年前查看全部
- 锂离子电池已经成为应用最广泛的可充电电池.某种锂离子电池的结构示意图:其中两极区间的隔膜只允许Li + 通过.电池充电时
锂离子电池已经成为应用最广泛的可充电电池.某种锂离子电池的结构示意图:其中两极区间的隔膜只允许Li + 通过.电池充电时的总反应化学方程式为:LiC 0 0 2 =Li 1-x C 0 0 2 +xLi.关于该电池的推论错误的是( ) A.放电时,Li + 主要从负极区通过隔膜移向正极区 B.放电时,负极反应xLi-xe - =xLi + C.充电时,负极(C)上锂元素被氧化 D.充电时,有电能转化为化学能 
 希望啊1年前1
希望啊1年前1 -
 做人要ss 共回答了24个问题
做人要ss 共回答了24个问题 |采纳率95.8%A、放电时,是原电池的工作原理,在原电池中,阳离子Li + 移向正极,故A正确;
B、放电时,是原电池的工作原理,原电池的负极发生失电子的氧化反应,即xLi-xe - =xLi + ,故B正确;
C、充电时,属于电解池的工作原理,电解池的阴极发生得电子的还原反应,即锂元素被还原,故C错误;
D、充电时,属于电解池的工作原理,电解池是将电能转化为化学能的装置,故D正确.
故选C.1年前查看全部
- 锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性学习小组对废旧锂离子电池正极材料(LiMn 2 O 4 和碳粉
锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性学习小组对废旧锂离子电池正极材料(LiMn 2 O 4 和碳粉涂覆在铝箔上)进行资源回收研究,设计实验流程如下 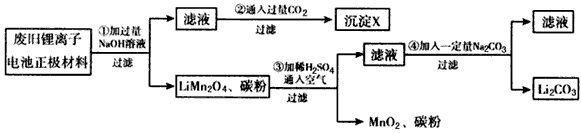
(1)第①步反应可能产生气体的化学式是________;第②步反应得到的沉淀X的化学式为_______。
(2)第③步反应有锂离子(Li + )生成,其反应的离子方程式是___________________。
(3)四步实验都包含过滤,实验室中过滤实验要使用的玻璃仪器包括_______。
(4)若废旧锂离子电池正极材料含LiMnO 4 的质量为18.1 g,第③步反应中加入 20.0 mL 3.0mol/L的H 2 SO 4 溶液,假定正极材料中的锂经反应③和④完全转化为Li 2 CO 3 ,则至少有______g Na 2 CO 3 参加了反应。 ck30261281年前1
ck30261281年前1 -
 孤独擦伤天空 共回答了14个问题
孤独擦伤天空 共回答了14个问题 |采纳率85.7%(1)H 2 ;Al(OH) 3
(2)4LiMn 2 O 4 +4H + +O 2 =8MnO 2 +4Li + +2H 2 O
(3)漏斗、烧杯、玻璃棒
(4)6.4或6.361年前查看全部
- 某锂离子电池的反应原理为:CoO 2 +LiC 6 LiCoO 2 +C 6 ,充电时LiCoO 2 中Li被氧化,Li
某锂离子电池的反应原理为:CoO 2 +LiC 6  LiCoO 2 +C 6 ,充电时LiCoO 2 中Li被氧化,Li + 迁移并以原子形式嵌入电极材料碳(C 6 )中,以LiC 6 表示。下列说法正确的是[ ]
LiCoO 2 +C 6 ,充电时LiCoO 2 中Li被氧化,Li + 迁移并以原子形式嵌入电极材料碳(C 6 )中,以LiC 6 表示。下列说法正确的是[ ]A.放电时,电池的正极反应为CoO 2 +Li + +e - =LiCoO 2
B.充电时,电池的阴极反应为LiC 6 -e - =Li + +C 6
C.锂离子电池的比能量(单位质量释放的能量)低
D.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质 落352片叶子1年前1
落352片叶子1年前1 -
 繁体字谁认得 共回答了23个问题
繁体字谁认得 共回答了23个问题 |采纳率95.7%A1年前查看全部
- 锂离子电池负极反应:C6Li-xe-==li(1-x)C6+xLi+正极反应:Li(1-x)MO2 + xLi+ + x
锂离子电池
负极反应:C6Li-xe-==li(1-x)C6+xLi+
正极反应:Li(1-x)MO2 + xLi+ + xe- == LiMO2
为什么会有1-X,若X大于1不就为负了吗?
 zqq_tt1年前1
zqq_tt1年前1 -
 297384273 共回答了17个问题
297384273 共回答了17个问题 |采纳率94.1%这个x的意思是指潜入碳层的Li不一定会都失去电子,变为锂离子,这个x没有特别标注,但是实际反应中当然不可能大于1啦.用x表示,就是遵从事实,不像初中化学反应那样定量.比如,潜入碳层的Li有100个,而实际中可能只有85个变为锂离子.剩下那15个并未反应.明白?1年前查看全部
- (2013•安庆二模)磷酸铁锂(LiFePO4)被认为是最有前途的锂离子电池正极材料.某企业利用富铁浸出液生成磷酸铁锂,
(2013•安庆二模)磷酸铁锂(LiFePO4)被认为是最有前途的锂离子电池正极材料.某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径.其主要流程如下:
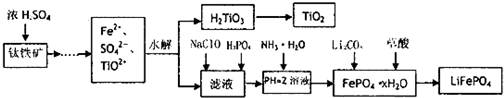
已知:H2LiO3是种难溶于水的物质.
(1)钛铁矿用浓硫酸处理之前,需要粉碎,其目的______
(2)TiO2+水解生成H2TiO3的离子方程式______
(3)加入NaClO发生反应的离子方程式______
(4)在实验中,从溶液中过滤出H2TiO3后,所得滤液浑浊,应如何操作______.
(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁己全部转化为二价铁离子),采取KMnO4标准液滴定Fe2+的方法:(不考虑KMnO4与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果______. (填“偏高、偏低、无影响”),滴定终点的现象______.滴定分析时,称取a g钛铁矿,处理后,用cmol/LKMnO4标准液滴定,消耗VmL,则铁元素的质量分数的表达式为[28cV/a]%[28cV/a]%. 寂寥散人1年前1
寂寥散人1年前1 -
 winner_ty 共回答了14个问题
winner_ty 共回答了14个问题 |采纳率100%解题思路:(1)根据接触面积对反应速率影响解答;
(2)TiO2+水解生成H2TiO3,同时生成氢离子;
(3)ClO-具有强氧化性,将Fe2+氧化为Fe3+,自身被还原为Cl-,酸性条件下,同时生成水;
(4)从溶液中过滤出H2TiO3后,所得滤液浑浊,需要更换过滤器,重新过滤;
(5)未用标准液润洗滴定管,导致消耗KMnO4溶液体积偏大,测定Fe2+的质量增大;滴定到达终点,滴入最后一滴KMnO4溶液,溶液颜色为紫红色,且半分钟内部不褪去;根据电子转移守恒,可得关系式:5Fe2+~KMnO4,据此计算.(1)将钛铁矿粉碎,可以增大表面积,增大浓硫酸的接触面积,加快反应速率,故答案为:增大表面积,增大浓硫酸的接触面积,加快反应速率;(2)TiO2+水解生成H2TiO3,同时生成氢离子,反应离子方程式为:TiO2++2H2O...
点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查化学工艺流程、对操作的理解评价、物质分离提纯、氧化还原反应滴定应用等,需要学生具备扎实的基础,综合考查学生分析解决问题的能力,难度中等.1年前查看全部
- 锂离子电池的方程式.
 呆子爱kk1年前1
呆子爱kk1年前1 -
 sunshine77 共回答了21个问题
sunshine77 共回答了21个问题 |采纳率95.2%H2O +LiPF6 → POF3 +LiF + 2HF
LiPF6→ LiF + PF5
H2O+ PF5 → POF3+ 2HF
H2O + POF3→ PO2F + 2HF
2H2O + PO2F → H3PO4+ HF
H2O + (CH2O CO2 Li) 2→ Li2CO3 + CO↑
RO CO2 Li + HF→ ROCO2H + LiF
Li2 CO3+2HF → H2CO3+ 2LiF
LiPF5 → LiF+ PF5
PF5+ H2O → 2HF + POF3
C4H8O3(EMC)+ PF5 → C2H5OCOOPF4 + HF+ C2H6↑
Li2CO3+ 2HF → 2LiF + H2O + CO2↑
DEC + e + 2Li+ →C2H5OCO2Li (s) + CH3 •
DEC + e + 2Li+ →C2H5OLi (s) + C2H5CO2•
C2H5CO2• + CH3•→CH3OCO2CH3
CH3 •+ 1/2H2 • →CH4↑
CH3•+ CH3•→ C2H6 ↑
DEC + 2e + 2Li+→C2H5OLi (s)+CO↑1年前查看全部
- (2014•江苏)磷酸铁(FePO4•2H2O难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料.实
(2014•江苏)磷酸铁(FePO4•2H2O难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料.实验室可通过下列实验制备磷酸铁.
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是______.
(2)向滤液中加入一定量H2O2氧化Fe2+,为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、______和______.
②若滴定x mL滤液中的Fe2+,消耗a mol•L-1 K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=[6ab/x][6ab/x]mol•L-1.
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是______(填序号);
A、加入适当过量的H2O2溶液
B、缓慢滴加H2O2溶液并搅拌
C、加热,使反应在较高温度下进行
D、用氨水调节溶液pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4•2H2O.若反应得到的FePO4•H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为______. ii8rt88jtrt1年前1
ii8rt88jtrt1年前1 -
 HBBI 共回答了14个问题
HBBI 共回答了14个问题 |采纳率92.9%解题思路:(1)温度越高,反应速率越快;
(2)①滴定管在使用前要检漏、洗涤、润洗,减少产生误差的机会;
②根据Fe2+和K2Cr2O7之间的关系式计算;
③为使滤液中的Fe2+完全被H2O2氧化,加入的氧化剂要过量,且使反应物充分反应;
(3)氢氧根离子和铁离子反应生成红褐色沉淀氢氧化铁.(1)温度越高,反应速率越快,所以反应加热的目的是加快铁与稀硫酸反应速率,故答案为:加快Fe和稀硫酸的反应速率;
(2)①滴定管在使用前要检漏、洗涤、用K2Cr2O7标准溶液润洗2-3次,如果不检漏或洗涤、润洗,会导致使用滴定管中液体体积偏大,测量溶液浓度偏大,故答案为:用蒸馏水洗净;用K2Cr2O7标准溶液润洗2-3次;
②根据Fe2+和K2Cr2O7之间的关系式得c(Fe2+)=
amol/L×b×10−3L
x×10−3L×6mol/L=[6ab/x]mol/L,
故答案为:[6ab/x];
③A、加入适当过量的H2O2溶液,导致铁离子能完全反应,故正确;
B、缓慢滴加H2O2溶液并搅拌,反应物接触面积增大,能使铁离子完全反应,故正确;
C、加热,使反应在较高温度下进行,虽然反应速率加快,但能促进亚铁离子水解而产生杂质,故错误;
D、用氨水调节溶液pH=7,亚铁离子和氢氧根离子反应生成氢氧化亚铁杂质,故错误;
故选AB;
(3)碱性条件下,溶液中含有大量氢氧根离子,氢氧根离子和铁离子反应生成红褐色沉淀氢氧化铁,导致反应得到的FePO4•H2O固体呈棕黄色,故答案为:Fe(OH)3(或氢氧化铁).点评:
本题考点: 真题集萃;制备实验方案的设计.
考点点评: 本题以铁及其化合物为载体考查了物质的制备,涉及氧化还原反应、实验操作、反应速率的影响因素等知识点,根据物质之间的关系式、实验操作的规范性、影响反应速率的因素等知识点来分析解答,题目难度中等.1年前查看全部
- 锂被誉为“金属味精”,以LiCoO 2 为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主
锂被誉为“金属味精”,以LiCoO 2 为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi 2 O 6 ,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
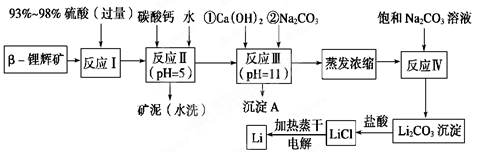
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:氢氧化物 Fe(OH) 3 Al(OH) 3 Mg(OH) 2 开始沉淀pH 2.7 3.7 9.6 完全沉淀pH 3.7 4.7 11
②Li 2 CO 3 在不同温度下的溶解度如下表:温度/℃ 0 10 20 50 75 100 Li 2 CO 3 的溶解度/g 1.539 1.406 1.329 1.181 0.866 0.728
请回答下列问题:
(1)用氧化物形式表示LiAlSi 2 O 6 的组成:________________________。
(2)反应Ⅱ加入碳酸钙的作用是_________________________________。
(3)写出反应Ⅲ中生成沉淀A的离子方程式:______________________________________。
(4)反应Ⅳ生成Li 2 CO 3 沉淀,写出在实验室中得到Li 2 CO 3 沉淀的操作名称___________,洗涤所得Li 2 CO 3 沉淀要使用______________ (选填“热水”或“冷水”),你选择的理由是________________。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是:__________________________。 王兴hh之王兴文1年前1
王兴hh之王兴文1年前1 -
 KMLULU 共回答了19个问题
KMLULU 共回答了19个问题 |采纳率89.5%(1)Li 2 O•Al 2 O 3 •4SiO 2
(2)除去反应Ⅰ中过量的H 2 SO 4 ;控制pH,使Fe 3 + 、A l 3 + 完全沉淀
(3)Mg 2 + +2OH - =Mg(OH) 2 ↓、Ca 2 + +CO 3 2 - =CaCO 3 ↓
(4)过滤 热水 Li 2 CO 3 在较高温度下溶解度小,用热水洗涤可减少Li 2 CO 3 的损耗
(5)加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li 2 O,电解时产生O 2
1年前查看全部
- 下列说法中正确的是( ) A.镍镉电池、锂离子电池和碱性锌锰干电池都是二次电池 B.燃料电池是一
下列说法中正确的是( )
A.镍镉电池、锂离子电池和碱性锌锰干电池都是二次电池 B.燃料电池是一种高效但是会污染环境的新型电池 C.化学电池的反应本质是氧化还原反应 D.铅蓄电池放电的时候正极是Pb,负极是PbO 2  小陈姑娘1年前1
小陈姑娘1年前1 -
 无rr9 共回答了21个问题
无rr9 共回答了21个问题 |采纳率85.7%C
1年前查看全部
- 锂离子电池的电化学表达式是什么
 4134276931年前1
4134276931年前1 -
 ice_speed 共回答了13个问题
ice_speed 共回答了13个问题 |采纳率100%对于最常见的钴酸锂正极、石墨负极的锂离子电池来说,电化学表达式为:
(-)C6|1mol•L-1LiPF6EC+DEC|LiCoO2(+)
负极 电解液 正极
材料不同,换个就是了1年前查看全部
- 【化学——选修2:化学与技术】(15分)碳酸锂用途广泛,可用作陶瓷、药物、催化剂,也是常用的锂离子电池的原料。工业上以锂
【化学——选修2:化学与技术】(15分)碳酸锂用途广泛,可用作陶瓷、药物、催化剂,也是常用的锂离子电池的原料。工业上以锂辉石(Li 2 O·Al 2 O 3 ·4SiO 2 ,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
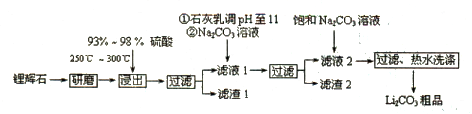
已知:①Li 2 O·Al 2 O 3 ·4SiO 2 +H 2 SO 4 (浓)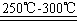 Li 2 SO 4 +Al 2 O 3 ·H 2 O↓
Li 2 SO 4 +Al 2 O 3 ·H 2 O↓
②某些物质的溶解度(S)如下表所示。
(1)从滤渣1中分离出Al 2 O 3 的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。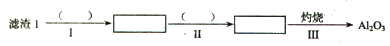
则步骤I中反应的离子方程式是 ,步骤Ⅱ应通入一种气体试剂为 ,步骤II反应完之后需要的操作是 。
(2)已知滤渣2的主要成分有Mg(OH) 2 和CaCO 3 。向滤液l中加入石灰乳的作用是(用离子方程式表示) 。
(3)向滤液2中加入饱和Na 2 CO 3 溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li 2 CO 3 粗产品制备成高纯Li 2 CO 3 的部分工艺如下:
a.将Li 2 CO 3 溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过 量NH 4 HCO 3 溶液,过滤、烘干得高纯Li 2 CO 3 。
①a中,阳极的电极反应式是 。
②b中,生成Li 2 CO 3 反应的化学方程式是 。 我的那些草儿1年前1
我的那些草儿1年前1 -
 fisherfei1982 共回答了15个问题
fisherfei1982 共回答了15个问题 |采纳率80%(1)Al 2 O 3 +6H + = 2Al 3+ +3H 2 O(2分) NH 3 (2分) 过滤(2分)
(2)Ca(OH) 2 + 2H + = Ca 2+ + 2H 2 O(1.5分)Ca(OH) 2 (s) + Mg 2+ Mg(OH) 2 (s) +Ca 2+ (1.5分)
Mg(OH) 2 (s) +Ca 2+ (1.5分)
(3) Li 2 CO 3 的溶解度随温度升高而减小,热水洗涤可减少Li 2 CO 3 的损失(2分)
(4)① 2Cl - ―2e - =Cl 2 ↑(2分)② 2LiOH+2NH 4 HCO 3 =Li 2 CO 3 ↓+(NH 4 ) 2 CO 3 +2H 2 O(2分)
本题考查元素化合物的性质及化学与技术有关知识。(1)用酸将Al 2 O 3 溶液解,再通入氨气转化为Al(OH) 3 沉淀,过滤后灼烧得到Al 2 O 3 ,步骤I中反应的离子方程式是Al 2 O 3 +6H + = 2Al 3+ +3H 2 O,通入的气体物质是NH 3 ,步骤II反应完之后需要的操作是过滤。(2)向滤液l中加入石灰乳的作用是调节溶液的pH值并将Mg 2+ 转化为难溶的Mg(OH) 2 沉淀,反应的离子方程式为Ca(OH) 2 + 2H + = Ca 2+ + 2H 2 O,Ca(OH) 2 (s) + Mg 2+ Mg(OH) 2 (s) +Ca 2+ 。(3)从表中数据可知,Li 2 CO 3 的溶解度随温度升高而减小,故用热水洗涤能减少Li 2 CO 3 的损失,保证更高的产率。(4)①Li 2 CO 3 溶于盐酸,得到LiCl溶液,电解时,阳极Cl - 失电子被子氧化,电极反应式为2Cl - ―2e - =Cl 2 ↑,Li + 通过半透膜进入阴极区,得到LiOH溶液。②电解后得到LiOH溶液,加入NH 4 HCO 3 ,将LiOH转化为Li 2 CO 3 ,反应的化学方程式是2LiOH+2NH 4 HCO 3 =Li 2 CO 3 ↓+(NH 4 ) 2 CO 3 +2H 2 O。
1年前查看全部
Mg(OH) 2 (s) +Ca 2+ 。(3)从表中数据可知,Li 2 CO 3 的溶解度随温度升高而减小,故用热水洗涤能减少Li 2 CO 3 的损失,保证更高的产率。(4)①Li 2 CO 3 溶于盐酸,得到LiCl溶液,电解时,阳极Cl - 失电子被子氧化,电极反应式为2Cl - ―2e - =Cl 2 ↑,Li + 通过半透膜进入阴极区,得到LiOH溶液。②电解后得到LiOH溶液,加入NH 4 HCO 3 ,将LiOH转化为Li 2 CO 3 ,反应的化学方程式是2LiOH+2NH 4 HCO 3 =Li 2 CO 3 ↓+(NH 4 ) 2 CO 3 +2H 2 O。
1年前查看全部
- (2014•浙江模拟)如图是一种可充电的锂离子电池充、放电的工作示意图.放电时该电池的电极反应式为:
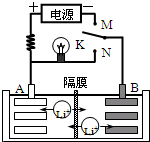 (2014•浙江模拟)如图是一种可充电的锂离子电池充、放电的工作示意图.放电时该电池的电极反应式为:
(2014•浙江模拟)如图是一种可充电的锂离子电池充、放电的工作示意图.放电时该电池的电极反应式为:
负极:LixC6-xe-═C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)
正极:Li1-xMnO2+xLi++x e-═LiMnO2(LiMnO2表示含锂原子的MnO2)
下列有关说法正确的是( )
A.该电池的反应式为Li1-xMnO2+LixC6
LiMnO2+C6充电 放电
B.K与M相接时,A是阳极,发生氧化反应
C.K与N相接时,Li+由A极区迁移到B极区
D.在整个充电或放电过程中都只存在一种形式的能量转化 遗世独立妥否1年前1
遗世独立妥否1年前1 -
 cosmic73 共回答了13个问题
cosmic73 共回答了13个问题 |采纳率100%解题思路:当K与M相接时,该装置是电解池,A为阳极,阳极上失电子发生氧化反应,B为阴极,发生还原反应,当K与N相接时,该装置是原电池,B为负极,A为正极,负极上发生氧化反应,正极上发生还原反应,原电池放电时,电解质溶液中阳离子向正极移动,阴离子向负极移动.
A.在原电池中,正极和负极反应之和即为电池的总反应;
B.在电解池中,和电源的正极相接的电极是阳极,阳极发生失电子的氧化反应;
C.原电池中,电解质中的阳离子移向正极;
D.存在电能与化学能、热能的转化.当K与M相接时,该装置是电解池,A为阳极,阳极上失电子发生氧化反应,B为阴极,发生还原反应,当K与N相接时,该装置是原电池,B为负极,A为正极,负极上发生氧化反应,正极上发生还原反应,原电池放电时,电解质溶液中阳离子向正极移动,阴离子向负极移动.
A.将正负极电极方程式相加可得Li1-xMnO2+LixC6
放电
充电 LiMnO2+C6,故A错误;
B.K与M相接时,A连接电源的正极,为电解池的是阳极,发生氧化反应,故B正确;
C.K与N相接时,由B的连接方向可知B为负极,原电池工作时,阳离子向正极移动,应向A极移动,故C错误;
D.原电池和电解质中,是电能和化学能之间的相互转化,化学能与热能转化等,故D错误.
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题以新型电池为载体考查原电池和电解池原理,明确原电池和电解池电极上得失电子即可解答,注意原电池放电时,阴阳离子的移动方向,为易错点.1年前查看全部
- 锂离子电池已经成为应用最广泛的可充电电池.某种锂离子电池的结构示意图:其中两极区间的隔膜只允许Li+通过.电池充电时的总
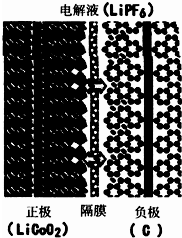 锂离子电池已经成为应用最广泛的可充电电池.某种锂离子电池的结构示意图:其中两极区间的隔膜只允许Li+通过.电池充电时的总反应化学方程式为:LiC002=Li1-xC002+xLi.关于该电池的推论错误的是( )
锂离子电池已经成为应用最广泛的可充电电池.某种锂离子电池的结构示意图:其中两极区间的隔膜只允许Li+通过.电池充电时的总反应化学方程式为:LiC002=Li1-xC002+xLi.关于该电池的推论错误的是( )
A.放电时,Li+主要从正极区通过隔膜移向负极区
B.放电时,负极反应xLi-xe-=xLi+
C.充电时,有电能转化为化学能
D.充电时,负极(C)上锂元素被氧化 黑se会mm1年前1
黑se会mm1年前1 -
 九九皈依 共回答了18个问题
九九皈依 共回答了18个问题 |采纳率94.4%解题思路:电池充电时的总反应化学方程式为:LiC002=Li1-xC002+xLi,则放电时的总反应为Li1-xC002+xLi=LiC002,放电时Li被氧化,为原电池的负极,电极反应式为xLi-xe-=xLi+,正极Li1-xC002得电子被还原,电极反应式为Li1-xC002+xe-+xLi+=LiC002,原电池工作时,阳离子向正极移动,阴离子向负极移动,充电时,电极反应与放电时的反应相反.A.放电时,Li+主要从负极区通过隔膜移向正极区,故A错误;
B.放电时Li被氧化,为原电池的负极,电极反应式为xLi-xe-=xLi+,故B正确;
C.充电时,为电解池反应,电能转化为化学能,故C正确;
D.由反应LiC002=Li1-xC002+xLi可知,充电时,阴极发生还原反应,生成Li,被还原,故D错误.
故选AD.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查化学电源新型电池,题目难度中等,本题注意根据电池总反应结合元素化合价的变化判断电极反应.1年前查看全部
- 下列说法不正确的是( )A.手机上用的锂离子电池属于二次电池B.测定中和反应的反应热,需要记录体系达到的最终温度C.催
下列说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.测定中和反应的反应热,需要记录体系达到的最终温度
C.催化剂能加快化学反应速率是因为降低了反应的活化能,增大了活化分子百分率
D.温度对化学平衡的影响是通过改变平衡常数实现的 loveorsoul1年前1
loveorsoul1年前1 -
 lqf5586 共回答了12个问题
lqf5586 共回答了12个问题 |采纳率100%解题思路:A、锂离子电池可以反复充电放电属于可充电电池,是二次电池;
B、测定中和反应的反应热,需要记录体系强酸温度和达到的最高温度;
C、催化剂降低反应的活化能,改变反应速率,不改变化学平衡;
D、平衡常数随温度变化.A、锂离子电池可以反复充电放电属于可充电电池,手机上用的锂离子电池是二次电池,故A正确;
B、测定中和反应的反应热,需要记录体系强酸温度和达到的最高温度,故B错误;
C、催化剂降低反应的活化能,增大了活化分子百分率,改变反应速率,不改变化学平衡,故C正确;
D、平衡常数随温度变化,温度对化学平衡的影响是通过改变平衡常数实现的,故D正确;
故选B.点评:
本题考点: 原电池和电解池的工作原理;化学反应速率的影响因素;化学平衡的影响因素;中和热的测定.
考点点评: 本题考查了化学反应速率、化学平衡影响因素,中和热测定方法和实验步骤,掌握基础是关键,题目难度中等.1年前查看全部
- 电动车是锂离子电池,请问有什么优点缺点吗?
 逝烟1年前1
逝烟1年前1 -
 良民小易 共回答了21个问题
良民小易 共回答了21个问题 |采纳率95.2%电动车用锂电池因其体积小 轻便而备受青睐.电动车用锂电池的问世彻底解决了传统电动车笨重稚拙的外观形象,小巧轻便 时尚简约 的外形 实现了真正意义上的电动自行车.另外 锂电池无记忆效应 可随时充电.缺点嘛 就是造价太高(一块36V的锂电池价格在1000元左右吧)废电池可利用价值太低(铅酸电池报废后里面的铅还可在利用,锂电则不然了).以上是我的个人之见,有不对的地方请方家指教.1年前查看全部
- 锂电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性.锂离子电池放电时的电极反应式为
锂电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性.锂离子电池放电时的电极反应式为
负极反应:C 6 Li-xe - =C 6 Li 1-x +xLi + (C 6 Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li 1-x MO 2 +xLi + +x e - =LiMO 2 (LiMO 2 表示含锂的过渡金属氧化物)
下列有关说法正确的是( )A.锂电池充电时电池反应为C 6 Li+Li 1-x MO 2 =LiMO 2 +C 6 Li 1-x B.在电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小 C.锂电池放电时电池内部Li + 向负极移动 D.锂电池充电时阴极反应为C 6 Li 1-x +xLi + +xe - =C 6 Li  jichun19831年前1
jichun19831年前1 -
 yearn228 共回答了16个问题
yearn228 共回答了16个问题 |采纳率100%A.由所给电池正负极反应式加合得电池的总反应式为C 6 Li+Li (1-x) MO 2 =LiMO 2 +C 6 Li (1-x) ,充电反应为放电反应的总反应的逆反应,则锂电池充电时电池反应为LiMO 2 +C 6 Li 1-x =C 6 Li+Li (1-x) MO 2 ,故A错误;
B.在电池反应中,锂、锌、银、铅各失去1mol电子,消耗的质量分别为:
7
1 g、
65
2 g、
108
1 g、
207
2 g,对比可知金属锂所消耗的质量最小,故B正确;
C.在原电池放电时,电池内部的阳离子向正极移动,阴离子向电源的负极移动,故C错误;
D.锂电池充电时阴极发生还原反应,生成锂的单质,与原电池的负极反应相反,反应的电极反应式为C 6 Li 1-x +xLi + +xe - =C 6 Li,故D正确.
故选BD.1年前查看全部
- 锂离子电池的应用很广,其正极材料可再生利用.某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等.充电时,
锂离子电池的应用很广,其正极材料可再生利用.某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等.充电时,该锂离子电池负极发生的反应为6C+xLi++xe-═LixC6.现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出).
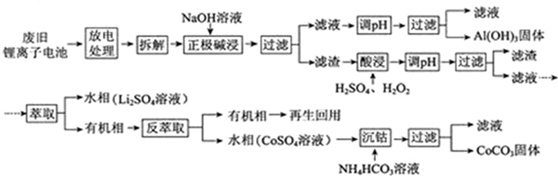
回答下列问题:
(1)LiCoO2中,Co元素的化合价为______.
(2)写出“正极碱浸”中发生反应的离子方程式______.
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式2LiCoO2+3H2SO4+H2O2
Li2SO4+2CoSO4+O2↑+4H2O△ .
2H2O2
2H2O+O2↑△ .2LiCoO2+3H2SO4+H2O2;可用盐酸代替H2SO4和H2O2的混合液,但缺点是______.
Li2SO4+2CoSO4+O2↑+4H2O△ .
2H2O2
2H2O+O2↑△ .
(4)写出“沉钴”过程中发生反应的化学方程式______.
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式______.
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是______.在整个回收工艺中,可回收到的金属化合物有______(填化学式). 77264061年前1
77264061年前1 -
 tina猫猫 共回答了15个问题
tina猫猫 共回答了15个问题 |采纳率86.7%解题思路:(1)根据化合物中,化合价的代数和为0判断;
(2)碱浸正极时,铝和氢氧根离子反应生成偏铝酸根离子和氢气;
(3)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式;由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成;
(4)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀;
(5)放电时,Li1-xCoO2和LixC6发生氧化还原反应生成LiCoO2和C;
(6)“放电处理”有利于锂在正极的回收,Li+从负极中脱出,经由电解质向正极移动,在整个回收工艺中,可回收到的金属化合物有Al(OH)3、CoCO3、Li2SO4.(1)根据化合物中,化合价的代数和为0知,LiCoO2中,Co元素的化合价为+3价,故答案为:+3;
(2)正极中含有铝,铝易溶于强碱溶液生成AlO2-,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成,
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O;有氯气生成,污染较大;
(4)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀、硫酸铵、二氧化碳和水,反应方程式为CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O,
故答案为:CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O;
(5)充放电过程中,Li1-xCoO2和LixC6发生氧化还原反应生成LiCoO2和C,反应方程式为:Li1-xCoO2+LixC6=LiCoO2+6C,
故答案为:Li1-xCoO2+LixC6=LiCoO2+6C;
(6)放电时,负极上生成锂离子,锂离子向正极移动并进入正极材料中,所以“放电处理”有利于锂在正极的回收,根据流程图知,可回收到的金属化合物有Al(OH)3、CoCO3、Li2SO4,
故答案为:Li+从负极中脱出,经由电解质向正极移动并进入正极材料中;Al(OH)3、CoCO3、Li2SO4.点评:
本题考点: 金属的回收与环境、资源保护;电极反应和电池反应方程式.
考点点评: 本题为生产流程题,涉及金属的回收、环境保护、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息,难度中等,难点是电极反应式的书写.1年前查看全部
- 锂离子电池电解液燃烧产生何种气体!
锂离子电池电解液燃烧产生何种气体!
锂离子电池电解液燃烧产生何种气体,是否对人体有害,有没有相关的文献, 薛白1年前3
薛白1年前3 -
 satour08 共回答了19个问题
satour08 共回答了19个问题 |采纳率94.7%电解液成分太复杂,不是真正做电解液的研发人员是不知道的,我是做锂电研发的,有人说的HF那个是因为电解液中的一种电解质遇水分解形成的,燃烧是形成不了的,给你一本书你看看吧,《锂离子电池原理与关键技术》上面有电解液解释的一章,个人估计产生的气体主要是CO2和一些挥发的有机物,这些有机物对人体是有很大的危害的1年前查看全部
- 手机上使用的锂离子电池上标有“3.6V 900mA•h”其中的mA•h是物理量______的单位;请估算这种电
手机上使用的锂离子电池上标有“3.6V 900mA•h”其中的mA•h是物理量______的单位;请估算这种电池可储存的电能为______J,若手机正常工作时的电流约为6mA,则这种充满电的锂离子电池可供手机连续使用______h.
 再活几十年1年前1
再活几十年1年前1 -
 ayi601 共回答了18个问题
ayi601 共回答了18个问题 |采纳率77.8%解题思路:mA是电流的单位,h是时间单位,根据电流的定义式可知mA•h表示的物理量,根据W=UIt=UQ求出手机储存的电能,由电荷量公式的变形式求出这种充满电的锂离子电池可供手机连续使用的时间.mA为电流单位,h为时间单位,则由Q=It可知,mA•h为电荷量的单位;
由W=UIt可得,这种电池可储存的电能:
W=UQ=3.6V×900×10-3A×3600=11664J,
由I=[Q/t]可得,这种充满电的锂离子电池可供手机连续使用的时间:
t=[Q/I′]=[900mA/6mA]=150h.
故答案为:电荷量;11664;150.点评:
本题考点: 电功的计算.
考点点评: 本题考查了电荷量的公式和电功公式的计算,注意在计算时单位要统一.1年前查看全部
- 某种锂离子电池的电极反应为Li +LiMn2O4= Li2Mn2O4,请问LiMn2O4是什么,Li2Mn2O4是什么,
某种锂离子电池的电极反应为Li +LiMn2O4= Li2Mn2O4,请问LiMn2O4是什么,Li2Mn2O4是什么,中文读法应该怎么读?相关物质的读法有什么规律么?
 小脑冰凉1年前4
小脑冰凉1年前4 -
 saybye11 共回答了22个问题
saybye11 共回答了22个问题 |采纳率86.4%LiMn2O4可称为锰酸锂,具有尖晶石结构
Li2Mn2O4就是LiMnO2
这两种物质都是锂电池的正极材料,目前似乎没有特别合适的命名,统称为锂锰氧化物,实际上Li-Mn原子的个数比是可变化的,即所谓的“掺杂”,不一定正好是上述1:2或者1:1,其比值可在0.5-1之间变化,由此带来不同的电容量性能1年前查看全部
- 锂离子电池的充电电压是多少?是3.7至4.2伏(与直线AB表示),或者必须是4.2伏(与点B表示).
 你挡在走道左边1年前1
你挡在走道左边1年前1 -
 癫子张 共回答了21个问题
癫子张 共回答了21个问题 |采纳率85.7%锂离子电池的充电电压的4.2V1年前查看全部
- 一节4V锂离子电池的容量是多少
 jamie19801年前3
jamie19801年前3 -
 zhrlwj 共回答了20个问题
zhrlwj 共回答了20个问题 |采纳率85%你说的一节是指18650电芯吧?这个规格的电芯比较常见,这个的容量没有标准.一般正常新电芯是2200mAH,好一些的可以做到2600mAH,最好的可以达到2800mA,但是差的就没下限了,我见过18650电芯400mA的. 还有,一般单节锂电池标称电压都是3.7V,铁锂电池3.2V.1年前查看全部
- 聚合物锂离子电池和液体锂离子电池有什么区别?
 半个教师1年前1
半个教师1年前1 -
 ruoruo徐 共回答了21个问题
ruoruo徐 共回答了21个问题 |采纳率85.7%锂聚合物电池电解质是固态聚合物、而不是液态电解质.锂聚合物电池电能密度更高,可实现更长的供电时间,在移动通信市场,笔记本电脑和手机是目前最大的锂聚合物电池.
锂聚合物电池又称高分子锂电池,具有能量密度高、更小型化、超薄化、轻量化,以及高安全性和低成本等多种明显优势,是一种新型电池.
液体锂离子电池用的是液态电解质.1年前查看全部
- 天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钻(LiCoO 2 ),充电时LiCoO 2
天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钻(LiCoO 2 ),充电时LiCoO 2 中Li被氧化,Li + 迁移并以原子形式嵌入电池负极材料碳(C 6 )中,以LiC 6 表示。电池反应为
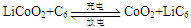 ,下列说法正确的是()
,下列说法正确的是()A.充电时,电池的负极反应为LiC 6 -e - =Li+C 6 B.放电时,电池的正极反应为CoO 2 +Li + +e - =LiCoO 2 C.羧酸、醇等含活泼氢气的有机物可用作锂离子电池的电解质 D.锂离子电池的比能量(单位质量释放的能量)低  帆影56361年前1
帆影56361年前1 -
 汪汪汪汪汪汪汪汪 共回答了25个问题
汪汪汪汪汪汪汪汪 共回答了25个问题 |采纳率92%B
1年前查看全部
- (2014•鄂尔多斯一模)LiFePO4新型锂离子电池因其原材料丰富、对环境友好、循环性能和安全性能好的特点,具有广阔的
(2014•鄂尔多斯一模)LiFePO4新型锂离子电池因其原材料丰富、对环境友好、循环性能和安全性能好的特点,具有广阔的应用前景.已知该电池放电时的电极反应式为:正极:FePO4+Li++e-=LiFePO4,负极:Li-e-=Li+,下列说法中正确的是( )
A.充电时阳极反应为Li++e-=Li
B.充电时动力电池上标注“-”的电极应与外接电源的负极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原 kbc51571年前1
kbc51571年前1 -
 zhangmwmcm 共回答了20个问题
zhangmwmcm 共回答了20个问题 |采纳率100%解题思路:根据电池反应可知,放电时LiFePO4电池负极反应为Li-e-═Li+,正极反应为FePO4+Li++e-═LiFePO4;充电时的阳极上LiFePO4失电子,阴极上Li+得电子,根据原电池和电解池的工作原理来回答.A、充电时,阳极上LiFePO4失电子,阴极上Li+得电子,则充电时阴极反应为Li++e-=Li,故A错误;
B、充电时,电池的负极上Li+离子得电子生成Li,所以动力电池上标注“-”的电极应与外接电源的负极相连,故B正确;
C、放电时,电池内部阳离子向正极移动,则Li+向正极移动,故C错误;
D、放电时,是原电池的工作原理,正极反应为:FePO4+Li++e-═LiFePO4,则在正极上是FePO4得电子被还原,故D错误;
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查化学电源新型电池知识,本题难度不大,注意根据电池反应书写电极反应式的方法,以及离子的定向移动问题.1年前查看全部
- 天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO 2 ),充电时LiCoO 2
天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO 2 ),充电时LiCoO 2 中Li被氧化,Li + 迁移并以原子形式嵌入电池负极材料碳(C 6 )中,以LiC 6 表示。电池反应为
LiCoO 2 +C 6 CoO 2 +LiC 6 ,下列说法正确的是[ ]
CoO 2 +LiC 6 ,下列说法正确的是[ ]A.充电时,电池的负极反应为LiC 6 -e - = Li + +C 6
B.放电时,电池的正极反应为CoO 2 +Li + +e - = LiCoO 2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低 海王类gg1年前1
海王类gg1年前1 -
 dingxianglan 共回答了10个问题
dingxianglan 共回答了10个问题 |采纳率90%B1年前查看全部
- 液态锂离子电池包括哪些?引用材料“根据锂离子电池所用电解质材料不同,锂离子电池可以分为液态锂离子电池和聚合物锂离子电池两
液态锂离子电池包括哪些?
引用材料“根据锂离子电池所用电解质材料不同,锂离子电池可以分为液态锂离子电池和聚合物锂离子电池两大类,动力锂电池主要包括钴酸锂电池、镍酸锂电池、锰酸锂电池、磷酸铁锂电池等,”
钴酸锂电池、镍酸锂电池、锰酸锂电池、磷酸铁锂电池属于液态锂离子电池,还是聚合物锂离子电池呢? 水镜泉1年前4
水镜泉1年前4 -
 supper-man 共回答了21个问题
supper-man 共回答了21个问题 |采纳率100%钴酸锂电池、镍酸锂电池、锰酸锂电池、磷酸铁锂电池的差别是正极材料的不同,钴酸锂电池正极材料为钴酸锂、镍酸锂电池正极材料为镍酸锂、锰酸锂电池正极材料为锰酸锂、磷酸铁锂电池正极材料为磷酸铁锂.
另外,现在市面上的锂离子电池,负极材料都相同为石墨.
至于液态锂离子电池与聚合物锂离子电池的分类,考虑的是电解液的不同.电解液为液态物质则为液态锂离子电池,为有机聚合物则为聚合物锂离子电池.现在市面上常见的为聚合物锂离子电池.
因此,你所问的是指锂离子电池的两种不同的分类方式:按正极材料分类与按电解质类型分类.二者没有包含的关系,不能说谁属于谁1年前查看全部
- 锂离子电池的广泛应用使同收利用锂资源成为重要课题,某研究性学习小组对废旧锂离子电池正极材料(LiMn 2 O 4 、碳粉
锂离子电池的广泛应用使同收利用锂资源成为重要课题,某研究性学习小组对废旧锂离子电池正极材料(LiMn 2 O 4 、碳粉等涂覆在铝箔上)进行资源叫收研究,设计实验流程如下: 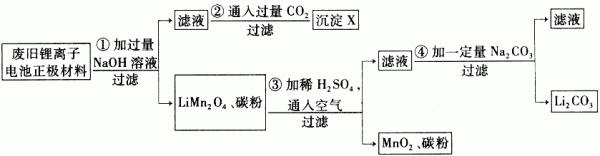
(1)第②步反应得到的沉淀X的化学式为________。
(2)第③步反应的离子方程式是______________________。
(3)第④步反应后,过滤Li 2 CO 3 所需的玻璃仪器有_______________。 若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:__________________、________________。
(4)若废旧锂离子电池正极材料含LiMn 2 O 4 的质量为18.1 g,第③步反应中加入20.0 mL 3.0 moI·L -1 的H 2 SO 4 溶液,假定正极材料中的锂经反应③和④完全转化为Li 2 CO 3 ,则至少有_______g Na 2 CO 3 参加反应。 荒凉心1年前1
荒凉心1年前1 -
 风雅不凋零 共回答了15个问题
风雅不凋零 共回答了15个问题 |采纳率86.7%(1)Al(OH) 3
(2)4LiMn 2 O 4 +4H + +O 2 = 8MnO 2 +4Li + +2H 2 O
(3)烧杯、漏斗、玻璃棒;玻璃棒下端靠在滤纸的单层处,导致滤纸破损漏斗中液面高于滤纸边缘
(4)6.4(或6.36)1年前查看全部
- (2012•潮州二模)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的
(2012•潮州二模)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的,回收利用锂资源成为重要课题.某研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如下:
已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.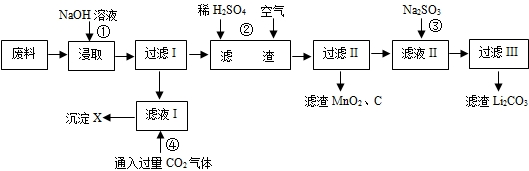
(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是______.
(2)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求______.
(3)写出反应④生成沉淀X的离子方程式:______.
(4)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的化学反应方程式:______.
(5)生成Li2CO3的化学反应方程式为______.已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应______. 胡太平1年前1
胡太平1年前1 -
 missyou_huihui 共回答了29个问题
missyou_huihui 共回答了29个问题 |采纳率93.1%解题思路:(1)根据外界条件对化学反应速率的影响分析;
(2)从金属锂的化学性质分析,锂为活泼金属;
(3)四羟基合铝酸钠与二氧化碳反应产生氢氧化铝和碳酸氢钠,注意生成的碳酸氢钠不是碳酸钠;
(4)LiMn2O4在酸性环境下能被空气中的氧气氧化;
(5)硫酸锂和碳酸钠反应生成硫酸钠和碳酸锂沉淀,Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应趁热过滤.第一步就是铝溶解在氢氧化钠溶液中(注意LiMn2O4不溶于水)生成四羟基合铝酸钠,即滤液的主要成分,第二步就是四羟基合铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠的过程,第三步是LiMn2O4在酸性环境下能被空气...
点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查了金属资源的回收和利用,难度较大,会运用基础知识分析信息给予题.1年前查看全部
- 锂离子电池中的负极材料-石墨比表面积大小对电池性能有哪些影响?
 abc5346619641年前1
abc5346619641年前1 -
 slowlyabc 共回答了22个问题
slowlyabc 共回答了22个问题 |采纳率86.4%SSA太大,造成首次容量损失过多.
而且加的粘结剂会比较多,造成内阻增加.1年前查看全部
- 下列说法中正确的是( )A. 镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池B. 燃料电池是一种高效但是会污染环境的
下列说法中正确的是( )
A. 镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池
B. 燃料电池是一种高效但是会污染环境的新型电池
C. 化学电池的反应基础是氧化还原反应
D. 铅蓄电池放电的时候:正极是Pb,负极是PbO2 紫袭1年前2
紫袭1年前2 -
 干人尔女马 共回答了18个问题
干人尔女马 共回答了18个问题 |采纳率94.4%解题思路:A.碱性锌锰干电池为一次电池;
B.燃料电池的产物多为CO2、H2O等,不污染环境;
C.化学电池是将化学能转变为电能的装置,有电子的转移,实质为氧化还原反应;
D.铅蓄电池放电的时候,Pb被氧化,为原电池的负极.A.镍氢电池、锂离子电池为二次电池,碱性锌锰干电池为一次电池,故A错误;B.燃料电池有氢氧燃料电池、甲烷燃料电池、乙醇燃料电池等,产物多为CO2、H2O等,不污染环境,故B错误;C.化学电池是将化学能转变为电能...
点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题考查常见原电池的组成以及工作原理,题目难度不大,学习中注意常见原电池的组成以及工作原理,注意相关基础知识的积累.1年前查看全部
- 手机的锂离子电池破损从而释放出来的气体吸入人体会有什么危害呢?如果吸入不多呢?这种气体易挥发掉吗?
 x7fdwnhu1年前1
x7fdwnhu1年前1 -
 d9453b9b95025717 共回答了21个问题
d9453b9b95025717 共回答了21个问题 |采纳率81%锂离子电池,所用的电解质一般是有机物,这些有机物有肝毒性,不过只要不是鼻子凑上去吸,我想问题不大.应该是易挥发的.1年前查看全部
- 为什么磷酸亚铁锂电池的电压比锂离子电池电压低?
为什么磷酸亚铁锂电池的电压比锂离子电池电压低?
磷酸亚铁锂电池的电压是3.2V,比锂离子电池电压是3.7V要低,这是什么原因?同样标称2000毫安时的这两种电池,实际容量应该是磷酸亚铁锂的要低一些吧? xueshan1181年前1
xueshan1181年前1 -
 cysally 共回答了11个问题
cysally 共回答了11个问题 |采纳率81.8%这是电池原材料分子性质,具体来说是分子键能决定的.
Ah并不是标准的能量容量单位,标准的应该是wh.Ah乘以电压,才是wh.所以说同样标称2000mah的电池,若无虚标的话,三元/锰酸锂(3.7v)的能量是7.4wh,铁锂的是6.4wh,是三元和锰酸锂的能量高.1年前查看全部
- 常用锂离子电池正极材料的电化学性能
 xinxingao1221年前1
xinxingao1221年前1 -
 silvia 共回答了17个问题
silvia 共回答了17个问题 |采纳率94.1%表1-2 锂离子电池电压和比能量
电池体系 电势/V 比能量/Wh•kg-1 比容量/mAh•g-1
C6-LiCoO2 3.6 360 137
C6-LiNiO2 3.5 444 193
C6-LiMn2O4 3.8 403 1481年前查看全部
- 锂离子电池的原理是什么?它的正负极和电解液都是什么?
 asddsde1年前1
asddsde1年前1 -
 潜水鱼和季侯枫 共回答了12个问题
潜水鱼和季侯枫 共回答了12个问题 |采纳率91.7%锂离子电池的正极材料通常有锂的活性化合物组成,负极则是特殊分子结构的碳.常见
的正极材料主要成分为 LiCoO2 ,充电时,加在电池两极的电势迫使正极的化合物释出锂离
子,嵌入负极分子排列呈片层结构的碳中.放电时,锂离子则从片层结构的碳中析出,重新
和正极的化合物结合.锂离子的移动产生了电流.
这是手机的锂电池原理1年前查看全部
- 寻找锂离子电池设计公式
 zhang123441年前1
zhang123441年前1 -
 九尾小灵狐 共回答了23个问题
九尾小灵狐 共回答了23个问题 |采纳率91.3%手机是受到损坏了,还是注意下吧,虽然没有鼓包,但是毕竟存在安全隐患,坏块匹配的电池就行了,电池也不贵的,推荐你个国产一线品牌,浦诺菲手机电池,优点是:
高能量密度;锂离子电池的重量是相同容量的镍镉或镍氢电池的一半,体积是镍镉的50%、镍氢的30%.
环保无污染;锂离子电池不含有诸如镉、铅、汞之类的有害金属物质.
循环寿命高;在正常条件下,锂离子电池的充放电周期可超过500次.
无记忆效应;记忆效应是指镍镉电池在充放电循环过程中,电池的容量减少的现象.锂离子电池不存在这种特性.
充电速度快;使用额定电压为4.2V的恒流恒压充电器可以使锂离子电池在一至两个小时内充满.1年前查看全部
- 磷酸铁锂锂离子电池的电解质是六弗磷酸锂吗?还是常用锂盐都有可能,包括高氯酸锂、四弗硼酸锂
 鬼吹灯火万家灭1年前3
鬼吹灯火万家灭1年前3 -
 mengdan000 共回答了26个问题
mengdan000 共回答了26个问题 |采纳率88.5%目前商业化的只有六氟磷酸锂,高氯酸锂、四弗硼酸锂在理论上都是可以的,因为电解质就是在电解液中提供锂离子,目前还只是在实验室使用,尚未大规模商业化.1年前查看全部
- 2013,新课标,锂离子电池的应用很广,其正极材料可再生利用.某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑
2013,新课标,
锂离子电池的应用很广,其正极材料可再生利用.某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等.充电时,该锂离子电池负极发生的反应为6C+xLi++xe-==LixC6.
(5)充放电过程中,发生LiCoO2与LixCoO2之间的转化,写出放电时电池反应方程式___________________.
Li1-xCoO2+LixC6==LiCoO2+6C
怎么理解呢? hvming199991年前2
hvming199991年前2 -
 放在书架上 共回答了15个问题
放在书架上 共回答了15个问题 |采纳率86.7%负极的反应式可以得出正极的反应LiCoO2--xLi---xe====Li1-xCoO2两个式子相加就可以了.你可以看一下今年北京海淀区高三一模试卷25题,也是关于锂电的.理解一下,不明白再追问吧1年前查看全部
- 锂被誉为“金属味精”,以LiCoO 2 为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要
锂被誉为“金属味精”,以LiCoO 2 为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi 2 O 6 ,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
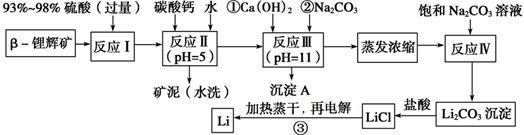
已知:部分金属氢氧化物开始沉淀和完全沉淀时的pH:氢氧化物 Fe(OH) 3 Al(OH) 3 Mg(OH) 2 开始沉淀pH 2.7 3.7 9.6 完全沉淀pH 3.7 4.7 11
请回答下列问题:
(1)写出反应Ⅰ中有电子转移的化学方程式_________________________;
(2)反应Ⅱ加入碳酸钙的作用是_______________;
(3)有同学认为在反应Ⅲ中只需加入碳酸钠溶液也能达成该步骤的目的,请阐述你的观点和理由 ____________;
(4)上述流程蒸发浓缩环节,若在实验室进行该操作,当蒸发浓缩至________出现时,就可停止该操作。
(5)Li与Mg、Be与Al、B与Si这三对元素在周期表中处于对角线位置,相应的两元素及其化合物的性质有许多相似之处。这种相似性称为对角线规则。步骤③中电解时,阳极产生的氯气中会混有少量氧气,原因是___________。
(6)请设计一种从水洗后的矿泥中分离出Al 2 O 3 的流程:
(流程常用的表示方式为: )
) 健康快乐清虚子1年前1
健康快乐清虚子1年前1 -
 yh_guo 共回答了18个问题
yh_guo 共回答了18个问题 |采纳率83.3%1年前查看全部
- 锂离子电池放电时是吸热反应还是放热反应
 Fiona0121年前1
Fiona0121年前1 -
 good_2061 共回答了13个问题
good_2061 共回答了13个问题 |采纳率69.2%多数锂电池充电时属吸热反应,放电时为放热反应,两者都包含内阻热耗.充电初期,极化电阻最小,吸热反应处于主导地位,电池温升可能出现负值,充电后期,阻抗增大,释热多于吸热,温升增加,过充时,随不可逆反应的出现,逸出气体,内压、温升升高,直到变形、爆裂.1年前查看全部
- 草酸亚铁晶体(FeC2O3•2H2O)在医药行业可用做补血剂,也可用于制备锂离子电池的正极材料磷酸亚铁锂(LiFePO2
草酸亚铁晶体(FeC2O3•2H2O)在医药行业可用做补血剂,也可用于制备锂离子电池的正极材料磷酸亚铁锂(LiFePO2),FeC2O4•2H2O加热至590℃时发生分解反应:FeC2O4•2H2O
FeO+CO2↑+CO↑+2H2O,甲同学设计了如图实验装置(部分夹持装置未列出)检验该反应生成的CO2,CO和水蒸气.590℃ .
(1)装置B中盛装的药品是______.
(2)装置C的作用是______.
(3)装置E中发生反应的化学方程式为CO+CuO
Cu+CO2△ .CO+CuO,能说明草酸亚铁晶体受热分解产生的气体中含有CO的现象是______.
Cu+CO2△ .
(4)写出一种尾气处理的方法:______.
(5)乙同学将装置F中的澄清石灰水换成新制的银氨溶液,反应一段时间后,观察到F的试管中生成大量的单质银颗粒,写出该反应的方程式:______. 小鱼ivy1年前1
小鱼ivy1年前1 -
 SSXKJ 共回答了17个问题
SSXKJ 共回答了17个问题 |采纳率94.1%解题思路:(1)水的检验可以用无水硫酸铜来检验;
(2)二氧化碳能使石灰水变或是氢氧化钡变浑浊;
(3)一氧化碳能使黑色的氧化铜粉末变为红色,生成物是铜和二氧化碳;
(4)一氧化碳的处理可以采用点燃法,生成的二氧化碳是无毒的;
(5)一氧化碳可以和银氨溶液之间发生反应生成金属银,据此回答.(1)水的检验可以用无水硫酸铜来检验,所以装置B中盛装的药品是无水硫酸铜,故答案为:无水硫酸铜;
(2)二氧化碳能和氢氧化钡反应生成碳酸钡和水,溶液变浑浊,可以用于二氧化碳的检验,故答案为:检验二氧化碳的产生;
(3)一氧化碳能使黑色的氧化铜粉末变为红色,反应的生成物是铜和二氧化碳,即CO+CuO
△
.
Cu+CO2,E中黑色固体变红色,F中石灰水变浑浊,可以证明一氧化碳的存在,故答案为:CO+CuO
△
.
Cu+CO2;E中黑色固体变红色,F中石灰水变浑浊;
(4)一氧化碳点燃生成的二氧化碳是无毒的,可以用点燃法处理,故答案为:将尾气点燃;
(5)一氧化碳可以和银氨溶液之间发生反应生成金属银,反应为:CO+2Ag(NH3)2OH=2Ag↓+NH3+(NH4)2CO3,故答案为:CO+2Ag(NH3)2OH=2Ag↓+NH3+(NH4)2CO3.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查学生物质的性质以及检验知识,注意知识的归纳和梳理是解题的关键,难度不大.1年前查看全部
- 某款新型电动轿车,每充一次电,锂离子电池储存的能量为50kW·h,可供该车连续行驶300km,其最高车速可达250km/
某款新型电动轿车,每充一次电,锂离子电池储存的能量为50kW·h,可供该车连续行驶300km,其最高车速可达250km/h.
(1)电动轿车的顶部向上凸起,当它高速行驶时,车顶的气压比车底的气压 .
(2)若该车以108km/h的速度匀速行驶10min,通过的路程是多少?
(3)该车连续行驶100km消耗的电能相当于完全燃烧多少升柴油产生的热量.(q柴油=4.3×107J/kg,ρ柴油=0.85×103kg/m3,计算结果保留两位小数) weifhappy1年前1
weifhappy1年前1 -
 chrissy1224 共回答了18个问题
chrissy1224 共回答了18个问题 |采纳率94.4%既然是车头凸起,那车顶的气压应该是低
108/60*10=18km
50/3kw.h.1KW.h=3600000J.
(50/3*3600000)/4.3×107/0.85×103/10001年前查看全部
- 锂离子电池已经成为第一代实用化的蓄电池,该电池具有能量密度大、电压高的特性.锂离子电池放电时的电极反应式为:
锂离子电池已经成为第一代实用化的蓄电池,该电池具有能量密度大、电压高的特性.锂离子电池放电时的电极反应式为:
负极反应:C6Li-xe-═C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料);
正极反应:Li1-xMO2+xLi++xe-═LiMO2(LiMO2表示含锂的过渡金属氧化物).
下列有关说法正确的是( )
A. 锂离子电池充电时电池反应为LiMO2+C6Li1-x═C6Li+Li1-xMO2
B. 电池反应中,锂、锌、银、铅各失去1 mol 电子,金属锂所消耗的质量最大
C. 锂离子电池放电时电池内部Li+向负极移动
D. 锂离子电池充电时阴极反应为C6Li1-x+xLi+-xe-═C6Li 光比霜雪1年前1
光比霜雪1年前1 -
 最后悔爱谁555 共回答了15个问题
最后悔爱谁555 共回答了15个问题 |采纳率93.3%解题思路:A.充电时电池反应式为放电电池反应式相反;
B.根据m=nM计算其质量;
C.放电时,电池内部阳离子向正极移动,阴离子向负极移动;
D.充电时,阴极上得电子发生还原反应,与放电时负极电极反应式相反.A.充电时电池反应式为放电电池反应式相反,放电时电池反应式为C6Li+Li1-xMO2=C6Li1-x+LiMO2,则充电时电池反应式为C6Li1-x+LiMO2=C6Li+Li1-xMO2,故A正确;
B.电池反应中,锂、锌、银、铅各失去1 mol 电子,消耗这几种金属的物质的量分别是1mol、0.5mol、1mol、0.5mol,根据m=nM知,消耗其质量分别是7g、32.5g、108g、103.5g,所以消耗Li质量最小,故B错误;
C.放电时,电池内部阳离子向正极移动,阴离子向负极移动,所以Li+向正极移动,故C错误;
D.充电时,阴极上得电子发生还原反应,与放电时负极电极反应式相反,则电极反应式为C6Li1-x+xLi++xe-═C6Li,故D错误;
故选A.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解池原理,明确蓄电池中正负极与阳极、阴极电极反应式关系是解本题关键,结合电池内部阴阳离子移动方向即可解答,题目难度不大.1年前查看全部
- 电压为3.6伏,750mhA的锂离子电池,一次最多能向外提供多少电能?
 rain_dongrui1年前5
rain_dongrui1年前5 -
 landowner_20 共回答了18个问题
landowner_20 共回答了18个问题 |采纳率83.3%3.6V*750mAh=3.6*0.75*3600J=0.9*3*3600J=9720J1年前查看全部
- (2012•湛江一模)锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的.因此锂离子电池回收具有重要意义,其中需要重
(2012•湛江一模)锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的.因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂.某回收工艺流程如下:
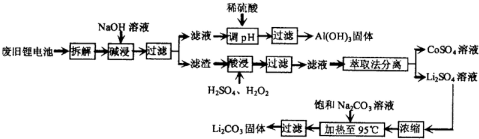
(1)上述工艺回收到的产物有Al(OH)3、______.
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全,对拆解环境的要求是______.
(3)酸浸时反应的化学方程式为______.如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是______.
(4)生成Li2CO3的化学反应方程式为______.已知Li2CO3在水中的溶解度随着温度的升高而减小,所以在浓缩结晶后要______过滤. 雪里红9981年前1
雪里红9981年前1 -
 双眼皮小猪 共回答了17个问题
双眼皮小猪 共回答了17个问题 |采纳率94.1%解题思路:(1)根据工艺流程的最终产物可判断回收到的产物,应为Al(OH)3、CoSO4、Li2CO3;
(2)从金属锂的化学性质分析,锂为活泼金属;
(3)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式;由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成;
(4)根据质量守恒定律来书写化学方程式,Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤.(1)工艺流程的最终产物为:Al(OH)3、CoSO4、Li2CO3,故答案为:CoSO4、Li2CO3;
(2)金属锂性质活泼,易与氧气、水发生反应,故答案为:隔绝空气和水分;
(3)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:
2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成,
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O;有氯气生成,污染较大;
(4)碳酸锂难溶,生成Li2CO3的化学反应属于复分解反应,Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤,故答案为:Li2SO4+Na2CO3=Na2SO4+Li2CO3↓;趁热.点评:
本题考点: 金属的回收与环境、资源保护;绿色化学;氧化还原反应;物质的分离、提纯和除杂.
考点点评: 本题为生产流程题,涉及金属的回收、环境保护、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息.本题难度中.1年前查看全部
- 下列属于消耗电能的是∶ A手机中正在使用的锂离子电池 B发电机 C电池 D充
下列属于消耗电能的是∶ A手机中正在使用的锂离子电池 B发电机 C电池 D充
下列属于消耗电能的是∶ A手机中正在使用的锂离子电池 B发电机 C电池 D充电中的蓄电池 请帮我分析这答案外的3个怎么不是 小二上西瓜1年前2
小二上西瓜1年前2 -
 的我都愿 共回答了17个问题
的我都愿 共回答了17个问题 |采纳率82.4%A.化学能转化为电能
B 机械能转化为电能
C 处于不同的状态,能量的转化也不同,无法判断
D 电能转化化学能
正解D1年前查看全部
大家在问
- 1CAD里图例:指图的比例怎么设定,
- 2改写文章怎么写?有现成的最好!
- 3英语的一道题.A:Excuse me .1__________ the Children's hospital?B:So
- 4数学 (a)某中学全校有m班,每班有a个男生及b个女生,以代数式表示全校学生的人数.
- 5一定质量的理想气体从状态 a 经历了温度缓慢升高到状态 d 的变化,下面的表格和 V-T 图各记录了其部分变化过程,试求
- 6Miss Li is deaf.So___can"t hear.(代词正确形式填空)
- 7(2008•北京一模)如图A与B是实验室常用来制取气体的装置,根据所学知识回答以下问题:
- 8I _ _ _ my parents 我和父母亲去采橘子了
- 9作者是从哪几个方面描写盛开的紫藤萝树,紫藤萝有过怎样的变迁,作者为什么会对紫藤萝产生这样浓厚的情感
- 10下列词语中没有错别字的一项是( )(2分) A.漪沦婉解鬈曲漠不关心 B.缔结峥嵘掂念
- 11找规律:-1,-4,7,10,( ),( )•••••这列数
- 12判断题:(1)生物体的生长,发育过程离不开细胞.( 错误 )
- 13你的尺子用英语怎么说
- 14(2008•江门模拟)如图表示免疫球蛋白IgG的结构示意图,其中-S-S-表示连接两条相邻肽链的二硫键.下列说法正确的是
- 15在如图6所示的电路中,电容器C的上极板带正电,为了使该极板仍带正电且电荷量增大,下列办法中可采用的是(