胆矾晶体是是电解质吗?我正在做一道化学题,胆矾晶体是不能导电的电解质吗?
 天使任务62022-10-04 11:39:541条回答
天使任务62022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 fff_000 共回答了15个问题
fff_000 共回答了15个问题 |采纳率86.7%- 是电解质 水溶液导电 但晶体不导电
- 1年前
相关推荐
- 双氧水与铜,稀硫酸制胆矾晶体的化学式
 mccoy_sun1年前2
mccoy_sun1年前2 -
 夫禾 共回答了25个问题
夫禾 共回答了25个问题 |采纳率84%题目说好的了用双氧水与铜,稀硫酸!楼上怎么用其他东西,还不知从哪生出CuO,难道拿CuCl2去灼烧啊!
方程式:H2O2 + Cu + H2SO4 == CuSO4 + 2H2O
不明白地方HI我,新年快乐!1年前查看全部
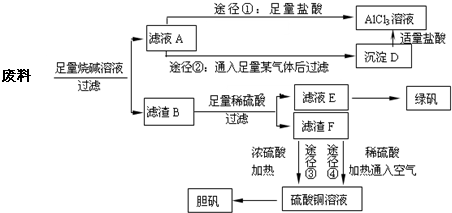
- 某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下图所
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下图所示。 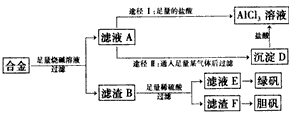
(1)过滤用的仪器已有:滤纸、铁架台、铁圈和烧杯,还需要的玻璃仪器是__________。
(2)由滤液A制AlCl 3 溶液有途径I和途径Ⅱ两种,你认为合理的是_________,理由是_____________。
(3)从滤液E中得到绿矾的实验操作是_________。
(4)按环保要求,写出用滤渣F制备胆矾的各步反应的化学方程式___________________。
(5)有同学提出可将方案中最初溶解合金的烧碱改为盐酸,重新设计方案,也能得到三种物质,你认为后者的方案是否更合理_________,理由是______________________。 古道人惆怅1年前1
古道人惆怅1年前1 -
 whiteblue919 共回答了17个问题
whiteblue919 共回答了17个问题 |采纳率94.1%(1)漏斗、玻璃棒
(2)Ⅱ;途径I制得的AlCl 3 溶液中含有大量的NaCl,而途径Ⅱ能制得纯净的AlCl 3 溶液
(3)蒸发、浓缩、冷却结晶
(4) 2Cu+O 2 = 2CuO;CuO+H 2 SO 4 = CuSO 4 +H 2 O;CuSO 4 +5H 2 O = CuSO 4 ·5H 2 O
(5)不合理;后者操作步骤多,消耗试剂量大,实验时间长1年前查看全部
- 如何制胆矾晶体
 guquan11091年前3
guquan11091年前3 -
 zhouzhuwu 共回答了20个问题
zhouzhuwu 共回答了20个问题 |采纳率80%方法一:用CuO和稀硫酸反应后滤液结晶得到
实验用品:铁架台(带铁圈)、蒸发皿、坩埚钳、玻璃棒、烧杯、量筒、漏斗、滤纸、剪刀、药匙、氧化铜、稀硫酸(1:4)
实验步骤:
1.用量筒量取15 mL稀硫酸(1:4)倒入一个蒸发皿里,蒸发皿放在铁架台的铁圈上,用酒精灯加热到将近沸腾(但不要使稀硫酸沸腾).然后注意保持这个温度,一边用玻璃棒进行搅拌,一边慢慢地撒入氧化铜粉末,直到氧化铜不再溶解为止.记录观察到的现象.
2.装置好漏斗,趁热过滤(过滤时不溶性物质可以留在蒸发皿里,不必转移到滤纸上).将滤液收集在烧杯里.使滤液逐渐冷却,仔细观察晶体生成时所发生的现象,并记录晶体的颜色和形状.如果滤液放置一段时间后,没有晶体生成,可以把滤液倒入洗净的蒸发皿里蒸发几分钟,再放置冷却,就会有晶体生成.
方法二:硫酸铜晶体溶解后利用晶种再结晶得到
~
称取75 g硫酸铜晶体放在烧杯里,加水200 mL.当晶体完全溶解后过滤,得到澄清的硫酸铜饱和溶液.取一块硫酸铜小晶体作晶种,用细铜丝扎牢后吊入溶液中.每隔2 3天,把上述晶体和溶液转入另一烧杯中,除去烧杯底部析出的小晶粒.一段时间后晶体不断长大,并且从不规则形逐渐变成规则的晶体.晶体长大后从溶液中取出,擦干表面后涂上清漆或其他保护层,以防止表面风化
说明:配置的硫酸铜溶液必须是饱和的.硫酸铜溶解时可以稍加热,然后冷却到室温后过滤.1年前查看全部
- 蓝色胆矾晶体为什么在空气中久置会变白?
 bai0080wu1年前3
bai0080wu1年前3 -
 kaikailake 共回答了15个问题
kaikailake 共回答了15个问题 |采纳率86.7%是因为失去结晶水的原因
CUSO4.5H2O=CUSO4+5H2O1年前查看全部
- 加热胆矾晶体测其结晶水含量时,加热过程中坩埚没有盖盖
加热胆矾晶体测其结晶水含量时,加热过程中坩埚没有盖盖
误差偏大还是偏小还是无误差 tousesad1年前1
tousesad1年前1 -
 素蝶jin 共回答了10个问题
素蝶jin 共回答了10个问题 |采纳率80%没有误差;而加热法测定胆矾晶体中结晶水含量时必须冷却后称量,否则测得的质量偏小.1年前查看全部
- (2009•梅州二模)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利
(2009•梅州二模)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用.其实验方案如下:
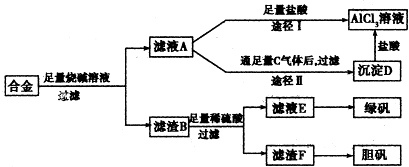
试回答下列问题:
(1)写出滤液A转化为沉淀D的离子方程式______.
(2)由滤液A制AlCl3溶液有途径I和途径Ⅱ两种,你认为合理的是______,理由是______.
(3)从滤液E中得到绿矾的实验操作是______.
(4)按环保要求,写出用滤渣F制备胆矾的各步反应的化学方程式2Cu+O2
2CuO、CuO+H2SO4=CuSO4+H2O△ .2Cu+O2.
2CuO、CuO+H2SO4=CuSO4+H2O△ .
(5)有同学提出可将方案中最初溶解合金的烧碱改为盐酸,重新设计方案,也能得到三种物质,你认为后者的方案是否更合理______,理由是______. 我不是gg的gg1年前1
我不是gg的gg1年前1 -
 看那一剑的风情 共回答了27个问题
看那一剑的风情 共回答了27个问题 |采纳率96.3%解题思路:铝可与氢氧化钠反应,当合金与氢氧化钠反应时,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,所得滤液A为NaAlO2溶液,经途径Ⅰ与足量盐酸反应可生成AlCl3溶液,在NaAlO2溶液中通过过量 的二氧化碳气体,发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,生成的氢氧化铝再和盐酸反应生成AlCl3,途径Ⅱ得到的AlCl3较纯净;
滤渣B为Fe和Cu的化合物,加入足量稀硫酸,得到的滤液E为FeSO4,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,可用于制备胆矾,以此解答该题.铝可与氢氧化钠反应,当合金与氢氧化钠反应时,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,所得滤液A为NaAlO2溶液,经途径Ⅰ与足量盐酸反应可生成AlCl3溶液,在NaAlO2溶液中通过过量 的二氧化碳气体,发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,生成的氢氧化铝再和盐酸反应生成AlCl3,途径Ⅱ得到的AlCl3较纯净;
滤渣B为Fe和Cu的化合物,加入足量稀硫酸,得到的滤液E为FeSO4,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,可用于制备胆矾,
(1)铝、铁、铜的合金中只有金属铝可以和强碱反应生成偏铝酸钠和氢气,所以滤液A的成分是偏铝酸钠,可以和过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,实质为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,发生的互促水解反应,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)NaAlO2溶液,经途径Ⅰ与足量盐酸反应可生成AlCl3溶液,但溶液中混有NaCl,在NaAlO2溶液中通过过量的二氧化碳气体,发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,生成的氢氧化铝再和盐酸反应生成AlCl3,途径Ⅱ得到的AlCl3较纯净,
故答案为:途径Ⅱ;因为滤液A是NaAlO2和NaOH溶液,按途径I直接向A中加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质,按途径Ⅱ,通入CO2气体,得Al(OH)3沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液.所以途径Ⅱ更合理;
(3)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,即可得到绿矾,故答案为:蒸发浓缩、冷却结晶;
(4)铜不能和稀硫酸反应,所以滤渣F是金属铜,Cu中加入稀硫酸和H2O2可以制备胆矾晶体,反应方程式为:Cu+H2SO4+3H2O+H2O2=CuSO4•5H2O,从环境保护的角度考虑,可先加热铜生成氧化铁,然后用氧化铜和稀硫酸反应制备胆矾,反应的方程式有2Cu+O2
△
.
2CuO、CuO+H2SO4=CuSO4+H2O,
故答案为:2Cu+O2
△
.
2CuO、CuO+H2SO4=CuSO4+H2O;
(5)将方案中最初溶解合金的烧碱改为盐酸,铁、铝与盐酸都反应,应加入过量的氢氧化钠分离二者,消耗的试剂量更多,且操作复杂,不与原实验方案合理,
故答案为:不合理;因为后者操作步骤多,消耗的试剂量更多,时间长.点评:
本题考点: 制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题综合考查物质的制备和性质探究等知识,侧重于学生的分析能力、实验能力的考查,为高考常见题型,注意把握实验的操作原理和步骤,把握相关物质的性质,难度中等.1年前查看全部
- 下列过程中,没有发生化学变化的是( ) A.将胆矾晶体研碎至细末 B.铜丝在火焰上灼烧至黑色 C.新鲜牛奶久置后变味
下列过程中,没有发生化学变化的是( ) A.将胆矾晶体研碎至细末 B.铜丝在火焰上灼烧至黑色 C.新鲜牛奶久置后变味 D.人体组织消化葡萄糖  斧头帮总部1年前1
斧头帮总部1年前1 -
 yyd 共回答了15个问题
yyd 共回答了15个问题 |采纳率86.7%生成了其它物质的变化叫化学变化,其本质特征是该变化过程中有其它物质生成.
A、将胆矾晶体研碎至细末,只是发生了物态变化,该变化过程中没有其它物质生成,所以正确.
B、铜丝在火焰上灼烧至黑色是因铜被氧化成了氧化铜,该变化过程中有其它物质生成,所以错误.
C、新鲜牛奶久置后变味是因缓慢氧化变质了,该变化过程中有其它物质生成,所以错误.
D、人体组织消化葡萄糖,最终葡萄糖要变成水和二氧化碳,该变化过程中有其它物质生成,所以错误.
故选A.1年前查看全部
- 配置250ml0.2mol/L硫酸铜溶液需取胆矾晶体多少g?
 xiahuixia781年前1
xiahuixia781年前1 -
 renjun_1120 共回答了20个问题
renjun_1120 共回答了20个问题 |采纳率75%250mL 0.2mol/L的硫酸铜溶液所需无水硫酸铜的物质的量是0.2*0.250=0.05mol,故所需的胆矾晶体(五水硫酸铜)的物质的量也是0.05mol,也就是0.05*250=12.5g1年前查看全部
- (2014•虹口区一模)胆矾晶体是硫酸铜的结晶水合物,其化学式为CuSO4•5H2O,在加热情况下,按温度不同,胆矾晶体
(2014•虹口区一模)胆矾晶体是硫酸铜的结晶水合物,其化学式为CuSO4•5H2O,在加热情况下,按温度不同,胆矾晶体会历经一系列的变化,得到不同组成的固体.
(1)称取0.1000g含有杂质的胆矾试样于锥形瓶中,加入0.1000mol/L氢氧化钠溶液28.00mL,反应完全后,过量的氢氧化钠用0.1000mol/L硫酸滴定到终点,消耗硫酸10.08mL,则试样中胆矾的质量分数为______.(已知:CuSO4+2NaOH→Cu(OH)2+Na2SO4;试样中的杂质不与酸、碱反应)
(2)将1.250g纯净的胆矾晶体置于坩埚中加热一段时间,测得剩余固体质量为0.960g.剩余固体中结晶水的质量分数为______(保留三位小数).
(3)将无水硫酸铜加热至650℃以上,可得到黑色的氧化铜与三氧化硫、二氧化硫和氧气的混合气体.现将9.600g无水硫酸铜充分加热分解为氧化铜,将生成的气体通过足量的吸收剂(碱石灰),吸收剂增重4.416g.计算最终吸收剂中硫酸盐与亚硫酸盐的物质的量之比.
(4)无水硫酸铜受热分解成氧化铜之前,有一种黄色中间产物X出现,其化学式可以表示为CuaOb(SO4)c(a,b,c为整数).将X放入水中,有不溶的蓝色沉淀Y生成(化学式为CuSO4•nCu(OH)2),同时还有[2/3]的硫酸根溶于水.若对Y进行加热脱水,将失去11.9%的质量.已知X和Y均可溶于稀硫酸.通过计算确定X和Y的化学式______. 真没品1年前1
真没品1年前1 -
 archibald 共回答了19个问题
archibald 共回答了19个问题 |采纳率89.5%解题思路:(1)根据题中的信息,当向胆矾中加入氢氧化钠溶液发生反应:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,反应后再加H2SO4将剩余的NaOH中和,则根据:H2SO4+2NaOH═Na2SO4+H2O,计算出剩余剩余NaOH的物质的量,从而计算出与胆矾反应的NaOH的物质的量,算出CuSO4物质的量,进一步其质量,继而得出答案;
(2)根据CuSO4•5H2O
CuSO4+5H2O,采用假设的方法,假设胆矾完全分解时,求出得到固体的质量,与题中给出的固体的质量相比较,从而判断胆矾是否完全分解,然后根据判断的结果,根据反应方程式的计算,求出未分解的胆矾的量,进一步推算晶体中结晶水的质量分数.即得答案;加热 .
(3)根据题中的信息硫酸铜加热至650℃以上,可得到黑色的氧化铜与三氧化硫、二氧化硫和氧气的混合气体,将生成的气体通过足量的吸收剂(碱石灰)吸收,吸收剂增重4.416g,则碱石灰只能吸收三氧化硫、二氧化硫,所以三氧化硫和二氧化硫的质量之和为4.416g,再根据9.600g无水硫酸铜充分加热分解,求出无水硫酸铜的物质的量,根据原子守恒算出二氧化硫与三氧化硫的物质的量之和,列方程求解,既得二氧化硫、三氧化硫的物质的量.即为亚硫酸钠、硫酸钠,即得答案;
(4)根据题意Y的化学式为CuSO4•nCu(OH)2,是一种不溶物,将其加热脱水,失去11.9%的质量,则有[18n/160+98n]×100%=11.9%;算出n值既得Y的化学式;再根据Y是由X和水相遇生成的,而且X和水相遇时,有[1/3]硫酸铜转化为Y,有[2/3]的溶解了这一条件,为了做题的方便,可假设Y为3mol,则有X和水相遇时Y为1mol,CuSO4 2mol,由X和Y的化学式可知,X+H2O→Y,根据原子守恒,可将Y转变为CuSO4•3CuO•3H2O的形式,则推出黄色中间产物含有Cu2+、SO42-的个数比为2:1,根据电荷守恒推出答案.(1)根据题中的条件,向0.1000g含有杂质的胆矾试样于锥形瓶中,加入0.1000mol/L氢氧化钠溶液28.00mL,反应完全后,氢氧化钠过量,剩余的氢氧化钠用0.1000mol/L硫酸中和消耗硫酸10.08mL.
设与0.1000mol/L、10.08mL硫酸反应的氢氧化钠的物质的量为xmol,则有
H2SO4+2NaOH═Na2SO4 +H2O
1mol 2mol
0.1000mol/L×0.01008L x
解得:x=0.002016mol
则与胆矾中硫酸铜反应的氢氧化钠的物质的量为:
0.1000mol/L×0.02800L-0.002016mol=0.000784mol
设胆矾中CuSO4的物质的量为ymol,则有
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
1mol 2mol
ymol 0.000784mol
解得:y=0.000392mol.
m(CuSO4)=0.000392mol×250gmol-1=0.098g
则胆矾中CuSO4的质量分数为:[0.0098g/0.1g]×100%=98%.
故答案为:98%
(2)1.250g胆矾的物质的量为:[1.25g
250g•mol−1=0.005mol
假设当0.005molCuSO4•5H2O完全分解时生成固体的物质的量为nmol,则有
CuSO4•5H2O
加热
./ ]CuSO4+5H2O
1mol 1mol
0.005mol nmol
解得n=0.005mol,
m( CuSO4)=0.005mol×160gmol-1=0.8g<0.960g
故胆矾只是部分分解,设发生分解的胆矾的物质的量为mmol,则有:
CuSO4•5H2O
加热
.
CuSO4+5H2O
1mol 1mol
mmol mmol
根据题中的条件剩余固体为 CuSO4•5H2O、CuSO4的混合物,其质量为0.960g,则有
m(CuSO4•5H2O)+m(CuSO4)=(0.005-m)mol×250gmol-1-160mg=0.960g
解得:m=[0.29/90mol
所以剩余固体中,n( CuSO4•5H2O)=0.005mol-
0.29
90mol=
0.16
90]mol
剩余固体中 CuSO4•5H2O晶体中结晶水的质量为:m(H2O)=[0.16/90]mol×90gmol-1=0.16g
所以,剩余固体中结晶水的质量分数为:[0.16g/0.96g×100%=16.7%
故答案为:16.7%
(3)根据题中的信息:无水硫酸铜加热至650℃以上,可得到黑色的氧化铜与三氧化硫、二氧化硫和氧气的混合气体,将生成的气体通过足量的吸收剂(碱石灰),(碱石灰)增重4.416g,则有:
m(SO2)+m(SO3)=4.416g ①.
9.600g无水硫酸铜物质的量为:
9.6g
160g•mol−1]=0.06mol,根据发生化学反应时原子守恒,则有:
n(SO2)+n(SO3)=0.06mol ②,将①变化为64•n(SO2)+80n(SO3)=4.416g ③
解②、③得 n(SO2)=0.024mol、n(SO3)=0.036mol,再根据原子守恒得出:
n(Na2SO4)=n(SO3)=0.036mol;n(Na2SO3)=0.024mol
所以n(Na2SO4):n(Na2SO3)=0.036mol:0.024mol=3:2
故答案为:3:2
(4)根据Y(化学式为CuSO4•nCu(OH)2)加热脱水,将失去11.9%的质量,则有:
[18n/160+98n]×100%=11.9%;解得n=3,故Y的化学式为:CuSO4•3Cu(OH)2;
再根据Y是由X和水相遇生成的,而且X和水相遇时,有点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题是一道好题,而且难度较大,解答时要特别注意,化学过程的分析,特别是(4)题意要分析清楚,极易出错.1年前查看全部
- (2009•中山模拟)某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾晶体
(2009•中山模拟)某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾晶体(CuSO4•5H2O),以探索工业废料的再利用.其实验方案如图:
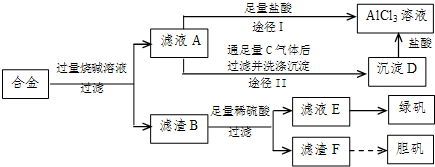
试回答下列问题:
(1)写出滤液A转化为沉淀D的离子方程式______.
(2)由滤液A制AlCl3溶液的途径有I和II两条,你认为合理的是途径______(填“I”或“II”),理由是______.
(3)从滤液E中得到绿矾晶体的实验操作是(不考虑E中的溶质被氧化这一因素):______.
(4)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣F中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总的化学方程式为______.
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否合理?______.理由是______. redngry1年前1
redngry1年前1 -
 紫灵梦雪 共回答了13个问题
紫灵梦雪 共回答了13个问题 |采纳率92.3%解题思路:(1)根据所发生的反应来确定溶液的组成情况,并书写发生的反应;
(2)根据反应所得产物的组成来选择合适的制取方案;
(3)根据溶液来得到晶体来分析实验操作;
(4)根据铜、稀硫酸、双氧水的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式;
(5)根据实验中的酸和碱的量的情况来对比回答.(1)铝、铁、铜的合金中只有金属铝可以和强碱反应生成偏铝酸钠和氢气,所以滤液A的成分是偏铝酸钠,可以和过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,实质为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,
故答案为:Ⅱ;因为滤液A是偏铝酸钠和氢氧化钠溶液,按途径I直接向A中加入盐酸得到的AlCl3溶液中含有大量的氯化钠杂质;按途径II通入二氧化碳气体,得Al(OH)3沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液;
(3)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,即可得到绿矾,故答案为:蒸发浓缩、冷却结晶;
(4)铜不能和稀硫酸反应,贴可以和硫酸反应,所以滤渣F是金属铜,Cu中加入稀硫酸和H2O2可以制备胆矾晶体,反应方程式为:Cu+H2SO4+3H2O+H2O2=CuSO4•5H2O,故答案为:Cu+H2SO4+3H2O+H2O2=CuSO4•5H2O;
(5)在实验方案一中,酸的量的控制上没有过高的要求,只需过量即可,但是方案二中,需要的是适量的酸,这很难控,故答案为:不合理;因为该方案操作步骤多、时间长,消耗试剂量大.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;制备实验方案的设计.
考点点评: 本题是对物质的分离和提纯知识点的考查,题目难度不是很大,可以根据所学的知识进行.1年前查看全部
- 如题.用胆矾晶体配制250mL0.5mol/L的CUSO4溶液.写出操作步骤.
 风行天下00141年前1
风行天下00141年前1 -
 hzwgq 共回答了20个问题
hzwgq 共回答了20个问题 |采纳率95%称31.25克胆矾,放入干净的100ml烧杯中,用蒸馏水溶解;借助玻棒把溶液转入250ml的容量瓶,在烧杯中加少量蒸馏水洗涤2~3次,洗后溶液直接用玻棒辅助转入容量瓶;再向容量瓶中加蒸馏水,快到标线时,改用滴管滴加蒸馏水至液弧与标线平齐止.盖上玻塞(盖玻塞注意方向)摇匀.1年前查看全部
- 在100g硫酸铜溶液中加入10g胆矾晶体,完全溶解后,所得溶液的溶质质量分数为10%,
在100g硫酸铜溶液中加入10g胆矾晶体,完全溶解后,所得溶液的溶质质量分数为10%,
则原硫酸铜溶液的溶质质量分数是多少.需要计算过程 何草不黄11年前1
何草不黄11年前1 -
 太原城市yy 共回答了18个问题
太原城市yy 共回答了18个问题 |采纳率94.4%胆矾是五水硫酸铜,CuSO4·5H2O相对分子质量250,其中160是硫酸铜,90是水.
加入10g胆矾晶体,溶质增加 10×160÷250 = 6.4g
溶液(水) 增加 10×90÷250 = 3.6g
溶液共110g,溶质质量分数为10%,所以含溶质11g
原100g溶液含溶质:11-6.4 = 4.6g
所以原硫酸铜溶液的溶质质量分数是:4.6 ÷ 100 × 100% = 4.6%1年前查看全部
- 某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
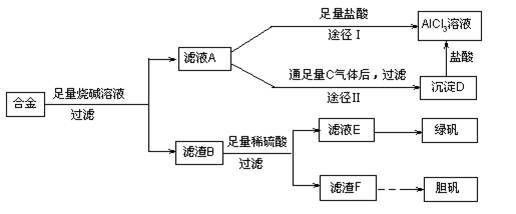
试回答下列问题:
(1)过滤用的器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是 。(2)由滤液A制得AlCl 3 溶液有途径Ⅰ和Ⅱ两条,你认为合理的是 ,理由是 。
(3)从滤液E中得到绿矾晶体的实验操作是 。
(4)写出用滤渣F制备胆矾晶体的有关化学方程式 。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理 ,理由是 。 samike1年前1
samike1年前1 -
 爱你很高兴 共回答了21个问题
爱你很高兴 共回答了21个问题 |采纳率95.2%(1)漏斗、玻璃棒。(2分)
(2)途径Ⅱ更合理;(1分)因为滤液A是NaAlO 2 溶液,按途径I直接向A加入盐酸得到的AlCl 3 溶液中含有大量的NaCl杂质;按途径II,通入c(CO 2 )气体,得D[Al(OH) 3 ]沉淀,将Al(OH) 3 溶解于盐酸中得到的是纯净的AlCl 3 溶液。所以途径Ⅱ,更合理。
(3)蒸发浓缩,冷却结晶。
(4)2Cu+O 2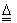 2CuO;CuO+H 2 SO 4 =CuSO 4 +H 2 O
2CuO;CuO+H 2 SO 4 =CuSO 4 +H 2 O
或 2Cu + O 2 + 2H 2 SO 4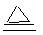 2CuSO 4 + 2H 2 O
2CuSO 4 + 2H 2 O
(5)后者的方案不合理。(1分)因为该方案不符合实验方案设计的简约性原则,即操作步骤多、消耗试剂量更大、时间长。(2分)
略1年前查看全部
- 某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、胆矾晶体
 wendy10011年前1
wendy10011年前1 -
 一个半酒窝 共回答了26个问题
一个半酒窝 共回答了26个问题 |采纳率96.2%铝被碱溶解,剩下铁铜.然后铁被酸溶解剩下铜.F是铜.1年前查看全部
- 20℃时,硫酸铜的溶解度为20g,现向240g饱和硫酸铜溶液加入16g无水硫酸铜固体,充分搅拌后可以析出多少g胆矾晶体?
20℃时,硫酸铜的溶解度为20g,现向240g饱和硫酸铜溶液加入16g无水硫酸铜固体,充分搅拌后可以析出多少g胆矾晶体?
答案是28.2g 夏季梅花泪1年前2
夏季梅花泪1年前2 -
 ljg99 共回答了20个问题
ljg99 共回答了20个问题 |采纳率95%硫酸铜分子量160,五水硫酸铜分子量是250
240g饱和硫酸铜溶液含40g无水硫酸铜,20:120=40:240
设置可以析出胆矾晶体x克
20:120=(40+16-x*160/250):(240+16-x)
化简,20:120=(x*160/250-16):(x-16)
0.64x*6-96=x-16,
2.84x=80
解得x=28.171年前查看全部
- 用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会导致无水硫酸铜吸收空气中的水重新形成结晶水合物,导致结果偏低,(请问
用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会导致无水硫酸铜吸收空气中的水重新形成结晶水合物,导致结果偏低,(请问这样的结论是如何分析出来的.)据我的分析确是偏高.
 nlc20061年前2
nlc20061年前2 -
 防腐剂之女 共回答了12个问题
防腐剂之女 共回答了12个问题 |采纳率100%结晶水的含量是根据前后质量差得出的,而吸水会导致后一次称量的质量变大,使质量差变小,结果变小1年前查看全部
- 下列说法正确的是( )A.只有在标准状况下22.4L的任何气体才含有NA个分子B.将25g胆矾晶体溶于1000mL水中
下列说法正确的是( )
A.只有在标准状况下22.4L的任何气体才含有NA个分子
B.将25g胆矾晶体溶于1000mL水中,所得溶液中CuSO4的物质的量浓度为0.1mol/L
C.气体摩尔体积就是22.4L/mol
D.标准状况下,11.2LNH3含有的电子数约为5NA warfarin1年前1
warfarin1年前1 -
 飘121 共回答了18个问题
飘121 共回答了18个问题 |采纳率77.8%解题思路:A、在非标准状况下22.4L的任何气体也可以有NA个分子;
B、分清结晶水合物溶于水后的浓度计算;
C、根据气体摩尔体积的概念和应用条件分析;
D、计算物质的量,结合分子中的电子数进行计算.A、在非标准状况下,根据气态方程PV=nRT,温度和压强都是标准状况的相同倍数时,22.4L的任何气体也可以有NA个分子,故A错误;
B、25g胆矾晶体的物质的量为0.1mol,是结晶水合物,溶于1000mL水中,所得溶液体积大于1L,所得溶液中CuSO4的物质的量浓度小于0.1mol/L,故B错误;
C、标准状况下,气体摩尔体积约为22.4L/mol,故C错误;
D、标准状况下,11.2LNH3的物质的量为0.5mol,1molNH3含10mol电子,所以0.5molNH3含5mol电子即5NA,故D正确;
故选D.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查了阿伏伽德罗常数的应用,气态摩尔体积的应用条件,结晶水合物的溶液组成,分子与电子数的关系.1年前查看全部
- 在氯化铜溶液中加入稀硫酸和双氧水来制备胆矾晶体总化学方程式
 云上人家1年前3
云上人家1年前3 -
 借你的翅膀 共回答了16个问题
借你的翅膀 共回答了16个问题 |采纳率87.5%应该是铜.
化学方程式:Cu + H2SO4 + H2O2 + 4H2O == CuSO4.5H2O1年前查看全部
- 00%硫酸铜溶液的密度)已知2.00%硫酸铜溶液的密度为1.02g/ml,欲配置500ml这种溶液,需要胆矾晶体多少克?
00%硫酸铜溶液的密度)
已知2.00%硫酸铜溶液的密度为1.02g/ml,欲配置500ml这种溶液,需要胆矾晶体多少克?所得溶液的物质的量浓度是多少? ramon30001年前4
ramon30001年前4 -
 法师的泪 共回答了19个问题
法师的泪 共回答了19个问题 |采纳率89.5%500*1.02*2%=10.2g,注意这是硫酸铜质量.即10.2/160=0.06375mol的硫酸铜,那么就需要0.06375mol的胆钒晶体
0.06375/0.5=0.1275mol/L1年前查看全部
- 未研碎的胆矾晶体的颜色与已研碎胆矾晶体的颜色是否相同?为什么?
 妮妹儿1年前1
妮妹儿1年前1 -
 狗才草天黑老母8 共回答了16个问题
狗才草天黑老母8 共回答了16个问题 |采纳率81.3%应该一样的吧~结构又没有变化
楼上的,是研碎!不是加热灼烧---结晶水又没有被去掉,只是体积由大变小罢了~1年前查看全部
- 用加热法测定胆矾晶体中结晶水含量时为什么必须冷却后称量
 snfj12371年前3
snfj12371年前3 -
 baiyin 共回答了21个问题
baiyin 共回答了21个问题 |采纳率90.5%热的物质称量时,由于周围的空气受热,会产生浮力,而使测得的质量偏小.
所以,要在干燥器中冷却至室温,再进行称量,且两次称量偏差不超过0.1g,就认为可以了.1年前查看全部
- 问一个关于溶解的问题请问往饱和硫酸铜溶液中加入无水硫酸铜与加入硫酸铜晶体(胆矾晶体)溶液变化有什么区别?请给以详细说明,
 广岛之恋囚鸟1年前1
广岛之恋囚鸟1年前1 -
 hjfenger 共回答了24个问题
hjfenger 共回答了24个问题 |采纳率83.3%往饱和硫酸铜溶液中加入无水硫酸铜,溶液析出晶体,溶质减少,溶剂减少,析出比原来质量增加,加入硫酸铜晶体无明显变化1年前查看全部
- 胆矾晶体用杵研碎变成蓝色粉末吗?
胆矾晶体用杵研碎变成蓝色粉末吗?
是粉末还是晶体? 杨不及备封马丙1年前1
杨不及备封马丙1年前1 -
 龙吟风随风 共回答了16个问题
龙吟风随风 共回答了16个问题 |采纳率81.3%胆矾晶体就是晶体啊.不论多小都是晶体.1年前查看全部
- 【1.配制200g8%的CuSO4溶液,需要胆矾晶体和水多少克?(相对原子质量Cu-64 S-32 O-16 H-16)
 samtong01561年前1
samtong01561年前1 -
 今非昔比2007 共回答了17个问题
今非昔比2007 共回答了17个问题 |采纳率100%溶液中含CuSO4质量为 200*8% = 16g
需要胆矾质量为x 则 16/25x = 16g 解得 x =25g
需要水质量为 200-25 = 175g
如果还有疑问 百度HI找我 详谈1年前查看全部
- 某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾和胆矾晶体,以探索工业废料的再利用.
 啡吗1年前1
啡吗1年前1 -
 dannal_2004 共回答了16个问题
dannal_2004 共回答了16个问题 |采纳率81.3%(1)、Fe和Cu CO2(铝铁铜只有铝会和氢氧化钠反应,所以A是偏铝酸和氢氧化钠,B是铁和铜,然后二氧化碳和偏铝酸反应会生成氢氧化铝沉淀,因为碳酸是弱酸,所以无法继续反应)(2)、AlO2- + CO2 + 2H2O ==== Al(OH)3↓ + HCO3-
Al(OH)3 + 3H+ ==== 3H2O +Al3+
(3)、 加热蒸发冷却结晶过滤洗涤干燥
(4)、2Cu + O2 ==加热== 2CuO
CuO + H2SO4 ==== H2O + CuSO41年前查看全部
- 在实验室利用胆矾晶体和烧碱溶液制备氧化铜固体,其实验操作步骤为?
 我太gg了_1年前2
我太gg了_1年前2 -
 trvelsun 共回答了22个问题
trvelsun 共回答了22个问题 |采纳率90.9%将胆矾晶体溶于水后滴加过量的烧碱,过滤沉淀.将沉淀洗净后灼烧即可1年前查看全部
- (18分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体[FeSO 4 ·7H 2 O]和胆矾晶体,
(18分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体[FeSO 4 ·7H 2 O]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
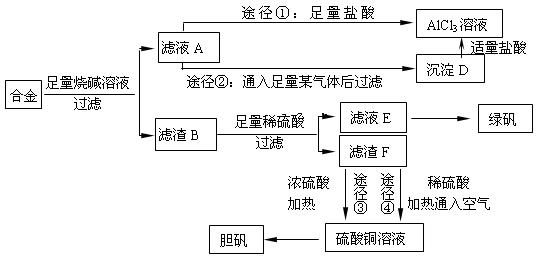
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式 。
(2)由滤液A制AlCl 3 溶液的途径有①和②两种,你认为合理的 是 。上述实验方案多处采用了过滤操作,过滤所用到的玻璃仪器有 和玻璃棒;其中玻璃棒的作用是 。
是 。上述实验方案多处采用了过滤操作,过滤所用到的玻璃仪器有 和玻璃棒;其中玻璃棒的作用是 。
(3)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是 、 。
(4)通过途径 ④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、 、冷却结晶、 、自然干燥。其中“加热通氧气”所起的作用为 (用离子方程式表示)。
④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、 、冷却结晶、 、自然干燥。其中“加热通氧气”所起的作用为 (用离子方程式表示)。 (5)测定所得胆矾(CuSO 4 ·xH 2 O)中x值的实验方案是蒸发硫酸铜晶体中的水得到白色的无水硫酸铜,冷却后称量。此变化的化学方程式为:CuSO 4 ·xH 2 O===C
(5)测定所得胆矾(CuSO 4 ·xH 2 O)中x值的实验方案是蒸发硫酸铜晶体中的水得到白色的无水硫酸铜,冷却后称量。此变化的化学方程式为:CuSO 4 ·xH 2 O===C uSO 4 +xH 2 O ,但温度过高,CuSO 4 会继续分解为CuO和SO 3 。在此实验过程中,称量操作至少进行 次。若测定结果x值偏高,可能的原因是 。
uSO 4 +xH 2 O ,但温度过高,CuSO 4 会继续分解为CuO和SO 3 。在此实验过程中,称量操作至少进行 次。若测定结果x值偏高,可能的原因是 。
a.加热温度过高 b.加热时胆矾晶体飞溅出来
c.加热后放在空气中冷却 d.所用坩埚事先未干燥(潮湿) 壮壮的ss1年前1
壮壮的ss1年前1 -
 宁夏的海王星 共回答了19个问题
宁夏的海王星 共回答了19个问题 |采纳率78.9%1年前查看全部
- 现有下列九种物质:①铜丝②NaOH溶液③蔗糖④稀硫酸⑤液态HCl⑥酒精⑦熔融KCl⑧盐酸 ⑨胆矾晶体
现有下列九种物质:①铜丝②NaOH溶液③蔗糖④稀硫酸⑤液态HCl⑥酒精⑦熔融KCl⑧盐酸 ⑨胆矾晶体
(1)可导电的是:
(2)属于电解质的是:
(3)属于非电解质的是:
填编号! lcr35201年前2
lcr35201年前2 -
 Arathes 共回答了16个问题
Arathes 共回答了16个问题 |采纳率87.5%(1)可导电的是:1、2、4、7、8
(2)属于电解质的是:5、7、9
(3)属于非电解质的是:3、61年前查看全部
- 胆矾晶体是硫酸铜的结晶水合物,其化学式为CuSO4•5H2O.在加热情况下,按温度不同,胆矾晶体会历经一系列的变化,得到
胆矾晶体是硫酸铜的结晶水合物,其化学式为CuSO4•5H2O.在加热情况下,按温度不同,胆矾晶体会历经一系列的变化,得到不同组成的固体.(第(1)(2)问用小数表示)
(1)称取0.10g含有杂质的胆矾试样于锥形瓶中,加入0.10mol/L氢氧化钠溶液28.00mL,反应完全后,过量的氢氧化钠用0.10mol/L硫酸滴定到终点,消耗硫酸10.08mL,则试样中胆矾的质量分数为______(已知:CuSO4+2NaOH→Cu(OH)2+Na2SO4;试样中杂质不与酸碱反应)
(2)将1.250g 纯净的胆矾晶体置于坩埚中加热一段时间,测得剩余固体质量为0.960g.剩余固体中结晶水的质量分数为______(保留三位小数).
(3)将无水硫酸铜加热至650℃以上,可得到黑色的氧化铜与三氧化硫、二氧化硫和氧气的混合气体.现将9.600g无水硫酸铜充分加热分解为氧化铜,将生成的气体通过足量的吸收剂(碱石灰),吸收剂增重4.416g.则最终吸收剂中硫酸盐与亚硫酸盐的物质的量之比为______
(4)取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960mL的NO2气体和672mL N2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02g.则x等于______. wonderqj1年前1
wonderqj1年前1 -
 沙湖ee 共回答了19个问题
沙湖ee 共回答了19个问题 |采纳率84.2%解题思路:(1)根据题中的信息,当向胆矾中加入氢氧化钠溶液发生反应:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,反应后再加H2SO4将剩余的NaOH中和,则根据:H2SO4+2NaOH═Na2SO4+H2O,计算出剩余剩余NaOH的物质的量,从而计算出与胆矾反应的NaOH的物质的量,算出CuSO4物质的量,进一步其质量,继而得出答案;
(2)根据CuSO4•5H2O
CuSO4+5H2O,采用假设的方法,假设胆矾完全分解时,求出得到固体的质量,与题中给出的固体的质量相比较,从而判断胆矾是否完全分解,然后根据判断的结果,根据反应方程式的计算,求出未分解的胆矾的量,进一步推算晶体中结晶水的质量分数.即得答案;△ .
(3)根据题中的信息硫酸铜加热至650℃以上,可得到黑色的氧化铜与三氧化硫、二氧化硫和氧气的混合气体,将生成的气体通过足量的吸收剂(碱石灰)吸收,吸收剂增重4.416g,则碱石灰只能吸收三氧化硫、二氧化硫,所以三氧化硫和二氧化硫的质量之和为4.416g,再根据9.600g无水硫酸铜充分加热分解,求出无水硫酸铜的物质的量,根据原子守恒算出二氧化硫与三氧化硫的物质的量之和,列方程求解,既得二氧化硫、三氧化硫的物质的量.即为亚硫酸钠、硫酸钠,即得答案;
(4)铜和镁失去的电子的物质的量,等于硝酸被还原为二氧化氮、四氧化二氮获得的电子的物质的量,等于他们结合的氢氧根的物质的量,根据氮的氧化物计算氢氧根的物质的量,沉淀的总质量减去氢氧根的质量即为金属的质量.(1)根据题中的条件,向0.1000g含有杂质的胆矾试样于锥形瓶中,加入0.1000mol/L氢氧化钠溶液28.00mL,反应完全后,氢氧化钠过量,剩余的氢氧化钠用0.1000mol/L硫酸中和消耗硫酸10.08mL,
设与0.1000mol/L、10.08mL硫酸反应的氢氧化钠的物质的量为xmol,则有
H2SO4 +2NaOH═Na2SO4+H2O
1mol2mol
0.1000mol/L×0.01008L x
解得:x=0.002016mol,
则与胆矾中硫酸铜反应的氢氧化钠的物质的量为:0.1000mol/L×0.02800L-0.002016mol=0.000784mol,
设胆矾中CuSO4的物质的量为ymol,则有
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
1mol 2mol
ymol 0.000784mol
解得:y=0.000392mol.
m(CuSO4)=0.000392mol×250gmol-1=0.098g
则胆矾中CuSO4的质量分数为:[0.0098g/0.1g]=0.98,
故答案为:0.98;
(2)1.250g胆矾的物质的量为:[1.250g/250g/mol]=0.005mol,
假设当0.005molCuSO4•5H2O完全分解时生成固体的物质的量为nmol,则有
CuSO4•5H2O
△
.
CuSO4+5H2O
1mol1mol
0.005molnmol
解得n=0.005mol,
m( CuSO4)=0.005mol×160gmol-1=0.8g<0.960g
故胆矾只是部分分解,设发生分解的胆矾的物质的量为ymol,则有:
CuSO4•5H2O
△
.
CuSO4+5H2O
1mol1mol
ymol ymol
根据题中的条件剩余固体为 CuSO4•5H2O、CuSO4的混合物,其质量为0.960g,则有
m(CuSO4•5H2O)+m(CuSO4)=(0.005-y)mol×250gmol-1+160yg=0.960g
解得:y=[0.29/90]mol,
所以剩余固体中,n( CuSO4•5H2O)=0.005mol-[0.29/90]mol=[0.16/90]mol
剩余固体中 CuSO4•5H2O晶体中结晶水的质量为:m(H2O)=[0.16/90]mol×90gmol-1=0.16g,
所以,剩余固体中结晶水的质量分数为:[0.16g/0.96g]=0.167,
故答案为:0.167;
(3)根据题中的信息:无水硫酸铜加热至650℃以上,可得到黑色的氧化铜与三氧化硫、二氧化硫和氧气的混合气体,将生成的气体通过足量的吸收剂(碱石灰),(碱石灰)增重4.416g,则有:64•n(SO2)+80n(SO3)=4.416g ①
9.600g无水硫酸铜物质的量为:[9.6g/160g/mol]=0.06mol,
根据发生化学反应时原子守恒,则有:
n(SO2)+n(SO3)=0.06mol ②,
根据①②解得:n(SO2)=0.024mol、n(SO3)=0.036mol,
再根据原子守恒得出:
n(Na2SO4)=n(SO3)=0.036mol;n(Na2SO3)=0.024mol,
所以:n(Na2SO4):n(Na2SO3)=0.036mol:0.024mol=3:2,
故答案为:3:2
(4)896mL的NO2气体的物质的量为:[8.96L/22.4L/mol]=0.4mol,
672mL的N2O4气体的物质的量为:[0.672L/22.4L/mol]=0.03mol,
所以金属提供的电子的物质的量为:0.4mol×(5-4)+0.03mol×2×(5-4)=0.46mol,
沉淀中含有氢氧根的物质的量为0.46mol,氢氧根的质量为0.46mol×17g/mol=7.82g,
所以金属的质量为:17.02g-7.82g=9.2g,
故答案为:9.2.点评:
本题考点: 溶液中溶质的质量分数及相关计算;化学方程式的有关计算.
考点点评: 本题考查了化学方程式的计算、溶质质量分数的计算、有关物质的量的计算,题目难度较大,试题计算量较大,综合性较强,注意掌握有关化学方程式、溶质质量分数的计算方法,试题培养了学生的分析、理解能力及化学计算能力.1年前查看全部
- 小华同学为研究胆矾晶体加热后所得物质的组成,做了以下实验:取2.50g胆矾晶体
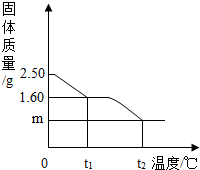 小华同学为研究胆矾晶体加热后所得物质的组成,做了以下实验:取2.50g胆矾晶体
小华同学为研究胆矾晶体加热后所得物质的组成,做了以下实验:取2.50g胆矾晶体
(CuSO4•XH2O)加热使其分解,绘制出固体的质量随温度的变化关系图.如图到
t1℃时该固体完全失去结晶水,化学方程式为:CuSO4•XH2O
CuSO4+XH2O↑.△ .
(1)计算胆矾晶体中X的值.(注:CuSO4•XH2O的相对分子质量可表示为:160+18X)
(2)升温到t2℃,残留固体是黑色物质,预测其化学式为______,m=______g.(写出求m的过程) 你是那个什1年前1
你是那个什1年前1 -
 女人是月亮 共回答了14个问题
女人是月亮 共回答了14个问题 |采纳率100%解题思路:(1)由图示数据和“到t1℃时该固体完全失去结晶水”可知,结晶水的质量=2.50g-1.60g;然后根据胆矾晶体受热分解的化学方程式和胆矾与结晶水的质量,列出比例式,就可计算出胆矾晶体中x的值;
(2)因为升温到t2℃时是硫酸铜受热继续分解,根据质量守恒定律,生成物质中一定有Cu,预测黑色物质,并求出m.(1)由图示数据和“到t1℃时该固体完全失去结晶水”可知,结晶水的质量为:2.50g-1.60g=0.90g
CuSO4•xH2O
△
.
CuSO4+xH2O↑.
160+18x 18x
2.50g 0.90g
∴[160+18x/18x=
2.50g
0.9g]
∴160+18x=50x,
∴x=[160/32]=5;
(2)根据原子守恒,黑色物质中一定含有铜,化学式CuO;
因为黑色物质是CuO,由Cu元素守恒得:m(Cu)=1.60g×[64/160]=0.64g;
所以m(CuO)=0.64g÷[64/80]=0.80g.
故答案为:(1)5;(2)CuO; 0.8g点评:
本题考点: 根据化学反应方程式的计算;有关化学式的计算和推断.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体[FeSO4•7H2O]和胆矾晶体,以探索工业废
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体[FeSO4•7H2O]和胆矾晶体,以探索工业废料的再利用.其实验方案如下:
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式______.
(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体其固态可用于人工降雨,则该气体是______(填化学式),滤液A与过量的某气体生成沉淀D的离子方程式为______.你认为较合理的途径是______(填①或②),理由是______.
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了Fe2+和H+外,还最可能存在的阳离子是______(用离子符号表示),检测该离子的方法是______.
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是______、______.
(5)途径③发生的反应中,体现了浓硫酸______性和______性.通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、______、自然干燥.其中途径④发生的反应为______(用一个离子方程式表示). 水在漂流1年前1
水在漂流1年前1 -
 wangxiaosong 共回答了20个问题
wangxiaosong 共回答了20个问题 |采纳率100%解题思路:(1)根据铝与碱反应生成偏铝酸钠和氢气;
(2)根据物质的性质结合框图转化关系和所得产品进行解答;
(3)二价铁易被空气中的氧气氧化成三价铁离子,检验三价铁离子用KSCN溶液;
(4)从环保和原料的利用率角度解答;
(5)铜与浓硫酸反应体现了浓硫酸的强氧化性和酸性,铜和氧气和酸反应生成铜离子;(1)因铝与碱反应生成偏铝酸钠和氢气,所以化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
则离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)某气体其固态可用于人工降雨,该气体应该为二氧化碳,二氧化碳的固态为干冰,干冰变成气体时须从外界吸收热量,致水蒸气冷凝,能实现人工降雨,AlCl3溶液中通入二氧化碳,碳酸的酸性比氢氧化铝强,所以能反应,且通过量的二氧化碳生成碳酸氢根离子,
故答案为:CO2;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;途径②;途径①会引入盐酸,氯化钠杂质;
(3)滤液E的成分中的硫酸亚铁中的二价铁离子易被空气中的氧气氧化成三价铁离子,检验三价铁离子的方法是用KSCN溶液,Fe3++3SCN-⇌Fe(SCN)3血红色,说明E中含有Fe3+,
故答案为:Fe3+;取滤液E少量于试管中,滴入2~3滴 KSCN溶液,若出现血红色,则证明滤液E中含有Fe3+;
(4)途径③的反应:Cu+2H2SO4(浓)
△
.
CuSO4+SO2↑+2H2O
途径④的反应:2Cu+O2+2H2SO4(稀)
△
.
2CuSO4+2H2O从反应方程式看出产生等量胆矾途径④消耗硫酸少,途径④不会产生污染大气的气体,
故答案为:产生等量胆矾途径④消耗硫酸少;途径④不会产生污染大气的气体;
(5)途径③的反应:Cu+2H2SO4(浓)
△
.
CuSO4+SO2↑+2H2O,从反应方程式看出,硫酸中硫从+6价变为产物中的+4价硫,体现强氧化性,金属和酸反应,生成盐,体现了硫酸的酸性,途径④的反应:2Cu+O2+2H2SO4(稀)
△
.
2CuSO4+2H2O改成离子反应为2Cu+O2+4H+=2Cu2++2H2O,
故答案为:强氧化、酸;过滤; 2Cu+O2+4H+=2Cu2++2H2O;点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;无机物的推断.
考点点评: 本题主要考查了怎样从工业废料中制取纯净物,注意从框图转化中找出有用信息,利用有关的化学反应进行解答,难度中等.1年前查看全部
- 一道高二化学填空题现有试管,烧杯,蒸发皿,坩埚,烧瓶,蒸馏烧瓶等受热仪器,若要证明胆矾晶体中含有结晶水,应将胆矾放在__
一道高二化学填空题
现有试管,烧杯,蒸发皿,坩埚,烧瓶,蒸馏烧瓶等受热仪器,若要证明胆矾晶体中含有结晶水,应将胆矾放在___中加热.
答案是试管,请各位高手解释一下每个仪器的用处谢谢
 zhuqinwei1年前3
zhuqinwei1年前3 -
 残破之滴血天剑 共回答了19个问题
残破之滴血天剑 共回答了19个问题 |采纳率73.7%在我记忆里,化学书后好像有这些.......
参考书上有吧?1年前查看全部
- t摄氏度时,在足量的饱和CuSO4溶液中加入mg无水CuSO4,析出胆矾晶体为ng,则下列叙述中正确
t摄氏度时,在足量的饱和CuSO4溶液中加入mg无水CuSO4,析出胆矾晶体为ng,则下列叙述中正确
的是( )
A.将ng胆矾加热失去结晶水,得到mg无水CuSO4
B.上述饱和溶液减少溶剂的质量等于(n-m)g
C.上述饱和溶液减少的质量等于(n-m)g
D.析出晶体后的溶液变成不饱合溶液
表示在B C间纠结 求过程 玫瑰星期三1年前1
玫瑰星期三1年前1 -
 wangchang1964 共回答了17个问题
wangchang1964 共回答了17个问题 |采纳率82.4%C.上述饱和溶液减少的质量等于(n-m)g
水参与反应,溶剂减少,又会析出晶体.所以(n-m)g不是反应的水的质量
CuSO4 + 5H2O ==== CuSO4•5H2O
mg1年前查看全部
- 某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用.其实验方案如下:
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用.其实验方案如下:

请回答下列问题:
(1)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是______,理由是:______.
(2)从滤液E中得到绿矾晶体的实验操作是______.
(3)请用一个总反应式表示由滤渣F制备胆矾晶体过程中发生的变化:2Cu+O2+2H2SO4+8H2O
2CuSO4•5H2O△ .2Cu+O2+2H2SO4+8H2O.
2CuSO4•5H2O△ .
(4).有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理______,理由是______. 大雪飘飞1年前1
大雪飘飞1年前1 -
 AINGAING 共回答了14个问题
AINGAING 共回答了14个问题 |采纳率92.9%解题思路:铝、铁、铜的合金中加入足量烧碱溶液,只有铝与其反应而溶解,过滤后得滤渣B的成分为铁和铜,滤液A为偏铝酸钠溶液;滤液A生成氯化铝溶液的途径Ⅰ发生反应:NaAlO2+4HCl=AlCl3↓+NaCl+2H2O;而途径Ⅱ通入足量的二氧化碳反应后过滤能得到纯净的氢氧化铝,氢氧化铝与盐酸反应能制得AlCl3溶液;滤渣B中只有铁和稀硫酸反应,反应后经过滤得滤渣为铜,再由铜制取胆矾,滤液为硫酸亚铁溶液,然后由溶液制取晶体.
(1)途径Ⅰ会引入氯化钠杂质;而途径Ⅱ能制得纯净的AlCl3溶液;
(2)由溶液制取晶体,需经过加热浓缩,冷却结晶、过滤洗涤、干燥;
(3)铜和氧气和酸反应生成硫酸铜和水;
(4)将方案中最初溶解合金的烧碱改为盐酸,后者操作步骤多,消耗的试剂量更多,时间长.铝、铁、铜的合金中加入足量烧碱溶液,只有铝与其反应而溶解,过滤后得滤渣B的成分为铁和铜,滤液A为偏铝酸钠溶液;滤液A生成氯化铝溶液的途径Ⅰ发生反应:NaAlO2+4HCl=AlCl3↓+NaCl+2H2O;而途径Ⅱ通入足量的二氧化...
点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题主要考查了从工业废料中制取纯净物,注意从框图转化中找出有用信息,利用有关的化学反应进行解答,难度中等.1年前查看全部
- 胆矾晶体颗粒较大,测结晶水含量为什么会偏小阿?
 背着家产流浪1年前3
背着家产流浪1年前3 -
 人生画谱 共回答了16个问题
人生画谱 共回答了16个问题 |采纳率93.8%颗粒较大,加热时会不均匀,内部受热少,水分不会出来,就会测量偏小1年前查看全部
- 某同学将50g胆矾晶体在200度温度下加热,称得剩余固体的质量为41g.
某同学将50g胆矾晶体在200度温度下加热,称得剩余固体的质量为41g.
(1)写出反应的化学方程式.
(2)有多少克(g)胆矾发生了分解.
(3)若将剩余的41g固体放入水中,全部溶解后,称得溶液质量为100g,则所得溶液的溶质质量分数为多少?
帮忙第3步,第一二步解答如下:
(1)CuSO4·5H2O==(加热)===》CuSO4+5H2O
(2)设有X mol胆矾分解.
mH2O=50-41=9(g)
MH20=9g/18g/mol=0.5mol
1/X=5/0.5
得X=0.1
0.1mol*250g/mol=25g sdx21年前1
sdx21年前1 -
 狐仙妹妹 共回答了26个问题
狐仙妹妹 共回答了26个问题 |采纳率100%mCuSO4=50g/(250g/mol)*(160g/mol)=32g
溶质质量分数=32g/(100g)*100%=32%1年前查看全部
- 胆矾晶体与浓硫酸发生化学反应吗
 司马芳1年前10
司马芳1年前10 -
 丁将裕 共回答了20个问题
丁将裕 共回答了20个问题 |采纳率100%首先化学反应的定义是“有新物质产生的反应”,于是当胆矾晶体与浓硫酸相遇时它们会产生脱水反应,胆矾晶体由块状变为粉末状,浓硫酸变稀,由于产生了新的物质“无水硫酸铜”,故可将其看成是发生了化学反应.1年前查看全部
- 为什么把胆矾晶体投到浓H2SO4里晶体会变无色
 jeffsec1年前2
jeffsec1年前2 -
 二月柳 共回答了23个问题
二月柳 共回答了23个问题 |采纳率95.7%浓H2SO4脱去胆矾晶体里的结晶水,它就无色了1年前查看全部
- 化学二氧化碳,胆矾晶体,铁,哪个不是电解质
 tangmeng5201年前1
tangmeng5201年前1 -
 jingjunxing 共回答了16个问题
jingjunxing 共回答了16个问题 |采纳率93.8%都不是电解质.电解质的定义是在水溶液或熔融状态下能够导电的化合物.首先铁是单质不是化合物;其次二氧化碳虽然在水溶液中能导电,但真正能导电的是反应生成的碳酸,不是二氧化碳;硫酸铜晶体是含水的化合物,真正起导电作用的是无水硫酸铜.所以,电解质只有纯粹酸、碱、盐类和水及其他少数物质(如液氨),不包括含水的盐、酸酐和金属氧化物等.1年前查看全部
- 胆矾晶体在空气中质量减少了(方程式)
 wsztt1年前3
wsztt1年前3 -
 hzmwhy 共回答了18个问题
hzmwhy 共回答了18个问题 |采纳率88.9%胆矾晶体在空气中失去结晶水质量减少了,方程式为:
CuSO4·5H2O=CuSO4+5H2O1年前查看全部
- 下列状态时,不能导电的电解质是( ) A 液态氯化氢 B 熔融食盐 C 胆矾晶体 D氯水
 zzh0142511年前1
zzh0142511年前1 -
 天堂法则 共回答了13个问题
天堂法则 共回答了13个问题 |采纳率100%AC液态氯化氢是强电解质,但由于其是共价化合物,所以只有溶于水后才能形成可自由移动的离子,进而能够导电食盐(氯化钠)是强电解质,且属于离子化合物,在熔融状态下和水溶液中均能形成可自由移动的离子,因此熔融食盐和食盐溶液均能导电(食盐溶液虽能导电,但不属于电解质)胆矾晶体属于强电解质,但是晶体中不存在自由移动的离子,所以胆矾晶体不能导电氯水是混合物,虽然能导电但不属于电解质1年前查看全部
- 亲简要说明原因:1配置100克10%硫酸铜溶液,称取10克胆矾晶体溶于90克水中为啥导致结果偏低.
亲简要说明原因:1配置100克10%硫酸铜溶液,称取10克胆矾晶体溶于90克水中为啥导致结果偏低.
2,石灰石与硝酸反应,石灰石与盐酸反应为啥可用同一离子方程式表示.
3,以下两组在溶液中大量共存且无色的是 一:H+ cl_ No3- Ba2+ 二:Ca2+ H+ So32_ No3-
4,为啥含硝酸银的废液不可以直接倒入水槽冲下下水道.
在10毫升0.01摩每升纯碱溶液中,不断搅拌并逐滴加入1.2毫升0,05摩每升的盐酸,完全反应后在标准状况下生成二氧化碳的体积为?A.1.344ML B.2.24ML C.0.672ML D.0ML
Na2CO3+HCl=NaCl+NaHCO3这一步我算出来明明Na2CO3有多啊,
第三题亲说明 Ba2+,他不是有颜色的吗。 amethystjj1年前3
amethystjj1年前3 -
 sophia_wu83 共回答了23个问题
sophia_wu83 共回答了23个问题 |采纳率87%1、10g胆矾晶体中含有结晶水,导致结果偏低.
2、硝酸和盐酸都是强酸,反应的实质都是和酸电离的氢离子的反应
3、 H+ cl_ No3- Ba2+ 共存
4、硝酸银是重金属盐,污染水体1年前查看全部
- 胆矾晶体放到水中的化学式怎么写?
 桥风儿1年前6
桥风儿1年前6 -
 究竟是因为什么 共回答了12个问题
究竟是因为什么 共回答了12个问题 |采纳率75%胆矾晶体CuSO4.5H2O放入水中形成溶液,溶质为CuSO4.1年前查看全部
- 一道化学选择题下列说法正确的是A.加热胆矾晶体失去结晶水,得到白色的无水硫酸铜,这一过程叫风化B.家用石碱久置后,由块状
一道化学选择题
下列说法正确的是
A.加热胆矾晶体失去结晶水,得到白色的无水硫酸铜,这一过程叫风化
B.家用石碱久置后,由块状变成粉末状,这一变化是风化的结果
C.还有水蒸气的气体通过固体氢氧化钠时,固体表面出现水珠,这是固体氢氧化钠潮解的缘故
D.从冰箱中取出物体,表面很快出现水珠,这种现象叫潮解
为什么不能选C,水蒸气和氢氧化钠不是潮解?二氧化碳才是反应吧?
 strong9301年前1
strong9301年前1 -
 风云任务 共回答了18个问题
风云任务 共回答了18个问题 |采纳率100%潮解是物理变化,潮解是自发吸收空气中的水蒸气,不是人为的给他通水蒸气。
有些晶体能自发吸收空气中的水蒸气,在它们的固体表面逐渐形成饱和溶液,它的水蒸气压若是低于空气中的水蒸气压,则平衡向着潮解的方向进行,水分子向物质表面移动。这种现象叫做潮解。1年前查看全部
- 一道化学题下列说法正确的是A.加热胆矾晶体失去结晶水,得到白色的无水硫酸铜,这一过程叫风化B.家用石碱久置后,由块状变成
一道化学题
下列说法正确的是
A.加热胆矾晶体失去结晶水,得到白色的无水硫酸铜,这一过程叫风化
B.家用石碱久置后,由块状变成粉末状,这一变化是风化的结果
C.还有水蒸气的气体通过固体氢氧化钠时,固体表面出现水珠,这是固体氢氧化钠潮解的缘故
D.从冰箱中取出物体,表面很快出现水珠,这种现象叫潮解
 有没有人爱过你1年前4
有没有人爱过你1年前4 -
 63523899 共回答了20个问题
63523899 共回答了20个问题 |采纳率75%bc
http://zhidao.baidu.com/link?url=4JHlty-By6avYI98u02gJbPeQykZU_abUSCqEvOt_wRKqt1aTzSHufKyu8AUH4CjSq7Uk0U3-aiq6okiCq3ecq1年前查看全部
- 蒸干nacl溶液要在蒸发皿中进行,蒸发cuso4溶液获得胆矾晶体能在烧杯中
 妖啊妖1年前1
妖啊妖1年前1 -
 junwang188 共回答了16个问题
junwang188 共回答了16个问题 |采纳率87.5%蒸发结晶都是在蒸发皿中进行1年前查看全部
- 硫酸铜结晶后变胆矾的计算将20℃时的饱和硫酸铜溶液200g,蒸发40g水后,冷却到20℃.试求会有多少胆矾晶体析出?(2
硫酸铜结晶后变胆矾的计算
将20℃时的饱和硫酸铜溶液200g,蒸发40g水后,冷却到20℃.试求会有多少胆矾晶体析出?(20℃时硫酸铜的饱和度为20g) 甲状腺功能减退症1年前1
甲状腺功能减退症1年前1 -
 zokmio 共回答了17个问题
zokmio 共回答了17个问题 |采纳率94.1%假设析出Xg胆矾晶体,那么析出后的溶液还是饱和溶液,浓度不变.
此时溶液还有(200-40-X)g,析出的溶质硫酸铜为X 16/25g,求出原来200g溶液中的硫酸铜质量.
Y/200=20/120,所以Y=100/3g,那么析出后还剩下硫酸铜为(100/3-16X/25)g,根据溶质浓度不变,可以得到如下等式:
(100/3-16X/25)/160-x=1/6,解得 X= 14.08g1年前查看全部
- 某班学生在实验室分组实验测定胆矾晶体
 烟燃-笑1年前1
烟燃-笑1年前1 -
 gg沉淀 共回答了18个问题
gg沉淀 共回答了18个问题 |采纳率88.9%D1年前查看全部
- 1.为了获得胆矾晶体,可将CUSO4溶液蒸干、灼烧到质量不再变化为止
1.为了获得胆矾晶体,可将CUSO4溶液蒸干、灼烧到质量不再变化为止
2.用石英坩埚高温熔融NAOH和NA2CO3的固体混合物
3.用洁净的玻璃棒蘸取HNO3,点在PH试纸中部测定此HNO3的PH
这三句都是错的,请分析每一句错误的原因. liuzhou81041年前1
liuzhou81041年前1 -
 红24 共回答了20个问题
红24 共回答了20个问题 |采纳率95%1、胆矾是五水硫酸铜,不能用灼烧的方法,否则得到无水硫酸铜,这里应该用蒸发结晶即可
2、石英是氧化硅,属于酸性氧化物,不能熔融碱性物质
3、硝酸是强氧化性酸,对纸有很强的氧化性,在浓度很低时,紫色石蕊试纸先变红色,然后马上变黑,就是先是它的酸性作用,再是它的强氧化性作用.
所以用Ph试纸是不能测硝酸的Ph的!1年前查看全部
大家在问
- 1氨基酸也不一定为主动运输吧 也可以协助扩散啊
- 2竹石的诗意是什么?
- 3英语翻译不敢轻易许诺言这个句子英语怎样翻译?
- 4我想我十年后一定结婚了 用英语怎么说
- 5醋酸为什么不是强电解质 谢谢!醋酸为什么不是强电解质 说明理由?醋酸铵为什么是强电解质? 我不知道咋办了!
- 6十年后我将嫁给你英语怎么说
- 7英语翻译“路过踩踩,浇浇花,记得囬访.”(中译英)
- 8英语作文撒谎
- 9乙醇是酸性还是碱性还是中性?如题...
- 10一道物理可以说是电化学的题美国科研人员正在研制一种新型镍铜长效电池,它是采用半衰期长达100年的放射性同位素63(Ni)
- 11兴奋时,钠离子进入神经元的方式,是主动运输还是自由扩散,为什么?
- 12为什么甲烷比氨气稳定性高
- 13酶为什么可以在细胞核中合成?不是说RNA主要存在细胞质中吗?
- 14谁能帮我翻译成英语呀?关于价格的问题,咱们已谈过很多次了,现在的确没有再降价的余地.
- 15怎样用化学方法区分铁.铝.铜

