150℃、101kP时,由两种烃组成的混合气体0.5L在4.5LO2中完全燃烧,测得反应后气体总面积小于5L其中含CO2
 塞北客2022-10-04 11:39:541条回答
塞北客2022-10-04 11:39:541条回答A. A0.7L
B. 1.4L
C. 1.6L
D. 2.8L

已提交,审核后显示!提交回复
共1条回复
 未时末 共回答了15个问题
未时末 共回答了15个问题 |采纳率93.3%- 解题思路:先根据烃的燃烧通式及反应后气体体积减小确定混合烃中平均氢原子数,再根据0.5L混合烃生成了0.8L二氧化碳计算出混合烃中平均碳原子数,根据计算结果可知一定含有甲烷,再根据平均氢原子数得出一定为甲烷和乙炔的混合物,然后根据混合烃的平均碳原子数计算出二者的体积之比,最后根据燃烧的关系式及氢原子守恒CH4~2H2O、C2H2~H2O计算出生成水蒸气的体积.
设该混合烃平均化学式为CxHy,则:
CxHy+(x+[y/4])O2=xCO2+[y/2]H2O
150℃时水为气体,要使反应后体积小于5L,则有该反应各气体物质的系数关系为:
1+x+[y/4]>x+[y/2]
解得:y<4,
0.5L混合烃产生0.8LCO2,相同条件下气体的物质的量之比等于其体积之比,
则0.5mol混合烃污染燃烧生成0.8mol二氧化碳,1mol混合烃完全燃烧生成1.6mol二氧化碳,则x=1.6;由此可知混合烃中必有甲烷CH4,另一种烃氢数一定小于4,氢原子数小于4的烃只有乙炔,
设含有xmol甲烷、ymol乙炔,
根据碳原子守恒看得:[xmol×1+ymol×2/xmol+ymol]=1.6,
解得:x:y=2:3,即:甲烷与乙炔物质的量之比为2:3,
相同条件下体积之比就等于物质的量之比,则混合气体中甲烷的体积为:0.5L×[2/2+3]=0.2L,乙炔的物质的量为:0.5L×[2/2+3]=0.3L,
根据氢原子守恒看得关系式:CH4~2H2O、C2H2~H2O,
1 2 1 1
0.2L 0.4L 0.3L 0.3L
则生成水的体积为:0.4L+0.3L=0.7L,
故选A.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查了混合烃燃烧的计算,题目难度中等,注意掌握烃的燃烧通式,能够根据反应前后气体体积不会判断混合烃中氢原子数的范围,经过对混合烃的平均分子式的讨论得出混合物为甲烷和乙炔为解答本题的关键. - 1年前
相关推荐
- 0.4%氟气与空气混合后在150℃时对金属有腐蚀性吗(⊙_⊙)?如无,则在何温度下有腐蚀?
 紫色眼睛的猫1年前2
紫色眼睛的猫1年前2 -
 qing_hui 共回答了14个问题
qing_hui 共回答了14个问题 |采纳率92.9%有1年前查看全部
- 150℃时(NH4)4CO3=2NH3↑+CO2↑+H2O↑.求索的混合气体的摩尔质量
 dalaohu861年前2
dalaohu861年前2 -
 know_2001 共回答了13个问题
know_2001 共回答了13个问题 |采纳率92.3%设1mol(NH4)2CO3 质量为96g
(NH4)4CO3=2NH3↑+CO2↑+H2O↑.
1 2 1 1
产物是4mol的气体
平均摩尔质量=总质量/总物质的量
根据质量守恒,总质量为96g
答案96/4=241年前查看全部
- 将一定量的(NH4)2CO3加热至150℃,使之完全分解,产生的混合气体对H2的相对密度为______.
 bjbobo1年前1
bjbobo1年前1 -
 mei1102 共回答了15个问题
mei1102 共回答了15个问题 |采纳率100%解题思路:先根据(NH4)2CO3分解求出混合气体的平均摩尔质量,然后利用密度之比等于摩尔质量之比.因N(NH4)2CO3发生反应:(NH4)2CO3 加热 . 2NH3↑+H2O↑+CO2↑ &nbs...
点评:
本题考点: 铵盐;化学方程式的有关计算.
考点点评: 本题结合铵盐的不稳定性,考查了平均摩尔质量的计算以及平均摩尔质量之比等于密度之比.1年前查看全部
- 已知NH4CO3 NH3+H2O+CO2↑在150℃时NH4CO3分解产生的混合气体A的密度是相同条件下H2密度的 几
已知NH4CO3 NH3+H2O+CO2↑在150℃时NH4CO3分解产生的混合气体A的密度是相同条件下H2密度的 几 倍.
 贪食鱼1年前2
贪食鱼1年前2 -
 筠筠 共回答了20个问题
筠筠 共回答了20个问题 |采纳率85%相同条件密度比=摩尔质量比
150℃时,NH3,H2O,CO2都是气体
应该为NH4HCO3
NH4HCO3(s) = NH3(g) + H2O(g) + CO2(g)
平均分子量即=17*1/3+18*1/3 + 44*1/3 = 26.33
所以密度比=26.33:2=13.2:1
混合气体A的密度是相同条件下H2密度的 13.2 倍1年前查看全部
- 在温度为150℃条件下,向密闭容器中充入1mol丙烯(C3H6)和甲烷的混合气体,再充入足量的氧气,完全燃烧后再恢复到1
在温度为150℃条件下,向密闭容器中充入1mol丙烯(C3H6)和甲烷的混合气体,再充入足量的氧气,完全燃烧后再恢复到150℃.欲使丙烯和甲烷混合气体对氢气的相对密度≥15.8,且反应后气体分子增加的总物质的量≤0.4mol.问丙烯和甲烷的物质的量之比应满足什么关系?
设混合烃为CxHy,可算出y≤5.6,平均M≥31.6,接下来该怎么算? 老牌钢笔1年前1
老牌钢笔1年前1 -
 黑虎99 共回答了21个问题
黑虎99 共回答了21个问题 |采纳率81%应该设丙烯为Xmol甲烷为Ymol
X+Y=1………………………………………………………………………(1)
(3X+Y)①+(3X+2Y)②-1③-[(3+3/2)X+2Y]④≤0.4………………(2)
42X+16Y≥31.6……………………………………………………………(3)
联立(1)、(2)、(3)求解就行
①:产生的二氧化碳
②:产生的水蒸汽
③:消耗的混合气体
④:消耗的氧气1年前查看全部
- 150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4L N2和H2的混
150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.

(1)反应前混合气体中V(N2):V(H2)=______;
反应达平衡后V(NH3)=______L;该反应中N2转化率为______.
(2)向平衡后的容器中充入0.2mol的NH3,一段时间后反应再次达到平衡,恢复到150℃时测得此过程中从外界吸收了6.44kJ的热量.
①充入NH3时,混合气体的密度将______,在达到平衡的过程中,混合气体的密度将______(填“增大”、“减小”或“不变”).反应重新达平衡的混合气体对氢气的相对密度将______5(填“>”、“<”或“=”).
②下列哪些实验现象或数据能说明反应重新到达了平衡______.
A.容器不再与外界发生热交换
B.混合气体的平均相对分子质量保持不变
C.当V(N2):V(H2):V(NH3)=1:3:2时D.当容器的体积不再发生变化时
③写出该反应的热化学方程式:______. ericleung8001年前2
ericleung8001年前2 -
 schdyu 共回答了18个问题
schdyu 共回答了18个问题 |采纳率77.8%解题思路:(1)根据三段式列出起始、变化、平衡的量,根据平均相对分子质量的公式计算,进而求得体积比、平衡体积和转化率;
(2)①再加入0.2m0l氨气由于氨气摩尔质量为17,大于10,故混合气体摩尔质量增大,则混合气体密度增大,反应过程中,平衡逆向移动,向体积增大方向移动,故混合气体密度减小,平衡时由于与原平衡等效,所以混合气体密度和原平衡相等;
②该变的量保持不变,则说明达到平衡状态;
③从(1)计算可知,氮气的转化率为30%,则氨气分解率为70%,故0.2mol×70%氨气分解吸收6.44kJ热量,则2mol氨气分解吸收热量为:
×2mol=92kJ,则生成2mol氨气放出92kJ热量,据此写出热化学方程式.6.44kJ 0.14mol (1)设起始时氮气的体积为x,氢气的体积为4-x,
3H2 +N2 ⇌2NH3,体积变化
3 1 2 2
起始 4-x x 0 0
变化 0.9 0.3 0.64-3.4=0.6
平衡 4-x-0.9 x-0.3 0.6 0.6
容器内气体对相同条件的氢气的相对密度为5,则相对分子质量为5×2=10,
[3.1−x/3.4]×2+[x−0.3/3.4×28+
0.6
3.4×17=10,解得x=1
反应前混合气体中V(N2):V(H2)=x:(4-x)=1:(4-1)=1:3;
平衡后氨气体积为:0.6L,氮气的转化率为:
0.3L
1L]×100%=30%,
故答案为:1:3;0.6;30%;
(2)①再加入0.2m0l氨气由于氨气摩尔质量为17,大于10,故混合气体摩尔质量增大,则混合气体密度增大,反应过程中,平衡逆向移动,向体积增大方向移动,故混合气体密度减小,平衡时由于与原平衡等效,所以混合气体密度和原平衡相等;
故答案为:增大;减小;=;
②该变的量保持不变,则说明达到平衡状态.反应过程中,热量、混合气体平均相对分子质量、体积在变化,若这些量保持不变,则说明达到平衡状态,
故答案为:A、B、D;
③从(1)计算可知,氮气的转化率为30%,则氨气分解率为70%,故0.2mol×70%氨气分解吸收6.44kJ热量,则2mol氨气分解吸收热量为:
6.44kJ
0.14mol×2mol=92kJ,则生成2mol氨气放出92kJ热量,则氢气和氮气合成氨气的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=-92KJ/mol,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92KJ/mol.点评:
本题考点: 化学平衡的计算;化学平衡状态的判断.
考点点评: 本题考查了化学平衡的有关计算,热化学方程式的书写等,难度较大.注意正反应和逆反应的反应热数值相等,符号相反.1年前查看全部
- 橡胶加热到150℃会产生什么气体?
橡胶加热到150℃会产生什么气体?
橡胶加热到150℃是否会产生气体?何种气体? 唐朝oo飞翔鸟1年前1
唐朝oo飞翔鸟1年前1 -
 tt甲醇 共回答了17个问题
tt甲醇 共回答了17个问题 |采纳率82.4%一般有机挥发项居多,PAH16类1年前查看全部
- LM35温度传感器测温范围是-55~+150℃.它在25度时精度是0.5要是测温到95度时 它的精度是多少.
 dabingbao1年前1
dabingbao1年前1 -
 吹吹水ww 共回答了14个问题
吹吹水ww 共回答了14个问题 |采纳率78.6%这个是没有公式来算的 .要看LM35的datasheet(数据手册)才能知道.1年前查看全部
- 将a mol O2,b mol CH4,c mol Na2O2放入密闭容器中,在150℃条件下电火花引发反应,反应后容器
将a mol O2,b mol CH4,c mol Na2O2放入密闭容器中,在150℃条件下电火花引发反应,反应后容器的压强为零,由此作出的正确结论是 ( )
A.a∶b∶c=1∶2∶6,生成的固体为Na2CO3和NaHCO3的混合物
B.a∶b∶c=1∶2∶4,生成的固体为Na2CO3和NaOH的混合物
C.a∶b∶c=1∶2∶6,生成的固体为Na2CO3和NaOH的混合物
D.a∶b∶c=2∶1∶4,生成的固体为Na2CO3和NaHCO3的混合物
 永恋她1年前4
永恋她1年前4 -
 若是爱上你 共回答了11个问题
若是爱上你 共回答了11个问题 |采纳率90.9%考的是,CO、H2燃烧生成CO2、H2O,与Na2O2反应的规律
2CO + O2 = 2CO2,2H2 + O2 = 2H2O
2CO2 + 2Na2O2 = 2Na2CO3 + O2,2H2O + 2Na2O2 = 4NaOH + O2
可以发现,CO2、H2O与Na2O2,会放出O2,相当于被吸收的是CO、H2
所以,a mol O2,b mol CH4组成相当于CO+H2,即a:b=1:2
生成物是Na2CO3和NaOH,据C、H元素守恒,得到Na元素为2×2+4×2=12,即Na2O2为6
a:b:c=1:2:6,即C1年前查看全部
- 8.科学家合成了一系列独特的氢铝化合物.最简单的氢铝化合物化学式为Al2H6,它的熔点为150℃,燃烧热极高
8.科学家合成了一系列独特的氢铝化合物.最简单的氢铝化合物化学式为Al2H6,它的熔点为150℃,燃烧热极高
A.Al2H6中Al为-3价, H为+l价
B.Al2H6在空气中完全燃烧,产物为氧化铝和水
C.Al2H6是共价化合物
D.氢铝化合物可能成为未来的储氢材料和火箭燃料
重点解释A szxcv1年前2
szxcv1年前2 -
 weianweian 共回答了19个问题
weianweian 共回答了19个问题 |采纳率84.2%A是错的吧?
铝的电负性为1.61,氢的电负性为2.20
氢的电负性更大,所以H为-1价,Al为+3价1年前查看全部
- 生石膏加热到150℃以上会失去部分结晶水
生石膏加热到150℃以上会失去部分结晶水
由生石膏加热失去结晶水生成1mol熟石膏时,生石膏失去的结晶水为几mol? 阿柏词1年前1
阿柏词1年前1 -
 澎蜞 共回答了23个问题
澎蜞 共回答了23个问题 |采纳率95.7%带两个分子结晶水的叫做石膏或生石膏(CaSO4·2H2O).将石膏加热到150-170℃时,大部分结晶水失去,变成熟石膏(CaSO4·1/2H2O),故失去结晶水为1.5mol,假如是完全脱水的话,就是失去结晶水2mol1年前查看全部
- 草酸晶体(H2C2O4•2H2O) 100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和C
草酸晶体(H2C2O4•2H2O) 100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2.
草酸晶体(H2C2O4•2H2O) 100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2.用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)不明白为什么选D不选A呢?
 oxfam1年前1
oxfam1年前1 -
 老牯牛 共回答了25个问题
老牯牛 共回答了25个问题 |采纳率92%若选C,生成的H2O倒流回试管底,导致试管破裂,所以应该选D,试管口朝下,用加热草酸晶体的方法获取某些气体,可能和气体的密度有关系,空气的密度29,CO为28,为了获取CO,所以才试管口口向下,排出了CO2,因为CO2大于空气密度,有两方面的考虑.1年前查看全部
- CO与H2混合气体3g和足量的氧气燃烧后,在150℃时将混合气体通过足量的Na2O2后,Na2O2增重的质量为( )
CO与H2混合气体3g和足量的氧气燃烧后,在150℃时将混合气体通过足量的Na2O2后,Na2O2增重的质量为( )
A.1.5 g
B.3 g
C.6 g
D.无法计算 xinyunyicun1年前1
xinyunyicun1年前1 -
 君子不夜行 共回答了13个问题
君子不夜行 共回答了13个问题 |采纳率92.3%解题思路:利用差量法,根据化学方程式CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应:2CO+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2点燃 .
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重△m=4NaOH-2Na2O2=2H2,可知反应后固体增加的质量为氢气质量.点燃 .CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应:2CO+O2
点燃
.
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;
2H2+O2
点燃
.
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重△m=4NaOH-2Na2O2=2H2,可知反应后固体增加的质量为氢气质量;
所以Na2O2增重的质量为CO与H2混合气体的质量,共3g,
故选:B.点评:
本题考点: 钠的重要化合物;化学方程式的有关计算.
考点点评: 本题考查混合物的计算,难度中等,注意从CO2、H2O与Na2O2生成固体质量的变化分析规律,是解答该题的关键.1年前查看全部
- (2008•门头沟区二模)一个质量是0.2kg的铁球,温度从100℃上升到150℃,求它吸收的热量.[已知:铁的比热容等
(2008•门头沟区二模)一个质量是0.2kg的铁球,温度从100℃上升到150℃,求它吸收的热量.[已知:铁的比热容等于0.46×103J/(kg•℃)].
 亮声1年前1
亮声1年前1 -
 迷惘的汨 共回答了22个问题
迷惘的汨 共回答了22个问题 |采纳率90.9%解题思路:知道铁球的质量、铁的比热容、铁球的温度升高值,利用吸热公式Q吸=cm△t求铁球吸收的热量.铁球吸收的热量Q吸=cm△t=cm(t-t0)
=0.46×103J/(kg•℃)×0.2kg×(150℃-100℃)
=4.6×104J.
答:铁球吸收的热量是4.6×104J.点评:
本题考点: 热量的计算.
考点点评: 本题考查了学生对吸热公式Q吸=cm△t的掌握和运用,注意温度升高了(△t)与升高到(末温)的区别.1年前查看全部
- 在标准大气压下,温度在150℃时,氮气的密度
 桃李大侠1年前4
桃李大侠1年前4 -
 zuihui127 共回答了18个问题
zuihui127 共回答了18个问题 |采纳率100%0.805g/L1年前查看全部
- (2011•百色模拟)CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后
(2011•百色模拟)CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的物质的量分数为( )
A.75%
B.25%
C.88%
D.32% gb88171年前1
gb88171年前1 -
 jasonyang1 共回答了18个问题
jasonyang1 共回答了18个问题 |采纳率88.9%解题思路:2CO2+2Na2O2=2Na2CO3+O2,固体增加的质量相当于CO的质量,2H2+O2=2H2O,2H2O+2Na2O2=4NaOH+O2↑,
二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量,以此计算.2CO2+2Na2O2=2Na2CO3+O2,固体增加的质量相当于CO的质量,2H2+O2=2H2O,2H2O+2Na2O2=4NaOH+O2↑,
二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量,
设混合气体中含有xmolCO2,ymolH2,
则
44x+2y=5
28x+2y=3.4
解得x=0.1,y=0.3,
则原混合气体中CO2的物质的量分数为
0.1
0.1+0.3×100%=25%,
故选B.点评:
本题考点: 有关混合物反应的计算;钠的重要化合物.
考点点评: 本题考查混合物的计算,题目难度中等,注意根据所发生反应的化学方程式计算.1年前查看全部
- 物质的量一节将4molO2和3molNxHy(y>x)的混合气体在150℃和1.05*105Pa下点燃,完全反映后,恢复
物质的量一节
将4molO2和3molNxHy(y>x)的混合气体在150℃和1.05*105Pa下点燃,完全反映后,恢复到原来的温度和压强时,测得反映后N2、O2、H2O(g)的混合气体比原混合气体的密度减少3/10.
反应方程:4NxHy+yO2=2xN2+2YH2O(g)
x与y的关系式为?.正确答案2x+y=8 kimmyzhou1年前1
kimmyzhou1年前1 -
 今朝醉 共回答了19个问题
今朝醉 共回答了19个问题 |采纳率89.5%由三段式有
4NxHy+yO2=2xN2+2YH2O(g)
3 4 0 0
3 0.75y 1.5x 1.5y (由于是完全反应,所以lNxHy无剩余)
0 4-0.75y 1.5x 1.5y
题干又说 恢复到原来的温度和压强,所以设物质总质量为M,所以得(M/7) * 0.7 = 4-0.75Y+1.5y+1.5x 所以解得2x+y=81年前查看全部
- (2012•上海模拟)质量为0.5千克的铝块,温度从150℃降低到50℃,在这过程中它放出的热量为多少?[已知铝的比热为
(2012•上海模拟)质量为0.5千克的铝块,温度从150℃降低到50℃,在这过程中它放出的热量为多少?[已知铝的比热为0.9×103焦/(千克•℃)].
 小欧欧1年前1
小欧欧1年前1 -
 andyding81 共回答了23个问题
andyding81 共回答了23个问题 |采纳率95.7%解题思路:已知铝块的质量和比热容以及初温、末温,根据Q=cm(t0-t)求出这过程中它放出的热量.这过程中铝块放出的热量为:
Q放=cm(t0-t)
=0.9×103J/(kg•℃)×0.5kg×(150℃-50℃)
=4.5×104J.
答:在这过程中铝块放出的热量为4.5×104J.点评:
本题考点: 热量的计算.
考点点评: 本题考查了热量的计算,是一道基础题目.1年前查看全部
- 将Xmol氧气.Ymol甲烷.Zmol过氧化钠放入密闭容器中.在150℃时用电火花引发反应.反应完成后
将Xmol氧气.Ymol甲烷.Zmol过氧化钠放入密闭容器中.在150℃时用电火花引发反应.反应完成后
反应物无剩余.容器内压强为零.X.Y.Z关系可以用一个等式来表示 正确的是
A.Z=2X+2Y
B.6Y=2X+Z
C.4Y=2X+3Z
D.3X=Y+5Z libraxiang1年前3
libraxiang1年前3 -
 逗你儿 共回答了24个问题
逗你儿 共回答了24个问题 |采纳率100%选A
因为最后没有气体,并且根据物质守恒定律,所以甲烷中的氢只能进入氢氧化钠,炭只能进碳酸钠,所以最终产物(不是剩余固体物)只有一种可能,就是碳酸钠和氢氧化钠的混合物.你可以不考虑中间过程,从而写一个非常综合的反应方程式,(甲烷加氧气加过氧化钠)作为反应物,生成物是碳酸钠和氢氧化钠.4CH4+2O2+12Na2O2=4Na2CO3+16NaOH
我以前上高中的时候就这样做这种类型的题的!
我化学很牛的,高考考了145哦!哈哈!不懂的问我啊!QQ:647262311年前查看全部
- (NH4)2CO3在150℃时完全分解所得的混合气体成份
(NH4)2CO3在150℃时完全分解所得的混合气体成份
这道题的答案有些和你不同是12倍 初七小海1年前1
初七小海1年前1 -
 35540398 共回答了20个问题
35540398 共回答了20个问题 |采纳率85%(NH4)2CO3 ===加热===CO2 +H2O +2NH3
成分就是二氧化碳,水气,氨气1年前查看全部
- 同样是Q235B材料制作的反应釜,蒸汽温度为150℃,和蒸汽温度为200℃对反应釜的影响大吗?不计算压力,设计压力0.5
同样是Q235B材料制作的反应釜,蒸汽温度为150℃,和蒸汽温度为200℃对反应釜的影响大吗?不计算压力,设计压力0.5MPa,肯定是够用的.请说明原因或者相关文献出处
 轻听花物语1年前3
轻听花物语1年前3 -
 肩膀疼 共回答了11个问题
肩膀疼 共回答了11个问题 |采纳率100%我是做退火窑的我们500度以上采用不锈钢,一下都用碳钢,没有问题的1年前查看全部
- 【高一化学】150℃时碳酸铵完全分解产生的气体混合物,其密度是相同条件下氢气密度的多少倍?
【高一化学】150℃时碳酸铵完全分解产生的气体混合物,其密度是相同条件下氢气密度的多少倍?
150℃时碳酸铵完全分解产生的气体混合物,其密度是相同条件下氢气密度的多少倍?
------------------------------------------------------- 一支出墙得红杏1年前1
一支出墙得红杏1年前1 -
 维维安LULU1 共回答了23个问题
维维安LULU1 共回答了23个问题 |采纳率91.3%2mol碳酸铵完全分解产生2molNH3,1molH2O,1molCO2,150℃ 时气态混合物的组成为NH3、H2O和CO2,体积比NH3:H2O:CO2=2:1:1,等温等压下气体的密度之比为摩尔质量之比,故混合气体的平均摩尔质量=(17*2+44+18)/4=24g/mol,是相同条件下H2密度的24/2=12倍1年前查看全部
- 请问有普通的镀锌管,可以通导热油么?导热油温度150℃.
请问有普通的镀锌管,可以通导热油么?导热油温度150℃.
我们厂买了一台油温机它配套的管道就是镀锌管+生料带的.厂家说这个通150摄氏度是没有问题的.
另外想问问高手,我设计的管道是这样的,油温机——导热油管道——热交换器(加热空气至130℃)——油温机.请问需要装油过滤器么?最高点需要装排气阀么? qianqian82541年前1
qianqian82541年前1 -
 nyzl 共回答了10个问题
nyzl 共回答了10个问题 |采纳率70%我来帮你回答:我们是专业生产导热油炉的,在整套的导热油炉中必须装有过滤器,一般在泵的进口管道上装有Y型过滤器,作用主要有两个方面:
一.在新系统中可以过滤掉管道中的焊渣.
二.随着设备使用的时间越来越长,导热油会碳化结焦,过滤器可以过滤掉这些.
应该更正下,应该是回油口的最高点装有排气装置.一般装油气分离器就可以了!(装油气分离器主要看系统的排气情况,如果可以通过膨胀槽排掉,可以不装,如果不行,就必须装)视情况而定.一般建议装!1年前查看全部
- 一数字温度测量系统的测温范围为-55℃~+150℃,在此范围内的最大线性偏差为±1℃,试求该系统的测温线性度.
 minimint91年前1
minimint91年前1 -
 飞无泪 共回答了18个问题
飞无泪 共回答了18个问题 |采纳率77.8%在规定条件下,传感器校准曲线与拟合直线间的最大偏差(ΔYmax)与满量程输出(Y)的百分比,称为线性度(线性度又称为“非线性误差”),该值越小,表明线性特性越好.
δ=ΔYmax/ Y*100%=1/(150+55)*100%=0.488%1年前查看全部
- 某温度计标有测量范围--10℃—正150℃,但将该温度计放入冰水混合物中时示数为4℃,放入1标 看下面补充
某温度计标有测量范围--10℃—正150℃,但将该温度计放入冰水混合物中时示数为4℃,放入1标 看下面补充
某温度计标有测量范围--10℃—正150℃,但将该温度计放入冰水混合物中时示数为4℃,放入1标准大气压下的沸水中时示数为98℃,则这支温度计所能测的最低温度为(),合()K,最高温度为(),合()K 清夜回声1年前1
清夜回声1年前1 -
 whhh 共回答了19个问题
whhh 共回答了19个问题 |采纳率94.7%某温度计标有测量范围--10℃—正150℃,但将该温度计放入冰水混合物中时示数为4℃,放入1标准大气压下的沸水中时示数为98℃,则这支温度计所能测的最低温度为(-14.9℃),合(258.25)K,最高温度为(155.3℃),合(428.45)K
刻度均匀、读数准确的温度计用100格表示100摄氏度,此题中所给出的温度计是98-4=94格表示100摄氏度,每一格代表(100/94)℃.当读数为最低的-10℃时,它的格数为4+10=14格.所以能测的最低温度应该是 -(100/94)℃x14= -14.9℃=-14.9+273.15K=258.25K.
当读数为最高的150℃时,它的格数为150-4=146格.所以能测的最高温度应该是 (100/94)℃x146= 155.3℃=155.3+273.15K=428.45K.1年前查看全部
- 在1.01×105 Pa 150℃条件下,在一恒容的密闭容器中,某有机物完全燃烧,反应前后压强不发生
在1.01×105 Pa 150℃条件下,在一恒容的密闭容器中,某有机物完全燃烧,反应前后压强不发生变化,该有机物可能是( )
A. CH4
B. C2H6
C. C2H4
D. C2H2 boning51年前1
boning51年前1 -
 希仃克 共回答了21个问题
希仃克 共回答了21个问题 |采纳率90.5%解题思路:根据烃燃烧的通式以及反应前后压强之比等于气体的物质的量之比来计算.设烃的分子式为CxHy,150℃条件下水为气体,该烃燃烧的通式为:CxHy+[4x+y/4]O2
点燃
xCO2+[y/2]H2O(g),
由于反应前后压强不变,可得:1+[4x+y/4]=x+[y/2],解得y=4,从而推知,只要满足CxH4的烃即可.
故选AC.点评:
本题考点: 有机物实验式和分子式的确定.
考点点评: 本题是一道有机物分子式确定的题目,可以根据所学知识来回答,难度不大.1年前查看全部
- 关于物质熔沸点两种熔点都为150摄氏度的物质混合后熔点依然为150摄氏度,说明了什么?原题:两样品的熔点都为150℃,以
关于物质熔沸点
两种熔点都为150摄氏度的物质混合后熔点依然为150摄氏度,说明了什么?
原题:两样品的熔点都为150℃,以任何比例混合后测得的熔点仍为150℃,这说明什么?这是提勒管法测物质熔点的实验思考题。 hk19911年前4
hk19911年前4 -
 Ringna 共回答了15个问题
Ringna 共回答了15个问题 |采纳率80%说明这两种物质是一个物质,因为如果是混合物的话,理论上熔点会降低的1年前查看全部
- 150℃时取1升混合烃与足量的9升O2混合,在容积固定的容器中充分燃烧,当恢复到150℃时,容器内压强增大8%,则混合烃
150℃时取1升混合烃与足量的9升O2混合,在容积固定的容器中充分燃烧,当恢复到150℃时,容器内压强增大8%,则混合烃可能的组成为( )
A. 甲烷和乙烯
B. 丙炔和乙炔
C. 丁烯和丁烷
D. 乙烯和丁烯 carlzhoujian1年前1
carlzhoujian1年前1 -
 chjwxhwxl 共回答了17个问题
chjwxhwxl 共回答了17个问题 |采纳率94.1%解题思路:假设混合烃的分子式是CxHy,其燃烧的方程式是:CxHy+(x+[y/4])O2
xCO2+[y/2]H2O.在150℃时水是气态.因此根据方程式可知1L的混合烃完全燃烧,气体体积增加了([y/4]-1)L.根据题意可得[y/4]-1=(1+9)×8%.解得y=7.2,H原子数平均为7.2个,则一种烃分子中的H原子数小于8,另一种大于8,对各个选项逐一排查解答.点燃 .假设混合烃的分子式是CxHy,在150℃时水是气态,则:
CxHy+(x+[y/4])O2
点燃
.
xCO2+[y/2]H2O 气体体积增大
1L(x+[y/4])LxL[y/2]L([y/4]-1)L
根据题意可得:[y/4]-1=(1+9)×8%,解得y=7.2,H原子数平均为7.2个,则一种烃分子中的H原子数小于7.2,另一种大于7.2,
A.甲烷和乙烯中H原子数目分别为4、4,不符合题意,故A错误;
B.丙炔和乙炔中H原子数目分别为4、2,不符合题意,故B错误;
C.丁烯和丁烷中H原子数目分别为8、10,不符合题意,故C错误;
D.乙烯和丁烯中H原子数目分别为4、8,符合题意,故D正确,
故选D.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查有机物燃烧规律的知识,注意利用平均分子式,结合燃烧通式进行解答,难度不大.1年前查看全部
- 将(NH4)2CO3固体加热,计算在150℃时所得混合气体密度是相同条件下氢气密度的多少倍
 badbird1年前3
badbird1年前3 -
 nancy813 共回答了14个问题
nancy813 共回答了14个问题 |采纳率85.7%(NH4)2CO3=2NH3+H2O+CO2
平均相对分子质量=(17*2+18+44)/4=24
所得混合气体密度是相同条件下氢气密度的24/2=12倍1年前查看全部
- 求150℃时碳酸铵安全分解 NH4HCO3=(加热)NH3+H2O+CO2所生成的混合气体的平均相对分子质量.
 newsalex1年前1
newsalex1年前1 -
 yi19tong 共回答了17个问题
yi19tong 共回答了17个问题 |采纳率82.4%做这类题是很简单的.
第一,你需要知道平均相对分子质量的计算公式.M=m/n.其实也就是平均摩尔质量——它与相对分子质量在数值上相等.
第二,你需要知道这个反应的方程式.NH4HCO3=NH3+H2O+CO2.
NH4HCO3的摩尔质量为79g/mol,即1mol NH4HCO3的质量为79g;从反应方程式可知,1mol NH4HCO3分解生成3mol 气体——依据质量守恒定律,3mol 气体的质量和为79g.所以,
混合气体的平均相对分子质量=79 / 3 = 26.3.1年前查看全部
- 近年来,科学家合成了一种稳定的氢铝化合物Al 2 H 6 。Al 2 H 6 的球棍模型如下图所示,它的熔点为150℃,
近年来,科学家合成了一种稳定的氢铝化合物Al 2 H 6 。Al 2 H 6 的球棍模型如下图所示,它的熔点为150℃,可用作高能燃料或储氢材料。下列说法正确的是 ( )
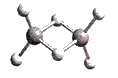
A.Al 2 H 6 可以燃烧,产物为氧化铝和水 B.1mol Al 2 H 6 中约含有4.8×10 24 个σ键 C.60g Al 2 H 6 中含铝原子约为1.2×10 23 个 D.Al 2 H 6 在固态时所形成的晶体是离子晶体  dd亦凡心1年前1
dd亦凡心1年前1 -
 sunpioneer 共回答了24个问题
sunpioneer 共回答了24个问题 |采纳率87.5%A
1年前查看全部
- (NH4)2CO3在150℃时能完全分解所得的混合气体的密度是相同条件下氢气密度的()倍A:12 B:24 C36 D4
(NH4)2CO3在150℃时能完全分解所得的混合气体的密度是相同条件下氢气密度的()倍A:12 B:24 C36 D48
 加文1年前1
加文1年前1 -
 cherrside 共回答了16个问题
cherrside 共回答了16个问题 |采纳率87.5%(NH4)2CO3在150℃时完全分解所得的混合气体成份为NH3,H2O(水蒸汽),CO2,方程式为(NH4)2CO3=2NH3+H2O+CO2,混合气体相对原子量为(17×2+18+44)/(2+1+1)=96/4=24,则密度之比为24/2=12,所以选A1年前查看全部
- 150℃时,将1L两种气态烃的混合物与8LO2混合后,点燃充分反应,恢复至150℃,密闭容器中压强增大了8%,则原混合烃
150℃时,将1L两种气态烃的混合物与8LO2混合后,点燃充分反应,恢复至150℃,密闭容器中压强增大了8%,则原混合烃可能是( )
A.甲烷、丙烯 B.乙烷、丙烯 C.乙炔、丙炔 D.乙烯、丁烯 心涌动1年前1
心涌动1年前1 -
 迷糊喵咪 共回答了20个问题
迷糊喵咪 共回答了20个问题 |采纳率80%像这类题,设混合烃的组成是CXHY.压强增大8%,说明物质的量增大8%,因为原物质的量是9,说明增大了0.72
CXHY+(X+0.25Y)O2-------XCO2+0.5YH2O 增大
1 X+0.25Y X 0.5Y 0.25Y-1
固有0.25Y-1=0.72
Y =3.28,说明混合烃的含H是3.28.故一个中含H>3.28 一个H1年前查看全部
- 【高一化学】150℃时碳酸铵完全分解产生的气体混合物,其密度是相同条件下氢气密度的多少倍?
【高一化学】150℃时碳酸铵完全分解产生的气体混合物,其密度是相同条件下氢气密度的多少倍?
密度比等于相对分子质量比,那混合物为什么要算平均相对分子质量?或平均摩尔质量? BabyFace辰1年前5
BabyFace辰1年前5 -
 人可西 共回答了20个问题
人可西 共回答了20个问题 |采纳率90%我告诉你吧,方法一,算生成混合物的平均相对分子质量,一摩尔碳酸铵生成2摩尔氨气,1莫尔水,1摩尔二氧化碳.怎么算平均相对分子质量 我就不说了 ,说起来麻烦.
方法二,2分子氨气,1分子水 1分子二氧化碳 加起来是4分子 .和4 分子氢气等体积.体积相同 密度之比等于质量之比.你算下4分子混合物 和 4分子氢气质量各是多少 就行了.我算了下 答案是 12
混合物有多种成分,各组分 相对分子质量不一样,求混合物的相对分子质量 就是求平均相对分子质量.同温同压下,平均相对分子质量比就是密度比.1年前查看全部
- 150℃时,只含C、H、O三种元素的有机物A 8.8g 在一定量的O2中燃烧,生成的混合
150℃时,只含C、H、O三种元素的有机物A 8.8g在一定量的O2中燃烧,生成的混合气体缓慢通过盛有足量无水CuSO4的干燥管,干燥管中的固体增重10.8g,剩余的气体通入盛有足量澄清石灰水的试剂瓶,试剂瓶中的物质增重8.8g,最后的气体缓慢通过盛有灼热CuO的硬质试管,硬质试管中的物质质量减少4.8g.请通过计算和分析回答下列问题:
(1)写有机物的分子式______
(2)本题中,A和O2反应的化学方程式为______;
(3)若A的结构满足下列条件:能和Na反应但不能和NaOH反应;能进行催化氧化但不能发生消去反应.则A的结构简式为______. 三oo子1年前0
三oo子1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2011•上海)草酸晶体(H2C2O4•2H2O)100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO
(2011•上海)草酸晶体(H2C2O4•2H2O)100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2.用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)( )
A.
B.
C.
D.
 a4605160581年前1
a4605160581年前1 -
 bluesmith 共回答了25个问题
bluesmith 共回答了25个问题 |采纳率92%解题思路:根据草酸晶体先失水,试管口应向下倾斜;加热固体来制取气体,应选择试管,不能选择锥形瓶;熔化的草酸会流到试管口,而酒精加热部位在试管底部,会使样品无法继续受热分解;
解决了受热过程中产生水以及样品融化流动的这两个问题即可解答.A、试管口向上倾斜,水倒流进试管,会使试管底炸裂,故A错误;
B、加热固体来制取气体,应选择试管,不能选择锥形瓶,故B错误;
C、草酸熔点低,在分解之前就熔化,C装置熔化的草酸会流到试管口,而酒精加热部位在试管底部,会使样品无法继续受热分解,故C错误;
D、该装置圆满的解决了受热过程中产生水以及样品融化流动的这两个问题,由草酸晶体100℃开始失水,试管口应向下倾斜,故D正确.
故选D.点评:
本题考点: 加热反应气体性质实验装置.
考点点评: 此题考核学生对于简易气体发生装置的应用.一般对于涉及到实验装置图的选项甄别,需要仔细观察装置之间的细微差别,同时结合题干文字部分进行选择.1年前查看全部
- 在一标准大气压下,150℃沸腾的水停止加热,水是立刻停止沸腾还是等温度降到100℃以下才停止沸腾?
在一标准大气压下,150℃沸腾的水停止加热,水是立刻停止沸腾还是等温度降到100℃以下才停止沸腾?
如果是降到100℃以下才不沸腾的话,那岂不是跟沸腾需要持续吸热冲突了吗? weiwei_vivian1年前1
weiwei_vivian1年前1 -
 大米爱老树 共回答了18个问题
大米爱老树 共回答了18个问题 |采纳率100%标准大气压下,水温不可能达到150度的 .“如果没有持续吸热,但温度仍然高于沸点的水会不会沸腾”这句话有歧义.对水来说,如果它的温度到沸点就会沸腾,但是这个温度是需要维持的,就是需要吸热.比如加热的容器温度比100度温度还高的话,水还是会沸腾的,因为从容器那吸收热量了.如果单纯就你这句“温度仍然高于沸点的水会不会沸腾”,那回答是的.1年前查看全部
- 在1.01×10 5 Pa、150℃条件下,某烃完全燃烧,反应前后压强不发生变化,该有机物可能是 [
在1.01×10 5 Pa、150℃条件下,某烃完全燃烧,反应前后压强不发生变化,该有机物可能是 [ ]A.CH 4
B.C 2 H 6
C.C 2 H 4
D.C 2 H 2 36257001年前1
36257001年前1 -
 逆来顺受的人 共回答了20个问题
逆来顺受的人 共回答了20个问题 |采纳率90%AC1年前查看全部
- 将2molNaHCO3和一定量Na2O2固体混合,在加热条件下让其充分反应,150℃时所得气体中仅含有两种组分,则反应后
将2molNaHCO3和一定量Na2O2固体混合,在加热条件下让其充分反应,150℃时所得气体中仅含有两种组分,则反应后固体的物质的量n的取值范围是( )
A. n=1mol
B. 1mol<n<2mol
C. 2mol<n<4mol
D. n≥4mol 历史由铁血铸成1年前1
历史由铁血铸成1年前1 -
 Visa莎_1029 共回答了10个问题
Visa莎_1029 共回答了10个问题 |采纳率100%解题思路:2molNaHCO3分解生成1molNa2CO3、1molH2O和1molCO2,生成的1molH2O和1molCO2会和Na2O2固体反应,可采用极值法来计算.加热后,发生反应如下:
2NaHCO3
△
.
Na2CO3+H2O+CO2↑,
2mol 1mol 1mol 1mol
2Na2Oz+2CO2═2Na2CO3+O2
1mol 1mol
2Na2Oz+2H2O═4NaOH+O2↑
1mol 1mol 2mol
由反应方程式可知,150℃时所得气体中仅含有两种组分,则气体为氧气和水蒸气,二氧化碳全部反应,2mol NaHCO3分解生成1molNa2CO3;若2mol NaHCO3分解生成二氧化碳全部被吸收,则1molCO2与Na2O2反应生成1mol Na2CO3,所以固体的物质的量最少为2molNa2CO3;
若2mol NaHCO3分解生成的H2O和CO2被足量的Na2O2吸收时,还可生成1mol Na2CO3和2molNaOH,所以固体最多不超过4mol;
故选:C.点评:
本题考点: 钠的重要化合物.
考点点评: 本题考查了碳酸氢钠的性质及过氧化钠的性质及有关计算,搞清反应原理,找出各量之间的关系是解题的基础,对于范围类的题目,常采用极值法进行计算.1年前查看全部
- 1.在150℃时碳酸铵可以受热完全分解,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
1.在150℃时碳酸铵可以受热完全分解,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
A.96倍 B.48倍 C.12倍 D.32倍
2.已知7 g C与14 g O2完全反应后,生成21 g CO和CO2混合气体,在相同状态下,混合气体中CO和CO2的体积之比为 ;体积分别为 ; .
1:1 11.2L 11.2L asdfgabdvjkhasd1年前1
asdfgabdvjkhasd1年前1 -
 ready804 共回答了10个问题
ready804 共回答了10个问题 |采纳率90%1.150℃下(NH4)2CO3分解出2份NH3,1份CO2和一份H2O(水蒸气) 平均分子质量为24,H2为2,所以选C
2.C+O2=CO2
2C+O2=2CO
其中C有7克O2有14克,恰好完全反应,根据摩尔数计算就是了
设生成CO2的C有x摩,生成CO的有y摩
12(x+y)=7
32x+16y=14
变形为
24x+24y=14
48x+24y=21
解得:x=7/24,y=7/24
得知x=y所以,n(CO2)=n(CO)
所以生成气体体积相同1年前查看全部
- 150℃时碳酸氢铵完全分解产生的气态混合物,其密度是相同条件下氢气密度的( )倍 A:6 B:8 C:12 D:32
150℃时碳酸氢铵完全分解产生的气态混合物,其密度是相同条件下氢气密度的( )倍 A:6 B:8 C:12 D:32
能说说为什么吗? huskypppp1年前1
huskypppp1年前1 -
 央金卓玛 共回答了20个问题
央金卓玛 共回答了20个问题 |采纳率85%我的算法和答案比较接近你参考一下
分解生成氨气(17),二氧化碳(44),水(18)共3mol
三个质量和是79
79/3=26(求出每摩尔的)
26/2=13(氢气的13倍)
最接近的是C选项1年前查看全部
- 空气温度450℃降到150℃ 要在10000立方米的容器里加多少水?
空气温度450℃降到150℃ 要在10000立方米的容器里加多少水?
空气温度450℃降到150℃ 要在10000立方米的容器里加多少常温水?
常温水假设20℃ 性项目1年前1
性项目1年前1 -
 zhao911 共回答了16个问题
zhao911 共回答了16个问题 |采纳率68.8%那现在题就是:现有10t铁、温度是450℃、想要把温度降到150℃、需要20℃的水多少?
t1=450℃-150℃=300℃
t2=100℃-20℃=80℃ (因为标准气压下水的沸点是100℃、不会超过100)
铁的比热容是:0.46×10^3J/(kg·℃)
水的比热容是:4.2×10^3J/(kg·℃)
设一共需要水X kg
Q1=Q2
C1M1T1=C2M2T2
0.46×10^3J/(kg·℃)×10000kg×300℃=4.2×10^3J/(kg·℃)×X×80℃
X≈4107kg
一共需要4107kg水1年前查看全部
- 7000立方25℃空气,每分钟加热到150℃,需要多少热量
 tangjiba1年前1
tangjiba1年前1 -
 我_男女男 共回答了15个问题
我_男女男 共回答了15个问题 |采纳率86.7%Q=cm(t2-t1)1年前查看全部
- 在常压、150℃时,某气态烃与过量氧气的混合气体aL,点燃后并恢复至原来的条件,体积仍为aL;然后将燃烧产物通过浓硫酸,
在常压、150℃时,某气态烃与过量氧气的混合气体aL,点燃后并恢复至原来的条件,体积仍为aL;然后将燃烧产物通过浓硫酸,体积减少bL;再通过氢氧化钠溶液,体积又减少bL,最后剩有少量尾气.求该烃的化学式.
 rr分叉1年前3
rr分叉1年前3 -
 隔离病人 共回答了20个问题
隔离病人 共回答了20个问题 |采纳率90%燃烧产物通过浓硫酸,体积减少bL;再通过氢氧化钠溶液,体积又减少bL 说明了产生的H2O和CO2的物质的量比为:b:b=1:1 所以n(c):n(H)=1:2
CnH2n + 3n/2O2---------------nCO2 +nH2O
所以:1+3n/2===n+n n=2
所以该烃的化学式C2H4 结构式:CH2=CH21年前查看全部
- 由一种气态烷烃A和烯烃B组成的混合气体10L,在150℃,一个大气压和足量氧气成分燃烧后,在相同情况下产生20L二氧化碳
由一种气态烷烃A和烯烃B组成的混合气体10L,在150℃,一个大气压和足量氧气成分燃烧后,在相同情况下产生20L二氧化碳和25L水蒸气,确定A,B的分子式和体积比
 rrup1年前1
rrup1年前1 -
 zhenggh1428 共回答了14个问题
zhenggh1428 共回答了14个问题 |采纳率100%N(C)=20/10=2
N(H)=25*2/10=2
两种烃的平均分子式为:C2H5.
可能有下列几种情况:
(1)CH4和C3H6:体积比1:1
(2)CH4和C4H8:不符合题意.
(3)C2H6和C2H4:体积比1:11年前查看全部
- 、有一气态烃,无论取量多少,与过量的氧气混合后,置于一定体积的密闭容器中引燃使之充分燃烧,当恢复至原温度(150℃)时容
、有一气态烃,无论取量多少,与过量的氧气混合后,置于一定体积的密闭容器中引燃使之充分燃烧,当恢复至原温度(150℃)时容器内的压强保持不变.
试归纳出这类烃的组成特征 (2条) hmljhyx1年前2
hmljhyx1年前2 -
 流浪的小肥猪 共回答了17个问题
流浪的小肥猪 共回答了17个问题 |采纳率94.1%我们可以设该气态烃的化学式为CxHy.
则和氧气反应的方程式为:
CxHy + (x+y/4)O2 = xCO2 + y/2H2O
因为是在150度下,所以水保持气态.
则压强保持不变,即体积保持不变时,有:
1+x+y/4=x+y/2
可得y=4.
则可知这类烃的组成特征:
1.C原子数目小于等于4.(因为是气态烃).
2.H原子数目一定等于4.(上面已经求出).1年前查看全部
- (2013•西城区模拟)质量为0.2kg的金属球,温度从150℃下降到100℃,放出的热量是4.6×103J.结合比热容
(2013•西城区模拟)质量为0.2kg的金属球,温度从150℃下降到100℃,放出的热量是4.6×103J.结合比热容表,判断此金属球的材料是______.
几种物质的比热容c/[J•(kg•℃)-1] 铁0.46×103 铝0.88×103 铅0.13×103 铜0.39×103  woaicuicui1年前1
woaicuicui1年前1 -
 小蜜蜂飞到花丛中 共回答了18个问题
小蜜蜂飞到花丛中 共回答了18个问题 |采纳率83.3%解题思路:知道金属球的质量、初温和末温和放出的热量,根据公式Q放=cm△t可计算该金属块的比热容,比热容是物质的一种特性,根据表格提供信息可查出是哪种金属.∵Q放=cm△t=cm(t0-t),
即:4.6×103J=c×0.2kg×(150℃-100℃),
∴c=0.46×1O3J/(kg•℃);根据表格可查出是铁.
故答案为:铁.点评:
本题考点: 热量的计算.
考点点评: 本题考查学生对比热容的理解和放热公式的灵活运用,属于基础题目.1年前查看全部
- 求化工原理达人~25.在套管换热器中热流体的温度有150℃降为100℃,冷流体的温度有50℃升为80℃,则逆流操作时对数
求化工原理达人~
25.在套管换热器中热流体的温度有150℃降为100℃,冷流体的温度有50℃升为80℃,则逆流操作时对数平均温差为 ℃,并流操作时对数平均温差为 ℃.
26.以精馏的方式分离液体混合物的基本原理是 .
27.组成为xF的苯-甲苯混合液体,经过部分汽化以后形成的饱和汽相组成为y,饱和液相组成为x.三个组成的大小顺序为 > > .
28.精馏塔进料的为饱和液体时热状况参数q= ,而为饱和汽体的热状况参数q= ,过冷液体的热状况参数q的范围是 ,过热蒸汽的热状况参数q的范围是 ,汽液两相的热状况参数q的范围是 .
29.在精馏塔计算中恒摩尔流假设是指 .
30.某精馏塔的进料流量为F、组成为xF,塔顶产品流量为D,组成为xD,塔顶产品流量为W,组成为xW.则全塔物料衡算方程式为 ,轻组分物料衡算方程式为 . 风雨后的山顶1年前1
风雨后的山顶1年前1 -
 混个屁 共回答了23个问题
混个屁 共回答了23个问题 |采纳率82.6%25逆流 (100-20)/ln(100/20)=49.7 并流(70-50)/ln(70/50)=59.44 约为60
26 挥发度的不同
27 y>xf>x
28 1,0 , q>1, q1年前查看全部
- 一道有机化学计算题在常压,150℃时,某气态烃与过量氧气的混合气体aL,点燃后并恢复至原来的条件,体积仍为aL.然后将燃
一道有机化学计算题
在常压,150℃时,某气态烃与过量氧气的混合气体aL,点燃后并恢复至原来的条件,体积仍为aL.然后将燃烧产物通过浓硫酸,体积减少bL,再通过NaOH溶液,体积又减少bL,最后剩有少量尾气.求改烃的化学式. 正儿九经1年前1
正儿九经1年前1 -
 小发财树 共回答了22个问题
小发财树 共回答了22个问题 |采纳率86.4%设该气态烃的化学式为:CxHy,燃烧后的化学方程式为:
CxHy+(y/4+x)O2=y/2 H2O+x CO2,由于反应 后在150度下,反应前后的体积相同,则前后气体摩尔数相等,有:1+y/4 +x=y/2+ x -------1
反应后被浓硫酸吸收bL,说明有bL水蒸汽,则有:y/2=b ---2
反应后被NaOH溶液吸收bL,说明有bLCO2,则有:x=b -------3
联合1、2、3解方程组则有x=2.y=4.
则该烃的化学式为C2H4.1年前查看全部
大家在问
- 1《军神》在课文中找出描写沃克医生神态的词语
- 2求函数y=tan(2x-π/3),x不等于(5π/12 + kπ/2)
- 3R N A L E D G -能组成什么单词
- 4孩子,请系好鞋带 那时,我还在读初一。学校每到年底都会组织游园活动庆祝新年的到来,记得那年的游园活动特别热闹,游戏很
- 5把这个实验解释出物理现象将曼妥思加入可乐中,并迅速关上瓶盖,发现瓶盖在几秒后被鼓开.将泡腾片放入筒状物当中,加水,盖上盖
- 6把方程0.5x-0.01/0.2-0.5=0.4x-0.06/1.2的分母化为整数以后是什么?
- 71、两个数相除,商3余10,被除数、除数、商及余数的和是143,被除数和除数各是多少?
- 8基因工程中,常用的运载体有质粒和细菌,这个为什么是错的?
- 9用1~9九个数字,填入下面的口里/,每个数字只能填一次使三个分数相等.囗/囗=囗/囗囗=口口/口口
- 10已知复数Z1=a+bi(a,b∈R),Z2=3+4i, (1)若Z1-Z2=2+i,求Z1; (2
- 11空气开关在家庭电路中发生______(选填“短路”或“断路”)故障时起保护作用的装置.
- 123分40秒/1000m换成时速是多少?
- 13海上日出和海上日出的读后感急求海上日出的完整的文章和海上日出的读后感!
- 14稀硝酸与铜反应产生无色的一氧化氮
- 15和"刀枪箭斧"一类的词
