那同离子效应导致的平衡移动溶剂的质量可以不变,但这时溶质的质量确实改变了,
 colour_19992022-10-04 11:39:541条回答
colour_19992022-10-04 11:39:541条回答
那同离子效应导致的平衡移动溶剂的质量可以不变,但这时溶质的质量确实改变了,
那此时它的溶解度是否变了
那此时它的溶解度是否变了

已提交,审核后显示!提交回复
共1条回复
 猫儿HOHO 共回答了21个问题
猫儿HOHO 共回答了21个问题 |采纳率85.7%- 例如
AG+ + CL- ==== AGCL 沉淀
该反应在1mol/L 的NACL溶液中 与在H2O中相比 平衡右移
我们说AGCL 在1mol/L 的NACL溶液中的溶解度比在水中溶解度小 - 1年前
相关推荐
- 化学的同离子效应同离子效应,共轭效应,诱导效应,请举简单的例子稍微解释下(难了我听不懂).高考会考到吗?
 光明殿下1年前1
光明殿下1年前1 -
 xzhtb 共回答了21个问题
xzhtb 共回答了21个问题 |采纳率100%同离子效应有两种,一种是降低弱电解质的电离度;另一种是您问到的降低原电解质的溶解度.即,在电解质1的饱和溶液中,加入和电解质1有相同离子的强电解质2,1年前查看全部
- (2009•梅州模拟)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物
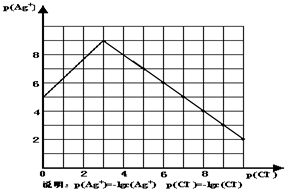 (2009•梅州模拟)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.
(2009•梅州模拟)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为______.
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:______
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是______
(4)若在AgCl形成的浊液中滴加氨水有什么现象?______发生反应的离子方程式为______. nebulaer1年前1
nebulaer1年前1 -
 rainytan 共回答了21个问题
rainytan 共回答了21个问题 |采纳率100%解题思路:(1)AgCl的溶度积常数Ksp=c(Ag+)•c(Cl-);
(2)根据化学平衡移动原理和题给信息回答;
(3)沉淀向着更难溶的物质转化;
(4)氯化银能和氨水反应生成银氨溶液.(1)AgCl的溶度积常数Ksp=c(Ag+)•c(Cl-)=10-9mol/L•10-3mol/L=10-12,故答案为:10-12;
(2)根据沉淀溶解平衡:AgCl(s)=Cl-(aq)+Ag+(aq),将氯化银放在氯化钠中,Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl+Cl-═[AgCl2]-,
故答案为:Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl+Cl-═[AgCl2]-;
(3)根据S(AgCl)>S(AgI)>S(Ag2S),并且沉淀向着更难溶的物质转化,可以设计实验方案是:向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色,
故答案为:向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色;
(4)氯化银能和氨水反应生成无色银氨溶液溶液,现象是:白色沉淀溶解,形成无色溶液,
实质为:AgCl+2NH3=Ag(NH3)2++Cl-,
故答案为:白色沉淀溶解,形成无色溶液;AgCl+2NH3=Ag(NH3)2++Cl-.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查学生化学平衡移动的判断以及沉淀溶解平衡的有关知识,是一道综合题.注意从题给信息和图示获得解题思路.1年前查看全部
- 举例说明什么是同离子效应?欲配制pH=10.0的缓冲溶液,应在300mL 0.5mol/L NH3•H2O溶
举例说明什么是同离子效应?欲配制pH=10.0的缓冲溶液,应在300mL 0.5mol/L NH3•H2O溶液中加NH4Cl 多少克?
 该用户名已使用1年前2
该用户名已使用1年前2 -
 kk一下 共回答了19个问题
kk一下 共回答了19个问题 |采纳率100%比如一个沉淀溶解平衡:AgCl(s)=Ag+(aq)+Cl-(aq)
你往里面加NaCl,则等于增加了[Cl-],则平衡逆向移动,AgCl溶解度降低
[OH-]=Kb*[NH3•H2O]/[NH4]
你Kb没告诉不能做..你可以查表得到..我记得好像是1.8*10^-5左右把
我就当作Kb算了
设加入NH4Cl x mol
代入数据得到
10^-4=Kb*0.5/(x/0.3)
x=1500Kb
则加入氯化铵质量为:1500Kb*53.5=80250K1年前查看全部
- 向饱和AgCl溶液中加入盐酸,AgCl的溶解度变小,原因是同离子效应,请你指出25℃时,AgCl在下列四种物质1.100
向饱和AgCl溶液中加入盐酸,AgCl的溶解度变小,原因是同离子效应,请你指出25℃时,AgCl在下列四种物质1.100ml水2.100ml 0.01mol/L的硝酸银3.100ml 0.01mol/LNaCl,溶液中的溶解度大小顺序为?
 genqcn1年前2
genqcn1年前2 -
 simlook 共回答了14个问题
simlook 共回答了14个问题 |采纳率92.9%由于氯化银在溶液中极少量的会溶解,而溶解的氯化银会发生电离:AgCl== Ag+ + Cl-
根据同离子效应,增加Ag+或Cl-都会影响AgCl的溶解度,
而2、3中两种离子浓度相等:C(Ag+)==C(Cl-),
所以效应是等效的,所以溶解度:1> 2==31年前查看全部
- 3.同离子效应与盐效应如何影响弱电解质的离解度?
 五月留影1年前1
五月留影1年前1 -
 flyingmind77 共回答了22个问题
flyingmind77 共回答了22个问题 |采纳率95.5%加入含相同离子的强电解质,使弱电解质电离度减小或使难溶盐溶解度降低的效应,叫同离子效应.1年前查看全部
- 高中化学:同离子效应 是不是相同浓度的含有弱酸根离子的溶液中电离大于水解还是水解大于电离啊?举些例子
高中化学:同离子效应 是不是相同浓度的含有弱酸根离子的溶液中电离大于水解还是水解大于电离啊?举些例子
高中化学:同离子效应 是不是相同浓度的含有弱酸根离子的溶液中电离大于水解还是水解大于电离啊?举些例子 badao801年前4
badao801年前4 -
 了悟一生 共回答了21个问题
了悟一生 共回答了21个问题 |采纳率85.7%没有特殊说明情况下,是电离大于水解.如同浓度的醋酸和醋酸钠溶液.
但HCN和NaCN则是CN-水解大于电离.这种题目会说明的,如:同浓度混合,溶液呈碱性1年前查看全部
- 同离子效应使难溶电解质的溶解度()盐效应使难溶电解质的溶解度()后一种效应较前一种效应()得多.
同离子效应使难溶电解质的溶解度()盐效应使难溶电解质的溶解度()后一种效应较前一种效应()得多.
A.减小,增大,小
B.减小,增大,大
C.减小,减小,大
D.增大,减小、小 贝贝猪1111年前4
贝贝猪1111年前4 -
 ttf2030 共回答了18个问题
ttf2030 共回答了18个问题 |采纳率88.9%B1年前查看全部
- 同离子效应是化学平衡的一个常见现象,请解释在缓冲溶液和沉淀平衡中的不同作用?
 jzw20081年前2
jzw20081年前2 -
 0415bingbing 共回答了22个问题
0415bingbing 共回答了22个问题 |采纳率95.5%在缓冲溶液中,盐的同离子效应抑制了弱酸或弱碱的电离,所以溶液中[H+]近似等于KaC酸/C盐;在沉淀平衡中,同离子效应促使平衡向沉淀的方向移动,即沉淀更完全.1年前查看全部
- 产生同离子效应的原因是什么?老师说是因为在溶液中的溶质里,例如KCl,K+和Cl-的乘积是定值,加入像NaCl,后,多了
产生同离子效应的原因是什么?
老师说是因为在溶液中的溶质里,例如KCl,K+和Cl-的乘积是定值,加入像NaCl,后,多了Cl,所以溶解的KCl就少了.是因为离子的乘积是定值的缘故吗? j5wuk1年前1
j5wuk1年前1 -
 gooubkp 共回答了13个问题
gooubkp 共回答了13个问题 |采纳率84.6%其实是每种盐在溶解时,在固定条件下有其固定的溶度积,可以想你说的那般理解,乘积为定值.就简单的来说水中的氢离子和氢氧根离子在标准状态下的乘积为十的负十四次方1年前查看全部
- 同离子效应对难溶电解质的溶解度有何影响?
 我思故我在81年前3
我思故我在81年前3 -
 茂子1981 共回答了16个问题
茂子1981 共回答了16个问题 |采纳率81.3%由于引入了难溶电解质电离出的离子,电离受到抑制,溶解度大幅度减少.
如:BaSO4 = Ba(2+) + SO4(2-)
在上述溶液中不论引进Ba(2+),还是SO4(2-),都会产生同离子效应,抑制硫酸钡的溶解.1年前查看全部
- 同离子效应使难溶电解质的溶解度,
同离子效应使难溶电解质的溶解度,
同离子效应使难溶电解质的溶解度()盐效应使难溶电解质的溶解度()后一种效应较前一种效应()得多.
A.减小,增大,小
B.减小,增大,大
C.减小,减小,大
D.增大,减小、小 隐逸隐逸1年前1
隐逸隐逸1年前1 -
 peg23311 共回答了15个问题
peg23311 共回答了15个问题 |采纳率86.7%A.减小,增大,小
盐效应是离子间相互作用的结果,使溶解度增大,但它的影响远远小于同离子效应1年前查看全部
- 何为同离子效应?在HAC溶液中加入NaAc对HAc的电离平衡有何影响
 刘小如1年前2
刘小如1年前2 -
 东海幺幺 共回答了14个问题
东海幺幺 共回答了14个问题 |采纳率100%加入的物质可在溶液中电离出相同的离子,因而可影响物质的电离平衡.
促进.前者结合水中的氢离子,把后者的电离方程式再写出来就明白了.1年前查看全部
- 同一体系中盐效应强于同离子效应吗
 yanyufengqw1年前2
yanyufengqw1年前2 -
 xsp19807520 共回答了15个问题
xsp19807520 共回答了15个问题 |采纳率100%一般说来,若难溶电解质的溶度积很小时,盐效应的影响很小,可忽略不计;若难溶电解质的溶度积较大时,溶液中各种离子的总浓度也较大时,就应该考虑盐效应的影响.在发生同离子效应时,由于也外加了强电解质,所以也伴随有盐效应的发生,只是这时同离子效应远大于盐效应,所以可以忽略盐效应的影响.1年前查看全部
- 同离子效应对弱电解质的电离度有何影响?
 wanglin_891年前1
wanglin_891年前1 -
 7uok114187 共回答了19个问题
7uok114187 共回答了19个问题 |采纳率89.5%抑制弱离子的电离,减小1年前查看全部
- 什么是同离子效应?举一个例子
 tymb1年前1
tymb1年前1 -
 px5000 共回答了23个问题
px5000 共回答了23个问题 |采纳率100%例如:在CH3COONa溶液中,CH3COOH的电离程度减小,因为CH3COO-离子对醋酸电离的抑制作用,该作用也称同离子效应.
再如:KCl饱和溶液中加入NaNO3固体,NaNO3固体一样可以溶解达饱和状态,因为它们电离产生的离子不相互影响,二者的溶解度都不变.但是如果KCl饱和溶液中加入NaCl固体也形成饱和液,显然根据Ksp(KCl) == C(K+)C(Cl-),溶液中的C(Cl-)增大,KCl的溶解度会降低,这就是同离子效应的影响.1年前查看全部
- 什么是同离子效应,同离子效应主要有哪些应用?
 54tk1年前1
54tk1年前1 -
 纖雲飛星 共回答了12个问题
纖雲飛星 共回答了12个问题 |采纳率83.3%同离子效应 由于加入含相同离子的强电解质,使弱电解质电离度减小或使难溶盐溶解度降低的效应,叫同离子效应.分别说明如下:①使弱电解质电离度减小 例如,在醋酸溶液中加人醋酸钠,由于醋酸钠是强电解质、在水中全部电...1年前查看全部
- 有关同离子效应同离子效应中判断析出(或挥发)的物质是根据该温度和压强下的溶解度的大小还是先转化成摩尔溶解度再比较大小我想
有关同离子效应
同离子效应中判断析出(或挥发)的物质是根据该温度和压强下的溶解度的大小还是先转化成摩尔溶解度再比较大小
我想了想,是不是应该是计算该温度和压强下哪个相同的那个离子溶解的少哪个就析出或挥发?还是我想太复杂了? 一段圆弧1年前3
一段圆弧1年前3 -
 npq1981 共回答了20个问题
npq1981 共回答了20个问题 |采纳率85%首先明确,是按照离子物质的量浓度计算的.同离子效应有两种:一种是降低弱电解质的电离度;另一种是您问到的降低原电解质的溶解度.即,在电解质1的饱和溶液中,加入和电解质1有相同离子的强电解质2,因而降低电解质1的溶解度的效应叫同离子效应.这种效应对于微溶电解质特别显著,在化学分析中应用很广.对此现象可以这样来理难溶电解质的溶解和沉淀是一种动态平衡,所以溶液中有关离子的浓度的(某种!)乘积是个常数--溶度积.例如[BiO+][Cl-]=Ksp(该Ksp的具体数据手边没有)=常数c,好,您看,假定原来单纯的BiOCl的饱和溶液中,[BiO+]=[Cl-];加了NaCl后,[Cl-]大大增加,但是常数c仍然得满足,所以必然是[BiO+]大大降低,它无处可去,只有沉淀![BiO+]降低不是意味着BiOCl的溶解度下降吗?上面提到的降低弱电解质的电离度的原理类推.在弱电解质溶液中加入含有与该弱电解质具有相同离子的强电解质,从而使弱电解质的解离平衡朝着生成弱电解质分子的方向移动,弱电解质的解离度降低的效应称为同离子效应.①使弱电解质电离度减小 例如,在醋酸溶液中加入醋酸钠,由于醋酸钠是强电解质、在水中全部电离成Na+和Ac-,溶液中Ac-浓度增大,大量的Ac-同H+结合成醋酸分子,使醋酸的电离平衡向左移动因此, 醋酸的电离度减小,溶液中H+浓度降低.在弱碱溶液中加入弱碱盐,例如,在氨水中加入氯化铵,也存在同离子效应.有同离子效应时计算氢离子浓度的一般公式(见插图)为:式中Kα为弱酸的电离常数,c为浓度.同理可得:式中Kb为弱碱的电离常数.②使难溶盐溶解度降低 例如,硫酸钡饱和溶液中,存在如下平衡:在上述饱和溶液中加入氯化钡,由于氯化钡完全电离,溶液中[Ba2+]突然增大,[Ba2+]>KSP,原来的平衡遭到破坏,>KSP时,[Ba2+]大于BaSO4溶解在纯水中的钡离子浓度,而平衡向左移动,析出BaSO4沉淀.当溶液中再次建立新的平衡,即[Ba2+]则小于BaSO4溶解在纯水中的硫酸根浓度,硫酸钡的溶解度可用新的平衡状态下的来量度.因此BaSO4在BaCl2溶液中的溶解度比在纯水中要小.即加入含相同离子的强电解质BaCl2使难溶盐BaSO4的溶解度降低.同离子效应也可以降低易溶电解质的溶解度.例如,在饱和的NaCl溶液中加入浓盐酸或通入氯化氢气体,也可以使NaCl晶体析出.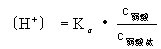 1年前查看全部
1年前查看全部
- 同离子效应可使难溶强电解质的溶解度大大降低.为什么这句话是错的?
 萍水亦相逢1年前1
萍水亦相逢1年前1 -
 郁闷的zz钱 共回答了25个问题
郁闷的zz钱 共回答了25个问题 |采纳率100%溶解度本身是一定的.1年前查看全部
- 求知以下医用化学名词的解释. 求知,一、缓冲溶液、二.共轭效应、三.同离子效应、四.缓冲作用、五.酰化反映、六、脱羧反应
求知以下医用化学名词的解释. 求知,一、缓冲溶液、二.共轭效应、三.同离子效应、四.缓冲作用、五.酰化反映、六、脱羧反应、七.胶体渗透压、八、表面活性剂、九酸败、十.官能团、十一.氨基酸、十二、表面张力、十三.π键十四酮体 在医用化学的解释
 ahpaol1年前1
ahpaol1年前1 -
 海南龙泉海景大酒店 共回答了20个问题
海南龙泉海景大酒店 共回答了20个问题 |采纳率95%我空间有这些名词解释1年前查看全部
- 有关同离子效应1.同离子效应中有一种是降低电解质的溶解度,但如NH4Cl和NaCl中,在低温时析出的是NH4Cl,但根据
有关同离子效应
1.同离子效应中有一种是降低电解质的溶解度,但如NH4Cl和NaCl中,在低温时析出的是NH4Cl,但根据同离子效应原理,NH4Cl不会完全析出,那Cl-还是比原来多了,相应的NaCl还会析出一点,也就是说NaCl的溶解度也减小了,但同离子效应中为什么说减小的是溶解度较小的物质的溶解度?
2.弱电解质的存在会不会导致溶解性较差的强电解质析出?如向饱和石灰水中通入氨 kkuu10641年前2
kkuu10641年前2 -
 恒春 共回答了28个问题
恒春 共回答了28个问题 |采纳率96.4%1楼的错了
1.“同离子效应中为什么说减小的是溶解度较小的物质的溶解度”这句话准确来说是错的,因为它们的溶解度都变小,只是相对而言原来溶解度小的变化的更大,所以一般说溶解度较小的物质的溶解度减小而不说溶解度较大的物质的溶解度减小;
2.弱电解质的存在会导致溶解性较差的强电解质析出.因为溶解度与电解质的强弱无关!只需满足同离子效应.向饱和石灰水中通入氨,由于通入的氨与水生成了OH-,使Ca(OH)2 (s)=可逆号=Ca2+(aq) + 2OH-(aq)平衡向左移动,生成了Ca(OH)2固体(注意,这个反应是溶解平衡,所以能写成可逆号).
楼主看懂了没1年前查看全部
- 同离子效应对弱电解质的解离度及难溶强电解质的溶解度各有什么影响
 大危危1年前3
大危危1年前3 -
 特洛伊嗨嗨 共回答了27个问题
特洛伊嗨嗨 共回答了27个问题 |采纳率81.5%相当于增加产物浓度,平衡逆向移动,即抑制弱电解质的解离度、使难溶强电解质的溶解度减小.1年前查看全部
- 什么是同离子效应和盐效应?
 cfzz3121年前1
cfzz3121年前1 -
 tiankun 共回答了19个问题
tiankun 共回答了19个问题 |采纳率94.7%盐效应:往弱电解质的溶液中加入与弱电解质没有相同离子的强电解质时,由于溶液中离子总浓度增大,离子间相互牵制作用增强,使得弱电解质解离的阴、阳离子结合形成分子的机会减小,从而使弱电解质分子浓度减小,离子浓度相应增大,解离度增大,这种效应称为盐效应.
同粒子效应:在弱电解质的溶液中,如果加入含有该弱电解质相同离子的强电解质,就会使该弱电解质的电离度降低的效应.同理,在电解质饱和溶液中,加入含有与该电解质相同离子的强电解质,也会降低该电解质的溶解度.1年前查看全部
- 一个纠结了很久的问题,向饱和的氨水(NH4+离子数已经上限了)的溶液中加入NH4Cl固体,根据同离子效应或者平衡移动解释
一个纠结了很久的问题,
向饱和的氨水(NH4+离子数已经上限了)的溶液中加入NH4Cl固体,根据同离子效应或者平衡移动解释,氨水的电离向左移动,但无法抵消增加的NH4+数目,那么NH4+一定会增多,这样一来不就和“已经饱和(不可能再溶解更多的NH4+)”矛盾了吗?
另外我同学说加入了NH4+后,为了使电离平衡常数K不变,必须减少OH-浓度,但是电离平衡常数只受温度影响,减少OH-应该没用啊 jdmade1年前1
jdmade1年前1 -
 伊崎神话 共回答了15个问题
伊崎神话 共回答了15个问题 |采纳率86.7%NH3NH4+ + OH-
达到平衡后加NH4Cl固体,发生完全电离:NH4Cl=NH4+ + Cl-,电离产生的NH4+时溶液中NH4+浓度增大,平衡向左移动,从而使OH-浓度减小,NH3·H2O浓度增大,最后当
c'(NH4+)·c'(OH-)/c'(NH3·H2O)又等于原来氨水中的c(NH4+)·c(OH-)/c(NH3·H2O)时,达到新的平衡.1年前查看全部
- 什么是同离子效应,盐效应,强电解质理论,离子强度,溶质活度?
什么是同离子效应,盐效应,强电解质理论,离子强度,溶质活度?
什么是同离子效应,盐效应,强电解质理论,离子强度和溶质活度?(请介绍详细些,) 普通用户8881年前1
普通用户8881年前1 -
 xiaoxindian 共回答了17个问题
xiaoxindian 共回答了17个问题 |采纳率94.1%我只知道 强电解质理论 .
比如说,任何酸不论强弱,在碱性溶液中,就都是强电解质; 任何碱不论强弱,在酸性溶液中,也就都是强电解质.
同离子效应 好像如我下面说的那样.
溶液中有2种或者2种以上的溶质,这几种溶质中含有同一种离子,那么这几种溶质都无法达到它们的溶解度.比如说现在 有溶液里有Na2SO4,NaCl,Na2CO3 3种溶质,假如在没有Na2SO4和Na2CO3这2种溶质时,原溶液可以溶解100g的NaCl,那么现在因为有了Na2SO4和Na2CO3,导致Na+离子的浓度变高,溶液就溶解不了100g的NaCl了.1年前查看全部
- 关于溶液PH的变化同浓度的盐酸和醋酸,用氢氧化钠滴定,请问谁的PH值变化较快.答案是醋酸更快,原因是同离子效应使醋酸电离
关于溶液PH的变化
同浓度的盐酸和醋酸,用氢氧化钠滴定,请问谁的PH值变化较快.
答案是醋酸更快,原因是同离子效应使醋酸电离减弱.
可是,有同离子效应的同时,氢离子也被大量消耗,可以促进醋酸的电离.
这两个哪个效果大呢?是只能通过实践得出还是有什么计算的过程呢? kth1361年前1
kth1361年前1 -
 jiniooo 共回答了20个问题
jiniooo 共回答了20个问题 |采纳率100%这个问题不能一概而论.下面我们用0.1000mol/L的氢氧化钠溶液滴定0.1000mol/L的盐酸、醋酸20mL来分析,滴定曲线的起点,是醋酸的高(约2.9),从0mL到10mL时,确实是醋酸上升较快,原因是生成的醋酸钠电离出的醋酸根离子的同离子效应,使得醋酸的电离减弱(此时,缓冲作用不很明显);在10mL以后,由于缓冲作用,醋酸的曲线变得平坦,一直到接近等当点(8.7);而盐酸的曲线则在4.3以后几乎呈直线上升;所以说,大约在加入15mL以后,就是盐酸变化较快.【问题在于,这些计算,中学阶段是不学的.】1年前查看全部
- 盐离子效应是什么为什么发生同离子效应时一定伴随盐离子效应
 无所不用其极1年前2
无所不用其极1年前2 -
 边走and边听 共回答了17个问题
边走and边听 共回答了17个问题 |采纳率94.1%电离平衡中:
同离子效应:
1.定义:在弱电解质溶液中,加入与该弱电解质有共同离子的强电解质时,弱电解质的电离平衡会左移,以致电解质的电离度下降,这种现象叫做同离子效应.
例如:在CH3COOH溶液中,存在以下电离平衡 CH3COOH←→CH3COO- + H+ .当加入强电解质CH3COONH4时,c(CH3COONH4)上升,使电离平衡左移,CH3COOH的电离度下降
2.应用:利用同离子效应,抑制溶质水解,如在NH3·H2O中加入NH4+
注意:弱电解质形成的盐通常是强电解质
盐效应:
1.定义:在弱电解质溶液中,加入其他强电解质时,弱电解质的电离度上升,这种影响叫做盐效应
例如:在0.1mol/L CH3COOH溶液中,加入0.1mol/L NaCl,则CH3COOH电离出的c(H+)不再是1.33·10^-3mol/L,而是1.68·10^-3mol/L了;其电离度也不是1.33%,而是1.68%了.
2.原因:盐效应的产生,是由于 强电解质的加入 使溶液中 离子浓度上升,溶液中离子间的相互牵制作用上升,即活度下降,离子结合为分子的机会下降,分子化速度下降.因此,重新达到平衡的CH3COOH的电离度要比未加NaCl时大.
因为同离子效应归根结底也是盐效应的一种,因此发生同离子效应时
一定伴随盐离子效应1年前查看全部
- 同离子效应的名词解释
 浪子fyj1年前2
浪子fyj1年前2 -
 windyvicky 共回答了13个问题
windyvicky 共回答了13个问题 |采纳率92.3%同离子效应英文名称:common ion effect ,在弱电解质溶液中加入跟该电解质有相同离子的强电解质,可以降低弱电解质的电离度,这种叫做同离子效应.在弱酸溶液中加入该酸的可溶性盐(如在醋酸溶液中加入少量固体醋酸钠),或在弱碱溶液中加入该碱的可溶性盐(如在氨水中加入氯化铵),都会发生同离子效应.发生同离子效应的原理主要是加入相同离子后,使原电解质的电离平衡向生成原电解质分子的方向移动,从而降低原电解质的电离度.在电解质饱和溶液中加入跟该电解质有相同离子的强电解质,从而降低原电解质的溶解度,这种现象也叫同离子效应.这是因为增加溶液中离子的浓度,使有关离子浓度的乘积超过原电解质的溶度积常数,使原电解质沉淀下来.1年前查看全部
- 同离子效应问题“例如[BiO+][Cl-]=Ksp=常数c,假定原来单纯的BiOCl的饱和溶液中,[BiO+]=[Cl-
同离子效应问题
“例如[BiO+][Cl-]=Ksp=常数c,假定原来单纯的BiOCl的饱和溶液中,[BiO+]=[Cl-];加了NaCl后,[Cl-]大大增加,但是常数c仍然得满足,所以必然是[BiO+]大大降低,它无处可去,只有沉淀![BiO+]降低就意味着BiOCl的溶解度下降了.” BiO+要沉淀就要和Cl-结合,那不是Cl-也要减少吗?如果这样常数就要变了? 释放一下1年前1
释放一下1年前1 -
 tommy_tjq 共回答了19个问题
tommy_tjq 共回答了19个问题 |采纳率78.9%BiOCl要沉淀,说明c[BiO+]c[Cl-]>Ksp而非取等号,BiO+和Cl-的量都因沉淀而减少,直到反应平衡,[BiO+][Cl-]=Ksp.所以Ksp不会变化.1年前查看全部
- 1、 同离子效应(名词解释2、缓冲溶液:3、可逆反应4、元素周期律:5、同位素
 karen_ng1年前2
karen_ng1年前2 -
 tt-水之丞 共回答了30个问题
tt-水之丞 共回答了30个问题 |采纳率93.3%1、在弱电解质的溶液中加入含有与弱电解质组成相同的强电解质,弱电解质的电离收到抑制的现象
2、能够抵抗外加少量强酸、强碱或者少量水的稀释而保持ph基本不变的溶液
3、在相同条件下,能同时向两个相反方向进行的反应
4、元素周期律,指元素的性质随着元素的原子序数(即原子核外电子数或核电荷数)的增加呈周期性变化的规律.
5、具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素1年前查看全部
- 无机化学复习题?一、填空题1、同离子效应发生的同时,必然伴有 发生,且同离子效应的强度 .2、化学反应速率通常用单位时间
无机化学复习题?
一、填空题
1、同离子效应发生的同时,必然伴有 发生,且同离子效应的强度 .
2、化学反应速率通常用单位时间内反应物浓度的 或生成物浓度的 来表示.
3、缓冲溶液是指加入少量强酸(强碱)或适当地稀释后能保持 不发生显著改变的溶液.
4、将不同强度的酸拉平到溶剂化质子水平的效应称为 .把各种不同强度的酸区别开来的效应称为 .
5、元素周期表中有 个周期,个族.
6、影响化学反应速率的外界因素是 、 、 、 .
7、稀溶液的依数性是 、 、 、 .
8、相同浓度时,不同弱电解质的电离常数越大,电离度 ..
9、酸碱反应实质上是两个共轭酸碱对之间的 转移反应. lmzr5211年前2
lmzr5211年前2 -
 蛟龙鼠女 共回答了17个问题
蛟龙鼠女 共回答了17个问题 |采纳率100%电离平衡的移动;较大;
减小;增大;
pH;
拉平效应;区分效应;
7;16;
浓度,温度,催化剂,压力;
沸点升高;熔点下降;渗透压;
越大;
质子.1年前查看全部
- 5,同离子效应使弱电解质的电离度_____;在0.1 mol/L的 HAc 溶液中加入 NaAc 固体后,HAc的电离度
5,同离子效应使弱电解质的电离度_____;在0.1 mol/L的 HAc 溶液中加入 NaAc 固体后,HAc的电离度会____.
 2000jps121年前1
2000jps121年前1 -
 加菲二代 共回答了19个问题
加菲二代 共回答了19个问题 |采纳率89.5%5,同离子效应使弱电解质的电离度_降低____;在0.1 mol/L的 HAc 溶液中加入 NaAc 固体后,HAc的电离度会__降低__.1年前查看全部
- 什么叫同离子效应和盐效应?他们对弱酸弱碱的解离平衡有何影响?
 dragon92991年前2
dragon92991年前2 -
 lljlq2007 共回答了15个问题
lljlq2007 共回答了15个问题 |采纳率73.3%在弱电解质溶液中加入含有与该弱电解质具有相同离子的强电解质,从而使弱电解质的解离平衡朝着生成弱电解质分子的方向移动,弱电解质的解离度降低的效应称为同离子效应.同理,在电解质饱和溶液中,加入含有与该电解质相同离子的强电解质,也会降低该电解质的溶解度.1年前查看全部
- 什么是沉淀反应同离子效应 急用
 ii2121年前1
ii2121年前1 -
 时代纪语 共回答了22个问题
时代纪语 共回答了22个问题 |采纳率86.4%不是沉淀反应,应该是难溶电解质的溶解平衡中的同离子效应.在一定温度下例如AgCl的溶解平衡中,达到平衡时,再加入NaCl固体,增大了氯离子浓度,使AgCl的溶解平衡向生成AgCl沉淀的方向移动,Ag离子浓度会减小,这就是同离子效应的表现.1年前查看全部
- 同离子效应与缓冲溶液的原理有何异同?
 方试玉01年前2
方试玉01年前2 -
 卡卡1981 共回答了16个问题
卡卡1981 共回答了16个问题 |采纳率93.8%同离子效应和缓冲溶液从原理上来说,道理一样,但是二个又有些不同:
缓冲溶液是同离子效应中的一种特殊情况,因为作为缓冲溶液有个缓冲范围,并且加入的是盐的离子:
比如 C(弱酸)/C(弱酸盐)或者 C(弱碱)/C(弱碱盐)的比值在1/10和10/1之间,否则就起不到缓冲作用了.
而对于同离子效应来说,只要加入相同的离子,就会对弱电解质的平衡产生影响,不会对浓度有什么要求,并且相同的离子除了盐以外,也可以是H+ 或OH-等参与平衡的其他离子.1年前查看全部
- 在氨水溶液中分别加入1.盐酸;2.氯化铵;3.氢氧化钠.电离平衡各向哪个方向移动?其中哪种是同离子效应?
 梦灵儿sheng1年前3
梦灵儿sheng1年前3 -
 枷15锁 共回答了20个问题
枷15锁 共回答了20个问题 |采纳率90%解析:NH3.H2O NH4+ + OH-
1.盐酸; H+ 与OH-发生中和反应,平衡向正放移动.
2.氯化铵是强电解质,全都电离,电离出的NH4+,NH4+,增多,使平衡向逆反应方向移动
3.氢氧化钠全部电离,OH-增多,使平衡向逆反应方向移动.
2,3 是同离子效应.1年前查看全部
- 在BASO4溶液中,加入BaCl2溶液,利用同离子效应使BASO4溶解度降低,体系中C(SO4)的变化是?
在BASO4溶液中,加入BaCl2溶液,利用同离子效应使BASO4溶解度降低,体系中C(SO4)的变化是?
(1大 2小 3不变)请说明原因. 蒋红菊Z1年前1
蒋红菊Z1年前1 -
 有事Q我 共回答了20个问题
有事Q我 共回答了20个问题 |采纳率90%硫酸根浓度减小.因为硫酸钡沉淀,消耗硫酸根,而且加入氯化钡溶液有稀释作用,硫酸根浓度肯定减小.1年前查看全部
- 同离子效应
 cocorainwind1年前1
cocorainwind1年前1 -
 guoguo001 共回答了16个问题
guoguo001 共回答了16个问题 |采纳率75%两种含有相同离子的盐(或酸、碱)溶于水时,它们的溶解度(或酸度系数)都会降低,这种现象叫做同离子效应.1年前查看全部
- 求问:同离子效应对配离子解离平衡的影响
求问:同离子效应对配离子解离平衡的影响
恩,很着急,希望能够在1小时内得到答案. lqh7384_191年前2
lqh7384_191年前2 -
 海之韵88 共回答了22个问题
海之韵88 共回答了22个问题 |采纳率86.4%比如说铵根离子(NH4+),在水中水解会生成氨水和氢离子,如果在含有铵根离子的溶液中加一些稀酸(即氢离子)的话,则会抑制铵根离子的水解.
同理,在纯水中加入稀酸或稀碱的话,都会抑制水的电离.
如果联系化学平衡的左右移动来想的话,会比较好想清楚.1年前查看全部
- 制取氯气第一步是含有杂质得Cl2气体要通入饱和食盐水,为什么要这样做,我知道同离子效应就是不彻底,
 swyd1年前1
swyd1年前1 -
 foolishgirl1983 共回答了15个问题
foolishgirl1983 共回答了15个问题 |采纳率100%Nacl是要吸收cl2中的Hcl,Hcl的溶解度很大,相对于Nacl溶液不饱和,易溶.而cl2则不易溶于Nacl,这样就会去掉混在cl2中的HCl气体了.1年前查看全部
- 1.同离子效应与缓冲溶液的原理有何差异?2.如何压制或促进水解?举例说明下.
 凌乱de幸福1年前1
凌乱de幸福1年前1 -
 avy520530 共回答了14个问题
avy520530 共回答了14个问题 |采纳率85.7%第一题 就以CH3COOH和CH3COONa为例 同离子效应:醋酸电离时生成醋酸根和氢离子,在醋酸溶液中加入了醋酸钠,也就相当于加入了醋酸根离子,是醋酸的电离平衡左移.这就抑制了醋酸的电离,即同离子效应.(这里的同离子是指醋酸根离子).缓冲溶液:溶液中含有醋酸和醋酸钠,当加入氢离子,溶液中的醋酸根离子会与之结合,当加入氢氧根离子,醋酸会与之反应,这就使溶液PH比较稳定.
第二题 将水解反应的离子方程式写出来,加入生成物则会抑制水解,加入与生成物反应的物质就会促进水解.另外,升高温度、降低浓度 会促进水解,反之 就会抑制水解.1年前查看全部
- 根据同离子效应,沉淀剂加入越多,其离子沉淀越完全.这句话对吗?为什么?
 mask10101年前1
mask10101年前1 -
 cbhyi 共回答了30个问题
cbhyi 共回答了30个问题 |采纳率83.3%不对.同离子太多会有盐效应,反而使沉淀溶解.1年前查看全部
- 同离子效应与盐析的区别我想知道在用酸水法提取盐酸小檗碱时,加食盐水的原理是盐析还是同离子效应?加的食盐水的浓度如何选择?
 beibeiy1年前1
beibeiy1年前1 -
 flybird1981 共回答了17个问题
flybird1981 共回答了17个问题 |采纳率88.2%同离子效应 两种含有相同离子的盐(或酸、碱)溶于水时,它们的溶解度(或酸度系数)都会降低,这种现象叫做同离子效应.在弱电解质的溶液中,如果加入含有该弱电解质相同离子的强电解质,就会使该弱电解质的电离度降低...1年前查看全部
- 如题比如 往醋酸溶液中加氯化铁溶液 研究离子浓度变化时是不是应"先看同离子效应,再看反应"
 xxezbe1年前2
xxezbe1年前2 -
 dacy 共回答了13个问题
dacy 共回答了13个问题 |采纳率92.3%我带我们寝室的-麦麦-回答你:(绝非子虚乌有)
同离子效应说弱电解质电离时会受到溶液中已有的,与之“相关”的离子的影响.例如醋酸溶液中溶解进去醋酸钠,因为醋酸钠全部电离而醋酸为弱电解质,醋酸的电离度因为醋酸钠电离出的醋酸根的影响而降低.
就你说的这个问题,我以为,...哪有反应...氯化铁溶液显强酸性,与醋酸混合后,其含有的氢离子会抑制醋酸的电离,降低醋酸的电离度.当然醋酸电离出的氢离子也会相应抑制铁离子的水解(相当于另类的电离)
同离子效应的机理如下:
例如弱电解质HA,电离时有平衡:
HA - H+ + A- (没有可逆反应号姑且以横线代替)
达到平衡后,若加入NaA,因其为离子化合物全部电离,大量A-和Na+加入上述体系.Na+与上述平衡无关,但大量A-的加入大大提高上述平衡过程右侧物质的浓度,从而导致平衡左移,宏观来看就是HA电离度降低.
再直观点就是,醋酸钠溶入醋酸溶液后导致酸性降低.
// 说了太多,楼主还有不懂请Hi我吧1年前查看全部
- 同离子效应是什么 指出谁被氧化,谁是氧化剂,谁是还原剂?ZN+Cucl2---
 龙吟凤舞1年前1
龙吟凤舞1年前1 -
 cg89518 共回答了11个问题
cg89518 共回答了11个问题 |采纳率90.9%Zn + CuCl2-->Cu + ZnCl2
记住"升失氧还" 化合价升高的 失电子 被氧化 是还原剂
Zn在反应中由0价变为+2价 可判断Zn被氧化 是还原剂 同理可得CuCl2是氧化剂
同离子效应有两种,一种是降低弱电解质的电离度;另一种是降低原电解质的溶解度.即,在电解质1的饱和溶液中,加入和电解质1有相同离子的强电解质2,因而降低电解质1的溶解度的效应叫同离子效应.这种效应对于微溶电解质特别显著,在化学分析中应用很广.1年前查看全部
- 溶度积和溶解度的关系,同离子效应的影响
 宋晓波1年前1
宋晓波1年前1 -
 青芒果2202 共回答了14个问题
青芒果2202 共回答了14个问题 |采纳率92.9%两者之间关系是:一般来讲,当电解质的电离度相差不大时溶解度越大其溶度积与弱电解质的离解平衡一样,难溶电解质的溶解平衡也受同离子效应的影响,1年前查看全部
- (大一无机化学)当同离子效应和盐效应同时存在时,优先考虑哪一个?为什么?
 chenhmily3471年前1
chenhmily3471年前1 -
 okeyo 共回答了15个问题
okeyo 共回答了15个问题 |采纳率80%加入具有相同离子的电解质,在产生同离子效应的同时 ,也能产生盐效应.在没有其它化学反应发生的情况下,同离子效应将减小难溶电解质的溶解度,而盐效应将使难溶电解质的溶解度增加. 一般说来,若难溶电解质的溶度积很小时,盐效应的影响很小,可忽略不计;若难溶电解质的溶度积较大时,溶液中各种离子的总浓度也较大时,就应该考虑盐效应的影响.1年前查看全部
- 举例说明,什么是沉淀溶解平衡中的同离子效应?
 2794944141年前2
2794944141年前2 -
 Tracy23 共回答了16个问题
Tracy23 共回答了16个问题 |采纳率81.3%沉淀溶解平衡:适用于溶解度较高的物质的饱和溶液,氯化钠、硫酸钠的饱和溶液中存在沉淀溶解平衡.
同离子效应:两种含有相同离子的盐(或酸、碱)溶于水时,它们的溶解度(或酸度系数)都会降低,这种现象叫做同离子效应.在弱电解质的溶液中,如果加入含有该弱电解质相同离子的强电解质,就会使该弱电解质的电离度降低的效应.同理,在电解质饱和溶液中,加入含有与该电解质相同离子的强电解质,也会降低该电解质的溶解度.
例子:如在醋酸溶液中加入少量固体醋酸钠,可以降低醋酸的电离度;如在氨水中加入氯化铵,可以降低氨的电离度;1年前查看全部
- 化学反应原理 - 同离子效应在弱电解质溶液中加入同弱电解质电离产生相同离子的强电解质,使电离平衡向逆反应方向移动.
 趁蛾1年前1
趁蛾1年前1 -
 poruo 共回答了19个问题
poruo 共回答了19个问题 |采纳率89.5%两种含有相同离子的盐(或酸、碱)溶于水时,它们的溶解度(或酸度系数)都会降低,这种现象叫做同离子效应.在弱电解质的溶液中,如果加入含有该弱电解质相同离子的强电解质,就会使该弱电解质的电离度降低的效应.同理,在电解质饱和溶液中,加入含有与该电解质相同离子的强电解质,也会降低该电解质的溶解度.1年前查看全部
大家在问
- 1A由10个9组成的四位数,B由十个6组成的四位数,a乘b=?【只要过程】
- 2六年级语文下册课文里有什么成语?
- 3三个连续的自然数后面两个数的积与前面两个数的积之差是114,那么这三个数中最小的数是______.
- 4中和反应的本质
- 5有一个公式B=WOR W为一个矩阵 R为一个矩阵 B怎么算?
- 6求英语试题答案!改为被动语态将下列句子改为被动语态1 We call match the language of sci
- 7不仅在于.更因为.比起.宁愿.造句~
- 8长方形周长108厘米长宽各是多少?面积是多少?
- 9终南望余雪是谁写的?
- 10学校把414棵树苗按各班的人数分给六年级三个班.一班和二班分得树苗的棵数比是2:3,二班和三班分得树苗的棵数比是5:7,
- 11语文作文万能句,例:成熟是一种素质,一种源于心灵表于行动的素质;成熟是一种能力,一种自我约束自我管理的能力;成熟是一种态
- 12英语翻译Our life is simply a reflection of our actions.If you wa
- 13麻烦写出下列数列的通项1,3,3,5,5,7,7,9,9,……2,-6,12,-20,30,-42,……3/5,1/2,
- 14已知等比数列{an}的首项为8,Sn是其前n项的和,某同学经计算得S2=20,S3=36,S4=65,后来该同学发现了其
- 15有两堆苹果,如果从甲堆里拿出18%,乙堆拿出1/3,那么甲堆余下的苹果是乙堆余下的2倍,如果从乙堆再拿多出1/5,乙堆就
