还原铁粉 能吸收 水和O2`吗那么 是什么?
 lianglucy2022-10-04 11:39:541条回答
lianglucy2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 杨柳岸杨柳岸 共回答了9个问题
杨柳岸杨柳岸 共回答了9个问题 |采纳率100%- 我猜那就是铁和水与氧气反应,差不多类似于铁碰到水生锈吧.
4Fe+6H2O+3O2-->4Fe(OH)3
2Fe(OH)3-->Fe2O3+3H20
(这题目问的地方有点...) - 1年前
相关推荐
- 利用生产钛白的副产品绿矾(FeSO4•7H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO
 利用生产钛白的副产品绿矾(FeSO4•7H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3•nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉.涉及的主要反应有:
利用生产钛白的副产品绿矾(FeSO4•7H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3•nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉.涉及的主要反应有:
FeCO3
FeO+CO2,C+CO2高温 .
2CO,CO+FeO高温 .
Fe+CO2,高温 .
(1)用稀硫酸代替水溶解绿矾的原因是______.
(2)证明沉淀已经洗涤干净的方法是______.
(3)干燥过程中少量FeCO3•nH2O被氧化为FeOOH,反应方程式为:______.
(4)沉淀中仍含少量硫酸盐,在焙烧过程中需加入CaCO3进行脱硫处理,下图为加CaCO3和不加CaCO3对还原铁粉的产率的影响,根据图象分析,CaCO3的另一作用为______. 歹歹的1年前1
歹歹的1年前1 -
 Redstar1213 共回答了15个问题
Redstar1213 共回答了15个问题 |采纳率86.7%解题思路:(1)硫酸亚铁易水解而使其溶液呈酸性,酸能抑制亚铁离子水解;
(2)FeCO3•nH2O沉淀易吸收硫酸根离子,硫酸根离子能和钡离子反应生成白色沉淀;
(3)FeCO3•nH2O易被氧气氧化为FeOOH,同时生成二氧化碳和水;
(4)高温下,碳酸钙分解生成二氧化碳,二氧化碳能被碳还原生成一氧化碳.(1)硫酸亚铁是强酸弱碱盐,易水解而使其溶液呈酸性,向溶液中加入酸能抑制亚铁离子水解,所以用稀硫酸代替水溶解绿矾,
故答案为:抑制Fe2+水解;
(2)FeCO3•nH2O沉淀易吸收硫酸根离子,硫酸根离子能和钡离子反应生成白色沉淀,如果沉淀已经洗涤干净,则其洗涤液中不含硫酸根离子,其检验方法是:取少量最后一次洗涤液于试管,滴入BaCl2溶液,若无白色沉淀产生,表明沉淀已洗涤干净,
故答案为:取少量最后一次洗涤液于试管,滴入BaCl2溶液,若无白色沉淀产生,表明沉淀已洗涤干净;
(3)FeCO3•nH2O易被氧气氧化为FeOOH,同时生成二氧化碳和水,反应方程式为:4FeCO3•nH2O+O2=4FeOOH+4CO2↑+(4n-2)H2O,
故答案为:4FeCO3•nH2O+O2=4FeOOH+4CO2↑+(4n-2)H2O;
(4)高温下,碳酸钙分解生成二氧化碳,二氧化碳能被碳还原生成一氧化碳,所以加入碳酸钙能增加一氧化碳的含量,则还原铁粉的产率增大,
故答案为:分解产生CO2与C反应生成还原剂CO.点评:
本题考点: 制备实验方案的设计;盐类水解的应用;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查了实验方案的设计,明确物质的性质是解本题关键,会根据图象进行分析解答,难度中等.1年前查看全部
- 将3.96g组成为X 2 YZ 4 的盐(不是复盐)溶于水,滴加适量稀硫酸后再加入2.24g还原铁粉,恰好完全反应生成F
将3.96g组成为X 2 YZ 4 的盐(不是复盐)溶于水,滴加适量稀硫酸后再加入2.24g还原铁粉,恰好完全反应生成Fe 2+ 。向反应后的溶液中加入足量的KOH溶液至刚好将Fe 2+ 完全沉淀;将沉淀过滤、洗涤并充分加热后得到红棕色固体4.80g;将滤液在一定条件下蒸发可得到一种纯净的不含结晶水的含氧酸盐(不是复盐)13.92g。
(1)红棕色固体的化学式为______________,含氧酸盐的化学式为______________。
(2)组成为X 2 YZ 4 的盐中是否含有铁元素和钾元素?通过计算说明。
(3)推断X 2 YZ 4 的盐的化学式,写出推断过程。 jianlovemeng1年前0
jianlovemeng1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在补铁的药品中,常含有少量极细的还原铁粉,可与胃液中的盐酸反应,使其吸收,起到补铁的作用,请用化学方程式表达这一反应过程
 wancheng88991年前2
wancheng88991年前2 -
 阳光一屡 共回答了20个问题
阳光一屡 共回答了20个问题 |采纳率90%Fe+2HCl=FeCl2+H21年前查看全部
- 还原铁粉和铁粉有什么区别,为什么是红色的,为什么铁和水蒸气反应要用它
 eforces1年前1
eforces1年前1 -
 f2g1 共回答了19个问题
f2g1 共回答了19个问题 |采纳率89.5%用一氧化碳还原纯磁铁矿(Fe3O4)或用氢气还原轧钢时产生的氧化铁粉.用这2种方法生产出的单质铁粉称作“还原铁粉”;由于具有很好的也隙度和海绵状微观结构,因此也称作“海绵铁粉”.
用氢气还原的单质铁粉内部结构中的微孔,比用一氧化碳还原的单质铁粉内部结构中的微也还要细小,因而其生扔利用变幻无常(即被人体吸收率)理高.添入食品后,这2种单质铁粉的微也中可充满油,能够自我泣滑.这2种单质铁粉的微也扩大了单质铁粉颗粒的表面积,加速其在PH值较低的胃中溶解的速度.
换句话说,还原铁粉是非常疏松的铁粉1年前查看全部
- 绿矾(FeSO4•7H2O)的一种综合利用其工艺流程如图(主要是生产还原铁粉):
绿矾(FeSO4•7H2O)的一种综合利用其工艺流程如图(主要是生产还原铁粉):

(1)绿矾溶解成______溶液,溶液中存在的阳离子是______.
(2)隔绝空气进行“焙烧”,FeCO3会分解生成氧化亚铁和二氧化碳,焙烧过程中作为还原剂的是一氧化碳.
①产生还原剂一氧化碳的反应化学方程式是C+CO2
2CO高温 .C+CO2.
2CO高温 .
②产生铁粉的反应化学方程式是FeO+CO
Fe+CO2△ .FeO+CO.
Fe+CO2△ . 江水悠悠1年前1
江水悠悠1年前1 -
 hunter1996 共回答了21个问题
hunter1996 共回答了21个问题 |采纳率90.5%解题思路:(1)根据绿矾溶于水后形成的溶液中的溶质和阳离子的定义考虑;(2)①根据FeCO3分解的生成物与煤粉反应来考虑;②根据方程式的书写考虑.(1)绿矾溶于水后溶质是硫酸亚铁,所以形成的溶液是硫酸亚铁溶液,带正电荷的是阳离子,所以溶液中存在的阳离子是Fe2+;
(2)①由于FeCO3分解的生成物有氧化亚铁和二氧化碳,又放入了煤粉,所以生成一氧化碳的反应物是碳和二氧化碳,生成物是一氧化碳,用观察法配平,反应条件是高温;
②产生铁粉的反应物是一氧化碳和氧化亚铁,生成物是铁和二氧化碳,反应条件是加热写在等号的上边.
故答案为:(1)硫酸亚铁;Fe2+;(2)①C+CO2
高温
.
2CO;②FeO+CO
△
.
Fe+CO2.点评:
本题考点: 物质的相互转化和制备;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题要注意方程式的写法:一写二配三注明四等号,要分清反应条件中的高温和加热.1年前查看全部
- 还原铁粉加水会产生氢气吗?多少铁粉与多少水,会产生多少氢气,师傅请指教
 8550511年前1
8550511年前1 -
 qqq3100708 共回答了13个问题
qqq3100708 共回答了13个问题 |采纳率100%可以产生氢气,另外还有四氧化三铁
方程式如下:
3Fe + 4H2O = Fe3O4 + 4H2
其中条件是高温1年前查看全部
- 亚铁离子的检验中学课本中有一个实验:在试管里加入5mLFeCl3溶液,加入几滴稀盐酸和适量还原铁粉,振荡一会儿,滴入几滴
亚铁离子的检验
中学课本中有一个实验:在试管里加入5mLFeCl3溶液,加入几滴稀盐酸和适量还原铁粉,振荡一会儿,滴入几滴滴入几滴KSCN溶液.观察发生的现象.
在此试验中,为什么加入稀盐酸,不加也能够检验亚铁离子吧 ljty11281年前1
ljty11281年前1 -
 apple199919 共回答了17个问题
apple199919 共回答了17个问题 |采纳率100%几滴稀盐酸是要抑制3价铁离子的水解(大约在PH=4左右3价铁就全变氢氧化铁了,影响实验).事实证明,不加酸实验现象不明显.当然,对铁的归中来说,H+没什么影响.1年前查看全部
- 还原铁粉和雾化铁粉的区别是什么?
 hdxzhyg1年前3
hdxzhyg1年前3 -
 kangdongrong 共回答了23个问题
kangdongrong 共回答了23个问题 |采纳率78.3%还原铁粉有两个意义:一是从还原氧化铁(如轧钢铁皮)而来的;二是说可作还原剂用的,如化学工业常用作还原剂.雾化铁粉是熔融铁或铁合金用高压水雾化生产的,是铁粉的新品种,由于生产过程中没有混进杂质,相对纯净,而且雾化法产生的球形颗粒,符合最紧密堆积原理,是压制机械零件的最好原料,因此,相对价格较高.1年前查看全部
- 铁粉与水反应吗通常,铁与水蒸气反应生成铁的氧化物和氢气.但是在还原铁粉与冷水,温水反应吗?
 豆子的挪挪1年前3
豆子的挪挪1年前3 -
 hiide 共回答了13个问题
hiide 共回答了13个问题 |采纳率84.6%Fe与高温水蒸气能较快反应,生成Fe3O4和H2,3Fe + 4H2O =高温= Fe3O4 + 4H2
Fe与冷水、热水均不能反应生成H2
Fe在潮湿的空气中,即与水和空气,会较快的腐蚀生锈,生成Fe2O3.xH2O1年前查看全部
- 为什么在硬质试管中加入还原铁粉和石棉绒的混合物,还有中间的圆试管里是什么?
 倾倾小月1年前3
倾倾小月1年前3 -
 demtrioli 共回答了20个问题
demtrioli 共回答了20个问题 |采纳率100%你说的是中间球型容器内的东西吧?是干燥剂,否则气体收集试管里全是水滴.1年前查看全部
- 食品袋内脱氧剂的活性成分是还原铁粉,它是一种黑色粉末,失效后变为红褐色,检验脱氧剂是否完全失效的化学方法是?
 晴天娃娃00001年前1
晴天娃娃00001年前1 -
 薇珊 共回答了23个问题
薇珊 共回答了23个问题 |采纳率87%其实是检验是否还有Fe单质只需加入NaOH看是否有气体产生.就OK了
避免意外的话可加上:收集产生的气体到集气瓶中,将带火星的小木条伸入到集气瓶中看是否复燃,若复燃则证明还未完全失效,反之则已完全失效.1年前查看全部
- 在高温下,铁与水蒸气可发生反应.应用装置在硬质玻璃管中放入还原铁粉和而棉绒的混合物加热并通入水蒸气就可以完成高温下铁与水
在高温下,铁与水蒸气可发生反应.应用装置在硬质玻璃管中放入还原铁粉和而棉绒的混合物加热并通入水蒸气就可以完成高温下铁与水蒸气反应 该实验方程式怎么写?
 玩玩kk1年前1
玩玩kk1年前1 -
 asddads31 共回答了17个问题
asddads31 共回答了17个问题 |采纳率82.4%Fe+H2O(g)=Fe OH 3 手机打的.不太清晰g是指水蒸气1年前查看全部
- (2012•增城市一模)绿矾(FeSO4•7H2O)的一种综合利用其工艺流程如下(主要是生产还原铁粉):
(2012•增城市一模)绿矾(FeSO4•7H2O)的一种综合利用其工艺流程如下(主要是生产还原铁粉):

(1)工艺流程中“分离”常用的操作是______.
(2)绿矾溶解成浅绿色溶液,溶液中存在的阳离子是______.
(3)隔绝空气进行“焙烧”,FeCO3会分解生成氧化亚铁和二氧化碳,焙烧过程中作为还原剂的是一氧化碳.
①产生还原剂一氧化碳的反应化学方程式是CO2+C
2CO高温 .CO2+C.
2CO高温 .
②产生铁粉的反应化学方程式是FeO+CO
Fe+CO2高温 .FeO+CO.
Fe+CO2高温 .
(4)116g FeCO3含有铁元素的质量是______g. 矛盾共同体1年前1
矛盾共同体1年前1 -
 vv_smile 共回答了17个问题
vv_smile 共回答了17个问题 |采纳率94.1%解题思路:(1)分离固体和液体常用过滤的方法,可以据此解答该题;
(2)根据绿矾溶于水后形成的溶液中的溶质和阳离子的定义考虑,可以据此解答该题;
(3)①根据FeCO3分解的生成物与煤粉反应来考虑;
②根据方程式的书写考虑.
(4)根据化合物中元素的质量分数的计算公式进行解答.(1)分离固体和液体常用过滤的方法;
(2)绿矾溶于水后溶质是硫酸亚铁,所以形成的溶液是硫酸亚铁溶液,带正电荷的是阳离子,所以溶液中存在的阳离子是Fe2+;
(3)①由于FeCO3分解的生成物有氧化亚铁和二氧化碳,放入煤粉之后发生的反应为碳和二氧化碳,生成物是一氧化碳,该反应的化学方程式为:CO2+C
高温
.
2CO;
②产生铁粉的反应物是一氧化碳和氧化亚铁,生成物是铁和二氧化碳,反应条件是加热,该反应的化学方程式为:FeO+CO
高温
.
Fe+CO2;
(4)116g FeCO3含有铁元素的质量为:116g×[56/56+12+16×3]×100%=56g.
故答案为:(1)过滤;
(2)亚铁离子(Fe2+);
(3)①CO2+C
高温
.
2CO;
②FeO+CO
高温
.
Fe+CO2;
(4)56.点评:
本题考点: 物质的相互转化和制备.
考点点评: 解答本题要注意方程式的写法:一写二配三注明四等号,要分清反应条件中的高温和加热.1年前查看全部
- 铁与水蒸气的实验探究活动过程中,要求设计一套简单的实验装置使还原铁粉与水蒸气反应,装置包括水蒸气发生器、水蒸气与铁粉的反
铁与水蒸气的实验探究活动过程中,要求设计一套简单的实验装置使还原铁粉与水蒸气反应,装置包括水蒸气发生器、水蒸气与铁粉的反应、检验产生的气体.一位同学设计了如下实验装置(图3.1—1,省略铁架台),同样能达到实验探究的目的.(D中药品为黑色的氧化铜,E中药品为无水硫酸铜)
请你仔细分析此装置,你能理解这位同学的设计用意吗?试一试下列问题:
(Ⅰ)除D装置外,实验中还必须对哪部分装置提供加热热源?
(Ⅱ)水蒸气的发生装置为 ;还原铁粉与水蒸气反应装置为 ;(选填A、B、C、D);C装置应该加入的实验药品是 ,
(Ⅲ)此实验是通过怎样的实验现象来检验产生的气体的?实验中能否将C装置撤销呢?
(Ⅳ)写出整个实验中涉及到的化学反应的方程式:

 askfish1年前4
askfish1年前4 -
 serti 共回答了18个问题
serti 共回答了18个问题 |采纳率83.3%(1) 对B处.因为B处是水蒸气发生装置,里面装的是水.
(2)B,
A,
浓硫酸(作用为干燥剩余水蒸气,为之后的检验氢气提供条件,因为要证明生成氢气,经过灼热氧化铜时必须是纯氢气,这样才能根据最后无水硫酸铜验出有水,从而推出前面有氢气,而之前的水蒸气会产生干扰)
(3)通过无水硫酸铜变蓝检验气体的
不能,之前的水蒸气会对之后的检验产生干扰.
(4) 3Fe + 4H20 =加热= Fe3O4 + 4H2↑
CuO + H2 =加热= Cu + H2O
CuSO4+5H2O= CuSO4?5H2O1年前查看全部
- 关于区分还原铁粉和活性炭的问题下列药品中不能区分还原铁粉与活性炭粉的是A.稀硫酸 B蒸馏水C 稀盐酸 D氧气sorry
关于区分还原铁粉和活性炭的问题
下列药品中不能区分还原铁粉与活性炭粉的是
A.稀硫酸 B蒸馏水
C 稀盐酸 D氧气
sorry ,
C选项是硫酸铜 hexo1年前4
hexo1年前4 -
 SUSUSU2 共回答了20个问题
SUSUSU2 共回答了20个问题 |采纳率95%A、取少量待测物,加入稀硫酸,溶解并产生气泡的是还原铁粉,无现象的是活性炭粉.所以A能区分.
B、取少量待测物,加入蒸馏水,两者都无现象.所以B不能区分.
C、取少量待测物,加入硫酸铜溶液,溶解并出现红色物质的是还原铁粉,无现象的是活性炭粉.所以C能区分.
D、取少量待测物,在氧气中点燃,出现黑色固体的是还原铁粉,固体全部消失的是活性炭粉.所以D能区分.
故答案为B.1年前查看全部
- 向还原铁粉中加入炭粉的作用是什么?
 gg没有脑子1年前4
gg没有脑子1年前4 -
 goobytang 共回答了20个问题
goobytang 共回答了20个问题 |采纳率90%你讲得应该是化学腐蚀的部分吧.还原铁粉中加入炭粉的目的是让铁和炭粉构成原电池的负极和正极从而加快反应速率.炭粉的作用是成为原电池的正极,加快反应速率.1年前查看全部
- (2011•扬州)粗还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
(2011•扬州)粗还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
[物质制备]利用绿矾制备精还原铁粉的工艺流程如下:
粗还原铁粉中还含有少量铁的氧化物和Fe3C,可用氢气在高温下进一步还原,其反应方程式为:FexOY+yH2
xFe+yH2O Fe3C+2H2高温 .
3Fe+CH4高温 .
(1)写出焙烧中氧化铁与CO反应的化学方程式Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO.
2Fe+3CO2高温 .
(2)焙烧中加焦炭的作用除了可以生成CO外,还能______.
[含量测定]为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行试验,已知 3CH4+4Fe2O3
3CO2+6H2O+8Fe高温 .
(假设每步反应都完全且不考虑装置内原来有空气对测定结果的影响).
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灯A、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量.
操作的先后顺序是①③______⑤⑥⑦(填序号);
(4)步骤③的目的是______,验证该步骤目的达到的实验方法是______;步骤⑥的目的是______
(5)若装置D、E分别增重mg和ng,则m与n的关系为______
A.11m=9nB.11m<9nC.11m>9n
若缺少装置D,则所测氧元素的质量分数将______(填“偏大”、“偏小”或“等于”.下同).碳元素的质量分数将______.
(6)粗还原铁粉样品的质量为10.000g,装置B,E分别增重0.180g和0.220g.计算样品中氧和碳元素的质量分数(要求计算过程). 我爱深圳uu1年前1
我爱深圳uu1年前1 -
 chaijin79 共回答了14个问题
chaijin79 共回答了14个问题 |采纳率64.3%解题思路:(1)CO具有还原性,能与氧化铁反应而使氧化铁还原成铁,同时放出二氧化碳;
(2)焦炭燃烧放出大量的热,该热量可维持其它反应的发生;
(3)装置A在加热时发生反应,生成的水与甲烷通过装置B处理后进入装置C,进入该装置的气体在加热条件下发生反应;
(4)步骤③的目的是 除去装置内的氧气,防止发生爆炸,验证该步骤目的达到的实验方法是收集尾气靠近燃着的酒精灯,听声音;步骤⑥的目的是 防止生成的还原铁粉再次被氧化,起保护作用
(5)若装置D、E分别增重mg和ng,当只有甲烷参与反应时可以求出二氧化碳和水的质量比为9:11,可求m与n的关系
若缺少装置D,氧元素的测定时取决于B装置的吸收,所以是不会影响的(后面与氧化铁的反应物是甲烷气体反应造成的,所以二氧化碳中的氧元素不会影响到).碳元素的质量分数是通过吸收二氧化碳,也可以说通过E装置的质量增加来实现,当D不存在时,导致部分水被E吸收,而被误当成二氧化碳进行计算,导致碳元素质量增加,进而使含碳量偏大.
(6)装置B中浓硫酸吸收氢气与粗还原铁粉反应生成的水,由该装置增重为反应生成水的质量可求得粗还原铁粉中氧元素质量;装置E中碱石灰吸收甲烷与氧化铁反应产生的二氧化碳,由该装置增重为反应生成二氧化碳的质量可计算出粗还原铁粉中所含碳元素质量.(1)氧化铁在高温条件下能与CO发生反应生成铁与二氧化碳,反应的化学方程式为Fe2O3+3CO
高温
.
2Fe+3CO2;
(2)焦炭燃烧放出大量的热,产生的热量使装置内其它反应得以发生;
(3)根据题目中的假设情况,为使装置A反应产生的甲烷气体全部在装置C中发生反应,操作时应先将C处酒精灯点燃,然后再点燃A处酒精处;
(4)步骤③的目的是 除去装置内的氧气,防止发生爆炸,验证该步骤目的达到的实验方法是收集尾气靠近燃着的酒精灯,听声音;有剩余则没有完全被除掉;步骤⑥的目的是 防止生成的还原铁粉再次被氧化,起保护作用
(5)若装置D、E分别增重mg和ng,当只有甲烷参与反应时可以求出二氧化碳和水的质量比为9:11,可求m与n的关系.
3CH4+4Fe2O3
△
.
8Fe+3CO2+6H2O
3×44 6×18
n m
[3×44/6×18]=[n/m] [n/m]=[11/9]
由于是加热C在前,所以导致会先生成水,导致水的质量多,所以是9n<11m,所以选C.
若缺少装置D,氧元素的测定时取决于B装置的吸收,所以是不会影响的(后面与氧化铁的反应物是甲烷气体反应造成的,所以二氧化碳中的氧元素不会影响到).碳元素的质量分数是通过吸收二氧化碳,也可以说通过E装置的质量增加来实现,当D不存在时,导致部分水被E吸收,而被误当成二氧化碳进行计算,导致碳元素质量增加,进而使含碳量偏大.
(6)装置B增重0.180g,则粗还原铁粉与氢气反应生成水的质量为0.180g,生成水中氧元素质量=0.180g×[16/18]×100%=0.160g;
样品中氧元素的质量分数=[0.160g/10.000g]×100%=1.6%
装置E增重0.220g,则甲烷与氧化铁反应生成二氧化碳的质量为0.220g,生成二氧化碳中碳元素质量=0.220g×[12/44]×100%=0.060g;
样品中碳元素的质量分数=[0.060g/10.000g]×100%=0.6%
答:样品中氧和碳元素的质量分数分别为1.6%、0.6%.
故答案为:
(1)Fe2O3+3CO
高温
.
2Fe+3CO2;
(2)提供热量;
(3)④②;
(4)除去装置内的氧气,防止发生爆炸; 收集尾气靠近燃着的酒精灯,听声音;防止生成的还原铁粉再次被氧化,起保护作用
(5)C;等于;偏大;
(6)装置B增重0.180g,则粗还原铁粉与氢气反应生成水的质量为0.180g,生成水中氧元素质量=0.180g×[16/18]×100%=0.160g;
样品中氧元素的质量分数=[0.160g/10.000g]×100%=1.6%
装置E增重0.220g,则甲烷与氧化铁反应生成二氧化碳的质量为0.220g,生成二氧化碳中碳元素质量=0.220g×[12/44]×100%=0.060g;
样品中碳元素的质量分数=[0.060g/10.000g]×100%=0.6%
答:样品中氧和碳元素的质量分数分别为1.6%、0.6%.点评:
本题考点: 一氧化碳还原氧化铁;实验探究物质的组成成分以及含量;实验数据处理或者误差分析的探究;物质的相互转化和制备;元素的质量分数计算.
考点点评: 通过对铁冶炼原理的知识迁移,理解该题的实验过程及目的,考查了知识的运用及实验分析的能力.1年前查看全部
- 如何加快还原铁粉和盐酸反应?
 比得番1年前1
比得番1年前1 -
 hsg0005 共回答了10个问题
hsg0005 共回答了10个问题 |采纳率70%加热肯定是不行的
盐酸会挥发
你可以保持铁粉散落在盐酸里 而不是堆积在盐酸里 因为这样可以增加反应面积或者你在盐酸中加一些浓醋酸 这样也可以增加反应速率1年前查看全部
- 食用含有还原铁粉的补血麦片食用后能补铁,人体为什么能吸收铁?
 我就叫嘎嘎1年前1
我就叫嘎嘎1年前1 -
 dwq_yz 共回答了30个问题
dwq_yz 共回答了30个问题 |采纳率90%因为人是考胃消化的!胃在消化食物时会产生胃酸,胃酸会和铁发生化学反应!所以人体吸收的不是生铁,而是铁的氧化物!所以在食用这种补品时,最好多吃酸性食物,水果和醋都行!1年前查看全部
- 三氧化二铁还原铁粉的方法有哪些急 方法越多越好!
 毫不保留1年前1
毫不保留1年前1 -
 SAMJD 共回答了18个问题
SAMJD 共回答了18个问题 |采纳率100%你说的 应该是Fe2O3被还原成Fe的方法吧
常用的 用H2 CO C Al还原 或者电解Fe2O3
如果还有疑问 百度HI找我 详谈1年前查看全部
- 还原铁粉.灰色或黑色粉末,又称"双吸剂",能够吸收空气中的水分和氧气,常用于食品
还原铁粉.灰色或黑色粉末,又称"双吸剂",能够吸收空气中的水分和氧气,常用于食品
保鲜.检验使用一段时间后的“双吸剂”是否仍有效的物理方法为?
 kissrose74241年前1
kissrose74241年前1 -
 barbaric2003 共回答了19个问题
barbaric2003 共回答了19个问题 |采纳率78.9%磁铁吸一吸……吸不上来就证明快用光了.
因为铁在空气中的氧化产物应该没有磁性.1年前查看全部
- 还原铁粉在胃酸作用下转化成亚铁盐.此反映锝离子方程式为?
 dk20041年前1
dk20041年前1 -
 shuiemg 共回答了22个问题
shuiemg 共回答了22个问题 |采纳率95.5%胃酸中含有稀盐酸,反应的离子方程式:
Fe + 2H+ ==== Fe2+ + H2↑1年前查看全部
- 还原铁粉的分析方法及滴定度的标定?麻烦大家进来帮帮忙,请尽量详细!O(∩_∩)O谢谢
 san4600121年前1
san4600121年前1 -
 germania 共回答了14个问题
germania 共回答了14个问题 |采纳率92.9%就是全铁分析重铬酸钾滴定的准确性,减少误差 还原剂的用量要合适,还原后还原剂要能除净,以免消耗重铬酸钾.操作时要控制摇晃的程度,使试剂迅速1年前查看全部
- 分析下列信息,按要求填空: 图象 铁丝 还原铁粉 成分 Fe Fe 颜色 银白色 灰色或灰黑色 聚集状态 丝状 粉末 相
分析下列信息,按要求填空:
图象 铁丝 
还原铁粉 
成分 Fe Fe 颜色 银白色 灰色或灰黑色 聚集状态 丝状 粉末 相同质量时表面积
{氧气存在形式、反应产物、反应条件化学方程式比较铁丝和还原铁粉
(各写出一点即可)较小
纯氧、四氧化三铁、点燃条件下
①______________________。非常大
空气中氧气、氧化铁(Fe 2 O 3 )、通常情况下
②______________________。③相同点:____________________________________________。
④不同点:____________________________________________。结论 ⑤____________________________________________。  pbj021年前1
pbj021年前1 -
 annm1981 共回答了17个问题
annm1981 共回答了17个问题 |采纳率82.4%
图象
铁丝
还原铁粉
成分
Fe
Fe
颜色
银白色
灰色或灰黑色
聚集状态
丝状
粉末
相同质量时表面积
{氧气存在形式、反应产物、反应条件化学方程式比较铁丝和还原铁粉
(各写出一点即可)
较小
纯氧、四氧化三铁、点燃条件下
①3Fe+2O 2 Fe 3 O 4
Fe 3 O 4
非常大
空气中氧气、氧化铁(Fe 2 O 3 )、通常情况下
②4Fe+3O 2 ═2Fe 2 O 3
③都含铁元素
④聚集状态不一样(或物理性质、化学性质存在差异等)
结论
⑤同一种物质,因聚集状态不同,可能导致其物理性质、化学性质产生差异(也可具体描述:如颜色可能不一样,性质也可能不同等)
铁在氧气中燃烧生成四氧化三铁,在空气中与氧气反应生成氧化铁,方程式分别是3Fe+2O 2 Fe 3 O 4 、4Fe+3O 2 ═2Fe 2 O 3 ,铁丝和铁粉均由铁
1年前查看全部
Fe 3 O 4 、4Fe+3O 2 ═2Fe 2 O 3 ,铁丝和铁粉均由铁
1年前查看全部
- 如何用还原铁粉(Fe)制取三氧化二铁Fe2O3 元素
 jacquiwz1年前3
jacquiwz1年前3 -
 lxjordan23 共回答了18个问题
lxjordan23 共回答了18个问题 |采纳率77.8%还原铁粉暴露在空气中,过一段时间就氧化了呗!1年前查看全部
- 高温下,铁与水蒸气反应的实验中.还原铁粉是什么?是不是就是铁?反应之后,试管中物质还是黑色,是不是铁已经变成了Fe3o4
高温下,铁与水蒸气反应的实验中.还原铁粉是什么?是不是就是铁?反应之后,试管中物质还是黑色,是不是铁已经变成了Fe3o4?
 善良的匪1年前2
善良的匪1年前2 -
 babagol 共回答了15个问题
babagol 共回答了15个问题 |采纳率80%还原铁粉就是一种很细的铁粉,性状是黑色,与水蒸气反应产生四氧化三铁和氢气,能否完全反应要看反应物比例和反应时间,但肯定产生了四氧化三铁.1年前查看全部
- 食品包装袋中装入还原铁粉,作用是
 闲蛋扯淡1年前5
闲蛋扯淡1年前5 -
 寒佛 共回答了11个问题
寒佛 共回答了11个问题 |采纳率100%相当于干燥剂,去氧去湿1年前查看全部
- (2013•永州)“暖宝宝”已成为寒冬季节中小学生取暖的最爱.“暖宝宝”的主要化学成分为:还原铁粉(Fe)、活性炭(C)
(2013•永州)“暖宝宝”已成为寒冬季节中小学生取暖的最爱.“暖宝宝”的主要化学成分为:还原铁粉(Fe)、活性炭(C)、食盐(NaCl)、水(H2O)、氧气(O2)和蛭石,发热原理主要是利用铁氧化反应放出热量来发热.其中涉及的反应方程式有:
①2Fe+O2+2H2O=2Fe(OH)2↓
②4Fe(OH)2+O2+2H2O=xFe(OH)3
③2Fe(OH)3=Fe2O3+3H2O
请问:
(1)上述反应中的x=______.
(2)暖宝宝”中铁元素最终以化合物形式存在,其化学式为______. dd路上的摇滚1年前1
dd路上的摇滚1年前1 -
 igeo4c 共回答了15个问题
igeo4c 共回答了15个问题 |采纳率93.3%解题思路:(1)根据质量守恒定律中化学反应前后原子的种类和个数都不变分析;
(2)根据反应原理中铁最终的产物分析.(1)在4Fe(OH)2+O2+2H2O=xFe(OH)3中反应前铁、氧、氢的原子个数分别为4、12、12,反应后铁、氧、氢原子的个数分别为1、3、3,因此Fe(OH)3的化学计量数是4;
(2)根据三个反应原理,铁最终转化为氧化铁,化学式为Fe2O3;
故答案为:(1)4;(2)Fe2O3.点评:
本题考点: 化学方程式的配平;物质的相互转化和制备;化学式的书写及意义.
考点点评: 本题考查了质量守恒定律的运用及根据信息解决问题的知识,难度不大,能够考查学生的知识运用能力和阅读信息的能力.1年前查看全部
- 写出下列反应的化学方程式:(1)市场上出售的补血麦片含微量颗粒细小的还原铁粉,铁粉与人体胃液中的盐酸反应生成一种铁的化合
写出下列反应的化学方程式:
(1)市场上出售的补血麦片含微量颗粒细小的还原铁粉,铁粉与人体胃液中的盐酸反应生成一种铁的化合物,起到补血的作用,写出其化学方程式______,属于______反应(化学反应基本类型)
(2)NO是大气污染物之一,目前一种治理方法是在400℃左右,有催化剂存在的条件下,用氨气把NO还原为氮气和水______. 高哲1年前1
高哲1年前1 -
 预约分手 共回答了13个问题
预约分手 共回答了13个问题 |采纳率100%(1)铁和稀盐酸反应生成氯化亚铁和氢气,方程式为Fe+2HCl═FeCl 2 +H 2 ↑ 该反应中反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,是置换反应;
(2)根据信息氨气把NO还原为氮气和水,化学方程式为:4NH 3 +6NO
催化剂
.
高温高压 5N 2 +6H 2 O
故答案为:(1)Fe+2HCl═FeCl 2 +H 2 ↑置换反应
(2)4NH 3 +6NO
催化剂
.
高温高压 5N 2 +6H 2 O1年前查看全部
- 人体为什么能吸收铁?市场上出售的“补铁麦片”中常含有微量细小的还原铁粉,食用后能起到补铁的作用,为什么?
 路文龙01年前2
路文龙01年前2 -
 撒迦or加隆 共回答了19个问题
撒迦or加隆 共回答了19个问题 |采纳率84.2%铁粉和胃中盐酸反应成可溶性2价铁盐被人体吸收
不过这个补法..跟吃铁钉差不多阿1年前查看全部
- 已知分子式为C10H14的有机物,不能使溴水褪色,但可使酸性高锰酸钾褪色.它与液溴在还原铁粉的作用下反应,生成的一溴代物
已知分子式为C10H14的有机物,不能使溴水褪色,但可使酸性高锰酸钾褪色.它与液溴在还原铁粉的作用下反应,生成的一溴代物有12种结构,则此烷烃基的结构有多少种?
 xujun19831年前1
xujun19831年前1 -
 doglijian 共回答了21个问题
doglijian 共回答了21个问题 |采纳率81%个人认为此题不正确,请楼主看
分析:
由“不能使溴水褪色”可知不是烯烃或炔烃
由“但可使酸性高锰酸钾褪色”可知含有不饱和键
由“它与液溴在还原铁粉的作用下反应”可知含有苯环
因此是苯的同系物(而且直接连在苯环上的碳至少有一个是含氢的,不然高锰酸
钾不会褪色)
C10H14不饱和度为4,说明除了苯环中有不饱和键,链上并没有不饱和键.链上共
4个碳
由“生成的一溴代物有12种结构”确定它的结构,这时会发现溴和铁粉的条件,只能取代苯环上的碳,就算剩下的4个碳都在一条支链上,那也只有5个苯环剩下的碳可以取代,不会有12种情况的
若还有问题,欢迎追问哦1年前查看全部
- (16分)某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和
(16分)某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).

(1)如何检查该装置的气密性:
(2)写出铁与水蒸气反应的化学方程式
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO 4 、3mol/L H 2 SO 4 、3mol/L HNO 3 、30%H 2 O 2 、0.01mol/L KMnO 4 、20%KSCN、蒸馏水。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
步骤1中加入足量1mol/L CuSO 4 溶液的作用是 。实验步骤 预期现象与结论 步骤1 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO 4 溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的 ,振荡溶解,过滤后将滤液配成250mL溶液,待用。 步骤2 取少量步骤1中滤液于试管中,
步骤3 取少量步骤1中滤液于试管中,
(4)固体产物中铁元素的质量分数的测定可采用下图的流程
其中步骤①是向溶液中加入锌粉至黄色刚好消失;步骤②用0.010 mol/LKMnO 4 溶液滴定至终点,消耗KMnO 4 溶液平均为v mL。(已知5Fe 2 + +MnO 4 - +8H + ==5Fe 3 + +Mn 2 + +4H 2 O)
其中加入锌粉的目的是____ ____。
实验测得ag样品中固体产物铁元素的质量分数为____ __ _(只列计算表达式)。 小妖UU1年前1
小妖UU1年前1 -
 95272004b 共回答了20个问题
95272004b 共回答了20个问题 |采纳率95%1年前查看全部
- 小梅从妈妈买的五洲牛肉干的包装袋中发现了一个小纸袋,上面注明“除氧保鲜剂,成分:还原铁粉”.小梅想知道为什么还原铁粉能保
小梅从妈妈买的五洲牛肉干的包装袋中发现了一个小纸袋,上面注明“除氧保鲜剂,成分:还原铁粉”.小梅想知道为什么还原铁粉能保鲜呢?他查阅了资料:除氧保鲜剂是一种利用水和盐为触媒,铁和氧发生的化学反应,能强效地吸收食品包装袋中的氧气使各类食品不易发霉,保持食品的原有风味、新鲜度及营养成分不变,化学反应为:4Fe+3O2+6H2O=4Fe(OH)3,Fe(OH)3不稳定,可发生缓慢反应:Fe(OH)3=Fe2O3+3H2O,加热分解更为迅速.小梅打开纸袋发现黑色粉末中有一些褐色的粉末他取了几份样品,开始了实验.
(1)小梅想知道这包“除氧保鲜剂”是否完全变质而失效,他用了一种化学方法是( )
(2)小梅用( )的方法将褐色粉末分离出来.褐色粉末是什么呢?他作出了猜想:(A)全部是 Fe(OH)3 ; (B)( ) ; (C)( ) .
(3)小梅取少量褐色粉末用天平称量后放于试管中,充分加热后取出烘干再次称量,发现质量减少了,于是他立刻排除了假设( ).
(4)请你设计实验证明此褐色粉末中含有铁元素:( ).
(5)你还能设计实验证明某物质中含有某元素吗(每说一种全对可加2分,最多可加4分)
你选取的物质是( ),方法是( ),说明含( )元素.
你选取的物质是( ),方法是( ),说明含( )元素. 没有蝉鸣的冬天1年前1
没有蝉鸣的冬天1年前1 -
 袁浩在工作 共回答了16个问题
袁浩在工作 共回答了16个问题 |采纳率81.3%(1)取少量样品加入盐酸,若有无色气泡产生,证明没有完全变质;反之完全变质
(2)吸铁石吸附铁粉 (B)全部是Fe2O3 (C)既有Fe(OH)3,又有Fe2O3
(3)B
(4)取褐色粉末少量于试管中,加入适量盐酸溶解粉末,若溶液呈现黄色,加入足量NaOH溶液,产生红褐色沉淀,证明沉淀为Fe(OH)3,从而证明褐色粉末含有铁元素
(5)选取CH4,方法是点燃气体,在火焰上方罩一个内壁涂有澄清石灰水的小烧杯,若石灰水变浑浊,证明CH4含有碳元素
选取CH4,方法是点燃气体,在火焰上方罩一个干冷的小烧杯,若烧杯内壁有水雾出现,证明CH4含有氢元素
选取NaCl溶液,方法是加入硝酸和硝酸银溶液,若有白色沉淀生成,证明NaCl含有氯元素1年前查看全部
- 废水除汞,加入还原铁粉,应该有什么现象,我加入铁粉以后,并没有生成汞金属,而是产生黄绿色液体,为什么?在加铁粉之前我加入
废水除汞,加入还原铁粉,应该有什么现象,我加入铁粉以后,并没有生成汞金属,而是产生黄绿色液体,为什么?在加铁粉之前我加入了硫酸调节ph,用铁粉除汞的具体步骤是什么,产生的现象是什么,如何判断汞完全除尽,生成的汞是什么形态的,然后如何回收.
 东方红751年前2
东方红751年前2 -
 mpqghj 共回答了21个问题
mpqghj 共回答了21个问题 |采纳率85.7%一般工业废水用硫化钠除汞的比较多,或者用离子交换树脂处理,铁置换的很少.1年前查看全部
- 硫酸亚铁中加入过量还原铁粉溶液变成黄色,这是什么?
 相当地那是1年前1
相当地那是1年前1 -
 老山坡的放xx 共回答了11个问题
老山坡的放xx 共回答了11个问题 |采纳率81.8%二价铁离子的还原性很强,硫酸亚铁存放不当时会被空气中的氧气所氧化,而变成了硫酸铁.你配出来的溶液是黄色的硫酸铁溶液!如果想得到硫酸亚铁,就向配出来的溶液中加入过量的铁粉,再加少量的稀硫酸,防止水解.这样就可以长期保存硫酸亚铁溶液了!1年前查看全部
- (1)月饼包装袋中有一包还原铁粉,是“双吸剂”,吸收的物质是______;“旺旺”雪饼包装袋中有一小包干燥剂,主要成分是
(1)月饼包装袋中有一包还原铁粉,是“双吸剂”,吸收的物质是______;“旺旺”雪饼包装袋中有一小包干燥剂,主要成分是生石灰,吸收水的原因(用化学方程式表示)______.
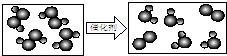
(2)用“ ”表示氢原子,“
”表示氢原子,“ ”表示氧原子,则右图所示的化学反应方程式为:2H2O2
”表示氧原子,则右图所示的化学反应方程式为:2H2O2
2H2O+O2↑催化剂 .2H2O2.根据右图,你能得出的结论是(写一条):______.
2H2O+O2↑催化剂 . 蓝天宝石11年前1
蓝天宝石11年前1 -
 岸岸M 共回答了21个问题
岸岸M 共回答了21个问题 |采纳率85.7%解题思路:(1)可从月饼变质的条件,以及铁生锈的条件来分析,生石灰具有吸水性,常用作食品干燥剂,
(2)由化学反应的微观模拟示意图可知:化学变化前后原子的种类和个数都不发生变化.(1)物质在有氧气和水存在的条件下发生反应而变质,防腐剂的作用是除去氧气和水,铁粉恰好可以与氧气和水发生化学反应而生锈,防止月饼因氧化而变质并且能吸水防潮;生石灰具有吸水性,常用作食品干燥剂,化学方程...
点评:
本题考点: 食品干燥剂、保鲜剂和真空包装的成分探究;生石灰的性质与用途;微粒观点及模型图的应用;质量守恒定律及其应用.
考点点评: 本题考查了食品保鲜剂的研究,完成此题,可以依据已有的知识进行;通过给出微粒的模型,考查学生的观察能力和对基本概念的理解与运用能力;通过分子、原子、离子、元素与物质之间的关系处理问题.1年前查看全部
- 用化学的方法检验放在空气中的双吸剂(还原铁粉)是否变质.2007年的一道中考题.
 多果丽1年前1
多果丽1年前1 -
 qiuyuekk 共回答了17个问题
qiuyuekk 共回答了17个问题 |采纳率76.5%加入盐酸,看溶液的颜色,如果开始时溶液显黄色则表示已经变质.因为变质后会有Fe2O3生成,与盐酸反应时会生成黄色的氯化铁.不变质则只有Fe,它与盐酸反应生成的氯化亚铁显浅绿色1年前查看全部
- 还原铁粉是Fe还是三氧化二铁?急要`
还原铁粉是Fe还是三氧化二铁?急要`
是一个些化学式的题,"市售的补血麦片中常含有微量的还原性铁粉,它与人胃液中的盐酸作用产生的补血物质" 秋的衣1年前3
秋的衣1年前3 -
 哈里吧人 共回答了11个问题
哈里吧人 共回答了11个问题 |采纳率81.8%它说了铁粉就是fe1年前查看全部
- 生铁粉与还原铁粉的区别
 宏宇强强1年前3
宏宇强强1年前3 -
 老鬼头 共回答了16个问题
老鬼头 共回答了16个问题 |采纳率93.8%还原性铁粉通俗的讲就是用还原方法制取的铁粉,又叫还原铁粉(纯铁).
一种活性很强的铁粉,因为具有较强的还原性,很容易发生氧化反应,甚至在空气中稍稍加热就会燃烧,因为它的这种特性,经常用于焊接铁轨、化工还原、防止氧化变质等.
生铁粉指生铁磨成粉末状,而生铁是含碳量大于2%的铁合金.1年前查看全部
- 一道化学计算若将28.12 g还原铁粉(含少量FexC)在氧气流中加热,得到标准状况下的CO2 224 mL;将相同质量
一道化学计算
若将28.12 g还原铁粉(含少量FexC)在氧气流中加热,得到标准状况下的CO2 224 mL;将相同质量的还原铁粉与足量硫酸反应,得到标准状况下的H2 10.752 L,计算FexC的化学式.(假设还原铁粉仅含两种物质) 不太安分1年前1
不太安分1年前1 -
 net3003 共回答了15个问题
net3003 共回答了15个问题 |采纳率86.7%由题意知,224mlCO2=0.01molCO2,是由FexC灼烧得到,10.752 LH2=0.48molH2,是金属铁粉和硫酸反应得到,Fe+H2SO4=FeSO4+H2,所以Fe=0.48mol*56=26.88(克)FexC=28.12-26.88=1.24(克),其中C=0.01mol*12=0.12克,Fe=1.24-0.12=1.12克=0.02mol,所以FexC=Fe2C.1年前查看全部
- 请问氧化亚铁与水反应,会和还原铁粉一样有放氢反应吗?
 小栎1年前1
小栎1年前1 -
 栗子娃娃 共回答了17个问题
栗子娃娃 共回答了17个问题 |采纳率94.1%水的状态应为水蒸气,氧化亚铁和还原铁粉与其反应都会生成四氧化三铁和氢气.若为液态水,在氧气存在的情况下生成Fe2O3·xH2O1年前查看全部
- 写出还原铁粉在胃酸的作用下转化为亚铁盐的化学方程式
写出还原铁粉在胃酸的作用下转化为亚铁盐的化学方程式
请您帮帮我,我马上要这个答案,谢谢! 好可爱阿1年前1
好可爱阿1年前1 -
 ht3v 共回答了22个问题
ht3v 共回答了22个问题 |采纳率95.5%Fe+2HCl=FeCl2+H2(气体)1年前查看全部
- 金属铁粉和还原铁粉有什么区别?
 492027491lan1年前1
492027491lan1年前1 -
 油女志乃 共回答了11个问题
油女志乃 共回答了11个问题 |采纳率100%用一氧化碳还原纯磁铁矿(Fe3O4)或用氢气还原轧钢时产生的氧化铁粉.用这2种方法生产出的单质铁粉称作“还原铁粉”;由于具有很好的也隙度和海绵状微观结构,因此也称作“海绵铁粉”.
用氢气还原的单质铁粉内部结构中的微孔,比用一氧化碳还原的单质铁粉内部结构中的微也还要细小,因而其生扔利用变幻无常(即被人体吸收率)理高.添入食品后,这2种单质铁粉的微也中可充满油,能够自我泣滑.这2种单质铁粉的微也扩大了单质铁粉颗粒的表面积,加速其在PH值较低的胃中溶解的速度.
换句话说,还原铁粉是非常疏松的铁粉1年前查看全部
- 生活中许多富脂糕点的包装盒内都装有一小包黑色的还原铁粉 长时间放置的糕点 包装盒内的还原铁粉往往
生活中许多富脂糕点的包装盒内都装有一小包黑色的还原铁粉 长时间放置的糕点 包装盒内的还原铁粉往往
变成红棕色(主要成分是Fe2O3)下列说法中正确的是
A 还原铁粉变成红棕色 发生了氧化反应
B 富脂食品长时间放置易被氧化
C Fe2O3是还原产物
D 如果放入Fe2(SO4)3也可以起到同样的作用 dalynana131年前1
dalynana131年前1 -
 linlilhs00 共回答了14个问题
linlilhs00 共回答了14个问题 |采纳率85.7%AB
还原铁粉是作为脱氧剂使用的.因为富含脂肪的食品容易氧化生成过氧化物,导致食物变质,所以在包装中加入脱氧剂,减少食品存储环境中的氧含量.脱氧剂脱氧是靠还原铁粉的氧化反应消耗包装中的氧气而起作用.1年前查看全部
- 制出黑的氢氧化铁我先给无水硫酸铜充分溶解,然后加还原铁粉,加热后溶液变绿又变成黄色的,然后我加氢氧化钠溶液,产生一堆黑色
制出黑的氢氧化铁
我先给无水硫酸铜充分溶解,然后加还原铁粉,加热后溶液变绿又变成黄色的,然后我加氢氧化钠溶液,产生一堆黑色沉淀……

 柳衣1年前1
柳衣1年前1 -
 贰手烟 共回答了23个问题
贰手烟 共回答了23个问题 |采纳率100%你加的还原铁粉的量可能不够,生成了氢氧化铜沉淀和氢氧化亚铁沉淀混在一起,氢氧化亚铁别氧化后迅速变成灰绿色,和深蓝色混在一起,就是黑的啦.或者说你没有过滤铜就加了氢氧化钠,加热使氧气氧化了铜,生成了黑色的氧化铜.(后一种可能较大)1年前查看全部
- 还原铁粉与水蒸气反应实验中,肥皂液和火柴,湿棉花做什么用
还原铁粉与水蒸气反应实验中,肥皂液和火柴,湿棉花做什么用
还原铁粉是什么?就是铁粉吗?
湿棉花提供水,为什么不直接加热试管底部的湿棉花,要加热还原铁粉?
肥皂液收集氢气为什么要用火柴证明是氢气,什么原理? chrzgggxz1年前1
chrzgggxz1年前1 -
 lxgdamao 共回答了21个问题
lxgdamao 共回答了21个问题 |采纳率90.5%还原铁粉是极细小的铁粉,加热湿棉花容易使试管炸裂而且铁粉与水要在高温下反应,用火柴点燃证明这种气体可燃,反应物中只有水和铁 说明产生的气体肯定是氢气1年前查看全部
- 抗氧化剂是还原剂吗?1、生石灰 2、还原铁粉(是什么?)
抗氧化剂是还原剂吗?1、生石灰 2、还原铁粉(是什么?)
3、亚硫酸钠 4、维生素 是抗氧化剂吗? wsmj1年前3
wsmj1年前3 -
 szhuang 共回答了19个问题
szhuang 共回答了19个问题 |采纳率100%抗氧化剂有是还原剂,也有不是还原剂.它有两种类型:
1、它是还原剂或易被氧化剂,当其与被保护物共存时自身先与侵入的氧化剂发生反应,从而延缓被保护物被氧化;
2、它是稳定剂,能与被保护物结合成更为稳定的物质,使之不易被氧化.
3、生石灰的主要成份是氧化钙,通常用作干燥剂,不能作为还原剂;还原铁粉即为金属铁粉碎而成,由于其比表面积较大,故用作还原剂.
亚硫酸钠是还原剂;维生素是易被氧化剂,也可认为是还原剂.1年前查看全部
- 已知分子为C10H14的分子,不能使溴水退色.它的分子结构只含一个烷基.它与液溴在还原铁粉存在下,反应生成一溴代物有3种
已知分子为C10H14的分子,不能使溴水退色.它的分子结构只含一个烷基.它与液溴在还原铁粉存在下,反应生成一溴代物有3种,则此烷基的结构有几种?
答案为4种.
问:我觉得 ……依题意应该是一个苯环上有一个烷基 .那苯环上就可以有三种一溴代物了,- -.怎么呢分析呢? diandengrenxu1年前4
diandengrenxu1年前4 -
 海odeta1 共回答了18个问题
海odeta1 共回答了18个问题 |采纳率88.9%因为又苯环所以一溴代物只有在苯环上取代.所以只要是苯环上是连接一个烷基那么一溴代物就有三种是不会错的.因为烷基有稳定性所以不会被溴取代的.其实就相当于四个碳链的结构分析了,所以四种答案是不会错的 还好你提供了答案要么都快忘记了1年前查看全部
- 食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水.下列分析不正确的是
食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水.下列分析不正确的是( )
A. “双吸剂”中的生石灰有吸水作用
B. “双吸剂”吸收氧气时,发生了原电池反应
C. 吸收氧气的过程中,铁作原电池的负极
D. 炭粉上发生的反应为:O2+4e-+4H+=2H2O 大梦敦煌1年前3
大梦敦煌1年前3 -
 闪亮的星陈 共回答了19个问题
闪亮的星陈 共回答了19个问题 |采纳率89.5%解题思路:A.氧化钙能与水反应生成氢氧化钙,从而可以作干燥剂;
B.在食品包装中加入铁粉,与碳粉、氯化钠溶液可构成原电池;
C.Fe为活泼金属,易失去电子;
D.正极上氧气得到电子.A.氧化钙能与水反应生成氢氧化钙,具有吸水性,从而可以作干燥剂,则“双吸剂”中的生石灰有吸水作用,故A正确;
B.在食品包装中加入铁粉,与碳粉、氯化钠溶液可构成原电池,正极上氧气得到电子,发生了原电池反应,故B正确;
C.Fe为活泼金属,易失去电子,铁作原电池的负极,故C正确;
D.由选项BC可知,正极上氧气得到电子,电极反应为O2+4e-+2H2O=4OH-,故D错误;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池原理,为高频考查,把握习题中的信息及电化学腐蚀中的吸氧腐蚀原理为解答的关键,注意中性溶液中正极上氧气得到电子,题目难度不大.1年前查看全部
大家在问
- 1下面几种现象中,能说明声音可以在水中传播的是 [ ] A.用光将鱼吸引到
- 2我校初二(1)班的同学想进行“测量纸锥下落的速度”实验,请问该实验:
- 3某商品标价比成本高P%,商口降价出售时,为了不亏本,降价幅度最多为d%,请用P表d
- 420岁后你打算干什么 用英语写短文
- 5they are nine改为一般疑问句
- 61、上海一家经贸代表团赴东南亚开展商贸活动,以下是该经贸团的所见所闻,你认为最不可信的是()
- 7unless bad weather stops me,i take exercise outdoors every m
- 8如图所示,一只小虫要从正方体的一个顶点A爬到相距它最远的另一个顶点B,最短的路径有几条?
- 9校园里有棵大木棉树,用4米长的绳子围绕这棵树绕了一圈还余下0.86米,请你算算这棵树树干横截面面积
- 10已知一个直角三角形三边长为a,b,c,∠B=90°,那么关于x的方程c(x-1)-2ax+b(x+1)=0的根的情况是?
- 11(2010•天津模拟)现有5名学生每人报考A、B、C三所大学中的一所大学,且每所大学至少有一人报考,则报考方式有( )
- 12英语翻译I always thought that I made the right decision,but the
- 13谁能告诉我这句话的意思谢谢,会英语的来or Insert boot media in selected boot dev
- 14怎么做一个简易水过滤器?里面的材料能不能换成别的家里常见的材料,例如活性炭那些...
- 152题化简.

