(2005•安丘市)你有没有引燃蜂窝煤炉的经验?它一般要经过下列几个步骤:
 清渠水2022-10-04 11:39:541条回答
清渠水2022-10-04 11:39:541条回答(1)把炉子移到庭院中,在炉膛中按自下而上的顺序把引火材料和蜂窝煤球放好.
(2)点燃最底下的引火材料.
(3)等到火燃烧起来以后,再在炉子的上方加一个拔火筒.
(4)看到引火材料基本烧完,蜂窝煤球微微被烧红以后,取下拔火筒,把炉子的进风口关小一点,并把炉子转移到较为温暖、避风的场所.直到炉火烧得旺旺的,你的工作才告成功!
说说看,为什么要经过这样一些步骤?这个过程应用了哪些关于燃烧的知识?______.

已提交,审核后显示!提交回复
共1条回复
 sadlkfjekrlgrth 共回答了25个问题
sadlkfjekrlgrth 共回答了25个问题 |采纳率88%- 解题思路:根据燃烧的条件及不同物质的着火点不同进行分析,燃烧的条件是:可燃物,温度达到着火点,与氧气(或空气)接触,三个条件缺一不可,同时具备.不同物质的着火点不同,燃烧的现象与氧气的量有关,氧气的量越大,有利于燃烧的进行.
燃烧的条件是:可燃物、氧气和温度达到着火点.不同物质的着火点不同,引火材料的着火点较低,易于点燃;煤的着火点较高,不易于点燃.利用引火材料的着火点较底,易于点燃,燃烧的过程放出大量的热,使周围的温度达到煤球的着火点以上,引燃煤球.在炉子的上方加一个拔火筒,为燃烧提供了足够的氧气,使煤球能够持续燃烧.
故答为:引火材料的着火点较底,易于点燃,燃烧的过程放出大量的热,使周围的温度达到煤球的着火点以上,引燃煤球,并提供足够的氧气,使煤球能够持续燃烧.点评:
本题考点: 燃烧与燃烧的条件.
考点点评: 本题紧密联系实际生活,体现了化学就在我们身边,生活中处处有化学. - 1年前
相关推荐
- (2009•安丘市模拟)甲、乙两小车在平直轨道上从同一点出发向东做匀速直线运动,它们的s-t图象分别如图(a)和(b)所
(2009•安丘市模拟)甲、乙两小车在平直轨道上从同一点出发向东做匀速直线运动,它们的s-t图象分别如图(a)和(b)所示,由图象可知( )

A.甲车的速度小于乙车的速度
B.以甲车为参照物,乙车向西运动
C.经过6秒,两车相距0.6米
D.通过3.6米的距离,甲车比乙车少用3秒 sailor3221年前1
sailor3221年前1 -
 第298次求婚 共回答了20个问题
第298次求婚 共回答了20个问题 |采纳率100%解题思路:A、由图象找出小车的路程s与所对应的时间t,由速度公式求出两车的速度,然后比较大小.
B、根据甲、乙两车的速度大小,判断它们的位置关系及它们相对位置是否变化,然后判断以甲为参照物,乙的运动状态.
C、由图象直接找出经过6s,甲车与乙车的路程,然后求出两车间的距离.
D、由速度公式求出甲车通过3.6m所以时间,由图象直接找出乙车通过3.6m所用的时间,然后求出它们所用时间差.A、由图象知甲车的速度v甲=
s甲
t甲=[2.4m/6s]=0.4m/s,乙车的速度v乙=
s乙
t乙=[3.6m/12s]=0.3m/s,v甲>v乙,故A错误.
B、甲、乙两小车在平直轨道上从同一点出发向东做匀速直线运动,由于v甲>v乙,乙在甲的西面,乙相对于甲的位置不断改变,以甲为参照物,乙车向西运动,故B正确.
C、由图象知:经过6秒,s甲=2.4m,s乙=1.8m,两者相距s=s甲-s乙=2.4m-1.8m=0.6m,故C正确.
D、由图象知:通过s=3.6m的距离t甲=[s
v甲=
3.6m/0.4m/s]=9s,由图象知t乙=12s,甲车比乙车少用12s-9s=3s,故D正确.
故选BCD.点评:
本题考点: 匀速直线运动;速度与物体运动.
考点点评: 这是一道s-t图象题,通过图象考查了:求小车的速度、判断两车的位置关系、求一定时间内的路程、求一定路程所以的时间等问题,是s-t图象题常考内容,要掌握;读懂图由图象找出小车路程与时间的对应关系是解题的关键.1年前查看全部
- (2005•安丘市)市场上有一些充气包装的食品(如图).装食品的塑料袋内充满了气体,气体充得鼓鼓的,看上去好像一个小“枕
 (2005•安丘市)市场上有一些充气包装的食品(如图).装食品的塑料袋内充满了气体,气体充得鼓鼓的,看上去好像一个小“枕头”.袋内充的是什么气体呢?
(2005•安丘市)市场上有一些充气包装的食品(如图).装食品的塑料袋内充满了气体,气体充得鼓鼓的,看上去好像一个小“枕头”.袋内充的是什么气体呢?
(1)初三(1)班的同学有两种猜想:A)二氧化碳,B)氧气.请判断哪种猜想更合理,并说明理由.
______
______.
(2)初三(2)班的同学也有两种猜想:A)氮气,B)二氧化碳.请设计一个实验,来判断猜想B是否正确.
______. javacoffer1年前1
javacoffer1年前1 -
 凉茶半盏 共回答了24个问题
凉茶半盏 共回答了24个问题 |采纳率95.8%解题思路:(1)根据氧气和二氧化碳的性质判断,氧气的化学性质比较活泼,能和食品中的物质发生化学反应,从而使食品腐败变质;
(2)根据二氧化碳能使澄清的石灰水变浑浊,氮气不能使石灰水变浑浊分析.(1)二氧化碳不能和食品中的物质反应,氧气能和食品中的物质发生化学反应,从而使食品腐败变质.
故答案为:二氧化碳的猜想更合理,因为氧气会使食品中某些成分氧化,氧气有利于某些微生物生长;二氧化碳则相反,可防止食品氧化,抑制微生物生长;
(2)可以用注射器抽取包装袋内气体,注入盛有澄清石灰水的试管中,若石灰水变浑浊,证明该气体为二氧化碳,若不变浑浊,就是氮气;
故答案为:用注射器抽取袋内气体通入少量澄清的石灰水中.若石灰水变浑浊,则猜想正确;反之,则不正确.点评:
本题考点: 食品干燥剂、保鲜剂和真空包装的成分探究;常见气体的检验与除杂方法.
考点点评: 本题考查包装袋内的气体的性质,属于与生活实际相联系的信息题.只要同学们把自己掌握的知识与题目所给信息相结合,问题就很好解决.1年前查看全部
- (2005•安丘市)纳米(nm)是一种长度单位,1nm=10-9m,纳米科技开辟了人类认识世界的新层面.纳米材料科技是纳
(2005•安丘市)纳米(nm)是一种长度单位,1nm=10-9m,纳米科技开辟了人类认识世界的新层面.纳米材料科技是纳米科技最基本的组成部分,把固体物质加工到纳米级(1nm~100nm)的超细粉末,即可得到纳米材料.这种加工过程属于( )
A.物理变化
B.化学变化
C.既有物理变化又有化学变化
D.既不是物理变化又不是化学变化 海沉大石1年前1
海沉大石1年前1 -
 火奴露露 共回答了16个问题
火奴露露 共回答了16个问题 |采纳率87.5%把固体物质加工到纳米级超细粉末的过程中,只是物质的颗粒大小即形状发生了改变,没有新物质生成,属于物理变化.
故选A.1年前查看全部
- (2005•安丘市)氢化钠是一种白色针状晶体,在这种化合物中钠显-1价.氢化钠与水反应生成碱和氢气.试根据上述情况推断并
(2005•安丘市)氢化钠是一种白色针状晶体,在这种化合物中钠显-1价.氢化钠与水反应生成碱和氢气.试根据上述情况推断并写出:将氢化钙 (CaH2)放于碳酸钠水溶液里发生反应的化学方程式为:______;______.
 找谁说1年前1
找谁说1年前1 -
 lei_tang 共回答了23个问题
lei_tang 共回答了23个问题 |采纳率87%解题思路:CaH2与Na2CO3水溶液反应时,由题干可知CaH2先与水反应生成氢氧化钙,氢氧化钙再与Na2CO3反应,据此可写出反应的化学方程式.氢化钙放于碳酸钠水溶液中首先与水反应生成氢氧化钙和氢气,反应的化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑;氢氧化钙又和碳酸钠反应生成碳酸钙和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
故答案为:CaH2+2H2O=Ca(OH)2+2H2↑;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查化学方程式的书写,难度较大.1年前查看全部
- (2005•安丘市)抗氧化剂能吸收氧气,降低食品内部及周围的含氧量,阻止氧气的食品发生氧化反应,从而延长食品的保持期.小
(2005•安丘市)抗氧化剂能吸收氧气,降低食品内部及周围的含氧量,阻止氧气的食品发生氧化反应,从而延长食品的保持期.小明发现新买来的高级月饼的包装盒内有一个印有“抗氧化剂”的小包,内装灰黑色粉末,其成份可能是( )
A.铁粉
B.氢氧化钠
C.二氧化锰
D.生石灰 ffwwtt1年前1
ffwwtt1年前1 -
 ahyuezhang 共回答了21个问题
ahyuezhang 共回答了21个问题 |采纳率95.2%解题思路:根据题意可以知道既然是抗氧化剂,肯定是用来吸收氧气的,所以可以根据所给物质的性质来判断能否吸收氧气来选择.A、铁粉能够和空气中的水和氧气反应,可以作为抗氧化剂来使用,且铁粉为灰黑色粉末,故A可能;
B、氢氧化钠能吸收水分,但是不能起到抗氧化剂的作用,故B不可能;
C、二氧化锰不能够和氧气反应,所以不能用来除去氧气,故C不可能;
D、生石灰是常用的干燥剂,但是不能和阻止氧气和食品的反应,故D不可能.
故选A.点评:
本题考点: 食品干燥剂、保鲜剂和真空包装的成分探究;金属的化学性质.
考点点评: 解答本题要分析物质在通常情况下能否和氧气反应,并且应该考虑这种物质的实际的颜色.1年前查看全部
- (2005•安丘市)“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得的
(2005•安丘市)“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得的产物,即原子的利用率为100%.在用C3H4(丙炔)合成C5H802(2-甲基丙烯酸甲酯)的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要的其它反应物是( )
A.CH3OH和H2
B.C02和H2O
C.CO和C2H5OH
D.CO和CH3OH bujuhua1年前1
bujuhua1年前1 -
 美如烟 共回答了16个问题
美如烟 共回答了16个问题 |采纳率87.5%解题思路:本题考查绿色化学的概念,并以此为依据,考查元素种类、原子种类在化学变化中都保持不变,因此我们要用守恒的观点来解答.由题意知,绿色化学即环境友好型化学,其理想状态是反应中原子全部转化为欲制得的产物,即原子的利用率为100%,根据这一观点,要把一个C3H4分子变成一个C5H802分子,还必须增加2个C原子、4个H原子、2个O原子,即原料中C、H、O的原子个数比为2:4:2.
A、CH3OH和H2,其中两种物质分子里三种原子不论怎样组合都不能使C、H、O的原子个数比为2:4:2,故A错;
B、C02和H2O,其中两种物质里三种原子不论怎样组合也都不能使C、H、O的原子个数比为2:4:2,故B错;
C、CO和C2H5OH,其中两种物质分子里三种原子不论怎样组合也不能使C、H、O的原子个数比为2:4:2,故C错;
D、CO和CH3OH,这两种物质如果按照分子个数比1:1组合,则很容易使C、H、O的原子个数比达到2:4:2,故D正确.
故选D.点评:
本题考点: 绿色化学;元素在化学变化过程中的特点.
考点点评: 本题考查的观念背景好,但是在解答时不知该如何着手,因此解本题时一定要读懂题意,明确命题者的意图,再结合所学方可解答1年前查看全部
- (2005•安丘市)为进一步了解血糖的调节功能,某校化学兴趣小组的同学,测定了一正常人在不同时期的血糖浓度(在测定期间被
(2005•安丘市)为进一步了解血糖的调节功能,某校化学兴趣小组的同学,测定了一正常人在不同时期的血糖浓度(在测定期间被测人只是在实验室中轻度活动).下表中最有可能表示测定记录的选项是( )
A.测定时间 血脂质量分数 空腹 0.1% 食用100g葡萄糖后半小时 0.08% 食用100g葡萄糖后2小时 0.14%
B.测定时间 血脂质量分数 空腹 0.14% 食用100g葡萄糖后半小时 0.1% 食用100g葡萄糖后2小时 0.08%
C.测定时间 血脂质量分数 空腹 0.08% 食用100g葡萄糖后半小时 0.1% 食用100g葡萄糖后2小时 0.14%
D.测定时间 血脂质量分数 空腹 0.1% 食用100g葡萄糖后半小时 0.14% 食用100g葡萄糖后2小时 0.1%  __Xiao灿1年前1
__Xiao灿1年前1 -
 qq狼人 共回答了25个问题
qq狼人 共回答了25个问题 |采纳率88%血液中的葡萄糖称为血糖,正常人的血液中葡萄糖的含量是0.1%,一般是在胰岛素的调节下保持稳定,当进食后糖类物质消化为葡萄糖被吸收,进入血液成为血糖,这时人体血液中的血糖浓度会相对升高,刺激胰岛素分泌,促进血糖分解或合成糖元,使血糖浓度降低,恢复原有水平,所以D项合理.
故选D.1年前查看全部
- (2009•安丘市模拟)下列说法正确的是( )
(2009•安丘市模拟)下列说法正确的是( )
A.固定电话的听筒把声音变成变化的电流
B.电磁波不能在真空中传播
C.移动电话是靠电磁波传递信息的
D.太阳能属于不可再生资源 贼佬1年前1
贼佬1年前1 -
 xiang_hua 共回答了17个问题
xiang_hua 共回答了17个问题 |采纳率88.2%解题思路:电话的话筒通过电磁感应把声音的信号变为强弱变化的电流,而听筒是把强弱变化的电流通过磁场对电流的作用转化成声音的信号的;
电磁波可以在真空中传播,声音不能在真空中传播;
移动通信利用的是微波---波长比较短的电磁波;光是电磁波的一种,电磁波的传播速度等于光速;
能够从自然界中源源不断的得到的能源叫可再生能源.电话的话筒把声音的信号转变为强弱变化的电流的信号传递出去,再通过听筒把强弱变化的电流信号变成声音的信号,把传输的声音还原出来;故A错误;
电磁波可以在真空中传播,故B错误;
移动通信是利用电磁波来传递信息的,电磁波的传播速度和光速相同;故C正确;
太阳能可以从自然界中源源不断的得到,因此它属于可再生能源,故D错误.
故选C.点评:
本题考点: 移动通信;电磁波的传播;不可再生能源的特点.
考点点评: 本题考查电话的原理、电磁波的特点、移动通信的原理和太阳能的有关问题,相对比较简单,属于基础题.1年前查看全部
- (2005•安丘市)工业生产中常将两种金属在同一容器里加热使其溶合,冷凝后得到具有金属特性的熔合物--合金.试根据下表中
(2005•安丘市)工业生产中常将两种金属在同一容器里加热使其溶合,冷凝后得到具有金属特性的熔合物--合金.试根据下表中所列的金属熔沸点的数据(其它条件均已满足).判断不能制得的合金是( )
金属 Na K Al Cu Fe 熔点(℃) 97.8 93.6 660 1083 1536 沸点(℃) 883 774 2200 2595 2750
A.K-Na合金
B.K-Fe合金
C.Na-Al合金
D.Fe-Cu合金 kdjlk23lfjlask1年前1
kdjlk23lfjlask1年前1 -
 bluky 共回答了14个问题
bluky 共回答了14个问题 |采纳率78.6%解题思路:由合金的形成可知,两种金属若能够形成合金,则熔点较高的金属的熔点不能大于熔点较低的金属的沸点.A、钠的熔点低于钾的沸点,两种金属能够形成合金.故选项错误;
B、铁的熔点高于钾的沸点,两种金属不能形成合金.故选项正确;
C、铝的熔点低于钠的沸点,两种金属能够形成合金.故选项错误;
D、铁的熔点低于铜的沸点,两种金属能够形成合金.故选项错误.
故选B.点评:
本题考点: 合金与合金的性质.
考点点评: 解答本题要从各种金属的熔点、沸点方面进行分析、判断,从而得出正确的结论.1年前查看全部
- (2005•安丘市)某氢氧化钠溶液中溶质的质量分数为10%,则该溶液中钠离子和水分子的个数比为( )
(2005•安丘市)某氢氧化钠溶液中溶质的质量分数为10%,则该溶液中钠离子和水分子的个数比为( )
A.1:10
B.1:5
C.1:20
D.1:40 zhaohuiwen22441年前1
zhaohuiwen22441年前1 -
 雨潮58105 共回答了15个问题
雨潮58105 共回答了15个问题 |采纳率100%解题思路:可以利用假设法:假设氢氧化钠溶液的质量为100克,则根据题意“氢氧化钠溶液中溶质的质量分数为10%”,可求知溶质的质量;由氢氧化钠与水的物质的量,可求该溶液中钠离子和水分子的个数比.假设氢氧化钠溶液的质量为100克,则根据题意“氢氧化钠溶液中溶质的质量分数为10%”,可求知溶质的质量为:10克,则氢氧化钠的物质的量为[10/40]=0.25摩尔,水的物质的量为(100-10)÷18=5摩尔,因为该溶液中钠离子和水分子的个数比即为:氢氧化钠的物质的量与水的物质的量的比.则:0.25:5=1:20.
故选C.点评:
本题考点: 溶质的质量分数;分子、原子、离子、元素与物质之间的关系.
考点点评: 掌握溶质的质量分数的有关计算;了解物质的量的概念,并且学会简单的应用.1年前查看全部
- (2005•安丘市)商场出售的服装都挂有面料成分及洗涤说明的标签,如图为某服装的标签:
 (2005•安丘市)商场出售的服装都挂有面料成分及洗涤说明的标签,如图为某服装的标签:
(2005•安丘市)商场出售的服装都挂有面料成分及洗涤说明的标签,如图为某服装的标签:
(1)面料中的天然纤维是______合成纤维是______.
(2)检验其主要成分为丝的简单方法是______. 年高峰海拔1年前1
年高峰海拔1年前1 -
 加那利海藻 共回答了24个问题
加那利海藻 共回答了24个问题 |采纳率91.7%解题思路:(1)天然纤维为自然界存在的纤维,以蛋白质组成的居多,合成纤维为人工合成一般是高分子聚合物.
(2)天然纤维燃烧时会有焦羽毛味,人造纤维则不具备.(1)天然纤维为自然界存在的纤维,以蛋白质组成的居多,合成纤维为人工合成一般是高分子聚合物,则此衣物中丝是天然纤维,其它为人造纤维,故答案为:丝;锦纶涤纶.
(2)天然纤维燃烧时会有焦羽毛味,人造纤维则不具备,燃烧时会有刺鼻的气味,故答案为:抽几根丝燃烧,有烧焦羽毛气味,残余物挤压成粉末状则是丝.点评:
本题考点: 合成纤维及其应用.
考点点评: 此题是对天然纤维及人造纤维的考查,解决的依据是对两者进行区分,并知道两者的相关性质.1年前查看全部
- (2005•安丘市)流星进入地球大气层时,由于与大气发生剧烈摩擦,会使流星燃烧发光.小明问老师:“发射火箭时,火箭同样也
(2005•安丘市)流星进入地球大气层时,由于与大气发生剧烈摩擦,会使流星燃烧发光.小明问老师:“发射火箭时,火箭同样也与空气发生剧烈摩擦,为什么没有燃烧发光?”老师解释说:“科学家们一方面研制了可耐几千摄氏度的耐高温材料;另一方面还在火箭头部涂了一层特殊材料,这种材料在高温下熔化并汽化,能起到防止烧坏火箭的作用.”请回答涂这层特殊材料为什么能起到防止烧坏火箭头部的作用?
 spaderman1年前1
spaderman1年前1 -
 瓷实的刺梨 共回答了16个问题
瓷实的刺梨 共回答了16个问题 |采纳率87.5%解题思路:物质由固态变为液态的过程叫熔化,由液态变为气态的过程叫汽化,物态变化中,熔化、汽化是吸热的,能起到降温的作用.由物质的三态的变化可知,物质由固态变为液态的过程叫熔化,由液态变为气态的过程叫汽化,物态变化中,熔化、汽化是吸热的,能起到降温的作用.
故答为:火箭头部的特殊材料熔化并汽化,而熔化和汽化都要吸热,使火箭头部温度不致过高,因而不会被烧毁.点评:
本题考点: 物质的三态及其转化.
考点点评: 此题考查的是汽化和熔化吸热在生活中的应用,是一道理论联系实际的题目,是中考经常出现的题型之一.1年前查看全部
- (图00八•安丘市)地球s的大部分水是以海水形式存在的,若能找到海水淡化的大规模生产方法,将极大地缓解目前左类面临的水资
(图00八•安丘市)地球s的大部分水是以海水形式存在的,若能找到海水淡化的大规模生产方法,将极大地缓解目前左类面临的水资源日益紧缺的状况.下列有关海水淡化的方法在原理s完全不可行的是( )
A.加明矾使海水中的盐分沉淀而淡化
B.利用太阳能将海水蒸馏淡化
C.在一定条件下将海水缓慢凝固以获取淡水
D.选择一种特殊的膜在一定条件下使海水中较小的水分子通过,而其中较大的溶质微粒不能通过,从而使溶剂水与溶质分离 lillian16161年前1
lillian16161年前1 -
 lijiding 共回答了17个问题
lijiding 共回答了17个问题 |采纳率94.1%解题思路:海水淡化能极大地缓解目前人类面临的水资源日益紧缺的状况,因此我们要积极寻找海水淡化的方法.如:利用太阳能将海水蒸馏淡化;选择一种特殊的膜在一定条件下使海水中较小的水分子通过,而其中较大的溶质微粒不能通过,从而使溶剂水与溶质分离,可以获取淡水.A、明矾使海水中的悬浮颗粒沉淀下来而净水,并不能淡化海水.故A错误;
B、利用太阳能将海水蒸馏淡化在原理上是可行的.故B正确;
C、在一定条件下将海水缓慢凝固以获取淡水在原理上是可行的.故C正确;
D、选择一种特殊的膜在一定条件下使海水中较小的水分子通过,而其中较大的溶质微粒不能通过,从而使溶剂水与溶质分离,可以获取淡水.故D正确;
故选A.点评:
本题考点: 水资源状况;水的净化.
考点点评: 本题考查海水的淡化,淡化的方法很多.如利用太阳能将海水蒸馏淡化等.1年前查看全部
- (2010•安丘市模拟)选修3-3有以下说法:其中正确的是______.
(2010•安丘市模拟)选修3-3有以下说法:其中正确的是______.
A.“用油膜法估测分子的大小”实验中油酸分子直径等于纯油酸体积除以相应油酸膜的面积
B.理想气体在体积不变的情况下,压强p与热力学温度T成正比
C.气体分子的平均动能越大,气体的压强就越大
D.物理性质各向同性的一定是非晶体
E.液体的表面张力是由于液体分子间的相互作用引起的
F.控制液面上方饱和汽的体积不变,升高温度,则达到动态平衡后该饱和汽的质量增大,密度增大,压强也增大
G.让一小球沿碗的圆弧型内壁来回滚动,小球的运动是可逆过程. yangyang30001年前1
yangyang30001年前1 -
 前提32 共回答了12个问题
前提32 共回答了12个问题 |采纳率91.7%解题思路:在用油膜法估测分子的大小”实验中,我们做了些理想化处理,认为油酸分子之间无间隙,油酸膜为单层分子.
压强p与热力学温度T成正比,必须是一定量的理想气体.
温度是分子平均动能的量度.
非晶体和多晶体是物理性质各向同性的.
液体的表面张力是由于液体分子间的相互作用引起的.
温度升高时,液体分子的平均动能增大,单位时间里从液面飞出的分子数增多,质量增大.
在运动过程中有能量损失,为不可逆过程.A、用油膜法估测分子的大小”实验中认为油酸分子之间无间隙,油酸膜为单层分子,所以可以认为油酸分子直径等于纯油酸体积除以相应油酸膜的面积,故A对.
B、没有确保是一定质量的理想气体,压强p与热力学温度T不一定成正比,故B错.
C、温度是气体分子平均动能的量度,气体分子的平均动能越大,温度越高,故C错.
D、多晶体的物理性质各向同性,所以不一定是非晶体,也有可能是多晶体,故D错.
E、液体间的作用力是由分子间的引力和斥力相互作用一起的,即分子作用力,故E对.
F、温度升高时,液体分子的平均动能增大,单位时间里从液面飞出的分子数增多,所以达到动态平衡后该饱和汽的质量增大,密度增大,压强也增大,故F对.
G、在运动过程中有能量损失,故为不可逆过程,故G错.
故选AEF.点评:
本题考点: 估测油酸分子大小;* 晶体和非晶体;*表面张力产生的原因;气体的实验定律.
考点点评: 本题主要考查基本知识点,只要平时记住即可.1年前查看全部
- (2889•安丘市模拟)饮料的吸管一端做成尖形是为了______用吸管吸饮料时利用了______的作用.
 yestwind1年前1
yestwind1年前1 -
 ricky460 共回答了26个问题
ricky460 共回答了26个问题 |采纳率84.6%解题思路:(1)压强大小跟压力大小和受力面积大小有关.
增大压强的方法:在压力一定时,减小受力面积来增大压强;在受力面积一定时,增大压力来增大压强.
(2)用吸管吸饮料,是利用大气压的作用把饮料压入嘴里.饮料的吸管一端做成尖形,在压力一定时,减小受力面积来增大吸管对瓶盖的压强.
吸管吸饮料时,吸气时,管内压强减小,饮料在大气压作用下被压入嘴里.
故答案为:增大压强;大气压.点评:
本题考点: 增大压强的方法及其应用;大气压的综合应用.
考点点评: 用吸管吸饮料利用了压强、大气压的作用等知识点,体现了物理和生活的密切关系.
掌握压强大小的影响因素,利用控制变量法解释生活中有关增大和减小压强的问题.1年前查看全部
- (2005•安丘市)集气瓶被誉为“万能瓶”,如下图装置是其中的一种.当被收集的气体从a口进入时,瓶内空气从b口排出,相当
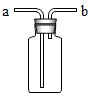 (2005•安丘市)集气瓶被誉为“万能瓶”,如下图装置是其中的一种.当被收集的气体从a口进入时,瓶内空气从b口排出,相当于向上排空气法收集气体.现若将被收集的气体从b口进入,则它可收集的气体为:①H2②CH4③CO2( )
(2005•安丘市)集气瓶被誉为“万能瓶”,如下图装置是其中的一种.当被收集的气体从a口进入时,瓶内空气从b口排出,相当于向上排空气法收集气体.现若将被收集的气体从b口进入,则它可收集的气体为:①H2②CH4③CO2( )
A.只有①
B.只有①和②
C.只有③
D.①②③均可 azurechen1年前1
azurechen1年前1 -
 叶小牙 共回答了16个问题
叶小牙 共回答了16个问题 |采纳率100%解题思路:根据题意气体从a口进入时相当于向上排空气法收集气体和常用气体的收集方法进行分析解答本题.根据题意被收集的气体从a口进入时,瓶内空气从b口排出,相当于向上排空气法收集气体,可知:将被收集的气体从b口进入,相当于向下排空气法收集气体,即比空气密度小的气体; ①H2②CH4③CO2三种气体中比空气密度小的气体有:①H2②CH4;
故选B.点评:
本题考点: 常用气体的收集方法.
考点点评: 本题考查学生根据题意和常用气体的收集方法进行分析解题的能力.1年前查看全部
- (2005•安丘市)在配制溶质质量分数为10%的氯化钠溶液时,导致氯化钠质量分数小于10%可能的原因是:①盛装溶液的试剂
(2005•安丘市)在配制溶质质量分数为10%的氯化钠溶液时,导致氯化钠质量分数小于10%可能的原因是:①盛装溶液的试剂瓶用蒸馏水润洗;②配制溶液的烧杯用少量蒸馏水润洗;③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数;④用量筒取水时俯视读数;⑤氯化钠晶体不纯净.( )
A.①③④⑤
B.①②③⑤
C.①②④⑤
D.②③④⑤ 江南布衣82021年前1
江南布衣82021年前1 -
 WOLIANHUI 共回答了27个问题
WOLIANHUI 共回答了27个问题 |采纳率96.3%解题思路:引起溶液中氯化钠的质量分数偏小的原因,主要从溶质偏少和溶剂偏多两方面考虑.引起溶液中氯化钠的质量分数偏小,从两个方面考虑:①溶质少了(称量时左码右物、在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数,会导致称量质量偏小,氯化钠晶体不纯净等)②水量多了(量水时仰视读数,烧杯中原来有水、盛装溶液的试剂瓶用蒸馏水润洗等).
故选B.点评:
本题考点: 一定溶质质量分数的溶液的配制;实验数据处理或者误差分析的探究.
考点点评: 通过回答本题知道了引起溶液中氯化钠的质量分数偏小的原因,主要从溶质和溶剂的质量两方面考虑.并能灵活运用.1年前查看全部
- (2009•安丘市模拟)如图所示,用40N的力F把重l0N的物体紧压在竖直墙壁上静止,则物体受到的摩擦力为______N
 (2009•安丘市模拟)如图所示,用40N的力F把重l0N的物体紧压在竖直墙壁上静止,则物体受到的摩擦力为______N,若压力F增大到80N,则物体受到的摩擦力为______N.
(2009•安丘市模拟)如图所示,用40N的力F把重l0N的物体紧压在竖直墙壁上静止,则物体受到的摩擦力为______N,若压力F增大到80N,则物体受到的摩擦力为______N.  1542965751年前1
1542965751年前1 -
 拖拖拉 共回答了15个问题
拖拖拉 共回答了15个问题 |采纳率73.3%解题思路:对处于平衡状态的物体进行受力分析,利用二力平衡的条件即可确定物体受到摩擦力大小.物体静止在图示的位置时,受到两对平衡力的作用:竖直方向的向下的重力和墙壁对它向上的摩擦力;水平方向上向左的压力和墙壁对它向右的压力.
由于摩擦力和重力是一对平衡力,并且重力等于10N,所以摩擦力也等于10N;在竖直方向,物体始终处于平衡状态,摩擦力始终等于重力,重力不变,所以摩擦力大小也不变,恒为
10N.
故答案为:10;10.点评:
本题考点: 二力平衡条件的应用.
考点点评: 把握住此时的摩擦力与重力是一对平衡力是解决此题的关键.1年前查看全部
- (2005•安丘市)已知硫化铜(CuS)、硫化亚铜(Cu2S)粉末的颜色和氧化铜粉末相似且都不溶于水.在空气中煅烧硫化铜
(2005•安丘市)已知硫化铜(CuS)、硫化亚铜(Cu2S)粉末的颜色和氧化铜粉末相似且都不溶于水.在空气中煅烧硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.试根据上述性质,设计一个不用任何化学试剂就能鉴别氧化铜、硫化铜、硫化亚铜三种粉末的简便化学实验方案,并将方案填写于下表中.实验提供天平及其他必要的设备.
实验步骤 实验现象 结论及有关化学方程式 (1)______ ______ 固体无变化的是氧化铜,产生刺激性气味的是硫化铜和硫化亚铜
2CuS+3O2
2CuO+2SO2△ .
Cu2S+2O2
2CuO+SO2△ .固体无变化的是氧化铜,产生刺激性气味的是硫化铜和硫化亚铜
2CuS+3O2
2CuO+2SO2△ .
Cu2S+2O2
2CuO+SO2△ .(2)______ ______ ______  ice1982911年前1
ice1982911年前1 -
 eastchang 共回答了21个问题
eastchang 共回答了21个问题 |采纳率76.2%解题思路:根据给出的物质的性质差异进行分析,在空气中煅烧硫化铜和硫化亚铜都转化为氧化铜和二氧化硫,有刺激性气味的气体产生,而氧化铜受热无变化,由于化铜和硫化亚铜的含铜量不同,故剩余的生成氧化铜的质量不同,然后根据物质的质量差异进行鉴别.在空气中煅烧硫化铜和硫化亚铜都转化为氧化铜和二氧化硫,有刺激性气味的气体产生,而氧化铜受热无变化,由于硫化铜和硫化亚铜的含铜量不同,故剩余的生成氧化铜的质量不同,然后根据物质的质量差异进行鉴别,
2CuS+3O2
△
.
2CuO+2SO2
192 160
Cu2S+2O2
△
.
2CuO+SO2
160 160
所以本题答案为:
实验步骤 现象 结论
(1)分别称取相同质量的样品,在空气中灼烧 有一种固体无变化,两种固体产生刺激性气味 固体无变化的是氧化铜,产生刺激性气味的是硫化铜和硫化亚铜
(2)分别称量硫化铜和硫化亚铜灼烧后剩余物质的质量, 有一种样品质量减轻,一种样品质量不变 质量减轻的是硫化铜,质量不变的是硫化亚铜点评:
本题考点: 物质的鉴别、推断;化学性质与物理性质的差别及应用.
考点点评: 不同考查了常见物质的鉴别,完成此题,可以依据题干提供的信息结合物质的性质差异进行.1年前查看全部
- (2010•安丘市模拟)甲和乙两物体在同一直线上运动,它们在0~0.4s内的v-t图象如图所示.若两物体均只受到彼此的相
 (2010•安丘市模拟)甲和乙两物体在同一直线上运动,它们在0~0.4s内的v-t图象如图所示.若两物体均只受到彼此的相互作用,则甲、乙的质量之比和图中时刻t1分别为( )
(2010•安丘市模拟)甲和乙两物体在同一直线上运动,它们在0~0.4s内的v-t图象如图所示.若两物体均只受到彼此的相互作用,则甲、乙的质量之比和图中时刻t1分别为( )
A.1:3和0.30s
B.3:1和0.30s
C.1:4和0.35s
D.4:1和0.35s 山青青3771年前1
山青青3771年前1 -
 yegaolun 共回答了20个问题
yegaolun 共回答了20个问题 |采纳率95%解题思路:先根据三角形相似知识求出t1,再根据速度图象的斜率等于加速度求出甲乙的加速度大小,由牛顿第二定律和第三定律求解两物体质量之比.根据三角形相似得:
0.4−t1
0.4=[1/4],得t1=0.3s.
根据速度图象的斜率等于加速度,得到:
甲的加速度大小为a甲=[1
t1=
10/3]m/s2,乙的加速度大小为a乙=[4−0/0.4]m/s2=10m/s2
据题,仅在两物体之间存在相互作用,根据牛顿第三定律得知,相互作用力大小相等,由牛顿第二定律F=ma得:两物体的加速度与质量成反比,则有质量之比为m甲:m乙=a乙:a甲=3:1.
故选B点评:
本题考点: 匀变速直线运动的图像.
考点点评: 本题一方面考查速度图象的斜率等于加速度;另一方面考查运用数学知识解决物理问题的能力.1年前查看全部
- (2010•兴业县模拟)安丘市正在建设的滨湖新区,区域内自然景观良好,水系较多.因此,有关人士分析,建成后新区夏天早晚的
 (2010•兴业县模拟)安丘市正在建设的滨湖新区,区域内自然景观良好,水系较多.因此,有关人士分析,建成后新区夏天早晚的温差相比较老城区要小,居家会有“冬暖夏凉”的舒适感,从物理学的角度分析,产生这一现象的主要原因是由于水的______较大;另外,湖边散步,还可以欣赏到如图所示的“湖光倒影”美景,这是一种______现象.
(2010•兴业县模拟)安丘市正在建设的滨湖新区,区域内自然景观良好,水系较多.因此,有关人士分析,建成后新区夏天早晚的温差相比较老城区要小,居家会有“冬暖夏凉”的舒适感,从物理学的角度分析,产生这一现象的主要原因是由于水的______较大;另外,湖边散步,还可以欣赏到如图所示的“湖光倒影”美景,这是一种______现象.  仙妮船长1年前1
仙妮船长1年前1 -
 小歪V 共回答了16个问题
小歪V 共回答了16个问题 |采纳率81.3%解题思路:相同质量的水和其它物质比较,吸收或放出相同的热量,因水的比热容比较大,所以水的温度升高或降低的少;
若升高或降低相同的温度,水吸收或放出的热量多,据此分析即可;
“湖光倒影”是指光在水面处发生的反射而成的像,水面相当于一平面镜.建成后新区水多,因为水的比热容大,相同质量的水和其它物质比较:白天,吸收相同的热量,水的温度升高的少,夜晚,放出相同的热量,水的温度降低的少,使昼夜温差小;夏天,吸收相同的热量,水的温度升高的少;冬天,放出相同的热量,水的温度降低的少,使人会有“冬暖夏凉”的舒适感;
水面相当于一平面镜,可将岸上的景物成像在水上,即看到的“湖光倒影”是一种光的反射现象;
故答案为:比热容;光的反射.点评:
本题考点: 水的比热容的特点及应用;光的反射.
考点点评: 本题考查水的比热容较大的特点、光的反射的应用,难度不大,但能密切联系生活,属于中考的热点.1年前查看全部
- (2009•安丘市模拟)如图所示是王浩同学用相同的加热器给质量相等的甲、乙两种固体物质加热时,根据测量结果描绘的图象,由
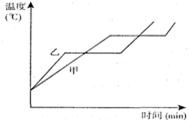 (2009•安丘市模拟)如图所示是王浩同学用相同的加热器给质量相等的甲、乙两种固体物质加热时,根据测量结果描绘的图象,由图可知(甲、乙两固体物质的比热容分别为C甲、C乙),C甲______C乙,液态甲、乙两种物体质中,______的凝固点较高.
(2009•安丘市模拟)如图所示是王浩同学用相同的加热器给质量相等的甲、乙两种固体物质加热时,根据测量结果描绘的图象,由图可知(甲、乙两固体物质的比热容分别为C甲、C乙),C甲______C乙,液态甲、乙两种物体质中,______的凝固点较高.  ----绿罗裙1年前1
----绿罗裙1年前1 -
 爱美丽的宝宝天使 共回答了17个问题
爱美丽的宝宝天使 共回答了17个问题 |采纳率94.1%解题思路:(1)判断甲乙两固体物质的比热容的大小,可判断两种物质在升高相同温度的情况下,所用时间的多,用时较多的,说明吸收的热量多,则比热较大.
(2)比较甲、乙两种物体的凝点,也就是比较两物质的熔点,根据图中的信息直接判断即可.(1)观察图片可知:在升高相同温度的情况下,甲固体所用的加热时间较多,因此吸收的热量也较多,所以固体甲的比热容较大;
(2)由图可知,甲的熔点要高于乙的熔点,因此甲的凝固点也高于乙的凝固点;
故答案为:>,甲.点评:
本题考点: 熔化和凝固的温度—时间图象;比热容的概念.
考点点评: 此题是晶体熔化的温度-时间图象与比热容的综合题,根据图象判断两物质比热的大小关系是此题的难点.1年前查看全部
- (2005•安丘市)常用燃烧法测定有机物的组成.现取2.3 g某有机物在足量的氧气中完全燃烧,生成4.4
(2005•安丘市)常用燃烧法测定有机物的组成.现取2.3 g某有机物在足量的氧气中完全燃烧,生成4.4 g CO2和2.7 g H2O.对该物质的组成有下列推断:①一定含C、H元素②一定不含O元素③可能含O元素④一定含O元素⑤分子中C、H的原子个数比为2:5⑥分子中C、H、O的元素质量比为12:3:8.其中正确的是( )
A. ①②⑤
B. ①④⑥
C. ①③⑤
D. ①④⑤ 枷枷1年前5
枷枷1年前5 -
 daocaoren1105 共回答了23个问题
daocaoren1105 共回答了23个问题 |采纳率82.6%解题思路:本题根据有 CO2和 H2O生成,说明有机物一定含有C、H两种元素;氧元素要计算CO2和 H2O中C、H两种元素的质量,若质量和小于2.3 g,则有氧元素,相等则不含氧元素;然后可进一步计算元素质量比和原子个数比.由题意,反应后 CO2和 H2O生成,有机物一定含有C、H两种元素,则①正确;CO2中C元素的质量4.4g×1244×100%=1.2gH2O中H元素的质量2.7g×218×100%=0.3g1.2g+0.3g=1.5g<2.3g,说明有氧元素,则④正确C、...
点评:
本题考点: 实验探究物质的组成成分以及含量;物质组成的综合计算.
考点点评: 本题根据元素守恒来确定有机物的组成元素,利用定量计算确定氧元素,是有机物成分确定常用的方法.1年前查看全部
- (2005•安丘市)如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻
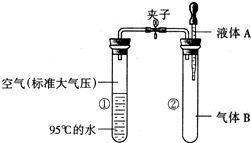 (2005•安丘市)如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合可能是下列的( )
(2005•安丘市)如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合可能是下列的( )
A.水、一氧化碳
B.硫酸、氮气
C.酒精、氧气
D.氢氧化钠溶液、二氧化碳 色刺猬1年前1
色刺猬1年前1 -
 hakbt 共回答了17个问题
hakbt 共回答了17个问题 |采纳率88.2%解题思路:水的沸点与压强有关,压强越小水的沸点越低.压强越大水的沸点越高,氢氧化钠溶液能吸收二氧化碳气体,打开夹子时①中的气体进入②中,从而使得①中的压强减小,水的沸点降低,水沸腾了.A、水不能吸收一氧化碳,打开夹子时①中的压强不变,水的沸点不变.故A错误;
B、硫酸不能吸收氮气,打开夹子时①中的压强不变,水的沸点不变.故B错误;
C、酒精不能吸收氧气,打开夹子时①中的压强不变,水的沸点不变.故C错误;
D、氢氧化钠溶液能吸收二氧化碳气体,打开夹子时①中的气体进入②中,从而使得①中的压强减小,水的沸点降低,水沸腾了.故D正确.
故选D.点评:
本题考点: 反应现象和本质的联系;碱的化学性质.
考点点评: 解答本题的关键是要充分理解水沸腾的原因,根据物质间反应后气体状态的改变,对问题做出正确的判断.1年前查看全部
- (2005•安丘市)某氢氧化钠溶液中溶质的质量分数为10%,则该溶液中钠离子和水分子的个数比为( )
(2005•安丘市)某氢氧化钠溶液中溶质的质量分数为10%,则该溶液中钠离子和水分子的个数比为( )
A. 1:10
B. 1:5
C. 1:20
D. 1:40 ataoxue1年前1
ataoxue1年前1 -
 jueping 共回答了16个问题
jueping 共回答了16个问题 |采纳率87.5%解题思路:可以利用假设法:假设氢氧化钠溶液的质量为100克,则根据题意“氢氧化钠溶液中溶质的质量分数为10%”,可求知溶质的质量;由氢氧化钠与水的物质的量,可求该溶液中钠离子和水分子的个数比.假设氢氧化钠溶液的质量为100克,则根据题意“氢氧化钠溶液中溶质的质量分数为10%”,可求知溶质的质量为:10克,则氢氧化钠的物质的量为[10/40]=0.25摩尔,水的物质的量为(100-10)÷18=5摩尔,因为该溶液中钠离子和水分子的个数比即为:氢氧化钠的物质的量与水的物质的量的比.则:0.25:5=1:20.
故选C.点评:
本题考点: 溶质的质量分数;分子、原子、离子、元素与物质之间的关系.
考点点评: 掌握溶质的质量分数的有关计算;了解物质的量的概念,并且学会简单的应用.1年前查看全部
- (2005•安丘市)常用燃烧法测定有机物的组成.现取2.3 g某有机物在足量的氧气中完全燃烧,生成4.4
(2005•安丘市)常用燃烧法测定有机物的组成.现取2.3 g某有机物在足量的氧气中完全燃烧,生成4.4 g CO2和2.7 g H2O.对该物质的组成有下列推断:①一定含C、H元素②一定不含O元素③可能含O元素④一定含O元素⑤分子中C、H的原子个数比为2:5⑥分子中C、H、O的元素质量比为12:3:8.其中正确的是( )
A. ①②⑤
B. ①④⑥
C. ①③⑤
D. ①④⑤ 油菜花开了开1年前1
油菜花开了开1年前1 -
 xienxienw 共回答了16个问题
xienxienw 共回答了16个问题 |采纳率81.3%解题思路:本题根据有 CO2和 H2O生成,说明有机物一定含有C、H两种元素;氧元素要计算CO2和 H2O中C、H两种元素的质量,若质量和小于2.3 g,则有氧元素,相等则不含氧元素;然后可进一步计算元素质量比和原子个数比.由题意,反应后 CO2和 H2O生成,有机物一定含有C、H两种元素,则①正确;
CO2中C元素的质量4.4g×
12
44×100%=1.2g
H2O中H元素的质量2.7g×
2
18×100%=0.3g
1.2g+0.3g=1.5g<2.3g,说明有氧元素,则④正确
C、H、O元素的质量比为:1.2g:0.3g:(2.3-1.5)g=12:3:8,则⑥正确
C、H、O的原子个数比为:[1.2/12]:[0.3/1]:[0.8/16]=2:6:1,则⑤不正确
故选B点评:
本题考点: 实验探究物质的组成成分以及含量;物质组成的综合计算.
考点点评: 本题根据元素守恒来确定有机物的组成元素,利用定量计算确定氧元素,是有机物成分确定常用的方法.1年前查看全部
- (2005•安丘市)将一个不与盐酸反应的小球放入盛有盐酸的烧杯中,小球漂浮在液面上,将几枚洁净的小铁钉投入烧杯中,当不再
(2005•安丘市)将一个不与盐酸反应的小球放入盛有盐酸的烧杯中,小球漂浮在液面上,将几枚洁净的小铁钉投入烧杯中,当不再有气泡逸出时(忽略溶液体积的变化),小球的位置与开始时比较,将( )
A.上浮一些
B.不变
C.下沉一些
D.无法判断 252521651年前1
252521651年前1 -
 c7819 共回答了21个问题
c7819 共回答了21个问题 |采纳率85.7%解题思路:运用溶液的密度增大会使小球上浮,液体密度越大所受的浮力就越大解答.稀盐酸和铁反应生成氯化亚铁和氢气,氯化亚铁溶于水所以溶液的密度变大,小球受到的浮力等于液体的密度乘以万有引力常数再乘以小球排开的液体的体积,所以液体的密度增大,小球受到的浮力不变等于小球自身受到的重力,液体密度变大,排开液体的体积变小浮力才不变,所以小球就上浮,故A说法正确.
故答案选A.点评:
本题考点: 金属的化学性质.
考点点评: 解答该题只要分析清楚变化前后溶液的溶质质量分数的变化即可较快得出答案,要明白液体的浮力和液体的密度有关.1年前查看全部
- (2005•安丘市)常用燃烧法测定有机物的组成.现取2.3 g某有机物在足量的氧气中完全燃烧,生成4.4
(2005•安丘市)常用燃烧法测定有机物的组成.现取2.3 g某有机物在足量的氧气中完全燃烧,生成4.4 g CO2和2.7 g H2O.对该物质的组成有下列推断:①一定含C、H元素②一定不含O元素③可能含O元素④一定含O元素⑤分子中C、H的原子个数比为2:5⑥分子中C、H、O的元素质量比为12:3:8.其中正确的是( )
A. ①②⑤
B. ①④⑥
C. ①③⑤
D. ①④⑤ 春水无恨1年前1
春水无恨1年前1 -
 21岁女孩 共回答了15个问题
21岁女孩 共回答了15个问题 |采纳率100%解题思路:本题根据有 CO2和 H2O生成,说明有机物一定含有C、H两种元素;氧元素要计算CO2和 H2O中C、H两种元素的质量,若质量和小于2.3 g,则有氧元素,相等则不含氧元素;然后可进一步计算元素质量比和原子个数比.由题意,反应后 CO2和 H2O生成,有机物一定含有C、H两种元素,则①正确;
CO2中C元素的质量4.4g×
12
44×100%=1.2g
H2O中H元素的质量2.7g×
2
18×100%=0.3g
1.2g+0.3g=1.5g<2.3g,说明有氧元素,则④正确
C、H、O元素的质量比为:1.2g:0.3g:(2.3-1.5)g=12:3:8,则⑥正确
C、H、O的原子个数比为:[1.2/12]:[0.3/1]:[0.8/16]=2:6:1,则⑤不正确
故选B点评:
本题考点: 实验探究物质的组成成分以及含量;物质组成的综合计算.
考点点评: 本题根据元素守恒来确定有机物的组成元素,利用定量计算确定氧元素,是有机物成分确定常用的方法.1年前查看全部
- (2005•安丘市)若把江河湖泊水中溶解的气体收集起来,分析的结果是:氧气所占的体积大于21%,氮气所占的体积小于78%
(2005•安丘市)若把江河湖泊水中溶解的气体收集起来,分析的结果是:氧气所占的体积大于21%,氮气所占的体积小于78%,对此应得出的结论正确的是( )
A.只有空气中的氧气和氮气能溶解在天然水中
B.溶解在天然水中氧气和氮气与空气中的氧气和氮气的百分含量相同
C.天然水中溶解的氧气极少,所以在湖泊中养鱼要采取增氧措施
D.在相同条件下,氧气比氮气在水中的溶解度大一些 智芋1年前1
智芋1年前1 -
 鑫颖 共回答了25个问题
鑫颖 共回答了25个问题 |采纳率92%解题思路:根据化学常识和课本基本知识,可知空气中氮气的体积分数约是78%和氧气含量约是21%,而它们溶于水后它们的体积分数发生变化,从这一点可推出二者溶解度的差别.我们知道空气主要有氮气(N2)和氧气(O2)组成,其中氮气占空气体积的78%,氧气占空气体积的21%.而对溶于水的气体进行分析,可知其体积分数为而氮气则小于78%,氧气所占的体积大于21%,说明氮气和氧气子水中的溶解性能不同,通过分析可知氧气比氮气更易溶于水.
故选D点评:
本题考点: 测定空气里氧气含量的探究.
考点点评: 本题考查了常见物质的物理性质,学生要运用气体是溶解性来分析解决题目中的问题,此题属于基础题,难度较小.1年前查看全部
- (2005•安丘市)若把江河湖泊水中溶解的气体收集起来,分析的结果是:氧气所占的体积大于21%,氮气所占的体积小于78%
(2005•安丘市)若把江河湖泊水中溶解的气体收集起来,分析的结果是:氧气所占的体积大于21%,氮气所占的体积小于78%,对此应得出的结论正确的是( )
A. 只有空气中的氧气和氮气能溶解在天然水中
B. 溶解在天然水中氧气和氮气与空气中的氧气和氮气的百分含量相同
C. 天然水中溶解的氧气极少,所以在湖泊中养鱼要采取增氧措施
D. 在相同条件下,氧气比氮气在水中的溶解度大一些 cc劈叉1年前9
cc劈叉1年前9 -
 APPLEJ 共回答了25个问题
APPLEJ 共回答了25个问题 |采纳率100%解题思路:根据化学常识和课本基本知识,可知空气中氮气的体积分数约是78%和氧气含量约是21%,而它们溶于水后它们的体积分数发生变化,从这一点可推出二者溶解度的差别.我们知道空气主要有氮气(N2)和氧气(O2)组成,其中氮气占空气体积的78%,氧气占空气体积的21%.而对溶于水的气体进行分析,可知其体积分数为而氮气则小于78%,氧气所占的体积大于21%,说明氮气和氧气子水中的溶解性能不同,通过分析可知氧气比氮气更易溶于水.
故选D点评:
本题考点: 测定空气里氧气含量的探究.
考点点评: 本题考查了常见物质的物理性质,学生要运用气体是溶解性来分析解决题目中的问题,此题属于基础题,难度较小.1年前查看全部
- (2009•安丘市模拟)为了研究物体在两个力作用情况下的运动状态与受力情况之间的关系,某小组同学利用两辆小车、光滑平直轨
 (2009•安丘市模拟)为了研究物体在两个力作用情况下的运动状态与受力情况之间的关系,某小组同学利用两辆小车、光滑平直轨道、测力计、秒表、刻度尺等实验器材,做了如图所示的实验:用方向相反的两个水平拉力F1和F2拉着小车在光滑平直轨道上运动,用测力计测出F1和F2
(2009•安丘市模拟)为了研究物体在两个力作用情况下的运动状态与受力情况之间的关系,某小组同学利用两辆小车、光滑平直轨道、测力计、秒表、刻度尺等实验器材,做了如图所示的实验:用方向相反的两个水平拉力F1和F2拉着小车在光滑平直轨道上运动,用测力计测出F1和F2
的大小,用秒表、刻度尺等器材测出小车在不同时间内所通过的路程.(m小车1>m小车2)
(1)分析实验一和实验二中的数据,可得出的初步结论是:当物体在水平方向受到一对平衡力作用时,物体的运动状态______(选填“改变”或“不变”).请你根据所归纳的结论,把实验一中的数据补完整.次数 F1、F2大小 时间(S)
路程/Cm0 1 2 3 4 5 6 7 8 1 F1=F2=10N
(小车1)路程/Cm 0 0 0 0 0 0 2 F1=F2=10N
(小车1)路程/Cm 0 2 4 6 8 10 12 14 16 3 F1=10N F2=5N
(小车1)路程/Cm 0 1 4 9 16 25 36 49 64 4 F1=20N
F2=10N
(小车1)路程/Cm 0 2 8 18 32 50 72 98 128 5 F1=20N
F2=10N
(小车2)路程/Cm 0 3 12 27 48 75 108 147 192
(2)分析实验三或实验四中的数据,可得出的初步结论是:当物体在水平方向______时,物体的运动状态将发生改变.
(3)综合分析实验三和实验四,可得出的初步结论是:当物体受到共线、反向的两个差值不同的力作用时,在相同的时间内,物体运动状态改变的程度不同,且______.
(4)综合分析实验四和实验五,可得出的初步结论是:不同的物体在水平方向的受力情况相同时,在相同的时间内,______.
(5)某同学对后面四次实验进行综合分析以后,认为:“当物体受到力的作用时,物体就会运动”.你认为该同学的观点是______的(选填:A正确;B合理,但不完整;C错误). 三张女人1年前1
三张女人1年前1 -
 GOGO125 共回答了16个问题
GOGO125 共回答了16个问题 |采纳率93.8%解题思路:(1)根据物体受力情况可判断物体受平衡力,然后利用测量的路程和时间计算出速度,根据速度是否变化来确定物体运动状态是否改变;
(2)首先根据小车在实验三、四的受力情况判断出小车不受平衡力,通过测量的数据计算出小车此时的速度,若速度发生变化则物体运动状态就变华;
(3)比较实验三和四小车所受的合力的大小,在结合两次实验小车运动速度变化的快慢程度,可以得出此题结论;
(4)在两辆小车所受合力相等质量不相等时,通过计算小车1和小车2 的速度可以得出此题结论;
(5)根据运动和力的关系可以解决此题.(1)实验一、二中,物体受两个大小相等、方向相反、同直线、同作用点的力,是平衡力,实验一小车速度为0,故小车静止,实验二小车速度始终为2m/s,是匀速运动,静止和匀速直线运动时,物体运动状态都不会改变.既然实验三中小车静止,所以后三次路程都为0.
(2)实验三、四小车受力大小不相等,受一对非平衡力,实验三小车速度是从1m/s逐渐增加到8m/s,实验四小车的速度是从2m/s逐渐增加到16m/s,小车在做变速运动,运动状态一直在变.
(3)实验三小车所受合力为10N-5N=5N,速度是在8s的时间里从1m/s逐渐增加到8m/s,实验四小车所受合力为20N-10N=10N,速度是在8s的时间里从2m/s逐渐增加到16m/s,可以看出小车的合力越大,运动状态改变越快.
(4)实验四和实验五的小车在水平方向的受力情况相同,但是m小车1>m小车2,通过计算小车一和小车二的速度可知:小车一在相等的时间比小车二速度改变的慢,所以物体质量越大,运动状态改变越慢;
(5)物体的运动不需要力来维持,物体不受力时可以做匀速直线运动,所以该同学的观点错误,故选C.
故答案为:(1)不变,0,0,0;
(2)受非平衡力;
(3)两力的差值越大,运动状态改变越快;
(4)物体质量越大,运动状态改变越慢;
(5)C.点评:
本题考点: 平衡力的辨别;平衡状态的判断;力与运动的关系.
考点点评: 物体受平衡力和不受力的状态是一样的,都做匀速直线运动或静止.力是改变物体运动状态的原因,但不是维持运动的原因.1年前查看全部
- (2010•安丘市模拟)如图所示,在实验室用两端带有竖直挡板C和D的气垫导轨和有固定挡板的质量都是M的滑块A和B做“探究
 (2010•安丘市模拟)如图所示,在实验室用两端带有竖直挡板C和D的气垫导轨和有固定挡板的质量都是M的滑块A和B做“探究碰撞中的守恒量”的实验,实验步骤如下:
(2010•安丘市模拟)如图所示,在实验室用两端带有竖直挡板C和D的气垫导轨和有固定挡板的质量都是M的滑块A和B做“探究碰撞中的守恒量”的实验,实验步骤如下:
I.把两滑块A和B紧贴在一起,在A上放质量为m的砝码,置于导轨上,用电动卡销卡住A和B,在A和B的固定挡板间放入一弹簧,使弹簧处于水平方向上的压缩状态;
II.按下电钮使电动卡销放开,同时启动两个记录两滑块运动时间的电子计时器,当A和B与固定挡板C和D碰撞同时,电子计时器自动停表,记下A至C的运动时间t1,B至D的运动时间t2;
III.重复几次,取t1和t2的平均值.
①在调整气垫导轨时应注意______;
②应测量的数据还有______;
③只要关系式(M+m)
=Ms1 t1 s2 t2 (M+m)成立,即可得出碰撞中守恒的量是mv的矢量和.
=Ms1 t1 s2 t2  gegejing1年前1
gegejing1年前1 -
 老骚 共回答了15个问题
老骚 共回答了15个问题 |采纳率93.3%解题思路:为保证释放滑块后(与弹簧分离后)滑块应做匀速直线运动,实验前应调节气垫导轨水平;实验过程中需要测出两滑块分别当挡板的运动时间与到挡板的距离,由速度公式求出速度,然后看两滑块与对应速度的乘积是否相等.①为了使滑块做匀速运动,在调整气垫导轨时应注意使气垫导轨水平;
②除了测出滑块的运动时间外,实验还应测出滑块A的左端到挡板C的距离s1和滑块B的右端到挡板D的距离s2;
③滑块A的速度vA=
s1
t1,滑块B的速度vB=
s2
t2,如果关系式(M+m)vA=MvB,即:(M+m)
s1
t1=M
s2
t2成立,即可得出碰撞中守恒的量是mv的矢量和.
故答案为:①使气垫导轨水平;②滑块A的左端到挡板C的距离s1和滑块B的右端到挡板D的距离s2;
③(M+m)
s1
t1=M
s2
t2.点评:
本题考点: 验证动量守恒定律.
考点点评: 本题考查了探究碰撞中的守恒量”实验的实验注意事项、实验原理与表达式,难度不大,掌握基础知识即可正确解题.利用位移或位移与时间的比值表示物体的速度是物理实验中常用的一种方法,要注意掌握.1年前查看全部
- (2005•安丘市)常用燃烧法测定有机物的组成.现取2.3 g某有机物在足量的氧气中完全燃烧,生成4.4
(2005•安丘市)常用燃烧法测定有机物的组成.现取2.3 g某有机物在足量的氧气中完全燃烧,生成4.4 g CO2和2.7 g H2O.对该物质的组成有下列推断:①一定含C、H元素②一定不含O元素③可能含O元素④一定含O元素⑤分子中C、H的原子个数比为2:5⑥分子中C、H、O的元素质量比为12:3:8.其中正确的是( )
A.①②⑤
B.①④⑥
C.①③⑤
D.①④⑤ lidongming051年前1
lidongming051年前1 -
 坏de彻底 共回答了13个问题
坏de彻底 共回答了13个问题 |采纳率76.9%解题思路:本题根据有 CO2和 H2O生成,说明有机物一定含有C、H两种元素;氧元素要计算CO2和 H2O中C、H两种元素的质量,若质量和小于2.3 g,则有氧元素,相等则不含氧元素;然后可进一步计算元素质量比和原子个数比.由题意,反应后 CO2和 H2O生成,有机物一定含有C、H两种元素,则①正确;
CO2中C元素的质量4.4g×
12
44×100%=1.2g
H2O中H元素的质量2.7g×
2
18×100%=0.3g
1.2g+0.3g=1.5g<2.3g,说明有氧元素,则④正确
C、H、O元素的质量比为:1.2g:0.3g:(2.3-1.5)g=12:3:8,则⑥正确
C、H、O的原子个数比为:[1.2/12]:[0.3/1]:[0.8/16]=2:6:1,则⑤不正确
故选B点评:
本题考点: 实验探究物质的组成成分以及含量;物质组成的综合计算.
考点点评: 本题根据元素守恒来确定有机物的组成元素,利用定量计算确定氧元素,是有机物成分确定常用的方法.1年前查看全部
- (2005•安丘市)2004年,美国科学家通过“勇气”号太空车探测出火星大气中含有一种称为硫化羰(化学式为COS,羰音t
(2005•安丘市)2004年,美国科学家通过“勇气”号太空车探测出火星大气中含有一种称为硫化羰(化学式为COS,羰音tang)的物质,已知硫化羰与二氧化碳的结构相似,但能在氧气中完全燃烧,下列有关硫化羰的说法正确的是( )
A. 硫化羰是酸性氧化物
B. 相同条件下,硫化羰的密度比空气大
C. 硫化羰可用作灭火剂
D. 硫化羰在氧气中完全燃烧后的生成物是CO2和SO3 贺兰容容BB1年前1
贺兰容容BB1年前1 -
 tczfr 共回答了19个问题
tczfr 共回答了19个问题 |采纳率84.2%解题思路:根据氧化物是指由两种元素组成且其中一种是氧元素的化合物,硫化羰的化学式COS及性质描述,对有关的硫化羰的说法进行正误判断.硫化羰由C、O、S三种元素组成的化合物,其相对分子质量=12+16+32=60;A、硫化羰(化学式为COS)它是由三种元素组成的,故不属于氧化物.说法错误;
B、硫化羰的相对分子质量为60大于29,则硫化羰的密度大于空气.说法正确;
C、硫化羰可燃,能在氧气中完全燃烧,故不能做灭火剂,说法错误;
D、根据燃烧规律:含碳元素的物质燃烧生成二氧化碳,含硫元素物质燃烧生成二氧化硫;所以由C、O、S元素组成的硫化羰完全燃烧的产生为二氧化硫和二氧化碳.说法错误.
故选B点评:
本题考点: 从组成上识别氧化物;化学性质与物理性质的差别及应用;完全燃烧与不完全燃烧.
考点点评: 空气的平均相对分子质量为29,若气体的相对分子质量大于29,该气体的密度大于空气;若气体的相对分子质量小于29,该气体的密度小于空气.1年前查看全部
- (2010•安丘市模拟)如图所示,一簇电场线的分布关于y轴对称,O是坐标原点,M、N、P、Q是以O为圆心的一个圆周上的四
 (2010•安丘市模拟)如图所示,一簇电场线的分布关于y轴对称,O是坐标原点,M、N、P、Q是以O为圆心的一个圆周上的四个点,其中M、N在y轴上,Q点在x轴上,则( )
(2010•安丘市模拟)如图所示,一簇电场线的分布关于y轴对称,O是坐标原点,M、N、P、Q是以O为圆心的一个圆周上的四个点,其中M、N在y轴上,Q点在x轴上,则( )
A.M点的电势比P点的电势低
B.O、M间的电势差小于N、O间的电势差
C.一正电荷在O点时的电势能小于在Q点时的电势能
D.将一负电荷由M点移到P点,电场力做正功 dj7411171年前1
dj7411171年前1 -
 gaoyanbo 共回答了15个问题
gaoyanbo 共回答了15个问题 |采纳率93.3%A、根据顺着电场线的方向电势降低可知,M点的电势比P点的电势低.故A正确.
B、O、M间的场强小于N、O间的场强,OM=NO,由公式U=Ed分析得知,O、M间的电势差小于N、O间的电势差.故B正确.
C、由图可得到,O点的电势高于Q点的电势,根据推论:正电荷在电势高处电势能大,则正电荷在O点时的电势能大于在Q点时的电势能.故C错误.
D、M点的电势比P点的电势低,则负电荷在M点的电势能比在P点的电势能大,所以将一负电荷由M点移到P点时,电势能减小,电场力将正功.故D正确.
故选ABD1年前查看全部
- (2005•安丘市)纳米(nm)是一种长度单位,1nm=10-9m,纳米科技开辟了人类认识世界的新层面.纳米材料科技是纳
(2005•安丘市)纳米(nm)是一种长度单位,1nm=10-9m,纳米科技开辟了人类认识世界的新层面.纳米材料科技是纳米科技最基本的组成部分,把固体物质加工到纳米级(1nm~100nm)的超细粉末,即可得到纳米材料.这种加工过程属于( )
A. 物理变化
B. 化学变化
C. 既有物理变化又有化学变化
D. 既不是物理变化又不是化学变化 爱大余的小思1年前1
爱大余的小思1年前1 -
 周rr 共回答了14个问题
周rr 共回答了14个问题 |采纳率71.4%解题思路:化学变化是指有新物质生成的变化.物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别是否有新物质生成.把固体物质加工到纳米级超细粉末的过程中,只是物质的颗粒大小即形状发生了改变,没有新物质生成,属于物理变化.
故选A.点评:
本题考点: 化学变化和物理变化的判别.
考点点评: 解答本题要分析变化过程中是否有新物质生成,如果没有新物质生成就属于物理变化.1年前查看全部
- (2005•安丘市)抗氧化剂能吸收氧气,降低食品内部及周围的含氧量,阻止氧气的食品发生氧化反应,从而延长食品的保持期.小
(2005•安丘市)抗氧化剂能吸收氧气,降低食品内部及周围的含氧量,阻止氧气的食品发生氧化反应,从而延长食品的保持期.小明发现新买来的高级月饼的包装盒内有一个印有“抗氧化剂”的小包,内装灰黑色粉末,其成份可能是( )
A. 铁粉
B. 氢氧化钠
C. 二氧化锰
D. 生石灰 ilxg011年前4
ilxg011年前4 -
 bengniu 共回答了26个问题
bengniu 共回答了26个问题 |采纳率84.6%解题思路:根据题意可以知道既然是抗氧化剂,肯定是用来吸收氧气的,所以可以根据所给物质的性质来判断能否吸收氧气来选择.A、铁粉能够和空气中的水和氧气反应,可以作为抗氧化剂来使用,且铁粉为灰黑色粉末,故A可能;
B、氢氧化钠能吸收水分,但是不能起到抗氧化剂的作用,故B不可能;
C、二氧化锰不能够和氧气反应,所以不能用来除去氧气,故C不可能;
D、生石灰是常用的干燥剂,但是不能和阻止氧气和食品的反应,故D不可能.
故选A.点评:
本题考点: 食品干燥剂、保鲜剂和真空包装的成分探究;金属的化学性质.
考点点评: 解答本题要分析物质在通常情况下能否和氧气反应,并且应该考虑这种物质的实际的颜色.1年前查看全部
- (2010•安丘市模拟)如图所示,相距为l的光滑平行金属导轨ab、cd放置在水平桌面上,阻值为R的电阻与导轨的两端a、c
 (2010•安丘市模拟)如图所示,相距为l的光滑平行金属导轨ab、cd放置在水平桌面上,阻值为R的电阻与导轨的两端a、c相连.滑杆MN质量为m,垂直于导轨并可在导轨上自由滑动,不计导轨、滑杆以及导线的电阻.整个装置放于竖直方向的范围足够大的匀强磁场中,磁感应强度的大小为B.滑杆的中点系一不可伸长的轻绳,绳绕过固定在桌边的光滑轻滑轮后,与另一质量也为m的物块相连,绳处于拉直状态.现将物块由静止释放,当物块达到最大速度时,物块的下落高度h=
(2010•安丘市模拟)如图所示,相距为l的光滑平行金属导轨ab、cd放置在水平桌面上,阻值为R的电阻与导轨的两端a、c相连.滑杆MN质量为m,垂直于导轨并可在导轨上自由滑动,不计导轨、滑杆以及导线的电阻.整个装置放于竖直方向的范围足够大的匀强磁场中,磁感应强度的大小为B.滑杆的中点系一不可伸长的轻绳,绳绕过固定在桌边的光滑轻滑轮后,与另一质量也为m的物块相连,绳处于拉直状态.现将物块由静止释放,当物块达到最大速度时,物块的下落高度h=
,用g表示重力加速度,则在物块由静止开始下落至速度最大的过程中( )2m2gR2 (Bl)4
A.物块达到的最大速度是mgR (Bl)2
B.通过电阻R的电荷量是2Bm2gRl (Bl)4
C.电阻R放出的热量为2m3g2R2 (Bl)4
D.滑杆MN产生的最大感应电动势为[mgR/Bl] tomobetter1年前1
tomobetter1年前1 -
 鸟龙菜 共回答了9个问题
鸟龙菜 共回答了9个问题 |采纳率88.9%解题思路:当棒子所受的安培力等于绳子拉力时,速度最大,根据平衡,结合闭合电路欧姆定律求出最大速度.根据能量守恒求出此过程中电阻R上放出的热量.求出速度最大时的感应电动势大小,从而根据功率的公式求出电阻R上消耗的功率.A、当FA=mg时,速度最大,有:
B2L2v
R=mg,则最大速度v=[mgR
B2L2.故A正确,
B、通过电阻R的横截面积的电荷量q=It=
△∅/R=
B•△S
R]=[B•Lh/R=
2BRgLm2
(BL)4],故B正确;
C、根据能量守恒得,mgh=[1/2]mv2+Q,解得Q=mgh-[1/2]mv2=
2m3g2R2
(BL)4−
1
2m
m2g2R2
(BL)4=
3m3g2R2
2(BL)4.故C错误.
D、物块速度最大时,产生的感应电动势E=Blv=[mgR/BL].故D正确.
故选ABD.点评:
本题考点: 导体切割磁感线时的感应电动势;闭合电路的欧姆定律.
考点点评: 解决本题的关键知道当棒子所受的安培力和绳子拉力相等时,速度最大.以及会根据能量守恒定律求出电阻R上消耗的热量.1年前查看全部
- (2009•安丘市模拟)如图所示,小磁针在纸面内能自由转动.则闭合开关后,下列说法正确的是( )
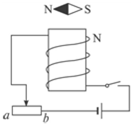 (2009•安丘市模拟)如图所示,小磁针在纸面内能自由转动.则闭合开关后,下列说法正确的是( )
(2009•安丘市模拟)如图所示,小磁针在纸面内能自由转动.则闭合开关后,下列说法正确的是( )
A.小磁针将沿顺时针方向转动
B.小磁针将沿逆时针方向转动
C.当滑动变阻器的滑片向b移动时,小磁针的转动方向不变
D.当滑动变阻器的滑片向a移动时,通电螺线管的磁性将减弱 南海雷神1年前1
南海雷神1年前1 -
 鲁迅 共回答了28个问题
鲁迅 共回答了28个问题 |采纳率96.4%解题思路:由右手螺旋定则可得出螺线管的磁极,则由磁极间的相互作用可得出小磁针的转动方向;由滑片的移动可知滑动变阻器接入电阻的变化,则由欧姆定律可得出线圈中电流的变化,则可知螺线管磁性的变化.由图可知电流由螺线管下方流入,则用右手握住螺线管,四指沿电流方向,则大拇指向上,故螺线管上方为N极;因同名磁极相互排斥,异名磁极相互吸引,则小磁针S将向螺线管靠近,N极远离螺线管,故小磁针将顺时针转动;...
点评:
本题考点: 通电螺线管的极性和电流方向的判断.
考点点评: 本题综合了电路知识及磁场的性质,考查了欧姆定律及磁极间的相互作用,是道好题.1年前查看全部
- (2005•安丘市)生产、生活中的废物、污水未经处理就直接排放,是造成水体富营养化、河水被污染的重要原因.右图是长江中游
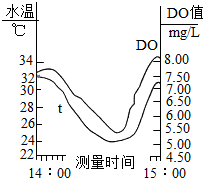 (2005•安丘市)生产、生活中的废物、污水未经处理就直接排放,是造成水体富营养化、河水被污染的重要原因.右图是长江中游某水质监测站在2007年8月的某天DO(溶解氧)的实测数据,下表为不同温度下DO(溶解氧)饱和值表:
(2005•安丘市)生产、生活中的废物、污水未经处理就直接排放,是造成水体富营养化、河水被污染的重要原因.右图是长江中游某水质监测站在2007年8月的某天DO(溶解氧)的实测数据,下表为不同温度下DO(溶解氧)饱和值表:
仔细观察实测数据和上表,回答问题:水温/℃ 25 26 27 29 31 32 34 DO饱和值/mg•L-1 8.15 8.00 7.85 7.65 7.43 7.30 7.20
(1)在凌晨零点时,河水中的DO(溶解氧)仅为该温度下的DO饱和值的75%~80%;但在午后,DO出现过饱和,如在15时,DO饱和度可高达1 10%,造成上述现象的主要原因______.
(2)河水里的微生物使有机物(化学式以C6H10O5为代表)与溶解在水中的氧气作用而转化为CO2和H2O的过程中所需的O2的量叫做BOD(生化需氧量),BOD是衡量水体质量的一个指标.当天该水质监测站测得河水中所含有机物的质量折合成C6H10O5为0.010g•L-1,通过计算回答:①该河段水体的BOD(生化需氧量)为______mg•L-1;②该河段适合鱼类生存吗(设水温为25℃)?______理由是:______. 云雨er1年前1
云雨er1年前1 -
 dreampool 共回答了29个问题
dreampool 共回答了29个问题 |采纳率86.2%解题思路:(1)依据水生植物、动物的呼吸作用和水生植物的光合作用分析;
(2)根据题意可知1L河水中有机物的质量,由有机物的质量根据有机物转化的化学方程式可以计算出转化1L河水中的有机物所需氧气的质量,即该河水的生化需氧量,用河水的生化需氧量跟氧气的溶解量比较就可以知道该河中的鱼类能否维持生命.(1)午夜时水中的水生植物、水生动物发生呼吸作用,消耗水中大量氧气;而午后光照最强,水生植物光合作用增强,产生大量氧气;
(2)由题意“C6H10O5为0.010g•L-1”即可得到1L河水中有机物的质量为0.01g1L河水的质量为0.01g
设转化0.01g有机物需要氧气的质量为x.
C6H10O5+6O2
酶
.
6CO2+5H2O
162192
0.01g x
[162/192]=[0.01g/x]
x≈0.01185g≈11.85mg
由于11.85>8.15,因此该河中的鱼类不能维持生命,会因缺氧死亡.
故答案为:
(1)水温升高,DO饱和值下降:光照增强,水生植物光合作用加强,产氧量增加;
(2)①11.85;
②不适合鱼类生存;因为25℃饱和DO值为8.15 mgL-1,小于BOD的11.85 mg.L-1,会造成鱼类缺氧.点评:
本题考点: 水资源的污染与防治;根据化学反应方程式的计算;保护水资源和节约用水.
考点点评: 结合生物学中的呼吸作用、光合作用,并根据题目信息,找出反应物和生成物,根据质量守恒定律,正确书写化学方程式进行计算,分析,难度较大.1年前查看全部
- (2005•安丘市)2004年,美国科学家通过“勇气”号太空车探测出火星大气中含有一种称为硫化羰(化学式为COS,羰音t
(2005•安丘市)2004年,美国科学家通过“勇气”号太空车探测出火星大气中含有一种称为硫化羰(化学式为COS,羰音tang)的物质,已知硫化羰与二氧化碳的结构相似,但能在氧气中完全燃烧,下列有关硫化羰的说法正确的是( )
A. 硫化羰是酸性氧化物
B. 相同条件下,硫化羰的密度比空气大
C. 硫化羰可用作灭火剂
D. 硫化羰在氧气中完全燃烧后的生成物是CO2和SO3 mejj1年前2
mejj1年前2 -
 希奇_园园 共回答了22个问题
希奇_园园 共回答了22个问题 |采纳率90.9%解题思路:根据氧化物是指由两种元素组成且其中一种是氧元素的化合物,硫化羰的化学式COS及性质描述,对有关的硫化羰的说法进行正误判断.硫化羰由C、O、S三种元素组成的化合物,其相对分子质量=12+16+32=60;A、硫化羰(化学式为COS)它是由三种元素组成的,故不属于氧化物.说法错误;
B、硫化羰的相对分子质量为60大于29,则硫化羰的密度大于空气.说法正确;
C、硫化羰可燃,能在氧气中完全燃烧,故不能做灭火剂,说法错误;
D、根据燃烧规律:含碳元素的物质燃烧生成二氧化碳,含硫元素物质燃烧生成二氧化硫;所以由C、O、S元素组成的硫化羰完全燃烧的产生为二氧化硫和二氧化碳.说法错误.
故选B点评:
本题考点: 从组成上识别氧化物;化学性质与物理性质的差别及应用;完全燃烧与不完全燃烧.
考点点评: 空气的平均相对分子质量为29,若气体的相对分子质量大于29,该气体的密度大于空气;若气体的相对分子质量小于29,该气体的密度小于空气.1年前查看全部
- (2005•安丘市)二氧化硫是大气污染物之一.我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二
 (2005•安丘市)二氧化硫是大气污染物之一.我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如表所示:
(2005•安丘市)二氧化硫是大气污染物之一.我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如表所示:
为测定某地空气中二氧化硫的含量,某中学环保小组按如图所示的实验装置进行如下实验:向试管中加入一定量的含碘(I.)1.27mg的碘水,再加入2~3滴淀粉溶液(淀粉遇I2变蓝色),通过抽气装置抽气,使空气由导气管进入试管与碘水充分接触,当溶液由蓝色变为无色时,恰好完全反应.反应的化学方程式是:S02+I2+2H20═H2SO4+2HI.实验过程中进入试管内的空气的总体积为1 000L.请通过计算说明该法测定的此空气中二氧化硫的浓度级别.浓度限值(mg/m3) 一级标准 二级标准 三级标准
0.15 0.50 0.70 卡每1年前1
卡每1年前1 -
 独舞在天台 共回答了16个问题
独舞在天台 共回答了16个问题 |采纳率81.3%解题思路:根据反应的化学方程式,由恰好完全反应消耗碘的质量计算出1000L空气中所含二氧化硫的质量,转化为标准表示法mg/m3,与级别标准对比,判断出空气中二氧化硫的浓度级别.1000L=1m3
设1m3空气中含SO2质量为x
S02+I2+2H20═H2SO4+2HI
64 254
x 1.27mg
[64/254=
x
1.27mg] x=0.32mg
空气中SO2浓度=0.32mg÷1m3=0.32mg/m3
由于0.15mg/m3<0.32mg/m3<0.5mg/m3,说明此空气中二氧化硫的浓度为二级
答:此空气中二氧化硫的浓度为二级.点评:
本题考点: 化学在环境监测与环境保护中的重要作用;根据化学反应方程式的计算.
考点点评: 本题为根据化学方程式的基本计算,在最后与级别标准对比时要注意:根据化学方程式计算所得值为空气中二氧化硫的质量,还需要转换成标准值.1年前查看全部
- (2005•安丘市)抗氧化剂能吸收氧气,降低食品内部及周围的含氧量,阻止氧气的食品发生氧化反应,从而延长食品的保持期.小
(2005•安丘市)抗氧化剂能吸收氧气,降低食品内部及周围的含氧量,阻止氧气的食品发生氧化反应,从而延长食品的保持期.小明发现新买来的高级月饼的包装盒内有一个印有“抗氧化剂”的小包,内装灰黑色粉末,其成份可能是( )
A. 铁粉
B. 氢氧化钠
C. 二氧化锰
D. 生石灰 黑龙MM1年前1
黑龙MM1年前1 -
 单身Gui族 共回答了18个问题
单身Gui族 共回答了18个问题 |采纳率83.3%解题思路:根据题意可以知道既然是抗氧化剂,肯定是用来吸收氧气的,所以可以根据所给物质的性质来判断能否吸收氧气来选择.A、铁粉能够和空气中的水和氧气反应,可以作为抗氧化剂来使用,且铁粉为灰黑色粉末,故A可能;
B、氢氧化钠能吸收水分,但是不能起到抗氧化剂的作用,故B不可能;
C、二氧化锰不能够和氧气反应,所以不能用来除去氧气,故C不可能;
D、生石灰是常用的干燥剂,但是不能和阻止氧气和食品的反应,故D不可能.
故选A.点评:
本题考点: 食品干燥剂、保鲜剂和真空包装的成分探究;金属的化学性质.
考点点评: 解答本题要分析物质在通常情况下能否和氧气反应,并且应该考虑这种物质的实际的颜色.1年前查看全部
大家在问
- 1式子“1+2+3+4+…+100”表示从1开始的100个连续自然数的和,由于式子比较长,书写不方便,为了简便起见,我们将
- 2我们能从各个方向看到花园里盛开的鲜花,这是由于光在鲜花表面( ) A.发生镜面反射 B.发生漫反射 C.沿直线传播 D
- 3___others play football is my hobby. A. Watch.
- 4Have you ever studied abroad? If you come to Australia as a
- 5请问以下小文怎么译成英文?上海最热的时候,温度在28--38度,可能会出现连续的35度以上的高温天气,午后有可能会出现短
- 6求教一个考研数学概率问题 只有这么多分了 希望懂的大哥帮忙下
- 7在三角形ABC中,角A,角B,角C所对的分别为a,b,c,若角A:角B=1:2,且a:b=1:根号3,求cos2B
- 8用代入法解下列方程:1.{3m-5n=0,2m-3n=1.2.{4y-3x=4,4x-5y=-3.3.{3x+2y=5,
- 9英语翻译
- 10超弦理论的十维空间
- 11在轴对称图形中,对称轴两侧相对的点到对称轴的距离(),圆有()对称轴,半圆()圆环(),()三角形有三条对称轴()三角形
- 12I have lost( )in fhysics,but I like math very much
- 13在X克水中加入a克盐,此时盐水浓度是?(一般数学题,用代数式表示)
- 14一些果汁怎么样? 怎么翻译
- 15When the UFO(landed/was landing),the dog (slept/was sleeping
