焦炭是怎样制得的
 wuxianwang2022-10-04 11:39:543条回答
wuxianwang2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 guolei0804 共回答了12个问题
guolei0804 共回答了12个问题 |采纳率91.7%- 烟煤在隔绝空气的条件下,加热到950-1050℃,经过干燥、热解、熔融、粘结、固化、收缩等阶段最终制成焦炭,这一过程叫高温炼焦(高温干馏).由高温炼焦得到的焦炭用于高炉冶炼、铸造和气化.炼焦过程中产生的经回收、净化后的焦炉煤气既是高热值的燃料,又是重要的有机合成工业原料.
- 1年前
 酷子 共回答了2个问题
酷子 共回答了2个问题 |采纳率- 简单的说就是 煤的不完全燃烧形成的产物
- 1年前
 众神的ee都 共回答了21个问题
众神的ee都 共回答了21个问题 |采纳率81%- 焦炭是电石生产的原材料,我们需将焦炭的含水量降低,除去焦炭中的水份,供电石使用,
- 1年前
相关推荐
- 焦炭用于治金业属于化学变化还是物理变化
 smartWu1年前2
smartWu1年前2 -
 amici 共回答了11个问题
amici 共回答了11个问题 |采纳率100%肯定是化学变化
比如 焦炭炼铁 Fe2O3变成了Fe CO 变成了CO2 都生成了新的物质,当然是化学变化1年前查看全部
- 煤高温干馏的产物中,可用作气体燃料的是 A.焦炭 B.煤焦油 C.焦炉气 D.粗氨水
煤高温干馏的产物中,可用作气体燃料的是 A.焦炭 B.煤焦油 C.焦炉气 D.粗氨水
煤高温干馏的产物中,可用作气体燃料的是
A.焦炭
B.煤焦油
C.焦炉气
D.粗氨水 brightstu1年前1
brightstu1年前1 -
 预产期3月8日 共回答了17个问题
预产期3月8日 共回答了17个问题 |采纳率94.1%焦炉气,因为题中说了是气体燃料,焦炭是固体,煤焦油和粗氨水都是液体,只有焦炉气是气体,而且焦炉气的主要成分是氢气、甲烷和少量一氧化碳都是可燃气体.1年前查看全部
- 已知在相同的温度和压强下,任何气体的体积和分子数成正比.在一体积空气中混入一体积二氧化碳,在高温下和足量的焦炭反应,假设
已知在相同的温度和压强下,任何气体的体积和分子数成正比.在一体积空气中混入一体积二氧化碳,在高温下和足量的焦炭反应,假设氧气和二氧化碳都转化为一氧化碳,则反应后气体中一氧化碳的体积百分含量约是
A.33% B.50% C.76% D.80%
说明为什么, 任性天空1年前5
任性天空1年前5 -
 weweslove 共回答了15个问题
weweslove 共回答了15个问题 |采纳率80%给个好理解的办法
分两部分 只考虑原料和生成物(比例) 忽略反应过程 假设气压不变化(但是体积变化)
第一部分
氧气在空气中的体积百分数约为五分之一(实际是21% 比这个多) 氧气1份 其他4份
氧气为O2 变成CO后 体积大一倍 这时这部分气体总量为6份 CO有2份 其他4份
第二部分
和第一部分一样大 同为5份 CO2变成CO 氧元素守恒 全变成CO 体积增大一倍 相当于CO有10份
合起来 生成物中 CO有12份 其他4份 CO含量75% 考虑到空气中实际氧气含量高于20% 故选择C1年前查看全部
- 为什么焦炭能还原SiO2,而硅不能还原CO2,si的还原性不是比c强吗
 sushe1年前1
sushe1年前1 -
 abin1211 共回答了17个问题
abin1211 共回答了17个问题 |采纳率88.2%对于同主族元素,从上到下,金属性增强,还原性增强.而Si在C的下方,所以Si还原性比C强.
对于反应2C + SiO2 =高温= Si + 2CO,这个并不矛盾,实际上Si的金属性是比C强,但这个反应也能发生,首先要清楚,两种物质之间,没有绝对的不发生反应,只有反应程度不同,反应中存在平衡.
首先让你看下面这个反应:
KCl+Na——K+NaCl 反应条件是高温800度左右,这个反应能够发生,但是K的金属性要比Na强,这个反应能发生的理由是,K在800度这个温度时,差不多要沸腾了,很容易挥发,而Na在这个温度时仍然是液态,因此,在反应过程中,K能够不断被挥发出来,从而发生这个反应.
SiO2+2c=Si+2CO 这个反应能够发生的理由和这个相似,CO是气态,能够促使反应向右边移动,于是反应就不断的发生了.1年前查看全部
- 为什么二氧化硅与焦炭反应生成的是一氧化碳?
 清爽夏天11年前1
清爽夏天11年前1 -
 nakle 共回答了19个问题
nakle 共回答了19个问题 |采纳率89.5%原因是原本产生CO2在高温条件下再与C反应生成CO,两个方程叠加,总反应式中就写CO1年前查看全部
- 焦炭与二氧化碳反应是吸热还是放热
 zhanchen9204121年前5
zhanchen9204121年前5 -
 kowinchan 共回答了17个问题
kowinchan 共回答了17个问题 |采纳率100%C + CO2 = 高温= 2CO
需要持续加入才能进行,所以是吸热反应.1年前查看全部
- 红热的焦炭与水蒸气反应的化学方程式
红热的焦炭与水蒸气反应的化学方程式
很急! qj291年前3
qj291年前3 -
 蓝天高歌 共回答了19个问题
蓝天高歌 共回答了19个问题 |采纳率100%C+H2O=CO+H2反应条件是高温哈………这个方程式很重要1年前查看全部
- 高炉炼铁时焦炭的作用写出两点
 益母草11年前2
益母草11年前2 -
 热血少年 共回答了18个问题
热血少年 共回答了18个问题 |采纳率100%1.焦炭本身有还原性,可还原铁矿石
2.与氧气不完全反应制成一氧化碳(还原剂)还原铁矿石1年前查看全部
- 高炉炼铁中焦炭的作用
 docxushu1年前1
docxushu1年前1 -
 李小猫ss 共回答了21个问题
李小猫ss 共回答了21个问题 |采纳率90.5%焦炭不完全燃烧生成一氧化碳,再还原氧化铁1年前查看全部
- 焦炭、木炭、活性炭、炭黑、颜色焦炭、木炭、活性炭、炭黑的颜色状态金刚石、石墨的熔点、导热性
 我好发愁1年前1
我好发愁1年前1 -
 浅浅依蓝 共回答了18个问题
浅浅依蓝 共回答了18个问题 |采纳率88.9%焦炭,木炭,活性炭和碳黑都是黑色.金刚石和石墨都是非金属,象熔点,导热性等物理量都是针对金属和非金属晶体的,非金属一般不参与比较.这是因为一般非金属它们升温后是由固态直接变为气态,(升华现象)不经历液态,因此不存在“熔点”.也有的非金属升温后发生了性质变化,由一种物质变成了另一种物质了.导热性也一样,涉及到了温度对物质的影响,理由同上.1年前查看全部
- 100吨煤可炼焦炭95吨,照这样计算,10吨、1000吨煤可炼焦炭多少吨?
 娃哈哈8x2d1年前2
娃哈哈8x2d1年前2 -
 歪嘴歪牙 共回答了19个问题
歪嘴歪牙 共回答了19个问题 |采纳率100%解题思路:先根据每吨煤炼焦碳吨数=焦炭吨数÷煤的吨数,求出每吨煤炼焦碳吨数,再根据煤炼焦碳吨数=每吨煤炼焦碳吨数×煤的吨数即可解答.95÷100×10,
=0.95×10,
=9.5(吨),
答:10吨煤可炼焦炭9.5吨;
95÷100×1000,
=0.95×1000,
=950(吨),
答:1000吨煤可炼焦炭950吨.点评:
本题考点: 简单的归一应用题.
考点点评: 依据等量关系式:每吨煤炼焦碳吨数=焦炭吨数÷煤的吨数,求出每吨煤炼焦碳吨数,是解答本题的关键.1年前查看全部
- 下列有关物质的性质或应用的说法中正确的是 A.铝合金是一种混合物,它比纯铝的熔点高 B.高炉中的主要反应是高温下焦炭和氧
下列有关物质的性质或应用的说法中正确的是
A.铝合金是一种混合物,它比纯铝的熔点高 B.高炉中的主要反应是高温下焦炭和氧化铁直接作用炼出生铁 C.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO 4 溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜 D.电解从海水中得到的氯化镁溶液可获得金属镁  血色胭脂1年前1
血色胭脂1年前1 -
 浪漫剑侠 共回答了12个问题
浪漫剑侠 共回答了12个问题 |采纳率91.7%C
A:合金的熔点低于其各组分的熔点,排除
B:高炉中的主要反应是高温下焦炭首先氧化为CO,再还原氧化铁生成铁,不正确
C:常温下铁在浓硝酸中发生钝化,形成致密的氧化膜,阻止了铁与其它物质的反应,正确
D:依据离子放电顺序,电解氯化镁溶液时:MgCl 2 +2H 2 O=Mg(OH) 2 ↓+Cl 2 ↑+H 2 ↑,不能得到镁,不正确
答案为C1年前查看全部
- 红热的焦炭和水蒸气反应是不是离子反应,为什么
 足球的旁边1年前5
足球的旁边1年前5 -
 来出郭 共回答了19个问题
来出郭 共回答了19个问题 |采纳率89.5%不是,这是固体与气体在高温下的反应,
离子反应一般在溶液中发生1年前查看全部
- 高炉炼铁中,风口前焦炭循环区的物理结构如何?
 bshrk1年前1
bshrk1年前1 -
 贺ii 共回答了19个问题
贺ii 共回答了19个问题 |采纳率100%结构疏松,也就是疏松层,随鼓风做激烈回旋运动,一般情况下风口上是看不到的;鼓风动能较低或炉缸工作不好能看到.1年前查看全部
- 几种燃料的热值(J/kg) 柴油 4.3×107 焦炭 3.0×107 酒精 3.0×107 氢 1.4×108 汽油
小明从表中提供的信息中,得出以下几个结论,其中正确的是( )几种燃料的热值(J/kg) 柴油 4.3×107 焦炭 3.0×107 酒精 3.0×107 氢 1.4×108 汽油 4.6×107 煤气 约3.9×107J/m3 木炭 3.4×107 沼气 1.9×107J/m3
A. 热值大的燃料燃烧时放出的热量多
B. 1千克汽油燃烧时放出的热量是4.6×107焦耳
C. 木炭燃烧不充分时其热值会变小
D. 2m3的沼气完全燃烧时放出的热量是3.8×107焦耳 tangwf1年前1
tangwf1年前1 -
 常山犬太郎 共回答了27个问题
常山犬太郎 共回答了27个问题 |采纳率85.2%解题思路:结合表中提供的信息和些列知识分析判断:
(1)1kg某种燃料完全燃烧放出的热量叫做这种燃料的热值,热值大小仅与燃料的种类有关,而与燃料的质量无关;
(2)当燃料完全燃烧时,燃料完全燃烧放出的热量Q放=mq(固体、液体燃料)或Q放=Vq(气体燃料).A、热值大的燃料燃烧时,若不充分燃烧或燃料的质量小,放出的热量不一定多,故A错;
B、汽油的热值是4.6×107J/kg,说明1kg其有完全燃烧放出的热量4.6×107J,因没有说明是完全燃烧,故B错;
C、热值是1kg某种燃料完全燃烧放出的热量,木炭燃烧不充分时,放出的热量少,但热值不变,故C错;
D、2m3的沼气完全燃烧放出的热量Q放=Vq=2m3×1.9×107J/m3=3.8×107J,故D正确.
故选D.点评:
本题考点: 热量的计算;燃料的热值.
考点点评: 本题考查了学生对热值概念、燃料完全燃烧时的放热公式的了解与掌握,注意固液体燃料燃烧放热公式Q放=mq,热值单位是J/kg,气体燃料燃烧放热公式Q放=Vq,热值单位是J/m3.1年前查看全部
- 下列有关物质性质和应用叙述正确并且有因果关系的是( ) A.烧碱具有碱性,能用于治疗胃酸过多 B.焦炭具有还原性,一定
下列有关物质性质和应用叙述正确并且有因果关系的是( )
A.烧碱具有碱性,能用于治疗胃酸过多 B.焦炭具有还原性,一定条件下能将二氧化硅还原为硅 C.浓硝酸具有强氧化性,能和浓氨水反应产生白烟 D.二氧化硫具有漂白性,与氯水混合使用漂白效果更好  红舞鞋-蝴蝶1年前0
红舞鞋-蝴蝶1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 完全燃烧1kg焦炭放出的热量,如果全部被水吸收,可以把多少千克20℃的水加热到100℃?焦炭的热值是3乘10的7次方J/
完全燃烧1kg焦炭放出的热量,如果全部被水吸收,可以把多少千克20℃的水加热到100℃?焦炭的热值是3乘10的7次方J/kg
 郑格秀1年前1
郑格秀1年前1 -
 rose彤 共回答了24个问题
rose彤 共回答了24个问题 |采纳率83.3%Q=cM△t1年前查看全部
- 水吸收的热量占焦炭放出热量的之比是?
水吸收的热量占焦炭放出热量的之比是?
水吸收的热量为6.72X10的5次方 焦炭的放出的热量为9X10的7次方 路人--冥1年前1
路人--冥1年前1 -
 honlang 共回答了17个问题
honlang 共回答了17个问题 |采纳率70.6%6.72*10^5/9*10^7=6.72/900=14/1875=0.75%1年前查看全部
- 以铁矿石和焦炭为原料生产H型钢经过什么工序
 跳格子mjx1年前1
跳格子mjx1年前1 -
 51305 共回答了23个问题
51305 共回答了23个问题 |采纳率95.7%……
先投资建个钢铁厂,把铁练出来,再练成钢,再上一条H型钢生产线1年前查看全部
- 焦炭还原四氧化三铁实验现象
 zuoxin_qq1年前1
zuoxin_qq1年前1 -
 巴期小滕 共回答了22个问题
巴期小滕 共回答了22个问题 |采纳率95.5%4C+FE3O4=3FE+4CO
黑色粉末变成银白色粉末1年前查看全部
- 完全燃烧100g焦炭放出的热量是多少?若这些热量只有42%被5KG的40℃的水吸收,能否将水加热至沸腾?若焦炭放出的热量
完全燃烧100g焦炭放出的热量是多少?若这些热量只有42%被5KG的40℃的水吸收,能否将水加热至沸腾?若焦炭放出的热量约有10%被2KG的液体吸收,液体的温度升高了72℃(液体还没有沸腾),则该液体的比热容是多少?(C水=4200 J/(KG.℃),Q焦炭=30000000 J/KG)
 592008001年前1
592008001年前1 -
 lanhuacao888 共回答了18个问题
lanhuacao888 共回答了18个问题 |采纳率88.9%1. 0.1*30000000=3*10^6J
2. 3*10^6*0.42/(5*4200)=60
40+60=100,刚好不沸腾吧
3. 10%* 3*10^6/(2*72)=2.08*10^3 J/(KG.℃)1年前查看全部
- 焦炭具有还原性,可以用于什么?就是他可以制作什么,它的用途,
 r6mc1年前2
r6mc1年前2 -
 路过看不过 共回答了22个问题
路过看不过 共回答了22个问题 |采纳率81.8%还原金属氧化物,可用作还原剂.1年前查看全部
- 二氧化碳加上焦炭在高温的条件下生成一氧化碳的化学方程式是什么【学霸帮忙解答一下=_=】
 yangcanq1年前0
yangcanq1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2010•大连一模)在同温同压下,把等体积的空气和二氧化碳混合,在高温下跟足量的焦炭充分反应.若氧气和二氧化碳都转化为
(2010•大连一模)在同温同压下,把等体积的空气和二氧化碳混合,在高温下跟足量的焦炭充分反应.若氧气和二氧化碳都转化为一氧化碳,则反应后气体中一氧化碳的体积分数约是( )
A.0.75
B.0.70
C.0.64
D.0.60 小小苏19821年前1
小小苏19821年前1 -
 成而文 共回答了23个问题
成而文 共回答了23个问题 |采纳率87%解题思路:发生反应2C+O2
2CO、C+CO2高温 .
2CO,令空气和二氧化碳的体积分别为1L,根据空气中氧气约占空气体积的[1/5]算出氧气的体积,再根据方程式计算氧气、二氧化碳反应生成CO的体积及反应后气体体积增大量,进而计算CO的体积分数.高温 .令空气和二氧化碳的体积分别为1L,则氧气的体积为1L×[1/5]=0.2L,
2C+O2
高温
.
2CO 体积增大
1 22-1=1
0.2L0.4L 0.2L
C+CO2
高温
.
2CO 体积增大
1 2 2-1=1
1L 2L 1L
故反应后V(CO)=0.4L+2L=2.4L,反应后气体总体积为1L+1L+0.2L+1L=3.4L,
则反应后气体中一氧化碳的体积分数约是[2.4L/3.2L]=0.75,
故选A.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查混合物计算、根据方程式计算,难度不大,计算混合后气体的体积是关键,注意差量法的运用.1年前查看全部
- 下列说法正确的是( )A. 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应B. CO2和钠在一定条件下可以
下列说法正确的是( )
A. 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应
B. CO2和钠在一定条件下可以得到金刚石和碳酸钠,反应中氧化剂和还原剂之比是3:4
C. 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl
D. 从燃煤烟道灰中(含GeO2)提取半导体材料单质锗(Ge),没有发生氧化还原反应 ee孤鹤1年前5
ee孤鹤1年前5 -
 boguu 共回答了16个问题
boguu 共回答了16个问题 |采纳率93.8%解题思路:A.试管自身含有二氧化硅;
B.化合价升高和降低的总数相等;
C.SiCl4(极易水解)水解后生成硅酸和氯化氢;
D.凡是有化合价的升降的反应是氧化还原反应.A.试管自身含有二氧化硅,高温条件下可以和焦炭反应,故A错误;
B.CO2和钠在一定条件下反应可以得到金刚石和碳酸钠,反应中氧化剂和还原剂的物质的量之比是1:4,故B错误;
C.SiCl4(极易水解)水解后生成硅酸和氯化氢,氯化氢易和氨气反应生成氯化铵固体,故C正确;
D.由GeO2提取半导体材料单质锗(Ge)有化合价的升降是氧化还原反应,故D错误.
故选C.点评:
本题考点: 硅和二氧化硅;氧化还原反应;盐类水解的应用.
考点点评: 本题考查硅的化合物的性质,难度中等,注意SiCl4(极易水解)水解后生成硅酸和氯化氢,氯化氢易和氨气反应生成氯化铵固体.1年前查看全部
- 某炼铁企业以焦炭、赤铁矿等为主要原材料炼铁,反应过程如图:
某炼铁企业以焦炭、赤铁矿等为主要原材料炼铁,反应过程如图:

(1)过程①中发生的反应属于______反应(选填“化合”“分解”“置换”“复分解”之一),过程③是利用了一氧化碳的______(选填“氧化性”“还原性”之一).
(2)列举一例防止钢铁锈蚀的具体措施:______.
(3)试用化学方程式计算:该企业用1000t含氧化铁80%的赤铁矿可炼得金属铁多少吨? 游戏中的王者1年前1
游戏中的王者1年前1 -
 天空深蓝 共回答了15个问题
天空深蓝 共回答了15个问题 |采纳率93.3%解题思路:(1)根据反应物、生成物的数量和种类来分析;根据一氧化碳的性质来分析;
(2)根据钢铁锈蚀的条件来分析;
(3)由赤铁矿石的质量、氧化铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出炼出铁的质量即可.(1)过程①发生的是:焦炭在高温条件下能和氧气反应生成二氧化碳,符合“多变一”的特征,属于化合反应;过程③是:氧化铁在高温条件下能够一氧化碳反应生成铁和二氧化碳,此反应中体现了一氧化碳具有还原性;
(2)铁与氧气和水接触时容易生锈.要防止钢铁生锈,就要把钢铁与空气和水隔绝,如保持钢铁的表面洁净干燥,镀一层金属,涂一层油漆等;
(3)氧化铁的质量为:1000t×80%=800t
设理论上可以炼铁的质量为x.
Fe2O3+3CO
高温
.
2Fe+3CO2
160112
800t x
[160/112=
800t
x]
x=560t
答:可炼得金属铁的质量为560t.
故答案为:(1)化合;还原性;
(2)刷油漆、镀其他金属、表面涂油等合理均可;
(3)560t.点评:
本题考点: 铁的冶炼;含杂质物质的化学反应的有关计算;金属锈蚀的条件及其防护;反应类型的判定.
考点点评: 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.1年前查看全部
- 工业炼铁,用到的原料有:铁矿石、焦炭、空气、石灰石,下列对原料在冶炼过程中的作用叙述不正确的是: [
工业炼铁,用到的原料有:铁矿石、焦炭、空气、石灰石,下列对原料在冶炼过程中的作用叙述不正确的是: [ ]
A.焦炭是铁矿石炼铁时的还原剂
B.空气在与焦炭的反应中,为炼铁提供能量
C.石灰石是助矿石中杂质形成炉渣
D.固体原料需粉碎,增大与气体的接触面 风吹的脸1年前1
风吹的脸1年前1 -
 zhangpengtao1 共回答了15个问题
zhangpengtao1 共回答了15个问题 |采纳率86.7%A1年前查看全部
- 蓝铜矿与焦炭一起加热生成铜,二氧化碳和水的反应化学方程式及反应类型?
 春风0hh211年前0
春风0hh211年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2010•眉山)实验表明浓硫酸与焦炭在加热的条件下能发生反应.经查阅资料得知:
(2010•眉山)实验表明浓硫酸与焦炭在加热的条件下能发生反应.经查阅资料得知:
①SO2可使澄清石灰水变浑浊;
②SO2可使品红溶液的红色褪去,而CO2不能;
③SO2可与酸性的KMnO4溶液反应使其褪色,而CO2不能;
④CuSO4为白色粉末,遇水可生成胆矾.
在对该反应的产物的探究中需用下列A、B、C装置: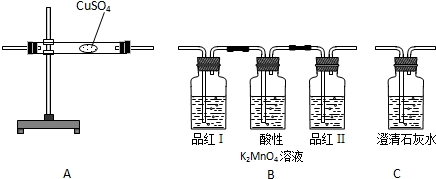
请根据提供的信息回答下列问题:
(1)浓硫酸与焦炭在加热的条件下发生如下反应:
C+2H2SO4(浓)
X↑+2SO2↑+2H2O 则生成物X的化学式为______.△ .
(2)若要证明产物中有水,则要用______装置(填装置的编号).
(3)若按B、A、C的顺序组装,不能证明产物______.
(4)若按C、B、A的顺序组装,则能证明产物______.
(5)若要证明这三种产物,正确的组装顺序是______,装置B中的品红Ⅰ的作用是______,品红Ⅱ的作用是______. daniel8521年前1
daniel8521年前1 -
 东江源人 共回答了18个问题
东江源人 共回答了18个问题 |采纳率100%解题思路:(1)根据质量守恒定律化学反应前后原子种类和数目不变;
(2)根据水的特性能使无水硫酸铜变蓝来回答;
(3)根据按B、A、C的顺序组装分别所起的作用来回答本题;
(4)根据ABC各装置的作用来回答;
(5)主要根据二氧化硫与二氧化碳的性质区别来考虑本题.(1)反应前碳原子有1个,氢原子有4个,硫原子有2个,氧原子有8个,生成物中有2个硫原子,6个氧原子,4个氢原子;所以生成物中还少1个碳原子和2个氧原子即二氧化碳;
(2)硫酸铜是白色粉末遇到水会生成五水硫酸铜,变成蓝色,所以用A装置检验是否有水生成;
(3)若按B、A、C的顺序组装,气体在通过B后经过了品红溶液和高锰酸钾溶液,已经带上了水,再通过硫酸铜,已经没有意义了,使硫酸铜变色的水到底是原来的还是品红溶液和高锰酸钾溶液中的水,无法判断,故不能检验水的存在;
(4)若按C、B、A的顺序能够鉴别二氧化硫的存在,不能鉴别二氧化碳的存在,因为二氧化硫和二氧化碳都能使石灰水变浑浊,而二氧化硫的检验是利用二氧化硫和高锰酸钾反应而使高锰酸钾褪色来证明的;
(5)通过ABC的顺序就能把三中气体都能鉴别出来,能使硫酸铜变蓝说明有水生成,通过B装置时既能鉴别出二氧化硫的存在,又能把二氧化硫除去,再通过石灰水变浑浊了说明就有二氧化碳存在了.
故答案为:(1)CO2;
(2)A;
(3)H2O;
(4)SO2;
(5)ABC;证明产物中的SO2;检验SO2是否完全反应.点评:
本题考点: 常见气体的检验与除杂方法;仪器的装配或连接;有关化学式的计算和推断.
考点点评: 通过回答本题知道了检验水的存在用硫酸铜,能够变蓝即可,检验二氧化硫用品红溶液或高锰酸钾溶液,检验二氧化碳用澄清石灰水.1年前查看全部
- 每千克焦炭的收到基热值为6800千卡,则其折合标准煤的折标系数是?
 kjghfd1年前1
kjghfd1年前1 -
 littlelau 共回答了22个问题
littlelau 共回答了22个问题 |采纳率86.4%6800/7000=0.9711年前查看全部
- 英语翻译拦焦车、液压缸、除尘系统、焦炭、导焦栅、主动轮、从动轮
 meiyouiq21年前2
meiyouiq21年前2 -
 绿和尚 共回答了20个问题
绿和尚 共回答了20个问题 |采纳率100%拦焦车coke-barrier car
液压缸hydraulic cylinder
除尘系统dust removal system
焦炭coke
导焦栅coke guide
主动轮driving wheel
从动轮driven wheel1年前查看全部
- 用水蒸气通过炽热的焦炭得到水煤气,其主要成分是co和h2还含有少量CO2和水蒸气,请用下列装置设计%
用水蒸气通过炽热的焦炭得到水煤气,其主要成分是co和h2还含有少量CO2和水蒸气,请用下列装置设计%
用水蒸气通过炽热的焦炭得到的水煤气,其主要成分是CO和H2,还含有少量CO2和水蒸气,请用下列装置设计一个实验,以证明水煤气中含有CO和H2 .
⑴ 连接上述所有装置的正确顺序是
水煤气→ → → → →
⑵ 装置丁在连接时,气体必须由_________进入(用“A”或“B”填写)
⑶ 确认水煤气中含有H2的实验现象主要是____________________.
⑷ 确认水煤气中含有CO的实验现象主要是___________________.
⑸上述实验有何安全缺陷:_________________________________.
你认为应如何改进___________________________________________.
(甲:加热装置cuo;乙:u形管里面是无水硫酸铜,丙:NaoH溶液两根管子,左边A长,右边B短;丁:和丙一样,但要把NaoH改成Ca(OH)2,戊:和丙一样,把NaoH改成浓硫酸) ccdujianlin1年前1
ccdujianlin1年前1 -
 罗蜜欧在流放 共回答了21个问题
罗蜜欧在流放 共回答了21个问题 |采纳率95.2%⑴ 连接上述所有装置的正确顺序是
水煤气→戊(长进短出)→丙(同左) →甲 →乙 →丁(长进短出)
⑵ 装置丁在连接时,气体必须由_A________进入(用“A”或“B”填写)
⑶ 确认水煤气中含有H2的实验现象主要是__无水硫酸铜变蓝__________________.
⑷ 确认水煤气中含有CO的实验现象主要是___甲中黑色固体变红,丁中出现白色沉淀________________.
⑸上述实验有何安全缺陷__________________CO泄漏有毒__________.
你认为应如何改进__在最后加一个酒精灯点燃_______________________________________.1年前查看全部
- (2010•徐汇区一模)钢铁是重要的金属材料,在生产、生活中有广泛的用途.炼铁厂常以焦炭、赤铁矿(主要成分是Fe2O3)
(2010•徐汇区一模)钢铁是重要的金属材料,在生产、生活中有广泛的用途.炼铁厂常以焦炭、赤铁矿(主要成分是Fe2O3)、空气等为主要原料炼铁,反应过程如图:

请回答:
(1)赤铁矿主要成分Fe2O3中铁元素的化合价是______
(2)第②步的化学反应基本类型属于______;
(3)第③步反应的化学方程式:3CO+Fe2O3
3CO2+2Fe高温 .3CO+Fe2O3,其中属于还原剂的物质是______.
3CO2+2Fe高温 . cher_aquarius1年前1
cher_aquarius1年前1 -
 sichuanguangqing 共回答了26个问题
sichuanguangqing 共回答了26个问题 |采纳率88.5%解题思路:(1)化合物中各元素的化合价代数和为零,根据这一原则,可由氧化铁中氧元素的化合价计算铁元素的化合价;
(2)化合反应是指两种或两种以上物质反应生成一种物质的化学变化,该变化的特点可总结为“多变一”;
(3)还原剂是指反应中夺取其它物质中的氧元素的物质.(1)设Fe2O3中铁元素的化合价为x,则x×2+(-2)×3=0,解得x=+3
故答案为:+3;
(2)焦炭在高温条件下与二氧化碳反应生成一氧化碳,该反应符合“多变一”的化合反应的特点,该反应属于化合反应;
故答案为:化合反应;
(3)高温条件下,一氧化碳还原氧化铁生成铁和二氧化碳;该反应中一氧化碳夺取氧化铁中的氧,为该反应中的还原剂;
故答案为:3CO+Fe2O3
高温
.
3CO2+2Fe;CO.点评:
本题考点: 铁的冶炼;一氧化碳还原氧化铁;有关元素化合价的计算;反应类型的判定;还原反应;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学变化的基本类型有四种:化合反应,两种或以上物质生成一种物质的反应;分解反应,一种物质生成两种或以上物质的反应;置换反应,单质与化合物生成单质与化合物的反应;复分解反应,两种化合物相互交换成分生成两种新的化合物的反应.1年前查看全部
- 试以石灰石、溴、溴化氢、氢气、水、焦炭、钠等无机物为主要原料合成有机物乙苯,并写出可能的化学方程式
 oknyh1年前1
oknyh1年前1 -
 wenhai111 共回答了20个问题
wenhai111 共回答了20个问题 |采纳率95%CaCO3==高温==CaO+CO2
CaO+3C==高温==CaC2+CO
CaC2+2H2O=Ca(OH)2+C2H2
3C2H2=高温 催化剂=C6H6(苯)
C2H2+H2=(选择性氢化)== CH2=CH2
C6H6+CH2=CH2 =(AlCl3催化)=Ph-Et(乙苯)1年前查看全部
- 1.天然气是一种情节能源,完全燃烧1m^3的天然气放出的热量相当于完全燃烧多少千克的焦炭放出的热量?(天然气的热值为8.
1.天然气是一种情节能源,完全燃烧1m^3的天然气放出的热量相当于完全燃烧多少千克的焦炭放出的热量?(天然气的热值为8.7x10^7J/m^3,焦炭的热值为3.0x10^7J/kg)
2.某低油耗小车在高速公路上匀速直线飞奔,所受平均阻力为1250N,每跑8km,消耗汽油1升,已知汽油的密度为0.7x10^3kg/m^3,求此车汽油机的效率 .汽油的热值是4.6x10^7J/kg.
在室温为20摄氏度时,小明用大烧杯配置了一杯温度温度为60摄氏度的饱和硝酸钾溶液,往其中放入一个塑料块,塑料块漂浮在液面,然后小明再让溶液冷却,说出溶液冷却过程中出现的两个现象, 猪鼓励笨娃1年前1
猪鼓励笨娃1年前1 -
 TXTQ 共回答了21个问题
TXTQ 共回答了21个问题 |采纳率81%1.(8.7x10^7J/m^3)*1m^3/(3.0x10^7J/kg)=2.9kg
2.w=FS=1250N*8000m=10^7J
Q=0.001m^3×0.7x10^3kg/m^3×4.6x10^7J/kg=3.22×10^7J
此车汽油机的效率=(10^7J/3.22×10^7J)*100%=31.1%
3.答:两个现象:一为溶液中有晶体析出,一为塑料块浸入溶液中的体积越来越大.原因是硝酸钾的溶解度随温度降低而降低,且在整个冷却过程中,随着晶体析出越来越多,溶液的密度越来越小,但塑料块受到的浮力不变,据阿基米德原理,则塑料块浸入溶液中的体积越来越大1年前查看全部
- 石灰石与焦炭制取电石的反应方程式
 ciba45471年前1
ciba45471年前1 -
 icemango 共回答了20个问题
icemango 共回答了20个问题 |采纳率100%CaCO3=煅烧=CaO+CO2↑
CaO+3C=高温=CaC2+CO1年前查看全部
- (1)将水蒸气通过红热的焦炭即可产生水煤气,反应为:C(s)+H2O(g)⇌CO(g)+H2(g)一定温度下,在一个容积
 (1)将水蒸气通过红热的焦炭即可产生水煤气,反应为:C(s)+H2O(g)⇌CO(g)+H2(g)一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是______(填字母,下同).
(1)将水蒸气通过红热的焦炭即可产生水煤气,反应为:C(s)+H2O(g)⇌CO(g)+H2(g)一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是______(填字母,下同).
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)⇌CO2(g)+H2(g),得到如下三组数据:
①实验1中以v(CO2)表示的反应速率为______.实验组 温度/℃ 起始量/mol 平衡量/mol 达到平衡所需时间/min H2O CO H2 CO 1 650 2 4 1.6 2.4 5 2 900 1 2 0.4 1.6 3 3 900 a b c d t
②该反应为______ (填“吸热”或“放热”)反应
(3)如图表示反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使cCH3OH)增大的是______.
a.升高温度
b.充入H2(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1molCO2和3molH2. 哭泣灵魂1年前1
哭泣灵魂1年前1 -
 囡囡的心 共回答了20个问题
囡囡的心 共回答了20个问题 |采纳率90%解题思路:(1)根据化学平衡状态的特征判断;
(2)①根据速率计算公式进行计算;
②根据温度变化,平衡时的生成物的物质的量的多少判断平衡移动的方向;
(3)使c (CH3OH)增大,应使平衡向正反应分析移动.(1)a.反应前后气体的体积不变,无论是否达到平衡状态,容器中的压强都不变,故a正确;
b.1molH-H键断裂的同时断裂2molH-O键,说明正逆反应速率相等,达到平衡状态,故b错误;
c.v正(CO)=v逆(H2O),说明正逆反应速率相等,反应达到平衡状态,故c错误;
d.c(CO)=c(H2)不能确定反应是否达到平衡状态,平衡时各物质的浓度取决于反应物的配料比和转化的程度,故d正确,
故答案为:a、d;
(2)①)①v(CO2)=v(CO)=
4mol-2.4mol
2L
5min=0.16mol•(L•min)-1,
故答案为:0.16mol•(L•min)-1;
②根据CO(g)+H2O(g)⇌CO2(g)+H2(g)可知压强对平衡移动无影响,如果在650℃,H2O、CO的物质的量改为1mol、2mol,达到平衡时CO的物质的量应为1.2mol,而900℃时CO的物质的量应为1.6mol,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,
故答案是:放热;
(3)a.升高温度平衡向逆反应方向移动,CH3OH减小,故a错误;
b.充入He(g),使体系压强增大,但平衡没有移动,故b错误;
c.将H2O(g)从体系中分离出来,平衡向正反应方向移动,CH3OH浓度增大,故c正确;
d.再充入1mol CO2和3mol H2,平衡向正反应方向移动,CH3OH浓度增大,故d正确.
故答案为:c、d.点评:
本题考点: 化学平衡状态的判断;化学平衡的调控作用;化学反应速率和化学计量数的关系.
考点点评: 本题考查化学平衡计算以及化学平衡移动等问题,题目难度中等,本题注意(2)为易错点,注意把握等效平衡的理解.1年前查看全部
- 这道题的解题过程是?800 ℃时,焦炭与水蒸
这道题的解题过程是?800 ℃时,焦炭与水蒸
800 ℃时,焦炭与水蒸气反应生成一氧化碳和氢气,反应热ΔH=+131.3 kJ/mol,它表示 [ ] A.碳和水反应吸收热量131.3 kJ
B.1 mol C(s)和1 mol H 2 O(g)反应生成一氧化碳和氢气,并吸收131.3 kJ的热量
C.1 mol C跟1 mol H 2 O反应吸收131.3 kJ的热量
D.固体碳和气态水各1 mol反应,放出131.3 kJ的热量
 211221111年前1
211221111年前1 -
 童心的我 共回答了14个问题
童心的我 共回答了14个问题 |采纳率78.6%B1年前查看全部
- 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:

(1)该反应的平衡常数表达式为K=c6(CO) c2(N2) ;c6(CO) c2(N2)
(2)若知上述反应为放热反应,则其反应热△H______零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);
(3)若使压强增大,则上述平衡向______反应方向移动(填“正”或“逆”);
(4)若已知CO生成速率为v(CO)=18mol/(L.min),则N2消耗速速率为v(N2)=______ mol/(L.min). xgz5011年前1
xgz5011年前1 -
 037ahhf 共回答了18个问题
037ahhf 共回答了18个问题 |采纳率94.4%解题思路:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,注意固体、纯液体浓度为常数,不用写固体、纯液体的浓度;
(2)对于放热反应,反应热△H<0;
该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;
(3)增大压强平衡向气体体积减小的方向移动;
(4)根据速率之比等于化学计量数之比计算.(1)可逆反应3SiO2(s)+6C(s)+2N2(g)⇌Si3N4(s)+6CO(g)的平衡常数K=
c6(CO)
c2(N2),故答案为:
c6(CO)
c2(N2);
(2)对于放热反应,反应热△H<0;该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小,故答案为:小于;减小;
(3)该反应正反应是气体体积增大的反应,增大压强平衡向气体体积减小的方向移动,即向逆反应移动,故答案为:逆;
(4)已知CO生成速率为v(CO)=18mol/(L•min),根据速率之比等于化学计量数之比,则N2消耗速率为:v(N2)=[1/3]v(CO)=[1/3]×18mol/(L•min)=6mol/(L•min),故答案为:6.点评:
本题考点: 化学平衡常数的含义;反应速率的定量表示方法;化学平衡的影响因素.
考点点评: 本题考查化学平衡常数与影响因素、影响平衡移动的因素、化学反应速率计算等,比较基础,注意方程式中物质的状态,注意基础知识的掌握.1年前查看全部
- (2010•南通模拟)以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾
(2010•南通模拟)以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如下:
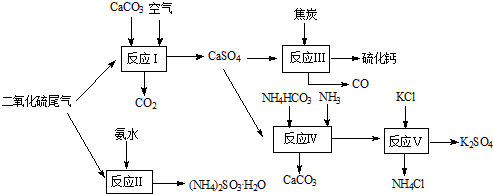
(1)生产过程中,反应Ⅰ中需鼓入足量空气,试写出该反应的总方程式2CaCO3+2SO2+O2═2CaSO4+2CO22CaCO3+2SO2+O2═2CaSO4+2CO2.
(2)反应Ⅱ中需要向溶液中加入适量的对苯二酚等物质,其可能的作用是防止亚硫酸铵被氧化防止亚硫酸铵被氧化.
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为1:41:4.
(4)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出.
(5)能用于测得尾气中SO2含量的是BCBC.
A.滴有酚酞的NaOH溶液 B.酸性KMnO4
C.滴有淀粉的碘水 D.BaCl2溶液. yuenjun1年前1
yuenjun1年前1 -
 征征猫 共回答了17个问题
征征猫 共回答了17个问题 |采纳率94.1%(1)碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳,方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2,故答案为:2CaCO3+2SO2+O2═2CaSO4+2CO2;
(2)对苯二酚具有还原性,空气中的氧气具有氧化性,亚硫酸氨中+4价的硫具有还原性,故答案为:防止亚硫酸铵被氧化;
(3)反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C,氧化剂与还原剂物质的量之比为1:4,故答案为:1:4;
(4)反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是利用乙二醇降低硫酸钾溶解度,有利于析出,
故答案为:乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出;
(5)酸性KMnO4与二氧化硫反应的方程式为:5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,碘与二氧化硫发生氧化还原的方程式为:SO2+I2+2H2O=H2SO4+2HI,碘消耗完,淀粉因没有碘单质不再显蓝色,故答案为:BC.1年前查看全部
- 下列说法正确的是( )A.工业上炼铁是用电炉B.工业炼铁的原料主要是:生铁、焦炭、石灰石C.高炉炼铁时,加入石灰石的目
下列说法正确的是( )
A.工业上炼铁是用电炉
B.工业炼铁的原料主要是:生铁、焦炭、石灰石
C.高炉炼铁时,加入石灰石的目的是把矿石中的二氧化硅转变成炉渣去掉
D.高炉炼出的铁是纯铁 杨衡1年前1
杨衡1年前1 -
 lukicat 共回答了15个问题
lukicat 共回答了15个问题 |采纳率86.7%解题思路:A.根据工业炼铁的设备来分析;B.根据炼铁的原料来分析;C.根据炼铁过程中加入石灰石的作用来分析;D.根据高炉炼铁的产物来分析.A.工业炼铁用高炉,故错误;
B.工业炼铁的原料主要是铁矿石、焦炭、石灰石,故错误;
C.高炉炼铁时,加入石灰石的作用是把矿石中的二氧化硅转化为炉渣除去,故正确;
D.高炉炼出的铁中含有杂质,属于生铁,故错误.
故选C.点评:
本题考点: 铁的冶炼.
考点点评: 本题考查了高炉炼铁的知识,题目比较简单,要掌握高炉炼铁的原理、设备及原料.1年前查看全部
- 工业上用焦炭冶炼金属铜,如果用200吨含杂质为20%的氧化铜与足量的焦炭反应,可制得含杂质10%的铜多少吨?
 信至指定客服1年前1
信至指定客服1年前1 -
 我要我们在一起W 共回答了21个问题
我要我们在一起W 共回答了21个问题 |采纳率85.7%CuO质量160吨 CuO----------------Cu
80 64
160 X X=128吨 可以得到纯铜128吨
现在含杂质10%,所以真正得到的铜为 128/0.9=142.2吨1年前查看全部
- 以石英砂、焦炭、水、MnO2和浓盐酸来制取纯硅,写出有关化学反应方程式
 特芮1年前2
特芮1年前2 -
 tzoaz 共回答了21个问题
tzoaz 共回答了21个问题 |采纳率100%SiO2+2C=2CO+Si(高温,得到粗硅)
MnO2+4HCl=MnCl2+Cl2+2H2O(加热)
C+H2O=CO+H2(高温)
制纯硅
Si+2Cl2=SiCl4(加热)
SiCl4+2H2=Si+4HCl(加热)1年前查看全部
- 物理题!!!!!!某太阳能热水器的水箱内装有50kg的水,太阳光照射一段时间后,水温从20°C升高到60°C 焦炭的热值
物理题!!!!!!
某太阳能热水器的水箱内装有50kg的水,太阳光照射一段时间后,水温从20°C升高到60°C 焦炭的热值为3.0x10³J/kg。求 (1)水吸的热值是多?少 (2)这些热值相当于完全燃烧多少千克的焦炭?
 zhoucf6281年前3
zhoucf6281年前3 -
 一溜赖青菜 共回答了22个问题
一溜赖青菜 共回答了22个问题 |采纳率86.4%Q=cm(t2-t1)=4200*50*(60-20)=8400000J
m=8400000/3000=2800kg1年前查看全部
- 在“氮气、焦炭、黄铜、明矾、压缩天然气、氯化钠”中选择合适的物质填空:
在“氮气、焦炭、黄铜、明矾、压缩天然气、氯化钠”中选择合适的物质填空:
(1)可用于炼铁的是焦炭(C)焦炭(C);
(2)在医疗上配制“生理盐水”的是氯化钠 (NaCl)氯化钠 (NaCl);
(3)标有“CNG”标志的汽车使用的燃料是压缩天然气压缩天然气;
(4)充入食品包装袋中防腐的是氮气 (N2)氮气 (N2);
(5)用于制造机器零件、仪表的是黄铜黄铜;
(6)常用于净水作絮凝剂的是明矾明矾. ligq19751年前1
ligq19751年前1 -
 网上小棉袄 共回答了15个问题
网上小棉袄 共回答了15个问题 |采纳率86.7%(1)可用于炼铁的是焦炭;
(2)用于医疗上配制“生理盐水”的是氯化钠;
(3)标有“CNG”标志的汽车使用的燃料是压缩天然气.
(4)充入食品包装袋中防腐的是氮气;
(5)用于制造机器零件、仪表的是黄铜;
(6)明矾能吸附悬浮在水中的固体小颗粒形成大颗粒而沉淀,故能用来净水.
故答案为:(1)焦炭;(2)氯化钠.(3)天然气;(4)氮气.(5)黄铜.(6)明矾1年前查看全部
- 干木材和焦炭的热值分别是1.2×107 J/kg和3.0×107 J/kg,这表明同样质量的干木材和焦炭完全燃烧时,焦炭
干木材和焦炭的热值分别是1.2×107 J/kg和3.0×107 J/kg,这表明同样质量的干木材和焦炭完全燃烧时,焦炭放出的热量要来得______(选填“多”或“少”);______ kg的干木材放出的热量和1kg焦炭放出的热量相等(设均是完全燃烧).
 lilong7251年前1
lilong7251年前1 -
 Saiya 共回答了14个问题
Saiya 共回答了14个问题 |采纳率85.7%解题思路:(1)1kg某种燃料完全燃烧放出的热量叫做这种燃料的热值,据此比较;
(2)根据m木q木=m碳q碳求干木材的质量.(1)干木材的热值1.2×107 J/kg,是指1kg干木材完全燃烧放出的热量为1.2×107 J,
焦炭的热值3.0×107 J/kg,是指1kg焦炭完全燃烧放出的热量为3×107 J,
可见同样质量的干木材和焦炭完全燃烧时,焦炭放出的热量多;
(2)∵m木q木=m碳q碳,
即:m木×1.2×107 J/kg=1kg×3×107 J/kg,
∴m木=2.5kg.
故答案为:多;2.5.点评:
本题考点: 燃料的热值.
考点点评: 本题考查了学生对热值概念、燃料完全燃烧放热公式的了解与掌握,属于基础题目.1年前查看全部
- 空气和二氧化碳按体积比5:1混合,使混合气体与足量的红热焦炭充分反应
空气和二氧化碳按体积比5:1混合,使混合气体与足量的红热焦炭充分反应
,设空气中氮气和氧气的体积比为4:1,不及其他成分,且体积都在同温同
压下,测定,则反应的气体中一氧化碳的体积分数为?
150摄氏度,碳酸氨完全分解,生成的气态混合物其密度是相同条件下氢气
密度的?
需要过程详细~谢谢~~
 fak09911年前1
fak09911年前1 -
 取个ID可真TM难 共回答了15个问题
取个ID可真TM难 共回答了15个问题 |采纳率86.7%设CO2 1mol则生成2mol CO
空气为5mol 有1mol O2 生成2mol CO
则为1/2
气体密度比等于相对质量比 39倍1年前查看全部
- 高温条件下二氧化碳与焦炭发生化学反应生成一种新的可燃气体的化学方程式
 重庆仔1年前2
重庆仔1年前2 -
 mm8963 共回答了13个问题
mm8963 共回答了13个问题 |采纳率69.2%CO2+C=高温=2CO
CO可以燃烧
2CO+O2=2CO21年前查看全部
- 在同温同压下,把等体积的空气和二氧化碳混合,在高温下跟足量的焦炭充分反应.若氧气和二氧化碳都转化为一氧化碳,则反应后气体
在同温同压下,把等体积的空气和二氧化碳混合,在高温下跟足量的焦炭充分反应.若氧气和二氧化碳都转化为一氧化碳,则反应后气体中一氧化碳的体积分数约是( )
A. 0.75
B. 0.70
C. 0.64
D. 0.60 1331581年前1
1331581年前1 -
 lyl7102 共回答了11个问题
lyl7102 共回答了11个问题 |采纳率90.9%解题思路:发生反应2C+O2
2CO、C+CO2高温 .
2CO,令空气和二氧化碳的体积分别为1L,根据空气中氧气约占空气体积的[1/5]算出氧气的体积,再根据方程式计算氧气、二氧化碳反应生成CO的体积及反应后气体体积增大量,进而计算CO的体积分数.高温 .令空气和二氧化碳的体积分别为1L,则氧气的体积为1L×[1/5]=0.2L,
2C+O2
高温
.
2CO 体积增大
1 22-1=1
0.2L0.4L 0.2L
C+CO2
高温
.
2CO 体积增大
1 2 2-1=1
1L 2L 1L
故反应后V(CO)=0.4L+2L=2.4L,反应后气体总体积为1L+1L+0.2L+1L=3.4L,
则反应后气体中一氧化碳的体积分数约是[2.4L/3.2L]=0.75,
故选A.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查混合物计算、根据方程式计算,难度不大,计算混合后气体的体积是关键,注意差量法的运用.1年前查看全部
大家在问
- 1蒸发皿为什么不能加热固体
- 2生态系统及稳定性的探究 探究目的:初步学会观察和研究人工生态系统.
- 3如图所示,被水平拉伸的轻弹簧右端拴在小车壁上,左端拴一质量为10kg的物块M.小车静止不动,弹簧对物块的弹力大小为
- 4"只把杭州作汴州"是哪首诗中的快
- 5鲁迅从百草园到三味书屋中写到的笑人齿缺曰狗窦大开全文是在哪里?
- 6下列俗语不能说明合作的重要性的是 [ ] A、三个臭皮匠,顶个
- 7用正方体的任意一个面画出图形一定是什么形
- 8The ____is shining
- 9what day ____(be)it yesterday?
- 10抗生素杀菌和抑菌的区别抗生素分为杀菌和抑菌,请问是不是抑菌药物始终没有杀菌药物好呢(没有彻底杀死细菌,容易复发)?克拉霉
- 11读了《掩饰过失的猫》后,这只猫最后为什么淹死了?读了这则寓言受到什么教育?
- 12在一根长钢管一端,用铁锤敲击一下,在另外一端可以听到___次声音,先听到的是沿___传来的声音.
- 13地理与我们的生活密切相关,下列地理现象与地球公转有关的是() A.四季变化B.昼夜交替C.时间的差
- 14胚胎时期,人体内的不同组织和器官是由于细胞分化而来的,人们把这种干细胞称为?
- 15已知数列{an}为等差数列,Sn为其前n项和,且a1=10,s12=-125求数列{an}的通项公式an
