在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a mol A和a mol
 chonge2022-10-04 11:39:541条回答
chonge2022-10-04 11:39:541条回答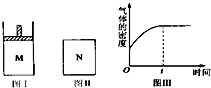 在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a mol A和a mol B,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?)⇌xC(g)△H<0,平衡时M中A、B、C的物质的量之比为1:3:4,下列判断不正确的是( )
在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a mol A和a mol B,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?)⇌xC(g)△H<0,平衡时M中A、B、C的物质的量之比为1:3:4,下列判断不正确的是( )A.x=4
B.若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率大于N中A的转化率

已提交,审核后显示!提交回复
共1条回复
 你知道我的迷茫 共回答了18个问题
你知道我的迷茫 共回答了18个问题 |采纳率77.8%- A、利用三段式,设转化了的B为bmol,
2A(?)+B(?)⇌xC(g)
起始(mol) a a 0
转化(mol) 2b b xb
平衡(mol)a-2ba-b xb
根据题意
a−2b
a−b=
1
3
a−2b
xb=
1
4,解得x=2,故A错误;
B、根据图Ⅲ可知,反应正向进行,密度增大,而该反应是在恒容条件下,所以反应后气体的质量的增大,则A、B只有一种是气态,故B正确;
C、若A为气体,B为非气体,则反应前后气体的体积不变,压强对平衡移动没有影响,所以在恒容和恒压下可以达到等效平衡,因为两容器中起始量相等,所以平衡时M、N中C的物质的量相等,故C正确;
D、若A、B均为气体时,该反应是气体体积减小的反应,所以达到平衡时M中的压强大于N的压强,所以平衡时M中A的转化率大于N中A的转化率,故D正确;
故选A. - 1年前
相关推荐
- 在既恒压又恒容状态下,是不是无论你怎么充入气体,平衡都不移动.
在既恒压又恒容状态下,是不是无论你怎么充入气体,平衡都不移动.
如A+B=2C (状态都为气态)
是否,你冲A 充C.都不移动? loulou51年前3
loulou51年前3 -
 hammer-guo 共回答了17个问题
hammer-guo 共回答了17个问题 |采纳率76.5%平衡一定移动.
加A,正向移动
加C逆向移动.不过单独加C,达到新平衡的状态与旧平衡状态一样(等效平衡)1年前查看全部
- 有两个容积相等的密闭容器A和B(如图1)所示,A容器有一个可上下移动的活塞,能使容器保持恒压,B容器的容积不变.起始时这
有两个容积相等的密闭容器A和B(如图1)所示,A容器有一个可上下移动的活塞,能使容器保持恒压,B容器的容积不变.起始时这两个容器中分别充入等量按体积比为2:1的SO2和O2的混合气体,并使A和B容积相等.在400℃条件下,发生如下反应:
2SO2(g)+O2(g)⇌2SO3(g)(△H<0).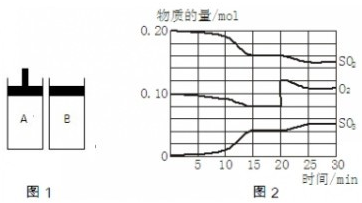
(1)达到平衡时,所需的时间t(A)______t(B),A容器中SO2的转化率比B容器中______.(填“大、小或相等)
(2)达到(1)所述平衡后,若向两容器中通入少量的等量氩气,A容器中化学平衡______移动,B容器中化学平衡______移动.(填“向左、向右、不”)
(3)达到(1)所述平衡后,若向两容器中通入等量原反应气体,再达到平衡时,A容器中c(SO3)______,B容器中SO3的质量分数______.(填“增大、减少或不变”)
(4)B容器反应过程中SO2、O2、SO3物质的量变化如图2所示:回答下列问题:
①反应在______时间处于平衡状态.
②反应进行至20min时,曲线发生变化的原因是______(用文字表述).10min到15min的曲线变化的原因可能是______(填写编号).
a.增加SO3的物质的量 b.缩小容器体积
c.加了催化剂 d.降低温度. 海灵子1年前1
海灵子1年前1 -
 gblbwoss 共回答了11个问题
gblbwoss 共回答了11个问题 |采纳率81.8%解题思路:(1)A能保持恒压,B能保持恒容.起始时向容积相等的A、B中分别通入体积比为2:1的等量的SO2和O2,使之发生反应:2SO2+O2⇌2SO3,恒温恒容随反应进行压强减小速率减慢,恒温恒压容器中反应过程中压强增大,反应速率大;转化率大;
(2)恒温恒压容器,加入惰气压强减小,平衡向气体体积增大的方向进行;恒温恒容容器加入惰气总压增大,分压不变,平衡不动,反应速率不变;
(3)恒温恒压容器加入等量原反应物,最后达到相同平衡状态;恒温恒容容器,加入原反应物压强增大,平衡正向进行;
(4)①反应混合物各物质的物质的量不变化,说明反应处于平衡状态;
②由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大;
由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.据此结合选项分析.(1)A能保持恒压,B能保持恒容.起始时向容积相等的A、B中分别通入体积比为2:1的等量的SO2和O2,使之发生反应:2SO2+O2⇌2SO3,恒温恒容随反应进行压强减小速率减慢,恒温恒压容器A中反应过程中压强增大,反应速率大;转化率大;所以达到平衡所需要的时间A小于B,SO2的转化率A大于B;
故答案为:小;大;
(2)恒温恒容B容器加入惰气总压增大,分压不变,平衡不动,反应速率不变;恒温恒压A容器,加入惰气压强减小,平衡向气体体积增大的方向进行,反应是气体体积减小的反应,所以平衡逆向进行;
故答案为:向左;不;
(3)恒温恒压容器A中加入等量原反应物,最后达到相同平衡状态物质的质量分数不变;恒温恒容容器B,加入原反应物压强增大,平衡正向进行,三氧化硫质量分数减小;
故答案为:不变;增大;
(4)①反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态,
故答案为:15-20min和25-30min;
②由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度;
由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.
a.10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,故a错误.
b.缩小容器体积,增大压强,增大反应速率,故b正确;
c.加了催化剂,增大反应速率,故c正确;
d.降低温度反应速率降低,故d错误;
故答案为:增大了氧气的浓度;bc.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡建立的过程;化学平衡的影响因素.
考点点评: 本题考查了恒温恒压,恒温恒容容器中化学平衡的影响因素分析判断,题目难度中等.1年前查看全部
- 恒容时,体积分数会变化么?恒压时,体积分数一定不变么
 cyscy1年前1
cyscy1年前1 -
 浪子七郎 共回答了18个问题
浪子七郎 共回答了18个问题 |采纳率77.8%w问题不明朗,
用理想气体状态方程(克拉珀龙方程)分析即可1年前查看全部
- 恒压条件下 气体冷却后体积怎么改变?
恒压条件下 气体冷却后体积怎么改变?
题目的意思就是说一个注射器含1.55毫升氧气在恒定的压力下从95℃冷却至0℃下,气体的总体积是什么?55毫升.为什么呢? 段改莉1年前3
段改莉1年前3 -
 uppa 共回答了23个问题
uppa 共回答了23个问题 |采纳率91.3%首先这是一个注射器,体积是很难改变的,那么不考虑其他条件,体积不变
如果这是一个气球,那么体积是要变得,根据气体状态方程PV=nRT,V=nRT/P
温度变低了90开尔文,体积将会减少,变为1.15ml左右1年前查看全部
- 一道高中等效平衡填空题,有两个密闭容器A和B,A容器内有一个移动的活塞能使容器内保持恒压.
一道高中等效平衡填空题,有两个密闭容器A和B,A容器内有一个移动的活塞能使容器内保持恒压.
有两个密闭容器A和B,A容器内有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等量的体积比为2:1的SO2和O2的混合气体,并使A和B的容积相等.
在保持4000C的条件下使之发生如下反应:2 SO2+O2 2SO3.
(1)达到平衡时所需要的时间A容器比B容器 ,A容器中SO2的转化率比B容器 .
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等量氩气,A容器化学平衡 移动,B容器化学平衡 移动.
(3)达到(1)所述平衡后,若向两容器中通入等量的原反应气体,达到平衡时,A容器SO3物质的量分数 ;B容器中SO3的物质的量分数 .(填增大、减小、不变)
答案我是知道
(1)短、大
(2)逆向、不
(3)不变,增大
希望给个解释 hanhetian1年前1
hanhetian1年前1 -
 jujishou1979 共回答了13个问题
jujishou1979 共回答了13个问题 |采纳率92.3%1、由于A可保持恒压,B可保持恒容,A中压强高于B中,因此A中的二氧化硫转化率比B容器中高
2、如果加入数量不多的等量氩气,则A中的反应物及生成物所占有的分压减小,因此A容器中平衡向左移动
B中反应物与生成物所占分压不变,因此反应平衡不变
3、因为恒压,A容器中三氧化硫的物质的量分数不变;因为恒容B压强增大,反应平衡右移,B中三氧化硫的物质的量方的分数增大1年前查看全部
- 如图在一定温度下,Ⅰ为恒压密闭容器,Ⅱ为恒容密闭容器.在Ⅰ、Ⅱ中分别加入2mol A和2molB
如图在一定温度下,Ⅰ为恒压密闭容器,Ⅱ为恒容密闭容器.在Ⅰ、Ⅱ中分别加入2mol A和2molB
如图在一定温度下,Ⅰ为恒压密闭容器,Ⅱ为恒容密闭容器.在Ⅰ、Ⅱ中分别加入2mol A和2mol B,起始时容器体积均为V L,发生如下反应并达到化学平衡状态:2A+B⇌xC(g),平衡时两容器中A、B、C的物质的量之比均为1:3:6.下列说法一定正确的是( )
A.x的值为2
B.B物质可为固体或液体
C.Ⅰ、Ⅱ容器中从起始到平衡所需时间相同
D.平衡时,Ⅰ容器的体积小于VL telecom1121年前1
telecom1121年前1 -
 lbs86822 共回答了15个问题
lbs86822 共回答了15个问题 |采纳率86.7%由初始状态和末状态,结合反应式易知,A反应掉1.6mol剩0.4,B反应掉0.8mol剩1.2,
所以C为2.4mol.不难推出反应式:2A+B=3C.
所以A错误.
在相同温度下,这个反应的化学平衡常数是不变的.
如果B是固体或者液体,K=c(C)³/c(A)²,
初始阶段容器内又有压强,所以A必定为气体.而A、C反应不是1比1,所以,此状态下一旦发生反应,容器一必定体积变化.体积缩小,物质的量相等,二相对于一的各组分浓度自然都是按比例升高.然而K=c(C)³/c(A)²,这样一、二求出的平衡常数就不同了.
所以B错误.
现在可以确定B为气体,那么恒压、恒容容器对反应都不造成影响,此时一、二反应情况相同.此时一容器体积就是vL,
所以D错误.
因为一、二反应时间相同,
所以C正确.
答案选C.
有不清楚的可以继续发问.希望对你有用.1年前查看全部
- 1mol的氢气与1mol的氮气分别在恒温恒压、恒温恒容的容器中发生可逆反应,哪个转化率高呢?
 一个永远心痛的人1年前2
一个永远心痛的人1年前2 -
 lkoooqqe311 共回答了22个问题
lkoooqqe311 共回答了22个问题 |采纳率95.5%恒温恒压.反应生成氨气体积是减小的,若是恒容相当于压强减小,不利于向氨气的转化1年前查看全部
- 恒压充入反应气体对于N2+O2=2NO.恒压时充入N2,反应如何变化.可是充入的是N2呀。
 非常低调1年前2
非常低调1年前2 -
 1wek9 共回答了13个问题
1wek9 共回答了13个问题 |采纳率84.6%不变啊.
左右两边分子数相同,平衡不会移动.1年前查看全部
- 标况下 某恒压容器内 有甲烷和氧气的混合气体,燃烧后恢复到原来温度,体积变为原来的40%
标况下 某恒压容器内 有甲烷和氧气的混合气体,燃烧后恢复到原来温度,体积变为原来的40%
求 剩余气体的平均分子量.(CH4 + 2O2----点燃---CO2 + 2H2O ) t2gk1年前1
t2gk1年前1 -
 热车2005 共回答了17个问题
热车2005 共回答了17个问题 |采纳率88.2%假定反应前的体积是10体积,则反应后为4体积,体积减少10-4=6
CH4 + 2O2----点燃---CO2 + 2H2O
1---------2----------------1---- 体积减少2
3---------6-----------------3----体积减少6
反应后,生成3体积的CO2,还有1体积是反应物剩余的.
如果剩余的是O2,剩余气体的平均分子量=32/4+44*3/4=41
剩余是CH4,剩余气体的平均分子量=16/4+44*3/4=371年前查看全部
- 对于一个恒温恒压的化学反应,熵变是否随反应温度变化?
 yupmghp1年前1
yupmghp1年前1 -
 zz49 共回答了22个问题
zz49 共回答了22个问题 |采纳率90.9%是有变化的.有一个公式 不过有点复杂.一点点
在标准压力下,要计算任意温度下化学反应的熵变 则温度为T时
ΔrSm(T) = ΔrSm(298.15K) + ∫【T/298.15K】∑ν(B)Cp,m(B)dT/T
积分号右边的方括号里斜杠左右分别代表定积分上下限 ν(B)代表求和号对应的一种物质在反应中的化学计量数 Cp,m(B)代表这种物质的摩尔等压热容
所以是要这样求的.摩尔等压热容一般在积分区间里看作定值1年前查看全部
- 合成氨反应的平衡题恒温恒压,合成氨反应达到平衡状态时,充入氨气,平衡如何移动?请详细说明理由!
 xing3510_cn1年前1
xing3510_cn1年前1 -
 闫志辉 共回答了14个问题
闫志辉 共回答了14个问题 |采纳率85.7%平衡向生成氮气和氢气的方向进行,根据勒夏特列原理,平衡向减少改变的方向移动,加入了氨气,平衡就朝减少氨气的方向进行.1年前查看全部
- 2so2(g)+o2(g)=2so3(g),在恒温恒压时,向改平衡体系中通入氦气,平衡怎么移动?
 tqdpg1年前1
tqdpg1年前1 -
 yujiantingjian 共回答了18个问题
yujiantingjian 共回答了18个问题 |采纳率94.4%逆向,恒温恒压通入不反应的惰性气体,相当于增大体积,平衡向计量数增大的方向进行.1年前查看全部
- COCl2(g)=CO(g)+Cl2(g)吸热的可逆反应中恒压加入惰性气体可以改变反应物的转化率吗?
 carey801年前1
carey801年前1 -
 不禁不由 共回答了22个问题
不禁不由 共回答了22个问题 |采纳率90.9%1 加入催化剂改变的反应的速率:催化剂有正负之分,正的加快反应速率,负的降低反应速率.但是绝对不会影响平衡的移动以及反应产率的. 2 气体反应中改变某些条件会使得平衡移动 但是平衡移动的实质无外乎就是改变反应物和生成物的浓度,既改变了反应速率,有时候对于转化率也有影响 (分析一下这个题哈) 首先 这个反应是气体体积增大的平衡反应,有气体参加. 要使得转化率改变就要让它的浓度发生变化:【恒压时反应平衡,加入惰性气体会使得体系的体积改变,进而影响参加反应的任务物质的浓度,所以会改变转化率】 但是 ,如果是恒定体积的话,加入惰性体积,虽然压力也会增大,但是单位空间里的物质分子的数目不变,是不会改变转化率的1年前查看全部
- 在密闭容器中,保持一定温度进行如下反应N2+3H2=2NH3,已经加入1molN2和3molH2,在恒压条件下达到平衡
在密闭容器中,保持一定温度进行如下反应N2+3H2=2NH3,已经加入1molN2和3molH2,在恒压条件下达到平衡
在密闭容器中,保持一定温度进行如下反应N2+3H2=2NH3,已经加入1molN2和3molH2,在恒压条件下达到平衡时
生成amolNH3,在恒容条件下达到平衡时生成bmolNH3.若相同条件下达到平衡时混合物中各组分的百分含量不变.
为什么a > 47453b7f5a0130c11年前1
47453b7f5a0130c11年前1 -
 汤告老鼠 共回答了25个问题
汤告老鼠 共回答了25个问题 |采纳率96%恒容条件下,随着气体体积减小,气体释稀程度大于恒压1年前查看全部
- 某化学反应在恒压,绝热和只做体积功的条件下,体系温度由T1升为T2,此过程的焓变为()
某化学反应在恒压,绝热和只做体积功的条件下,体系温度由T1升为T2,此过程的焓变为()
A △H 木石无盟1年前3
木石无盟1年前3 -
 mayp7241 共回答了17个问题
mayp7241 共回答了17个问题 |采纳率82.4%根据题意得,Q=0,三角U=W=-P外DV,H=U+PV,因为恒压,所以三角H=三角U+PDV=-P外DV+PDV,因为恒压,所以P外=P,所以三角H=0.所以答案选B.1年前查看全部
- 蛋白分子量为100kd,湿转,恒压还是恒流好?数值多少较合适?
 oo归来1年前3
oo归来1年前3 -
 gao0610 共回答了13个问题
gao0610 共回答了13个问题 |采纳率100%我们实验室用的是恒压100V,2小时1年前查看全部
- 298K,1.01乘10的5次方KPa,在恒压密闭容器中冲入10摩氮气,30摩氢气,20摩氨气,开始的瞬间,反应向哪移动
 猪的好生活1年前1
猪的好生活1年前1 -
 lixue152 共回答了13个问题
lixue152 共回答了13个问题 |采纳率92.3%氮气和氨气是在高温高压和催化剂的作用下才进行反应,怎么就变成常温了呢?如果常温反应,那就考虑为:相当于对原来的高温感应进行降温,则平衡应该向逆向移动吧,因为该反应是一个放热反应1年前查看全部
- 题目没说是恒容还是恒压,只说是密闭容器,这时是压强不变的容器,还是体积不变的容器?
 159775321年前1
159775321年前1 -
 aihua4023 共回答了20个问题
aihua4023 共回答了20个问题 |采纳率95%如果题目没有特别说明是恒容还是恒压,那么这道题一般不涉及等效平衡问题,因为等效平衡要考虑m+n是否等于p+q然后再考虑是恒容还是恒压.
大可不必担心1年前查看全部
- 当容器为恒压时,混合气体的密度可以用来判定是否达到动态平衡
当容器为恒压时,混合气体的密度可以用来判定是否达到动态平衡
当容器恒容时,并且反应前后无物质状态转变(气→固),就可以用密度来判定可逆反应是否达到动态平衡了吧? xu47911年前1
xu47911年前1 -
 老妖01 共回答了15个问题
老妖01 共回答了15个问题 |采纳率80%这个题应说明它在的环境才好回答.1;在真空环境中,2;在大气环境中.1年前查看全部
- 同一反应,无论是以恒压途径还是以恒容途径完成,其反应的焓变不变,热力学能的改变量也不变,
同一反应,无论是以恒压途径还是以恒容途径完成,其反应的焓变不变,热力学能的改变量也不变,
恒压途径的焓变和恒容途径的焓变是不一样的呀? kgjkdf431年前1
kgjkdf431年前1 -
 zirui1 共回答了11个问题
zirui1 共回答了11个问题 |采纳率100%因为H和U均是状态函数,状态函数只与初终态有关,而与过程无关.
例如,温度T是状态函数,
1、将水从20度(初态)降温到10度,再由10度升温到90度(终态),温度的初终态变化是90-20=70度;
2、同样将水从20度(初态)升温到50度,再由50度降温到30度,再由30度升温到90度(终态),这时初终态的温度差仍然是90-20=70度.
焓或者热力学能一样,是体系的状态函数,只要初终态一样,它的改变值是相同的,不管经过了什么过程,同温度一样的道理.1年前查看全部
- 对不起,我打错了,我说假如是恒容的,恒容的不是会随着反应进行压强减小,也就是浓度减少吗?而恒压的话,它反应进行活塞向里,
对不起,我打错了,我说假如是恒容的,恒容的不是会随着反应进行压强减小,也就是浓度减少吗?而恒压的话,它反应进行活塞向里,压强不变,所以相对于恒容的来说不就相当与加压吗?加压的实质不就是为了增大反应物的浓度吗.所以和恒容的一比,恒压的不就一直向着减小压枪的方向进行吗?这是我的疑问.困扰我好久了
 野蛮小妖精1年前3
野蛮小妖精1年前3 -
 谁染枫林醉 共回答了12个问题
谁染枫林醉 共回答了12个问题 |采纳率91.7%恒温恒压,说明反应过程中始终保持压强不变,所以你认为相当于加压是不对的.
另外,加压指认为缩小气体体积压强变大,不是反应过程中气体体积缩小就是加压,只有人为干扰,即认为加压才是加压.1年前查看全部
- 请问N2+3H2=2NH3的反应恒压充入氢气是不是相当于增加氢气浓度?那氢气转化率应该怎么变呢?
 bjx0011年前2
bjx0011年前2 -
 yymings 共回答了24个问题
yymings 共回答了24个问题 |采纳率91.7%不是 恒压 你充入氢气体积也会跟着变大的 所以浓度不变 而是整体体积增大所以其他气体的浓度变小 就相当于氢气浓度变大 从而反应正反应速率变大,但是氢气转化率降低1年前查看全部
- 无压力管道严密性试验记录表格中 恒压时间补入的水量W 怎么填
 rhbnh1年前1
rhbnh1年前1 -
 0o玻璃翅膀o0 共回答了20个问题
0o玻璃翅膀o0 共回答了20个问题 |采纳率85%反推:
按规范查出允许的渗水量 任取一个数值(必须小于允许渗水量),在根据公式 W=qxTL 求出补水量W 单位要记得自己换算.1年前查看全部
- 相同温度下,两个恒压密闭容器中发生可逆反应:X2(g)+3Y2(g)⇌2XY3(g)△H=-92.6kJ•mol-1,实
相同温度下,两个恒压密闭容器中发生可逆反应:X2(g)+3Y2(g)⇌2XY3(g)△H=-92.6kJ•mol-1,实验测得反应在起始及达到平衡时的有关数据如下表所示:
下列叙述正确的是( )容器编号 起始时各物质物质的量/mol 达平衡时体系能量变化 X2 Y2 XY3 ① 0.1 0.3 0 4.63kJ ② 0.8 2.4 0.4 Q(Q>O)kJ
A.反应的平衡常数:①>②
B.达到平衡时,容器①、②中各物质的百分含量相同
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol•L-1
D.若容器①体积为0.20L.则达平衡时放出的热量大于4.63kJ xbsqmxbsqm1年前1
xbsqmxbsqm1年前1 -
 308333 共回答了15个问题
308333 共回答了15个问题 |采纳率86.7%解题思路:A、平衡常数只与温度有关;
B、容器②中按化学计量数转化到左边可得X20.2mol,Y20.6mol,所以X2总量为1mol,Y2总量为3mol,n(X2):n(Y2)=1:3,与容器①中对应物质的物质的量比相同,温度恒压下,容器①、②中达到平衡为等效平衡;
C、温度恒压下,容器①、②中达到平衡为等效平衡,平衡时两个容器中XY3的物质的量浓度相同,不知道起始的体积无法计算平衡时的体积.
D、容器①达平衡时放出的热量4.63kJ,生成的XY3的物质的量为[4.63kJ/92.6kJ]×2mol=0.1mol,不知道起始的体积无法判断平衡时XY3的物质的量与0.1mol关系.A、平衡常数只与温度有关,温度不变,对同一反应平衡常数不变,故A错误;
B、容器②中按化学计量数转化到左边可得X20.2mol,Y20.6mol,所以X2总量为1mol,Y2总量为3mol,n(X2):n(Y2)=1:3,与容器①中对应物质的物质的量比相同,温度恒压下,容器①、②中达到平衡为等效平衡,达到平衡时各物质的百分含量相同,故B正确;
C、由B分析可知,容器①、②中达到平衡为等效平衡,平衡时两个容器中XY3的物质的量浓度相同,不知道起始的体积无法计算平衡时的体积,故不能得到具体的浓度,故C错误;
D、恒温恒压下,所以容器①中的物质的转化率一定,达平衡时放出的热量4.63kJ,生成的XY3的物质的量为[4.63kJ/92.6kJ]×2mol=0.1mol,不知道起始的体积无法判断平衡时XY3的物质的量与0.1mol关系,无法判断达平衡时放出的热量与4.63kJ关系,故D错误.
故选:B.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡移动问题、等效平衡、反应热等问题,题目难度不大,注意等效平衡规律.1年前查看全部
- 在一定温度下,有A,B两容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO2气体,如果只考
在一定温度下,有A,B两容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO2气体,如果只考虑发生下列可逆反应:2NO2==N2O4,分别经过一段时间后,A,B都达到平衡,下列叙述正确与否?---平均反应速率A〉B
B的平均反应速率应该怎么看呢
但是,B达到的平衡并不相同啊,各物质浓度变化量不同,时间也不一定啊,速率该怎么判断啊? beater1年前4
beater1年前4 -
 dongweichuan 共回答了17个问题
dongweichuan 共回答了17个问题 |采纳率88.2%反应的正反应是体积减小,也可以说是压强减小.根据乐夏特列原理,那么随着反应的进行,反应就会向能增大压强的方向进行,即向逆反应进行.横容密闭容器和恒压密闭容器相比,前者的压强肯定小(因为只要正反应发生,压强必定比开始时小),所以容易向逆反应进行,所以
反应速率应该为B〉A1年前查看全部
- 关于化学平衡的问题t℃时在一定条件下,将1molSO2和1molO2分别置于恒容和恒压的两个密闭容器中,到达平衡状态时放
关于化学平衡的问题
t℃时在一定条件下,将1molSO2和1molO2分别置于恒容和恒压的两个密闭容器中,到达平衡状态时放出的热量为Q1,Q2问哪个大
答案是Q1 zrx851年前1
zrx851年前1 -
 lychee_lu 共回答了18个问题
lychee_lu 共回答了18个问题 |采纳率88.9%增大压强,平衡向压强减小的方向移动.本题中,由于反应后气体体积会减小,故恒容的容器压力会减小,即小于恒压的容器.二者相较,是恒压的容器增大了压强,平衡向正反应方向移动,放出更多热量1年前查看全部
- 在NO2+SO2=NO+SO3(液态) 其它都是气体 恒压密闭容器中发生上述反应时,若加入Ar气,使得反应速率_____
 况利民1年前2
况利民1年前2 -
 凤凰地接 共回答了17个问题
凤凰地接 共回答了17个问题 |采纳率76.5%变慢.体感所说反应容器为恒压封闭容器,氩气为惰性气体不参与反应,如此,冲入一定体积氩气而容器内压强不变,即容器内气体总体积增加,而参与反应气体不变,则参与反应之气体浓度下降,反应气体浓度下降会导致反应率下降,则反应速率下降1年前查看全部
- 已知恒压反应 N2(g) + 3 H2(g) = 2 NH3(g)在298K的ΔrUm = -92*10^3 J/mol
已知恒压反应 N2(g) + 3 H2(g) = 2 NH3(g)在298K的ΔrUm = -92*10^3 J/mol,试计算该反应在298K的ΔrHm
 bhdshsr78811年前1
bhdshsr78811年前1 -
 光头666 共回答了19个问题
光头666 共回答了19个问题 |采纳率84.2%ΔrHm=ΔrUm+ΔnRT1年前查看全部
- 合成氨反应,恒容合成氨反应1.恒温恒容,通入氩气.平衡怎样移动.2.恒温恒压,通入氩气.平衡怎样移动.---------
合成氨反应,恒容
合成氨反应
1.恒温恒容,通入氩气.平衡怎样移动.
2.恒温恒压,通入氩气.平衡怎样移动.
---------------------------------------
我想的是,
1.恒容,通氩气,相当于压强增大,影响压强减小的方向移动.
2.恒压,通氩气,体积增大,各反应物浓度均减小,平衡不移动.
可是答案不是这样的.
为什么对反应物影响比生成物影响大 崇天1年前3
崇天1年前3 -
 再见依然 共回答了19个问题
再见依然 共回答了19个问题 |采纳率94.7%1.恒温恒压 通入惰性气体 虽然压力增加了 但是 反应物的浓度c=n/v不变~
2.恒温恒压,通入惰性气体,要维持恒压 必须膨胀体积 所以体积V增大 各物质浓度C=n/v 都变小了 反应物 生成物浓度都变小了 但是对反应物影响比生成物影响大 故向气体体积膨胀的方向移动 也就向左反应
N2+3H2====2NH3
大学三年级学化学的解答 因为大学还会分析大气压 体积 温度 对反应方向的影响 因为看这是高中化学题 就不详细解释了~平衡反应说到底在恒温恒压下对浓度的分析就可以知道方向1年前查看全部
- 一盏电灯接在恒压的电源上,其功率为100W,若将这盏灯先接上一段很长的导线后,再接在同一电源上,在导线上损失的电功率是9
一盏电灯接在恒压的电源上,其功率为100W,若将这盏灯先接上一段很长的导线后,再接在同一电源上,在导线上损失的电功率是9W,那么这时电灯实际消耗的电功率将( )
A. 等于91 W
B. 小于91 W
C. 大于91 W
D. 条件不足,无法确定 clarkralf1年前3
clarkralf1年前3 -
 fangpeiliu 共回答了21个问题
fangpeiliu 共回答了21个问题 |采纳率90.5%解题思路:已知导线和灯泡串联,导线电阻较大,说明电路电阻变大,根据公式P=
可知,电路的总功率变小,已知导线消耗的功率从而可以求出灯泡消耗的功率.U2 R 如果导线电阻忽略时,灯接在恒定电压的电源上功率是100W;
因为导线和灯泡串联,当导线上电阻较大时,即电路中的电阻变大,
由P=
U2
R可知电路消耗的总功率变小,即小于100W,而导线上消耗的功率为9W,
所以灯泡的实际功率只能小于91W.
故选:B.点评:
本题考点: 电功、电功率.
考点点评: 本题考查电功率计算公式的应用,特别注意实际功率与额定功率的区别,不难.1年前查看全部
- t℃时,在一定条件下,将1molSO₂和1molO₂分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q
t℃时,在一定条件下,将1molSO₂和1molO₂分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q₁,Q₂ 化学反应的热量变化前者小于后置的是
 wx123451年前3
wx123451年前3 -
 ww11ww22 共回答了13个问题
ww11ww22 共回答了13个问题 |采纳率92.3%Q11年前查看全部
- 恒压A(g)+2B(g)=3C(g)按2:1物质的量比加入A和B达到平衡后A物质的体积分数为p%再加入nmolC达到平衡
恒压A(g)+2B(g)=3C(g)按2:1物质的量比加入A和B达到平衡后A物质的体积分数为p%再加入nmolC达到平衡分数为?
 韵脚画皮1年前1
韵脚画皮1年前1 -
 锐艺 共回答了17个问题
锐艺 共回答了17个问题 |采纳率100%题目中2:1应该是B和A的比吧?如是的话,因为是恒压,反应前后物质的量不变,加入C后,在相同条件下,分解得到A和B的比还是1:2.1年前查看全部
- 只是我一直没弄清楚…例如:某物质在恒压且非体积功为零的条件下!此处的恒压是气体压力还是环境压力?还有是不是没有特殊指明一
只是我一直没弄清楚…
例如:某物质在恒压且非体积功为零的条件下!此处的恒压是气体压力还是环境压力?还有是不是没有特殊指明一般都认为是环境压力… 板板6451年前1
板板6451年前1 -
 kaisen_jen 共回答了16个问题
kaisen_jen 共回答了16个问题 |采纳率93.8%应该是环境压力,但题目给这样的条件是告诉你你所考虑的对象压强不变.1年前查看全部
- 化学平衡题,急 (4)相同温度下,有相同体积的恒容密闭容器A和恒压密闭容器B, A容器中充入1molN2和3molH2、
化学平衡题,急 (4)相同温度下,有相同体积的恒容密闭容器A和恒压密闭容器B, A容器中充入1molN2和3molH2、B容器中充入2molN2和6molH2,充分反应达到平衡状态,A中NH3的体积分数为a ,放出热量Q1kJ;B中NH3的体积分数为b ,放出热量Q2kJ .则: a___b(填“>、=或
 shan136355399371年前1
shan136355399371年前1 -
 454957472 共回答了17个问题
454957472 共回答了17个问题 |采纳率100%a、=或1年前查看全部
- 恒压反映热Q=△H,那为什么△H是状态函数,而Q不是状态函数呢?
 搜狐菜地守望者1年前1
搜狐菜地守望者1年前1 -
 bailinmu 共回答了20个问题
bailinmu 共回答了20个问题 |采纳率95%只是在恒压的条件下,Q的值等于△H,与他们自身的意义无关1年前查看全部
- 一定条件下,在某恒压容器中发生如下反应:CO(g)+2H2=CH3OH(g),若开始时只充入1molCH3OH的蒸气,达
一定条件下,在某恒压容器中发生如下反应:CO(g)+2H2=CH3OH(g),若开始时只充入1molCH3OH的蒸气,达到平衡时,混合物的压强比起始时增大了70% :若开始后充入2mol的CO和4MOL的H2的混合气体,达到平衡时CO的转化率为(65% )
先写分析过程,在写计算过程.. wrh5861年前2
wrh5861年前2 -
 998599 共回答了22个问题
998599 共回答了22个问题 |采纳率100%首先,两种情况下的CO的物质的量分数是一样的.
第一种情况下的总物质的量为1MOL,达到平衡后,总物质的量为1.7MOL,
由此可算出有0.35MOL的CH3OH参与了反应,并生成了0.35MOL的CO.
所以,第二种情况中CO的物质的量分数为0.35/1.7 再设第二种情况下的CO有X MOL参加了反应.再列出等式即可求出答案.1年前查看全部
- 恒定容器,充入惰性气体,化学反应如何改变?恒压容器充入惰性气体,反应速率如何改变?
 心医1年前1
心医1年前1 -
 清蒸带鱼 共回答了18个问题
清蒸带鱼 共回答了18个问题 |采纳率72.2%恒定容器,充入惰性气体,容器体积未变、反应物生成物物质的量未变,所以反应物生成物浓度未变,化学反应速率不变.
恒压容器,充入惰性气体,容器体积变大、反应物生成物物质的量未变,所以反应物生成物浓度变小,反应速率变小.1年前查看全部
- 物理学题目已知一个容器内气体体积V1=1.0m3,温度T1=4℃,压强P1=1Mpa,该容器内气体释放到一个恒压容器内,
物理学题目
已知一个容器内气体体积V1=1.0m3,温度T1=4℃,
压强P1=1Mpa,该容器内气体释放到一个恒压容器
内,容器恒压为P2=0.1Mpa,求体积V2和温度T2分
别是多少? 8638201年前1
8638201年前1 -
 爱人775 共回答了21个问题
爱人775 共回答了21个问题 |采纳率85.7%P1*V1/T1=P2*V2/T2 因为P1=10P2所以10V1=V2=0.1(m^3)(气体受压小) 1/T2=P1*V1/P2*V2*T1=1*1/0.1*0.1*4=1/0.04=25 T2=0.04(度)1年前查看全部
- 为什么容积可变的恒压容器中,充入一种不反应的气体,气态物质的浓度发生变化
 yy人0011年前1
yy人0011年前1 -
 孙勇进 共回答了21个问题
孙勇进 共回答了21个问题 |采纳率85.7%你充入不反应气体后~体积是变大的,根据公式CV=n知,浓度是变小了1年前查看全部
- 请问吉布斯自由能判据的适用条件的压强是等压还是恒压?
请问吉布斯自由能判据的适用条件的压强是等压还是恒压?
等压是始末相同过程中可变,这里是等压还是恒压呢?另外,定压又是指什么? 我的加州我的梦1年前1
我的加州我的梦1年前1 -
 白袍小子256 共回答了16个问题
白袍小子256 共回答了16个问题 |采纳率93.8%吉布斯自由能是状态函数是吧,所以判据只需要考虑体系的初末状态就可以了.所以按你说的是等压条件.
我学的那个时候还没分的这么细,就一个等压条件,但意思相当于你说的恒压.至于只考虑初末状态的这样的“等压”条件,都是要仔细说清楚的,不能用一个词就带过的.定压我就根本没听过了,问问你们老师吧.1年前查看全部
- 化学平衡与速率1、两容器A和B,A恒压,B恒容,容积相等,起始时分别向AB通入体积比2:1的等量的SO2和O2,并达到平
化学平衡与速率
1、两容器A和B,A恒压,B恒容,容积相等,起始时分别向AB通入体积比2:1的等量的SO2和O2,并达到平衡.问起始时两容器中的反应速率___较大;反应过程中的反应速率___较大.(说明原因)
2、某温度下,在容积固定的密闭容器中发生可逆反应:A(g)+2B(g)===2Q(g).平衡时,各物质的浓度比为A:B:C=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、Q,则下列说法正确的是:
A、刚充入的反应速率V正减少,V逆增大
B、达到新的平衡时,反应混合物中AB的物质的量分数增加
C、达到新的平衡时,ABQ浓度之比仍为1:1:2
D、达到新的平衡过程中,体系压强先增大,后逐渐减小
3、将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间的关系如图(可惜不能显示出来),在下列因素中:
1.盐酸的浓度 2.镁带的表面积 3.溶液的浓度 4.氢气的压强 5.氯离子浓度
影响反应速率的因素有_________
解释图中速率增大段AB形成的原因_________
解释图中速率到达最大值后速率逐渐减小段的原因_________
 Nancylu83161年前1
Nancylu83161年前1 -
 chenyigirl 共回答了20个问题
chenyigirl 共回答了20个问题 |采纳率95%1.起始时速率相等.因所有条件都一样,速率也一样.反应过程中恒压容器中速率快.因这是一个等体积气体反应,恒压时体积会减小,浓度相对恒容的要大,所以速率快.
2.D.
A.速率都增大
B.此操作相当于加压,平衡向正反应移动.Q体积分数增大.
C.因平衡发生移动,比值变化.若是恒压,平衡不移动,则不变.
D.刚充入时,压强增大,因平衡向右移动,分子数减少,压强减小.
3.影响因素:123
AB增大是因为该反应放热,温度上升,速率增大.
过B后是因为盐酸浓度减小太多,浓度的影响超过了温度的影响,所以速率减小.1年前查看全部
- 在某温度时,一定量的元素A的氢化物AH3在恒温恒压的密封容器中完全分解为两种气态单质,此时容器的体积变为原来的7/4,则
在某温度时,一定量的元素A的氢化物AH3在恒温恒压的密封容器中完全分解为两种气态单质,此时容器的体积变为原来的7/4,则A单质的分子式为( ),AH3分解反应的化学方程式为( ).
 郑重1年前4
郑重1年前4 -
 jinhaixiupin 共回答了18个问题
jinhaixiupin 共回答了18个问题 |采纳率100%A4 设它的分子式是AX,其分解式为
XAH3===AX+ (3 X /2 )H2
因为容器的体积变为原来的7/4
所以[1+(3 X /2 )]/ X=7/4
解得X=4
所以其分子式为A4
分解式为4AH3===A4+ 6H21年前查看全部
- 相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3mol H2,此时两容器的体积相等.
相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3mol H2,此时两容器的体积相等.
在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1KJ;B中NH3的体积分数为b,放出热量Q2KJ.问:a与b的大小关系,Q1和Q2的大小关系,Q1与92.4的大小关系(因为1mol N2和3mol H2反应的△H为-92.4KJ/mol) 请有才之人写出具体的步骤,我要最具体的步骤, zhongliaoning1年前1
zhongliaoning1年前1 -
 fu_rong57 共回答了18个问题
fu_rong57 共回答了18个问题 |采纳率88.9%这个反就是可逆反应的1年前查看全部
- 在一定温度下,有A,B两个容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO2气体,如果只
在一定温度下,有A,B两个容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO2气体,如果只考虑发生下列可逆反应:2NO2=N2O4,分别经过一段时间后,A,B都达到平衡.下列有关叙述正确的是( )
A.平衡反应速率:A>B B.平衡时NO2物质的量:B>A C.平衡时NO2的转化率:A>B D.平衡时N2O4物质的量:B>A ho3211231年前2
ho3211231年前2 -
 上只角小开 共回答了15个问题
上只角小开 共回答了15个问题 |采纳率100%D
A是恒容密闭容器,-----即容器体积不变,随反应进行,容器中压强会减小
B是恒压密闭容器----即有活塞,而且会向内运动,即容器的体积会减小
A.平衡反应速率:A>B -----错,平衡时A的体积大,相当于压强小,因此速率小
B.平衡时NO2物质的量:B>A ----错,B容器体积变小,相当于加压,平衡正向移动,生成的N2O4多,NO2则少
C.平衡时NO2的转化率:A>B ----错,B中的转化率大
D.平衡时N2O4物质的量:B>A----对1年前查看全部
- 在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO(2写在右下角
在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器.两容器起始状态完全相同,其中都充有NO(2写在右下角)气体,如果只考虑发生下列可逆反应:2NO(2写在右下角)【可逆符号】N(2写右下角)O(4写右下角),分别经过一段时间后,A、B都达到平衡,下列有关叙述正确的是(CD )
A 平均反应速率A>B
B 平衡时NO(2写右下角)的物质的量B>A
C平衡时NO(2写右下角)的转化率B>A
D平衡时N(2写右下角)O(4写右下角)的物质的量B>A
【注:已经知道答案选CD,我要问的是有关这道题的一个解题知识点:(我们班老师总结的):同一反应在不同的容器中,恒温恒压相当于在恒温恒容的基础上增大压强.这个规律是在任何情况下都成立吗?即如果正反应是体积增大的反应的时候还是成立的吗?这块小生不大明白, 情报局1年前1
情报局1年前1 -
 2005jie11 共回答了15个问题
2005jie11 共回答了15个问题 |采纳率86.7%你可以这样考虑:
此反应:2NO2 → N2 +2O2 由2体积的NO2 生成1体积氮气和2体积氧气,由2体积气体一共生成3体积气体,是气体体积增加的反应;记住压强增加,可逆反应的平衡向气体体积减小的方向移动.
A: 恒容就是体积不变,但是压强会变.B: 恒压就是压强不变.
而此反应是气体体积增加的反应,也就是反应进行中若容器容积不变则压强会变大.所以,A恒容增压,反应向逆反应方向移动,生成的氮气和氧气的体积比B小,反应速率也小.
但是,同一反应在不同的容器中,恒温恒压相当于在恒温恒容的基础上增大压强.这不对吧.应该是同一体积增大的反应在不同的容器中,恒容相当于在恒压的基础上增大压强.而体积增大的反应,恒容相当于在恒压的基础上增大压强.1年前查看全部
- 在恒压情况下,氮气氢气氨气达到平衡状态,此时向容器充一点氮气,问,(1)此时正反应速率的变化,(2)平衡转化率变化
在恒压情况下,氮气氢气氨气达到平衡状态,此时向容器充一点氮气,问,(1)此时正反应速率的变化,(2)平衡转化率变化
(1)情境是恒温恒压(2)我最想弄清楚的是再次充入氮气候容器体积也扩大了虽然氮气浓度增加,但是氢气和氨气浓度都减小(瞬时)且氢气减小的程度还大于氨气,这该如何判断 邹优丽1年前3
邹优丽1年前3 -
 huynhgiaban 共回答了10个问题
huynhgiaban 共回答了10个问题 |采纳率100%我们来分析这个反应.
N2+3H2=2NH3
从计量数可以看出反应向正方向进行,气体总体积是变小的,这样反应速率就会逐渐减慢.
加入氮气之后,正方向反应物增加,反应速率加快,平衡也会向正方向移动,但是平衡之后氮气含量会增大(因为氢气减少,氮气相对的比例就大了)
这样就得到了你的问题的答案:
(1)变快
(2)氢气转化率增大,氮气转化率减小1年前查看全部
- 苯甲酸的恒压燃烧热是多少
 windows01年前1
windows01年前1 -
 清水人家 共回答了19个问题
清水人家 共回答了19个问题 |采纳率94.7%Qv=Qp+ΔnRT Δn=反应后的气体的物质的量-反应前气体的物质的量 Qv=3226.8KJ/mol1年前查看全部
- 反应热的前提是要在恒压条件下的吗?为什麽?
反应热的前提是要在恒压条件下的吗?为什麽?
如果不是的话,为什麽百科中的定义是说在恒压条件下的
恒温恒容的Qv等于什麽 落破帅哥1年前1
落破帅哥1年前1 -
 menxyz 共回答了18个问题
menxyz 共回答了18个问题 |采纳率94.4%有恒压反应热和恒容反应热两种,看你指哪种!封闭体系,非体积功为零时,恒压反应热等于反应焓变,恒容反应热也等于反应焓变!1年前查看全部
- 化学等效平衡很难的题两容器,起始体积相同,一个恒压,一个恒容.一个充3摩尔A,1摩尔B,另一个充a摩尔A,b摩尔B,c摩
化学等效平衡很难的题
两容器,起始体积相同,一个恒压,一个恒容.
一个充3摩尔A,1摩尔B,另一个充a摩尔A,b摩尔B,c摩尔C,达平衡时两容器压强相等,C的体积分数相等,则a,b,c的关系式如何?
反应式:3A+B=2C,为放热反应 wgh16333331年前1
wgh16333331年前1 -
 总会有情天 共回答了16个问题
总会有情天 共回答了16个问题 |采纳率87.5%答案:a=3b,c大于等于0.
由于“达平衡时两容器压强相等,C的体积分数相等”,可知这两个反应是等效的.
反应方程式:3A+B=2C,可知反应前后系数不等,所以,这种类型的反应要想达到等效平衡,必须满足:对应的反应物的量与对应的系数都成一定的比例.已知“充3摩尔A,1摩尔B”与“充a摩尔A,b摩尔B,c摩尔C”是等效的,可列:
3A+B==2C
3----1
a----b---c(可将cmolC看成1.5cmol的A和0.5cmol的B)
(a+1.5c)----(b+0.5c)----0
要想达到平衡,必须满足:
(a+1.5c)/3=(b+0.5c)/1
可解得:a=3b,与c的量无关,但同时要说明c大于等于零.1年前查看全部
大家在问
- 1not paid 和 unpaid 的区别
- 2[求助]高中英语小作文作文内容:朋友Joe将抵达你所在的城市,但你由于工作不能去陪他,写张便条给你的朋友Steve,拜托
- 3f(x)=x+1/x的图像怎么画,这是什么函数,有什么性质
- 4醉翁亭记中乐的全部意思
- 5一个圆柱半径为5米,高是8米,表面积是多少?体积是多少?
- 640075.69读作( )
- 7英语!英语!根据句意及首字母填空.1.Is there r________ why you are late?2.In
- 8它是一条运河,它的长度是1800千米;它是世界上最长、开凿最早的人工河;它自北向南经过4省2市、贯通海河等五大水系;这条
- 9Are dress codes important?Is it right for people to judge yo
- 10什么是文化产物?有那些?请尽量详细说明!
- 11What do we need if we want to grow a flower?
- 12she is afraid of_(蜘蛛)
- 13下图中正方形的周长是16cm,圆的周长是多少,阴影部分面积是多少
- 14"Do you know what the best thing is"与"Do you know what is th
- 15人类生男生女的奥秘可用如图表示,据图回答问题。 (1)写出图中序号所代表的染色体符号
