若某菱镁矿含MgCO3的百分含量为60%,由菱镁矿制备碳酸镁的产率是89%,由碳酸镁制备金属镁的产率是95%,则1t菱镁
 蓝色幽灵lyx2022-10-04 11:39:541条回答
蓝色幽灵lyx2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 li889154 共回答了15个问题
li889154 共回答了15个问题 |采纳率100%- 菱镁矿含MgCO3的百分含量为60%,则1t菱镁矿含MgCO3=1*60%=0.6t
由菱镁矿制备碳酸镁的产率是89%,则可产MgCO3=0.6*89%=0.534t
由碳酸镁制备金属镁的产率是95%,镁的相对原子质量为24,碳的相对原子质量为12,氧的相对原子质量为16,
所以1t菱镁矿通过上述生产方法可制得金属镁的质量=1*60%*89%*95%*24/84=0.145t - 1年前
相关推荐
- 这个文件检索的检索式怎么写啊?“高硅高钙高铁型低品级菱镁矿选矿提纯方面的文献”
这个文件检索的检索式怎么写啊?“高硅高钙高铁型低品级菱镁矿选矿提纯方面的文献”
“高硅高钙高铁型低品级菱镁矿选矿提纯方面的文献”的检索式怎么写啊 牛奶蘇1年前1
牛奶蘇1年前1 -
 wanglei1112 共回答了14个问题
wanglei1112 共回答了14个问题 |采纳率92.9%我在万方里试检了一下,用这个比较合适:(高硅+高钙+高铁)*
但是结果也不多,论文11条,专利4条.
当然你还可以扩展下检索策略,直接用:菱镁矿*提纯
结果:论文22条,专利13条1年前查看全部
- 高一化学某火力发电厂所在地有较丰富的石灰石和菱镁矿(主要成分为碳酸镁),若该发电厂以含硫重油作燃料,请就地取材提出两种吸
高一化学
某火力发电厂所在地有较丰富的石灰石和菱镁矿(主要成分为碳酸镁),若该发电厂以含硫重油作燃料,请就地取材提出两种吸收二氧化硫的方法,写出有关反应的化学方程式
 耶稣的阳光不照我1年前1
耶稣的阳光不照我1年前1 -
 李琴 共回答了14个问题
李琴 共回答了14个问题 |采纳率92.9%CaCO3+SO2=CaSO3+CO2
MgCO3+SO2=MgSO3+CO21年前查看全部
- (2013•大连二模)菱镁矿主要成分为MgCO3,MgCO3中碳元素的化合价是( )
(2013•大连二模)菱镁矿主要成分为MgCO3,MgCO3中碳元素的化合价是( )
A.-4
B.-2
C.+2
D.+4 shdcli1年前1
shdcli1年前1 -
 千益 共回答了15个问题
千益 共回答了15个问题 |采纳率86.7%解题思路:根据在化合物中正负化合价代数和为零,结合MgCO3的化学式进行解答本题.镁元素显+2价,氧元素显-2价,设碳元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+x+(-2)×3=0,则x=+4价.
故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则(化合物中正负化合价代数和为零)计算指定元素的化合价的方法即可正确解答本题.1年前查看全部
- 由菱镁矿(主要成分为MgCO 3 )制阻燃型氢氧化镁的工艺流程如下:
由菱镁矿(主要成分为MgCO 3 )制阻燃型氢氧化镁的工艺流程如下:

(1)从下面两图可以得出的结论为 、 。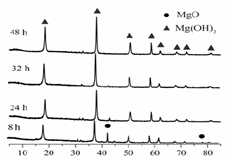
图1 25℃时MgO水化随时间变化X射线衍射谱图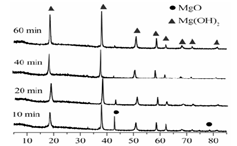
图2 90℃时MgO水化随时间变化X射线衍射谱图
(2)水化反应MgO+H 2 O = Mg(OH) 2 能自发进行的原因是 。
(3)结合元素周期律和表1可知,金属氢氧化物受热分解的规律有 。(写一条即可)
表1 部分主族元素的金属氢氧化物热分解温度/℃LiOH NaOH KOH Al(OH) 3 Mg(OH) 2 Ca(OH) 2 Ba(OH) 2 924 不分解 不分解 140 258 390 700
(4)已知热化学方程式:Mg(OH) 2 (s) =" MgO" (s)+H 2 O (g) ΔH =" 81.5" kJ·mol -1
①Mg(OH) 2 起阻燃作用的主要原因是 。
②与常用卤系(如四溴乙烷)和有机磷系(磷酸三苯酯)阻燃剂相比,Mg(OH) 2 阻燃剂的优点是 。 三维动画制作1年前1
三维动画制作1年前1 -
 ww过客1975 共回答了19个问题
ww过客1975 共回答了19个问题 |采纳率68.4%(1)随着水化时间延长,MgO的量不断减少,Mg(OH) 2 的量不断增加 ;温度升高,水化反应速率加快。
(2)ΔH < 0
(3)金属离子半径越大,氢氧化物越难分解(或金属性越强,氢氧化物越难分解等)
(4)①Mg(OH) 2 分解时吸热,使环境温度下降;同时生成的耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳。②无烟、无毒、腐蚀性小
1年前查看全部
- (2014•黄浦区一模)氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分
(2014•黄浦区一模)氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)加入H2O2氧化时,发生反应的化学方程式为______.
(2)滤渣2的成分是______(填化学式).
(3)煅烧过程存在以下反应:2MgSO4+C═2MgO+2SO2↑+CO2↑
MgSO4+C═MgO+SO2↑+CO↑ MgSO4+3C═MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.
①D中收集的气体可以是______(填化学式).
②B中盛放的溶液可以是______(填字母).
a.NaOH溶液 b.Ca(OH)2溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:3S+6OH-
2S2-+SO32-+3H2O△ .3S+6OH-.
2S2-+SO32-+3H2O△ . 天津哲哲1年前1
天津哲哲1年前1 -
 philanthropist20 共回答了19个问题
philanthropist20 共回答了19个问题 |采纳率94.7%解题思路:流程分析可知,以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁,菱镁矿加入酸溶解,过滤得到溶液中含有亚铁离子和镁离子,滤液中加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH为4,使铁离子全部沉淀,过滤得到滤渣2为氢氧化铁沉淀,滤液经处理得当纯净的氧化镁;
(1)过氧化氢在酸性条件下氧化硫酸亚铁为硫酸铁;
(2)加入氨水调节溶液PH使氢氧化铁全部沉淀;
(3)煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集.(1)加入H2O2 氧化时,在酸性溶液中氧化硫酸亚铁为硫酸铁,反应的化学方程式为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O,
故答案为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O;
(3)酸溶后过滤得到溶液中加入过氧化氢氧化亚铁离子为铁离子,加入氨水调节溶液PH使铁离子全部沉淀,过滤后所以得到沉淀为氢氧化铁,
故答案为:Fe(OH)3;
(3)煅烧得到的气体主要有SO2、CO2、CO、S,产生的气体进行分步吸收或收集,所以通过A使硫蒸气冷凝下来,再通过B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集;
①D中收集的气体可以是CO,故答案为:CO;
②B中盛放的溶液可以KMnO4溶液吸收二氧化硫,故答案为:d;
③A中得到的淡黄色固体与热的NaOH溶液反应,依据氧化还原反应原理,产物中元素最高价态为+4,最低价为-2价,反应的离子方程式为:3S+6OH-
△
.
2S2-+SO32-+3H2O,
故答案为:3S+6OH-
△
.
2S2-+SO32-+3H2O.点评:
本题考点: 制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了镁铝及其化合物、二氧化硫性质应用,混合物分离方法和实验操作方法,物质性质熟练掌握是解题关键,题目难度中等.1年前查看全部
大家在问
- 1英语翻译1.SoftwalkA 9mm PU underlay with superb underfoot confor
- 2maybe 和may be的用法 区别,一定要详细额...
- 3英语根据汉语意思完成句子 请尽量完成这项工作.Please try ( ) ( ) this work today
- 4关于做语文阅读和平时读文章的疑惑,望众君解惑.后面会加分的
- 5You ready to lose happy!
- 6描写水的诗.
- 7性状的遗传实质上是亲代通过()过程把()传递给子代.()是基因在亲子间传递的桥梁
- 81.四川某些著名风景旅游景点于8月6日前后相继开放,为了更好的吸引顾客前去浏览,某旅游景点给出团体购买公园门票价如下:
- 9用一笑而过.然后.这是 造句如题- -
- 10从前有三个人,第一个人叫一,第二个人叫二,第三个人叫三,第四个人叫什么?
- 11人类对野生动物的破坏造成的后果
- 12已知一个三角形的两个坐标,求第三点的坐标.
- 13为什么高锰酸钾酸化可以用高氯酸代替希硫酸呢(不考虑价格的时候)?高氯酸不是也有强氧化性么?
- 14一列火车从一人身后开来,从他身旁开过的时间是15秒,车场105米,时速28.8千米一小时,行人每小时走几千米
- 15为了测量未知电阻Rx(约10欧姆)的阻值,小明准备的器材有,电源3V电流表0-0.6A,开关导线和三个定值电阻R1
