过氧化钙与水反应生成氢氧化钙和氧气的化学方程式
 5760776242022-10-04 11:39:543条回答
5760776242022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
相关推荐
- 饲养观赏鱼,可以陶冶人的情操,增进人们对生活的热爱.空运观赏鱼,必须密封.为了解决鱼的吸氧问题,可在水中加入过氧化钙(化
饲养观赏鱼,可以陶冶人的情操,增进人们对生活的热爱.空运观赏鱼,必须密封.为了解决鱼的吸氧问题,可在水中加入过氧化钙(化学式:CaO2),过氧化钙与水反应,生成氢氧化钙[Ca (OH)2]和氧气.
(1)写出过氧化钙与水反应的化学方程式______
(2)一位养鱼爱好者欲测定所用过氧化钙样品中过氧化钙的质量分数,做了如下实验:称取样品2.0g,加入到足量的水中,生成了0.32g氧气.试计算所用样品中过氧化钙的质量分数. 快乐得人1年前1
快乐得人1年前1 -
 浴火中凤凰 共回答了14个问题
浴火中凤凰 共回答了14个问题 |采纳率85.7%解题思路:根据题干提供的信息即可写出有关反应的化学方程式,书写化学方程式要注意:①化学式要正确;②遵循质量守恒定律;③写必要的条件;④是否有“↑”或“↓”;
计算样品中过氧化钙的质量分数时,根据化学方程式求出过氧化钙的质量,再除以样品的质量即可求得.(1)该氧化钙能与水反应氢氧化钙和氧气,所以本题答案为:2CaO2+2H2O═2Ca(OH)2+O2↑;
(2)设2.0g样品中含CaO2质量为x,则有
2CaO2+2H2O═2Ca(OH)2+O2↑
144 32
x 0.32g
[144/x=
32
0.32g]
x=1.44g
样品中过氧化钙的质量分数为:[1.44g/2.0g]×100%=72%
故答案为:(1)2CaO2+2H2O═2Ca(OH)2+O2↑;(2)答:所用样品中过氧化钙的质量分数为72%.点评:
本题考点: 根据化学反应方程式的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题是对化学方程式计算的考查题,解题的关键是对相关的化学反应中量的有关对应关系的掌握;1年前查看全部
- 过氧化钙与盐酸 氧化钙与盐酸反应的方程式
过氧化钙与盐酸 氧化钙与盐酸反应的方程式
过氧化钙与水反应的化学方程式 oovod1年前1
oovod1年前1 -
 ciarasa 共回答了17个问题
ciarasa 共回答了17个问题 |采纳率100%过氧化钙与盐酸 CaO2+2HCl===CaCl2+H2O2,2H2O2==2H2O+O2
氧化钙与盐酸反应 CaO+2HCl===CaCl2+H2O1年前查看全部
- 过氧化钙与水反应,向酚酞溶液中加入过氧化钙,现象是溶液先变红,后褪色.为什么?
 july_zjl1年前1
july_zjl1年前1 -
 绿萝凝香 共回答了16个问题
绿萝凝香 共回答了16个问题 |采纳率87.5%过氧化钙融于水显碱性,且其本身有强氧化性1年前查看全部
- 72g过氧化钙与多少克二氧化碳中含氧元素质量相等,
 star_lee99991年前3
star_lee99991年前3 -
 比比看4gcyv41 共回答了26个问题
比比看4gcyv41 共回答了26个问题 |采纳率92.3%设72g过氧化钙与a克二氧化碳中含氧元素质量相等
72×【16×2/(40+16×2)】=a×【16×2/(16×2+12)】
解之得:a=44g
这是初中解法,1年前查看全部
- 过氧化钙(CaO2)是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO,分别称取等量的两份样品进行实验.
过氧化钙(CaO2)是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO,分别称取等量的两份样品进行实验.
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:
2CaO2•XH2O=2CaO+O2↑+2XH2O,得到的O2在标准状况下体积为67.2mL,又知氧气的密度为1.43g/L,该样品中CaO2的质量为______g.
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g.已知:2CaO2+4HCl═2CaCl2+O2↑+2H2O
①样品中CaO的质量为______g.
②样品中CaO2•XH2O的X值为[1/2][1/2]. 东东0071年前1
东东0071年前1 -
 xbk953 共回答了13个问题
xbk953 共回答了13个问题 |采纳率84.6%解题思路:(1)根据生成氧气的质量结合化学方程式可以求算样品在过氧化钙的质量;
(2)根据钙元素的守恒可以求算出样品中氧化钙的质量,并根据化学式的组成来判断出X的值.67.2mL=0.0672L,
由题意知道:氧气质量=1.429 g/L×0.0672L=0.096g
设该样品中CaO2的质量为 x
从方程式2CaO2•XH2O═2CaO+O2↑+2XH2O知:
2CaO2~O2
144 32
x 0.096g
[144/32=
x
0.96g]
解得:x=0.432g
(2)①根据(1)的解答可以知道0.542gCaO2中钙元素的质量=0.432g×[40/40+32]×100%=0.24g;根据题意可以知道本题中所发生的相关反应的化学方程式为:
2CaO2•XH2O=2CaO+O2↑+2XH2O
CaO+2HCl═CaCl2+H2O
CaCl2+Na2CO3═CaCO3↓+2NaCl
从而得到以下关系,设钙元素总质量为y
Ca~CaCO3↓
40100
y0.7g
[40/100=
y
0.7g]
解得:y=0.28 g
所以CaO中钙元素的质量=0.28g-0.24g=0.04 g
所以CaO质量=0.04g÷[40/40+16]×100%=0.056 g
②根据上述解答可以知道样品中CaO2•XH2O的总质量=0.542g-0.056g=0.486 g
所以CaO2•xH2O中水的质量=0.486g-0.432g=0.054 g
则:0.486g×[18x/40+162+18x]×100%=0.054g
解得:x=[1/2]
故答案为:(1)0.432g;
(2)①0.056g;
②[1/2].点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,细致地分析题意(或图表信息)等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.1年前查看全部
- 如何生成过氧化钙
 屋顶的鱼儿1年前5
屋顶的鱼儿1年前5 -
 hezhizhang2000 共回答了15个问题
hezhizhang2000 共回答了15个问题 |采纳率93.3%热心问友 2010-08-08
1.氧化钙与过氧化氢反应可以制得过氧化钙(CaO2):
CaO + H2O2 = CaO2 + H2O
2.可溶性钙盐与过氧化钠反应:
CaCl2 + Na2O2 = CaO2 + 2NaCl
补充:
金属钙在空气中燃烧只得到氧化钙,在纯氧中燃烧才可得到过氧化钙
煅烧碳酸钙也可制得氧化钙1年前查看全部
- 在学校的元旦联欢会上,小王同学表演了“水能生火”的魔术.他向包有过氧化钙(CaO2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.
 在学校的元旦联欢会上,小王同学表演了“水能生火”的魔术.他向包有过氧化钙(CaO2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小明很兴趣,于是,他和同学们进行探究.
在学校的元旦联欢会上,小王同学表演了“水能生火”的魔术.他向包有过氧化钙(CaO2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小明很兴趣,于是,他和同学们进行探究.
【提出问题】该魔术是如何给可燃物脱脂棉提供燃烧的另外两个燃烧条件的呢?
【猜想】①过氧化钙与水反应可能有一种气体和另一种物质生成;②反应过程中可能有热量放出
【设计装置】如图所示
【实验探究】
(1)打开装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃.说明过氧化钙与水反应生成了一种气体,这使可燃物脱脂棉满足了燃烧的一个条件是______.
(2)实验过程中,还观察到U型管A端红墨水液面下降,该现象说明______,这使可燃物脱脂棉满足了燃烧的另一个条件是______.
【拓展提高】
(1)CaO2和H2O反应除生成一种气体外,还生成了一种固体,小明认为生成的固体是Ca(OH)2,小红认为是CaCO3,同学们经过思考讨论后认为小红同学的猜想是错误的,你认为他们的理由是:______.
(2)小明设计了一个实验方案来验证过氧化钙和水反应产生的另一种物质是氢氧化钙,请你帮助他完成:
【问题讨论】实验步骤及操作方法 预期的实验现象 结论 ①取少量过氧化钙放入试管中,加足量水,振荡,
②______
______.①产生气泡,
②______
______.过氧化钙和水反应产生的另一种物质是氢氧化钙
(1)小明尝试上述魔术表演时,滴加水的速度太快,发现脱脂棉没有燃烧起来,请你从燃烧的条件分析原因是______.
(2)过氧化钙和水反应的化学方程式为______. soury1年前1
soury1年前1 -
 aloveybbs 共回答了12个问题
aloveybbs 共回答了12个问题 |采纳率91.7%解题思路:【实验探究】
可燃物燃烧的条件是:与氧气接触,温度达到可燃物的着火点,二者必须同时具备,缺一不可;
温度越高,气体的压强越大;
【拓展提高】
化学反应前后,元素的种类不变,原子的种类、总个数不变;
氢氧化钙的水溶液显碱性,能使酚酞试液变红色;
氢氧化钙的水溶液又称为石灰水,二氧化碳能使澄清石灰水变浑浊;
【问题讨论】
水蒸发时吸收热量,能使周围的温度降低;
根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式.【实验探究】
(1)过氧化钙和水反应生成的气体能使带火星的木条复燃,说明产生的是氧气,这使可燃物脱脂棉满足了燃烧的一个条件是与氧气接触.
故填:与氧气接触.
(2)实验过程中,还观察到U型管A端红墨水液面下降,该现象说明U型管A端的压强高于右边的压强,进一步说明过氧化钙和水反应放出热量,这使可燃物脱脂棉满足了燃烧的另一个条件是温度达到脱脂棉的着火点.
故填:过氧化钙和水反应放出热量;温度达到脱脂棉的着火点.
【拓展提高】
(1)因为反应物过氧化钙和水中都不含有碳元素,所以产物中不可能含有碳元素,即不可能生成碳酸钙.
故填:过氧化钙和水中不含有碳元素,不可能生成碳酸钙.
(2)实验步骤及操作方法:①取少量过氧化钙放入试管中,加足量水,振荡;
②取两份溶液,向一份中滴加适量的酚酞试液,向另一份中通入二氧化碳.
预期的实验现象:①产生气泡;
②酚酞试液变红色,溶液变浑浊.
实验结论:过氧化钙和水反应产生的另一种物质是氢氧化钙.
故填:取两份溶液;向一份中滴加适量的酚酞试液,向另一份中通入二氧化碳;酚酞试液变红色;溶液变浑浊.
【问题讨论】
(1)如果滴加水的速度太快,过量的水吸热较多,温度不能达到脱脂棉的着火点,会导致脱脂棉没有燃烧起来.
故填:过量的水吸热较多,温度不能达到脱脂棉的着火点.
(2)过氧化钙和水反应的化学方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑.点评:
本题考点: 实验探究物质变化的条件和影响物质变化的因素;碱的化学性质;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式;燃烧与燃烧的条件.
考点点评: 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.1年前查看全部
- 为解决鱼呼吸的问题,可在水中加入过氧化钙,其化学方程式是2CaO2===2Ca(OH)2+O2↑,于是爱鱼者做了实验
为解决鱼呼吸的问题,可在水中加入过氧化钙,其化学方程式是2CaO2===2Ca(OH)2+O2↑,于是爱鱼者做了实验
为解决鱼呼吸的问题,可在水中加入过氧化钙,其化学方程式是2CaO2===2Ca(OH)2+O2↑,于是爱鱼者欲测定所用的过氧化钙的质量分数,作如下实验:称取样品2.0g,加入到水中,生成224mL洋气(氧气密度为1.43g/L).试计算所用过氧化钙样品中过氧化钙的质量分数! 白微微白1年前1
白微微白1年前1 -
 clydezhou 共回答了17个问题
clydezhou 共回答了17个问题 |采纳率82.4%产生氧气的质量=0.0224×1.43=0.32g.
2CaO2+2H20===2Ca(OH)2+O2↑
144 32
1.44 0.32
其质量分数=1.44/2=72%1年前查看全部
- 过氧化钙与水反应生成氧气和氢氧化钙,方程式为2CaO2+2H2O=2Ca(OH)2+O2,生成氧气1.6克,水足量.
过氧化钙与水反应生成氧气和氢氧化钙,方程式为2CaO2+2H2O=2Ca(OH)2+O2,生成氧气1.6克,水足量.
求过氧化钙质量,期待中… HELLOTIT1年前3
HELLOTIT1年前3 -
 guolongabc 共回答了19个问题
guolongabc 共回答了19个问题 |采纳率89.5%设过氧化钙的质量为x
2CaO2+2H2O=2Ca(OH)2+O2↑
2*72 32
x 1.6g
x=(2*72*1.6g)/32=7.2g
答:过氧化钙的质量为7.2g1年前查看全部
- 小刚发现养鱼师傅为解决鱼塘中氧气不足的问题,向鱼塘中撒一种淡黄色固体,其主要成分是过氧化钙(CaO 2 ).他查阅资料得
小刚发现养鱼师傅为解决鱼塘中氧气不足的问题,向鱼塘中撒一种淡黄色固体,其主要成分是过氧化钙(CaO 2 ).他查阅资料得知:过氧化钙与水反应,生成氢氧化钙和氧气.为测定淡黄色固体中过氧化钙的质量分数,称取20 g样品(样品中其他成分与水不反应)加入到足量的水中,共收集3.2 g氧气.请计算该样品中过氧化钙的质量分数.  quanyu19911年前1
quanyu19911年前1 -
 hemababy 共回答了11个问题
hemababy 共回答了11个问题 |采纳率90.9%设样品中过氧化钙的质量分数为x.
2CaO 2 +2H 2 O=2Ca(OH) 2 +O 2 ↑
144 32
20g×x 3.2g
144
32 =
20g×x
3.2g ,x=72%
答:该样品中过氧化钙的质量分数为72%.1年前查看全部
- 为什么用过氧化钙做增氧剂百度知道里是说缓慢氧化,漫漫增氧,但它在加热300多度才能分解,放水里怎么氧化,
 能不能凑合1年前1
能不能凑合1年前1 -
 julian630 共回答了24个问题
julian630 共回答了24个问题 |采纳率100%实际上是:CaO2 + 2H2O == Ca(OH)2 + H2O2
然后由于是碱性环境H2O2会被催化分解,像Na2O2与水反应生成O2也是一样的过程,你可以自己做实验用双氧水加进NaOH或Na2CO3(水解呈碱性)溶液里会看到H2O2迅速分解而产生大量O2.
由于CaO2是微溶于水(30%的过氧化氢溶液与Ca(OH)2反应就可以看到有一些红黄色物质生成就是CaO2的水合物沉淀),而且Ca(OH)2溶解性不好其溶液的碱性是比较低的,所以CaO2置入水中会缓慢分解释放O2,具有较好的持续效果,又由于成本低所以是非常好的增氧剂.1年前查看全部
- 用一个实验来验证过氧化钙和水反应产生的另一种物质是氢氧化钙.
用一个实验来验证过氧化钙和水反应产生的另一种物质是氢氧化钙.
是九年级上学期《主题作业》的考试卷《期末试卷(九)》的14题的(2)~ 藤秋是我1年前1
藤秋是我1年前1 -
 xun5899 共回答了14个问题
xun5899 共回答了14个问题 |采纳率92.9%将过氧化钙加入足量的水中,待其反应完全后(即不再有气泡产生)向其中通入二氧化碳,若溶液生成白色沉淀,则证明过氧化钙与水反应产生了氢氧化钙
既然是九年级的书,那这个答案应该对
我猜你在复习~1年前查看全部
- 长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气,过氧化钙与水反应除生成氧气外,还生成什么物质
长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气,过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一过程中进行探究:
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
【猜想】另一生成物为氢氧化钙.
【进行实验】
取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞试液,液体变成
______色,则猜想成立.写出反应的化学方程式______.
【意外发现】
较长时间后,同学们发现滴入酚酞后变色了的液体颜色又变回无色,他们认为褪色的可能原因是______.
【查阅资料】
过氧化钙放置在空气中,会变质产生氢氧化钙和碳酸钙两种杂质.
实验探究二:测定久置过氧化钙纯度
【实验过程】
称量144g样品放在铜网中,按图1所示装置组装后(药水瓶底部留有小孔),称量仪器及药品总质量,将铜网插入足量水中,反应完全后称量仪器
及反应后物质总质量.测得实验数据如下表.
【问题讨论】样品质量 装置及药品总质量 装置及反应后物质总质量 实验数据 144g 394g 378g

(1)药水瓶中碱石灰的作用为______.
(2)本实验测得过氧化钙含量可能会偏小的原因是______.
(3)根据实验数据计算:①生成氧气______g.②样品中过氧化钙的含量是______.
实验探究三:测定久置过氧化钙样品中碳酸钙含量
【测定方案】
①如图2所示,连接好装置,检查装置气密性;
②精确称量一袋样品质量置于烧杯中并加入适量水混合,再全部倒入烧瓶中,并在分液漏斗中加入足量稀盐酸;
③将液面调节到量气管的“0”刻度,并使两边液面相平,打开止水夹和分液漏斗活塞;
④反应结束后,再次调节量气管两边液面相平,读出气体体积;
⑤计算样品中碳酸钙含量(CO2的密度为1.97g/L).
【问题讨论】
(4)图中油层的作用为______,油层上方留有空气,会使测量结果______(填“偏大”、“偏小”或“无影响”).中和反应放热,滴加稀盐酸后,发生装置中的中和反应的化学方程式为______.
(5)若测得量气管读数为896mL,则实验中选用的量气管规格合适的是______(填字母序号)
A、100mlB、1LC、2L
(6)测定方案的步骤4中再次调节量气管两边液面相平的方法为______.步骤2中将样品和水混合的目的是______.
(7)在充分反应后将烧瓶中的液体蒸干得到55.5g固体,求这袋样品在变质前的过氧化钙质量(写计算过程). 青果happy1年前1
青果happy1年前1 -
 ss妹妹花 共回答了17个问题
ss妹妹花 共回答了17个问题 |采纳率100%解题思路:实验探究一:根据实验探究的过程和学过的知识可知:酚酞试液遇到碱性溶液变成红色;过氧化钙与水反应生成氢氧化钙和氢气;较长时间后,同学们发现滴入酚酞后变色了的液体颜色又变回无色,是因为Ca(OH)2被空气中的二氧化碳反应掉了;
实验探究二:药水瓶中碱石灰的作用为吸收O2中的水蒸气,起干燥作用;本实验测得过氧化钙含量可能会偏小的原因是:生成的氧气排走了空气,造成瓶内气体质量增大;有关的计算要准确.
实验探究三:油层的作用为:隔绝水和CO2,防止CO2溶于水;油层上方留有空气,不会影响测量结果;氢氧化钙和盐酸反应生成氯化钙和水,此过程是放热反应,造成气体体积膨胀,因此结果偏大.调节量气管内液面与油层液面相平的方法是:要上下移动量气管,至量气管内的液面与油层液面相平;除去CaO2,防止在烧瓶中产生氧气;有关的计算要准确.根据得到27.75g固体,可以求钙元素的质量,求碳酸钙的质量,最后求过氧化钙的质量.【进行实验】酚酞试液遇到碱性溶液变成红色;过氧化钙与水反应生成氢氧化钙和氢气;故答案为:红2CaO2+2H2O=2Ca(OH)2+O2↑
【意外发现】较长时间后,同学们发现滴入酚酞后变色了的液体颜色又变回无色,是因为Ca(OH)2被空气中的二氧化碳反应掉了;故答案为:Ca(OH)2与空气中的二氧化碳气体反应成生了碳酸钙
(1)药水瓶中碱石灰的作用为吸收O2中的水蒸气,起干燥作用;故答案为:吸收O2中的水蒸气
(2)本实验测得过氧化钙含量可能会偏小的原因是:生成的氧气排走了空气,造成瓶内气体质量增大;故答案为:生成的氧气排走了空气,造成瓶内气体质量增大(其它合理答案也可)
(3)根据质量守恒定律:生成氧气的质量=394.0g-378.0g=16.0g;
设过氧化钙的质量分数为x
2CaO2+2H2O=2Ca(OH)2+O2↑
144 32
144.0g•x 16g
[144/144.0g•x=
32
16g]
x=50%
故答案为:①16.0g;②50%
问题讨论:
(4)二氧化碳会与水反应,对测定的体积产生影响,生成多少二氧化碳就会排出多少水,油层的作用为:隔绝水和CO2,防止CO2溶于水;油层上方的空气对测定的结果不会产生影响,但是盐酸和氢氧化钙中和生成氯化钙和水,反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O
(5)选用量气管要接近所测得体积,太大或太小都会产生误差,
(6)调节量气管内液面与油层液面相平的方法是:要上下移动量气管,至量气管内的液面与油层液面相平;
通过改变液面的高度,改变产生的压强差,如果在集气瓶中,过氧化钙会与水反应生成的氧气,是测定的结果偏大.
(7)根据得到55.5g固体为氯化钙,可以求钙元素的质量,最后求过氧化钙的质量.
故答案为:探究一:红色2CaO2+2H2O=2Ca(OH)2+O2↑
二氧化碳与氢氧化钙反应,没有氢氧化钙了
探究二:(1)吸收生成氧气中的水蒸气(2)、碱石灰吸收空气中二氧化碳与水
(3)16g50% 探究三:
(4)隔绝二氧化碳和水的接触无影响
Ca(OH)2+2HCl=CaCl2+2H2O
(5)B
(6)固定左边仪器,将右边量气管向下移使样品中过氧化钙转化为氢氧化钙,否则有氧气生成影响实验结果
( 7)解法一
设原来纯过氧化钙质量为x
CaO2~CaCl2
72111
X55.5g
X=36g
解法二
先算出氯化钙中钙元素,因为反应前后钙元素守恒,可根据钙元素求出纯过氧化钙质量点评:
本题考点: 实验探究物质的性质或变化规律;酸碱指示剂及其性质;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.1年前查看全部
- (2014•扬州)过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法.
(2014•扬州)过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法.
已知:温度过高过氧化物会分解生成氧化物和氧气.
方法1:由Ca(OH)2为原料最终反应制得,其制备流程如图1:
方法2:由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如图2:
(1)方法1中搅拌的目的是______.请将搅拌过程中发生反应的化学方程式补充完整:
CaC12+H2O2+2NH3•H2O+6______═CaO2•8H2O↓+2NH4Cl.制备过程中除水外可循环使用的物质是______(填化学式).
(2)方法2中气体X是______,实验室常用______溶液来吸收.煅烧后的反应是化合反应,也能生成CaO2•8H2O,反应的化学方程式为______.该反应需控制温度在0~2℃,可将反应器放置在______,获得的CaO2产品中主要含有的固体杂质是______(填化学式).
(3)这两种制法均要求在低温下进行(除煅烧外),温度过高会造成氨水挥发外,还能______.
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO2•8H2O的反应符合“绿色化学”的是______(填“方法1”或“方法2”). netspace1年前1
netspace1年前1 -
 aladin801108 共回答了22个问题
aladin801108 共回答了22个问题 |采纳率95.5%解题思路:(1)根据搅拌可以使反应物充分混合进行分析,根据质量守恒定律进行分析,根据既是反应物也是生成物的物质可以循环利用进行分析;
(2)根据鸡蛋壳的主要成分是碳酸钙,碳酸钙在高温的条件下生成氧化钙和二氧化碳,所以X是二氧化碳,在实验室常用氢氧化钠来吸收二氧化碳,氧化钙与水反应生成氢氧化钙,然后依据反应原理、质量守恒定律书写化学方程式,根据实验室控制温度的方法进行分析,根据题中的反应物进行分析;
(3)根据温度过高过氧化物会分解生成氧化物和氧气进行分析;
(4)根据绿色化学的条件进行分析.(1)搅拌可以使药品均匀混合,所以方法1中搅拌的目的是:使反应充分,提高原料利用率;依据质量守恒定律可知,化学反应前后原子个数不变,所以需要补充的物质是水,氯化铵既出现在了反应物中,也出现在了生成物中,所以制备过程中除水外可循环使用的物质是:NH4C1;
(2)鸡蛋壳的主要成分是碳酸钙,碳酸钙在高温的条件下生成氧化钙和二氧化碳,所以X是二氧化碳,在实验室常用氢氧化钠来吸收二氧化碳,氧化钙与水反应生成氢氧化钙,氢氧化钙和双氧水反应生成过氧化钙晶体,化学方程式为:Ca(OH)2+H2O2+7H2O=CaO2•8H2O,冰水混合物的温度是0℃,所以反应需控制温度在0~2℃,可将反应器放置在冰水中,氢氧化钙是反应物,但是在反应过程中不一定会完全反应,所以获得的CaO2产品中主要含有的固体杂质是Ca(OH)2;
(3)依据题中的知识可知,温度过高过氧化物会分解生成氧化物和氧气,所以温度过高会造成氨水挥发外,还能使CaO2分解;
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,方法1中有副产物氯化铵,方法2中没有副产物,所以上述两种方法中生成CaO2•8H2O的反应符合“绿色化学”的是:方法2.
故答案为:(1)使反应充分,提高原料利用率;H2O,NH4C1;
(2)CO2,NaOH,Ca(OH)2+H2O2+7H2O=CaO2•8H2O,冰水中,Ca(OH)2;
(3)使CaO2分解;
(4)方法2.点评:
本题考点: 物质的相互转化和制备;绿色化学;碳酸钙、生石灰、熟石灰之间的转化;碱的化学性质;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析题中的反应流程,然后结合学过的知识和题中所给的知识进行分析解答.1年前查看全部
- 过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域.下图是以大理石(主要杂质F
过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域.下图是以大理石(主要杂质Fe2O3)等为原料制取CaO2的流程:
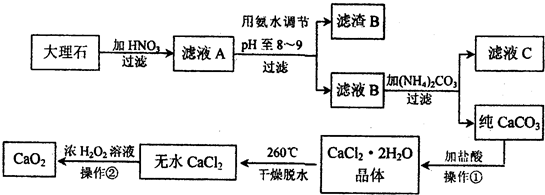
(1)操作①中应包括______(填序号).
A溶解B.过滤C.蒸馏D.分液E.蒸发结晶
请写CaCO3 和稀盐酸反应的离子方程式:______.
(2)用氨水调节pH至8-9的目的:______.
(3)从滤液C中可回收得到的工业产品的化学式为______.
(4)操作②的化学反应方程式:______. sunnerlove1年前1
sunnerlove1年前1 -
 雪薇雪儿 共回答了16个问题
雪薇雪儿 共回答了16个问题 |采纳率93.8%解题思路:(1)实现固体和液体的分离采用过滤的方法,从氯化钙的溶液中获得氯化钙的结晶水合物要采用蒸发结晶的方法,碳酸钙能和强酸反应;
(2)pH至8-9范围段内时,三价铁可易形成沉淀;
(3)硝酸钙和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵;
(4)双氧水可以和氯化钙反应生成过氧化钙和盐酸.根据图示信息,可得出:滤液A的成分有硝酸钙和硝酸铁以及剩余的硝酸,当pH至8-9范围段内时,三价铁可易形成沉淀,所以滤渣B是氢氧化铁,滤液B是硝酸钙,和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵,过滤,沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体,再失水成为无水氯化钙,双氧水可以和氯化钙反应生成过氧化钙和盐酸.
(1)碳酸钙和硝酸铵的混合物过滤后,所得沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体,CaCO3 和稀盐酸反应的实质是:CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:A、B、E,CaCO3+2H+=Ca2++CO2↑+H2O;
(2)用氨水调节pH至8-9,三价铁可易形成沉淀,从而分离出硝酸钙溶液,故答案为:除去Fe3+ (或使Fe3+转化为Fe(OH)3沉淀被除去);
(3)硝酸钙和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵,过滤所得滤液主要成分是硝酸铵,故答案为:NH4NO3;
(4)双氧水可以和氯化钙反应生成过氧化钙和盐酸,即CaCl2+H2O2=CaO2↓+2HCl,故答案为:CaCl2+H2O2=CaO2↓+2HCl.点评:
本题考点: 无机物的推断;物质的分离、提纯和除杂.
考点点评: 本题是一道框图推断题,考查知识面较广,要求学生具有分析和解决问题的能力,难度较大.1年前查看全部
- 菱湖是湖州养鱼重点地区之一.在夏天为了解决鱼塘中氧气不足的问题,养鱼师傅向鱼塘中撒一种主要成分是过氧化钙(CaO 2 )
菱湖是湖州养鱼重点地区之一.在夏天为了解决鱼塘中氧气不足的问题,养鱼师傅向鱼塘中撒一种主要成分是过氧化钙(CaO 2 )的微黄色的固体.小燕同学回家后查阅资料,知道CaO 2 与水反应的原理是:2CaO 2 +2H 2 O=2Ca(OH) 2 +O 2 ↑.
(1)水中的溶解氧进入鱼鳃的毛细血管,通过血液循环运至每个细胞,在细胞内用于氧化分解有机物,释放______,满足生命活动的需要.
(2)CaO 2 与H 2 O反应不仅可解决鱼塘中氧气不足的问题,而且生成的氢氧化钙在水产养殖中也有一定的作用,请你说出氢氧化钙在水产养殖中的一项作用______
(3)取该质量分数为50%的CaO 2 990克投人鱼塘中能产生多少升氧气?(注:在当时温度下氧气的密度为1.43克/升.假设样品中其它成分与水不反应.) 小松树_刘坤1年前1
小松树_刘坤1年前1 -
 有人吧 共回答了15个问题
有人吧 共回答了15个问题 |采纳率100%(1)有机物氧化分解时会释放能量,满足生命活动的需要.
(2)氢氧化钙具有碱性,可以净化鱼塘、防止鱼塘水体变酸、吸收鱼呼出的二氧化碳等(选其中一项即可).
(3)设生成氧气的体积为x.
2CaO 2 +2H 2 O=2Ca(OH) 2 +O 2 ↑
144 32
990g×50% x÷1.43g/L
144
32 =
990g×50%
x÷1.43g/L ,
x≈76.9L
答:(1)能量.
(2)净化鱼塘、防止鱼塘水体变酸、吸收鱼呼出的二氧化碳等(选其中一项即可).
(3)能产生76.9L氧气.1年前查看全部
- 碳和碳的氧化物1.为了解决鱼儿的吸氧问题,可在水中加入过氧化钙,制得氧气.一养鱼爱好者欲测定所用过氧化钙样品中过氧化钙的
碳和碳的氧化物
1.为了解决鱼儿的吸氧问题,可在水中加入过氧化钙,制得氧气.一养鱼爱好者欲测定所用过氧化钙样品中过氧化钙的质量分数,做如下实验:称取样品2.0g,加入到足量的水中,生成224ml氧气(氧气密度为1.43g/l).试计算样品中过氧化钙的质量分数.
2.实验室需要6.4g氧气,如果用过氧化氢溶液和二氧化锰来制取,需要多少克过氧化氢?
看不懂. qwzhy1年前1
qwzhy1年前1 -
 他们都叫我害虫 共回答了24个问题
他们都叫我害虫 共回答了24个问题 |采纳率75%m=ρv=1.43g/l*0.224l=0.3032g
设反应所需的过氧化钙的质量为X
2CaO2+2H2O→2Ca(OH)2+O2↑
144 32
X 0.3032
X=1.3644g
过氧化钙的质量分数为:(1.3644/2.0)*100%=68.22%
设需要过氧化氢的质量为X
2H2O2=MnO2=2H2O+O2↑
68 32
X 6.4g
X=13.6g1年前查看全部
- 过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO.
过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO.
1 称取0.542g过氧化钙样品,灼烧时发生如下反应:2CaO2乘xH2O=2CaO+O2+2xH2O,得到的O2的质量为0.096g.该样品中CaO2的物质的量为多少2另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的NaCO3溶液,将溶液中的Ca2+全部转化为CaCO3沉淀,该样品中CaO的质量为多 pfmgjb1年前1
pfmgjb1年前1 -
 rara0100 共回答了19个问题
rara0100 共回答了19个问题 |采纳率94.7%1,氧气物质的量=0.096/32=0.003mol根据方程式每2mol过氧化钙生成1mol氧气所以过氧化钙为0.003*2=0.006mol 第二题缺了碳酸钙沉淀质量了,是不是0.7克?2.加入HCl发生如下反应:
2CaO2 + 4HCl = 2CaCl2 + 2H2O + O2 …… 2CaCO3
CaO + 2HCl = CaCl2 + H2O ……CaCO3
从上面可以看到,生成的CaCO3来源有两部分,分别是从CaO2和CaO生成.
生成的CaCO3的物质的量为0.70/100=0.007mol.
从(1)的结果可以得到CaO2的物质的量,而根据钙原子守恒,可以知道关系2CaO2 - 2CaCl2 - 2CaCO3,因此由CaO2生成的CaCO3的物质的量为0.006mol.
因此由CaO生成的CaCO3的物质的量为0.007-0.006=0.001mol.
根据钙原子守恒有关系 CaO - CaCO3 ,因此CaO也是0.001mol,即0.001*56=0.056g.
现在我们知道了0.542g样品中有0.006molCaO2和0.056gCaO,剩下的质量就是结晶水了,所以结晶水的质量为0.542-0.006*72-0.056=0.054g,即0.054/18=0.003mol.
也就是说H2O与CaO2的物质的量之比为0.006:0.003=2:1,因此X的值为0.51年前查看全部
- 钙反应生成氧化钙的方程式是什么如果加热 不就生成过氧化钙了吗
 叉烧餐包1年前1
叉烧餐包1年前1 -
 蛇油霜 共回答了16个问题
蛇油霜 共回答了16个问题 |采纳率100%2Ca+O2=2CaO 条件:加热1年前查看全部
- 过氧化钙的电子式怎样写
 逆光1年前3
逆光1年前3 -
 冷于冰szxl 共回答了23个问题
冷于冰szxl 共回答了23个问题 |采纳率87%过氧化钙的化学式为CaO2 其为离子化合物.电子结构式可简写为 Ca2+[O-O]2- 可看作钙失去两个电子转移至过氧根中,即由钙离子和过氧根离子组成的化合物.1年前查看全部
- 怎样使水和过氧化钙反应加快除了加入催化剂,还有什么办法
 佛坂博正1年前1
佛坂博正1年前1 -
 feishou 共回答了21个问题
feishou 共回答了21个问题 |采纳率76.2%提高温度哦1年前查看全部
- 用过氧化钙加水制取氧气要使反应加快该怎么做?
 米兰香1年前1
米兰香1年前1 -
 guangyuge 共回答了17个问题
guangyuge 共回答了17个问题 |采纳率88.2%过氧化钙制取氧气的原理是先生成双氧水,双氧水分解生成氧气.
而双氧水在碱性条件和光照下容易分解,可以试试这两个条件.1年前查看全部
- 氧化钙和过氧化钙的区别?要具体一点的!我是指他们之间的联系。
 帝龙天下1年前2
帝龙天下1年前2 -
 wondery 共回答了24个问题
wondery 共回答了24个问题 |采纳率75%cao:是氧化物,吸水性强,可做干燥剂
其中的o无氧化性
而后者是过氧化物,具有很强的氧化性,遇水发生氧化还原反应,两个氧原子共用一对电子,加起来才显-2价
联系不大吧,要说联系只有他们组成的元素相同.1年前查看全部
- 稀盐酸HCl与食品添加剂的反应最好是现象明显的反应,给一些双乙二酸、过氧化钙、溴酸钾或硫(及其化合物)的验证也好如有特别
稀盐酸HCl与食品添加剂的反应
最好是现象明显的反应,
给一些双乙二酸、过氧化钙、溴酸钾或硫(及其化合物)的验证也好
如有特别好的答案, kingkill1年前1
kingkill1年前1 -
 丁香花开了 共回答了24个问题
丁香花开了 共回答了24个问题 |采纳率91.7%盐酸与亚硝酸钠反应,生成黄绿色气体(氯气).1年前查看全部
- 如何实验证明过氧化钙与水生成氢氧化钙和氧气
 歪歪子男1年前2
歪歪子男1年前2 -
 longgongwz 共回答了14个问题
longgongwz 共回答了14个问题 |采纳率100%氧化钙扔水里
收集出来的气体
把带火星的棍子插进集气瓶
复燃,有氧
嘿 搞定1年前查看全部
- 过氧化钙与水反应生成氢氧化钙和氧气.写化学方程式
 Acetfill1年前1
Acetfill1年前1 -
 gnzs7f8hx3dfa 共回答了17个问题
gnzs7f8hx3dfa 共回答了17个问题 |采纳率88.2%2CaO2+2H2O=2Ca(OH)2+O2↑1年前查看全部
- 过氧化钙是碱性氧化物吗?它和水生成了氢氧化钙个氧气.那么和酸反应也不应该只生成盐和水吧.那么它是不是碱性氧化物呢?还有,
过氧化钙是碱性氧化物吗?
它和水生成了氢氧化钙个氧气.那么和酸反应也不应该只生成盐和水吧.那么它是不是碱性氧化物呢?
还有,四氧化三铁也不是吧 solive1年前1
solive1年前1 -
 逆天萌萌 共回答了23个问题
逆天萌萌 共回答了23个问题 |采纳率95.7%不是,过氧化钙是过氧化物,过氧化物在物质分类中既不属于酸性.氧化物也不属于碱性氧化物.2 CaO2+2H2O=2Ca(oH)2+O2/.
因为该反应有氧气生成,不只碱性氧化物碱,而且碱性氧化物与水反应只生成一种碱,不生成其他物质.1年前查看全部
- 氧化钙与过氧化钙的区别
 dearestlover1年前3
dearestlover1年前3 -
 smileruirui 共回答了21个问题
smileruirui 共回答了21个问题 |采纳率85.7%氧化钙与有效氧化钙的区别有哪些呢,关于这个知识点的内容,敬请期待为您带来的文章分析.
氧化钙(CaO2)在空气中易与二氧化碳(CO2)反应生成碳酸钙(CaCO3);而氧化钙(CaO2)有较多的碳酸钙(CaCO3)不是特别纯,且有效氧化钙(CaO2)它的(CaCO3)比较少,比较纯净,所以叫有效氧化钙,可以了解下博盛的嘛!1年前查看全部
- 过氧化钙的活性氧含量为多少?
 酷乌鼠1年前1
酷乌鼠1年前1 -
 原来奇怪 共回答了14个问题
原来奇怪 共回答了14个问题 |采纳率92.9%16/(32+40)1年前查看全部
- 过氧化钙是什么性 酸还是 碱 盐 氧化物?
 梦琪888881年前1
梦琪888881年前1 -
 木棉树边 共回答了13个问题
木棉树边 共回答了13个问题 |采纳率100%氧化物1年前查看全部
- 钙在氧气中燃烧生成的产物是氧化钙CaO还是过氧化钙CaO2
 花莲蓬1年前6
花莲蓬1年前6 -
 只为想念一个人 共回答了18个问题
只为想念一个人 共回答了18个问题 |采纳率83.3%先用钠理解,钠在空气中加热生成过氧化钠,而钙比钠还活泼,那么钙在空气中燃烧的产物至少是过氧化钙(或更复杂的化合物,因为它很活泼)1年前查看全部
- 加热过氧化钙生成氧气实验的问题.
加热过氧化钙生成氧气实验的问题.
对此实验改进使反应加快,谁能告诉我怎么改进. 一边人1年前1
一边人1年前1 -
 caizhengkai007 共回答了21个问题
caizhengkai007 共回答了21个问题 |采纳率90.5%1.改变加热方式,利用酒精喷灯或者使用电炉子加热,以提高反应温度,加快反应速度.
2.加入催化剂,加快反应速度.1年前查看全部
- 颗粒氧是养鱼专业户常常用到的物质,其主要成分是过氧化钙(化学式为CaO2).取颗粒氧10g,加入到足量的水中,共生成1.
颗粒氧是养鱼专业户常常用到的物质,其主要成分是过氧化钙(化学式为CaO2).取颗粒氧10g,加入到足量的水中,共生成1.6g氧气(假定只有过氧化钙与水反应).请你计算出该颗粒氧中过氧化钙的质量分数.
颗粒氧与水反应的原理:[2CaO2+2H2O=2Ca(OH)2+O2↑]. mlrxl1年前1
mlrxl1年前1 -
 edisonrei7 共回答了18个问题
edisonrei7 共回答了18个问题 |采纳率83.3%解题思路:由生成氧气的质量根据过氧化钙与水反应的化学方程式可以计算出样品中过氧化钙的质量分数.设样品中过氧化钙的质量分数为x.
2CaO2+2H2O=2Ca(OH)2+O2↑
144 32
10g×x 1.6g
[144/32]=[10g×x/1.6g],x=72%
答:该样品中过氧化钙的质量分数为72%.点评:
本题考点: 含杂质物质的化学反应的有关计算;实验探究物质的组成成分以及含量.
考点点评: 本题主要考查含杂质物质的化学方程式计算,难度稍大.1年前查看全部
- 农名把过氧化钙丢进鱼池里 为了使池内含氧量提高 ...
农名把过氧化钙丢进鱼池里 为了使池内含氧量提高 ...
可过氧化钙只有在300度分解成氧气 那在鱼池里又怎么分解呢 七块钱1年前3
七块钱1年前3 -
 a498882581 共回答了18个问题
a498882581 共回答了18个问题 |采纳率88.9%实际上是:CaO2 + 2H2O == Ca(OH)2 + H2O2
然后由于是碱性环境H2O2会被催化分解,像Na2O2与水反应生成O2也是一样的过程,你可以自己做实验用双氧水加进NaOH或Na2CO3(水解呈碱性)溶液里会看到H2O2迅速分解而产生大量O2.
由于CaO2是微溶于水(30%的过氧化氢溶液与Ca(OH)2反应就可以看到有一些红黄色物质生成就是CaO2的水合物沉淀),而且Ca(OH)2溶解性不好其溶液的碱性是比较低的,所以CaO2置入水中会缓慢分解释放O2,具有较好的持续效果.1年前查看全部
- 过氧化钙可以和石灰一起使用吗?用于池塘祛除大量藻类.之前撒过过氧化钙现在可以撒石灰吗?
过氧化钙可以和石灰一起使用吗?用于池塘祛除大量藻类.之前撒过过氧化钙现在可以撒石灰吗?
池塘里的水像是长了铁锈一样,原因是水中的红藻和蓝藻大量繁殖造成的,怎么有效的去掉这些藻类?但净化后的水不可以对农作物(红萝卜)有影响. airsupplyer1年前5
airsupplyer1年前5 -
 liukichen 共回答了10个问题
liukichen 共回答了10个问题 |采纳率100%过氧化钙可以和石灰一起使用,杀毒灭菌,效果好,只要控制使用量,不要使该环境碱性太强,就可以了.
以前使用过氧化钙与现在使用石灰没有关系,结果大同小异,只是过氧化钙的杀菌能力强得多而已.1年前查看全部
- 向鱼塘中撒入过氧化钙以补充氧气,←属于化学变化么
 hugo光1年前5
hugo光1年前5 -
 szh3h 共回答了21个问题
szh3h 共回答了21个问题 |采纳率95.2%有新物质的产生就属于化学变化1年前查看全部
- 钙怎样生成过氧化钙?怎样生成氧化钙?请明确的说清楚?
 32faseui1年前2
32faseui1年前2 -
 凉拌果冻鸡 共回答了18个问题
凉拌果冻鸡 共回答了18个问题 |采纳率94.4%1.氧化钙与过氧化氢反应可以制得过氧化钙(CaO2):CaO + H2O2 = CaO2 + H2O 2.可溶性钙盐与过氧化钠反应:CaCl2 + Na2O2 = CaO2 + 2NaCl1年前查看全部
- 过氧化钙与水反应生成物为什么不是氧化钙
 youyunfuzi1年前1
youyunfuzi1年前1 -
 柠檬的不乖猫 共回答了17个问题
柠檬的不乖猫 共回答了17个问题 |采纳率82.4%过氧化钙与水反应的化学方程式是2CaO2+2H2O=2Ca(OH)2+O2↑
CaO会与水反应.CaO+H2O=Ca(OH)21年前查看全部
- 农民用过氧化钙做曾氧剂的原因是什么?
 ralexer1年前2
ralexer1年前2 -
 贼和尚 共回答了26个问题
贼和尚 共回答了26个问题 |采纳率92.3%过氧化钙相对于过氧化钠来说碱性要小一些,跟空气反应较慢,相对不那么容易变质,当然便宜也使得它在农业上比过氧化钠划算1年前查看全部
- 过氧化钙与水反应的化学方程式
 hao4031年前3
hao4031年前3 -
 bold1234567 共回答了24个问题
bold1234567 共回答了24个问题 |采纳率87.5%2CaO2 +2 H2O == 2Ca(OH)2 + O21年前查看全部
- (2012•石景山区二模)氧化钙和过氧化钙(CaO2)是钙的两种氧化物.过氧化钙是一种淡黄色的固体,与水反应能放出氧气,
(2012•石景山区二模)氧化钙和过氧化钙(CaO2)是钙的两种氧化物.过氧化钙是一种淡黄色的固体,与水反应能放出氧气,过氧化钙在受热时生成氧化钙和氧气.下列结论中,正确的是( )
A.组成两种物质的元素不同
B.两种物质的化学性质相同
C.过氧化钙在受热时发生的反应属于分解反应
D.过氧化钙与水反应的化学方程式为CaO2+H2O=CaCO3↓+O2↑ jxqzb1年前1
jxqzb1年前1 -
 sunlan1999 共回答了17个问题
sunlan1999 共回答了17个问题 |采纳率100%解题思路:A、根据氧化钙和过氧化钙的化学式分析元素组成;
B、根据氧化钙的性质及信息提供的过氧化钙的性质分析;
C、根据分解反应的特征一边多的化学反应;
D、根据元素守恒的观点分析方程式.解;A、氧化钙和过氧化钙都是由钙元素和氧元素组成的,故选项错误;
B、氧化钙能与水反应生成氢氧化钙,而过氧化钙能与水反应放出氧气,故选项错误;
C、过氧化钙在受热时生成氧化钙和氧气符合分解反应的定义,故选项正确;
D、根据质量守恒定律,化学反应前后元素的质量不变,所以过氧化钙与水反应不能生成碳酸钙,故选项错误.
故选项为:C.点评:
本题考点: 物质的元素组成;分解反应及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了物质的元素组成、物质的性质、化学反应类型及质量守恒定律的应用,考查较为全面,所以基础性的考查,难度不大.1年前查看全部
- 饲养观赏鱼可以陶冶人的情操,增进人们对生活的热爱.空运观赏鱼必须密封.为了解决鱼的吸氧问题,可在水中加入过氧化钙(化学式
饲养观赏鱼可以陶冶人的情操,增进人们对生活的热爱.空运观赏鱼必须密封.为了解决鱼的吸氧问题,可在水中加入过氧化钙(化学式:CaO2).过氧化钙与水反应生成氢氧化钙和氧气.
(1)写出过氧化钙与水反应的化学方程式______
(2)已知钙元素只有一种化合价,请你分析过氧化钙中钙元素的化合价为______价.将来我们会学习“凡有元素化合价变化的化学反应就叫做氧化还原反应”,则根据这个概念判断过氧化钙与水反应是否为氧化还原反应______ (填写“是”或“否”). lv6661年前1
lv6661年前1 -
 不相信未来 共回答了24个问题
不相信未来 共回答了24个问题 |采纳率87.5%解题思路:(1)过氧化钙与水反应生成氢氧化钙和氧气,写出反应的化学方程式即可.
(2)根据常见元素的化合价进行分析解答;由题意:凡有元素化合价变化的化学反应就叫做氧化还原反应,据此进行分析解答.(1)过氧化钙与水反应生成氢氧化钙和氧气,反应的化学方程式为:2CaO2+2H2O═2Ca(OH)2+O2↑.
(2)已知钙元素只有一种化合价,钙元素在化合物中显+2价,则过氧化钙中钙元素的化合价为+2价.
凡有元素化合价变化的化学反应就叫做氧化还原反应,在2CaO2+2H2O═2Ca(OH)2+O2↑中,钙元素显+2,设氧元素的化合价是x,可知CaO2中氧元素的化合价:(+2)+2x=0,则x=-1;单质中元素的化合价为0,O2属于单质,故氧元素的化合价为0;反应前后,氧元素的化合价发生了改变,则该反应属于氧化还原反应.
故答案为:(1)2CaO2+2H2O═2Ca(OH)2+O2↑;(2)+2;是.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;有关元素化合价的计算;氧化反应;还原反应.
考点点评: 本题难度不大,掌握化学方程式的书写方法、化合价的原则、氧化还原反应的概念是正确解答本题的关键.1年前查看全部
- 过氧化钙(CaO2)用于鱼池供氧剂,同时有熟石灰生成. ①写出过氧化钙与水反应的化学方程式
过氧化钙(CaO2)用于鱼池供氧剂,同时有熟石灰生成. ①写出过氧化钙与水反应的化学方程式
过氧化钙(CaO2)用于鱼池供氧剂,同时有熟石灰生成.
①写出过氧化钙与水反应的化学方程式
2CaO2+2H2O=2Ca(OH)2+O2↑
②现将7.2g过氧化钙放入36.0g水中,使之充分反应,所得混合物中氧元素的质量是多少?
求第二问啊 我爱迪士尼1年前1
我爱迪士尼1年前1 -
 庸俗 共回答了19个问题
庸俗 共回答了19个问题 |采纳率100%由方程式可看成氧气是由过氧化钙产生的,水中氧气含量不变
水中氧气含量:36/18*16=32g
过氧化钙产生的氧气量=过氧化钙留在水里的氧气量:7.2/(72*2)*32=16g
溶液中总的氧气量:32+16=48g1年前查看全部
- 某同学把1.8g不纯的过氧化钙样品加入到盛有足量水的烧杯中发生了2CaO2+2Ca(OH)2+O2上箭头的反应完全反应后
某同学把1.8g不纯的过氧化钙样品加入到盛有足量水的烧杯中发生了2CaO2+2Ca(OH)2+O2上箭头的反应完全反应后生成了0.224L氧气密度为1.43g.L负一次方
1.生成氧气质量精确到0.01g
2.该样品含过氧化氢钙的质量分数 路过顶过1年前1
路过顶过1年前1 -
 爱黑猫的鱼 共回答了18个问题
爱黑猫的鱼 共回答了18个问题 |采纳率83.3%1,氧气质量根据:质量=体积*密度=0.224*1.43=0.32032=0.32g
2.根据质量守恒定律,
2*72 32
——=—— x=1.44g
X 0.32
所以过氧化钙的质量分数=1.44/1.8=0.81年前查看全部
- 长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体.甲.乙两位同学发现往水中投入过氧?
长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体.甲.乙两位同学发现往水中投入过氧?
进行猜想:甲同学认为:生成氧化钙和氧气;
乙同学认为:生成氢氧化钙和氧气。
(1)你认为 同学的猜想是错误的,其理由是
(2)请设计一个实验方案来验证另一个同学的猜想是正确的,并填入下表空格中。
实验步骤及操作方法 预期的实验现象 结论
1.取少量过氧化钙放入试管中,
加足量水,
___________________________。有氧气生成
2.________________________
___________________________
___________________________ 出现浑浊
(3)运输鱼苗时,在水中加入少量过氧化钙的主要目的_____________ __________ squashgirl1年前3
squashgirl1年前3 -
 刀客1998 共回答了13个问题
刀客1998 共回答了13个问题 |采纳率92.3%(1)甲,氧化钙和水会反应,生成氢氧化钙(CaO+H2O=Ca(OH)2)
(2)1.有气泡,并能使带火星的木条复燃
2.一段时间后,溶液
(3)增加氧气,吸收二氧化碳1年前查看全部
- 高手请进:怎样用高锰酸钾滴定法测定过氧化钙中过氧根离子的含量?
 bbflr3b1年前1
bbflr3b1年前1 -
 SYJ801017 共回答了21个问题
SYJ801017 共回答了21个问题 |采纳率85.7%首先,配制标准高锰酸钾溶液,配好后装入酸式滴定管然后,隔绝空气条件下准确称量一定质量的过氧化钙高锰酸钾本身就可以做指示剂,无需加指示剂滴至粉红色半分钟内不退去既是终点,重复上述操作2至3次求平均1年前查看全部
- 一养鱼爱好者为测定所用的过氧化钙样品中过氧化钙的质量分数,作如下实验:称取样品5g
一养鱼爱好者为测定所用的过氧化钙样品中过氧化钙的质量分数,作如下实验:称取样品5g
加入到足量的水,生成448ml氧气(氧气的密度为1.34/L).试计算所用样品中过氧化钙的质量分数.
尽快啊,如果对了再送10分. 黑彦hh1年前1
黑彦hh1年前1 -
 haichuanj 共回答了16个问题
haichuanj 共回答了16个问题 |采纳率100%设样品中过氧化钙的质量为x.
化学式为:
2CaO2+2H2O=2Ca(OH)2+O2↑
144 32
x 0.448*1.34g
144/x=32/( 0.448*1.34)
x=2.7g
过氧化钙的质量分数是2.7/5*100%=54%1年前查看全部
- 过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO.
过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO.
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:2CaO2•XH2O →△ 2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 .
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g.
① 试计算样品中CaO的质量.② 试计算样品中CaO2•XH2O的X值
可以简单的认为 两组份的 cao2的mol数都是6乘以10^-3嘛?
因此由CaO2生成的CaCO3的物质的量为0.006mol.
因此由CaO生成的CaCO3的物质的量为0.007-0.006=0.001mol
怎么出来的 Smiling_angel1年前3
Smiling_angel1年前3 -
 浅浅0122 共回答了20个问题
浅浅0122 共回答了20个问题 |采纳率90%1.O2在标准状况下体积为67.2ml,也就是67.2/1000=0.0672L,换算成物质的量为0.0672/22.4=0.003mol.反应方程式可以看作是:
2CaO2→△ 2CaO + O2↑
2 1
x 0.003
因此x=0.006mol,CaO2的物质的量为0.006mol.
2.加入HCl发生如下反应:
2CaO2 + 4HCl = 2CaCl2 + 2H2O + O2 …… 2CaCO3
CaO + 2HCl = CaCl2 + H2O ……CaCO3
从上面可以看到,生成的CaCO3来源有两部分,分别是从CaO2和CaO生成.
生成的CaCO3的物质的量为0.70/100=0.007mol.
从(1)的结果可以得到CaO2的物质的量,而根据钙原子守恒,可以知道关系2CaO2 - 2CaCl2 - 2CaCO3,因此由CaO2生成的CaCO3的物质的量为0.006mol.
因此由CaO生成的CaCO3的物质的量为0.007-0.006=0.001mol.
根据钙原子守恒有关系 CaO - CaCO3 ,因此CaO也是0.001mol,即0.001*56=0.056g.
现在我们知道了0.542g样品中有0.006molCaO2和0.056gCaO,剩下的质量就是结晶水了,所以结晶水的质量为0.542-0.006*72-0.056=0.054g,即0.054/18=0.003mol.
也就是说H2O与CaO2的物质的量之比为0.006:0.003=2:1,因此X的值为0.51年前查看全部
- 某同学发现养鱼师傅向鱼塘中撒一种微黄色的固体,咨询得知,这种固体的主要成分是过氧化钙(CaO 2 ),是为了解决鱼塘中氧
某同学发现养鱼师傅向鱼塘中撒一种微黄色的固体,咨询得知,这种固体的主要成分是过氧化钙(CaO 2 ),是为了解决鱼塘中氧气不足的问题。他回家后查阅资料,查到过氧化钠与水反应的原理:2Na 2 O 2 +2H 2 O==4NaOH+O 2 ↑,且CaO 2 与Na 2 O 2 的化学性质非常相似。
(1)写出CaO 2 与H 2 O反应的化学方程式 ;
(2)该同学为测定这种固体中CaO 2 的质量分数,称取20g样品加入到足量的水中,结果生成3.2g O 2 (假设样品中其他成分与水不反应)。请你帮助计算该样品中CaO 2 的质量分数。 shinianshao1年前1
shinianshao1年前1 -
 qqkafde 共回答了14个问题
qqkafde 共回答了14个问题 |采纳率78.6%(1)2CaO 2 +2H 2 O==2Ca(OH) 2 +O 2 ↑
(2)该样品中CaO 2 的质量分数为72%1年前查看全部
大家在问
- 1如图,等腰三角形底边为8cm,腰长为5cm,一动点p在底边上从B向点c以0.25m/s的速度移动,请你探,当点p移动几秒
- 2浮生若梦?又当如何!
- 3英语翻译1.心情开朗,乐观豁达,凡事不要与人斤斤计较,少生气,知足常乐,最好有一颗童真的心.2.保持青春活力 我认为最重
- 4怎样写好一个作文
- 524×205=24×(200+5),这是根据( )
- 6莉莉是一个美国人,大卫是一个英国人.把这句翻译成英语
- 7Her first name is linda . and her last name is smith 合并成一句话
- 8(2014•思南县模拟)化学是一门以实验为基础的科学.
- 9晚春 韩愈 语言特点晚春 韩愈 这首诗语言特点如何?请分析。(直接说,不要赏析什么的!~)
- 10相似三角形一道,求旗杆高AB是旗杆,甲在操场上C处直立3米高的竹竿CD,乙从C处退到E处恰好看到竹竿顶端D与旗杆顶端B重
- 112/(12*14)+2/(14*16)+2/(16*18)+2/(18*20)+1/20
- 12完成下列作图:(1)请在图1中画出物体AB在平面镜中所成的像A′B′.(2)请在图2中画出使用该滑轮组最省力的绕线方式.
- 13英语翻译A was added to b followed by the addition of c即到底添加A,B,C
- 14(2014•达州)完全燃烧0.3m3的天然气来加热水箱中的水,放出的热量是______ J;若放出热量的84%
- 15填空,因为8分之5×9分之8=9分之5,所以9分之5÷9分之8=(),9分之5÷9分之8=()

