草酸亚铁能溶于三甘醇吗如题,求解答谢谢!
 zhizhi0502072022-10-04 11:39:541条回答
zhizhi0502072022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 ttxx16 共回答了17个问题
ttxx16 共回答了17个问题 |采纳率100%- 应该是不溶
- 1年前
相关推荐
- 磷酸铁跟草酸亚铁区别就是磷酸铁锂的原材料 两种比较主要有什么区别不是的 我说这两样东西就是用在 磷酸铁锂的原料上个有什么
磷酸铁跟草酸亚铁区别
就是磷酸铁锂的原材料 两种比较主要有什么区别
不是的 我说这两样东西就是用在 磷酸铁锂的原料上个有什么优势与缺点 zygswd1年前3
zygswd1年前3 -
 ly01-hainan 共回答了23个问题
ly01-hainan 共回答了23个问题 |采纳率91.3%磷酸铁
一、中文化学名:磷酸铁,正磷酸铁磷酸铁产品图片二、英文化学名:Ferrous Phosphate 三、FePO4·2H2O,分子量186.82,CAS号:13463-10-0 四、物性:淡黄色或浅黄白色粉末.堆实密度0.65~0.85;加热时溶于硫酸,难溶于其它酸,几不溶于水、醋酸、醇.在自然界中以蓝铁矿形式存在.多由亚铁盐溶液与磷酸钠作用而得.五、技术规格:电池级磷铁技术标准 Fe3+≥29.1% Mg2+≤50ppm Na+≤50ppm K+≤50ppm Cu2+≤10ppm Cr3+≤10ppm Pb2+≤15ppm 铁磷比=0.97~1.02 以上为生产磷酸铁锂电池材料专用规格.也可用作催化剂及制造陶瓷等.六、包装:25KG/袋.外袋为纸塑复合袋,内衬高压聚乙烯薄膜.七、用途:主要用于制造磷酸铁锂电池材料.
草酸亚铁
草酸亚铁简介 一、品名:草酸亚铁 二、分子式:FeC2O4·2H2O 三、分子量:179.900 四、CAS号:6047-25-2 五、性质:淡黄色结晶性粉末,稍有轻微刺激性.熔点160℃(分解),振实密度:1.25g/cm3,松装密度:0.8g/cm3.真空下于142℃失去结晶水.冷水中溶解0.22g/100g,热水中0.026g/100g,能溶于冷盐溶液.六、技术指标:草酸亚铁(电池级) 主含量>99% 有效金属含量>=98% 氯化物1年前查看全部
- 草酸亚铁与空气隔热分解
 酒香梅子1年前2
酒香梅子1年前2 -
 huihuang7944 共回答了23个问题
huihuang7944 共回答了23个问题 |采纳率95.7%FeC2O4 = FeO + CO + CO2
如果加热温度较高,生成的FeO和CO会发生氧化还原反应,此时反应方程式为
FeC2O4 = Fe + 2CO21年前查看全部
- (2014•安徽一模)草酸亚铁晶体(FeC2O4•2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产.回答下列
(2014•安徽一模)草酸亚铁晶体(FeC2O4•2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产.回答下列问题:
I兴趣小组对草酸亚铁晶体的分解产物进行实验和探究.探究分解得到的固体产物中铁元素的存在形式.
(1)提出假设
假设一:______;假设二:全部是FeO;假设三:FeO和Fe混合物.
(2)设计实验方案证明假设三.
限选试剂:稀盐酸、新制的氯水、0.1mol•L-1CuSO4溶液、20% KSCN溶液、蒸馏水.
Ⅱ兴趣小组在文献中查阅到,FeC204•2H20受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC204•2H20晶体受热分解的化学方程式为:实验步骤 现象与结论 步骤1:向试管中加入少量固体产物,再加入足量______,充分振荡 若溶液颜色明显改变,且有______生成,则证明有铁质存在 步骤2:将步骤1中得到浊液过滤,并用蒸馏水洗涤至洗涤液无色 步骤3:取步骤2得到的少量固体于试管中滴加______ ______ FeC2O4.2H2O
FeO+CO↑+CO2↑+2H2O△ .FeC2O4.2H2O
FeO+CO↑+CO2↑+2H2O△ .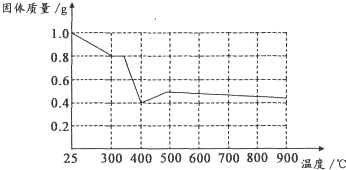
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设二不成立.你是否同意该同学的结论,并简述理由:______. yuyu7yaya1年前1
yuyu7yaya1年前1 -
 秋菊背心的ii 共回答了6个问题
秋菊背心的ii 共回答了6个问题 |采纳率100%解题思路:Ⅰ.(1)依据假设2、3分析假设1的内容;
(2)依据假设3是铁和氧化亚铁的混合物,利用硫酸铜溶液和铁反应生成铜的现象分析证明铁的存在,过滤后用蒸馏水洗涤,取固体用盐酸溶解后加入过氧化氢氧化为铁离子,加入硫氰酸钾溶液若出现血红色现象证明含有氧化亚铁,据此设计实验步骤检验;
Ⅱ.氧化亚铁溶解于盐酸生成氯化亚铁溶液,加入KSCN溶液,若溶液不变红证明假设一正确;
定量实验:根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立不合理,氧化亚铁可以被空气氧化;
Ⅱ.根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立不合理,氧化亚铁可以被空气氧化.解Ⅰ:(1)假设2:FeO; 假设3:FeO和Fe混合物,则假设1为Fe,
故答案为:Fe;
②依据题干所提供的试剂结合假设3的混合物组成为铁和氧化亚铁的性质分析设计实验步骤为,向试管中加入少量固体产物,再加入足量硫酸铜溶液,充分振荡,若溶液颜色明显改变,且有暗红色固体物质生成证明有铁单质存在,将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色,取步骤2得到的少量固体与试管中,滴加过量HCl,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN,若溶液呈血红色证明含有氧化亚铁,
故答案为:
实验步骤现象与结论
步骤1:硫酸铜溶液(暗)红色固体
步骤3:过量HCl,静置,取上层清液,滴加几滴KSCN溶液,再滴加适量新制的氯水,充分振荡 若滴加适量新制的氯水后溶液呈红色,则证明有FeO ;
II.通过剩余固体的质量可知,过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,设失去结晶水x,图象分析可知固体质量变化1.0-0.8=0.2g,依据则反应的化学方程式计算为:
FeC2O4•2H2O
△
.
FeC2O4+(2-x)H2O+xH2O△m
180 18x
1.0 0.2
解得:x=2
加热到300°C,晶体全部失去结晶水生成草酸亚铁和水,
继续加热到400°C,固体质量减少0.8g-0.4g=0.4g;此时草酸亚铁分解减少的是气体质量,反应过程中一定存在反应生成氧化亚铁和二氧化碳,铁元素化合价不变时,依据元素化合价变化和电子守恒可知碳元素化合价从+3价变化为+4价,一定有化合价降低生成+2价的一氧化碳,反应的化学方程式为:FeC2O4
△
.
FeO+CO+CO2,分析图象可知;
FeC2O4
△
.
FeO+CO+CO2 △m
144 72
0.8 0.4
计算结果符合图象固体质量变化,所以反应的化学方程式为:FeC2O4.2H2O
△
.
FeO+CO↑+CO2↑+2H2O;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,依据铁元素守恒计算得到若生成氧化亚铁,质量为0.4g,但实验过程中最终残留黑色固体的质量大于0.4g,可能是实验未在密闭容器中进行,氧化亚铁被空气氧化为氧化铁,所以“某同学由此得出结论:假设一不成立”不合理,
故答案为:FeC2O4.2H2O
△
.
FeO+CO↑+CO2↑+2H2O;不同意,实验未在密闭容器中进行,FeO会被空气进一步氧化,生成铁的其它氧化物.点评:
本题考点: 性质实验方案的设计;探究物质的组成或测量物质的含量.
考点点评: 本题考查了探究物质组成、测量物质含量及性质实验方案的设计,题目难度中等,注意掌握物质的性质及检验方法,(II)为易错点,正确分析曲线变化为解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.1年前查看全部
- 用硫酸亚铁和草酸制取草酸亚铁是强酸制弱酸的反应么?
用硫酸亚铁和草酸制取草酸亚铁是强酸制弱酸的反应么?
FeSO4+H2C2O4→FeC2O4+H2SO4
就这个式子对吧,怎么看都觉得弱酸盐回合强酸反应,什么原因呢? 福满全天下1年前2
福满全天下1年前2 -
 水边月色 共回答了17个问题
水边月色 共回答了17个问题 |采纳率94.1%FeSO4+H2C2O4=FeC2O4↓+H2SO4
这是一个弱酸制强酸的反应.
草酸为弱酸,硫酸为强酸.
这个反应可以进行,草酸亚铁为沉淀,不会与硫酸反应.1年前查看全部
- (2009•朝阳区一模)铁具有可变的化合价,将14.4g草酸亚铁(FeC2O4)在隔绝空气的条件下加热分解,最终可得到7
(2009•朝阳区一模)铁具有可变的化合价,将14.4g草酸亚铁(FeC2O4)在隔绝空气的条件下加热分解,最终可得到7.2g铁的氧化物,则该铁的氧化物是( )
A.Fe2O3
B.FeO
C.Fe3O4
D.无法确定 12345678zh1年前1
12345678zh1年前1 -
 twthuai 共回答了20个问题
twthuai 共回答了20个问题 |采纳率90%解题思路:根据化学变化前后元素质量不变,14.4g草酸亚铁(FeC2O4)中铁元素的质量即为7.2g铁的氧化物中铁元素的质量,由此可计算出铁的氧化物中铁与氧两元素的质量比,再由质量比计算出原子个数比而确定物质的化学式.14.4g草酸亚铁(FeC2O4)中铁元素的质量=14.4g×[56/56+12×2+16×4]×100%=5.6g
铁的氧化物中铁与氧两元素的质量比=5.6g:(7.2g-5.6g)=56:16
铁的氧化物中铁与氧两元素的原子个数比=[56/56]:[16/16]=1:1,则该铁的氧化物是FeO;
故选B.点评:
本题考点: 有关化学式的计算和推断.
考点点评: 根据物质的化学式,一定质量的化合物中组成元素的质量=化合物的质量×化合物中该元素的质量分数.1年前查看全部
- (2013•茂名二模)草酸亚铁(FeC2O4•2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产.已知:CO能
(2013•茂名二模)草酸亚铁(FeC2O4•2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产.已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉.回答下列问题:
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究.
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有______.
(2)探究分解得到的固体产物中铁元素的存在形式.
①提出假设
假设1:______;假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3.
限选试剂:1.0mol•L-1盐酸、3% H2O2、0.1mol•L-1CuSO4、20% KSCN、蒸馏水.
Ⅱ:某草酸亚铁样品中含有少量草酸.现用滴定法测定该样品中FeC2O4的含量.滴定反应是:5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++10CO2↑+3Mn2++12H2O实验方案设计为:实验步骤 现象与结论 步骤1:向试管中加入少量固体产物,再加入足量______,充分振荡 若溶液颜色明显改变,且有______生成,则证明有铁单质存在 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 步骤3:取步骤2得到的少量固体与试管中,滴加______
____________
______
①将准确称量的0.20g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1 mL
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红.将滤液过滤至另一个锥形瓶中,继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2 mL
③重复以上实验1~2次
若某小组的一次测定数据记录如下:V1=18.90mL,V2=6.20mL.根据数据计算0.20g 样品中:n(Fe2+)=______; n(C2O42-)=______;FeC2O4 的质量分数为______(精确到0.01%) 武术qq1年前1
武术qq1年前1 -
 m7ax 共回答了13个问题
m7ax 共回答了13个问题 |采纳率76.9%解题思路:Ⅰ、(1)依据CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉,二氧化碳和澄清石灰水变浑浊分析判断;
(2)①依据假设2、3分析假设1的内容;
②依据假设3是铁和氧化亚铁的混合物,利用硫酸铜溶液和铁反应生成铜的现象分析证明铁的存在,过滤后用蒸馏水洗涤,取固体用盐酸溶解后加入过氧化氢氧化为铁离子,加入硫氰酸钾溶液若出现血红色现象证明含有氧化亚铁,据此设计实验步骤检验;
Ⅱ、根据题干数据,计算出亚铁离子、草酸根离子的浓度,再根据亚铁离子、草酸根离子的物质的量计算出草酸铁的质量分数.Ⅰ:(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,说明产物含有二氧化碳气体,B中出现黑色物质生成,CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉,证明含有一氧化碳气体,则上述现象说明气体产物中有二氧化碳和一氧化碳,
故答案为:CO2、CO;
(2)①假设2:FeO; 假设3:FeO和Fe混合物,则假设1为Fe,故答案为:Fe;
②依据题干所提供的试剂结合假设3的混合物组成为铁和氧化亚铁的性质分析设计实验步骤为,向试管中加入少量固体产物,再加入足量硫酸铜溶液,充分振荡,若溶液颜色明显改变,且有暗红色固体物质生成证明有铁单质存在,将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色,取步骤2得到的少量固体与试管中,滴加
过量HCl,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN,若溶液呈血红色证明含有氧化亚铁,
故答案为:
实验步骤 现象与结论
步骤1:硫酸铜溶液 暗红色固体
步骤3:过量HCl,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN 若溶液呈血红色,则证明有FeO Ⅱ:样品中亚铁离子、草酸根离子消耗的高锰酸钾溶液的体积为V1ml:高锰酸钾的物质的量为:V1×10-3L×0.02000mol/L=2V1×10-5mol,
亚铁离子消耗的高锰酸钾溶液的体积为V2ml,高锰酸钾的物质的量为:V2×10-3L×0.02000mol/L=2V2×10-5mol,
草酸根离子消耗的高锰酸钾的物质的量为:(2V1×10-5mol-2V2×10-5mol)×0.02000mol/L,V1=18.90mL,V2=6.20mL;
根据化合价升降相等找出关系式:5Fe2+~MnO4-,5C2O42-~2MnO4-,
n(Fe2+)=5×2V2×10-5mol=0.0006200mol
n(C2O42-)=2.5×(2V1×10-5mol-2V2×10-5mol)=0.0006350mol
根据亚铁离子物质的量可知草酸亚铁的物质的量为:0.0006200mol,质量为:0.0006200mol×144g/mol=0.08928g,
草酸铁的质量分数为:[0.08928g/0.20g]×100%=44.64%,
故答案为:0.0006200mol;0.0006350mol;44.64%.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了用滴定法测定该样品中FeC2O4的含量,涉及了实验方案设计、滴定管的使用、质量分数的计算等知识,可以根据所学知识完成,难度中等.1年前查看全部
- 草酸亚铁分解后通过碱石灰,a再于氧化铜反应通过b 点燃,其中a是什么?
草酸亚铁分解后通过碱石灰,a再于氧化铜反应通过b 点燃,其中a是什么?
b应该是澄清石灰水吧,
a 是浓硫酸还是氢氧化钠还是别的?目的貌似是对一氧化碳检验还是啥的,
我想应该是氢氧化钠,co2应该会有残留把他吸收完,
蛋疼的一模,还问有机物一定有什么, Lareine1年前5
Lareine1年前5 -
 龙兴之帝 共回答了12个问题
龙兴之帝 共回答了12个问题 |采纳率91.7%2FeC2O4===加热==Fe2O3+3CO+CO2
通过碱石灰,碱石灰吸收CO2
所以a是CO
CO+CuO==加热==Cu+CO2,
b应该是澄清石灰水,没错1年前查看全部
- 铁有可变化合价,将14.4克FeC2O4(草酸亚铁)隔绝空气加热使之分解,最终可得7.6克铁的氧化物,则该铁的氧化物的组
铁有可变化合价,将14.4克FeC2O4(草酸亚铁)隔绝空气加热使之分解,最终可得7.6克铁的氧化物,则该铁的氧化物的组成可能是( )
A.FeO
B.Fe3O4
C.FeO•Fe3O4
D.Fe2O3 明明2-011年前1
明明2-011年前1 -
 在tt中成长 共回答了25个问题
在tt中成长 共回答了25个问题 |采纳率96%解题思路:化学变化前后元素质量不变,14.4g FeC2O4中铁元素的质量即为7.6g铁的氧化物中铁元素的质量,由此可计算出铁的氧化物中铁与氧两元素的质量比,再由质量比计算出原子个数比而确定物质的化学式.14.4gFeC2O4中铁元素的质量=14.4g×[56/56+12×2+16×4]=5.6g,
铁的氧化物中铁与氧两元素的质量比=5.6g:(7.6g-5.6g)=56:20,
铁的氧化物中铁与氧两元素的原子个数比=[56/56]:[20/16]=4:5,则该铁的氧化物是FeO•Fe3O4,
故选C.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题以物质确定为载体,考查化学式的有关计算,难度不大,注意理解化学式表示的意义.1年前查看全部
- 将适量黄色的草酸亚铁(FeC2O4•2H2O)粉末加入试管,在酒精灯上边加热边摇动,发生剧烈反应.产生的气体可使燃着的木
将适量黄色的草酸亚铁(FeC2O4•2H2O)粉末加入试管,在酒精灯上边加热边摇动,发生剧烈反应.产生的气体可使燃着的木条熄灭,生成黑色粉末.反应将结束时,用橡皮塞塞好试管,稍冷后,打开塞子将所得的黑色粉末洒在石棉网上,便会立即自燃起来.试回答下列问题:
(1)黑色粉末是什么物质?为什么在空气中自燃?____________
(2)反应结束时,用橡皮塞塞好试管有何作用?______
(3)化学反应的快慢与反应物的表面积有何关系?______
(4)写出草酸亚铁受热分解的化学方程式?FeC2O4•2H2O
Fe+2CO2↑+2H2O△ .FeC2O4•2H2O.
Fe+2CO2↑+2H2O△ . zjusl1年前1
zjusl1年前1 -
 双手万能 共回答了18个问题
双手万能 共回答了18个问题 |采纳率88.9%解题思路:FeC2O4•2H2O加热的实验一般在试管中密闭加热,产物是二氧化碳和铁粉,中间产物一氧化碳有还原性,最后得到单质铁,得到的铁呈粉末状,黑色,反应性强,在空气中极易点燃.解;(1)①FeC2O4•2H2O加热产物是二氧化碳和铁粉,铁粉呈粉末状,黑色;
②由于生成的铁粉很细,极易氧化并产生热量使铁粉达到着火点引起自燃.
(2)因为生成的铁粉很细,极易氧化,所以反应结束时,要用橡皮塞塞好试管;
(3)反应物质的接触面表面积越大,反应越快;
(4)草酸亚铁受热分解的化学方程式为:FeC2O4•2H2O
△
.
Fe+2CO2↑+2H2O.
故答案为:(1)铁粉.由于生成的铁粉很细,极易氧化并产生热量使铁粉达到着火点引起自燃;
(2)防止铁粉被氧化;
(3)反应物表面积越大,反应越快;
(4)FeC2O4•2H2O
△
.
Fe+2CO2↑+2H2O.点评:
本题考点: 物质的鉴别、推断;影响化学反应速率的因素探究;金属的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 某课题组为探究淡黄色草酸亚铁晶体(FeC2O4•2H2O)的化学性质,进行了一系列实验探究.
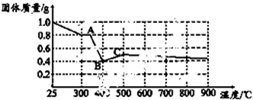 某课题组为探究淡黄色草酸亚铁晶体(FeC2O4•2H2O)的化学性质,进行了一系列实验探究.
某课题组为探究淡黄色草酸亚铁晶体(FeC2O4•2H2O)的化学性质,进行了一系列实验探究.
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有______(填“氧化性”、“还原性”或“碱性”).写出该过程反应的离子方程式:______
(2)实验表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO假设二:______假设三:______
(3)为验证上述假设一是否成立,课题组进行如下研究.请你完成下表中内容.
(4)FeC2O4•2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4•2H2O晶体受热分解的化学方程式为:实验步骤(不要求写出具体操作过程) 预期实验现象和结论
取少量黑色固体,______
______FeC2O4.2H2O
FeO+CO+CO2+2H2O△ .FeC2O4.2H2O.
FeO+CO+CO2+2H2O△ . teleyoung20001年前1
teleyoung20001年前1 -
 addyy 共回答了23个问题
addyy 共回答了23个问题 |采纳率82.6%解题思路:(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒配平方程式;
(2)草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体可能为氧化亚铁或四氧化三铁,分析判断;
(3)氧化亚铁溶解于盐酸生成氯化亚铁溶液,加入KSCN溶液,若溶液不变红证明假设一正确;
(4)根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据氧化还原反应电子守恒原子守恒配平书写离子方程式为:5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++3Mn2++5CO2↑+12H2O,
故答案为:还原性;5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++3Mn2++5CO2↑+12H2O;
(2)假设一:全部是氧化亚铁;假设二:全部是四氧化三铁;假设三:氧化亚铁和四氧化三铁的混合物;
故答案为:全部是四氧化三铁;氧化亚铁和四氧化三铁的混合物;
(3)实验步聚:取少量黑色固体,加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液.现象与结论:若溶液不变红,则假设一成立,若溶液变红,则假设一不成立;
故答案为:加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液;若溶液不变红,则假设一成立,若溶液变红,则假设一不成立;
(4)通过剩余固体的质量可知,过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,设失去结晶水x,图象分析可知固体质量变化1.0-0.8=0.2g,依据则反应的化学方程式计算为:FeC2O4•2H2O
△
.
FeC2O4+(2-x)H2O+xH2O△m
180 18x
1.0 0.2
解得x=2
加热到300°C,晶体全部失去结晶水生成草酸亚铁和水,继续加热到400°C,固体质量减少0.8g-0.4g=0.4g;此时草酸亚铁分解减少的是气体质量,反应过程中一定存在反应生成氧化亚铁和二氧化碳,铁元素化合价不变时,依据元素化合价变化和电子守恒可知碳元素化合价从+3价变化为+4价,一定有化合价降低生成+2价的一氧化碳,反应的化学方程式FeC2O4
△
.
FeO+CO+CO2,分析图象可知;
FeC2O4
△
.
FeO+CO+CO2 △m
144 72
0.8 0.4
计算结果符合图象固体质量变化,所以反应的化学方程式为:FeC2O4.2H2O
△
.
FeO+CO+CO2+2H2O,
故答案为:FeC2O4.2H2O
△
.
FeO+CO+CO2+2H2O.点评:
本题考点: 性质实验方案的设计.
考点点评: 本题考查了铁及其化合物性质的实验验证和实验分析判断,定量计算,图象分析是解题关键,题目难度较大.1年前查看全部
- 制氧化亚铁用加热分解草酸亚铁的方法,试说明不用Fe2CO3加热分解制FeO,而用此方法的原因
制氧化亚铁用加热分解草酸亚铁的方法,试说明不用Fe2CO3加热分解制FeO,而用此方法的原因
制氧化亚铁用加热分解草酸亚铁的方法:FeC2O4→FeO+CO↑+CO2↑,试说明不用Fe2CO3加热分解制FeO,而用此方法的原因:_____________ crazybaby_9131年前1
crazybaby_9131年前1 -
 陌路人乙 共回答了13个问题
陌路人乙 共回答了13个问题 |采纳率100%这是因为 草酸铁分解产生了CO或者说草酸跟具有还原性,分解时不会形成Fe2O3
而FeCO3没有还原气氛,分解时很容易形成Fe2O3 和Fe3O4而得不到FeO1年前查看全部
- 化学产品的说明书(草酸亚铁),急
化学产品的说明书(草酸亚铁),急
化学产品的说明书,有关于草酸亚铁产品的说明书 bxgj27181年前3
bxgj27181年前3 -
 我该怎么办才好 共回答了18个问题
我该怎么办才好 共回答了18个问题 |采纳率88.9%草酸亚铁
化学名称:乙二酸亚铁
CAS No:6047-25-2
分子式:FeC2O4·2H20
分子量:179.90
性状:黄色粉状结晶,微溶于水,溶于稀无机酸.加热至190℃以上开始分解成氧化铁.
技术规格:
序列
项目 电子级 工业级
1
含量(FeC2O4·2H20),%,≥ 99.5 99
2
粒径(平均),μm,≤ 15
3
水分,%,≤ 0.5 1
4
硫化合物(以SO4-2计),%,≤ 0.05 0.1
5
氯化物(以CL-),%,≤ 0.01 0.1
6
重金属(以Pb计),%,≤ 痕量
产品名称:草酸亚铁
别 名:无
英文名称:Ferrous oxalate
分 子 式:FeC2O4 2H2O
规 格:AR/25kg
CAS号 :516-03-0
参考价格:电议
性 状:浅黄色粉末状结晶,微溶于水
包 装:25kg编织袋(可按客户特殊要求包装)
注意事项:该品与皮肤接触或吞入有害.应防止儿童接近.使用时应避免与眼睛及皮肤接触.密封避光保存.
用 途:分析;涂料;染料;陶瓷;玻璃;感光材料.
淡黄色结晶性粉末,有轻微刺激性.熔点160℃(分解),相对密度2.28.真空下于142℃失去结晶水.冷水中溶解度0.22g/100g,热水中0.026g/100g,能溶于冷盐溶液.还原性较强,可被铬酐分解,并放出CO2.1年前查看全部
- 草酸亚铁(FeC 2 O 4 •2H 2 O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(
草酸亚铁(FeC 2 O 4 •2H 2 O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl 2 )溶液反应生成黑色的钯粉。回答下列问题:
I.兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:________; 假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3。
限选试剂: 1.0 mol•L - 1 盐酸、3% H 2 O 2 、0.1 mol•L - 1 CuSO 4 、20% KSCN、蒸馏水。实验步骤 现象与结论 步骤1 :向试管中加入少量固体产物,再加入足量_________________,充分振荡 若溶液颜色明显改变,且有_______生成,则证明有铁单质存在 步骤2: 将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 步骤3:取步骤2得到的少量固体与试管中, 滴加___________________________________
_______________________________________
__________________________________
___________________________________
II.某草酸亚铁样品中含有少量草酸(为方便于计算,草酸亚铁中草酸根和草酸分子均用C 2 O 4 2 - 代替)。现用滴定法测定该样品中FeC 2 O 4 的含量。滴定反应分别是:5Fe 2+ +MnO 4 - +8H + =5Fe 3+ +Mn 2+ +4H 2 O、5C 2 O 4 2 - +2MnO 4 - +16H + =10CO 2 ↑+2Mn 2+ +8H 2 O。
(3)实验方案设计为:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H 2 SO 4 溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V 1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H 2 SO 4 溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V 2 mL。
③若某小组的一次测定数据记录如下: V 1 = 18.90mL,V 2 =6.20mL。根据数据计算0.20g样品中:n(Fe 2+ )= ; n(C 2 O 4 2 - )= ;FeC 2 O 4 的质量分数为 (精确到0.01%,FeC 2 O 4 的式量为144) 深层qq的女人1年前1
深层qq的女人1年前1 -
 俗张大民 共回答了18个问题
俗张大民 共回答了18个问题 |采纳率83.3%(16分)I.(1)CO 2 、CO (2分) (2)① Fe (2分)
②
实验步骤
现象与结论
步骤1:硫酸铜溶液(1分)
暗红色固体(1分)
步骤3:过量HCl,静置,取上层清液,滴加适量H 2 O 2 ,充分振荡后滴加KSCN (2分)
若溶液呈血红色,则证明有FeO (2分)
II.(3)n(Fe 2+ )=0.0006200mol n(C 2 O 4 2 - )=0.0006350mol FeC 2 O 4 的质量分数为44.64%(每空2分,共6分)
1年前查看全部
- 高锰酸钾与草酸亚铁的总反应方程式是什麽= =
高锰酸钾与草酸亚铁的总反应方程式是什麽= =
我能写出他们分步反应的方程式.但是并起来就不对了.系数凑不齐. sript1年前1
sript1年前1 -
 qtgs 共回答了18个问题
qtgs 共回答了18个问题 |采纳率83.3%在酸性条件下,高猛酸根氧化二价铁离子、草酸根离子,其离子反应方程式分别为:
MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2↑ + 8H2O
总的离子方程式:
3MnO4- + 5FeC2O4 + 24H+ = 3Mn2+ + 5Fe3+ + 12H2O
化学方程式为:
6KMnO4 + 10FeC2O4 + 24H2SO4 = 6MnSO4 + 5Fe2(SO4)3 + 3K2SO4 + 20CO2↑ + 24H2O
(网页上不能设置字体格式,只能写成这种形式了)1年前查看全部
- 草酸亚铁固体是否含有结晶水
 qtooy1年前1
qtooy1年前1 -
 paulina1019 共回答了17个问题
paulina1019 共回答了17个问题 |采纳率94.1%FeC2O4·2H2O1年前查看全部
- 加热草酸亚铁得到的物质?感觉不是氧化一铁加热后在烧杯底部有一些比黑色稍浅的固体然后加入水,水变浑浊,但是放了十分钟多些就
加热草酸亚铁得到的物质?
感觉不是氧化一铁
加热后在烧杯底部有一些比黑色稍浅的固体
然后加入水,水变浑浊,但是放了十分钟多些就变清了些、从烧杯上方可以看到沉淀,但是从侧面看很浑浊.
这是一氧化铁还是四氧化三铁.还是三氧化二铁?还是其他的?…… david61年前1
david61年前1 -
 悠悠鱼闲庭花 共回答了17个问题
悠悠鱼闲庭花 共回答了17个问题 |采纳率82.4%FeC2O4==加热===FeO +CO +CO2
最开始是形成FeO
要是没有隔绝空气
6FeO +O2===加热===2Fe3O4
加热时FeO很容易被空气中氧气氧化成Fe3O41年前查看全部
- 某研究性学习小组为探究草酸亚铁晶体的化学性质,进行了下列实验.已知草酸亚铁晶体(FeC2O4•2H2O)呈浅黄色,其中C
某研究性学习小组为探究草酸亚铁晶体的化学性质,进行了下列实验.已知草酸亚铁晶体(FeC2O4•2H2O)呈浅黄色,其中C元素的化合价为+3价.
(1)向盛有草酸亚铁晶体的试管中滴入几滴H2SO4酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到有CO2气体生成.这说明草酸亚铁晶体具有______(填“氧化性”、“还原性”或“碱性”).若此反应中消耗2molFeC2O4•2H2O,则参加反应的KMnO4为______mol.
(2)查阅资料表明:草酸亚铁晶体在密闭容器中加热到一定温度时完全分解,生成几种氧化物,残留物为黑色固体.请你根据课本上介绍的铁的氧化物的物理性质,对黑色固体的组成提出如下假设,完成假设二和假设三:
假设一:全部是FeO假设二______:假设三______:
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成下表中内容.
【定量研究】资料表明FeC2O4•2H2O受热分解时,固体质量随温度变化的曲线如下图所示.请你写出加热到400℃时,FeC2O4•2H2O晶体受热分解(生成几种氧化物)的化学方程式为:实验步骤(不要求写出具体操作过程) 预期实验现象和结论 取少量黑色固体,______ ______ FeC2O4
FeO+CO+CO2△ .FeC2O4
FeO+CO+CO2△ .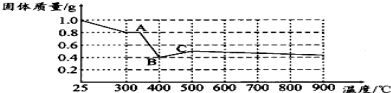
 贝贝sx1年前1
贝贝sx1年前1 -
 无语lan 共回答了26个问题
无语lan 共回答了26个问题 |采纳率92.3%解题思路:(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量;
(2)草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体可能为氧化亚铁或四氧化三铁,分析判断;
(3)氧化亚铁溶解于盐酸生成氯化亚铁溶液,加入KSCN溶液,若溶液不变红证明假设一正确;
定量实验:根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量,依据氧化还原反应电子守恒原子守恒配平书写离子方程式为:
5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++3Mn2++5CO2↑+12H2O,消耗2mol FeC2O4•2H2O,则参加反应的KMnO4为1.2mol;
故答案为:还原性;1.2;
(2)假设一:全部是氧化亚铁;假设二:全部是四氧化三铁;假设三:氧化亚铁和四氧化三铁的混合物,
故答案为:全部是四氧化三铁;氧化亚铁和四氧化三铁的混合物;
(3)[定性研究]实验步聚:取少量黑色固体,加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液.现象与结论:若溶液不变红,则假设一成立,若溶液变红,则假设一不成立;
故答案为:取少量黑色固体,加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液,若溶液不变红,则假设一成立,若溶液变红,则假设一不成立;
[定量研究]通过剩余固体的质量可知,过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,设失去结晶水x,图象分析可知固体质量变化1.0-0.8=0.2g,依据则反应的化学方程式计算为:
FeC2O4•2H2O
△
.
FeC2O4•(2-x)H2O+xH2O△m
180 18x
1.0 0.2
x=2
加热到300°C,晶体全部失去结晶水生成草酸亚铁和水,
继续加热到400°C,固体质量减少0.8g-0.4g=0.4g;此时草酸亚铁分解减少的是气体质量,反应过程中一定存在反应生成氧化亚铁和二氧化碳,铁元素化合价不变时,依据元素化合价变化和电子守恒可知碳元素化合价从+3价变化为+4价,一定有化合价降低生成+2价的一氧化碳,反应的化学方程式FeC2O4
△
.
FeO+CO+CO2,
FeC2O4
△
.
FeO+CO+CO2 △m
144 72
0.8 0.4
计算结果符合图象固体质量变化,所以反应的化学方程式为FeC2O4
△
.
FeO+CO+CO2 ,
故答案为:FeC2O4
△
.
FeO+CO+CO2 .点评:
本题考点: 性质实验方案的设计.
考点点评: 本题考查了铁及其化合物性质的实验验证和实验分析判断,定量计算,图象分析是解题关键,题目难度较大.1年前查看全部
- 铁具有可变化合价,将14.4克草酸亚铁隔绝空气加热分解
 guo_11271年前1
guo_11271年前1 -
 yldh8855 共回答了26个问题
yldh8855 共回答了26个问题 |采纳率92.3%如果是隔绝空气加热,应该生成氧化亚铁和一氧化碳、二氧化碳.
FeC2O4=(隔绝空气加热)FeO+CO↑+CO2↑,14.4g 草酸亚铁恰好0.1mol,所以生成FeO 0.1mol 7.2g;CO 0.1mol 2.8g;CO2 0.1mol 4.4g1年前查看全部
- 草酸亚铁受热分解为何生成的事FeO、CO、二氧化碳,那么CO不就将FeO还原了吗?
 1589954901年前3
1589954901年前3 -
 wyp_hua 共回答了24个问题
wyp_hua 共回答了24个问题 |采纳率95.8%不能哦,因为CO要是还原氧化铁和氧化亚铁的时候必须是要在高温的情况下,但是草酸根分解只需要在加热情况下,温度远低于高温(加热是在酒精灯的加热温度范围内约在50--800摄氏度,高温是要到煅烧的温度,需要用酒精喷灯约...1年前查看全部
- (2007•广州一模)某草酸亚铁样品中含有少量硫酸亚铁.现用滴定法测定该样品中FeC2O4的含量.滴定反应是:
(2007•广州一模)某草酸亚铁样品中含有少量硫酸亚铁.现用滴定法测定该样品中FeC2O4的含量.滴定反应是:
5Fe2++5C2O42-+3MnO4-+24H+═5Fe3++10CO2↑+3Mn2++12H2O.
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b ml.
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后(不含Fe3+),继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c ml.
③______.
④数据处理.
请回答下列问题:
(1)上述实验方案中的步骤③是______.
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ.______;
Ⅱ.用高锰酸钾标准溶液润洗滴定管;
Ⅲ.加入高锰酸钾标准溶液,赶走尖嘴部位的气泡;
Ⅳ.______.
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有______溶液的试管中,如______,则说明溶液合格.
(4)某实验探究小组的一次测定数据记录如下:
根据数据计算0.1582g 样品中:n(Fe2+)=______; n(C2O42-)=______;FeC2O4(FeC2O4 的摩尔质量为144g/mol)的质量分数为______.(精确到0.1%)a/g 起始读数/mL b/mL c/mL 0.1582 0.00 29.90 40.90 0.1582 0.00 30.10 41.10 0.1582 0.00 32.10 43.10  羊羊的幸福生活1年前1
羊羊的幸福生活1年前1 -
 漪ss 共回答了24个问题
漪ss 共回答了24个问题 |采纳率91.7%解题思路:(1)为了减小误差,需要重新操作实验;
(2)Ⅰ滴定管使用前必须进行查漏;
Ⅳ根据滴定管的构造,0刻度在上方,盛装的溶液不能超过0刻度;
(3)可以根据检验三价铁离子的方法完成;
(4)根据表中数据,舍弃无效数据,然后计算出消耗高锰酸钾溶液的平均体积,根据关系式计算出亚铁离子、草酸根离子的浓度,再根据亚铁离子、草酸根离子的物质的量计算出草酸铁的质量分数.(1)为了使实验数据更加准确,需要重复1-2次实验,
故答案为:重复以上实验1-2次;
(2)Ⅰ滴定管在使用前需要进行检查是否漏液,
故答案为:检验活塞是否漏液;
Ⅳ由于滴定管的0刻度在上方,盛装的溶液不能超过0刻度,所以需要调节液面至“0”刻度以下,
故答案为:调节液面至“0”刻度以下;
(3)要证明溶液中没有三价铁离子,可以向溶液中加入硫氰化钾溶液,溶液中没有出现血红色,证明溶液中没有三价铁离子,
故答案为:KSCN;溶液中没有出现血红色(或红色);
(4)由于第三次试验的数据误差较大,舍弃掉,
样品配制溶液中亚铁离子、草酸根离子消耗的高锰酸钾溶液的平均体积为:[40.90+41.10/2]mL=41.00ml,高锰酸钾的物质的量为:0.041L×0.02000mol/L=8.2×10-4mol,
亚铁离子消耗的高锰酸钾溶液的平均体积为:41.00mL-[29.90+30.10/2]mL=11.00mL,高锰酸钾的物质的量为:0.011L×0.02000mol/L=2.2×10-4mol,
草酸根离子消耗的高锰酸钾溶液的体积为:30.00mL-11.00mL=19.00mL,高锰酸钾的物质的量为:0.019×0.02000mol/L=3.8×10-4mol
根据化合价升降相等找出关系式:5Fe2+~MnO4-,5C2O42-~2MnO4-,
n(Fe2+)=5×2.2×10-4mol=0.001100mol,
n(C2O42-)=2.5×3.8×10-4mol=0.00095mol,
根据草酸根离子物质的量可知草酸铁的物质的量为:0.00095mol,质量为:0.00095mol×144=0.1368g,
草酸铁的质量分数为:[0.1368g/0.1582g]×100%≈86.5%,
故答案为:0.001100mol;n(C2O42-)=0.001000mol;86.50%;点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了用滴定法测定该样品中FeC2O4的含量,涉及了实验方案设计、滴定管的使用、质量分数的计算等知识,可以根据所学知识完成,难度中等.1年前查看全部
- (2014•厦门)已知有些晶体按比例含有一定量特殊的水(称为结晶水),在一定的温度下可脱去结晶水,为了研究草酸亚铁晶体的
 (2014•厦门)已知有些晶体按比例含有一定量特殊的水(称为结晶水),在一定的温度下可脱去结晶水,为了研究草酸亚铁晶体的组成,称取54.0g草酸亚铁晶体在隔绝空气条件下加热,得到剩余固体的质量随温度变化曲线如图所示.已知:温度t1℃时,草酸亚铁晶体完全脱去结晶水,并生成草酸亚铁(FeC2O4)固体;温度t2℃时,草酸亚铁完全分解,发生反应:3FeC2O4
(2014•厦门)已知有些晶体按比例含有一定量特殊的水(称为结晶水),在一定的温度下可脱去结晶水,为了研究草酸亚铁晶体的组成,称取54.0g草酸亚铁晶体在隔绝空气条件下加热,得到剩余固体的质量随温度变化曲线如图所示.已知:温度t1℃时,草酸亚铁晶体完全脱去结晶水,并生成草酸亚铁(FeC2O4)固体;温度t2℃时,草酸亚铁完全分解,发生反应:3FeC2O4
Fe3O4+4CO↑+2CO2↑.△ .
(1)根据化学方程式计算草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量.
(2)求该草酸亚铁晶体中结晶水的质量.
(3)求该草酸亚铁晶体中铁元素的质量分数(精确到0.1%). aa咻咻1年前1
aa咻咻1年前1 -
 vv家居顶固 共回答了19个问题
vv家居顶固 共回答了19个问题 |采纳率94.7%解题思路:(1)根据题意结合图示可知生成的四氧化三铁的质量,结合草酸亚铁完全分解的化学方程式即可计算出FeC2O4的质量.
(2)54.0g草酸亚铁晶体减去FeC2O4的质量即为结晶水的质量;
(3)根据四氧化三铁中铁元素的质量即为草酸亚铁晶体中铁元素的质量,结合元素质量分数的公式即可解答.(1)设草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量为x,
3FeC2O4
△
.
Fe3O4+4CO↑+2CO2↑
432232
x23.2g
[432/x=
232
23.2g]
x=43.2g
(2)该草酸亚铁晶体中结晶水的质量:54.0g-43.2g=10.8g;
(3)四氧化三铁中铁元素的质量:23.2g×
56×3
232×100%=16.8g
该草酸亚铁晶体中铁元素的质量分数:
16.8g
54.0g×100%=31.1%;
答:(1)草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量是43.2g;
(2)该草酸亚铁晶体中结晶水的质量是10.8g;
(3)该草酸亚铁晶体中铁元素的质量分数是31.1%.点评:
本题考点: 根据化学反应方程式的计算;化合物中某元素的质量计算.
考点点评: 本题考查的是根据化学方程式的计算以及有关化学式计算的综合类计算,需熟练掌握计算步骤与格式.1年前查看全部
- 铁有可变化合价.将28.8g草酸亚铁(FeC2O4)在隔绝空气的条件下加热分解,最终得到14.4g铁的氧化物.通过计算求
铁有可变化合价.将28.8g草酸亚铁(FeC2O4)在隔绝空气的条件下加热分解,最终得到14.4g铁的氧化物.通过计算求这种铁的氧化物的化学式.
FeO glciqgyt1年前1
glciqgyt1年前1 -
 穆可可 共回答了27个问题
穆可可 共回答了27个问题 |采纳率88.9%【氧化亚铁】化学式FeO不稳定,在空气中加热时迅速被氧化成四氧化三铁,所以实验在隔绝空气的环境下进行.
在隔绝空气条件下加热草酸亚铁制得:
FeC2O4=FeO+CO+CO2
草酸亚铁的摩尔质量144g/mol
得草酸亚铁中的铁的物质的量为28.8/144=0.2mol
0.2mol的铁的质量为56*0.2=11.2g
得到的氧化物中的氧的质量就是14.4-11.2=3.2g
3.2g氧的物质的量为0.2mol
所以该氧化物中铁和氧的比例为1:1
所以是FeO1年前查看全部
- 草酸亚铁晶体(FeC 2 O 4 ·2H 2 O)在医药行业可用作补血剂。某化学兴趣小组的同学为探究草酸亚铁晶体的化学性
草酸亚铁晶体(FeC 2 O 4 ·2H 2 O)在医药行业可用作补血剂。某化学兴趣小组的同学为探究草酸亚铁晶体的化学性质,进行了如下实验。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO 4 溶液,振荡,发现溶液的颜色由紫红色变为棕黄色,同时有气体生成。这说明草酸亚铁晶体具有_____________(填“氧化性”、“还原性”或“酸性”)。若反应中消耗1mol FeC 2 O 4 ·2H 2 O,则参加反应的KMnO 4 为_____________mol。
(2)已知草酸亚铁晶体的熔点为160℃,当加热至590℃时晶体可发生分解:FeC 2 O 4 ·2H 2 O FeO+CO 2 ↑+CO↑+2H 2 O。甲同学欲检验晶体分解生成的CO 2 、CO和水蒸气,设计了如下实验装置(央持仪器已略去):
FeO+CO 2 ↑+CO↑+2H 2 O。甲同学欲检验晶体分解生成的CO 2 、CO和水蒸气,设计了如下实验装置(央持仪器已略去): 
乙同学通过分析草酸亚铁晶体的熔点和分解温度,发现上述实验装置中有一处明显的错误,清指出如何改进:________________________。
(3)根据乙同学的建议将装置改进后,开始进行实验。实验现象:装置C、G中澄清石灰水变浑浊,B中CuSO 4 粉末变蓝,F中CuO粉末变红。据此回答下列问题。
①在上述实验装置中,氢氧化钠溶液的作用是____________。能够说明草酸亚铁晶体的分解产物中含有CO的理由是_____________________________。
②实验开始时,应首先检验装置的_______________,实验结束时,应先熄灭_____________处的酒精灯。
③丙同学认为装置A的试管中还可能发生如下反应:FeO+CO Fe+CO 2 ,请你设汁一个简单的化学实验验证该结论(写出实验操作步骤、现象与结论):__________________________。
Fe+CO 2 ,请你设汁一个简单的化学实验验证该结论(写出实验操作步骤、现象与结论):__________________________。  土豆和麻袋1年前1
土豆和麻袋1年前1 -
 天堂鸟pw 共回答了19个问题
天堂鸟pw 共回答了19个问题 |采纳率89.5%(1)还原性;0.6
(2)将装置A中的试管口改为向上倾斜
(3)①除去晶体分解产生的CO 2 ;F中粉末变红,晶体分解产生的CO 2 已被除去,但G中的澄清石灰水仍变浑浊
②气密性;F
③ 待装置A中的试管冷却后,取下试管,向试管中加入稀硫酸,若有气泡产生,则说明FeO被CO还原生成了单质铁1年前查看全部
- 第四问要解题过程某草酸亚铁样品(FeC2O4•xH2O)中含有少量硫酸亚铁.现用滴定法测定该样品中FeC2O
第四问要解题过程
某草酸亚铁样品(FeC2O4•xH2O)中含有少量硫酸亚铁.现用滴定法测定该样品中FeC2O4的含量.滴定反应是:5 Fe2+ +5C2O42—+3MnO4—+24H+==5 Fe3+ +10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5—8min,经检验溶液合格后,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c mL
③ .
④数据处理.
请回答下列问题:
(1)上述实验方案中的步骤③是 .
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ.检验活塞是否漏水.
Ⅱ..
Ⅲ.加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数.
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有 溶液的试管中,如 ,则说明溶液合格.
(4)某小组的一次测定数据记录如下:
a/g 起始读数/mL b/mL c/mL
0.1970 0.00 31.30 42.40
根据数据计算0.1970g 样品中:n(Fe2+)== ; n(C2O42—)== ;
FeC2O4 的质量分数为 (精确到0.01%) robertonana1年前1
robertonana1年前1 -
 jestion 共回答了18个问题
jestion 共回答了18个问题 |采纳率88.9%第一次滴定所需高锰酸钾b mL为滴定Fe2+和C2O42—的总用量,第二次滴定所需高锰酸钾C mL为滴定Fe2+的用量.
所以根据5 Fe2+ ——MnO4—可以求得:
n(Fe2+)=0.02000 mol/L *c/mL =5* 0.02000 *(42.40-31.30)=0.00111mol
再根据5C2O42—2MnO4-可以求得
n(C2O42—)==52*0.02000 *[31.30-(42.40-31.30)]=0.00101mol1年前查看全部
- FeC2O4是什么?是草酸亚铁么
 saynook1111年前2
saynook1111年前2 -
 白紙╦黒字m 共回答了15个问题
白紙╦黒字m 共回答了15个问题 |采纳率86.7%是的.1年前查看全部
- 草酸亚铁加热到900度不分解?
 我是来泡妞的1年前2
我是来泡妞的1年前2 -
 qingqingxiaoniu 共回答了19个问题
qingqingxiaoniu 共回答了19个问题 |采纳率94.7%将适量黄色的草酸亚铁(FeC2O4·2H2O)粉末加入试管,在酒精灯上边加热边摇动,发生剧烈反应,产生的气体可以使燃着的木条熄灭,生成黑色的粉末.反应将结束时,用橡皮塞塞好试管,稍冷后,打开塞子将所得的黑色粉末洒在石棉网上,便会立刻自然起来
草酸亚铁受热分解为氧化亚铁,一氧化碳,二氧化碳(FeC2O4=FeO+CO+CO2
FeC2O4*2H2O=Fe+2CO2+2H2O ) 黑色粉末是铁粉(氧化亚铁被一氧化碳还原,氧化亚铁在加热的条件下和氧气反应生成四氧化三铁.)铁和氧气在500度左右也会放应生成四氧化三铁(温度更高四氧化三铁又会分解为氧气和三氧化二铁,大约在700到800度)所以在反应快结束时用橡皮塞塞好是为了防止和氧气反应,不在一开始就塞上是因为要生成气体1年前查看全部
- 草酸亚铁(FeC2O4)难溶于水,受热会分解.用硫酸亚铁溶液和草酸铵溶液反应可制备草酸亚铁晶体FeC2O4•2H2O(相
草酸亚铁(FeC2O4)难溶于水,受热会分解.用硫酸亚铁溶液和草酸铵溶液反应可制备草酸亚铁晶体FeC2O4•2H2O(相对分子质量180).
(1)制草酸亚铁晶体反应的化学方程式______.
(2)18.0gFeC2O4•2H2O加热至400℃,得7.2gFeO、3.6gH2O和______(填序号).
①CO②CO2 ③CO和CO2. lulu2007121年前1
lulu2007121年前1 -
 老二掉了碗大个疤 共回答了16个问题
老二掉了碗大个疤 共回答了16个问题 |采纳率75%解题思路:(1)根据题中所给的知识找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式;(2)根据题中所给的数据再采用极限法计算,然后分析生成物的成分.(1)通过分析题中所给的物质可知,硫酸亚铁草酸铵和水反应生成草酸亚铁晶体和硫酸铵,化学方程式为:FeSO4+(NH4)2C2O4+2H2O=FeC2O4•2H2O↓+(NH4)2SO4;(2)设草酸亚铁晶体分解全部生成了二氧化碳为x, &...
点评:
本题考点: 物质的相互转化和制备;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,可以用极限法判断混合气体的成分,书写化学方程式时要依据质量守恒定律进行书写.1年前查看全部
- 草酸亚铁受热分解成什么
 xtassfn5201年前1
xtassfn5201年前1 -
 贪睡的标点 共回答了13个问题
贪睡的标点 共回答了13个问题 |采纳率84.6%隔绝空气 FeC2O4=加热=FeO+ CO↑+ CO2↑
空气中,有氧气参与:
4FeC2O4+O2=加热=2Fe2O3 + 2CO↑+ 2CO2↑1年前查看全部
- 那草酸亚铁需要加热吗?
 鱼儿宝贝水里游1年前1
鱼儿宝贝水里游1年前1 -
 8个qq的ww 共回答了16个问题
8个qq的ww 共回答了16个问题 |采纳率81.3%加热会分解,我们一般用的是晶体草酸亚铁,先失水,再分解
对光也敏感,见光长时间也分解
FeC2O4·2H2O=FeC2O4+2H2O
FeC2O4=FeO+CO+CO21年前查看全部
- 草酸亚铁(FeC2O4*2H2O)加热后生成什么,化学方程式是什么?
 陈aa1年前2
陈aa1年前2 -
 oyanglisi 共回答了20个问题
oyanglisi 共回答了20个问题 |采纳率85%FeC2O4*2H2O加热的实验我做过,一般在试管中密闭加热,产物是二氧化碳和铁粉
中间产物一氧化碳有还原性,最后得到单质铁
FeC2O4*2H2O=Fe+2CO2+2H2O
得到的铁呈粉末状,黑色,反应性强,在空气中极易点燃1年前查看全部
- 请问要如何用铁的化合物制铁粉?请问我现在有硫酸亚铁,草酸亚铁等一些铁的化合物,要如何制作铁粉?或者有其他的什么办法制铁粉
请问要如何用铁的化合物制铁粉?
请问我现在有硫酸亚铁,草酸亚铁等一些铁的化合物,要如何制作铁粉?或者有其他的什么办法制铁粉? yxiong1年前1
yxiong1年前1 -
 dinor 共回答了21个问题
dinor 共回答了21个问题 |采纳率95.2%制铁一般原理:Fe2O3+3CO==2Fe+3CO2 你可将硫酸亚铁,草酸亚铁等在高温分解生成Fe2O3或FeO,然后再用CO还原就OK.1年前查看全部
- 草酸亚铁晶体热分解产物是水、CO2、CO,利用下列装置检验气体产物.受热分解装置应该怎么画啊
草酸亚铁晶体热分解产物是水、CO2、CO,利用下列装置检验气体产物.受热分解装置应该怎么画啊
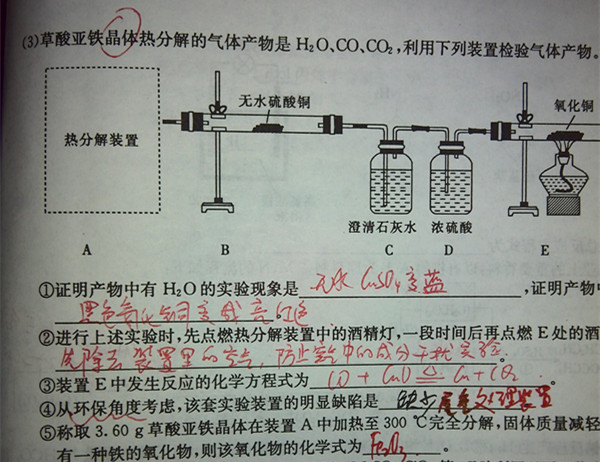

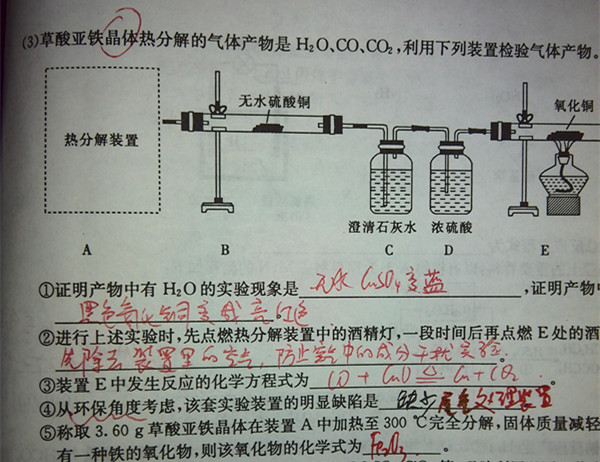
还有最后一问,该氧化物的化学式为什么是氧化铁,怎么算的?
 龙门浪1年前0
龙门浪1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 草酸亚铁晶体(化学组成为FeC2O4•xH2O)是一种淡黄色晶体粉末,常用于照相显影剂及制药工业,是电池材料的制备原料.
草酸亚铁晶体(化学组成为FeC2O4•xH2O)是一种淡黄色晶体粉末,常用于照相显影剂及制药工业,是电池材料的制备原料.

草酸亚铁晶体受热分解可以生成四种氧化物,为确定分解后的产物及x的值,某实验小组设计了如下实验装置并进行探究(酒精灯略去,不考虑装置中气体的质量,且无水CuSO4足量):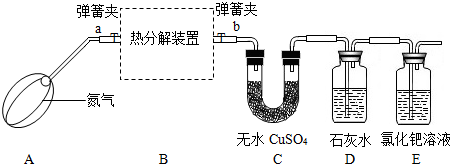
【实验步骤】:
①连接好装置,______;
②称量装置B(含两侧弹簧夹)、C的质量;
③在热分解装置中装入一定质量的草酸亚铁晶体,打开弹簧夹a、b,鼓入一段时间氮气;
④______,用酒精灯加热热分解装置,直至晶体完全变成黑色,停止加热;
⑤打开弹簧夹a,继续通氮气至装置冷却,关闭弹簧夹a、b;
⑥再次称量装置B、C的质量.
【进行实验】:该小组同学按上述实验步骤进行实验,并记录了如下数据:
【实验分析及数据处理】:装置B的质量(/g) 装置C的质量(/g) 实验前 145.8 168.2 实验后 140.4 170.0 热分解装置质量为136.8g
(1)实验过程中,装置C中固体颜色变为蓝色,说明草酸亚铁晶体分解生成了______,FeC2O4•xH2O中x的值为______;
(2)装置E出现黑色物质,说明草酸亚铁晶体分解生成了______;
(3)装置C中澄清石灰水变浑浊,说明草酸亚铁晶体分解生成了______;
(4)根据上表数据,计算反应后,热解装置中残留黑色物质的化学式;(提示:相对分子质量分别为FeC2O4:144; H2O:18)
______;
(5)实验过程中,鼓入氮气的目的是______;
(6)实验后,热解装置中固体的颜色由淡黄色变成黑色,写出草酸亚铁晶体受热分解的化学方程式FeC2O4•2H2O
FeO+CO2↑+CO↑+2H2O300℃ .FeC2O4•2H2O;
FeO+CO2↑+CO↑+2H2O300℃ .
【反思应用】:
(7)有同学认为,实验中生成的CO和铁的氧化物会继续反应生成铁.你认为这种说法是否正确?请说出可能的理由______;
(8)经过讨论,同学们一致认为上述实验装置有不足,你认为是什么?______;
(9)某些食品的包装袋中,常用氧化亚铁作为防伪试剂,一旦包装打开,立即变成红棕色,写出该反应的化学方程式______. hymzyg1年前1
hymzyg1年前1 -
 goodnight_kiss 共回答了23个问题
goodnight_kiss 共回答了23个问题 |采纳率78.3%解题思路:【实验步骤】:运用气体的制取和题中实验装置的用途和气流的方向解答.
【实验分析及数据处理】:
(1)运用无水硫酸铜遇到水变蓝的性质和题中记录的实验数据结合化学式的计算解答.
(2)运用一氧化碳能与氯化钯溶液反应生成黑色的物质解答.
(3)运用二氧化碳能使澄清的石灰水变浑浊解答.
(4)运用根据化学式计算组成元素的质量比解答.
(5)运用装置A和后面的装置的实验目的解答.
(6)运用化学方程式的书写方法解答.
(7)运用一氧化碳还原铁的氧化物所需的温度和酒精灯加热的最高温度解答.
(8)运用一氧化碳的毒性从环保的角度解答.
(9)运用题中信息和化学方程式的书写解答.【实验步骤】:从实验装置图分析可知B是草酸亚铁受热分解的装置,根据实验中气流的方向和基本操作,故答案:①检查气密性④关闭弹簧夹a
【实验分析及数据处理】:
(1)无水硫酸铜遇水变蓝色结合实验中装置C中的无水硫酸铜变蓝色,装置C增加的质量既是草酸亚铁中水的质量为分解后生成水的质量:170.0g-168.2g=1.8g,草酸亚铁晶体的质量为145.8g-136.8g=9.0g,9g草酸亚铁晶体中FeC2O4的质量为9.0g-1.8g=7.2g,即56+12×2+16×4:18x=7.2:1.8,x=2故(1)答案:水2
(2)一氧化碳能与氯化钯溶液反应生成黑色的物质,故(2)答案:CO
(3)二氧化碳能使澄清的石灰水变浑浊,故(3)答案:CO2
(4)根据表中数据可得热分解装置中草酸亚铁晶体的质量为145.8g-136.8g=9.0g,分解后生成水的质量为170.0g-168.2g=1.8g,则草酸亚铁晶体中FeC2O4的质量为9.0g-1.8g=7.2g,
则其中Fe元素质量为
7.2g×[56/144]×100%=2.8g …(1分)
又∵热分解装置中剩余黑色固体质量为140.4g-136.8g=3.6g,
∴剩余物中氧元素质量为3.6g-2.8g=0.8g…(1分)
设此黑色物质的化学式为FeaOb,则
[56a/16b=
2.8g
0.8g]得[a/b=
1
1]
∴热解装置中残留黑色物质的化学式为FeO
故(4)答案:FeO
(5)A在B草酸亚铁加热分解得装置前,故(5)答案:排尽装置中的空气,以免黑色的残留物(或FeO)被氧化
(6)草酸亚铁晶体受热分解可以生成四种氧化物:FeO、CO2、CO、H2O,故(6)答案:
FeC2O4•2H2O
300℃
.
FeO+CO2↑+CO↑+2H2O
【反思应用】:
(7)酒精灯加热的最高温度,氧化亚铁被一氧化碳还原的温度是710℃,故(7)答案:不正确,因为温度达不到工业炼铁所需的高温,所以不能相互反应生成Fe;
(8)一氧化碳有毒不能直接排入空气中,故(8)答案:没有尾气处理装置,会造成CO污染空气;
(9)氧化铁是红棕色固体,故(9)答案:4FeO+O2═2Fe2O3点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;二氧化碳的化学性质;一氧化碳的化学性质;化合物中某元素的质量计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题从照相显影剂及制药工业,是电池材料的制备原料草酸亚铁的性质探究入手,体现了化学是生活化,这就要求同学们不断培养运用所学知识解决日常生活中常见现象的能力.1年前查看全部
- 草酸和硫酸亚铁是否会反应?我把两种溶液混合后好像没反应,但按复分解反应原理,应该会出现草酸亚铁沉淀啊?
 jwr_sp1年前3
jwr_sp1年前3 -
 fangsanyu 共回答了17个问题
fangsanyu 共回答了17个问题 |采纳率76.5%如果这样的话,草酸亚铁的伴随产物是硫酸,乙酸是弱酸,弱酸不能制强酸.1年前查看全部
- 草酸铁加热生成什么生成物可自燃隔绝氧气 草酸亚铁
 路_渐行渐远1年前1
路_渐行渐远1年前1 -
 好几个孩叫 共回答了17个问题
好几个孩叫 共回答了17个问题 |采纳率88.2%草酸亚铁隔绝氧气加热
FeC2O4=FeO+CO↑+CO2↑1年前查看全部
- 制备草酸亚铁时加入硫酸的作用是什么?
 cheng07551年前1
cheng07551年前1 -
 兔兔T_T 共回答了21个问题
兔兔T_T 共回答了21个问题 |采纳率85.7%抑制亚铁离子水解1年前查看全部
- 草酸亚铁晶体(FeC2O3•2H2O)在医药行业可用做补血剂,也可用于制备锂离子电池的正极材料磷酸亚铁锂(LiFePO2
草酸亚铁晶体(FeC2O3•2H2O)在医药行业可用做补血剂,也可用于制备锂离子电池的正极材料磷酸亚铁锂(LiFePO2),FeC2O4•2H2O加热至590℃时发生分解反应:FeC2O4•2H2O
FeO+CO2↑+CO↑+2H2O,甲同学设计了如图实验装置(部分夹持装置未列出)检验该反应生成的CO2,CO和水蒸气.590℃ .
(1)装置B中盛装的药品是______.
(2)装置C的作用是______.
(3)装置E中发生反应的化学方程式为CO+CuO
Cu+CO2△ .CO+CuO,能说明草酸亚铁晶体受热分解产生的气体中含有CO的现象是______.
Cu+CO2△ .
(4)写出一种尾气处理的方法:______.
(5)乙同学将装置F中的澄清石灰水换成新制的银氨溶液,反应一段时间后,观察到F的试管中生成大量的单质银颗粒,写出该反应的方程式:______. 小鱼ivy1年前1
小鱼ivy1年前1 -
 SSXKJ 共回答了17个问题
SSXKJ 共回答了17个问题 |采纳率94.1%解题思路:(1)水的检验可以用无水硫酸铜来检验;
(2)二氧化碳能使石灰水变或是氢氧化钡变浑浊;
(3)一氧化碳能使黑色的氧化铜粉末变为红色,生成物是铜和二氧化碳;
(4)一氧化碳的处理可以采用点燃法,生成的二氧化碳是无毒的;
(5)一氧化碳可以和银氨溶液之间发生反应生成金属银,据此回答.(1)水的检验可以用无水硫酸铜来检验,所以装置B中盛装的药品是无水硫酸铜,故答案为:无水硫酸铜;
(2)二氧化碳能和氢氧化钡反应生成碳酸钡和水,溶液变浑浊,可以用于二氧化碳的检验,故答案为:检验二氧化碳的产生;
(3)一氧化碳能使黑色的氧化铜粉末变为红色,反应的生成物是铜和二氧化碳,即CO+CuO
△
.
Cu+CO2,E中黑色固体变红色,F中石灰水变浑浊,可以证明一氧化碳的存在,故答案为:CO+CuO
△
.
Cu+CO2;E中黑色固体变红色,F中石灰水变浑浊;
(4)一氧化碳点燃生成的二氧化碳是无毒的,可以用点燃法处理,故答案为:将尾气点燃;
(5)一氧化碳可以和银氨溶液之间发生反应生成金属银,反应为:CO+2Ag(NH3)2OH=2Ag↓+NH3+(NH4)2CO3,故答案为:CO+2Ag(NH3)2OH=2Ag↓+NH3+(NH4)2CO3.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查学生物质的性质以及检验知识,注意知识的归纳和梳理是解题的关键,难度不大.1年前查看全部
大家在问
- 1为什么两个带电的绝缘体接触,如果是异种电荷就会发生电子转移,它不是绝缘吗,绝缘不就不移吗
- 2某校七年级有6个班,采用单循环制进行篮球比赛,共需进行比赛的场数为( )
- 310.9起点世博问答答案1. 1915年的博览会是为纪念 (D ) 而举办的 A 苏伊士运河开通 B 阿尔贝特运河 C
- 4钨丝是什么颜色白炽灯里的钨丝在没有通电发光时究竟是什么颜色的,通电反光后又是什么颜色的?
- 5有三个不相同的有理数,即如1,a+b,a,也可以0,b/a,b,求a的2001次方+b的2002次方的值
- 6多音字“蒙”2011/8/9 14:13:27,蒙 除了有 meng(第二声) 还有什么读音?
- 7银燕小学有一块长方形花圃,长8米.在修建校园时,把花圃的长增加了3米,于是面积增加了18平方米.现在这个花圃的面积是多少
- 8步行对身体有好处,你为什么不步行上班呢?英文翻译
- 9麻烦纠正一下语法错误World Cup is appealing to me.it worth watching,i t
- 10一辆汽车运面粉和大米共2400千克,其中大米是面粉的2倍,求大米和面粉各多少千克?
- 11问几道数学题 请速回答 16分之( )=( )分之15=( ) :( )=125%在5 :3=15 :9比例中,如果内项
- 12新航路开辟过程中,发现美洲的航海家是 A.迪亚士 B.达·伽马 C.哥伦布 D.麦哲伦
- 13英语翻译My biggest problem is that I'm too busy.when I was young
- 14仲夏夜之梦是不是莎士比亚写的?
- 15求lim x→0 (1+3x)5x分之一的平方,极限
