金属铁FeCl3怎么变成H2SO4,离子方程式?可以分两部反应
 九月的云2022-10-04 11:39:541条回答
九月的云2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 小笑林 共回答了17个问题
小笑林 共回答了17个问题 |采纳率88.2%- 这个有可能吗.还是说你想问fecl3和硫酸反应的方程式
- 1年前
相关推荐
- 写出下列反应的化学方程式:(1)盐酸与氢氧化钠反应______(2)金属锌与稀硫酸反应______(3)金属铁与硫酸铜溶
写出下列反应的化学方程式:
(1)盐酸与氢氧化钠反应______
(2)金属锌与稀硫酸反应______
(3)金属铁与硫酸铜溶液反应______
(4)碳酸钙与盐酸反应______
(5)氯化铁溶液与氢氧化钠溶液反应______. 南京小猪7704221年前1
南京小猪7704221年前1 -
 teadust 共回答了14个问题
teadust 共回答了14个问题 |采纳率85.7%解题思路:(1)盐酸与氢氧化钠反应生成氯化钠和水;
(2)金属锌与稀硫酸反应生成氢气和硫酸锌;
(3)金属铁与硫酸铜溶液反应生成硫酸亚铁和铜;
(4)碳酸钙与盐酸反应生成氯化钙和二氧化碳;
(5)氯化铁溶液与氢氧化钠溶液反应生成氢氧化铁和氯化钠.(1)盐酸与氢氧化钠反应,化学方程式为:HCl+NaOH=NaCl+H2O;
故答案为:HCl+NaOH=NaCl+H2O;
(2)金属锌与稀硫酸反应,化学方程式为:Zn+H2SO4═ZnSO4+H2↑;
故答案为:Zn+H2SO4═ZnSO4+H2↑;
(3)金属铁与硫酸铜溶液反应,化学方程式:CuSO4+Fe=FeSO4+Cu;
故答案为:CuSO4+Fe=FeSO4+Cu;
(4)碳酸钙与盐酸反应,化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O;
故答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O;
(5)氯化铁溶液与氢氧化钠溶液反应,化学方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;
故答案为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl.点评:
本题考点: 化学方程式的书写.
考点点评: 本题考查了化学方程式的书写,题目难度不大,明确反应的实质是解题关键,注意沉淀、气体符合的标注.1年前查看全部
- 对于反应 1.氢氧化钠和盐酸 2.石灰水和二氧化碳 3.氧化钙和盐酸 4.金属铁和稀硫酸
对于反应 1.氢氧化钠和盐酸 2.石灰水和二氧化碳 3.氧化钙和盐酸 4.金属铁和稀硫酸
不论怎么改变反应物的用量,均可以用同一个离子方程式表示的是 神经唏兮1年前1
神经唏兮1年前1 -
 landenking 共回答了16个问题
landenking 共回答了16个问题 |采纳率87.5%答案应该是一和四,二中生成了碳酸钙后若二氧化碳过量便会生成碳酸氢钙,三中若盐酸中氯化氢反应完,氧化钙便会和水反应,四中稀硫酸再多也不会变成浓硫酸,所以是一和四1年前查看全部
- (2014•宝山区一模)以石灰石、赤铁矿为原料,进行金属铁的冶炼,各物质之间的转化关系如下图所示.
(2014•宝山区一模)以石灰石、赤铁矿为原料,进行金属铁的冶炼,各物质之间的转化关系如下图所示.

试回答:
Ⅰ.写出步骤①和③的化学方程式:①CaCO3
CaO+CO2↑高温 .CaCO3、③
CaO+CO2↑高温 .Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO.
2Fe+3CO2高温 .
Ⅱ.上述流程中可循环利用的物质是______(填物质名称).
Ⅲ.B中还含有未煅烧完的碳酸钙.检验方法Ⅰ:取样,______,证明B残渣中含有碳酸钙;检验方法Ⅱ:______,证明B残渣中含有碳酸钙. 乖玉妖妖1年前1
乖玉妖妖1年前1 -
 sdkfjhawkjrgeg 共回答了20个问题
sdkfjhawkjrgeg 共回答了20个问题 |采纳率70%解题思路:Ⅰ、石灰石高温分解生成氧化钙和二氧化碳,化学方程式为CaCO3
CaO+CO2↑;二氧化碳与碳反应生成一氧化碳,一氧化碳能与氧化铁反应生成铁和二氧化碳,故A为二氧化碳,B为氧化钙,C为一氧化碳,一氧化碳与氧化铁反应生成二氧化碳和铁,化学方程式为Fe2O3+3CO高温 .
2Fe+3CO2高温 .
Ⅱ、在整个过程中二氧化碳可循环利用.
Ⅲ、根据碳酸钙的化学性质分析,碳酸钙能与盐酸反应生成二氧化碳,还能高温分解生成二氧化碳.Ⅰ、石灰石高温分解生成氧化钙和二氧化碳,化学方程式为CaCO3
高温
.
CaO+CO2↑;二氧化碳与碳反应生成一氧化碳,一氧化碳能与氧化铁反应生成铁和二氧化碳,故A为二氧化碳,B为氧化钙,C为一氧化碳,一氧化碳与氧化铁反应生成二氧化碳和铁,化学方程式为Fe2O3+3CO
高温
.
2Fe+3CO2
Ⅱ、由上述分析可知二氧化碳可以循环利用.
Ⅲ、Ⅰ碳酸钙能与盐酸反应生成二氧化碳,因此检验B中还含有未煅烧完的碳酸钙可以取样品少量于试管,滴加稀盐酸,有气泡产生,证明B残渣中含有碳酸钙;Ⅱ、碳酸钙在高温条件下能分解生成氧化钙和二氧化碳,因此可取样,将样品称量:m1克,将样品高温煅烧,冷却后再称量:m2克,若m1>m2证明B残渣中含有碳酸钙.
故答案为:ⅠCaCO3
高温
.
CaO+CO2↑
Fe2O3+3CO
高温
.
2Fe+3CO2
Ⅱ二氧化碳
Ⅲ滴加稀盐酸,有气泡产生
取样,将样品称量:m1克,将样品高温煅烧,冷却后再称量:m2克,若m1>m2点评:
本题考点: 物质的相互转化和制备;证明碳酸盐;一氧化碳还原氧化铁;碳酸钙、生石灰、熟石灰之间的转化;书写化学方程式、文字表达式、电离方程式.
考点点评: 根据反应过程确定物质的成分及根据碳酸钙的性质确定检验方法是解答本题关键.1年前查看全部
- 金属铁,木炭,氧气,氧化钙,氧化铜,大理石(用于制备二氧化碳),稀盐酸,稀硫酸,Naoh溶液,氢氧化钙溶液,NaCI溶液
金属铁,木炭,氧气,氧化钙,氧化铜,大理石(用于制备二氧化碳),稀盐酸,稀硫酸,Naoh溶液,氢氧化钙溶液,NaCI溶液,硝酸银溶液,硫酸铜溶液,石蕊溶液
上述化学式中能与碳酸钠,二氧化碳,氧化钠反应的是?写出方程式,类别,实验现象,结论 painton1年前1
painton1年前1 -
 万里独行1979 共回答了8个问题
万里独行1979 共回答了8个问题 |采纳率87.5%分太少,懒得写1年前查看全部
- 右图中的A、B、C、D、E、F,分别表示石灰水、硫酸铜溶液、碳酸钠溶液、氯化钡溶液、盐酸和金属铁,它们之间的连线表明相邻
右图中的A、B、C、D、E、F,分别表示石灰水、硫酸铜溶液、碳酸钠溶液、氯化钡溶液、盐酸和金属铁,它们之间的连线表明相邻的两种物质能发生反应.试根据图中关系确定A、B、C、D、E、F各物质的化学式.
A______、B______、C______、D______、E______、F______.
 东海蛮夷1年前3
东海蛮夷1年前3 -
 genius_88888 共回答了19个问题
genius_88888 共回答了19个问题 |采纳率89.5%解题思路:图框中给出了物质之间的反应关系及转化关系,观察图框,总结图框中物质之间关系:F能和A、B、E、D四种物质反应,六种物质中,碳酸钠可以和硫酸铜、碳酸钙、盐酸、氯化钡四种物质反应,与铁不反应,可知F为碳酸钠溶液,C为铁;B可以和铁、碳酸钠和A三种物质反应,可知B为硫酸铜溶液,A为氯化钡溶液;铁和硫酸铜、D反应,可知D为盐酸;由上可知E为石灰水,代入验证即可.F能和A、B、E、D四种物质反应,六种物质中,碳酸钠可以和硫酸铜、碳酸钙、盐酸、氯化钡四种物质反应,与铁不反应,可知F为碳酸钠溶液,C为铁;B可以和铁、碳酸钠和A三种物质反应,可知B为硫酸铜溶液,A为氯化钡溶液;铁和硫酸铜、D反应,可知D为盐酸;由上可知E为石灰水,代入验证,符合题中转化关系;
所以A、B、C、D、E、F各物质的化学式为:A、BaCl2,B,CuSO4,C、Fe,D、HCl,E、Ca(OH)2,F、Na2CO3.
故答案为:A、BaCl2,B,CuSO4,C、Fe,D、HCl,E、Ca(OH)2,F、Na2CO3.点评:
本题考点: 物质的鉴别、推断;化学式的书写及意义.
考点点评: 本题属于图框推断题,解题时,认真观察图框,总结出物质之间的关系,与图框中物质之间关系相对应,可以首先推出F是碳酸钠,以此为突破口,利用物质之间的相互关系,即可将物质一一推出.1年前查看全部
- 实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华.下图是两个学生设计的实验装置、
实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华.下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示.试回答:

(1)B中反应的化学方程式为:4HCl(浓)+MnO2
MnCl2+Cl2 ↑+2H2O△ .4HCl(浓)+MnO2;
MnCl2+Cl2 ↑+2H2O△ .
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是:______.
(3)D中反应化学方程式为:2Fe+3Cl2
2FeCl3△ .2Fe+3Cl2.
2FeCl3△ .
(4)装置(Ⅰ)的主要缺点是:______.
(5)装置(Ⅱ)的主要缺点是:______.如果选用此装置来完成实验,则必须采取的改进措施是:______. 花631年前1
花631年前1 -
 夕阳天边 共回答了20个问题
夕阳天边 共回答了20个问题 |采纳率95%解题思路:(1)实验室用氯气和铁反应制取氯化铁,所以首先要制取氯气,一般常用浓盐酸和二氧化锰反应制取氯气;
(2)利用生成的氯气排出装置中的空气来分析;
(3)加热条件下,氯气和铁反应生成氯化铁;
(4)导管易被产品堵塞,有毒气体应该有尾气处理装置;
(5)尾气处理装置中有水,导致氯化铁易潮解.(1)实验室用氯气和铁反应制取氯化铁,所以首先必须制取氯气,实验室常用浓盐酸和二氧化锰加热制取氯气,加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,所以B中发生的化学反应是4HCl(浓)+MnO2
△
.
MnCl2+Cl2 ↑+2H2O,
故答案为:4HCl(浓)+MnO2
△
.
MnCl2+Cl2 ↑+2H2O;
(2)D中的反应开始前,需排除装置中的空气,防止氧气和铁反应生成铁的氧化物而产生杂质,所以D中的反应开始前,必须排除装置中的空气,其方法是B中的反应进行一段时间后,看到共绿色气体充满装置,再开始加热D,
故答案为:B中的反应进行一段时间后,看到共绿色气体充满装置,再开始加热D;
(3)加热条件下,铁和氯气反应生成氯化铁,反应方程式为2Fe+3Cl2
△
.
2FeCl3,故答案为:2Fe+3Cl2
△
.
2FeCl3;
(4)导气管口较小,D装置中的固体物质易堵塞导管口;氯气是有毒气体,不能直接排空,否则会污染环境,所以应该有一个尾气处理装置,
故答案为:导管易被产品堵塞,尾气排入空气,易造成环境污染;
(5)该装置中有尾气处理装置,但尾气处理装置中是水溶液,会导致E中有水蒸气,会导致氯化铁产品易潮解,所以为防止氯化铁潮解,在瓶E和F之间连接装有干燥剂的装置,
故答案为:产品易潮解;在瓶E和F之间连接装有干燥剂的装置.点评:
本题考点: 制备实验方案的设计;氯气的化学性质;氯气的实验室制法.
考点点评: 本题考查了制备实验方案中的有关知识,难度不大,注意加热时,无论铁是否过量,铁和氯气反应都生成氯化铁不是氯化亚铁.1年前查看全部
- 金属锌,一氧化碳,金属铁,铜,I-,S2-.硫化氢,碳,铝,Fe2+,Fe,Fe3+- 还原性怎么排
 rebecca9501年前1
rebecca9501年前1 -
 zengqingguo7961 共回答了20个问题
zengqingguo7961 共回答了20个问题 |采纳率95%强 S2- H2S I- C CO Al Zn Fe Fe2+ Cu Fe3+ 弱1年前查看全部
- 金属铁,木炭,氧气,氧化钙,氧化铜,大理石(用于制备二氧化碳),稀盐酸,稀硫酸,Naoh溶液,氢氧化钙溶液,NaCI溶液
金属铁,木炭,氧气,氧化钙,氧化铜,大理石(用于制备二氧化碳),稀盐酸,稀硫酸,Naoh溶液,氢氧化钙溶液,NaCI溶液,硝酸银溶液,硫酸铜溶液,石蕊溶液
上述化学式中能与碳酸钠,二氧化碳,氧化钠反应的是?写出方程式,类别,实验现象,结论 sptangbei1年前2
sptangbei1年前2 -
 chenglq 共回答了20个问题
chenglq 共回答了20个问题 |采纳率90%给我点时间做一下1年前查看全部
- 如图:X为单质硅,Y为金属铁,a为NaOH溶液,按图组装一个原电池,下列说法正确的是( ) A.X为负极,电极反应为:
如图:X为单质硅,Y为金属铁,a为NaOH溶液,按图组装一个原电池,下列说法正确的是( ) A.X为负极,电极反应为:Si-4e - ═Si 4+ B.X为正极,电极反应为:4H 2 O+4e - ═4OH - +2H 2 ↑ C.X为负极,电极反应为:Si+6OH - -4e - ═SiO 3 2- +3H 2 O D.Y为负极,电极反应为:Fe-2e - ═Fe 2+ 
 oo下士1年前1
oo下士1年前1 -
 逆风笑 共回答了24个问题
逆风笑 共回答了24个问题 |采纳率79.2%硅易失电子发生氧化反应而作负极,电极反应式为Si+6OH - -4e - ═SiO 3 2- +3H 2 O,铁作正极,正极上水得电子发生还原反应,电极反应式为4H 2 O+4e - ═4OH - +2H 2 ↑,
故选:C.1年前查看全部
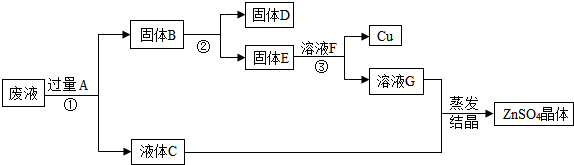
- 人类的生产生活离不开金属.(1)金属铁、铝常用来制作炊具,主要是利用其______性.(2)人类每年从自然界提取大量的金
人类的生产生活离不开金属.
(1)金属铁、铝常用来制作炊具,主要是利用其______性.
(2)人类每年从自然界提取大量的金属,其中提取量最大的是铁.赤铁矿(主要成分为fe 2 o 3 )和一氧化碳炼铁的化学方程式为______.
(3)***钢铁年产量很高,但因锈蚀造成的损失也很惊人.工业上常用稀盐酸除去铁锈,该反应的化学方程式为______.
(4)从含有cuso 4 、znso 4 、feso 4 的废水中回收重要原料硫酸锌和有关金属,实验过程如下.
请回答:
写出步骤①中发生反应的化学方程式______;固体d的化学式为______;以上物质a~g中,含有锌元素的是______(填字母序号) tjmuwzq1年前1
tjmuwzq1年前1 -
 heroine123 共回答了16个问题
heroine123 共回答了16个问题 |采纳率93.8%(1)作炊具,主要是利用金属的导热性.
(2)用赤铁矿(主要成分为Fe 2 O 3 )和一氧化碳炼铁的反应物是一氧化碳和氧化铁,写在等号的左边,生成物铁和二氧化碳写在等号的右边,根据得失氧进行配平,反应条件是高温写在等号的上边,所以化学方程式为:3CO+Fe 2 O 3
高温
.
2Fe+3CO 2 .
(3)盐酸除铁锈的反应物是盐酸和氧化铁写在等号的左边,生成物氯化铁和水写在等号的右边,用观察法配平即可,所以方程式是:6HCl+Fe 2 O 3 =2FeCl 3 +3H 2 O.
(4)根过量A是加入的锌,锌与硫酸亚铁反应生成铁和硫酸锌,所以方程式是:Zn+FeSO 4 ═Fe+ZnSO 4 ;锌与硫酸铜反应生成铜和硫酸锌,所以方程式是:Zn+CuSO 4 ═ZnSO 4 +Cu;由于锌与硫酸亚铁反应生成铁盒硫酸锌,锌与硫酸铜反应生成铜和硫酸锌,且加入的锌是过量的,所以固体B中含有锌、铁、铜;溶液C是硫酸锌溶液;固体B用磁铁把铁吸引出来,所以固体D是铁;固体E中含有锌和铜,由于锌能与硫酸反应,铜与硫酸不反应,所以加入的溶液F是稀硫酸,溶液G是硫酸锌溶液;所以含有锌元素的有ABCEG.
故答案为:(1)导热性; (2)3CO+Fe 2 O 3
高温
.
2Fe+3CO 2 ;(3)6HCl+Fe 2 O 3 =2FeCl 3 +3H 2 O;(4)Zn+FeSO 4 =Fe+ZnSO 4 ;Zn+CuSO 4 =ZnSO 4 +Cu;Fe;ABCEG.1年前查看全部
- 氢气的实验室制法1.药品及原理?2.从金属的角度,为什么不选择金属铁、镁或铝?3.从酸的角度,为什么不选择浓硫酸或浓盐酸
氢气的实验室制法
1.药品及原理?2.从金属的角度,为什么不选择金属铁、镁或铝?3.从酸的角度,为什么不选择浓硫酸或浓盐酸? Islamofascism1年前1
Islamofascism1年前1 -
 huanghunyue 共回答了19个问题
huanghunyue 共回答了19个问题 |采纳率89.5%1锌粉,稀盐酸 Zn+2HCl=ZnCl2+H2
2.镁铝,反应太快,铁易被氧化.锌虽然也被氧化了,但是影响很小,里面仍有大部分的锌存在.
3.浓硫酸浓盐酸.均太危险,操作有隐患.其次,浓盐酸易挥发,1年前查看全部
- (2014•历城区模拟)将一定质量的金属铁放入AgNO3与Zn(NO3)2的混合溶液中,充分反应后,过滤,向滤液中滴入稀
(2014•历城区模拟)将一定质量的金属铁放入AgNO3与Zn(NO3)2的混合溶液中,充分反应后,过滤,向滤液中滴入稀盐酸,有白色沉淀产生.则下列对滤渣和滤液的成分判断中,正确的是( )
A.滤渣中一定含有银和锌
B.滤渣中一定含有单质银、铁、锌
C.滤液中的溶质只有Fe(NO3)2
D.滤液中一定含有AgNO3、Fe(NO3)2和Zn(NO3)2 苦闷爱人1年前1
苦闷爱人1年前1 -
 carolotus 共回答了21个问题
carolotus 共回答了21个问题 |采纳率90.5%解题思路:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,利用此知识分析即可.在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,银离子遇氯离子能生成氯化银白色沉淀,说明滤液中含有硝酸银.在金属活动性顺序中,铁、银和锌的顺序为锌>铁>银,向AgNO3、Zn(NO3)2的混合溶液中加入一定量铁粉,铁能将银置换出来,所得固体中一定含有银,向滤液中滴入稀盐酸,有白色沉淀产生,说明滤液中含有硝酸银,故滤液中一定含有AgNO3、Fe(NO3)2和Zn(NO3)2;故答案选:D.
点评:
本题考点: 金属的化学性质.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 家里用的不锈钢(主要成分为金属铁)汤勺,常在手柄的上端加一木柄或塑料柄。这说明铁具有的物理性质是(
家里用的不锈钢(主要成分为金属铁)汤勺,常在手柄的上端加一木柄或塑料柄。这说明铁具有的物理性质是()
A.铁是电的良导体 B.铁的密度大 C.铁在空气中容易生锈 D.铁是热的良导体  子皓空间1年前1
子皓空间1年前1 -
 xgoogle 共回答了18个问题
xgoogle 共回答了18个问题 |采纳率100%D
1年前查看全部
- (2008•黔东南州)金属铁及其化合物之间有如下转化关系:
(2008•黔东南州)金属铁及其化合物之间有如下转化关系:

请回答下列问题:
(1)A是______;B是______;C是______.
(2)写出A→B或A→C的化学反应方程式(任选一个):______. 86911年前1
86911年前1 -
 幼迪 共回答了17个问题
幼迪 共回答了17个问题 |采纳率76.5%解题思路:(1)根据铁锈的主要成分、氧化铁与盐酸反应、与硫酸反应的生成物回答本题;(2)根据方程式的书写考虑.(1)铁锈主要成分是氧化铁,所以A是氧化铁,氧化铁与盐酸反应生成氯化铁和水,所以B是氯化铁;氧化铁与硫酸反应生成硫酸铁和水,所以C是硫酸铁;
(2)氧化铁与盐酸反应生成氯化铁和水,先配平铁,再配平盐酸、氢气,用观察法配平即可,所以方程式是Fe2O3+6HCl═2FeCl3+3H2O.
故答案为:(1)氧化铁;氯化铁;硫酸铁;(2)Fe2O3+6HCl═2FeCl3+3H2O.点评:
本题考点: 物质的相互转化和制备.
考点点评: 解答本题关键是要知道氧化铁与酸反应发生的是复分解反应,反应前后元素化合价不变.1年前查看全部
- 金属铝加入稀硫酸溶液的离子方程式 金属铁加入硫酸铜溶液的离子方程式 大理石加入醋酸溶液的离子方程式
金属铝加入稀硫酸溶液的离子方程式 金属铁加入硫酸铜溶液的离子方程式 大理石加入醋酸溶液的离子方程式
金属铝加入稀硫酸溶液的离子方程式
金属铁加入硫酸铜溶液的离子方程式
大理石加入醋酸溶液的离子方程式
硫酸铝溶液中加入氨水的离子方程式
外加这四个的化学方程式. 老rr1年前1
老rr1年前1 -
 Me小手冰凉 共回答了16个问题
Me小手冰凉 共回答了16个问题 |采纳率87.5%若有纸有笔就写给你.1年前查看全部
- 下列关于氧气性质和用途的说法错误的是( ) A.液氧具有助燃性 B.金属铁的锈蚀说明氧气有氧化性 C.用纯氧炼钢,可提
下列关于氧气性质和用途的说法错误的是( ) A.液氧具有助燃性 B.金属铁的锈蚀说明氧气有氧化性 C.用纯氧炼钢,可提高炉温 D.没有氧气不能燃烧,氧气是重要的燃料  tiantiabu1年前1
tiantiabu1年前1 -
 Management2076 共回答了19个问题
Management2076 共回答了19个问题 |采纳率100%A、氧气具有助燃性,正确;
B、铁在空气中锈蚀,实际上是铁跟空气中的氧气和水共同作用的结果,说明氧气有氧化性,正确;
C、氧气能支持燃烧,可用于炼钢工业,提高炉温,正确;
D、氧气具有助燃性,不具有可燃性,不能用作燃料,故错误;
故选D.1年前查看全部
- 如图,某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4,为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜
如图,某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4,为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜,设计如图流程.下列说法不正确的是( )

A. 固体b为铁
B. 操作①、②中玻璃棒的作用不同
C. 滤液a中含有3种溶质
D. 除污水外,含锌元素的有:固体a、b,滤液a、b 小白宝贝2121年前2
小白宝贝2121年前2 -
 pantom 共回答了15个问题
pantom 共回答了15个问题 |采纳率86.7%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸发生置换反应生成氢气,可以根据金属与酸的反应和金属与盐溶液的反应来进行固体的分离;
向污水中加入过量锌,锌和硫酸铜反应生成硫酸锌和铜,锌和硫酸亚铁反应生成硫酸锌和铁,过滤得到固体a,其中含有铜、铁和锌,滤液b是硫酸锌溶液;
向铜、铁和锌中加入过量稀硫酸,铜不能反应,铁和锌与稀硫酸反应分别生成硫酸亚铁和氢气、硫酸锌和氢气,过滤得到铜,滤液a中含有硫酸亚铁、硫酸锌和稀硫酸;
向滤液a中加入适量的锌,锌和硫酸亚铁反应生成硫酸锌和铁,和稀硫酸反应生成硫酸锌和氢气,过滤得到固体b--铁;
蒸发硫酸锌溶液可以得到硫酸锌固体.A、由流图可知固体b为铁,故A正确.
B、操作①中玻璃棒的作用是引流,②中玻璃棒的作用是搅拌.故B正确.
C、滤液a中含有硫酸亚铁、硫酸锌和硫酸3种溶质,故C正确.
D、固体a中含有锌,c是硫酸锌,滤液a中含有硫酸锌,b中含有硫酸锌.故D错误.
故选:D.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;蒸发与蒸馏操作;金属的化学性质.
考点点评: 根据金属的活动性,排在氢前面的金属都可把酸中的氢置换出来而得到氢气;活动性强的金属可把活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- 化学分析法的准确度和稳定性问题生产中需要大量的测试半成品,它的主配方是三种成特定比例的金属铁锰锌的氧化物(7:2:1),
化学分析法的准确度和稳定性问题
生产中需要大量的测试半成品,它的主配方是三种成特定比例的金属铁锰锌的氧化物(7:2:1),测试项目就是这三种氧化物的含量.根据最后成品的性能跟踪,三种氧化物含量每种都不能超过0.05%,请问一般的化学滴定法能否达到要求(要求快速测量)? 我么乃1年前1
我么乃1年前1 -
 2007nian9yue 共回答了21个问题
2007nian9yue 共回答了21个问题 |采纳率100%测试这个半成品的滴定法是国标方法还是非国标方法?一般的化学滴定都是靠人工做的,即使是同一个人做的,读数啊,显色上的都会有一定偏差,准确度和稳定性得不到保证.1年前查看全部
- 如图所示,X为单质硅,Y为金属铁,a为NaOH溶液,组装成一个原电池,下列说法中正确的是( )
如图所示,X为单质硅,Y为金属铁,a为NaOH溶液,组装成一个原电池,下列说法中正确的是( )

A.X为负极,电极反应为:Si-4e -  Si 4+
Si 4+ B.X为正极,电极反应为:4H 2 O+4e -  4OH - +2H 2 ↑
4OH - +2H 2 ↑C.X为负极,电极反应为:Si+6OH - -4e -  Si+3H 2 O
Si+3H 2 OD.Y为负极,电极反应为:Fe-2e -  Fe 2+
Fe 2+  小玉05141年前1
小玉05141年前1 -
 kaixian 共回答了21个问题
kaixian 共回答了21个问题 |采纳率95.2%1年前查看全部
- 1.将金属铁放入稀盐酸中 2.向氯化亚铁溶液通入氯气3.碳酸钠水解4.氯气通入水中 5.碳酸氢钙溶液与氢氧化钠溶液反应6
1.将金属铁放入稀盐酸中
2.向氯化亚铁溶液通入氯气
3.碳酸钠水解
4.氯气通入水中
5.碳酸氢钙溶液与氢氧化钠溶液反应
6.碳酸钙与醋酸反应
7.铜片与稀硝酸反应
8.将金属钠加入水中
9.三氯化铝溶液中加人过量氨水
10.次氯酸钙溶液中通入二氧化硫
11.硫酸亚铁酸性溶液中加双氧水
12.用氨水吸收少量二氧化硫
13.饱和石灰水跟稀硝酸反应 娃哈哈x21年前4
娃哈哈x21年前4 -
 whmmd 共回答了19个问题
whmmd 共回答了19个问题 |采纳率100%1.将金属铁放入稀盐酸中:Fe + 2HCl == FeCl2 + H2↑2.向氯化亚铁溶液通入氯气:Cl2 + 2FeCl2 == 2FeCl33.碳酸钠水解:CO3(2-) + H2O HCO3- + OH-4.氯气通入水中:Cl2 + H2O HCl + HClO5.碳酸氢钙溶液与氢氧化钠溶液反...1年前查看全部
- 下列说法正确的是( )A. 浓硫酸、浓硝酸、稀硝酸都是氧化性酸,常温下都能使金属铁钝化B. 浓硫酸与蔗糖混合搅拌产生刺
下列说法正确的是( )
A. 浓硫酸、浓硝酸、稀硝酸都是氧化性酸,常温下都能使金属铁钝化
B. 浓硫酸与蔗糖混合搅拌产生刺激性气味气体,此过程只体现了浓硫酸的脱水性
C. 某溶液中加盐酸产生使澄清石灰水变浑浊的气体,说明该溶液中一定含CO32-或SO32-
D. 某溶液中滴加BaCl2.溶液产生不溶于稀硝酸的白色沉淀,不能说明该溶液中一定含SO42- 不要再自卑1年前1
不要再自卑1年前1 -
 qq的海洋 共回答了27个问题
qq的海洋 共回答了27个问题 |采纳率88.9%解题思路:A.稀硝酸不具有使金属钝化的性质;
B.刺激性气体为二氧化硫,体现了浓硫酸的强氧化性;
C.还可能含有HCO3-或HSO3-;
D.可能生成AgCl沉淀.A.浓硫酸和浓硝酸具有使金属钝化的性质,但稀硝酸不具有使金属钝化的性质,故A错误;
B.浓硫酸具有脱水性,可使蔗糖脱水生成碳,碳和浓硫酸发生氧化还原反应生成具有刺激性气味的二氧化硫,故B错误;
C.溶液中加盐酸产生使澄清石灰水变浑浊的气体,可能为二氧化碳或二氧化硫,溶液中可能含CO32-或SO32-,还可能含有HCO3-或HSO3-,故C错误;
D.可能生成AgCl沉淀,应先加盐酸,如无现象,再加入氯化钡,如生成沉淀,说明含有SO42-,故D正确.
故选D.点评:
本题考点: 浓硫酸的性质;常见离子的检验方法;硝酸的化学性质.
考点点评: 本题综合考查硝酸、硫酸以及离子的检验,侧重于学生的分析能力、实验能力和元素化合物知识的综合运用的考查,为高考常见题型,注意相关基础知识的积累与学习,难度中等.1年前查看全部
- 科学初二为什么将金属铁放到稀盐酸溶液中,反应后的溶液质量将?要区别稀盐酸和稀硫酸最好用哪种?稀盐酸加入下面ph几乎不变的
科学初二为什么
将金属铁放到稀盐酸溶液中,反应后的溶液质量将?要区别稀盐酸和稀硫酸最好用哪种?稀盐酸加入下面ph几乎不变的是?A.AgNO3 溶液 B.CACO3固体 .C.KOH溶液 D.生石灰 有一无色溶液,向其中加入氯化钡溶液有白色沉淀生成,此沉淀不溶于稀盐酸,则溶液中一定有大量?
不能用金属跟酸直接反应得到物质是?A氯化铁 B氯化亚铁 C氯化锌 D 烧碱 高成1年前1
高成1年前1 -
 miss_候鸟 共回答了15个问题
miss_候鸟 共回答了15个问题 |采纳率100%变重,cuo,d,so4+1年前查看全部
- 下列有15种物质①氯化钠 ②氧化钙 ③碳酸钠 ④金属钠 ⑤氧气 ⑥氢气 ⑦氢氧化钠 ⑧硫酸 ⑨金属铁 ⑩硫单质 11液溴
下列有15种物质
①氯化钠 ②氧化钙 ③碳酸钠 ④金属钠 ⑤氧气 ⑥氢气 ⑦氢氧化钠 ⑧硫酸 ⑨金属铁 ⑩硫单质 11液溴 12二氧化碳 13硝酸钾 14氨气 15二氧化硅
按溶解性分类
微溶于水:
易溶于水:
不溶于水: saer891年前2
saer891年前2 -
 linyingisme 共回答了18个问题
linyingisme 共回答了18个问题 |采纳率83.3%微溶于水:氧化钙,二氧化碳,
易溶于水:氯化钠,碳酸钠,氢氧化钠 ,硫酸,液溴,硝酸钾,氨气,金属钠
不溶于水:氧气,氢气,金属铁,硫单质 ,二氧化硅1年前查看全部
- 人类的生产生活离不开金属.(1)金属铁、铝常用来制作炊具,主要是利用其______性.(2)人类每年从自然界提取大量的金
人类的生产生活离不开金属.
(1)金属铁、铝常用来制作炊具,主要是利用其______性.
(2)人类每年从自然界提取大量的金属,其中提取量最大的是铁.赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.
2Fe+3CO2高温 .
(3)从含有CuSO4、ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属,实验过程如图.请回答:写出步骤①中发生反应的化学方程式______;固体D的化学式为______;以上物质A~G中,含有锌元素的
是______(填字母序号) hldlizhen1年前1
hldlizhen1年前1 -
 maxterm 共回答了17个问题
maxterm 共回答了17个问题 |采纳率70.6%解题思路:(1)根据金属性质的应用解答;
(2)根据金属铁的冶炼原理方程式解答;
(3)根据题中的信息,推导出反应物和生产物,正确书写化学方程式.根据加入的过量锌与硫酸铜和硫酸亚铁反应,得到的固体B中含有铁、铜、锌,再利用磁铁分离开铁,再利用硫酸把铜和锌分开,再进一步进行分析即可.(1)作炊具,主要是利用金属的导热性.
(2)用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的反应物是一氧化碳和氧化铁,写在等号的左边,生成物铁和二氧化碳写在等号的右边,根据得失氧进行配平,反应条件是高温写在等号的上边,所以化学方程式为:3CO+Fe2O3
高温
.
2Fe+3CO2.
(3)根过量A是加入的锌,锌与硫酸亚铁反应生成铁和硫酸锌,所以方程式是:Zn+FeSO4═Fe+ZnSO4;锌与硫酸铜反应生成铜和硫酸锌,所以方程式是:Zn+CuSO4═ZnSO4+Cu;由于锌与硫酸亚铁反应生成铁和硫酸锌,锌与硫酸铜反应生成铜和硫酸锌,且加入的锌是过量的,所以固体B中含有锌、铁、铜;溶液C是硫酸锌溶液;固体B用磁铁把铁吸引出来,所以固体D是铁;固体E中含有锌和铜,由于锌能与硫酸反应,铜与硫酸不反应,所以加入的溶液F是稀硫酸,溶液G是硫酸锌溶液;所以含有锌元素的有ABCEG.
故答案为:(1)导热性; (2)3CO+Fe2O3
高温
.
2Fe+3CO2;(3)Zn+FeSO4=Fe+ZnSO4 ;Zn+CuSO4=ZnSO4+Cu;Fe;ABCEG.点评:
本题考点: 金属的物理性质及用途;金属的化学性质;铁的冶炼;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题要熟练掌握金属铁的性质、冶炼以及金属活动顺序等知识,培养学生对知识的概括和总结能力.1年前查看全部
- 在①金属铁②氯化铵③硝酸钾④单质碘⑤二氧化硅⑥烧碱⑦盐酸⑧氯化钙中电解质有__非电解质有__
 6217H1年前1
6217H1年前1 -
 xclover 共回答了20个问题
xclover 共回答了20个问题 |采纳率85%电解质:2368
非电解质:5
剩余147 既不是电解质也不是非电解质.
电解质和非电解质前提是化合物.1年前查看全部
- 耐高温粘合剂多少钱用于金属铁,钢,铝,陶瓷,玻璃等表面,最高可耐温度:1500℃
 玉版1年前1
玉版1年前1 -
 ll0701 共回答了19个问题
ll0701 共回答了19个问题 |采纳率94.7%大约每公斤350元左右.(依据使用环境、要求的不同价格和品种均有差异)1年前查看全部
- 某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4,为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜,设计
某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4,为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜,设计如图所示流程.

下列说法不正确的是( )
A.固体b为铁
B.操作①、②中玻璃棒的作用不同
C.滤液a中含有3种溶质
D.除污水外,含锌元素的有:固体a、b,滤液a、b 因为9411年前1
因为9411年前1 -
 tammu 共回答了15个问题
tammu 共回答了15个问题 |采纳率86.7%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸发生置换反应生成氢气,可以根据金属与酸的反应和金属与盐溶液的反应来进行固体的分离;向污水中加入过量锌,锌和硫酸铜反应生成硫酸锌和铜,锌和硫酸亚铁反应生成硫酸锌和铁,过滤得到固体a,其中含有铜、铁和锌,滤液b是硫酸锌溶液;向铜、铁和锌中加入过量稀硫酸,铜不能反应,铁和锌与稀硫酸反应分别生成硫酸亚铁和氢气、硫酸锌和氢气,过滤得到铜,滤液a中含有硫酸亚铁、硫酸锌和稀硫酸;向滤液a中加入适量的锌,锌和硫酸亚铁反应生成硫酸锌和铁,和稀硫酸反应生成硫酸锌和氢气,过滤得到固体b--铁;蒸发硫酸锌溶液可以得到硫酸锌固体.A、由流图可知固体b为铁,故A正确.
B、操作①中玻璃棒的作用是引流,②中玻璃棒的作用是搅拌.故B正确.
C、滤液a中含有硫酸亚铁、硫酸锌和硫酸3种溶质,故C正确.
D、固体a中含有锌,c是硫酸锌,滤液a中含有硫酸锌,b中含有硫酸锌.故D错误.
故选:D.点评:
本题考点: 金属的化学性质;过滤的原理、方法及其应用;蒸发与蒸馏操作.
考点点评: 根据金属的活动性,排在氢前面的金属都可把酸中的氢置换出来而得到氢气;活动性强的金属可把活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- 把铁的矿物变成金属铁的过程,叫做铁的冶炼.炼铁的主要原料是______、______和石灰石.炼铁的主要设备是高炉,在高
把铁的矿物变成金属铁的过程,叫做铁的冶炼.炼铁的主要原料是______、______和石灰石.炼铁的主要设备是高炉,在高炉内发生的主要反应的化学方程式为Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO.
2Fe+3CO2高温 . 恋林羁鸟1年前1
恋林羁鸟1年前1 -
 kk 共回答了18个问题
kk 共回答了18个问题 |采纳率88.9%解题思路:根据炼铁的主要原料、在高炉内用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,据此进行分析解答.工业炼铁在高炉中进行,主要原料有:铁矿石、焦炭和石灰石,焦炭在过量空气中生成二氧化碳,同时放出大量热,二氧化碳又在焦炭的作用下生成一氧化碳,一氧化碳把铁从铁矿石中还原出来,从而制得铁.
在高炉内用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO
高温
.
2Fe+3CO2.
故答案为:铁矿石、焦炭,Fe2O3+3CO
高温
.
2Fe+3CO2.点评:
本题考点: 铁的冶炼;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握炼铁的主要原料和原理、化学方程式的书写方法是正确解答本题的关键.1年前查看全部
- 将金属铁放到稀盐酸中,反应后溶液质量( )A.增加 B.减少 C.不变 D.无法确定
将金属铁放到稀盐酸中,反应后溶液质量( )A.增加 B.减少 C.不变 D.无法确定
麻烦 说明一下为什么 douglas11281年前2
douglas11281年前2 -
 二锅头泡的茶 共回答了18个问题
二锅头泡的茶 共回答了18个问题 |采纳率88.9%A增加 Fe+2Hcl=Fecl2+H2
在原来的溶液中溶质只有盐酸(氯化氢)而反应后的溶液中溶质是氯化亚铁其相对原子质量比盐酸大,而由于原子守恒原理,有1摩尔的盐酸就能生成0.5摩尔的氯化亚铁.在比较质量可以很明显的得到溶液质量增加.如果你是初中生不懂摩尔,可以参照相对原子质量的计算得到溶质增加1年前查看全部
- Fe是地壳中含量很丰富的元素,也是生物体所必需的元素.自然界中铁矿石主要有赤铁矿和磁铁矿,金属铁是在高炉中冶炼的,高炉炼
Fe是地壳中含量很丰富的元素,也是生物体所必需的元素.自然界中铁矿石主要有赤铁矿和磁铁矿,金属铁是在高炉中冶炼的,高炉炼铁除了加入铁矿石外,还需加入焦炭和石灰石.请填空:
①写出磁铁矿主要成分的化学式:______.
②写出赤铁矿被还原成铁的化学方式:Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO.
2Fe+3CO2高温 .
③写出焦炭在高炉中参与反应的两个化学方式:C+O2
CO2,CO2+C点燃 .
2CO高温 .C+O2.
CO2,CO2+C点燃 .
2CO高温 .
④写出CaCO3所参与反应的两个化学方程式:CaCO3
CaO+CO2高温 .CaCO3,
CaO+CO2高温 .CaO+SiO2
CaSiO3高温 .CaO+SiO2.
CaSiO3高温 . yufangde1年前1
yufangde1年前1 -
 虫子骑士 共回答了24个问题
虫子骑士 共回答了24个问题 |采纳率91.7%解题思路:①根据磁铁矿的有关知识;
②在炼铁高炉中一氧化碳能与氧化铁反应生成铁和二氧化碳;
③碳与足量氧气反应生成二氧化碳,二氧化碳和碳在高温下反应生成一氧化碳;
④煅烧石灰石生成氧化钙和二氧化碳,氧化钙能与二氧化硅反应形成炉渣.①磁铁矿的主要成分为Fe3O4,故答案为:Fe3O4;
②因一氧化碳能与氧化铁反应生成铁和二氧化碳,反应的方程式为Fe2O3+3CO
高温
.
2Fe+3CO2,
故答案为:Fe2O3+3CO
高温
.
2Fe+3CO2;
③碳与足量氧气反应生成二氧化碳,二氧化碳和碳在高温下反应生成一氧化碳,故答案为:C+O2
点燃
.
CO2,CO2+C
高温
.
2CO;
④石灰石的作用是形成炉渣,CaCO3所参与反应的两个化学方程式为:CaCO3
高温
.
CaO+CO2↑;CaO+SiO2
高温
.
CaSiO3,
故答案为:CaCO3
高温
.
CaO+CO2↑;CaO+SiO2
高温
.
CaSiO3.点评:
本题考点: 高炉炼铁.
考点点评: 本题考查了铁的冶炼的知识,完成此题,可以依据已有的知识进行解答,题目比较简单.1年前查看全部
- 写出分类类别的依据 类别1:金属铁,金属锌,木炭,CuO,CaCO3 类别2:H2SO4,NaOH,Ba(OH)2,Na
写出分类类别的依据 类别1:金属铁,金属锌,木炭,CuO,CaCO3 类别2:H2SO4,NaOH,Ba(OH)2,NaCl,CuSO4
 蓝蓝的苹果1年前1
蓝蓝的苹果1年前1 -
 南方丙丁火 共回答了15个问题
南方丙丁火 共回答了15个问题 |采纳率86.7%分类类别的依据,为物质是否易溶于水.
类别一的物质均难溶于水,类别二的物质均易溶于水.1年前查看全部
- Fe是地壳中含量很丰富的元素,也是生物体所必需的元素.自然界中的铁矿石主要有赤铁矿和磁铁矿,金属铁是在高炉中冶炼的,高炉
Fe是地壳中含量很丰富的元素,也是生物体所必需的元素.自然界中的铁矿石主要有赤铁矿和磁铁矿,金属铁是在高炉中冶炼的,高炉炼铁除了加入铁矿石外,还需加入焦炭和石灰石.请填空:
①写出磁铁矿主要成分的化学式:______.
②写出赤铁矿被还原成铁的化学方程式:______.
③写出CaCO 3 所参与反应的两个化学方程式:______,______. shuimuxiyan1年前1
shuimuxiyan1年前1 -
 白sё聖誕 共回答了20个问题
白sё聖誕 共回答了20个问题 |采纳率85%①磁铁矿的主要成分为Fe 3 O 4 ,故答案为:Fe 3 O 4 ;
②因一氧化碳能与氧化铁反应生成铁和二氧化碳,反应的方程式为Fe 2 O 3 +3CO
高温
.
2Fe+3CO 2 ,
故答案为:Fe 2 O 3 +3CO
高温
.
2Fe+3CO 2
③石灰石的作用是形成炉渣,CaCO 3 所参与反应的两个化学方程式为:CaCO 3
高温
.
CaO+CO 2 ↑;CaO+SiO 2
高温
.
CaSiO 3
故答案为:CaCO 3
高温
.
CaO+CO 2 ↑;CaO+SiO 2
高温
.
CaSiO 31年前
51年前查看全部
- 下列酸与金属铁发生反应,硫元素或氮元素的化合价不发生变化的是() A浓硫酸B稀硝酸C浓硝酸D稀硫酸 选什么?为什么?
 画罗裙1年前6
画罗裙1年前6 -
 阳关三叠H 共回答了3个问题
阳关三叠H 共回答了3个问题 |采纳率100%选c,因为浓硫酸和浓硝酸都和铁发生钝化,稀硫酸与铁不反因1年前查看全部
- 如图,某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4,为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜
如图,某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4,为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜,设计如图流程.下列说法不正确的是( )

A. 固体b为铁
B. 操作①、②中玻璃棒的作用不同
C. 滤液a中含有3种溶质
D. 除污水外,含锌元素的有:固体a、b,滤液a、b ananyyllj1年前1
ananyyllj1年前1 -
 紫伊表妹 共回答了24个问题
紫伊表妹 共回答了24个问题 |采纳率75%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,氢前的金属能与酸发生置换反应生成氢气,可以根据金属与酸的反应和金属与盐溶液的反应来进行固体的分离;
向污水中加入过量锌,锌和硫酸铜反应生成硫酸锌和铜,锌和硫酸亚铁反应生成硫酸锌和铁,过滤得到固体a,其中含有铜、铁和锌,滤液b是硫酸锌溶液;
向铜、铁和锌中加入过量稀硫酸,铜不能反应,铁和锌与稀硫酸反应分别生成硫酸亚铁和氢气、硫酸锌和氢气,过滤得到铜,滤液a中含有硫酸亚铁、硫酸锌和稀硫酸;
向滤液a中加入适量的锌,锌和硫酸亚铁反应生成硫酸锌和铁,和稀硫酸反应生成硫酸锌和氢气,过滤得到固体b--铁;
蒸发硫酸锌溶液可以得到硫酸锌固体.A、由流图可知固体b为铁,故A正确.
B、操作①中玻璃棒的作用是引流,②中玻璃棒的作用是搅拌.故B正确.
C、滤液a中含有硫酸亚铁、硫酸锌和硫酸3种溶质,故C正确.
D、固体a中含有锌,c是硫酸锌,滤液a中含有硫酸锌,b中含有硫酸锌.故D错误.
故选:D.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;蒸发与蒸馏操作;金属的化学性质.
考点点评: 根据金属的活动性,排在氢前面的金属都可把酸中的氢置换出来而得到氢气;活动性强的金属可把活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- 化学金属铁铜铝【急】以上三种物质,颜色和状态光泽?硬度?密度?导电性?导热性?
 飞奔的雄性猪1年前2
飞奔的雄性猪1年前2 -
 lxpdog 共回答了19个问题
lxpdog 共回答了19个问题 |采纳率73.7%金属 铁 铜 铝
1颜色 白 紫红 白
2硬度 铁>铜>铝
3密度 铜>铁大于铝
4导电性 铜>铝> 铁
5导热性 铜>铝> 铁1年前查看全部
- 二氧化氯和金属铁的反应式怎么写?都有哪些反应!据了解二氧化氯在水里可分解成好多强氧化剂的.
 uu菜鸟1231年前1
uu菜鸟1231年前1 -
 unique守护 共回答了16个问题
unique守护 共回答了16个问题 |采纳率100%Cl2O+Fe=Fe3++Cl1-+O21年前查看全部
- 金属铁与硫酸溶液反应后所得溶液的质量比原溶液的质量增大吗 为什么
 lovezhanglei1191年前1
lovezhanglei1191年前1 -
 mengso888 共回答了13个问题
mengso888 共回答了13个问题 |采纳率84.6%是,因为H2SO4中的H元素被Fe置换了1年前查看全部
- 实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华.下图是两个学生设计的实验装置、
实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华.下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示.试回答:

(1)B中反应的化学方程式为:______;
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是:______.
(3)D中反应化学方程式为:______.
(4)装置(Ⅰ)的主要缺点是:______.
(5)装置(Ⅱ)的主要缺点是:______.如果选用此装置来完成实验,则必须采取的改进措施是:______. 俯视姚明1年前1
俯视姚明1年前1 -
 紫竹71 共回答了12个问题
紫竹71 共回答了12个问题 |采纳率100%解题思路:(1)实验室用氯气和铁反应制取氯化铁,所以首先要制取氯气,一般常用浓盐酸和二氧化锰反应制取氯气;
(2)利用生成的氯气排出装置中的空气来分析;
(3)加热条件下,氯气和铁反应生成氯化铁;
(4)导管易被产品堵塞,有毒气体应该有尾气处理装置;
(5)尾气处理装置中有水,导致氯化铁易潮解.(1)实验室用氯气和铁反应制取氯化铁,所以首先必须制取氯气,实验室常用浓盐酸和二氧化锰加热制取氯气,加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,所以B中发生的化学反应是4HCl(浓)+MnO2
△
.
MnCl2+Cl2 ↑+2H2O,
故答案为:4HCl(浓)+MnO2
△
.
MnCl2+Cl2 ↑+2H2O;
(2)D中的反应开始前,需排除装置中的空气,防止氧气和铁反应生成铁的氧化物而产生杂质,所以D中的反应开始前,必须排除装置中的空气,其方法是B中的反应进行一段时间后,看到共绿色气体充满装置,再开始加热D,
故答案为:B中的反应进行一段时间后,看到共绿色气体充满装置,再开始加热D;
(3)加热条件下,铁和氯气反应生成氯化铁,反应方程式为2Fe+3Cl2
△
.
2FeCl3,故答案为:2Fe+3Cl2
△
.
2FeCl3;
(4)导气管口较小,D装置中的固体物质易堵塞导管口;氯气是有毒气体,不能直接排空,否则会污染环境,所以应该有一个尾气处理装置,
故答案为:导管易被产品堵塞,尾气排入空气,易造成环境污染;
(5)该装置中有尾气处理装置,但尾气处理装置中是水溶液,会导致E中有水蒸气,会导致氯化铁产品易潮解,所以为防止氯化铁潮解,在瓶E和F之间连接装有干燥剂的装置,
故答案为:产品易潮解;在瓶E和F之间连接装有干燥剂的装置.点评:
本题考点: 制备实验方案的设计;氯气的化学性质;氯气的实验室制法.
考点点评: 本题考查了制备实验方案中的有关知识,难度不大,注意加热时,无论铁是否过量,铁和氯气反应都生成氯化铁不是氯化亚铁.1年前查看全部
- 盐酸与金属铁反应盐酸与铁反应的化学式与CuO反应与NaOH与AgNO3(这个是盐)麻烦也顺便写下反应型类
 maobo99201年前1
maobo99201年前1 -
 SMARTMANS 共回答了14个问题
SMARTMANS 共回答了14个问题 |采纳率100%2HCl+Fe=FeCl2+H2(箭头向上) 置换反应
2HCl+CuO=CuCl2+H2O 复分解反应
HCl+NaOH=NaCl+H2O 复分解反应
HCl+AgNO3=AgCl(箭头向下)+HNO3 复分解反应1年前查看全部
- “酸的性质”实验盐酸与金属铁.锌反应后发生的现象.盐酸与氧化铜粉末反应后的现象.
 sneozt1年前1
sneozt1年前1 -
 jnby1004 共回答了20个问题
jnby1004 共回答了20个问题 |采纳率95%现象:
固体溶解,有气泡生成.
第二个:
现象:
黑色固体溶解(氧化铜黑色),溶液变蓝(生成的CuCl2是蓝色的)
这是很标准的回答了 我们化学老师每天都强调的1年前查看全部
大家在问
- 1sina*cosa=1/2则下列结论成立的是.sina=二分之根号二 sina+cosa=1 sina-cosa=0
- 2【急】已知sinA*cosA大于0,sinA*tanA小于0,在以下四个命题中正确的是
- 3给出下列命题,正确的是:1)存在一个锐角a,使sina=cosa
- 4带肠的成语有哪些成语
- 5肠字开头的成语
- 6带肠的成语有哪些
- 7金属铁 镁 铝都怎么制得?
- 8光速为什么是不可超越的?爱因斯坦有根据吗?
- 9354万用英语怎么拼
- 10下列四个命题中可能成立的一个是( )
- 11一着不慎下一句
- 12填上双句成语的另半句 1失之毫厘,( ) 2四体不勤,( ) 3一着不慎,( )
- 13“含氟牙膏”中的氟应理解为?“含氟牙膏”中的氟应理解为?一,单质二,元素三,离子
- 14金属最高价氧化物是不是就是所对应的碱
- 15什么物质由原子构成?什么物质由原子构成?理由!
