金属铬能与氢氟酸反应吗?可否做玻璃对氢氟酸的保护层
 752302022-10-04 11:39:541条回答
752302022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 jmw74417 共回答了14个问题
jmw74417 共回答了14个问题 |采纳率100%- 应该不会反应,氢氟酸是弱酸
铬不久就会脱落,不耐用. - 1年前
相关推荐
- 下列拟采用的金属防腐措施,不正确的是 A.给金属衣架或电线外面包上一层塑料层 B.给自行车钢圈镀上一层金属铬
下列拟采用的金属防腐措施,不正确的是
A.给金属衣架或电线外面包上一层塑料层 B.给自行车钢圈镀上一层金属铬 C.在铁船身上镶嵌金属铜 D.给铁栅栏表面涂上一层油漆  xkw亚子1年前1
xkw亚子1年前1 -
 brother01 共回答了19个问题
brother01 共回答了19个问题 |采纳率84.2%C
1年前查看全部
- (2012•宝坻区二模)铬是人体必需的一种微量元素,但铬过量摄入对人体危害非常大.铬的毒性与其存在形式有关,金属铬毒性最
(2012•宝坻区二模)铬是人体必需的一种微量元素,但铬过量摄入对人体危害非常大.铬的毒性与其存在形式有关,金属铬毒性最小,二价铬和三价铬的毒性其次,六价铬毒性最大.河北、浙江等多地不法厂家生产的“毒胶囊”中主要含有毒性最大的铬元素,其化学成分可能是( )
A.CrCl2
B.K2CrO4
C.Cr2O3
D.Cr(OH)3 ning03031年前1
ning03031年前1 -
 yyp1 共回答了16个问题
yyp1 共回答了16个问题 |采纳率100%解题思路:根据在化合物中正负化合价代数和为零,结合各选项中的化学式进行解答本题.A、氯元素显-1价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-1)×2=0,则w=+2价.
B、钾元素显+1价,氧元素显-2价,设铬元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:(+1)×2+y+(-2)×4=0,则y=+6价.
C、氧元素显-2价,设铬元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:2z+(-2)×3=0,则z=+3价.
D、氢氧根显-1价,设铬元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:z+(-1)×3=0,则x=+3价.
故含有六价铬的是K2CrO4.
故选B.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法即可正确解答.1年前查看全部
- (2013•天河区一模)(1)金属铬(Cr)可以形成碱[Cr(OH)3]和化合价为+3的绿色的氧化物,该氧化物的化学式是
(2013•天河区一模)(1)金属铬(Cr)可以形成碱[Cr(OH)3]和化合价为+3的绿色的氧化物,该氧化物的化学式是______,
Cr(OH)3与足量稀硫酸发生中和反应的化学方程式是______,反应后得到的溶液呈绿色,使溶液呈绿色的离子的符号是______.
(2)CrO3是一种橙红色固体,可用于检测司机是否酒后驾车.将CrO3加热分解,发现固体逐渐变绿,同时产生一种能使带火星木条复燃的气体,其反应的化学方程式是4CrO3
2Cr2O3+3O2↑△ .4CrO3.
2Cr2O3+3O2↑△ . mnemosyne61年前1
mnemosyne61年前1 -
 兴tt豆腐 共回答了20个问题
兴tt豆腐 共回答了20个问题 |采纳率85%解题思路:(1)化合物化学式的书写一般规律:先读后写,后读先写;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零;
(2)根据题中信息结合化学方程式的书写分析.(1)铬元素显+3价,氧元素显-2价,根据化学式的书写的一般规律可知,铬元素与氧元素形成氧化物的化学式为CrO3;Cr(OH)3与足量稀硫酸发生中和反应的化学方程式是2Cr(OH)3+3H2SO4═Cr2(SO4)3+3H2O;反应后得到的溶液呈绿色,使溶液呈绿色的离子是铬离子,其离子符号是Cr3+;
(2)根据信息“将CrO3加热分解,发现固体逐渐变绿,同时产生一种能使带火星木条复燃的气体”可知,CrO3加热分解生成了Cr2O3和氧气,其反应的化学方程式是4CrO3
△
.
2Cr2O3+3O2↑.
故答案为:(1)Cr2O3;2Cr(OH)3+3H2SO4═Cr2(SO4)3+3H2O;Cr3+;(2)4CrO3
△
.
2Cr2O3+3O2↑.点评:
本题考点: 化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,主要考查根据题中信息结合已学知识进行解决问题的能力.1年前查看全部
- 146.金属铬(Cr)是一种重要的金属材料,它具有良好的光泽度和抗腐蚀性,常用来镀在 其它金属的表面上.小明同学为了探究
146.金属铬(Cr)是一种重要的金属材料,它具有良好的光泽度和抗腐蚀性,常用来镀在 其它金属的表面上.小明同学为了探究铬的性质,把金属铬放入硫酸铜溶液中,发现铬表面有红色物质生成.由此他可得出的结论是 ( ) A.铬比铜活泼 B.铬一定能与稀硫酸反应制得氢气 C.铜比铬活泼 D.铬与铜都不能与稀硫酸反应制得氢气
 爱情不是屁1年前1
爱情不是屁1年前1 -
 枯眼到天明 共回答了19个问题
枯眼到天明 共回答了19个问题 |采纳率94.7%A,仅凭铬能置换出铜只能知道铬比铜活泼,但还不足以知道铬相对于H+的金属活动性,所以不能判断能否置换出氢气.1年前查看全部
- 下列拟采用的金属防腐措施,错误的是 A.给金属衣架或电线外面包上一层塑料层 B.给自行车钢圈镀上一层金属铬 C.在轮船的
下列拟采用的金属防腐措施,错误的是
A.给金属衣架或电线外面包上一层塑料层 B.给自行车钢圈镀上一层金属铬 C.在轮船的外表面焊上一些铜块 D.给铁栅栏表面涂上一层油漆  king-Wjb1年前1
king-Wjb1年前1 -
 SmartSha 共回答了20个问题
SmartSha 共回答了20个问题 |采纳率95%C
1年前查看全部
- 下列关于铁制品保护措施的说法中不正确的有( ) A.在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油 B.在海轮的
下列关于铁制品保护措施的说法中不正确的有( ) A.在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油 B.在海轮的外壳上常焊有锌块,且定期更新 C.相同条件下,马口铁(表层镀锡)与白铁(表层镀锌)相比,马口铁更为耐用 D.将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理  Hollymood1年前1
Hollymood1年前1 -
 纽扣123 共回答了18个问题
纽扣123 共回答了18个问题 |采纳率94.4%A.在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油,阻止了铁与氧气和水接触,所以能防止铁被腐蚀,故A不符合;
B.在海轮的外壳上常焊有锌块,且定期更新,铁、锌和海水构成原电池且铁作负极材料,所以能阻止铁被腐蚀,故B不符合;
C.相同条件下,马口铁中的铁作原电池负极,加快铁被腐蚀,白铁中的铁作原电池正极,能防止铁被腐蚀,所以白铁更为耐用,故C符合;
D.将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理,阻止了铁与氧气和水接触,所以能防止铁被腐蚀,故D不符合;
故选C.1年前查看全部
- 某化学兴趣小组的同学在探究金属铬(Cr)、铁、铜的活动性强弱,请你一同参与. 试管1 试管2 试管3 实验操作
某化学兴趣小组的同学在探究金属铬(Cr)、铁、铜的活动性强弱,请你一同参与.
【作出猜想】试管1 试管2 试管3 实验操作 


实验现象 铁片表面产生气泡较慢溶液变为
______色铬片表面产生气泡较快溶液变为蓝色
______
猜想一:Cr>Fe>Cu;
猜想二:Fe>Cu>Cr;
猜想三:你的猜想是______;
【查阅资料】
(1)铬是银白色,有金属光泽,在空气中其表面能生成抗腐蚀的致密氧化膜;
(2)铬能与稀硫酸反应,生成蓝色的硫酸铬(CrSO4)溶液.
【设计与实验】小聪取大小相等的三块金属片,用砂纸打磨光亮;再取三支试管,分别加入等量的同种稀硫酸,实验操作如图:①______;②______;
【结论与解释】
(1)小聪等到的结论是猜想______正确;
(2)实验前用砂纸打磨金属片的目的是______.
【知识运用】
将铬片投入FeS04溶液中,反应______(填“能”或“不能”)进行.若能进行,若能进行,请你写出反应的化学方程式:______. gracie02281年前1
gracie02281年前1 -
 老周7007 共回答了11个问题
老周7007 共回答了11个问题 |采纳率100%解题思路:【作出猜想】根据三种金属的活动性顺序进行猜想;
【设计与实验】根据金属活动性顺序分析,注意铁、铜是否与酸反应,注意反应现象;
【结论与解释】(1)根据实验的现象得出结论;(2)根据金属的表面常有一层金属氧化物会影响金属和溶液的反应分析;
【知识运用】根据在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来分析并写出反应的方程式.【作出猜想】根据考虑到铁的活动性比铜强,三种金属中铬的金属性比它们都强、只比铜强、比它们都弱来猜想.则三种金属的活动性顺序可能存在三种情况:猜想一为Cr>Fe>Cu;猜想二为Fe>Cu>Cr;故猜想三为:Fe>Cr>Cu;
【设计与实验】铁与稀盐酸反应,有气泡产生,生成浅绿色溶液;因为铜的活动性顺序位于氢的后面,因此不能和酸反应,表现为无现象;
【结论与解释】(1)试管1中实验现象铁片表面产生气泡较慢,溶液变为浅绿色,可知金属铁在金属活动顺序中排在氢前,根据铬片表面产生气泡较快,溶液变为蓝色,从而得出铬也排在氢前且铬比铁活泼,因为铜不能和稀硫酸反应生成氢气,可知铜排在氢的后面,故猜想一.Cr>Fe>Cu正确;
(2)因为金属的表面常有一层金属氧化物会影响金属和溶液的反应,因此实验前用砂纸打磨金属片的目的是除去金属表面的氧化膜,利于反应;
【知识运用】因为“铬片表面产生气泡较快溶液变为蓝色”,可知金属铬比铁活泼强,故铬能和硫酸亚铁反应生成硫酸铬和铁,则反应的化学方程式为:Cr+FeSO4=Fe+CrSO4;
故答案为:【作出猜想】Fe>Cr>Cu;
【设计与实验】浅绿;无明显现象发生(或无气泡生成,溶液也不变色);
【结论与解释】(1)一;(2)除去金属表面的氧化膜,利于反应;
【知识运用】能; Cr+FeSO4=Fe+CrSO4.点评:
本题考点: 金属活动性的探究;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是对金属活动性顺序的考查,运用实验探究金属的活动性顺序,考查了实验探究的过程,注重学生运用实验分析实验能力的培养.1年前查看全部
- 按还原剂来命名的.用铝作还原剂生产金属铬,称为铝热法,用硅作还原剂还原V2O3冶...
按还原剂来命名的.用铝作还原剂生产金属铬,称为铝热法,用硅作还原剂还原V2O3冶...
按还原剂来命名的.用铝作还原剂生产金属铬,称为铝热法,用硅作还原剂还原V2O3冶炼,称为硅热法. anne_yuyu1年前1
anne_yuyu1年前1 -
 tenderrill 共回答了16个问题
tenderrill 共回答了16个问题 |采纳率87.5%高难度,看了都头疼1年前查看全部
- (2014•广州一模)(1)金属铬(Cr)可以形成碱[Cr(OH)3]和化合价为+3的绿色的氧化物,该氧化物的化学式是_
(2014•广州一模)(1)金属铬(Cr)可以形成碱[Cr(OH)3]和化合价为+3的绿色的氧化物,该氧化物的化学式是______,Cr(OH)3与足量稀硫酸发生中和反应的化学方程式是______,反应后得到的溶液呈绿色,使溶液呈绿色的离子的符号是______.
(2)将3.2g氧化铜加入稀硫酸中完全溶解后,再加入铁粉充分反应,过滤,得到滤渣A和滤液B.再将滤渣A加入足量稀硫酸中,有气泡冒出.充分反应后,剩余固体的质量为______,滤液的主要成分为______. longyaya1年前1
longyaya1年前1 -
 泡沫羽翼 共回答了13个问题
泡沫羽翼 共回答了13个问题 |采纳率84.6%解题思路:(1)根据元素的化合价可以书写物质的化学式;
氢氧化铬和稀硫酸反应生成硫酸铬和水;
铬离子能使溶液呈绿色;
(2)再将滤渣A加入足量稀硫酸中,有气泡冒出,说明铁粉过量,进一步说明滤渣A中含有铜和铁,滤液B中含有硫酸亚铁.(1)铬元素的化合价是+3,氧元素的化合价是-2,设铬元素和氧元素组成的化合物的化学式是CrxOy,根据化合物中元素化合价代数和为零有:(+3)×x+(-2)×y=0,
[x/y]=[2/3],即该氧化物的化学式是Cr2O3;
Cr(OH)3与足量稀硫酸发生中和反应的化学方程式是:3H2SO4+2Cr(OH)3═Cr2(SO4)3+6H2O;
反应后得到的溶液呈绿色,使溶液呈绿色的离子的符号是Cr3+.
故填:Cr2O3;3H2SO4+2Cr(OH)3═Cr2(SO4)3+6H2O;Cr3+.
(2)3.2g氧化铜中的铜元素与稀硫酸反应后完全转化为硫酸铜中的铜元素,与铁粉充分反应后又转化为铜,将滤渣A加入足量稀硫酸中,充分反应后,剩余固体是铜,质量为:
3.2g×[64/80]×100%=2.56g;
滤液的主要成分是硫酸亚铁,化学式为FeSO4.
故填:2.56g;FeSO4.点评:
本题考点: 酸的化学性质;化学符号及其周围数字的意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查物质化学式的书写方法、化学方程式的书写及其相关方面的计算的方面的知识,综合性较强,要注意理解掌握.1年前查看全部
- 铬是人体必需的一种微量元素,但铬过量摄入对人体危害非常大.铬的毒性与其存在形式有关,金属铬毒性最小,二价铬和三价铬的毒性
铬是人体必需的一种微量元素,但铬过量摄入对人体危害非常大.铬的毒性与其存在形式有关,金属铬毒性最小,二价铬和三价铬的毒性其次,六价铬毒性最大.河北、浙江等多地不法厂家生产的“毒胶囊”中主要含有毒性最大的铬元素,其化学成分可能是( ) A.CrCl 2 B.K 2 CrO 4 C.Cr 2 O 3 D.Cr(OH) 3  liusy011年前1
liusy011年前1 -
 fghfhfgjhgnn 共回答了22个问题
fghfhfgjhgnn 共回答了22个问题 |采纳率86.4%A、氯元素显-1价,设铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-1)×2=0,则w=+2价.
B、钾元素显+1价,氧元素显-2价,设铬元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:(+1)×2+y+(-2)×4=0,则y=+6价.
C、氧元素显-2价,设铬元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:2z+(-2)×3=0,则z=+3价.
D、氢氧根显-1价,设铬元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:z+(-1)×3=0,则x=+3价.
故含有六价铬的是K 2 CrO 4 .
故选B.1年前查看全部
- 【化学--化学与技术】工业上以碳素铬铁为原料制取铬铵矾,利用电解法制取金属铬.其工艺流程如图所示.已知:H2SO4+Cr
【化学--化学与技术】
工业上以碳素铬铁为原料制取铬铵矾,利用电解法制取金属铬.其工艺流程如图所示.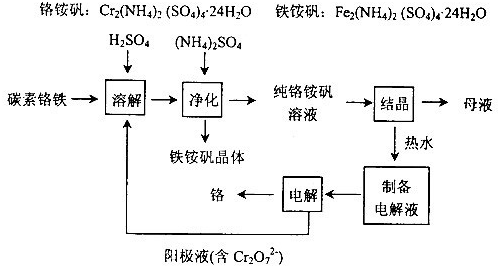
已知:H2SO4+Cr═CrSO4+H2↑
(1)碳素铬铁是铁铬合金,粉碎后溶于硫酸和电解阳极液的混合溶液中.该过程中电解阳极液的主要作用是______.
(2)加入(NH4)2SO4的目的是______.
(3)结晶后的母液从绿色化学的角度可采用的处理方法是______.
(4)产品铬中含氧呈脆性,为了降低其含氧量,可通过______提高其纯度. cherishrong1年前1
cherishrong1年前1 -
 棉花糖即溶巧克力 共回答了19个问题
棉花糖即溶巧克力 共回答了19个问题 |采纳率94.7%解题思路:(1)根据流程及重铬酸钾溶液具有氧化性进行分析;(2)根据工艺流程进行分析;(3)从绿色化学的角度进行分析处理结晶后的母液方法;(4)根据隔离空气降低其含氧量角度进行分析.(1)重铬酸钾溶液具有氧化性,将铬铁元素转化为Fe3+和Cr3+,
故答案为:作氧化剂,将铬铁元素转化为Fe3+和Cr3+,
(2)根据流程,加入(NH4)2SO4后,铁离子生成铁铵矾晶体析出,与铬铵矾溶液分离,
故答案为:生成铁铵矾和铬铵矾进行分离;
(3)母液中含有铬铵矾溶液,可以转入净化后的纯铬铵矾溶液进行结晶,得到铬铵矾晶体,
故答案为:转入净化后的纯铬铵矾溶液进行结晶;
(4)可以通过真空处理或氢还原的方法,降低产品铬中含氧量,
故答案为:真空处理或氢还原.点评:
本题考点: 制备实验方案的设计;金属冶炼的一般原理.
考点点评: 本题考查了工业上以碳素铬铁为原料制取铬铵矾的方法,解题关键是合理分析制取流程,本题充分考查了学生的分析、理解能力,难度中等.1年前查看全部
- 金属铬在空气中容易被氧化吗?氧化物是几价的?大概多久能被氧化?
 随便不1年前1
随便不1年前1 -
 从此空白 共回答了16个问题
从此空白 共回答了16个问题 |采纳率93.8%想氧化铬不是那么容易的,不然自行车钢圈,汽车的亮片都不会镀铬了.铬的氧化物有三价和五价两种.五价铬具有强氧化性,溶解在浓硫酸中,就是清洗玻璃容器的铬酸洗液,那是相当强悍.1年前查看全部
- 304不锈钢由碳钢,铬和镍 组成,那这个铬是金属铬还是氧化铬,这个镍是氯化镍还是硫化镍?
 爱我别走1贞1年前3
爱我别走1贞1年前3 -
 金裕熙 共回答了23个问题
金裕熙 共回答了23个问题 |采纳率69.6%304不锈钢是由铁,铬和镍 等元素组成的,其中的铬和镍已经不是金属铬,氧化铬,氯化镍,硫化镍等你所说的单一物质了,而是几种复杂的“相”了.1年前查看全部
大家在问
- 1如何将陈述句改成一般疑问句?
- 2惯性系与非惯性系有什么区别?
- 3疑问句怎样改成陈述句
- 4什么物质(离子化合物)与氧气反应生成氢氧化铝和一种气体
- 5化简:根号16答案是4还是正负4.
- 6设n大于1,且n∈N,A=根号n-根号(n-1),B=根号(n+1)-根号n则A与B的大小关系为
- 7某电解质,当把其固体加热时,能生成气体并生成一种只含离子键的化合物,该物质是什么
- 8厂字头下面一个虎 是什么字?怎么读?
- 9数典忘祖的含义数典是什么意思我到现在都不了深入了解
- 10dining room,restaurant,canteen,请说明这三个词语的区别,并各造一个句子
- 11wait的名词有助于回答者给出准确的答案
- 12基因是染色体的最小单位吗如题那是什么?
- 13一条染色体上有几个DNA分子RT!
- 14汉字画是什么结构
- 15小明每天骑车上学都要经过3个安装有红灯,绿灯,假如每个路口红灯和绿灯亮的时间相同,那么他从家出发去学叫.他刚好遇到2次红
