金红石,碳粉混合在高温条件下,通入氯气制得TiCl4和一种可燃性气体,此反应的化学式的方程式是什么?
 ghd877777777772022-10-04 11:39:541条回答
ghd877777777772022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 林子8610 共回答了18个问题
林子8610 共回答了18个问题 |采纳率94.4%- TiO2+2C+2Cl2==TiCl4+2CO
条件是高温 - 1年前
相关推荐
- 金红石二氧化钛 晶体结构分析
 再度梅开1年前2
再度梅开1年前2 -
 shan012 共回答了21个问题
shan012 共回答了21个问题 |采纳率85.7%提问不明确.下面是在网上搜索的关于金红石型TiO2的一些基础知识.如果你想仔细分析TiO2的晶体结构,可以看看一些书籍,比如《结晶学与矿物学》.还有一个很好的网站,应该是在国内晶体学方面做得最好的:http://www.***.org/Index.html.
金红石(Rutile)
TiO2
[晶体化学] 常含Fe2+、Fe3+、Nb5+、Ta5+、Sn4+等类质同像混入物,有时含Cr3+或V3+.多为异价替代,常见方式有2Nb5+(Ta5+)+ Fe2+—3Ti4+,Nb5+(Ta5+)+ Fe2+—Ti4++ Fe3+等.当Nb5+或Ta5+以1:1的方式替代Ti4+时,可能会导致晶格中的阳离子缺席.
富铁变种称为铁金红石;富含Nb、Ta的变种,当Nb>Ta时称铌铁金红石;Ta>Nb时称钽铁金红石.
[结构与形态] 四方晶系,a0=0.458nm,c0=0.295nm;Z=2.金红石型结构,为AX2型化合物的典型结构.O2-作近似六方最紧密堆积,Ti4+填充其半数的八面体空隙.Ti4+占据晶胞的角顶和中心,Ti与O分别为6次和3次配位,[TiO6]八面体共棱联结成∥c轴的链,链间八面体共角顶.
三种同质多像变体金红石、板钛矿、锐钛矿的结构都由[TiO6]八面体组成.所不同的是,在这三种结构中[TiO6]八面体分别共两棱、三棱和四棱.根据鲍林法则,配位多面体共棱、共面会降低结构的稳定性,因此,三种变体中以金红石分布最广.
复四方双锥晶类,D4h-4/mmm(L44L25PC).常具完好的四方柱状或针状晶形.常见单形:四方柱m{110}、a{100},四方双锥s{111}、e{101},有时见复四方柱r{320}、h{120}和复四方双锥z{321}.晶体常具∥c轴的柱面条纹.常以(011)为双晶面成膝状双晶、三连晶或环状双晶;针状、纤维状晶体有时作为包裹体见于透明水晶中.有时成致密块状集合体.晶形与形成条件有关.在伟晶岩中,常呈双锥状、短柱状;而在金红石-石英脉中,快速结晶时则为长柱状、针状晶形.
[物理性质] 常见暗红、褐红色,黄、桔黄色者稀见,富铁者黑色;条痕浅黄至浅褐色;金刚光泽,铁金红石半金属光泽.解理∥{110}完全,∥{100}中等;裂开∥{092}和{011}.硬度6~6.5.性脆.相对密度4.4.3,富铁或铌、钽者可增高至5.5以上.
偏光镜下:大多为浅红、淡黄、紫色.多色性不显著.No黄至褐黄色;Ne褐黄至黄绿色.含有Nb、Ta、Fe的变种颜色变深,多色性显著.一轴晶(+).No=2.616,Ne= 2.903.人工合成纯金红石,No=2.605,Ne=2.901.
[产状与组合] 一般在高温下形成.最主要产状为热液金红石-石英脉型和伟晶型.在伟晶型中可成巨晶.在区域变质过程中,金红石常由含钛矿物(如钛铁矿)转变而成,见于角闪岩、榴辉岩、片麻岩和片岩中.金红石化学性质稳定,因而常发现于砂矿床中.
[鉴定特征] 四方柱晶形,膝状双晶,带红的褐色,柱面解理完全为其特征.
[工业应用] 主要用作颜料工业、光学材料、宝石原料,以及制作介电陶瓷等.
颜料工业:以其制取的纯TiO2粉称钛白粉.金刚光泽.一轴晶(+),高折射率,No=2.605~2.613,Ne=2.899~2.901.高反射率:Ro:21.21.1(470nm),19.20.0 (546nm),19.19.6(589nm),18.19.1(650nm);Re:24.24.6(470nm),23.23.5 (546nm),22.23.0(589nm),22.22.6(650nm).高介电常数和明显的介电各向异性,介电常数k在∥c轴为173,⊥c轴为89.钛白粉具有高白度、高折射率和散射能力,在白色颜料中占90%以上,主要用于涂料、造纸、橡胶工业,占总消费量的85%以上.其中涂料用钛白粉约占钛白粉总消量的1/2.钛白粉对紫外光波段具有强吸收效应,常用作防晒化妆品的添加剂.此外,钛白粉还用于化学纤维、玻璃、陶瓷工业.
TiO2颜料分为金红石型和锐钛矿型.前者为微淡色泽,相对密度3.4.2,折射率2.71,吸油率16~48g/100g,平均粒径0.0.3μ;后者为冷蓝白色,相对密度3.4.1,折射率2.55,吸油率18~30g/100g,平均粒径0.18~0.3μ.
光学材料:金红石单晶具有特殊的透光性能.在波长1~5μm范围内的折射率为2.2.3,大致相当于常用探测器材料(Ge、Si、InSb、PbS等)和空气折射率的几何平均值.故作为元件窗口或前置透镜时可使反射损失显著减小.2mm厚的单晶薄片在0.43~6.2μm波长范围内是透明的.300nm厚的金红石单晶薄膜能将可见光反射掉42%,透过57%,可作无损而又耐久的分束器.
其它应用:金红石具高介电系数,可以耐10(12)频率级的超高频.含TiO2的陶瓷是一种优良的高频介电材料.金红石还是一种重要的高温隔热涂层材料.作为隔热材料使用时,要求矿物纯度高,结构为金红石型,铁杂质含量低,晶格常数较大,反射率较高,辐射系数较低,微波介电常数较高,介电损耗较低.美观的金红石单晶可作宝石.1年前查看全部
- (2005•重庆)钛和钛合金被认为是21世纪的重要金属材料,金红石(主要成分TiO2)是冶炼金属钛的主要原料.计算TiO
(2005•重庆)钛和钛合金被认为是21世纪的重要金属材料,金红石(主要成分TiO2)是冶炼金属钛的主要原料.计算TiO2中Ti元素的质量分数.
 天山有雪1年前0
天山有雪1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 金红石 现有一个金红石矿产,TiO2的含量在2%左右.想问一下是否值得开采?还有现在金红石TiO2
 单身极品男人1年前1
单身极品男人1年前1 -
 circleinsummer 共回答了14个问题
circleinsummer 共回答了14个问题 |采纳率92.9%2%的含量稍有些低了,而且不知道这个含量是钛的总量还是金红石的量,两者是不一样的.
更多信息百度一下”中能矿研”,中能有色矿冶研究院.1年前查看全部
- (16分)二氧化钛是一种不溶于稀酸的物质,常用于制取金属钛。某种金红石矿石的主要成分是TiO 2 ,含有Fe 2 O 3
(16分)二氧化钛是一种不溶于稀酸的物质,常用于制取金属钛。某种金红石矿石的主要成分是TiO 2 ,含有Fe 2 O 3 和Al 2 O 3 杂质。一研究性学习小组设计如下方案制备金属钛,并得到其它副产品。
(1)已知Fe(OH) 3 、Al(OH) 3 ,开始沉淀的pH数据(见下表)向溶液I中滴加NaOH溶液,并调溶液pH,若开始只得到一种沉淀,该沉淀是氢氧化物 Fe(OH) 3 A1(OH) 3 开始沉淀pH 1.5 3.3
,应控制pH的范围是 ,反应的离子方程式是 ;
(2)向溶液Ⅱ中“继续加适量NaOH溶液”,若操作不当会减少滤渣Ⅲ的质量,请你设计另一种方案代替向溶液Ⅱ中“继续加适量NaOH溶液”的方案,该方案是 ,反应的离子方程式是 ;
(3)已知:①CO 2 (g)==C(s)+O 2 (g); △ H ="393.5" kJ·mol -l
②CO(g)+ O 2 (g)==CO 2 (g);△ H =-283 kJ·mol -l
③TiO 2 (s)+2Cl 2 (g)==TiCl 4 (s)+O 2 (g);△ H ="141" kJ·mol -l
写出TiO 2 与Cl 2 +C反应的热化学方程式 。
(4)若经过多步反应后制得b g金属钛,则金红石矿石中TiO 2 的质量分数为 likang529991年前0
likang529991年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- P139.2、 金红石(Tio2)的晶胞如图所示,图中色点代表钛原子,黑点代
P139.2、 金红石(Tio2)的晶胞如图所示,图中色点代表钛原子,黑点代
2、 金红石(Tio2)的晶胞如图所示,图中色点代表钛原子,黑点代表氧原子.长方体的8个顶点和中心是钛原子,4个氧原子的位置是A(0.31a,0.31b,0),B(0.69a,0.69b,0),C(0.81a,0,0.5c)和D(0.19a,0.81b,0.5c).中心处钛原子与A处氧原子间的距离叫做键长.当a=b时,试求键长. yuanxiaoyang3211年前1
yuanxiaoyang3211年前1 -
 binkugua 共回答了14个问题
binkugua 共回答了14个问题 |采纳率92.9%因为中心钛原子坐标(0.5a,0.5b,0.5c)
所以d=√(0.5a-0.31a)∧2+(0.5b-0.31b)∧2+(0.5c)∧2
又a=b∴d=√2×(0.19a)∧2+(0.5c)∧2
d=√0.0722a∧2+0.25c∧21年前查看全部
- 以金红石为原料生产金属钛的步骤有 1在高温下,向金红石与焦炭的混合物中通入Cl2,得到TlCl4和一种可燃性
以金红石为原料生产金属钛的步骤有 1在高温下,向金红石与焦炭的混合物中通入Cl2,得到TlCl4和一种可燃性
1在高温下,向金红石与焦炭的混合物中通入Cl2,得到TlCl4和一种可燃性气体,2在稀有气体(如氩)氛围和加热的条件下,用镁与TlCl4反应可得到钛.
请写出上述反应的化学方程式,并分析反应2时稀有气体氛围的作用 sjiav1年前1
sjiav1年前1 -
 wangazhong 共回答了27个问题
wangazhong 共回答了27个问题 |采纳率96.3%1在高温下,向金红石与焦炭的混合物中通入Cl2,得到TlCl4和一种可燃性气体,
TiO2 + 2C + 2Cl2 =高温= TiCl4 + 2CO
2在稀有气体(如氩)氛围和加热的条件下,用镁与TlCl4反应可得到钛.
TiCl4 + 2Mg =高温= Ti + 2MgCl2
请写出上述反应的化学方程式,并分析反应2时稀有气体氛围的作用--------保护Ti和Mg不发生其它反应1年前查看全部
- 由金红石(TiO 2 )制取单质Ti,涉及的步骤为:已知:
由金红石(TiO 2 )制取单质Ti,涉及的步骤为:已知: 
①C(s)+O 2 (g)====CO 2 (g) ΔH=-393.5 kJ·mol -1
②2CO(g)+O 2 (g) ====2CO 2 (g) ΔH=-566 kJ·mol -1
③TiO 2 (s)+2Cl 2 (g) ====TiCl 4 (s)+O 2 (g) ΔH=+141 kJ·mol -1
则
(1)TiO 2 (s)+2Cl 2 (g)+2C(s) ====TiCl 4 (s)+2CO(g)的ΔH=____________________。
(2)碳在氧气中不完全燃烧生成CO的热化学方程式为_______________________________。 红红欣欣1年前1
红红欣欣1年前1 -
 长烟瘦马 共回答了15个问题
长烟瘦马 共回答了15个问题 |采纳率86.7%(1)-80kJ·mol -1
(2)C(s)+1/2O 2 (g)==CO(g) ΔH=-110.5 kJ·mol -11年前查看全部
- 钛(Ti)和钛的合金被认为是2l世纪重要的金属材料.目前大规模生产钛的方法是:第一步,在高温时,将金红石(Ti0 2 )
钛(Ti)和钛的合金被认为是2l世纪重要的金属材料.目前大规模生产钛的方法是:第一步,在高温时,将金红石(Ti0 2 )、碳粉混合并通入氯气制得TiCl 4 和一种可燃性气体,写出该反应的化学方程式______;第二步,在氩气的环境中,用过量的镁在加热条件下与TiCl 4 .反应制得金属钛(氩气不参加反应).写出该反应的化学方程式______.  缘定山大1年前1
缘定山大1年前1 -
 废园故事 共回答了20个问题
废园故事 共回答了20个问题 |采纳率90%(1)根据“在高温时,将金红石(Ti0 2 )、碳粉混合并通入氯气”的叙述,得知反应物是三种物质金红石、炭粉和氯气在高温下反应发生的;又“制得TiCl 4 和一种可燃性气体”可知生成两种物质,其中可燃性气体的确定为本问题的难点.根据反应前后元素种类不变,反应前含C、O、Ti、Cl四种元素,反应后只能明确在TiCl 4 中含有Ti、Cl两种元素,所以判断可燃性气体应含有C、O两种元素.由C、O元素组成的可燃性气体为CO气体.
故答案为:Ti0 2 +2C+2Cl 2
高温
.
TiCl 4 +2CO;
(2)题中明确说明“在氩气的保护下”说明此反应中稀有气体氩气只作为保护气并不参加反应,所以氩气不是该反应的反应物,反应的反应物为TiCl 4 和镁.对于生成物,题中信息只告知“制得金属钛”,其他生成物需要自己分析解决.而题中对此反应没有更多介绍信息,因此在分析反应时可借助“金属(Mg)和盐(TiCl 4 )发生置换反应”的规律解答.故答案为:TiCl 4 +2Mg
△
.
Ti+2MgCl 2 ;1年前查看全部
- 金红石、木炭粉混合在高温的条件下通入氯气生成Ticl4和一种可燃性气体,方程式
 晚上条1年前1
晚上条1年前1 -
 今夜无人 共回答了16个问题
今夜无人 共回答了16个问题 |采纳率87.5%TiO2+2C+2Cl2=高温=TiCl4+2CO1年前查看全部
- 钛(Ti)和钛的合金被认为是2l世纪重要的金属材料。目前大规模生产钛的方法是:第一步,在高温时,将金红石(TiO 2 )
钛(Ti)和钛的合金被认为是2l世纪重要的金属材料。目前大规模生产钛的方法是:第一步,在高温时,将金红石(TiO 2 )、碳粉混合并通人氯气制得TiCl 4 和一种可燃性气体,写出该反应的化学方程式__________________________ ;第二步,在氩气的环境中,用过量的镁在加热条件下与TiCl。反应制得金属钛(氩气不参加反应)。写出该反应的化学方程式_____________________。  lyt_nihao1年前1
lyt_nihao1年前1 -
 3nmhj5u 共回答了21个问题
3nmhj5u 共回答了21个问题 |采纳率100%1年前查看全部
- 钛和钛合金被认为是21世纪的重要金属材料,金红石(主要成分TiO 2 )是冶炼金属钛的主要原料.计算TiO 2 中Ti元
钛和钛合金被认为是21世纪的重要金属材料,金红石(主要成分TiO 2 )是冶炼金属钛的主要原料.计算TiO 2 中Ti元素的质量分数.  peng1231年前1
peng1231年前1 -
 nic_lin1 共回答了18个问题
nic_lin1 共回答了18个问题 |采纳率94.4%根据化合物中元素的质量分数=
元素的相对原子质量×原子个数
相对分子质量 ×100%,TiO 2 中Ti元素的质量分数=
48
48+16×2 × 100%=60%.
故答案为:60%.1年前查看全部
- TiO2除了具有金红石结构外,还有哪些其他结构?
 xlue1年前1
xlue1年前1 -
 ivy315666 共回答了22个问题
ivy315666 共回答了22个问题 |采纳率100%还有钙钛矿型二氧化钛1年前查看全部
- (2008•黑龙江)金属钛及钛的合金被认为是21世纪重要的金属材料,地壳中的钛矿石主要是金红石(TiO2),TiO2中钛
(2008•黑龙江)金属钛及钛的合金被认为是21世纪重要的金属材料,地壳中的钛矿石主要是金红石(TiO2),TiO2中钛的化合价是______.目前工业上制取钛的方法是:第一步,在高温时,将金红石、炭粉混合并通入氯气(Cl2)制得TiCl4和一种可燃性气体,该反应的化学方程式是TiO2+2C+2Cl2
TiCl4+2C0高温 .TiO2+2C+2Cl2;第二步,在氩气做保护气(氩气不参加反应)的环境中,用过量的金属镁在加热条件下与TiCl4反应制得金属钛,该反应的化学方程式是
TiCl4+2C0高温 .2Mg+TiCl4
2MgCl2+Ti△ .2Mg+TiCl4.
2MgCl2+Ti△ . 寒水哥1年前1
寒水哥1年前1 -
 临风沐雪 共回答了18个问题
临风沐雪 共回答了18个问题 |采纳率88.9%解题思路:根据化合价原则可以计算出钛的化合价.
根据化学方程式的书写方法可以写出相关的化学方程式.设TiO2中钛的化合价为x.则
x+(-2)×2=0
解得x=+4
由“在高温时,将金红石、炭粉混合并通入氯气(Cl2)制得TiCl4和一种可燃性气体”可知:
反应物是金红石、碳粉和氯气,生成物是四氯化钛和一氧化碳,条件是高温.
因此第一步反应的化学方程式为:TiO2+2C+2Cl2
高温
.
TiCl4+2C0.
由“在氩气做保护气(氩气不参加反应)的环境中,用过量的金属镁在加热条件下与TiCl4反应制得金属钛”可知:
反应物是四氯化钛和金属镁,生成物是钛和氯化镁,条件是高温.
因此第二步反应的化学方程式为:2Mg+TiCl4
△
.
2MgCl2+Ti.
故答案为:+4;TiO2+2C+2Cl2
高温
.
TiCl4+2C0;2Mg+TiCl4
△
.
2MgCl2+Ti.点评:
本题考点: 有关元素化合价的计算;常见元素与常见原子团的化合价;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查有关化合价的计算和化学方程式的书写,难度稍大.1年前查看全部
- 由金红石(TiO2)制取单质Ti涉及到的步骤为:TiO2→TiCl4镁/800℃/ArTi
由金红石(TiO2)制取单质Ti涉及到的步骤为:TiO2→TiCl4
Ti镁/800℃/Ar
已知:①C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H是( )
A.-80 kJ•mol-1
B.-160 kJ•mol-1
C.160 kJ•mol-1
D.80 kJ•mol-1 12112011年前1
12112011年前1 -
 无所事事82 共回答了21个问题
无所事事82 共回答了21个问题 |采纳率85.7%解题思路:依据热化学方程式和盖斯定律计算得到,反应的焓变与变化过程无关,只与起始和终了状态有关;:①C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H=+141kJ•mol-1
依据盖斯定律①×2-②+③得到
TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=-80KJ/mol;
故选A.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查了热化学方程式和盖斯定律的计算应用,掌握基础是关键,题目较简单.1年前查看全部
- 由金红石(TiO 2 )制取单质Ti,涉及到的步骤为:
由金红石(TiO 2 )制取单质Ti,涉及到的步骤为:
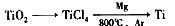
已知:① C(s) + O 2 (g) ="=" CO 2 (g); △H = -393.5 kJ•mol -1
② 2CO(g) + O 2 (g) ="=" 2CO 2 (g); △H = -566 kJ•mol -1
③ TiO 2 (s) + 2Cl 2 (g) ="=" TiCl 4 (s) + O 2 (g); △H =" +141" kJ•mol -1
(1)则TiO 2 (s) + 2Cl 2 (g) + 2C(s)="=" TiCl 4 (s) + 2CO(g) 的△H = _________________。
(2)反应TiCl 4 + 2Mg ="=" 2MgCl 2 + Ti 在Ar气氛中进行的理由是_____________。 nc19701年前1
nc19701年前1 -
 kristy过敏缘 共回答了16个问题
kristy过敏缘 共回答了16个问题 |采纳率81.3%(1)△H=—80 kJ•mol -1 ;(2)防止高温下Mg(Ti)与空气中的O 2 (CO 2 、N 2 )反应。
可以将上述三个反应按一定方式合并,①×2—②+③,就得到所需要的反应,反应热也为①×2—②+③。计算时通过判断物质种类与反应及系数的关系,找出计算方法,反应热的符号和倍数关系是易出错的问题,要特别注意。1年前查看全部
- 盖斯定律的问题由金红石(TiO2)制备单质Ti,涉及的步骤为:TiO2→TiCl4→(Mg,800℃,Ar)→Ti已知:
盖斯定律的问题
由金红石(TiO2)制备单质Ti,涉及的步骤为:
TiO2→TiCl4→(Mg,800℃,Ar)→Ti
已知:①C(s)+O2(g)====CO2(g);△H=-393.5kj·mol-1
②2CO(g)+O2(g)====2CO2(g);△H=-566kj·mol-1
③TiO2(s)+2Cl2(g)====TiCl4(s)+O2(g);△H=+141kj·mol-1
则TiO2(g)+2Cl2(g)+2C(s)====TiCl4(s)+2CO(g)的△H=_____.反应TiCl4+2Mg====2MgCl2+Ti在Ar气氛中进行的理由是_______________. 炭去盐归1年前1
炭去盐归1年前1 -
 1022126 共回答了14个问题
1022126 共回答了14个问题 |采纳率92.9%TiO2(g)+2Cl2(g)+2C(s)====TiCl4(s)+2CO(g)
此式没问题吗?是气态TiO2?1年前查看全部
- 由金红石(TuO2)制取单质Tu,涉及到的部分步骤为:
由金红石(TuO2)制取单质Tu,涉及到的部分步骤为:
TuO2→TuO8
Tu镁/8八八℃/0r
已知:①6(s)+O2(g)=6O2(g)△H1
②26O(g)+O2(g)=26O2(g)△H2
③TuO2(s)+26l2(g)=Tu6l8(s)+O2(g)△H大
则反应TuO2(s)+26l2(g)+26(s)=Tu6l8(s)+26O(g)的△H为( )
A.△H3+2△H1-2△H2
B.△H3+△H1-△H2
C.△H3+2△H1-△H2
D.△H3+△H1-2△H2 喂你月亮1年前1
喂你月亮1年前1 -
 alex_天若有情 共回答了24个问题
alex_天若有情 共回答了24个问题 |采纳率95.8%解题思路:根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式,据此计算.已知:①0(s)+O2(g)=0O2(g)△H手
②20O(g)+O2(g)=20O2(g)△H2
③TiO2(s)+20l2(g)=Ti0l4(s)+O2(g)△H3
由盖斯定律可知,①×2-②+③得TiO2(s)+20l2(g)+20(s)=Ti0l4(s)+20O(g),△H=△H3+2△H手-△H2,
故选0.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查反应热的计算、盖斯定律等,难度中等,理解盖斯定律并根据盖斯定律构造目标热化学方程式是解答本题的关键.1年前查看全部
- 钛(Ti)被广泛用于航空、航天、医学等方面.地壳中一种含钛矿石--金红石(主要成分是TiO 2 )是目前大规模生产钛的重
钛(Ti)被广泛用于航空、航天、医学等方面.地壳中一种含钛矿石--金红石(主要成分是TiO 2 )是目前大规模生产钛的重要原料,TiO 2 中钛元素的化合价为( ) A.+1 B.+2 C.+3 D.+4  最快不过光光跑361年前1
最快不过光光跑361年前1 -
 男大当荤女大当驾 共回答了14个问题
男大当荤女大当驾 共回答了14个问题 |采纳率78.6%在TiO 2 中氧元素的化合价为-2价,设钛元素的化合价为x.
根据化合物中各元素的正负化合价的代数和为0,则
x+(-2)×2=0
解得x=+4
故选D.1年前查看全部
- (2014•南京三模)钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为
 (2014•南京三模)钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.
(2014•南京三模)钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.
(1)Ti基态的电子排布式为1s22s22p63s23p63d44s21s22s22p63s23p63d44s2.
(2)TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃.固态TiCl4属于分子分子晶体.
(3)BaCO3为离子化合物.CO32-中C原子的杂化类型为sp2sp2,写出一种与CO32-互为等电子体的阴离子:NO3-、SiO32-NO3-、SiO32-(填化学式).
(4)钛酸钡的晶胞如图所示,其化学式为BaTiO3BaTiO3
(5)用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的配合物[TiCl(H2O)5]Cl2•H2O.1mol该配合物中含有σ键的数目为18mol18mol. zhuxiang011年前1
zhuxiang011年前1 -
 5464768x 共回答了15个问题
5464768x 共回答了15个问题 |采纳率93.3%(1)Ti原子序数为22,其核外电子排布式为:1s22s22p63s23p63d44s2,故答案为:1s22s22p63s23p63d44s2;
(2)TiCl4熔、沸点较低,可判断知其固态形式为分子晶体,故答案为:分子;
(3)CO32-中C原子价电子数为:
4+2
2=3,即形成了三条杂化轨道,杂化类型为:sp2;CO32-,原子数为4,价电子数为:24,则NO3-、SiO32-,为其等电子体,
故答案为:sp2;NO3-、SiO32-;
(4)Ba位于体心,数目为1,Ti位于顶点,数目为8×
1
8=1,O位于棱心,12×
1
4=3,化学式为:BaTiO3,故答案为:BaTiO3;
(5)1molTi与1molCl和5molH2O,形成6molσ键,5molH2O内含有5×2=10molσ键,外界1molH2O内含有2molσ键,共含有6+10+2=18mol,故答案为:18mol.1年前查看全部
- 一个化学题,在金红石(主要含TiO2)里加入焦炭和CL2,生成了TiCL4和一种可燃性物色气体
一个化学题,在金红石(主要含TiO2)里加入焦炭和CL2,生成了TiCL4和一种可燃性物色气体
然后要写出反应方程式.我的判断:一种就是可燃性物色气体是氧气,把焦炭当作了催化剂,或是焦炭也反应,生成CO,想知道在这种情况下我怎么判断哪个对呢?拿到这种题该怎样思考?还有能否说一下怎样书写电解法里正负极的反应方程式,因为拿到这种题完全不知道怎样写. ling08101年前2
ling08101年前2 -
 cddb 共回答了18个问题
cddb 共回答了18个问题 |采纳率94.4%氧气是助燃剂,氧气不是可燃的!
可以看出,反应物有TiO2与C、Cl2,生成物有TiCl4,根据质量守恒定律,另一种生成物肯定有C、O两种元素,又因为是可燃性气体,所以是CO.
TiO2+Cl2+C=CO+TiCl4配平即可.
TiO2+2Cl2+2C=2CO+TiCl41年前查看全部
- 工业上用金红石(主要成分为TiO2)制金属钛,可通过以下反应进行:
工业上用金红石(主要成分为TiO2)制金属钛,可通过以下反应进行:
①TiO2+2C+2Cl2
TiCl4+2CO高温 .
②TiCl4+2Mg
Ti+2MgCl2氩气 .
对于上述两个反应的叙述中,正确的是( )
A.都是置换反应
B.①中TiO2作氧化剂
C.每生成1mol金属Ti,②中转移电子数为2NA
D.②中氩气作保护气,可防止金属Ti被氧化 wenchangjuanke1年前1
wenchangjuanke1年前1 -
 mvija2 共回答了18个问题
mvija2 共回答了18个问题 |采纳率77.8%解题思路:反应①中,Cl元素的化合价降低,C元素的化合价升高,反应②中Mg元素的化合价升高,Ti元素的化合价降低,以此来解答.A.反应①没有单质生成,不是置换反应,故A错误;
B.反应①中Ti元素化合价没有变化,Cl元素的化合价降低,则TiCl4在反应(1)中是还原产物,而氯气为氧化剂,故B错误;
C.Ti元素化合价由+4价降低到0价,则每生成1mol金属Ti,②中转移电子数为4NA,故C错误;
D.氩气为惰性气体,与钛不反应,则②中氩气作保护气,可防止金属Ti被氧化,故D正确.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.1年前查看全部
- 钛和钛合金被认为是21世纪的重要金属材料,金红石(主要成分TiO 2 )是冶炼金属钛的主要原料。计算TiO 2 中Ti元
钛和钛合金被认为是21世纪的重要金属材料,金红石(主要成分TiO 2 )是冶炼金属钛的主要原料。计算TiO 2 中Ti元素的质量分数___________。[Ti的相对原子质量为48]  birting1年前1
birting1年前1 -
 55531246 共回答了18个问题
55531246 共回答了18个问题 |采纳率94.4%60%1年前查看全部
- 钛(Ti)和钛的合金被认为是2l世纪重要的金属材料.目前大规模生产钛的方法是:第一步,在高温时,将金红石(Ti02)、碳
钛(Ti)和钛的合金被认为是2l世纪重要的金属材料.目前大规模生产钛的方法是:第一步,在高温时,将金红石(Ti02)、碳粉混合并通入氯气制得TiCl4和一种可燃性气体,写出该反应的化学方程式Ti02+2C+2C12
TiCl4+2CO高温 .Ti02+2C+2C12;第二步,在氩气的环境中,用过量的镁在加热条件下与TiCl4.反应制得金属钛(氩气不参加反应).写出该反应的化学方程式
TiCl4+2CO高温 .TiCl4+2Mg
Ti+2MgCl2△ .TiCl4+2Mg.
Ti+2MgCl2△ . pglzyp1年前1
pglzyp1年前1 -
 hzh267 共回答了27个问题
hzh267 共回答了27个问题 |采纳率96.3%解题思路:根据题意,题目旨在分析所给信息找出反应发生的过程,用化学方程式表示反应.解答此类问题时,主要抓住反应物、生成物和反应条件的辨别和分析,正确书写有关物质的化学式,然后根据书写化学方程式的步骤完成.(1)根据“在高温时,将金红石(Ti02)、碳粉混合并通入氯气”的叙述,得知反应物是三种物质金红石、炭粉和氯气在高温下反应发生的;又“制得TiCl4和一种可燃性气体”可知生成两种物质,其中可燃性气体的确定为本问题的难点.根据反应前后元素种类不变,反应前含C、O、Ti、Cl四种元素,反应后只能明确在TiCl4中含有Ti、Cl两种元素,所以判断可燃性气体应含有C、O两种元素.由C、O元素组成的可燃性气体为CO气体.
故答案为:Ti02+2C+2Cl2
高温
.
TiCl4+2CO;
(2)题中明确说明“在氩气的保护下”说明此反应中稀有气体氩气只作为保护气并不参加反应,所以氩气不是该反应的反应物,反应的反应物为TiCl4和镁.对于生成物,题中信息只告知“制得金属钛”,其他生成物需要自己分析解决.而题中对此反应没有更多介绍信息,因此在分析反应时可借助“金属(Mg)和盐(TiCl4)发生置换反应”的规律解答.故答案为:TiCl4+2Mg
△
.
Ti+2MgCl2;点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 认真分析题目中给出的信息是解题的关键,初中化学中“可燃性气体”主要有一氧化碳、氢气、甲烷三种气体.1年前查看全部
- 金红石TiO2回收率什么意思
 本来是哭1年前1
本来是哭1年前1 -
 浴血狂飚 共回答了24个问题
浴血狂飚 共回答了24个问题 |采纳率87.5%选矿回收率:指选矿产品(一般为精矿)中某一有用成分的质量与入选原矿中同一有用成分质量的百分比:ε=γ×β / α×100% ,式中:ε为产品中某一成分的回收率(%);α为原矿中此种成分的品位(%);β为产品中此种成分的品位(%);γ为产品的产率(%).
金红石精矿中TiO2的回收率就是指精矿中TiO2的质量与入选原矿中同一有用成分质量的百分比.1年前查看全部
- 由金红石(TiO 2 )制取单质Ti,涉及到的步骤为:
由金红石(TiO 2 )制取单质Ti,涉及到的步骤为: 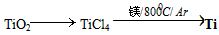
已知:① C(s)+O 2 (g)=CO 2 (g);△H=-393.5 kJ·mol-1
② 2CO(g)+O 2 (g)=2CO 2 (g); △H=-566 kJ·mol-1
③ TiO 2 (s)+2Cl 2 (g)=TiCl 4 (s)+O 2 (g);△H=+141 kJ·mol-1
则TiO 2 (s)+2Cl 2 (g)+2C(s)=TiCl 4 (s)+2CO(g)的△H=___________________ 淼灵1年前1
淼灵1年前1 -
 缘博渊情 共回答了18个问题
缘博渊情 共回答了18个问题 |采纳率94.4%-80kJ/mol1年前查看全部
- 盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.金红石(TiO2)制
盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.金红石(TiO2)制钛,涉及的步骤为:TiO2-TiCl4-Ti,
已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol①
O2(g)+2CO(g)=2CO2 (g)△H=-566kJ/mol②
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H=+141kJ/mol③
写出金红石与氯气、石墨制取TiCl4(s)和CO的热化学反应方程式______. suny03271年前1
suny03271年前1 -
 徽徽的笑 共回答了18个问题
徽徽的笑 共回答了18个问题 |采纳率94.4%解题思路:根据盖斯定律结合已知热化学反应的方程式来回答即可.金红石与氯气、石墨制取TiCl4(s)和CO的化学反应方程式可以通过③+①×2-②得到,
所以TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=141kJ/mol-393.5kJ/mol×2+566kJ/mol=-80KJ/mol,
即TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=-80KJ/mol,
故答案为:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=-80KJ/mol.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查学生盖斯定律的应用知识,属于重要的考点,难度不大.1年前查看全部
- 金红石加碳粉 混合后通入氯气制的TiCI4和一种可燃性气体 化学方程式是什么呀
 快说出来1年前3
快说出来1年前3 -
 peasantrychao 共回答了15个问题
peasantrychao 共回答了15个问题 |采纳率73.3%Tico+2C+2Cl2=====(高温)Ticl4+2CO(标一个向上的箭头),可燃气体是一氧化碳.1年前查看全部
- 金红石碳粉混合后通入氯气制的TiCI4和一种可燃性气体,该反应的还原剂是什么
 beijingzl20031年前1
beijingzl20031年前1 -
 feibutterfly 共回答了17个问题
feibutterfly 共回答了17个问题 |采纳率76.5%TiO2+2Cl2+2C===高温===TiCl4+2CO
还原剂是C1年前查看全部
- 金红石,碳粉混合在高温条件下,通入氯气制得TiCl4和一种可燃性气体,此反应的化学方程式是什么?
 sunny9211年前1
sunny9211年前1 -
 lkj6666 共回答了13个问题
lkj6666 共回答了13个问题 |采纳率84.6%TiO2+2C+2Cl2=TiCl4+2CO1年前查看全部
- TiO2的红外光谱?求TiO2的红外标准谱(锐钛矿、金红石).以及Ti-O四面体、Ti-O八面体、Ti-O-Ti等键的伸
TiO2的红外光谱?
求TiO2的红外标准谱(锐钛矿、金红石).以及Ti-O四面体、Ti-O八面体、Ti-O-Ti等键的伸缩和弯曲振动的具体谱带位置.网上能见所到的都是有机物的红外谱,无机物的很少. 李许1年前1
李许1年前1 -
 jsk83 共回答了19个问题
jsk83 共回答了19个问题 |采纳率94.7%http://riodb01.ibase.a ... ?sdbsno=40172TiO2的标准IR光谱,具体谱带位置你可能得去查文献.这个日本的网站还可以查其它物质的IR、Raman、NMR等,但主要是针对有机物. 查看原帖>>
采纳哦1年前查看全部
- (2013•江苏模拟)钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料.以金红石(主要成分为TiO2,含少量Fe2O3
(2013•江苏模拟)钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料.以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti.工业流程如下:
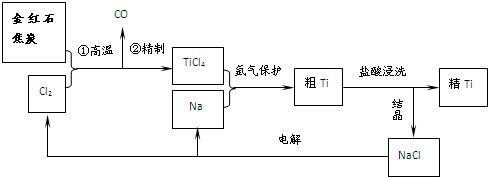
(1)写出金红石高温反应制取TiCl4的化学方程式TiO2+2C+2Cl2
TiCl4+2CO高温 .TiO2+2C+2Cl2.
TiCl4+2CO高温 .
(2)写出电解熔融NaCl的化学方程式2NaCl(熔融)
2Na+Cl2↑通电 .2NaCl(熔融);阴极产物是______.
2Na+Cl2↑通电 .
(3)粗钛产品粉碎后要用盐酸浸洗.其主要目的是______.
(4)Ti可溶解在浓HF溶液中,请完成下列离子方程式.
______Ti+______HF-______TiF62-+______(______)+______H2↑ 我要我要我们ss1年前1
我要我要我们ss1年前1 -
 那个天长地久 共回答了28个问题
那个天长地久 共回答了28个问题 |采纳率92.9%解题思路:(1)根据反应物和生成物结合质量守恒定律书写化学方程式;
(2)电解氯化钠生成金属钠和氯气,在阴极发生还原反应生成钠;
(3)从溶解平衡的角度分析;
(4)根据氧化还原反应得失电子数目相等和离子方程式电荷守恒的角度书写反应的离子方程式.(1)由流程图可知,反应为TiO2、C和Cl2,生成物为TiCl4和CO,则反应的化学方程式为TiO2+2C+2Cl2
高温
.
TiCl4+2CO,
故答案为:TiO2+2C+2Cl2
高温
.
TiCl4+2CO;
(2)电解氯化钠生成金属钠和氯气,方程式为2NaCl (熔融)
通电
.
2Na+Cl2↑,在阴极发生还原反应生成钠,
故答案为:2NaCl (熔融)
通电
.
2Na+Cl2↑;钠;
(3)粗钛产品中剩余的少量钠,加入盐酸和除去,并且Cl-浓度增大,有利于NaCl晶体析出,
故答案为:除去粗钛产品中剩余的少量钠,促进NaCl晶体析出(Cl-同离子效应);
(4)反应前后Ti的化合价由0价升高为+4价,HF中H元素的化合价由+1价降低到0价,则有Ti~2H2,
则有1Ti+6HF=1TiF62-+2H++2H2↑,
故答案为:1;6;1;2;H+;2.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查物质的制备和分离的实验设计,题目难度中等,本题易错点为(3),注意从混合物的成分以及平衡移动的角度解答.1年前查看全部
大家在问
- 1描写当你坐在车上,看窗外的树快速过去时的悲伤心理,急啊!
- 2什么是双重趋避式冲突
- 31.学校打算对校园面积的9分之1进行绿化,绿化面积的3分之1用来种草.草坪的面积占校园面积的几分之几?
- 4师徒二人共做一批服装,开始,徒弟做的慢,当师傅做好20套时,徒弟只做了8套;以后,师傅每做6套,徒弟就能做4套;当师徒一
- 5甲、乙两数的和是36.3,如果将乙数的小数点向右移动一位则两数相等,甲数是多少?乙数是多少?
- 6在一草地上有一水泥地长为15m,宽带8m的长方形,在角上用一根长沙10m的绳子栓着一只羊,请问羊吃草的面积.
- 7横断山脉形成的原因是冰川搬运吗
- 8在正方形ABCD内做一个等边三角形BEC,连接AE,BE,则角BEC=
- 9哪些动物能做人类的老师
- 10惯性系指牛顿运动定律成立的参照系,非惯性系指牛顿运动定律不成立的参照系.这种说法对吗?
- 11广藿香挥发油的水蒸气蒸馏提取原理是什么
- 12在化学反应中易获得电子形成稳定结构的粒子是
- 13人教版七年级下册语文27还有29课课时夺冠答案
- 14冬季贝加尔湖部分湖面冰层薄甚至不结冰原因
- 15一辆自行车的车轮外直径是70厘米,通过一座大桥,车轮要转动8OO圈,大桥长多少米?(得数保留整数)


