多晶硅纯度钟提到的5N,8N,太阳能级和电子级多晶硅有什么区别?具体区分两个类别的参数标准是多晶硅的纯度吗?请给我个多晶
 浪花朵朵白2022-10-04 11:39:541条回答
浪花朵朵白2022-10-04 11:39:541条回答太阳能级和电子级多晶硅有什么区别?具体区分两个类别的参数标准是多晶硅的纯度吗?请给我个多晶硅的基础知识普及好吗,

已提交,审核后显示!提交回复
共1条回复
 lm773190 共回答了15个问题
lm773190 共回答了15个问题 |采纳率86.7%- N 是英文nine的简写,就是九,几N就是指其纯度是几个九,3N就是说其纯度是99.9%,4N就是99.99%.这是化学中高纯物质的通用表示法.主要就在于对纯度的控制,最明显的就在精馏工序,电子级和太阳能级的塔高和数量相差可大了.太阳能能多晶硅纯度为小数点后6个9,电子级多晶硅小数点12个9,整个工艺流程电子级比太阳能级在原料纯度,管道清洗,提纯塔,厂房洁净度等要求都要高.
- 1年前
相关推荐
- 多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热.研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有铁、镁等离子)制备BaCl2•2H2O,工艺流程如下.已知:①常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4.
②M (BaCO3)=197g/mol,M(BaCl2•2H2O)=244g/mol
(1)SiCl4水解反应的方程式为______,SiCl4水解控制在40℃的原因是______.
(2)已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol则由SiCl4制备硅的热化学方程式为______.
(3)加钡矿粉并调节pH=7的作用是使BaCO3转化为BaCl2和______.
(4)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是______.
(5)BaCl2滤液经______、冷却结晶、______、洗涤,再经真空干燥后得到BaCl2•2H2O. 看起来乐1年前1
看起来乐1年前1 -
 woyao2009 共回答了19个问题
woyao2009 共回答了19个问题 |采纳率94.7%解题思路:(1)氯化硅水解生成原硅酸和氯化氢;温度越高,氯化硅的水解速率越大,氯化氢的挥发越强;
(2)将两个方程式相加即得则由SiCl4制备硅的热化学方程式,注意焓变进行相应的改变;
(3)pH=3.4时,三价铁离子转化为氢氧化铁,当调节PH=7时能促使三价铁离子沉淀完全;
(4)根据氢氧化铁和氢氧化镁完全沉淀所需溶液的PH值确定滤渣A的成分;
(5)根据从溶液中析出固体的方法分析解答.(1)氯化硅水解生成原硅酸和氯化氢,水解方程式为SiCl4+4H2O=H4SiO4↓+4HCl,
温度高时,氯化硅的水解速率增大,氯化氢的挥发增强,且氯化氢能污染环境,温度较低时,能防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈,
故答案为:水解方程式为SiCl4+4H2O=H4SiO4↓+4HCl;防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈;
(2)将方程式SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol和SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol相加得SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol,
故答案为:SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol;
(3)pH=3.4时,三价铁离子完全生成沉淀,使Fe3+完全沉淀;盐酸和碳酸钡反应生成氯化钡和二氧化碳、水,加钡矿粉并调节pH=7的作用是使BaCO3转化为BaCl2,同时使使Fe3+完全沉淀,故答案为:使Fe3+完全沉淀;
(4)当pH=3.4时,铁离子完全生成沉淀,当pH=12.4时,镁离子完全沉淀生成氢氧化镁,Mg(OH)2,所以当pH=12.5时,滤渣A的成分是氢氧化镁,故答案为:Mg(OH)2;
(5)从溶液中制取固体的方法是:蒸发浓缩→冷却结晶→过滤→洗涤,故答案为:蒸发浓缩;过滤.点评:
本题考点: 制备实验方案的设计;用盖斯定律进行有关反应热的计算;影响盐类水解程度的主要因素;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了制备实验方案的有关知识,难度不大,明确从溶液中制取固体的方法,是高考的热点,但多以选择或填空形式考查.1年前查看全部
- 多晶硅薄膜的电学性质急用,论文
 xx的重庆帅哥1年前1
xx的重庆帅哥1年前1 -
 cjb964 共回答了20个问题
cjb964 共回答了20个问题 |采纳率85%多晶硅薄膜由于存在断键,从而造成了界面态密度,长沟道器件中可以可以用V型指数分布的态密度代入泊松房方程去求解.
基本和单晶硅一样.1年前查看全部
- 多晶硅的DcS dcs,tcs,tet个代表什么
 亲爱小楠1年前1
亲爱小楠1年前1 -
 vitamincs 共回答了16个问题
vitamincs 共回答了16个问题 |采纳率87.5%DCS SiH2Cl2 二氯二氢硅/二氯硅烷
& O7 B* I* l& z9 W# aTCS SiHCl3 三氯氢硅/三氯硅烷9 m8 c1 B& @- R!M+ O; U1 c9 E) N
STC SiCl4 也有记作TET的,四氯硅烷& T- X8 G" Y- K* N3 o1 k7 z
Polymer:聚硅烷;硅烷聚合物1年前查看全部
- 经营范围里的“化工产品”,都包括哪些?饲料添加剂,多晶硅,硒土算化工产品吗?木材应该算哪类?
 忘了该干吗1年前1
忘了该干吗1年前1 -
 NZHJ 共回答了15个问题
NZHJ 共回答了15个问题 |采纳率86.7%添加剂那些都属于化工产品,但木材我也不清楚是那一类,我觉得有点像建材类.1年前查看全部
- 多晶硅是太阳能光伏产业的重要基础.由石英砂可制取粗硅,其相关反应的热化学方程式为:
多晶硅是太阳能光伏产业的重要基础.由石英砂可制取粗硅,其相关反应的热化学方程式为:
SiO2(s)+C(s)═SiO(g)+CO(g)△H═a kJ•mol-1,
2SiO(g)═Si(s)+SiO2(s)△H═b kJ•mo-1
反应SiO2(s)+2C(s)═Si(s)+2CO(g)的△H═______kJ•mol-1(用含a、b的代数式表示). 6002286141年前1
6002286141年前1 -
 muq3000 共回答了20个问题
muq3000 共回答了20个问题 |采纳率100%解题思路:依据热化学方程式和盖斯定律计算得到所需热化学方程式;①SiO2(s)+C(s)═SiO(g)+CO(g)△H═a kJ•mol-1,
②2SiO(g)═Si(s)+SiO2(s)△H═b kJ•mo-1
依据盖斯定律①×2+②得到:SiO2(s)+2C(s)═Si(s)+2CO(g)的△H═(2a+b)KJ/mol;
故答案为:2a+b;点评:
本题考点: 热化学方程式.
考点点评: 本题考查了热化学方程式和盖斯定律计算应用,掌握基础是关键,题目较简单.1年前查看全部
- 多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl 4 为主,它环境污染很大,能遇水强烈水解,放出
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl 4 为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl 4 水解生成的盐酸和钡矿粉(主要成分为BaCO 3 ,且含有铁、镁等离子),制备BaCl 2 • 2H 2 O,工艺流程如下:
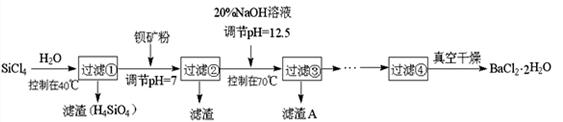
已知: ① 常温下Fe 3+ 、Mg 2+ 完全沉淀的pH分别是3.4、12.4;
② BaCO 3 的相对分子质量是197; BaCl 2 • 2H 2 O的相对分子质量是244;
(1)SiCl 4 发生水解反应的化学方程式__________________________________
(2)高温下,SiCl 4 (g) 用H 2 还原可制取纯度很高的硅,当反应中有1mol电子转移时吸收
59 kJ热量,则该反应的热化学方程式为__________________________________
(3)加钡矿粉调节pH=7的作用是:
①使BaCO 3 转化为BaCl 2 ②_______________________________
(4)生成滤渣A的离子方程式________________________________________
(5)BaCl 2 滤液经__________、_________、过滤、洗涤,再经真空干燥后得到BaCl 2 • 2H 2 O
(6)10吨含78.8% BaCO 3 的钡矿粉理论上最多能生成BaCl 2 • 2H 2 O___________吨。 xuetao5071年前1
xuetao5071年前1 -
 owenraul 共回答了13个问题
owenraul 共回答了13个问题 |采纳率92.3%(1)SiCl 4 +4H 2 O=H 4 SiO 4 ↓+4HCl (2分,写成H 2 SiO 3 且配平可给1分)
(2)SiCl 4 (g)+2H 2 (g)=Si(s)+4HCl(g) △H= +236 kJ/mol (2 分)
(3)使Fe 3+ 完全沉淀 (1分)
(4)Mg 2+ +2OH - = Mg(OH) 2 ↓( 1分)
(5)蒸发浓缩,降温结晶(2分)
(6)9.76 (2 分)
1年前查看全部
- 制备多晶硅时,有如下反应:Si+3HCl═X+H 2 ↑,X的化学式为( ) A.SiCl B.SiH 2 Cl 2
制备多晶硅时,有如下反应:Si+3HCl═X+H 2 ↑,X的化学式为( ) A.SiCl B.SiH 2 Cl 2 C.SiHCl 3 D.SiH 4  kktto1年前1
kktto1年前1 -
 困惑的ELLA 共回答了22个问题
困惑的ELLA 共回答了22个问题 |采纳率90.9%根据反应的化学方程式Si+3HCl═X+H 2 ↑,反应物中硅、氢、氯原子个数分别为1、3、3,反应后的生成物中硅、氢、氯原子个数分别为0、2、0,根据反应前后原子种类、数目不变,则每个X分子由1个硅原子、1个氢原子和3个氯原子构成,则物质X的化学式为SiHCl 3 .
故选C.1年前查看全部
- (2013•乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第
 (2013•乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒cigs(cis中掺入ga)等化合物薄膜太阳能电池以及薄膜si系太阳能电池.
(2013•乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒cigs(cis中掺入ga)等化合物薄膜太阳能电池以及薄膜si系太阳能电池.
(1)亚铜离子(cu+)基态时的价电子排布式表示为______.
(2)硒为第4周期元素,相邻的元素有***和溴,则这3种元素的第一电离能从大到小的顺序为______(用元素符号表示).
(3)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(h3bo3)在水溶液中能与水反应生成[b(oh)4]-而体现一元弱酸的性质.
①[b(oh)4]-中b的原子杂化类型为______.
②不考虑空间构型,[b(oh)4]-的结构可用示意图表示为______.
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的c原子换成si原子且同种原子不成键,则得如图所示的金刚砂(sic)结构;若在晶体硅所有si-si键中插入o原子即得sio2晶体.
①在sic中,每个c原子周围最近的c原子数目为______.
②判断a.sio2,b.干冰,c.冰三种晶体的熔点从小到大的顺序是______(填序号). ginew1年前1
ginew1年前1 -
 yqzhang0 共回答了16个问题
yqzhang0 共回答了16个问题 |采纳率93.8%解题思路:(1)根据构造原理写出其核外电子排布式;
(2)同一周期中元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素大于其相邻元素;
(3)①根据价层电子对互斥理论确定其杂化方式;
②[B(OH)4]-中含有配位键;
(4)①每个碳原子连接4个硅原子,每个硅原子又连接其它3个碳原子,据此判断每个C原子周围最近的C原子数目;
②根据晶体类型判断熔点大小,再根据分子晶体中是否含有氢键判断熔点高低.(1)铜是29号元素,铜原子失去一个电子变成亚铜离子,所以亚铜离子核外有28个电子,基态铜离子(Cu+)的价电子排布式为:3d10,故答案为:3d10;
(2)As、Se、Br属于同一周期且原子序数逐渐增大,这三种元素依次属于第IVA族、第VA族、第VIA族,第VA族元素大于其相邻元素的第一电离能,所以3种元素的第一电离能从大到小顺序为Br>As>Se,故答案为:Br>As>Se;
(3)①[B(OH)4]-中B的价层电子对=4+
1
2(3+1−4×1)=4,所以采取sp3杂化,故答案为:sp3;
②B原子是缺电子原子,所以该离子中还含有配位键,其结构为: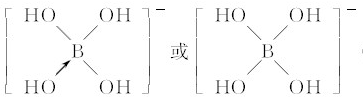 ,
,
故答案为: ;
;
(4)①每个碳原子连接4个硅原子,每个硅原子又连接其它3个碳原子,所以每个C原子周围最近的C原子数目为3×4=12,故答案为:12;
②原子晶体的熔点大于分子晶体,分子晶体中含有氢键的物质熔点大于不含氢键的物质,二氧化硅是原子晶体,冰属于分子晶体但其含有氢键,干冰属于分子晶体但不含氢键,所以三种晶体的熔点从小到大的顺序是b<c<a,故答案为:b<c<a.点评:
本题考点: 原子核外电子排布;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题涉及核外电子排布、第一电离能大小的比较、杂化方式的判断等知识点,难点是配位数的判断,会根据晶胞结构结合丰富想象力进行分析解答,难度较大.1年前查看全部
- 少子寿命的概念是什么?关于多晶硅的
 胡安台1年前1
胡安台1年前1 -
 3455532532 共回答了18个问题
3455532532 共回答了18个问题 |采纳率94.4%对于p型硅片,少子就是电子,所谓少子寿命就是当一定波长的光照射硅片后,硅片内就会出现电子-空穴对的分离,作为少数载流子的电子由于数量较少,在扩散过程中就会逐渐被复合掉,从产生到复合的时间即为少子寿命,一般单位为us(微秒).1年前查看全部
- 非晶硅,单晶硅,多晶硅英文怎么说?
 LIURONG02091年前2
LIURONG02091年前2 -
 leejia2006 共回答了13个问题
leejia2006 共回答了13个问题 |采纳率76.9%amorphous silicon
Monocrystalline silicon
polycrystalline silicon1年前查看全部
- (2010•扬州模拟)多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,
(2010•扬州模拟)多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热.研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有钙、铁、镁等离子)制备BaCl2•2H2O,工艺流程如下.已知常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4.

(1)SiCl4水解控制在40℃以下的原因是______.
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol;SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol
则由SiCl4制备硅的热化学方程式为______.
(2)加钡矿粉时生成BaCl2的离子反应方程式是______.
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是______,控制温度70℃的目的是______.
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到•2H2O.实验室中蒸发浓缩用到的含硅酸盐的仪器有______种.
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是______. 111111281年前1
111111281年前1 -
 拯救亡灵2007 共回答了17个问题
拯救亡灵2007 共回答了17个问题 |采纳率94.1%解题思路:(1)氯化硅水解生成原硅酸和氯化氢;温度越高,氯化硅的水解速率越大,氯化氢的挥发越强;将两个方程式相加即得则由SiCl4制备硅的热化学方程式,注意焓变进行相应的改变;
(2)钡矿粉时生成BaCl2是碳酸钡溶解于酸中反应生成;
(3)根据氢氧化铁和氢氧化镁完全沉淀所需溶液的PH值,氢氧化钙溶解度随温度升高减小确定滤渣A的成分;温度是为了除去钙离子;
(4)蒸发浓缩用到的含硅酸盐的仪器为玻璃仪器;根据从溶液中析出固体的方法分析解答.
(5)循环利用是过程中生成的物质可以再用在制备流程中的原料.(1)氯化硅水解生成原硅酸和氯化氢,水解方程式为SiCl4+4H2O=H4SiO4↓+4HCl,温度高时,氯化硅的水解速率增大,氯化氢的挥发增强,且氯化氢能污染环境,温度较低时,能防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈,
由盖斯定律可知:将方程式SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol和SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol相加得SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol,
故答案为:防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈;SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol;
(2)碳酸钡和盐酸反应生成氯化钡,反应的两种方程式为:BaCO3+2H+=Ba2++CO2+H2O↑,故答案为:BaCO3+2H+=Ba2++CO2+H2O↑;
(3)当pH=3.4时,铁离子完全生成沉淀,当pH=12.4时,镁离子完全沉淀生成氢氧化镁,Mg(OH)2,所以当pH=12.5时,滤渣A的成分是氢氧化镁,氢氧化钙;控制温度70℃的目的是确保钙离子完全除去,故答案为:Mg(OH)2,Ca(OH)2;确保钙离子完全除去(或温度越高,Ca(OH)2溶解度越小);
(4)从溶液中制取固体的方法是:蒸发浓缩→冷却结晶→过滤→洗涤,实验室中蒸发浓缩用到的含硅酸盐的仪器即为玻璃仪器,有蒸发皿、玻璃棒,酒精灯,故答案为:3;
(5)依据流程分析可知,该工艺中能循环利用的物质是BaCl2溶液,故答案为:BaCl2溶液.点评:
本题考点: 制备实验方案的设计;离子方程式的书写;盐类水解的应用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了物质制备流程分析判断,物质性质的应用,盐类水解、沉淀形成条件,杂质除去方法,试剂选择,离子方程式书写,盖斯定律应用,题目难度中等.1年前查看全部
- 关于硅太阳能电池的特性问题1、单晶硅、多晶硅、非晶硅的暗伏安特性说明了什么性质,与二极管有什么关系?2、单晶硅、多晶硅、
关于硅太阳能电池的特性问题
1、单晶硅、多晶硅、非晶硅的暗伏安特性说明了什么性质,与二极管有什么关系?
2、单晶硅、多晶硅、非晶硅光照时的开路电压、短路电流与光强的关系?
3、单晶硅、多晶硅、非晶硅光照时的输出特性?
4、单晶硅、多晶硅、非晶硅光强特性?
5、单晶硅、多晶硅、非晶硅的光谱灵敏度性质?
6、单晶硅、多晶硅、非晶硅光照时的温度特性? 辉Sir1年前1
辉Sir1年前1 -
 hanfengze 共回答了20个问题
hanfengze 共回答了20个问题 |采纳率90%单晶硅转化率高,单成本是三者之中最大的
多晶硅性价比是最高的
非晶硅吸收弱光性好,但转化率是最低的,成本也低,制备能耗少.1年前查看全部
- 多晶硅生产工艺流程如下:(1)粗硅粉碎的目的是______.分离SiHCl3(l)和SiCl4(l)的方法为______
多晶硅生产工艺流程如下:

(1)粗硅粉碎的目的是______.分离SiHCl3(l)和SiCl4(l)的方法为______.
(2)900℃以上,H2与SiHCl3发生如下反应:SiHCl3(g)+H2(g)⇌Si(s)+3HCl(g);△H>0,其平衡常数表达式为K=c3(HCl) c(SiHCl)×c(H2) .为提高还原时SiHCl3的转化率,可采取的措施有______.c3(HCl) c(SiHCl)×c(H2)
(3)该流程中可以循环使用的物质是______.
(4)SiCl4与上述流程中的单质发生化合反应,可以制得SiHCl3,其化学方程式为______. vv米1年前1
vv米1年前1 -
 我是留胡男 共回答了23个问题
我是留胡男 共回答了23个问题 |采纳率82.6%解题思路:(1)根据固体表面积越大,化学反应速率越快;根据互溶的液体采用蒸馏的方法分离;(2)根据平衡常数的概念;根据外界条件对平衡的影响;(3)根据化学根据反应物中和生成物中都有的物质考虑;(4)根据题目信息以及原子守恒来书写;(1)固体表面积越大,化学反应速率越快,粗硅粉碎的目的是增大接触面积,加快反应速率,充分反应;SiHCl3(l)和SiCl4(l)是互溶的液体,采用蒸馏的方法分离;
故答案为:增大接触面积,加快反应速率,充分反应;蒸馏;
(2)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=
c3(HCl)
c(SiHCl)×c(H2);
升高温度或增大氢气与SiHCl3的物质的量之比或增大氢气浓度,提高还原时SiHCl3的转化率,故答案为:升高温度或增大氢气与SiHCl3的物质的量之比或增大氢气浓度;
(3)由图示可知反应物有粗硅、HCl、H2;反应过程中生成物有:SiHCl3、H2、SiCl4、HCl,所以在反应物中和生成物中都有的物质是HCl、H2,所以流程中可循环使用的物质是HCl、H2;
故答案为:HCl、H2;
(4)SiCl4与上述流程中的硅和氢气发生化合反应,可以制得SiHCl3:3SiCl4+Si+2H2═4SiHCl3,故答案为:3SiCl4+Si+2H2═4SiHCl3;点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;化学平衡常数的含义.
考点点评: 本题涉及关硅和二氧化硅性质的综合题,难度较大,考查学生分析和解决问题的能力.1年前查看全部
- 多晶硅用太阳能发电,太阳能是先变成化学能再变成电能么
多晶硅用太阳能发电,太阳能是先变成化学能再变成电能么
如果不是,希望能帮我解释一下究竟是怎么变化的, jbfowx1年前3
jbfowx1年前3 -
 neo_suyunpeng 共回答了20个问题
neo_suyunpeng 共回答了20个问题 |采纳率95%不是的~是半导体晶硅材料的光生伏打效应,形成PN结,直接产生直流电
所以他是一个光能直接转化成电能的过程1年前查看全部
- 多晶硅生产精馏过程中主要是除去哪些物质?哪些物质易除去?哪些物质难除去?
 cff21年前1
cff21年前1 -
 玻璃娃娃的等待 共回答了15个问题
玻璃娃娃的等待 共回答了15个问题 |采纳率100%主要去除三氯氢硅中的痕量杂质即Mn、 Fe 、Ti、 Mg 、 Al、 Pb、 Ca、 Cr、 Cu、 Zn等金属杂质.
硼、磷可分别用自然挥发法和气相色谱法测定,所以易于去除.
镁、钙在水中含有少量不易去除 、铁等在设备中就含有,所以也不易去除1年前查看全部
- 多晶硅制成单晶硅的能耗指标是多少?
多晶硅制成单晶硅的能耗指标是多少?
如果一吨多晶硅制成单晶硅,能形成多少兆瓦的硅片,这个环节的耗能多少? 2haoha1年前1
2haoha1年前1 -
 e芒果雪芭e 共回答了24个问题
e芒果雪芭e 共回答了24个问题 |采纳率79.2%按20寸热场拉6寸硅片计算.
1吨多晶=950KG单晶方棒(按头尾料、边皮料、锅底料重复使用计算,大概有5%的原料损耗)
950KG单晶方棒=72200片(按每公斤出8英寸硅片78片)
每张6寸硅片按发电2.5W计算,能发电72200*2.5=180500W=0.1805兆瓦
能耗就得算成本了,不过估算需要反复拉晶18炉左右.按每炉运行50小时,60KW计算,拉晶需要电费54000千瓦时的电,另外人工、辅料、开方、切片的都还没算.1年前查看全部
- (2013•潍坊模拟)工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅.下图1是离子交换膜法(允许钠
(2013•潍坊模拟)工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅.下图1是离子交换膜法(允许钠离子通过,不允许氢氧根与氯离子通过)电解饱和食盐水,电解槽阳极产生的气体是______,NaOH溶液的出口为______(填字母),精制饱和食盐水的进口为______(填字母),干燥塔中应使用的液体是______.

(1)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注.SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4、H2、O2反应,产物有两种,化学方程式为SiCl4+2H2+O2
SiO2+4HCl高温 .SiCl4+2H2+O2.SiCl4可转化为SiCl3而循环使用.一定条件下,在20L恒容密闭容器中反应3SiCl4(g)+2H2(g)+Si(s)═4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗NaCl的质量为______kg.
SiO2+4HCl高温 .
(2)如图2,实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4⇌ZnSO4+H2↑,MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O△ ..
据此,从下列所给仪器装置中选择制备并收集H2的装置______(填代号)和制备并收集干燥、纯净Cl2的装置______(填代号).
可选用制备气体的装置:
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气.现制得氯酸钠213.0kg,则生成氢气______m3(标准状况).(忽略可能存在的其他反应) JHDDT11年前1
JHDDT11年前1 -
 qusar 共回答了22个问题
qusar 共回答了22个问题 |采纳率90.9%解题思路:电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;H2、2NaOH在阴极,NaOH溶液的出口为a,Cl2在阳极,精制饱和食盐水从阳极进入,要干燥Cl2需要用酸性干燥剂或中性干燥剂;
(1)SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可;
利用三段分析法,根据平衡时H2与SiHCl3物质的量浓度,求出的起始物质的量,再根据2NaCl+2H2O
Cl2↑+H2↑+2NaOH,求出理论上消耗纯NaCl的质量;电解 .
(2)根据反应物状态和反应条件选取反应装置,根据气体的溶解性、密度选取收集装置;
(3)根据得失电子守恒,NaCl转化为NaClO3所失去的电子等于H2O转化为H2所得到的电子,由氯酸钠的质量求出氯酸钠的物质的量,进而求出NaCl转化为NaClO3所失去的电子的物质的量,最后求出生成氢气在标准状况下的体积.电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,
阳极:2Cl--2e-═Cl2↑,
阴极:2H++2e-═H2↑;
总反应为:2NaCl+2H2O
电解
.
Cl2↑+H2↑+2NaOH,
阴极:氢离子放电,产生氢气.致使氢氧根离子浓度增大,钠离子和氢氧根离子的增大都发生在阴极室,所以a出口导出的液体是氢氧化钠溶液;
阳极:氯离子放电,产生氯气,致使钠离子浓度升高,通过阳离子交换膜到达阴极室.所以d入口应加入精制饱和食盐水;
要干燥Cl2需要用酸性干燥剂浓硫酸或P2O5等,中性干燥剂无水CaCl2.
故答案为:氯气;a;d;浓硫酸;
(1)①SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可,发生的化学方程式为:SiCl4+2H2+O2
高温
.
SiO2+4HCl;
②由3SiCl4(g)+2H2(g)+Si(s)⇌4SiHCl3(g)
起始量(mol)n0
变化量(mol)2xx4x
平衡量(mol)n-2x 4x
4x=0.020mol/L×20L=0.4mol,x=0.1mol,
n-2x=0.140mol/L×20L=2.8mol,n=3.0mol,
由2NaCl+2H2O
电解
.
Cl2↑+H2↑+2NaOH,
2mol 1mol
(2×58.5)g
1mol=
m(NaCl)
3mol,m(NaCl)=350g=0.35kg
故答案为:SiCl4+2H2+O2
高温
.
SiO2+4HCl;0.35;
(2)实验室用锌和稀硫酸制取氢气,该反应是固液混合态且不需要加热,所以不需要酒精灯,氢气不易溶于水且密度小于空气密度,所以可以采用向下排空气法或排水法收集,故选e;
实验室制取氯气是固液混合态且需要加热,所以需要酒精灯,氯气能溶于水且密度大于空气,所以采用向上排空气法收集,故选d;
(3)由NaCl转化为NaClO3,失去电子数为6,H2O转化为H2,得到的电子数为2,
设产生的H2体积为Vm3,
由得失电子守恒得:6×
213×103
116.5mol=2×
103V
22.4mol,V=134.4m3,故答案为:134.4.点评:
本题考点: 电解原理;化学方程式的有关计算.
考点点评: 本题考查电解、氯碱工业、化学平衡的计算、化学方程式书写、化学计算、仪器装置的选取等知识点,注意氧化还原反应中电子守恒法的运用.1年前查看全部
- 工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅.
工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅.

(1)图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是______;NaOH溶液的出口为______(填字母);精制饱和食盐水的进口为______(填字母);干燥塔中应使用的液体是______.
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用收到广泛关注.
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为______.
②SiCl4可转化为SiHCl3而循环使用.一定条件下,在20L恒容密闭容器中的反应:3SiCl4(g)+2H2(g)+Si(g) 4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为______kg.
4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为______kg.
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气______M3(标准状况). 情有独锺1年前1
情有独锺1年前1 -
 huangfast 共回答了10个问题
huangfast 共回答了10个问题 |采纳率90%解题思路:(1)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;H2、2NaOH在阴极,NaOH溶液的出口为a,Cl2在阳极,精制饱和食盐水从阳极进入,要干燥Cl2需要用酸性干燥剂或中性干燥剂.
(2)①SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可;
②利用三段分析法,根据平衡时H2与SiHCl3物质的量浓度,求出的起始物质的量,再根据2NaCl+2H2O
Cl2↑+H2↑+2NaOH,求出理论上消耗纯NaCl的质量;电解 .
(3)根据得失电子守恒,NaCl转化为NaClO3所失去的电子等于H2O转化为H2所得到的电子,由氯酸钠的质量求出氯酸钠的物质的量,进而求出NaCl转化为NaClO3所失去的电子的物质的量,最后求出生成氢气在标准状况下的体积.(1)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,
阳极:2Cl--2e-═Cl2↑,
阴极:2H++2e-═H2↑;
总反应为:2NaCl+2H2O
电解
.
Cl2↑+H2↑+2NaOH,
阴极:氢离子放电,产生氢气.致使氢氧根离子浓度增大,钠离子和氢氧根离子的增大都发生在阴极室,所以a出口导出的液体是氢氧化钠溶液;
阳极:氯离子放电,产生氯气,致使钠离子浓度升高,通过阳离子交换膜到达阴极室.所以d入口应加入精制饱和食盐水;
要干燥Cl2需要用酸性干燥剂浓硫酸或P2O5等,中性干燥剂无水CaCl2.
(2)①SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可.
发生的化学方程式为:SiCl4+2H2+O2
高温
.
SiO2+4HCl;
②由3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
起始量(mol)n 0
变化量(mol)2xx 4x
平衡量(mol)n-2x 4x
4x=0.020mol/L×20L=0.4mol,x=0.1mol,
n-2x=0.140mol/L×20L=2.8mol,n=3.0mol,
由2NaCl+2H2O
电解
.
Cl2↑+H2↑+2NaOH,
2mol 1mol
[2×58.5g/1mol=
m(NaCl)
3mol]; m(NaCl)=351g=0.351kg.
(3)由NaCl转化为NaClO3,失去电子数为6,H2O转化为H2,得到的电子数为2,
设产生的H2体积为Vm3,
由得失电子守恒得:6×
213×103g
116.5gmol−1=2×
Vm3×103L•m−3
22.4L•mol−1;
V=134.4m3.
故答案为:(1)①氯气;a;d;浓硫酸;
(2)①SiCl4+2H2+O2
高温
.
SiO2+4HCl;②0.351;
(3)134.4.点评:
本题考点: 氯碱工业;化学平衡的计算;硅和二氧化硅.
考点点评: 本题考查电解、氯碱工业、化学平衡的计算、化学方程式书写、化学计算等知识.1年前查看全部
- (2014•松江区一模)多晶硅被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解
(2014•松江区一模)多晶硅被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热.研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有铁、镁等离子)制备BaCl2•2H2O,工艺流程如图:

已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4.
(1)SiCl4水解反应的化学方程式为______.过滤操作需要的玻璃仪器有______.
(2)加钡矿粉调节pH=7的作用是______、______.
(3)加20%NaOH调节pH=12.5,得到滤渣A的主要成分是______.
(4)BaCl2滤液经______、______、过滤、洗涤,再经真空干燥后得到BaCl2•2H2O.
(5)10吨含78.8%BaCO3的钡矿粉理论上最多能生成BaCl2•2H2O______吨.实际产量为9.70吨,相对误差为______%. xl_lemon1年前1
xl_lemon1年前1 -
 穆岩生 共回答了16个问题
穆岩生 共回答了16个问题 |采纳率87.5%解题思路:(1)SiCl4遇水强烈水解,生成盐酸和滤渣(H4SiO4),放出大量的热,故SiCl4的水解生成为H4SiO4沉淀和HCl;过滤操作需要的主要仪器有:烧杯、漏斗、滤纸、玻璃棒;
(2)盐酸中加钡矿粉时,盐酸和碳酸钡反应生成氯化钡和二氧化碳、水,消耗了盐酸,溶液pH变大,pH>3.4时,三价铁离子完全生成沉淀,使Fe3+完全沉淀,故钡矿粉两个作用:转化为BaCl2、使Fe3+完全沉淀,加钡矿粉的同时也是调节PH值的过程;
(3)当pH=12.4时,镁离子完全沉淀生成Mg(OH)2,所以当pH=12.5时,滤渣A的成分是氢氧化镁;
(4)从溶液中制取固体的方法是:蒸发浓缩→冷却结晶→过滤→洗涤;
(5)由原子守恒知,1molBaCO3能生成1molBaCl2•2H2O,n(BaCl2•2H2O)=n(BaCO3);以此分析相对误差的计算.SiCl4水解生成盐酸和硅酸,硅酸不溶解,故第一步操作中的滤液为盐酸溶液,向其中加入钡矿粉(主要成份为BaCO3,且含有铁、镁等离子),钡矿粉和盐酸反应,BaCO3转化为BaCl2,溶液中H+减少,PH变大,Fe3+沉淀为氢氧化铁,得到的溶液含有Ba2+、Mg2+和Cl-,过滤后的滤液中含有Ba2+、Mg2+和Cl-,向滤液中加20%NaOH调节pH=12.5,生成氢氧化镁沉淀,滤液主要成分为Cl-和Ba2+,蒸发浓缩、冷却结晶、过滤、洗涤、干燥后得BaCl2•2H2O;
(1)SiCl4遇水强烈水解,生成盐酸和滤渣(H4SiO4),放出大量的热,故SiCl4的水解方程式为:SiCl4+4H2O=H4SiO4↓+4HCl;过滤操作需要的主要仪器有:烧杯、漏斗、滤纸、玻璃棒,其中滤纸不是玻璃仪器;
故答案为:SiCl4+4H2O=H4SiO4↓+4HCl;烧杯、漏斗、玻璃棒;
(2)盐酸中加钡矿粉时,盐酸和碳酸钡反应生成氯化钡和二氧化碳、水,消耗了盐酸,溶液pH变大,pH>3.4时,三价铁离子完全生成沉淀,使Fe3+完全沉淀;故钡矿粉两个作用:转化为BaCl2、使Fe3+完全沉淀;
故答案为:使BaCO3转化为BaCl2;使Fe3+完全沉淀;
(3)当pH=3.4时,铁离子完全生成沉淀,当pH=12.4时,镁离子完全沉淀生成Mg(OH)2,所以当pH=12.5时,滤渣A的成分是氢氧化镁;
故答案为:Mg(OH)2;
(4)从溶液中制取固体的方法是:蒸发浓缩→冷却结晶→过滤→洗涤,
故答案为:蒸发浓缩;冷却结晶;
(5)由原子守恒知,1molBaCO3能生成1molBaCl2•2H2O,n(BaCl2•2H2O)=n(BaCO3)
m(BaCl2•2H2O)=n(BaCl2•2H2O)×M(BaCl2•2H2O)=[10t×78%/197g/mol]×244g/mol=9.76t,
实际产量为9.70吨,相对误差=[实验测得的数值−真实数值/真实数值]×100%=[9.76−9.70/9.76]×100%≈-0.61%,
故答案为:9.76;-0.61.点评:
本题考点: 制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查制备实验方案的设计,物质分离和提纯的方法和基本操作的应用,明确考查从溶液中制取固体的方法,以及根据原子守恒计算和相对误差的计算等,难度不大,但考查知识较多.1年前查看全部
- 工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。

(1)上图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是________;NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母);干燥塔中应使用的液体是________。
(2)多晶硅主要采用SiHCl 3 还原工艺生产,其副产物SiCl 4 的综合利用受到广泛关注。
①SiCl 4 可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl 4 与H 2 和O 2 反应,产物有两种,化学方程式为___________________________________。
②SiCl 4 可转化为SiHCl 3 而循环使用,一定条件下,在20 L恒容密闭容器中的反应:
3SiCl 4 (g)+2H 2 (g)+Si(s) 4SiHCl 3 (g)
4SiHCl 3 (g)
达平衡后,H 2 和SiHCl 3 物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H 2 全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0 kg,则生成氢气________m 3 (标准状况)。 宝宝凌1年前1
宝宝凌1年前1 -
 m339023 共回答了22个问题
m339023 共回答了22个问题 |采纳率100%(1)氯气 a d 浓硫酸 (2)①SiCl 4 +2H 2 +O 2 SiO 2 +4HCl ②0.35 (3)134.4
SiO 2 +4HCl ②0.35 (3)134.4
(1)电解饱和食盐水的电极反应分别为:阴极:2H + +2e - =H 2 ↑;阳极:2Cl - -2e - =Cl 2 ↑。所以阳极产物为氯气,H + 在阴极放电,水中的c(OH - )增大,即NaOH在阴极(a处)产生。电解饱和食盐水所用的阳离子交换膜只允许阳离子(Na + )通过,阻止阴离子和气体通过,电解过程中,Cl - 在阳极大量消耗,因此应在阳极区(d处)补充NaCl干燥塔干燥的气体为Cl 2 ,应用浓H 2 SO 4 。
(2)①光导纤维为SiO 2 ,产物为两种,另一种物质只能为HCl。
②n(H 2 )= ×20=3 mol。
×20=3 mol。
由2NaCl+2H 2 O 2NaOH+H 2 ↑+Cl 2 ↑
2NaOH+H 2 ↑+Cl 2 ↑
2×58.5 2
m(NaCl) 6 g
m(NaCl)=351 g≈0.35 kg。
(3)由题意,可写出反应的化学方程式为:
NaCl+3H 2 O NaClO 3 +3H 2 ↑
NaClO 3 +3H 2 ↑
106.5 6
213 kg m(H 2 )
m(H 2 )=12 kg,n(H 2 )=6 000 mol,V(H 2 )=134.4 m 3 。1年前查看全部
- 多晶硅怎么翻译
 黑骑1年前1
黑骑1年前1 -
 lanmeng_528 共回答了18个问题
lanmeng_528 共回答了18个问题 |采纳率94.4%polysilicon n.多晶硅
例句:The refractory metals and refractory metal silicides that are used to augment or replace the polysilicon are generally deposited by physical vapor deposition processes.
用于增强和取代多晶硅的难熔金属和难熔金属硅化物通常是用物理蒸发沉积工艺沉积的.1年前查看全部
- 电子厂 多晶硅的清洗 硝酸和氢氟酸的比例是多少?
电子厂 多晶硅的清洗 硝酸和氢氟酸的比例是多少?
工种叫做洗料,就是把清洗多晶硅,目的就是清洗之后让原料看起来发亮,硝酸和氢氟酸的比例是多少.听大家都说是10比1,但是是体积比还是物质的量比?洗完第一批之后还要加入硝酸和氢氟酸,加入的比例又是多少?知道的说下哦.. facethemusic1年前3
facethemusic1年前3 -
 sl160 共回答了12个问题
sl160 共回答了12个问题 |采纳率83.3%硝酸与氢氟酸体积比10:1到2:1之间都可以,硝酸量多能增大腐蚀速度,所以一般用10:1.由于反应中硝酸与氢氟酸的体积比是4:18,所以每次添加腐蚀液可可较原始配方,减小硝酸与氢氟酸的比例,例如5:1,4:1,3:1,均可,看其腐蚀速度而定1年前查看全部
- (2012•扬州)制备多晶硅时,有如下反应:Si+3HCl═X+H2↑,X的化学式为( )
(2012•扬州)制备多晶硅时,有如下反应:Si+3HCl═X+H2↑,X的化学式为( )
A.SiCl
B.SiH2Cl2
C.SiHCl3
D.SiH4 aii1年前1
aii1年前1 -
 nnml 共回答了13个问题
nnml 共回答了13个问题 |采纳率84.6%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.根据反应的化学方程式Si+3HCl═X+H2↑,反应物中硅、氢、氯原子个数分别为1、3、3,反应后的生成物中硅、氢、氯原子个数分别为0、2、0,根据反应前后原子种类、数目不变,则每个X分子由1个硅原子、1个氢原子和3个氯原子构成,则物质X的化学式为SiHCl3.
故选C.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解答此类题的关键.1年前查看全部
- 英语翻译四氯化硅是生产多晶硅的废料,对环境有很大的破坏作用,对四氯化硅的利用不仅能够变废为宝,还能够促进新产业的发展.本
英语翻译
四氯化硅是生产多晶硅的废料,对环境有很大的破坏作用,对四氯化硅的利用不仅能够变废为宝,还能够促进新产业的发展.本文根据四氯化硅与氢氧化钙的水解反应原理,设计出四氯化硅与氢氧化钙的反应制备出硅酸钙的工艺,全面分析工艺组成中的四氯化硅水解系统、原硅酸脱水系统、硅酸钙生成系统的特点,研究工艺过程的影响因素,通过试验,制备出的硅酸钙符合国家标准;在此基础上探讨了工艺副产物的利用.本文的研究有助于解决多晶硅生产废物的严重污染问题,又可大幅度降低多晶硅生产成本,极大提高产业经济效益,对发展***多晶硅和太阳能产业具有十分重要的作用. ss2010081年前1
ss2010081年前1 -
 ysy_f 共回答了20个问题
ysy_f 共回答了20个问题 |采纳率90%The silicon tetrachloride is produces the polycrystalline silicon the waste material, has the very big destructive effect to the environment, not only can recycle waste to the silicon tetrachloride use, but also can promote the new industrial development.This article according to the silicon tetrachloride and the calcium hydroxide hydrolitic reaction principle, designs the silicon tetrachloride and the calcium hydroxide response prepares the calcium silicate the craft, analyzes in the craft composition comprehensively the silicon tetrachloride hydrolysis system, the ortho-silicic acid dehydration system, the calcium silicate production system characteristic, the research technological process influence factor, through the experiment, the calcium silicate which prepares conforms to the national standards; Has discussed the craft by-product use in this foundation.This article research is helpful to the solution polycrystalline silicon production waste serious contamination concern, also may reduce the polycrystalline silicon production cost large scale, enhances the industrial economic efficiency enormously, to develops our country polycrystalline silicon and the solar energy industry has the extremely vital role.1年前查看全部
- 多晶硅与硝酸加氢氟酸反应生成的黄色烟雾是什么?
多晶硅与硝酸加氢氟酸反应生成的黄色烟雾是什么?
多晶硅与一定比例的硝酸和氢氟酸反应生成的黄色烟雾是什么东西? wqlemon1年前4
wqlemon1年前4 -
 vronsky 共回答了16个问题
vronsky 共回答了16个问题 |采纳率93.8%应该是二氧化氮,硝酸和氢氟酸比例应该是2:1至10:1,硝酸和氢氟酸都是刻蚀溶液,硅的腐蚀问题.硝酸是氧化剂,氢氟酸作络合剂.
3Si+4HNO3=3SiO2+2H2O+4NO
2NO+O2==2NO2
SiO2+6HF=H2[SiF6]+2H2O
由于生成的NO在空气中遇到氧气生成NO2是黄色1年前查看全部
- 为什么太阳能电池的单晶硅的发电量为25%,而多晶硅的发电量为20.4%.是不是以平方为单位而产出的电量.
 52lena1年前1
52lena1年前1 -
 yinghanwen123 共回答了24个问题
yinghanwen123 共回答了24个问题 |采纳率100%与面积无关,不是以平方为单位产出的电量.是太阳光能转化成电能的比例,面积大小比例是不变的,也叫发电效率.单晶和多晶因为晶体结构不同,发电效率也不同.你说的是实验室的发电效率,实际应用中还达不到上述指标.1年前查看全部
- 多晶硅每立方米的重量是多少?
 朱烨651年前1
朱烨651年前1 -
 钓鱼郎154 共回答了21个问题
钓鱼郎154 共回答了21个问题 |采纳率85.7%约2.34——2.53吨1年前查看全部
- 每立方米多晶硅矿有多重
 九条兼实1年前1
九条兼实1年前1 -
 复活节彩蛋 共回答了18个问题
复活节彩蛋 共回答了18个问题 |采纳率83.3%中信珍珠岩厂权威回答珍珠岩60-70公斤一立方 2.2-2.4*10^3kg/m^3 (它们的密度的范围) 强度尚可 大概在50公斤左右1年前查看全部
- 多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl 4 为主,它对环境污染很大,能遇水强烈水解,放
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl 4 为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl 4 水解生成的盐酸和钡矿粉(主要成分为BaCO 3 ,且含有钙、铁、镁等离子)制备BaCl 2 ·2H 2 O,工艺流程如图所示。已知常温下Fe 3 + 、Mg 2 + 完全沉淀的pH分别是3.4、12.4。

(1)SiCl 4 水解控制在40 ℃的原因是___________________________________。
已知:SiCl 4 (s)+H 2 (g)=SiHCl 3 (s)+HCl(g) ΔH 1 =+47 kJ·mol - 1
Si(s)+3HCl(g)=SiHCl 3 (s)+H 2 (g) ΔH 2 =-189 kJ·mol - 1
则由SiCl 4 制备硅的热化学方程式为__________________________________。
(2)加钡矿粉时生成BaCl 2 的离子反应方程式是_________________________。
(3)加20% NaOH溶液调节pH=12.5,得到滤渣A的主要成分是________,控制温度70 ℃的目的是____________________________________________。
(4)BaCl 2 滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到BaCl 2 ·2H 2 O。实验室中蒸发浓缩,用到的含硅酸盐的仪器有__________种。
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是____________。 sun_winter1年前1
sun_winter1年前1 -
 车仁俊 共回答了14个问题
车仁俊 共回答了14个问题 |采纳率92.9%(1)防止HCl挥发污染环境或控制SiCl 4 的水解速率,防止反应过于剧烈 SiCl 4 (s)+2H 2 (g)=Si(s)+4HCl(g) ΔH=+236 kJ·mol - 1
(2)BaCO 3 +2H + =Ba 2 + +CO 2 ↑+H 2 O
(3)Mg(OH) 2 、Ca(OH) 2 确保钙离子完全除去[或温度越高,Ca(OH) 2 溶解度越小]
(4)3 (5)BaCl 2
根据题中信息SiCl 4 与水反应时,强烈水解并放出大量的热,控制温度较低,可以降低反应速率,减少HCl的挥发。将题给的两个热化学方程式相减,便得到制硅的热化学方程式。(2)过滤后溶液为盐酸,与碳酸钡发生反应,碳酸钡难溶,写离子方程式时,应保留化学式。(3)根据题中的信息,常温下Fe 3 + 、Mg 2 + 完全沉淀的pH分别是3.4、12.4,因此调节pH=7时滤渣的主要成分是Fe(OH) 3 ,pH=12.5时滤渣的主要成分是Mg(OH) 2 ,同时控制温度较高时,Ca(OH) 2 溶解度减小,有Ca(OH) 2 生成。(4)蒸发浓缩时,需要用到酒精灯、蒸发皿、玻璃棒。(5)过滤④的滤液中含有大量的氯化钡,可以循环利用。1年前查看全部
大家在问
- 1月月在计算一道题小数除法的计算题时,把商的小数点点错了一位,所得的商多了10.8,正确的商是多少?
- 2"碁"大家知道这个字念什么吗?广州番禹的一个镇 叫石碁
- 3He is a man. We should all learn from him.合并为一句
- 4为什么农夫山泉的矿泉水350ml的和550ml的一个价
- 5my holiday小学英语作文
- 6计算:(1)6又8分之1 减 (9又23分之15 减 3又8分之7)= 2又5分之4 减 1又4分之3 加 7又5分之1
- 7矩形ABCD中,E在AB边上,F在BC边上,∠EDF=∠BDC,DE交AC于G,DF交AC于H.AB/BC=1/1求证:
- 818分之7和27分之5的通分
- 9修改病句:一年有四个春夏秋冬季节.
- 10急求一道线性变换的题目
- 11做一个长6厘米,宽5厘米,高4厘米,的正方体包装箱,至少用多少平方厘米的纸板 这个包装箱的体积是多少立
- 12He read a book in the library.(对划线部分提问)_______ ___________he
- 13不论用什么数值代替式中的字母,它的左右边的值总是相等的是、等式,叫做恒等式,有数字组成的正确的式子也叫恒等式,.请你根据
- 14英语翻译1811年春,父亲在霍詹维尔东北10英里处的诺布河畔买下了一块230英MOU的土地栖身,那里的土壤肥沃,移民也较
- 1542的因数,又是7的倍数的数有哪些().().()
