华雪同学对氯化镁固体样品(仅含杂质NaCl)进行如下检测:取5.0g样品溶于一定量的水中得到25.0g溶液,再加入溶质质
 zgw4352022-10-04 11:39:541条回答
zgw4352022-10-04 11:39:541条回答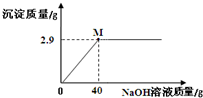 华雪同学对氯化镁固体样品(仅含杂质NaCl)进行如下检测:取5.0g样品溶于一定量的水中得到25.0g溶液,再加入溶质质量分数为10%的氢氧化钠溶液,实验时得到沉淀的质量与加入NaOH溶液的质量关系如图所示:
华雪同学对氯化镁固体样品(仅含杂质NaCl)进行如下检测:取5.0g样品溶于一定量的水中得到25.0g溶液,再加入溶质质量分数为10%的氢氧化钠溶液,实验时得到沉淀的质量与加入NaOH溶液的质量关系如图所示:请计算在M点时所得溶液溶质质量分数(最后结果精确到0.1%).

已提交,审核后显示!提交回复
共1条回复
 aa的天地 共回答了17个问题
aa的天地 共回答了17个问题 |采纳率100%- 解题思路:根据图表可知生成沉淀的质量就是氢氧化镁的质量,利用氢氧化镁的质量求出参加反应氯化镁的质量以及生成氯化钠的质量,进而求出在M点时所得溶液溶质质量分数即可
设生成2.9g氢氧化镁沉淀时,消耗氯化镁的质量为x,生成氯化钠的质量是y.MgCl2+2NaOH═Mg(OH)2↓+2NaCl9558&n...
点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题是一道有关物质组成的综合计算题,包括根据化学方程式的计算,有关溶液中溶质质量分数的计算,考查了学生根据实验数据分析反应情况的能力. - 1年前
相关推荐
- 华雪同学对氯化镁固体样品(仅含杂质NaCl)进行如下检测:取5.0g样品溶于一定量的水中得到25.0g溶液,再加入溶质质
华雪同学对氯化镁固体样品(仅含杂质NaCl)进行如下检测:取5.0g样品溶于一定量的水中得到25.0g溶液,再加入溶质质量分数为10%的氢氧化钠溶液,实验时得到沉淀的质量与加入NaOH溶液的质量关系如图所示:请计算在M点时所得溶液溶质质量分数(最后结果精确到0.1%)。
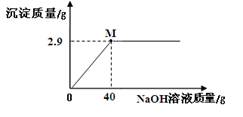
 zuihouyici1年前1
zuihouyici1年前1 -
 doncici 共回答了26个问题
doncici 共回答了26个问题 |采纳率96.2%9.8%
1年前查看全部
- (2013•株洲)华雪同学想制取“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液.请回答下列问题:
(2013•株洲)华雪同学想制取“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液.请回答下列问题:
(1)若用氢氧化钠固体配制,需称取氢氧化钠——
g.
(2)若用25%的氢氧化钠溶液配制,需要25%的氢氧化钠溶液——
g;蒸馏水——
g;配制时应选用——
mL(选填“10”、“20”、“50”、'100“)的量筒量取蒸馏水.
(3)下列操作正确的是——
.
A、在托盘天平的左右盘上垫滤纸称取氢氧化钠固体
B、将准确称取的氢氧化钠固体直接倒入装有水的量筒中溶解
C、将配制好的NaOH溶液装入玻璃试剂瓶中,塞好橡胶塞并贴上标签 北纬230111年前1
北纬230111年前1 -
 bieaiwoqq 共回答了19个问题
bieaiwoqq 共回答了19个问题 |采纳率89.5%(1)5
(2)20 30 50
(3)C
分析:
(1)若用氢氧化钠固体配制,需称取氢氧化钠的质量=50克×10%=5克
(2)若用25%的氢氧化钠溶液配制,需要25%的氢氧化钠溶液质量=5克÷25%=20克,需要加入稀释的蒸馏水的质量m水=50克-20克=30克,需要蒸馏水的体积V水=m水/ρ水=30克÷1.0克/厘米³=30厘米³=30毫升.用量筒量取水的体积时,为了能一次性量出且准确点,所用量筒的量程比要量取水的体积大一点即可,因此选用50mL的量筒.
(3)A错误,因为氢氧化钠固体有很强的腐蚀性,所以不能垫纸称量,而要放在烧杯里称量.B错误,量筒不能用于溶液的配制,配制溶液要在烧杯里进行,量筒只能用来测量液体的体积.1年前查看全部
- 华雪同学想制取“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液.请回答下列问题:
华雪同学想制取“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液.请回答下列问题:
(1)若用氢氧化钠固体配制,需称取氢氧化钠______g.
(2)若用25%的氢氧化钠溶液配制,需25%的氢氧化钠溶液______g;蒸馏水______g;配制时应选用______mL(选填“10”、“20”、“50”、“100”)的量筒量取蒸馏水.
(3)下列操作正确的是______.
A.在托盘天平的左右托盘上垫滤纸称取氢氧化钠固体
B.将准确称取的氢氧化钠固体直接倒入装有水的量筒中溶解
C.将配制好的NaOH溶液装入玻璃试剂瓶中,塞好橡胶塞并贴上标签. bbscom1年前1
bbscom1年前1 -
 杏花春雪 共回答了17个问题
杏花春雪 共回答了17个问题 |采纳率82.4%解题思路:(1)利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量.
(2)根据溶液稀释前后,溶质的质量不变;从减小实验误差的角度去选择量筒的量程,结合题意进行分析解答.
(3)A、根据氢氧化钠具有腐蚀性进行分析判断.
B、溶解操作应在烧杯中进行,不能在量筒中进行.
C、溶液配制完成后,应装入玻璃试剂瓶中,塞好橡胶塞并贴上标签.(1)若用氢氧化钠固体配制,配制50g质量分数为10%的氢氧化钠溶液,需要氢氧化钠固体的质量为50g×10%=5g.
(2)若用25%的氢氧化钠溶液配制,溶液稀释前后,溶质的质量不变,设需25%的氢氧化钠溶液的质量为x,则25%x=50g×10%,x=20g;需要蒸馏水的质量为50g-20g=30g(合30mL);选取量筒时,尽量选用能一次量取的最小规格的量筒.用50mL量筒量取30mL蒸馏水,误差最小,量筒选择合理.
(3)A、氢氧化钠具有腐蚀性,不能放在纸片上称量,应放在玻璃器皿中称量,故选项说法错误.
B、溶解操作应在烧杯中进行,不能在量筒中进行,故选项说法错误.
C、将配制好的NaOH溶液装入玻璃试剂瓶中,塞好橡胶塞并贴上标签,故选项说法正确.
故答案为:(1)5;(2)20;30;50;(3)C.点评:
本题考点: 一定溶质质量分数的溶液的配制;测量容器-量筒;称量器-托盘天平.
考点点评: 本题难度不大,明确配制一定溶质质量分数的溶液的有关计算、实验步骤、注意事项是正确解答本题的关键.1年前查看全部
- (2014•株洲)胆矾晶体部分失水后得到某硫酸铜晶体(CuSO4•xH2O),华雪同学为研究CuSO4•xH2O加热后所
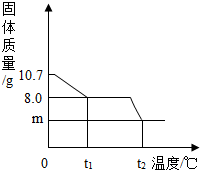 (2014•株洲)胆矾晶体部分失水后得到某硫酸铜晶体(CuSO4•xH2O),华雪同学为研究CuSO4•xH2O加热后所得物质的组成,做了以下实验:取10.7gCuSO4•xH2O晶体加热使其分解,绘制出固体的质量随温度的变化关系图.如图所示,到t1℃时该固体完全失去结晶水,化学方程式为:CuSO4•xH2O
(2014•株洲)胆矾晶体部分失水后得到某硫酸铜晶体(CuSO4•xH2O),华雪同学为研究CuSO4•xH2O加热后所得物质的组成,做了以下实验:取10.7gCuSO4•xH2O晶体加热使其分解,绘制出固体的质量随温度的变化关系图.如图所示,到t1℃时该固体完全失去结晶水,化学方程式为:CuSO4•xH2O
CuSO4+xH2O↑.△ .
(1)计算该硫酸铜晶体(CuSO4•xH2O)中x的值.(CuSO4•xH2O的相对分子质量为:160+18x)
(2)CuSO4中铜元素的质量分数是多少?
(3)升温到t2℃,残留固体是黑色物质,则m=______g.(写出求m的过程) 单单鱼1年前1
单单鱼1年前1 -
 这里好 共回答了18个问题
这里好 共回答了18个问题 |采纳率88.9%解题思路:(1)由图示数据和“到t1℃时该固体完全失去结晶水”可知,结晶水的质量=10.7g-8.0g=2.7g;然后根据胆矾晶体受热分解的化学方程式和胆矾与结晶水的质量,列出比例式,就可计算出胆矾晶体中x的值;
(2)根据化合物中元素的质量分数=[相对原子质量×原子个数/相对分子质量]×100%,进行分析解答;
(3)因为升温到t2℃时是硫酸铜受热继续分解,根据质量守恒定律,生成物质中一定有Cu,预测黑色物质,并求出m.(1)由图示数据和“到t1℃时该固体完全失去结晶水”可知,结晶水的质量为:10.7g-8.0g=2.7g
CuSO4•xH2O
△
.
CuSO4+xH2O↑.
160 18x
8g 2.7g
[160/8g=
18x
2.7g]
x=3;
(2)CuSO4中铜元素的质量分数=[64/64+32+16×4×100%=40%;
(3)铜元素的质量=8.0g×40%=3.2g.
根据原子守恒,黑色物质中一定含有氧化铜,化学式CuO;
因为黑色物质是CuO,由Cu元素守恒得
m(CuO)=3.2g÷
64
80]=4.0g.
答:(1)该硫酸铜晶体(CuSO4•xH2O)中x的值为5;
(2)CuSO4中铜元素的质量分数是40%;
(3)升温到t2℃,残留固体是黑色物质,则m=4.0.点评:
本题考点: 根据化学反应方程式的计算;元素的质量分数计算.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 华雪同学想制取“叶脉书签”,需要50g溶质质量分数为10%的氢氧化钠溶液,她若用25%的氢氧化钠溶液配制,则需要25%的
华雪同学想制取“叶脉书签”,需要50g溶质质量分数为10%的氢氧化钠溶液,她若用25%的氢氧化钠溶液配制,则需要25%的氢氧化钠溶液______g;蒸馏水______g.
 rayspecter1年前1
rayspecter1年前1 -
 uu5213sx4 共回答了28个问题
uu5213sx4 共回答了28个问题 |采纳率78.6%解题思路:利用溶质质量=溶液质量×溶质的质量分数,根据溶液稀释前后,溶质的质量不变,结合题意进行分析解答.需要50g溶质质量分数为10%的氢氧化钠溶液,她若用25%的氢氧化钠溶液配制,设需要25%的氢氧化钠溶液的质量为x,溶液稀释前后,溶质的质量不变,则50g×10%=25%x,x=20g;需要蒸馏水的质量为50g-20g=30g.
故答案为:20;30.点评:
本题考点: 有关溶质质量分数的简单计算.
考点点评: 本题难度不大,掌握溶液稀释前后溶质的质量不变、溶质质量分数的有关计算并能灵活运用是正确解答本题的关键.1年前查看全部
- 华雪同学想制取“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液.请回答下列问题:
华雪同学想制取“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液.请回答下列问题:
(1)若用氢氧化钠固体配制,需称取氢氧化钠______g.
(2)若用25%的氢氧化钠溶液配制,需25%的氢氧化钠溶液______g;蒸馏水______g;配制时应选用______mL(选填“10”、“20”、“50”、“100”)的量筒量取蒸馏水.
(3)下列操作正确的是______.
A.在托盘天平的左右托盘上垫滤纸称取氢氧化钠固体
B.将准确称取的氢氧化钠固体直接倒入装有水的量筒中溶解
C.将配制好的NaOH溶液装入玻璃试剂瓶中,塞好橡胶塞并贴上标签
(4)在实验室配制氢氧化钠溶液时,______(填“要”或“不要”)用到玻璃棒.
(5)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应______.
A.增加适量氢氧化钠固体 B.减少适量氢氧化钠固体 C.调节游码D.添加砝码
(6)(2)会导致所得溶液溶质质量分数偏小的选项有哪些?______
A.氢氧化钠中有杂质 B.称量时使用了生锈的砝码
C.用量筒量取水时,仰视读数 D.配制完成后移取液体时有部分溅出. 朱朱bu哭1年前1
朱朱bu哭1年前1 -
 云淡风清8513 共回答了16个问题
云淡风清8513 共回答了16个问题 |采纳率93.8%解题思路:(1)根据溶质质量=溶液质量×溶质质量分数计算;
(2)根据溶液质量=溶质质量÷溶质质量分数、要配制的溶液的质量减去需要的溶液的质量就是所需水的质量和量筒规格的选择依据解答;
(3)A、根据氢氧化钠具有强烈的腐蚀性,必须放在玻璃器皿中称量解答;
B、根据溶解不能在量筒中进行,一般在烧杯中进行解答;
C、根据配制好的溶液要装瓶并贴好标签以备使用解答.
(4)配制溶液要用玻璃棒搅拌以加快溶解的速度解答;
(5)根据称量时左物右码,指针指向的那边质量大解答;
(6)根据溶质质量分数=[溶质质量/溶液质量]×100%解答.(1)所需溶质的质量50g×10%=5g;
(2)需要25%的溶液的质量为[5g/25%]=20g,需要水的质量为50g-20g=30g;30g水合30ml和50mL的量筒最接近,所以选择50mL的量筒;
(3)A、氢氧化钠具有强烈的腐蚀性,必须放在玻璃器皿中称量;
B、溶解不能在量筒中进行,一般在烧杯中进行;
C、配制好的溶液要装瓶并贴好标签以备使用.
(4)配制溶液要用玻璃棒搅拌以加快溶解的速度;
(5)称量时左物右码,指针指向的那边质量大,指针指向左边说明氢氧化钠加多了;
(6)A、氢氧化钠中含有杂质,则取用的氢氧化钠中氢氧化钠的量小于所需的氢氧化钠单质溶液中溶质质量偏小,溶质质量分数偏小;
B、砝码生锈则称量出的氢氧化钠的质量大于所需的质量,溶质质量分数偏大;
C、仰视读数取用的水的体积大于所需的水的体积,溶质质量分数偏小;
D、配制好的溶液有部分液体溅出后,溶液是均一稳定的,不会影响溶液的溶质质量分数.
故答案:(1)5;(2)20;30;50;(3)C;(4)要;(5)B;(6)AC.点评:
本题考点: 一定溶质质量分数的溶液的配制;称量器-托盘天平.
考点点评: 熟练掌握溶质质量分数的计算公式和公式变形及配制溶液的基本操作是解答该题的关键.1年前查看全部
大家在问
- 1课文 冬阳 童年 骆驼队 是小说 城南旧事 的序言 (加标点)
- 2王叔叔今天生产零件98个出现两个次品,合格率为《 》
- 3在一段封闭粗细均匀的细玻璃管,用一段10cm的水银柱将一段空气封闭在管内.当向上开口竖直放置时,管内空气柱长15cm:设
- 4讽喻、起兴、借代、衬托、反复、反语、委婉、互文、用典、化用、叠词都是修辞手法吗?不是的请说!
- 5关于原电池,铁片与锌片浸入稀硫酸,用导线连接
- 6已知向量a=﹙sina,-2﹚与b=﹙1,cona﹚互相垂直,其中a∈﹙0,π/2﹚求sina和cona得知
- 7The face is strange ( ) me
- 8我没有钱充饭卡,英语怎样说?
- 9关于力对物体做功,下列说法中正确的是( )
- 10已知{an},{bn}都是各项为正数的数列,都有an,bn^2,an+1成等差数列 ;bn^2,an+1,bn+1^2成
- 11273%化小数 46.2%化小数 7%化小数 63.57%化小数 1.72化百分数
- 12(2013•泰州)下列一元二次方程中,有两个不相等实数根的方程是( )
- 13人可以在喝水过程中来汲取水中的氧气么
- 14设A为m阶对称矩阵,B为m*n矩阵,证明B的转置乘AB为n阶对称矩阵
- 15(2014•碑林区二模)如图,把△ABC绕着点C顺时针旋转35°,得到△A′B′C,A′B′交AC于D点.若∠A′DC=
