Na2B4O7'10H2O(硼砂)若部分风化,则测定结果偏高还是偏低?
 lanpeng8208202022-10-04 11:39:541条回答
lanpeng8208202022-10-04 11:39:541条回答药用硼砂的测定,用盐酸滴定

已提交,审核后显示!提交回复
共1条回复
 淄博男人 共回答了14个问题
淄博男人 共回答了14个问题 |采纳率78.6%- Na2B4O7.10H2O的摩尔质量是381.42,如果部分风化,其摩尔质量达不到381.42,而结果计算过程中采用381.42,因此测定结果偏高.
- 1年前
相关推荐
- (2008•抚州)某些阻燃剂在燃烧过程中吸收大量热量,使燃烧温度难以上升,从而产生阻燃效果.如硼砂阻燃剂(Na2B4O7
(2008•抚州)某些阻燃剂在燃烧过程中吸收大量热量,使燃烧温度难以上升,从而产生阻燃效果.如硼砂阻燃剂(Na2B4O7•10H2O)在燃烧受热时,要释放出10个结晶水,同时每382g硼砂要吸收142kJ的热量.反应方程式为:Na2B4O7•10H2O
Na2B4O7+10H2O,则下列说法正确的是( )△ .
A.Na2B4O7•10H2O的阻燃反应是放热反应
B.Na2B4O7•10H2O不是化合物
C.Na2B4O7•10H2O中硼元素(B)的化合价为+3
D.Na2B4O7•10H2O可以燃烧 乾隆醉1年前1
乾隆醉1年前1 -
 浅浅凉凉 共回答了19个问题
浅浅凉凉 共回答了19个问题 |采纳率94.7%解题思路:此题是一道关于结晶水合物硼砂(Na2B4O7•10H2O)性质及其用途的一道题.解答时必须明确结晶水合物的概念及其性质,正确分析题中给予的信息,进行排除法筛选出正确答案.结晶水合物属于化合物,当然它也属于由两种或两种以上的元素组成的纯净物.因为许多物质从水溶液里析出晶体时,晶体里常含有一定数目的水分子,这样的水分子叫做结晶水.含有结晶水的物质叫做结晶水合物.根据在燃烧...
点评:
本题考点: 物质发生化学变化时的能量变化;单质和化合物的概念;有关元素化合价的计算.
考点点评: 解答此类情景分析题的关键是把握题中给予的信息,结合已有的知识进行排除即可选出答案.1年前查看全部
- 用HCl标液测定硼砂(Na2B4O7·10H2O)试剂的纯度有时会出现含量超过100%的情况
用HCl标液测定硼砂(Na2B4O7·10H2O)试剂的纯度有时会出现含量超过100%的情况
求原因 玉面秀才1年前1
玉面秀才1年前1 -
 violetpipi 共回答了17个问题
violetpipi 共回答了17个问题 |采纳率94.1%有些硼沙脱水了,没含有10个水分子1年前查看全部
- 1.在分析化学中,经常用硼砂(Na2B4O7 •10H2O)来标定盐酸的浓度,反应为:
1.在分析化学中,经常用硼砂(Na2B4O7 •10H2O)来标定盐酸的浓度,反应为:
Na2B4O7+HCl+H2O―→H3BO3+NaCl(未配平)
现准确称取硼砂0.4709 g,与某浓度HCl25.20 mL恰好完全反应,则盐酸的物质的量浓度为 爪子帮1年前2
爪子帮1年前2 -
 mfr518 共回答了19个问题
mfr518 共回答了19个问题 |采纳率89.5%hupeng257 | 四级 的答案有误
Na2B4O7+2HCl+5H2O==4H3BO3+2NaCl
c(HCl)=2m(Na2B4O7 •10H2O) / V(HCl)M(Na2B4O7 •10H2O)
= 2*0.4709 g/(25.20 * 10^-3 L* 381.37g/mol)
=0.0980 mol/L 注意有效数字1年前查看全部
- 四硼酸钠{Na2B4O7 . 10H2O的相对分子质量是多少?
 iv152591年前1
iv152591年前1 -
 littleelectron 共回答了19个问题
littleelectron 共回答了19个问题 |采纳率78.9%四硼酸钠Na2B4O7 .10H2O的相对分子质量 = 23*2 + 11*4 + 16*7 + 10*18 = 3821年前查看全部
- (2014•龙岩一模)氯化硼(BN)晶体是一种新型无机合成材料.用硼砂(Na2B4O7)和尿素反应可以得到氮化硼:Na2
 (2014•龙岩一模)氯化硼(BN)晶体是一种新型无机合成材料.用硼砂(Na2B4O7)和尿素反应可以得到氮化硼:Na2B4O7+2CO(NH2)2=4BN+Na2O+4H2O+2CO2↑
(2014•龙岩一模)氯化硼(BN)晶体是一种新型无机合成材料.用硼砂(Na2B4O7)和尿素反应可以得到氮化硼:Na2B4O7+2CO(NH2)2=4BN+Na2O+4H2O+2CO2↑
根据要求回答下列问题:
(1)组成反应物的所有元素中,第一电离能最大的是______.
(2)尿素分子( )中π键与σ键数目之比为______;尿素分子中处于同一平面的原子最多有______个.
)中π键与σ键数目之比为______;尿素分子中处于同一平面的原子最多有______个.
(3)尿素分子一定条件下形成六角形“超分子”(结构如图).“超分子”中尿素分子间主要通过什么作用力结合.答:______(填1种).
(4)图示“超分子”的纵轴方向有一“通道”.直链烷烃分子刚好能进人通道.并形成“超分子”的包台物;支链烷烃因含有侧链,空间体积较大而无法进入“通道”.利用这一性质可以实现直链烷烃和支链烷烃的分离.
①直链烷烷烃分子能进人通道时,通过什么作用力与“超分子”结合,从而形成“超分子”包合物?答:______.
②下列物质可以通过尿素“超分子”进行分离的是______.
A.乙烷和丁烷B.丁烷和异丁烷C.异戊烷和新戊烷D氯化钠和氯化钾
(5)BN晶体有a、B两种类型,且a-BN结构与石墨相似、B-BN结构与金刚石相似.
①a一BN晶体中N原子杂化方式是______;
②B-BN晶体中,每个硼原予形成______个共价键.这些共价键中,有______个为配位键. 向君炎1年前1
向君炎1年前1 -
 liulp717 共回答了21个问题
liulp717 共回答了21个问题 |采纳率95.2%解题思路:(1)根据第一电离能递变规律判断;
(2)根据分子结构判断π键和σ键数目;根据分子结构判断;
(3)根据微粒间作用力判断;
(4)①根据微粒间作用力判断;②根据题目给出的信息判断;
(5)①根据石墨结构判断杂化类型;②根据金刚石晶体结构判断.(1)第一电离能同周期从左到右,呈增大趋势;同主族从上到下,逐渐减小,位于周期表右上方的元素第一电离能大,又由于N>O,故答案为:N;
(2)分子内只含一条双键,即只含一条π键;相邻原子之间均存在σ键,数目为7;碳氧双键及相连的原子一定共平面,即O、C、N原子一定共平面,与每个N相连的H可能共平面,故答案为:1:7;6;
(3)由于存在的微粒为分子,应从分子间作用力方面考虑,H与N相连,且分子内还含有极性较强的C、O双键,可以想到分子间可形成氢键,故答案为:氢键;
(4)①微粒为分子,不具备形成分子间氢键的条件,只能考虑到作用力为范德华力,故答案为:范德华力;
②不含支链的分子可通过,含有支链的分子不能通过,可得到答案;A.都不含支链,不可分离;B、丁烷不含支链,异丁烷含有支链,可以分离;C、异戊烷和新戊烷都含有支链,不可分离;D、氯化钠和氯化钾均以离子形式存在,二者相同,不可分离;故答案为:B;
(5)①与石墨结构相似,石墨中C以sp2杂化,故答案为:sp2;
②结构与金刚石相似,金刚石中,C原子形成4条共价键;B原子最外层有3个电子占据3条杂化轨道,只能形成3条共价键,还有一条空轨道,形成配位键,故答案为:4、1.点评:
本题考点: 晶胞的计算;元素电离能、电负性的含义及应用;共价键的形成及共价键的主要类型;原子轨道杂化方式及杂化类型判断.
考点点评: 本题综合考查物质结构与性质,涉及核外电子排布规律、电离能、杂化理论、分子结构、晶胞结构等,难度中等.1年前查看全部
- Na2So4+SiO2+Na2B4O7的反应式
 沁香谷1年前2
沁香谷1年前2 -
 thcfhb1l 共回答了25个问题
thcfhb1l 共回答了25个问题 |采纳率84%高温下得到玻璃体:Na2So4+SiO2+Na2B4O7——2Na2O·SiO2·2B2O3+SO31年前查看全部
- (2012•台州一模)硼镁泥是硼镁矿(主要成分:MgO•B2O3)生产硼砂(Na2B4O7)的废渣,生产原理如下:2Mg
(2012•台州一模)硼镁泥是硼镁矿(主要成分:MgO•B2O3)生产硼砂(Na2B4O7)的废渣,生产原理如下:2MgO•B2O3+Na2CO3+CO2═Na2B4O7+2MgCO3.硼镁泥中MgCO3含量为:52%~80%,是宝贵的镁资源.某研究小组以硼镁泥为原料提取MgSO4•7H2O,设计了如下流程图:

各离子开始沉淀和完全沉淀的pH值
请回答下列问题离子 Fe3+ Al3+ Fe2+ Mn2+ Mg2+ 开始沉淀~沉淀完全的pH 2.7~4.1 3.7~5.2 7.5~9.6 8.6~10.1 9.6~11.1 
(1)步骤①可在图1装置中进行,仪器A的名称是______,煮沸的目的是______.
(2)本实验中多次用到抽滤,相比普通过滤,抽滤的优点是______.
(3)步骤②中加硼镁泥的作用是______,NaClO的作用是______.
(4)步骤③趁热过滤的目的是______,该过程中温度应控制在______℃左右.
(5)步骤④的具体操作:当______时即停止加热,其原因是______.
(6)若硼镁泥中MgCO3的含量为63%,不考虑步骤②中加入的少量硼镁泥,该实验的产率为______.(用小数表示,保留2位小数) q9a0av1年前1
q9a0av1年前1 -
 shlina 共回答了13个问题
shlina 共回答了13个问题 |采纳率92.3%解题思路:(1)根据图1分析;操作①是用硫酸溶解硼镁泥中的金属离子;
(2)根据抽滤的特点分析;
(3)操作②加入硼镁泥可以消耗多余的硫酸,促使Fe3+、Al3+完全沉淀;Fe2+、Mn2+在pH较小时不能形成沉淀,所以加氧化剂转化为易分离的物质;
(4)由图2可知硫酸镁在80℃左右溶解度最大;
(5)加热溶液当出现晶膜时停止加热,防止温度过高使MgSO4•7H2O失去结晶水;
(6)根据Mg原子守恒计算理论上生成的硫酸镁晶体的质量.(1)根据图1可知该仪器为三颈烧瓶;操作①是用硫酸溶解硼镁泥中的金属离子,为了使硫酸与多种金属氧化物完全反应而生成硫酸盐要进行加热,
故答案为:三颈烧瓶;促进硫酸与多种金属氧化物反应而生成硫酸盐;
(2)抽滤属于减压过滤,过滤时速度快,得到的固体较干燥,
故答案为:速度快、得到的滤渣较干燥;
(3)已知Fe3+形成沉淀的pH范围是2.7~4.1,Al3+形成沉淀的PH范围是3.7~5.2,所以操作②加入硼镁泥可以消耗多余的硫酸,调节pH,促使Fe3+、Al3+完全沉淀;由表中数据可知Fe2+、Mn2+在pH较小时不能形成沉淀,所以加氧化剂将其转化为易分离的物质,所以加入NaClO的作用是,氧化Fe2+、Mn2+;
故答案为:消耗多余的硫酸使pH增加到5~6,促使Fe3+、Al3+完全沉淀;氧化Fe2+、Mn2+;
(4)由图2可知硫酸镁在80℃左右溶解度最大所以该过程中温度应控制80℃左右,温度太低会析出晶体,所以要趁热过滤,
故答案为:防止析出MgSO4•7H2O;80;
(5)加热溶液当出现晶膜时停止加热,然后冷却使硫酸镁结晶析出,如果继续加热会因为温度过高使MgSO4•7H2O失去结晶水,而得不到硫酸镁晶体,
故答案为:出现晶膜;防止MgSO4•7H2O失去结晶水;
(6)设8g硼镁泥完全转化生成MgSO4•7H2O为xg,
根据Mg原子守恒:MgCO3 ~MgSO4•7H2O
84 246
8×63% xg
[84/ 8×63%]=[246/ xg],所以x=14.76,
所以该实验的产率为:[12.3/14.76]=0.83,
故答案为:0.83.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题是一道物质的分离和提纯知识的综合实验题,考查学生分析和解决问题的能力,综合性强,难度较大.1年前查看全部
- 帮我平衡这个化学式,NA2B4O7 + H2SO4 + H2O ----> H3BO3 + NA2SO4另外请问 平衡化
帮我平衡这个化学式,
NA2B4O7 + H2SO4 + H2O ----> H3BO3 + NA2SO4
另外请问 平衡化学式的时候 有什么窍门么? 菠萝爱ee香蕉1年前3
菠萝爱ee香蕉1年前3 -
 pinky_2006 共回答了12个问题
pinky_2006 共回答了12个问题 |采纳率91.7%NA2B4O7 + H2SO4 + 5H2O ----> 4H3BO3 + NA2SO4
可以先配方程式前后都只有的一种元素 此题可先配B 再配其他元素1年前查看全部
- (2011•淮安二模)过硼酸钠是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中.以硼砂(主要成为Na2B4O7)
(2011•淮安二模)过硼酸钠是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中.以硼砂(主要成为Na2B4O7)为原料生产过硼酸钠晶体的主要流程如下:

(1)由Na2B4O7和NaOH反应制NaBO2的离子方程式为______;
(2)沉淀A中含有酸不溶物和氢氧化镁杂质,为了分离出氢氧化镁,在沉淀中加过量的酸,过滤得到含Mg2+的滤液,再在滤液加入碱使Mg2+形成氢氧化镁.若加碱前溶液中c(Mg2+)=0.056mol•L-1,那么需调节溶液的pH=______时,才开始出现沉淀.[已知25℃下Mg(OH)2的Ksp=5.6×10-12]
(3)已知纯品过硼酸钠晶体中各元素的物质的量比为:n(Na):n(B):n(H):n(O)=1:1:n:7.将制得的纯品样品在
70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如右图所示,则T3时所得晶体的化学式为______.(书写简单计算过程)
(4)若反应温度控制不当,所得的过硼酸钠晶体中将混有NaBO2,则产品中钠的质量分数______(填“升高”、“降低”或“不变”). tim123451年前1
tim123451年前1 -
 草公 共回答了30个问题
草公 共回答了30个问题 |采纳率93.3%解题思路:(1)根据已知和质量守恒即可写出离子方程式;
(2)根据溶度积计算出氢氧根离子浓度,再根据水的离子积常数计算氢离子浓度,再求pH;
(3)根据各元素物质的量比以及图中各数据计算出各元素的原子个数比,写出化学式.
(4)比较化学式NaBO3•H2O、NaBO2 即可知道质量分数的大小.(1)根据已知可写出反应物和部分生成物:
Na2B4O7+NaOH→NaBO2+?,根据质量守恒可知未知物为H2O,
配平后方程式为:Na2B4O7+2NaOH═4NaBO2+H2O,离子方程式为:
B4O72-+2OH-=4BO2-+H2O.
故答案为:B4O72-+2OH-=4BO2-+H2O.
(2)Mg2+沉淀的PH计算如下:Ksp═c(Mg2+)×c(OH-)2 ,设c(OH-)浓度为x,带入Ksp表达式得:
0.056×x2═5.6×10-12,解得x═1.0×10-5,C(H+)=1×10-14÷1.0×10-5═1×10-9,pH═9.故调节溶液的pH=9时,才开始出现沉淀.
故答案为:9.
(3)计算过程:T3时,nNa=(20.0g×23%)/23g.mol-1=0.2mol
则30.8g样品中,nNa:nB:nH:nO=0.2:0.2:0.2n:1.4
有:0.2×23+0.2×11+0.2n+1.4×16=30.8
解出n=8,则原晶体为:NaBO3•4H2O.
进一步根据T3时所得晶体中钠元素的质量分数,求出结晶水数目:23÷(23+11+48+18n)═0.23,解得n═1.
所以T3时所得晶体的化学式为NaBO3•H2O.
故答案为:NaBO3•H2O
(4)比较化学式NaBO3•H2O、NaBO2 可知,NaBO2 中钠的质量分数大于NaBO3•H2O 中钠的质量分数.所以过硼酸钠晶体中混有NaBO2,则产品中钠的质量分升高.
故答案为:升高.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;复杂化学式的确定.
考点点评: 计算是难点,计算时要充分利用题目所给数量关系和表中数据,根据质量关系和质量分数的概念快速解题.1年前查看全部
- 以下基准物质使用前处理方法是(1)Na2CO3——(2)Na2B4O7·10H20——(3)H2C2O4·2H20——(
以下基准物质使用前处理方法是
(1)Na2CO3——(2)Na2B4O7·10H20——(3)H2C2O4·2H20——(4)NaCl——
A 500℃下灼烧.B.室温空气下干燥 C.置于相对湿度60% 下D.在300℃下灼烧
这是一个填空题,急 aliwyan1年前1
aliwyan1年前1 -
 落叶无秋风 共回答了14个问题
落叶无秋风 共回答了14个问题 |采纳率78.6%(1)Na2CO3——270~300℃,一般用来标定酸,选D;
(2)Na2B4O7·10H2O——因为会部分失去结晶水,使用前需将硼砂在水中重结晶二次,保存在相对湿度为60%的恒湿器,选C;
(3)H2C2O4·2H20——熔点较低,室温空气下干燥,选B;
(4)NaCl——用于标定AgNO3的,一般在500℃左右干燥,选A;1年前查看全部
- (2012•龙岩二模)尿素()和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:
 (2012•龙岩二模)尿素(
(2012•龙岩二模)尿素(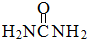 )和硼砂(na2b4o7)在高温高压下反应可以获得硼氮化合物:
)和硼砂(na2b4o7)在高温高压下反应可以获得硼氮化合物:
na2b4o7+2co(nh2)2═4(bn)+na2o+2co2↑+4h2o
(1)上述反应物中含有一种元素,其基态原子具有4种不同能量电子,写出该基态原子的电子排布式______;
(2)元素b、c、o、n第一电离能由大到小的顺序______;
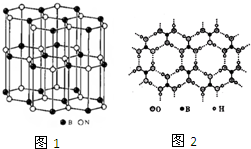
(3)某硼氮化合物的结构与石墨相似(如图1),俗称“白石墨”.
①晶体中b、n原子的杂化方式分别是______;
②白石墨不能导电,原因是b、n原子之间的π键电子被______原子强烈吸引,不能自由移动;
③写出“白石墨”的一种用途______;
(4)尿素可用于制有机铁肥,主***有[fe(h2nconh2)6](no3)3[三硝酸六尿素合铁(Ⅲ)].结构测定知,1mol该配合物中含有6na个配位键.形成配位键时,提供孤对电子的原子是______;
(5)由硼砂可以制取硼酸,硼酸(h3bo3)是一种片层状结构白色晶体,层内的“h3bo3”微粒之间通过氢键相连(如图2),则下列有关说法中不正确的是______.
a.硼酸晶体属于分子晶体
b.h3bo3晶体中有氢键,因此硼酸分子较稳定
c.分子中各原子最外层均为8电子稳定结构
d.1mol h3bo3晶体中含有3mol氢键. 立志过uu1年前1
立志过uu1年前1 -
 lfz7812 共回答了21个问题
lfz7812 共回答了21个问题 |采纳率85.7%解题思路:(1)上述反应物中含有4种不同能量电子的元素是Na元素,根据构造原理书写其基态原子核外电子排布式;
(2)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第ⅡA族、第ⅤA族元素的第一电离能大于相邻元素;
(3)①根据价层电子对互斥理论确定杂化方式;
②B、N原子之间的π键电子被电负性较大的原子吸引;
③氮化硼熔点较高,能作耐火材料,故答案为:耐火材料;
(4)含有孤电子对的原子和含有空轨道的原子之间存在配位键;
(5)A.根据构成微粒判断晶体类型;
B.分子的稳定性与化学键有关;
C.该化合物中H原子不能达到8电子结构;
D.利用均摊法计算含1molH3BO3的晶体中的氢键.(1)上述反应物中含有4种不同能量电子的元素是Na元素,Na元素核外有11个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s1,故答案为:1s22s22p63s1;(2)同一周期元素中,元素的第一电离能随着原...
点评:
本题考点: 原子核外电子排布;元素电离能、电负性的含义及应用;化学键;配合物的成键情况;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查核外电子排布规律、杂化轨道理论、络合物、第一电离能大小的判断等,难度中等,注意氢键不属于化学键,第一电离能规律中的异常现象,为易错点.1年前查看全部
- 请问硼砂(Na2B4O7·10H2O)在不同温度下的溶解度(克/千克)是多少
请问硼砂(Na2B4O7·10H2O)在不同温度下的溶解度(克/千克)是多少
如题 pillaryang1年前1
pillaryang1年前1 -
 dr246 共回答了21个问题
dr246 共回答了21个问题 |采纳率90.5%硼砂溶解度
10℃ 1.6 g/100g H2O
50 ℃ 10.6g/100g H2O
100℃ 52.5g/100g H2O1年前查看全部
- 化学:硼砂与硫酸反应化学方程式硼砂:na2b4o7·10h2o
 彻夜未眠等着您1年前2
彻夜未眠等着您1年前2 -
 444dg96 共回答了23个问题
444dg96 共回答了23个问题 |采纳率87%Na2B4O7.10H2O + H2SO4 == Na2SO4 + 4H3BO3 +5H2O1年前查看全部
- 称取硼砂(Na2B4O7·10H2O) 0.4853g,用以标定盐酸溶液.已知化学计量点时消耗盐酸溶液24.75mL,求
称取硼砂(Na2B4O7·10H2O) 0.4853g,用以标定盐酸溶液.已知化学计量点时消耗盐酸溶液24.75mL,求些盐酸溶液的物质的量浓度.
 临洮哥舒1年前1
临洮哥舒1年前1 -
 thugwcvv43 共回答了19个问题
thugwcvv43 共回答了19个问题 |采纳率100%该反应为HCl+Na2B4O7·10H2O=2NaCl+4H3BO3+5H2O
n(HCl)= n(1/2Na2B4O7·10H2O)
C(HCl)V HC l = m/ M(1/2Na2B4O7·10H2O)
所以盐酸溶液的物质的量浓度
c(HCl)= 0.10286 (mol/L)1年前查看全部
大家在问
- 1(2014•江都市一模)如图是某乳业公司纯牛奶包装标签文字说明.
- 2下列各组性状中,属于相对性状的一组是( )
- 3六一儿童节快到了,同学们一定过得很快乐!描写快乐的场面和同学们快乐的心情我们可以用?
- 4解方程十八分之x+4-六分之一(x-5)=三分之x+3-二分之一,去分母时方程两边同乘得( )
- 5阅读理解 WONDERFUL EVENTS
- 6father usually book read my weekend the on ,连词成句
- 7(2014•湖南一模)设函数f(x)=sinx+sin(x+π3).
- 8—I was at the cinema at nine o’clock yesterday evening. What
- 9关于大气的组成成分及结构的说法正确的是( ) A.从低层到高层的大气成分依次是水汽、干
- 10计算题:27÷3×73×6÷925÷5×8
- 11为了了解某校初三年级1000名学生的视力情况,随机抽查了部分初三学生的视力情况,经过统计绘制了频率分布表和频率分布直方图
- 12配制一定物质的量浓度的溶液时,由于操作不慎,使液面略超过了容量瓶的刻度(标线),这时应采取的措施是( )
- 13已知:如图,CD⊥AB,BE⊥AC,垂足分别为点D,E;又BE,CD相交于点F,且AF平分∠DFE求证AB=AC
- 14中文翻译英文我对你们的抽纱制品很感兴趣.请问供应情况怎么样?
- 15Good evening, here is the weather report. The weather tomorr
