将PH=1的H2SO4溶液1毫升与PH=12的NaOH9毫升混合后,混合液的PH约为多少?
 snail062022-10-04 11:39:543条回答
snail062022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 在水一方的我 共回答了20个问题
在水一方的我 共回答了20个问题 |采纳率90%- (0.1*0.001-0.01*0.009)/0.01=0.001mol/L
PH=3 - 1年前
 彼岸有家 共回答了5个问题
彼岸有家 共回答了5个问题 |采纳率- 那个过量,用那个对应的离子浓度算。
- 1年前
 叶骨青青 共回答了4个问题
叶骨青青 共回答了4个问题 |采纳率- 酸过量、、所以用氢离子浓度算0.001*(0.1-0.01*9)/(1+9)=0.001mol/L
pH=3 - 1年前
相关推荐
- PH=1和PH=3的HCL溶液等体积混合,混合后溶液的PH和H离子浓度
 roc8881年前5
roc8881年前5 -
 zizi_2007 共回答了22个问题
zizi_2007 共回答了22个问题 |采纳率90.9%C(H+)为H离子浓度
pH=-lg(C(H+))
所以pH=1 的C(H+)=0.1 pH=3 C(H+)=0.001
因为HCL溶液(强电解质全部电离)等体积混合
所以C(H+)=(0.1V+0.001V)/2V=0.0505
得pH=-lg0.0505=1.31年前查看全部
- pH=1的盐酸溶液与pH=8的氢氧化钠溶液等体积混合后的pH怎么算
 cn_wuustc1年前1
cn_wuustc1年前1 -
 xyxxin 共回答了18个问题
xyxxin 共回答了18个问题 |采纳率88.9%1年前查看全部
- 10 LpH=1的硫酸溶液中含有的H+数为2NA ,为什么pH=1表明溶液中的c(H+)=0.1 mol/L?
 疯疯疯疯子1年前1
疯疯疯疯子1年前1 -
 dc3624531 共回答了18个问题
dc3624531 共回答了18个问题 |采纳率94.4%答:
【1】10 L、pH=1的硫酸溶液中含有的H+数为2NA :
是因为1 mol的硫酸,含有1NA 个硫酸分子;含2mol的H+数 为2NA
【2】 pH=1表明溶液中的c(H+)=0.1 mol/L?
是依据 pH =- lg c(H+)=- lg 0.1 = - (-1)= 11年前查看全部
- 没有去除氧化膜的铝片与PH=1的盐酸和硫酸在同温同压下反应时两者产生气体的速率盐酸明显比硫酸...
没有去除氧化膜的铝片与PH=1的盐酸和硫酸在同温同压下反应时两者产生气体的速率盐酸明显比硫酸...
没有去除氧化膜的铝片与PH=1的盐酸和硫酸在同温同压下反应时两者产生气体的速率盐酸明显比硫酸大.最大的可能是 A盐酸的物 zy76771年前3
zy76771年前3 -
 手机要充电 共回答了25个问题
手机要充电 共回答了25个问题 |采纳率88%原因主要在于盐酸中的Cl能够与Al形成络合物,促进Al2O3氧化膜的溶解.Cl离子有促进腐蚀的作用.1年前查看全部
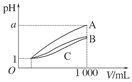
- pH=1的三种酸溶液A、B、C各1 mL,分别加水稀释到1000 mL,其pH与溶液体积(V)的关系如图所示,下列说法不
 一路总裁1年前1
一路总裁1年前1 -
 wang8738629 共回答了17个问题
wang8738629 共回答了17个问题 |采纳率82.4%B
相同pH的酸或碱,稀释相同倍数强者pH变化大,从图像不难得出酸性,B、C应有相同的浓稀酸情况,故B项错误。1年前查看全部
- 某温度(t ℃)时,水的离子积为K w =1×10 - 13 。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫
某温度(t ℃)时,水的离子积为K w =1×10 - 13 。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比。
(1)若所得混合溶液为中性,则a∶b=__________;此溶液中各种离子的浓度由大到小的排列顺序是
______________________________________________________________。
(2)若所得混合溶液的pH=2,则a∶b=_____________。 美丽的大肚子1年前1
美丽的大肚子1年前1 -
 岁月能读懂的美丽 共回答了20个问题
岁月能读懂的美丽 共回答了20个问题 |采纳率75%(1)10∶1(2分);c(Na + )>c(SO 4 2- )>c(H + )=c(OH - )(1分);(2)9∶2(2分)
1年前查看全部
- 用N A 表示阿伏加德罗常数的值。下列叙述正确的是( ) A.25℃时,pH=1的1.0 LH 2
用N A 表示阿伏加德罗常数的值。下列叙述正确的是()
A.25℃时,pH=1的1.0 LH 2 SO 4 溶液中含有的H + 的数目为0.2N A B.标准状况下,2.24 LCl 2 与过量稀NaOH溶液反应,转移的电子总数为0.2N A C.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5N A D.取0.5 L 0.2 mol·L -1 mol氯化铁溶液 ,所得溶液含有0.1 N A 个Fe 3 +  sfsdgsdghdfhd1年前1
sfsdgsdghdfhd1年前1 -
 allan_he 共回答了7个问题
allan_he 共回答了7个问题 |采纳率100%C
1年前查看全部
- (8分)某温度时,水的离子积常数K W =10 - 13 ,将此温度下pH=11的Ba(OH) 2 溶液a L与pH=1
(8分)某温度时,水的离子积常数K W =10 - 13 ,将此温度下pH=11的Ba(OH) 2 溶液a L与pH=1的H 2 SO 4 溶液bL混合。设混合溶液体积为两者之和,所得固体体积忽略不计。
(1)若所得混合溶液为中性,则a︰b= ,生成沉淀的物质的量为 mol。
(最终结果用含a的式子表达)
(2)若a︰b=9︰2,则所得溶液pH= 。若混合后溶液的总体积为220mL,则该混合溶液最多能溶解铁粉 g。 雅士居1年前1
雅士居1年前1 -
 kid2006 共回答了19个问题
kid2006 共回答了19个问题 |采纳率100%(8分)(1)10︰1 5×10 - 3 a(2)2 0.0616(每空2分)
略1年前查看全部
- (2011·湖北省八校联考)25℃时,pH=13的氨水中由水电离出的c(H + )=a,pH=1的盐酸中由水电离出的c(
(2011·湖北省八校联考)25℃时,pH=13的氨水中由水电离出的c(H + )=a,pH=1的盐酸中由水电离出的c(H + )=b,0.2 mol·L -1 盐酸与0.1 mol·L -1 氢氧化钠溶液等体积混合后,由水电离出的c(H + )=c,则a、b、c的关系正确的是( )
A.a>b=c B.a=b=c C.c>a=b D.a>c>b  默然自语1年前1
默然自语1年前1 -
 1111TAMA 共回答了19个问题
1111TAMA 共回答了19个问题 |采纳率100%C
pH=13的氨水中,c(H + ) 水 =c(H + )=10 -13 mol·L -1 ;pH=1的盐酸中,c(H + ) 水 =c(OH - )=10 -13 mol·L -1 ;
0.2 mol·L -1 盐酸与0.1 mol·L -1 氢氧化钠溶液等体积混合,
c(H + )= mol·L - 1 =0.05 mol·L - 1 ,pH=2-lg5=1.3,c(H + ) 水 =10 - 12.7 mol·L - 1 ,所以c>a=b。1年前查看全部
- N A 代表阿伏加德罗常数的数值。下列有关叙述正确的是( ) A.50℃时,pH=1的1.0L H 2 SO
N A 代表阿伏加德罗常数的数值。下列有关叙述正确的是( )
A.50℃时,pH=1的1.0L H 2 SO 4 溶液中含有的H + 数目为0.1 N A B.标准状况下,2.24L Cl 2 与过量稀NaOH溶液反应,转移的电子总数为0.2 N A C.室温下,21.0g乙烯和丁烯的混合气体中含有的氢原子数目为1.5N A D.3.4gNH 3 中含N—H键数目为0.2N A  爱情贩子1年前1
爱情贩子1年前1 -
 zhang7221 共回答了18个问题
zhang7221 共回答了18个问题 |采纳率83.3%A
A.考查pH的定义,与温度无关,正确
B.在Cl 2 +2NaOH=NaCl+NaClO+H 2 O反应中,只有一个电子转移,故标准状况下,2.24L Cl 2 与过量稀NaOH溶液反应,转移的电子总数为0.1N A ,不正确
C.两物质的最简式均为CH 2 ,即14g混合物中含有的氢原子为2mol,故室温下,21.0g乙烯和丁烯的混合气体中含有的氢原子数目为3N A ,不正确
D.氨分子中有三个N—H键,故3.4gNH 3 中含N—H键数目为0.6N A ,不正确
答案为A1年前查看全部
- 下列各组物质能在pH=1的无色溶液中大量共存的是 [ ] A.K 2 S
下列各组物质能在pH=1的无色溶液中大量共存的是 [ ]A.K 2 SO 4 、Ba(OH) 2 、KCl
B.Cu(NO 3 ) 2 、NaCl、KNO 3
C.Na 2 CO 3 、KNO 3 、NH 4 Cl
D.MgSO 4 、NaNO 3 、KCl chick1231年前1
chick1231年前1 -
 erhu1999 共回答了26个问题
erhu1999 共回答了26个问题 |采纳率92.3%D1年前查看全部
- (2011年四川广安,34题)下列各组物质能在pH=1的无色溶液中大量共存的是 A.K 2 SO 4 Ba(OH) 2
(2011年四川广安,34题)下列各组物质能在pH=1的无色溶液中大量共存的是
A.K 2 SO 4 Ba(OH) 2 KCl B.Cu(NO 3 ) 2 NaCl KNO 3 C.Na 2 CO 3 KNO 3 NH 4 Cl D.MgSO 4 NaNO 3 KCl  格子君子兰1年前1
格子君子兰1年前1 -
 tt之翼 共回答了21个问题
tt之翼 共回答了21个问题 |采纳率85.7%D
pH为1的水溶液显酸性,水溶液中含有大量的H + .
A、K 2 SO 4 和和Ba(OH) 2 在溶液中相互交换成分生成硫酸钡沉淀,不能大量共存,且Ba(OH) 2 不能在酸性溶液中共存,故选项错误.
B、三者之间不反应,能在酸性溶液中共存,且不存在有色离子,故选项正确.
C、Na 2 CO 3 溶液中的碳酸根离子与H + 在溶液中结合成水、二氧化碳,不能大量共存,故选项错误
D、三者之间不反应,且能在酸性溶液中共存,但CuSO 4 溶于水呈蓝色,故选项错误..
故选D.1年前查看全部
- 25℃时,下列各组离子在指定溶液中一定能大量共存的是 A.pH=1的溶液中:Na + 、K + 、MnO 4 - 、CO
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:Na + 、K + 、MnO 4 - 、CO 3 2 - B.c(H + )=1×10 -13 mol/L的溶液中:Mg 2 + 、Cu 2 + 、SO 4 2 - 、NO 3 - C.0.1mol/LNH 4 HCO 3 溶液中:K + 、Na + 、NO 3 - 、Cl - D.0.1mol/LFeCl 3 溶液中:Fe 2 + 、NH 4 + 、SCN - 、SO 4 2 -  babyrun9991年前1
babyrun9991年前1 -
 天赐 共回答了18个问题
天赐 共回答了18个问题 |采纳率100%C
1年前查看全部
- 水溶液浓度为0.1 mol·L-1,pH=1的HA
水溶液浓度为0.1 mol·L-1,pH=1的HA
0.1 mol·L-1,pH=1说,H+浓度为0.1 mol·L-1,即HA电离完全,是强电解质可以给我解释一下这句话的意思吗? yinghuajingling11年前2
yinghuajingling11年前2 -
 ee了都要爱戚薇6 共回答了13个问题
ee了都要爱戚薇6 共回答了13个问题 |采纳率92.3%0.1mol/L的HA溶液
若HA完全电离
HA == H+ + Ac-
H+浓度为0.1mol/L
pH=-lg[H+]=1
所以当pH=1,说明HA完全电离,在水溶液中完全电离的电解质是强电解质.1年前查看全部
- EDTA滴定铅,二甲酚橙作为指示剂,最初ph=1,用六次甲基四胺调节ph
EDTA滴定铅,二甲酚橙作为指示剂,最初ph=1,用六次甲基四胺调节ph
加入六次甲基四胺过多或者过少会对滴定产生什么影响 muyu_aa111年前1
muyu_aa111年前1 -
 COOLping 共回答了21个问题
COOLping 共回答了21个问题 |采纳率81%六次甲基四胺作为缓冲剂,加多了也没什么问题!
只不过用六次甲基四胺作缓冲剂不很方便,效果也不那么理想,一般都用pH10的NH3-NH4Cl缓冲溶液.1年前查看全部
- 在下列溶液中,能大量共存的一组离子是 A.pH=1的溶液中:NH 4 + 、 Fe 2+ 、SO 4 2- 、ClO -
在下列溶液中,能大量共存的一组离子是
A.pH=1的溶液中:NH 4 + 、 Fe 2+ 、SO 4 2- 、ClO - B.通入过量SO 2 气体的溶液中:Fe 3+ 、NO 3 - 、Ba 2+ 、H + C.c(Al 3+ )=0.1 mol/L的溶液中 :Na + 、K + 、AlO 2 - 、SO 4 2- D.通入过量CO 2 气体的溶液中:Na + 、Ba 2+ 、HCO 3 - 、Cl - 、Br -  落雨桥1年前1
落雨桥1年前1 -
 柠檬1026 共回答了22个问题
柠檬1026 共回答了22个问题 |采纳率90.9%D
1年前查看全部
- PH=1的溶液一定是酸吗
 hj4jhfdjnga1年前5
hj4jhfdjnga1年前5 -
 梦竹子 共回答了14个问题
梦竹子 共回答了14个问题 |采纳率100%不是
一定是酸性物质1年前查看全部
- 下列说法正确的是(设N A 表示阿伏加德罗常数的值)( ) A.80℃时,1 L pH=1的硫酸溶液中,含有0.2N
下列说法正确的是(设N A 表示阿伏加德罗常数的值)( )
A.80℃时,1 L pH=1的硫酸溶液中,含有0.2N A 个H + B.4.6 g Na完全转化成Na 2 O和Na 2 O 2 的混合物,生成物中阴离子总数为0.1N A C.标准状况下,2.24 L Cl 2 溶于水,转移的电子数目为0.1N A D.300 mL 2 mol·L - 1 蔗糖溶液中所含分子数为0.6N A  qqhqydzxd08581年前1
qqhqydzxd08581年前1 -
 红运档头15 共回答了16个问题
红运档头15 共回答了16个问题 |采纳率81.3%B
A项,1 L pH=1的硫酸溶液中,c(H + )=0.1 mol·L - 1 ,n(H + )=0.1 mol,与硫酸是二元酸无关;B项,Na 2 O和Na 2 O 2 中阳离子均为Na + ,阴离子分别为O 2 - 和O 2 2 — ,阳离子与阴离子的个数比均为2:1,B项正确;C项,忽视了氯气与水的反应为可逆反应,不能进行彻底;D项,忽视了水分子的存在。
点拨:本题考查阿伏加德罗常数,意在考查考生对化学基础知识的理解与应用。1年前查看全部
- 在某未知溶液中检验出含有Ba 2+ 、NO 3 - ,且溶液的pH=1。某学生还需鉴定此溶液中是否大量存在:①Al 3+
在某未知溶液中检验出含有Ba 2+ 、NO 3 - ,且溶液的pH=1。某学生还需鉴定此溶液中是否大量存在:①Al 3+ ;②NH 4 + ;③Fe 2+ ;④Cl - ;⑤AlO 2 - ;⑥SO 4 2- ,其实这些离子中有一部分不必再鉴定就能加以否定,你认为不必再鉴定的离子组是 [ ]A.③⑤⑥
B.④⑤⑥
C.①②⑤
D.①③④ 阳光淑女1年前1
阳光淑女1年前1 -
 我是东北人 共回答了17个问题
我是东北人 共回答了17个问题 |采纳率100%A1年前查看全部
- 某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下) ①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓
某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下) ①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度一定降低
②pH=2的盐酸和pH=1的盐酸,c(H + )之比为2∶1
③pH相等的四种溶液:a.CH 3 COONa;b.C 6 H 5 ONa c.NaHCO 3 d.NaOH,其溶质物质的量浓度由小到大顺序为:d、b、c、a
④NH 4 HSO 4 溶液中滴加NaOH溶液至溶液pH=7,则c(Na + )=2c(SO 4 2- )
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为:Ka?Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是
[ ]A.全部
B.③⑤⑥
C.④⑤⑥
D.①②④ 玩的就是派1年前1
玩的就是派1年前1 -
 流泪不哭 共回答了15个问题
流泪不哭 共回答了15个问题 |采纳率86.7%B1年前查看全部
- 28-5/ 在PH=1的无色溶液总能大量共存的离子组是()?
28-5/ 在PH=1的无色溶液总能大量共存的离子组是()?
(A)NH4+;Mg^2+;SO4^2-;Cl-
(B)Ba^2+;K^+;OH-;NO3-
(C)Al^3+;Cu^2+;SO4^2-;Cl-
(D)Na+;Ca^2+;Cl-;NO3-
为什么c对,而B选项都却不对?
请详细说明每个选项并写出详细过程. WANG7711131年前2
WANG7711131年前2 -
 zbxa 共回答了10个问题
zbxa 共回答了10个问题 |采纳率100%PH=1即显酸性,说明溶液中有大量
A对,其中没有什么离子反应.
B中OH-与H+离子不能大量共存
C中Cu^2+有颜色
D也对
答案应为AD1年前查看全部
- 将pH=1的H2SO4溶液1毫升与PH=12的NaOH溶液9毫升混合后,混合液的PH约为?
 tyaya1年前2
tyaya1年前2 -
 兰色江南 共回答了17个问题
兰色江南 共回答了17个问题 |采纳率100%pH=1的H2SO4溶液1毫升,则氢离子物质的量为 10的﹣4次方
PH=12的NaOH溶液9毫升,则氢氧根离子物质的量为9×10的﹣5次方
10的﹣4次方-9×10的﹣5次方=10的﹣5次方
除以体积约为10的-3次方 ph为31年前查看全部
- 酸碱中和的计算常温下pH=11的苛性钠aL与pH=1的稀硫酸bL混合,若所得溶液为中性,则a:b=_____,若所得pH
酸碱中和的计算
常温下pH=11的苛性钠aL与pH=1的稀硫酸bL混合,若所得溶液为中性,则a:b=_____,若所得pH=2,则a:b=_____ 无亲情1年前1
无亲情1年前1 -
 琉璃妖妖 共回答了13个问题
琉璃妖妖 共回答了13个问题 |采纳率100%常温下pH=11的苛性钠aL与pH=1的稀硫酸bL混合,若所得溶液为中性,则a:b=1:100,若所得pH=2,则a:b=1:101年前查看全部
- 将PH=1的稀H2SO4慢慢加入一定量的BaCl2的溶液中,恰好使钡离子完全沉淀,此时溶液体积为100ML,且混合溶液的
将PH=1的稀H2SO4慢慢加入一定量的BaCl2的溶液中,恰好使钡离子完全沉淀,此时溶液体积为100ML,且混合溶液的PH=2,则原BaCl2中氯离子的浓度?
 seven7141年前1
seven7141年前1 -
 禾山 共回答了18个问题
禾山 共回答了18个问题 |采纳率88.9%0.1L*0.01mol/L得到硫酸中的氢离子的物质的量为0.001mol.即为氯离子的物质的量
反应前后,硫酸中的氢离子没有变化
0.001÷0.1mol/L得到原来硫酸的体积为10mL
氯化钡溶液体积为90mL
浓度为0.001÷0.09=0.01mol/L1年前查看全部
大家在问
- 1已知圆 与抛物线 y 2 =40 x 的准线相切,若直线 与圆 C 有公共点,且公共点都为整点(整点是指横坐标、纵坐标都
- 2用别出心裁写一句话
- 3读“某地区年均温等温线分布图”,回答下列小题。
- 4生活因你而精彩 作文
- 5(2010•天津)在一次射击比赛中,甲、乙两名运动员10次射击的平均成绩都是7环,其中甲的成绩的方差为1.21,乙的成绩
- 6(1)Is it going to be hot in Beijing tomorrow?(做否定回答)
- 7下列细胞中含叶绿体的是( ) A.番茄果肉细胞 B.洋葱鳞片叶表皮细胞 C.根尖分生组织细胞 D.保卫细胞
- 8在写作文时,想"2008"占稿纸几个格?
- 9(九0p三•南长区二模)整理、归纳物质性质之间少相互联系,是化学学习少一种有效方法.如图表示少是常见物质A-H相互间少常
- 10生活中到处有着这样的 生命之线 ,试从生活和阅读材料中找出类似的例证.
- 11请把下列翻译成英语 thank you!
- 12一头大象每天要吃85千克食物那么一个月要吃多少千克食物?一年大约要吃多少吨
- 13124除以什么数商是8,余数是4呢?
- 14已知三角形ABC中,角ABC等于90度,点O是AB上得一点,以O为圆心,OB为半径的圆与AB交与点E
- 15五年级作文--------新学期的打算