汽车安全气囊内所装化学物质,能在碰撞后10毫秒内,生成一种空气中含量最多的气体,该气体是( )
 忘了爱的人2022-10-04 11:39:541条回答
忘了爱的人2022-10-04 11:39:541条回答| 汽车安全气囊内所装化学物质,能在碰撞后10毫秒内,生成一种空气中含量最多的气体,该气体是( ) A.氮气 B.氧气 C.稀有气体 D.二氧化碳 |

已提交,审核后显示!提交回复
共1条回复
 lcmxx 共回答了20个问题
lcmxx 共回答了20个问题 |采纳率85%- 空气中各成分及体积分数为:氮气78%、氧气21%、稀有气体0.94%、二氧化碳0.03%、水蒸气和杂质0.03%.所以空气中含量最多的气体是氮气.
故选A - 1年前
相关推荐
- 高级汽车中常配置有一种汽车安全气袋,内部贮存有硝酸铵(NH 4 NO 3 ),当汽车高速行驶中受到猛烈撞击时,硝酸铵迅速
高级汽车中常配置有一种汽车安全气袋,内部贮存有硝酸铵(nh 4 no 3 ),当汽车高速行驶中受到猛烈撞击时,硝酸铵迅速分解产生的大量***(n 2 o)气体和另一种氧化物充满气袋,填补在乘员与挡风玻璃、方向盘之间,防止乘员受伤。
(1)nh 4 no 3 受撞击后发生分解反应的化学方程式是____________。
(2)此反应中反应物和生成物中氮元素的化合价从左到右依次为______________。 zhangfeixue1年前1
zhangfeixue1年前1 -
 zjh2842 共回答了14个问题
zjh2842 共回答了14个问题 |采纳率85.7%1年前查看全部
- (2002•山东)一种汽车安全气袋内贮有硝酸铵,当汽车在高速行驶中受到猛烈撞击时,发生化学反应:NH4NO3
(2002•山东)一种汽车安全气袋内贮有硝酸铵,当汽车在高速行驶中受到猛烈撞击时,发生化学反应:NH4NO3
N2O+2H2O,生成物充满气袋,填补在乘员与方向盘、挡风玻璃之间,防止乘员受伤,此反应属于化学反应基本类型中的( )压力 .
A.化合反应
B.分解反应
C.复分解反应
D.置换反应 JACK8411301年前1
JACK8411301年前1 -
 网络酸菜 共回答了20个问题
网络酸菜 共回答了20个问题 |采纳率95%解题思路:分解反应是由一种物质参与反应生成两种或两种以上,其变化特征是“一变多”利用此知识解决此题.NH4NO3
压力
.
N2O+2H2O符合分解反应的特征“一变多”即反应物是一种,生成物是多种;故选B点评:
本题考点: 反应类型的判定.
考点点评: 解答本题要充分理解各种反应类型的特点,只有这样才能对各种反应类型做出正确的判断.1年前查看全部
- 汽车安全气囊内所装化学物质,能在碰撞后10毫秒内,生成一种空气中含量最多的气体,该气体是( )
汽车安全气囊内所装化学物质,能在碰撞后10毫秒内,生成一种空气中含量最多的气体,该气体是( )
A. 氮气
B. 氧气
C. 稀有气体
D. 二氧化碳 不在流泪的女人1年前1
不在流泪的女人1年前1 -
 superbatman 共回答了24个问题
superbatman 共回答了24个问题 |采纳率95.8%解题思路:熟记空气中各成分及体积分数,就能解决这一题目.空气中各成分及体积分数为:氮气78%、氧气21%、稀有气体0.94%、二氧化碳0.03%、水蒸气和杂质0.03%.所以空气中含量最多的气体是氮气.
故选:A.点评:
本题考点: 空气的成分及各成分的体积分数.
考点点评: 此题考查学生只要能熟记空气中各成分及体积分数,再能灵活运用,就能很轻松的解决此类问题.1年前查看全部
- 汽车安全保护装置有哪些类型?请具体说明,
 小破布1年前1
小破布1年前1 -
 xin123dong 共回答了18个问题
xin123dong 共回答了18个问题 |采纳率83.3%亮才牌汽车安全保护器分为主动保护和被动保护,最大限度保护人身安全,其他的有安全气囊安全带等.目前国际汽车保护装置只注重保护人,不注重保护车,却不知保护了车也就保护了人.贺亮才发明的汽车安全保护器,使人与车都受到了保护,是一项了不起的发明.1年前查看全部
- 汽车安全气囊,单极气体发生器气囊与双极气体发生器气囊两者之间的区别?
 抱抱熊㊣1年前1
抱抱熊㊣1年前1 -
 ll未归人 共回答了23个问题
ll未归人 共回答了23个问题 |采纳率82.6%双级的比单击的起爆逻辑更复杂,同时也更能在不同速度的碰撞下更好的保护乘员.
单极的发生器,一般只有下列逻辑,正面碰撞时,13公里/小时以下速度不爆,13-18公里为模糊区域为模糊区域可以起爆也可以不起爆,18公里以上必起爆
而双级的逻辑就要复杂很多,在速度低的碰撞情况下,先起爆一级,或者根据情况反转起爆,总之逻辑很多,这里就不一一叙述,总之双级的比单级在不同速度的碰撞下能更好的保护乘员.1年前查看全部
- 汽车安全气囊中的填充物主要成分是NaN3、KNO3和SiO2,汽车发生猛烈碰撞时NaN3分解,生成甲、乙两种单质,有
汽车安全气囊中的填充物主要成分是NaN3、KNO3和SiO2,汽车发生猛烈碰撞时NaN3分解,生成甲、乙两种单质,有
关的化学反应方程式为_____,KNO3的作用是与可能会对人体造成伤害的单质甲反应,请写出该反应的化学方程式________,从理论上计算可知,SiO2与NaN3的质量比宜大于___:___
(只需讲解第三问,) 伊枫1年前1
伊枫1年前1 -
 心月无痕 共回答了30个问题
心月无痕 共回答了30个问题 |采纳率93.3%2NaN3=(高压)=2Na+3N2
2KNO3+10Na==K2O+5Na2O+N2
K2O+Si02=K2SiO3
Na2O+SiO2=Na2SiO3
2NaN3--2Na+2/5K--6/5Si
3SiO2---5NaN3
质量比宜大于3*60/(5*65)=36:65
SiO2过量是为了将有害的碱金属氧化物反应掉1年前查看全部
- 汽车安全气囊内所装化学物质,能在碰撞后10毫秒内,生成一种空气中含量最多的气体,该气体是( )
汽车安全气囊内所装化学物质,能在碰撞后10毫秒内,生成一种空气中含量最多的气体,该气体是( )
A. 氮气
B. 氧气
C. 稀有气体
D. 二氧化碳 weiguolin1年前3
weiguolin1年前3 -
 wanghao957 共回答了21个问题
wanghao957 共回答了21个问题 |采纳率85.7%解题思路:熟记空气中各成分及体积分数,就能解决这一题目.空气中各成分及体积分数为:氮气78%、氧气21%、稀有气体0.94%、二氧化碳0.03%、水蒸气和杂质0.03%.所以空气中含量最多的气体是氮气.
故选:A.点评:
本题考点: 空气的成分及各成分的体积分数.
考点点评: 此题考查学生只要能熟记空气中各成分及体积分数,再能灵活运用,就能很轻松的解决此类问题.1年前查看全部
- 汽车安全气囊内所安装的化学物质,能在碰撞后10毫秒内生成一种空气中含量最多的气体是?
 bluejonas1年前1
bluejonas1年前1 -
 Balando 共回答了15个问题
Balando 共回答了15个问题 |采纳率80%氮气1年前查看全部
- 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究.
[查阅资料]
①NaN3受撞击会生成Na、N2.
②NaN3遇盐酸、H2SO4溶液无气体生成.
③碱石灰是CaO和 NaOH的混合物.
④NaN3的制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和氨气(NH3).
[问题探究]
(1)汽车经撞击后,30毫秒内引发NaN3迅速分解,写出该反应的化学方程式:2NaN3
2Na+3N2↑撞击 .2NaN3.
2Na+3N2↑撞击 .
(2)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示):______.
(3)为测定某工业级NaN3样品中含有Na2CO3的质量分数,化学小组同学设计了如下实验装置.
①小明同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是______.
②小刚同学在大家讨论的基础上,设计了装置II.请分析:装置II中A的作用______;若无装置C,对测定结果造成的影响是______(填“偏大”、“偏小”或“无影响”);
③根据装置II,小组同学设计的实验步骤有:
a.称量装置D.
b.称量样品,检查装置气密性.
c.打开弹簧夹,鼓入空气.
d.打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞.
其正确顺序为______(填字母序号,可重复).
(4)该小组对某一工业级NaN3样品进行检测.取100克该样品于烧杯中,加水将其溶解,然后逐滴加入一定溶质质量分数的稀硫酸并不断振荡.
首先发生的反应是:2Na2CO3+H2SO4=2NaHCO3+Na2SO4;
然后发生的反应是:2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑;
在上述过程中生成二氧化碳的质量与加入稀硫酸质量的关系如图甲所示.
①请你根据以上信息,在图乙的坐标系中画出检测过程中烧杯中溶液的质量随滴加硫酸溶液质量的变化曲线.
②计算该样品中纯碱的质量分数. dj33331年前1
dj33331年前1 -
 fishshow 共回答了16个问题
fishshow 共回答了16个问题 |采纳率81.3%解题思路:(1)根据信息“NaN3受撞击会生成Na、N2”判断反应物、生成物、反应条件,然后写出方程式;
(2)氢氧化钠和空气中的二氧化碳反应反应生成碳酸钠,据此回答;
(3)①浓盐酸易挥发,产生的氯化氢气体,进入B装置;二氧化碳气体逸出时带出的水蒸气在装置B中冷凝而被吸收;装置A内空气中的二氧化碳被装置B吸收;A中生成的二氧化碳不能全部进入B装置,使实验产生误差等.据此分析;
②根据碱石灰、浓硫酸、澄清石灰水的成分和用途回答;
③根据反应原理设计试验步骤;
(4)①从题目中给出的反应原理和图象进行分析解答;
②此反应的总的化学方程式是Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,根据图中生成的二氧化碳的质量和化学方程式Na2CO3+H2SO4=Na2SO4+H2O+CO2↑计算出样品中碳酸钠的质量,然后根据质量分数公式便可计算出样品中纯碱的质量分数.解(1)根据题目中信息“NaN3受撞击会生成Na、N2”可得此反应的反应物是叠氮化钠,生成物是钠和氮气,反应条件是撞击,故答案为:2NaN3
撞击
.
2Na+3N2↑;
(2)工业级NaN3中常含有少量的Na2CO3,其原因是氢氧化钠和空气中的二氧化碳反应反应生成碳酸钠,故答案为:2NaOH+CO2═Na2CO3+H2O
(3)①装置I用浓盐酸与样品反应,浓盐酸具有挥发性,产生的氯化氢气体被装置B吸收,二氧化碳气体逸出时带出的水蒸气在装置B中冷凝而被吸收;装置A内空气中的二氧化碳被装置B吸收;A中生成的二氧化碳不能全部进入B装置,使实验产生误差等.故答案为:浓盐酸有挥发性,挥发出的氯化氢气体会带来实验误差;
②装置II中A中药品是碱石灰,碱石灰可作干燥剂,能吸收空气中的水分和二氧化碳,防止空气中水蒸汽和二氧化碳干扰试验;C装置的浓硫酸干燥CO2气体,若无C装置会使实验结果偏大;CO2通入澄清石灰水,使澄清石灰水变浑浊,装置E的作用是检验二氧化碳是否被D装置完全吸收,防止空气中的二氧化碳和水蒸气进入D装置.故答案为:吸收空气中的二氧化碳和水;偏大;
③根据装置II,小组同学设计的实验步骤为:称量样品,检查装置气密性;打开弹簧夹,鼓入空气;称量装置D;打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞;打开弹簧夹,鼓入空气;称量装置D;其正确顺序为 bcadca;
(4)①本实验中首先发生的反应是:2Na2CO3+H2SO4=2NaHCO3+Na2SO4,然后发生的反应是:2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑.从图甲可看出当加入稀硫酸的质量是50g时开始生成二氧化碳,从而导致溶液质量增加变慢;当加入稀硫酸100g的时候,二氧化碳不再产生,溶液质量增加速率恢复到以前.故答案为:
②从图甲看,最多生成的二氧化碳的质量是4.4g.设样品中碳酸钠的质量是x.
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 4.4g
[106/x]=[44/4.4g]
解得:x=10.6g
根据质量分数公式可得该样品中纯碱的质量分数为:[10.6g/100g]×100%=10.6%
答:该样品中纯碱的质量分数为10.6%.点评:
本题考点: 有关溶质质量分数的简单计算;常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
考点点评: 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,对这类题目要重点训练.1年前查看全部
- (2014•盐城)在受到猛烈撞击时,汽车安全气囊内的物质瞬间分解,产生大量的空气中体积分数最大的气体.该气体是( )
(2014•盐城)在受到猛烈撞击时,汽车安全气囊内的物质瞬间分解,产生大量的空气中体积分数最大的气体.该气体是( )
A.氮气
B.氧气
C.氦气
D.水蒸气 天源水1年前1
天源水1年前1 -
 jo_lizhenyu 共回答了26个问题
jo_lizhenyu 共回答了26个问题 |采纳率88.5%解题思路:熟记空气中各成分及体积分数,就能解决这一题目.空气中各成分及体积分数为:氮气78%、氧气21%、稀有气体0.94%、二氧化碳0.03%、水蒸气和杂质0.03%.所以空气中含量最多的气体是氮气.
故选A.点评:
本题考点: 空气的成分及各成分的体积分数.
考点点评: 此题考查学生只要能熟记空气中各成分及体积分数,再能灵活运用,就能很轻松的解决此类问题1年前查看全部
- (2012•郑州二模)汽车安全气囊内有叠氮酸钠(NaN3)或硝酸铵(NH4NO3)等物质.当汽车受撞击时,这些物质会迅速
(2012•郑州二模)汽车安全气囊内有叠氮酸钠(NaN3)或硝酸铵(NH4NO3)等物质.当汽车受撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊,从而保护车内人员.
(1)NaN3分解反应的方程式为:2NaN3
2Na+撞击 . .(请填写
.(请填写 中内容).
中内容).
(2)NH4NO3中氢、氮元素质量比为______,其中铵根离子(NH4+)中氮元素的化合价为______. sunshinexue1年前1
sunshinexue1年前1 -
 真没品 共回答了18个问题
真没品 共回答了18个问题 |采纳率88.9%解题思路:(1)根据叠氮酸钠的组成结合质量守恒定律可以判断出该物质的化学式及化学计量数;
(2)根据硝酸铵的组成及有关化学式的计算可以求算出硝酸铵中氢元素和氮元素的质量比,根据原子团中正负化合价代数和等于原子团的化合价可以求算出铵根离子中氮元素的化合价.(1)由题给的化学方程式可以知道,在反应物中含有2个Na,6个N,根据质量守恒定律的实质可以知道,在反应前后原子的种类和数目相等,所以反应后也应该出现2个Na,6个N,而反应后只出现了2个Na,所以在题中应该填写的...
点评:
本题考点: 质量守恒定律及其应用;有关元素化合价的计算;元素质量比的计算.
考点点评: 本题难度不是很大,掌握化学方程式的书写方法、利用化合价的原则计算指定元素的化合价的方法是正确解答本题的关键.1年前查看全部
- 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.

【查阅资料】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2.
(2)将生成的金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X.则为______,实验室检验该气体使用的试纸是湿润______.根据制备反应,工业级NaN3中会含有Na2CO3.试分析工业级NaN3中含有Na2CO3的可能原因______.
【Na2CO3质量分数测定】
为进一步测定NaN3样品中Na2CO3的质量分数设计如下图装置(已知H2SO4溶液与NaN3,反应不生成气体).
实验步骤如下:
①按图连接装置,______;
②准确称得盛有碱石灰(固体氢氧化钠和氧化钙的混合物)的干燥管D的质量为a g;
③准确称得叠氮化钠(NaN3)样品的质量W g放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后再称得干燥管D的总质量为b g.根据实验中测得的有关数据,可以算出样品中碳酸钠的质量分数.
试回答:(1)第⑤步缓缓鼓入空气的目的是______,装置A中试剂X最适宜选用______.写出B中生成气体的反应方程式______.
(2)若没有C装置,则会导致测定结果______(填:“偏大”或“偏小”).
(3)E装置的作用是______. yifenghaha1231年前1
yifenghaha1231年前1 -
 waigeshi 共回答了11个问题
waigeshi 共回答了11个问题 |采纳率90.9%解题思路:【查阅资料】
(2)根据质量守恒定律分析X;根据氨气的性质分析检验的方法,根据生成的产物中含有氢氧化钠及其性质分析;
【Na2CO3质量分数测定】
有气体生成的反应应检查装置的气密性;
(1)根据装置中充满二氧化碳气体分析缓缓鼓入空气的目的,根据空气中含有少量的二氧化碳分析装置A中试剂X,根据B中发生的反应写出反应的方程式;
(2)根据生成的气体中含有水蒸气分析;
(3)根据空气中含有二氧化碳和水蒸气分析.【查阅资料】(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X的化学式为:NH3.氨气的水溶液显碱性,检验该气体使用的试纸是湿润红色石蕊试纸,工业级NaN3中含有Na2CO3的可能原因是:生成NaN2的同时有NaOH生成,NaOH吸收空气中的CO2生成Na2CO3;
【Na2CO3质量分数测定】
①按图连接装置,应检查装置的气密性;
(1)由于装置中充满二氧化碳气体,缓缓鼓入空气的目的是:将B中生成的二氧化碳赶往D中.由于空气中含有少量的二氧化碳,为了防止干扰,应除去.所以,装置A中试剂X最适宜选用氢氧化钠溶液.在B中碳酸钠与硫酸反应生成了硫酸钠、二氧化碳和水,反应的方程式是:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
(2)由于生成的气体中含有水蒸气,若没有C装置,则会导致测定结果偏大;
(3)为了防止空气中的二氧化碳和水蒸气对实验的结果造成影响,所以E装置的作用是吸收空气中的水和二氧化碳.
故答为:【查阅资料】(2)NH3,红色石蕊试纸,生成NaN2的同时有NaOH生成,NaOH吸收空气中的CO2生成Na2CO3;
【Na2CO3质量分数测定】检查装置的气密性(1)将B中生成的二氧化碳赶往D中,氢氧化钠溶液,Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;(2)偏大;(3)吸收空气中的水和二氧化碳.点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;质量守恒定律及其应用.
考点点评: 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练.1年前查看全部
- 一个汽车以30m/s速度在拱形桥上行驶,为保证汽车安全,拱形桥最小半径为多少?
一个汽车以30m/s速度在拱形桥上行驶,为保证汽车安全,拱形桥最小半径为多少?
如果汽车速度v>√gR,则汽车与桥无作用力,所以v30
g=10,所以10R>900,所以R>90,即半径最小为90米。 maggieleei1年前2
maggieleei1年前2 -
 LEEOO 共回答了14个问题
LEEOO 共回答了14个问题 |采纳率100%对滴!第一个是大于等于!>=!1年前查看全部
- 汽车安全气囊内的物质在碰撞后,迅速反应,生成一种空气中含量最多的气体,该气体是..
汽车安全气囊内的物质在碰撞后,迅速反应,生成一种空气中含量最多的气体,该气体是..
1.氧气
2.二氧化碳
3.氮气
4.稀有气体 jameshill1年前1
jameshill1年前1 -
 ghfx613215 共回答了24个问题
ghfx613215 共回答了24个问题 |采纳率87.5%空气含量最多是氮气.常识,1年前查看全部
- 一种汽车安全气囊内贮有硝酸铵,当汽车在高速行驶中受到猛烈撞击时,发生化学反应NH 4 NO 3
一种汽车安全气囊内贮有硝酸铵,当汽车在高速行驶中受到猛烈撞击时,发生化学反应NH 4 NO 3
X+2H 2 O,则X的化学式为( )撞击 . A.NO B.N 2 O C.NO 2 D.HNO 3  hnwdd1年前1
hnwdd1年前1 -
 伟大的潇琳儿 共回答了21个问题
伟大的潇琳儿 共回答了21个问题 |采纳率81%由反应的化学方程式NH 4 NO 3
撞击
.
X+2H 2 O,可得知:
反应前 反应后
N原子 2 0
H原子 4 4
O原子 3 2
根据化学变化前后原子的种类、数目不变,可判断生成物X的分子由2个N原子和1个O原子构成,则物质X的化学式为N 2 O;
故选B.1年前查看全部
- 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
应用研究:
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为______.
制备研究:
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______.
Na2CO3质量分数测定:工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体).
(3)装置A的作用是______.设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,______;⑤再次称量装置C.计算碳酸钠含量至少需要测定______(填数字)个数据.根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因______.
NaN3纯度测定:
精确称量0.140g NaN3样品,设计如图装置,测定其纯度.已知2NaN3→3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差______(填“变大”、“变小”或“不变”),说明气密性良好.
(5)使小试管中的NaN3样品与M溶液接触的操作是______.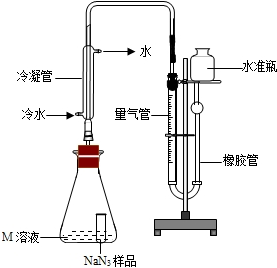
(6)使用冷水冷凝的目的是______.反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是______.
(7)常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是______(填字母序号).
A.100mLB.1LC.2L
(8)计算NaN3样品的纯度(写出计算过程). 608991年前1
608991年前1 -
 cnzaq 共回答了14个问题
cnzaq 共回答了14个问题 |采纳率100%解题思路:(1)根据信息判断反应物、生成物、反应条件,然后写出方程式.
(2)根据质量守恒定律和氨水呈碱性回答.
(3)根据碱石灰的成分和用途回答前一空;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置.
(4)根据出现液面差后,如装置严密,装置内的气压不变的情况回答.
(5)使锥形瓶倾斜,让小试管倾斜其中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝可除去生成的气体中的水蒸气;生成的气体进入量气管后,右管中液面上升,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出.
(8)先根据体积和密谋计算氮气的体积,再利用关系式2NaN3→3N2计算NaN3样品的纯度.(1)汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2,即反应物是NaN3,生成物是Na、N2,条件是撞击,所以反应方程式为 2NaN3
撞击
.
2Na+3N2↑.
(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X为氨气,氨水呈碱性,检验时用无色酚酞试纸或红色石蕊试纸.
(3)碱石灰的主要成分是氧化钙和氢氧化钠,二者既能吸收水分,又能吸收二氧化碳气体,所以A的作用是除去空气中的二氧化碳和水蒸气;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置;计算碳酸钠含量,要知道样品的质量、反应前后C装置的质量,共3个数据;制备工业级NaN3时同时生成氢氧化钠,它能和空气中的二氧化碳反应生成Na2CO3.
(4)连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,如装置严密,装置内气压不变,两边高度差不变.
(5)使小试管中的NaN3样品与M溶液接触的操作是使锥形瓶倾斜,让小试管中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝的目的是除去生成的气体中的水蒸气;为了排除两侧液面不水平,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出,所以选100mL的量筒.
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%.
故答案为:(1)2NaN3
撞击
.
2Na+3N2↑;
(2)无色酚酞试纸或红色石蕊试纸;
(3)除去空气中的二氧化碳和水蒸气;鼓入空气;3;制备过程中未除净的氢氧化钠与空气中的二氧化碳反应生成的;
(4)不变;
(5)使锥形瓶倾斜;
(6)除去生成的气体中的水蒸气;调节量气管使,两侧的液面保持水平;
(7)A;
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%..点评:
本题考点: 实验探究物质的组成成分以及含量;化学实验方案设计与评价.
考点点评: 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练.1年前查看全部
- (2013•河西区二模)如图所示为汽车安全气囊,设计安全气囊的目的是为了防止车在突然______(选填“启动”或“刹车”
 (2013•河西区二模)如图所示为汽车安全气囊,设计安全气囊的目的是为了防止车在突然______(选填“启动”或“刹车”)时,由于______(选填“汽车”或“人”)的惯性,使人与车之间发生猛烈撞击而受伤.
(2013•河西区二模)如图所示为汽车安全气囊,设计安全气囊的目的是为了防止车在突然______(选填“启动”或“刹车”)时,由于______(选填“汽车”或“人”)的惯性,使人与车之间发生猛烈撞击而受伤.  魏晋遗风1年前1
魏晋遗风1年前1 -
 echotsu 共回答了21个问题
echotsu 共回答了21个问题 |采纳率76.2%解题思路:一切物体都有保持原有运动状态的特性,叫做惯性.车子发生严重撞击时,人会由于惯性还会继续向前运动,安全气囊能起到保护的作用.人和汽车一起高速行驶,在车子突然刹车或严重撞击时,人由于惯性要保持原来的运动状态,继续前行,此时安全气囊自动充气弹出,阻止人继续前进,不会撞到车上,防止人受伤.
故答案为:刹车;人.点评:
本题考点: 惯性在实际生活中的应用.
考点点评: 一切物体都具有惯性,有时我们要利用物体的惯性,有时我们要防止惯性带来的危害;体现了物理服务于人们的生活,生活中处处有物理.1年前查看全部
- (2009•凉山州)汽车安全气囊内的物质碰撞后迅速反应,生成一种空气中含量最多的气体,该气体是( )
(2009•凉山州)汽车安全气囊内的物质碰撞后迅速反应,生成一种空气中含量最多的气体,该气体是( )
A.氧气
B.二氧化碳
C.氮气
D.稀有气体 ZWPLYX1年前1
ZWPLYX1年前1 -
 苦恼的小胖 共回答了19个问题
苦恼的小胖 共回答了19个问题 |采纳率89.5%解题思路:空气中含量最多的气体是氮气.根据题意:生成一种空气中含量最多的气体,可知是氮气.
故选:C.点评:
本题考点: 空气对人类生活的重要作用.
考点点评: 明确空气的主要成分即可轻松解答,含量最多的是氮气,其次是氧气.1年前查看全部
- 汽车在倾斜的弯道上拐弯,弯道倾角为A,半径为r,若汽车质量为m,最大静摩擦力为f,那么,汽车安全行驶速度
 哭泣的面包1年前1
哭泣的面包1年前1 -
 永远的图腾 共回答了25个问题
永远的图腾 共回答了25个问题 |采纳率88%你好!
进行受力分析后我们可以发现:在最大速度行驶中重力沿斜面的分量和最大静摩擦力共同提供向心力:
即有:f+mgsinA=mV^2/r
V=根号下(fr/m+grsinA)
希望对你有帮助!1年前查看全部
- 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
应用研究:
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为______.
制备研究:
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______.
Na2CO3质量分数测定:工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体).
(3)装置A的作用是______.设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,______;⑤再次称量装置C.计算碳酸钠含量至少需要测定______(填数字)个数据.根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因______.
NaN3纯度测定:
精确称量0.140g NaN3样品,设计如图装置,测定其纯度.已知2NaN3→3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差______(填“变大”、“变小”或“不变”),说明气密性良好.
(5)使小试管中的NaN3样品与M溶液接触的操作是______.
(6)使用冷水冷凝的目的是______.反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是______.
(7)常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是______(填字母序号).
A.100mLB.1LC.2L
(8)计算NaN3样品的纯度(写出计算过程). y19909161年前1
y19909161年前1 -
 frison 共回答了18个问题
frison 共回答了18个问题 |采纳率88.9%解题思路:(1)根据信息判断反应物、生成物、反应条件,然后写出方程式.
(2)根据质量守恒定律和氨水呈碱性回答.
(3)根据碱石灰的成分和用途回答前一空;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置.
(4)根据出现液面差后,如装置严密,装置内的气压不变的情况回答.
(5)使锥形瓶倾斜,让小试管倾斜其中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝可除去生成的气体中的水蒸气;生成的气体进入量气管后,右管中液面上升,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出.
(8)先根据体积和密谋计算氮气的体积,再利用关系式2NaN3→3N2计算NaN3样品的纯度.(1)汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2,即反应物是NaN3,生成物是Na、N2,条件是撞击,所以反应方程式为 2NaN3
撞击
.
2Na+3N2↑.
(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X为氨气,氨水呈碱性,检验时用无色酚酞试纸或红色石蕊试纸.
(3)碱石灰的主要成分是氧化钙和氢氧化钠,二者既能吸收水分,又能吸收二氧化碳气体,所以A的作用是除去空气中的二氧化碳和水蒸气;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置;计算碳酸钠含量,要知道样品的质量、反应前后C装置的质量,共3个数据;制备工业级NaN3时同时生成氢氧化钠,它能和空气中的二氧化碳反应生成Na2CO3.
(4)连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,如装置严密,装置内气压不变,两边高度差不变.
(5)使小试管中的NaN3样品与M溶液接触的操作是使锥形瓶倾斜,让小试管中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝的目的是除去生成的气体中的水蒸气;为了排除两侧液面不水平,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出,所以选100mL的量筒.
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%.
故答案为:(1)2NaN3
撞击
.
2Na+3N2↑;
(2)无色酚酞试纸或红色石蕊试纸;
(3)除去空气中的二氧化碳和水蒸气;鼓入空气;3;制备过程中未除净的氢氧化钠与空气中的二氧化碳反应生成的;
(4)不变;
(5)使锥形瓶倾斜;
(6)除去生成的气体中的水蒸气;调节量气管使,两侧的液面保持水平;
(7)A;
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%..点评:
本题考点: 实验探究物质的组成成分以及含量;化学实验方案设计与评价.
考点点评: 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练.1年前查看全部
- 汽车安全袋中的硝酸铵受到猛烈撞击后产生大量的气体,使气囊迅速鼓起而减轻人身伤害,其发生的反应为:
汽车安全袋中的硝酸铵受到猛烈撞击后产生大量的气体,使气囊迅速鼓起而减轻人身伤害,其发生的反应为:
2NH 4 NO 3
2N 2 ↑+O 2 ↑+4X,则X物质为( )高温 . 或撞击 A.H 2 B.H 2 O C.H 2 O 2 D.HNO 3  hudong19851年前1
hudong19851年前1 -
 憧瑟若笙 共回答了20个问题
憧瑟若笙 共回答了20个问题 |采纳率90%反应前原子的种类和个数为:4个氮原子,6个氧原子,8个氢原子,而反应后的原子种类和个数为:4个氮原子,2个氧原子,根据反应前后原子的种类和个数相等可以知道,在4X中含有4个氧原子和8个氢原子,所以X中含有1个氧原子和2个氢原子,所以X的化学式为:H 2 O.分析所给的选项可以知道选项B是正确的.
故选B.1年前查看全部
- (2012•上海)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生40.32L(标准状况下
(2012•上海)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生40.32L(标准状况下)氮气,至少需要叠氮化钠______g.
 高愚1年前1
高愚1年前1 -
 00涧水蓝 共回答了36个问题
00涧水蓝 共回答了36个问题 |采纳率91.7%解题思路:叠氮化钠分解反应方程式为2NaN3=3N2↑+2Na,根据氮气和叠氮化钠之间的关系式计算叠氮化钠的质量.叠氮化钠分解反应方程式为2NaN3=3N2↑+2Na,设需要叠氮化钠的质量为x,
2NaN3=3N2↑+2Na
130g 67.2L
x 40.32L
130g:67.2L=x:40.32L
x=[130g×40.32L/67.2L]=78g,
故答案为:78.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查了根据方程式进行计算,正确书写方程式是解本题关键,再结合方程式中各物理量的关系进行解答即可,题目难度不大.1年前查看全部
- 一辆质量为4吨的汽车通过一座半径为90m的圆弧形拱桥,桥顶能承受的最大压力为3×10四次方n,为使汽车安全
一辆质量为4吨的汽车通过一座半径为90m的圆弧形拱桥,桥顶能承受的最大压力为3×10四次方n,为使汽车安全
汽车速度应该多大 qqwdbb1年前1
qqwdbb1年前1 -
 谁是好人 共回答了19个问题
谁是好人 共回答了19个问题 |采纳率89.5%答案:15m/s~30m/s之间
汽车受到的重力与支持力的合力充当向心力,且支持力大小与车对桥的压力大小相等:
即:F合=G-F=mv^2/R
代数得:4000×10-30000=4000v^2/90
解得:v=15m/s
如果对桥顶无压力:G=mv^2/R
即:40000=4000v^2/90
v=30m/s1年前查看全部
- 叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
 叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
2NaNH2+N2O═NaN3+NaOH+NH3↑
3NaNH2+NaNO3═NaN3+3NaOH+NH3↑
(1)①氮原子的L层电子排布图______.
②氮所在的周期中,第一电离能最大的元素为______(填元素符号).
③与N3互为等电子体的粒子为______(写出一种).
④氨气的电子式______.
(2)NH3沸点(-33.34℃)比N2O沸点(-88.49℃)高,其主要原因是______
(3)依据价层电子对互斥理论,NO-3间构型呈______形.
(4)汽车安全气囊的设计是基于反应6NaN3+Fe2O3═3Na2O+2Fe+9N2↑,生成物中的铁是一种常见物质,而铁的晶体有三种堆积方式,其中两种的堆积方式如图所示,下列有关铁及晶体的说法中正确的是______.
A.金属铁的导电性是由于通电时产生的自由电子作定向移动
B.α-Fe、γ-Fe的堆积方式分别与钾和铜相同
C.空间利用率α-Fe大于γ-Fe
D.金属铁内部存在金属键
(5)铁的上述两种晶体(α-Fe:γ-Fe)的密度比值为______.(写成小数,保留2位有效数字) inina111年前0
inina111年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生
叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生
40.32 L(标准状况下)氮气,至少需要叠氮化钠______g.
答案是78,我知道用比例的办法能做出来,但是为什么用化学方程式列出式子就怎么也算不对呢?设叠氮化钠的质量是ng
2NaN3 = 2Na+ 3N2
2*(23+14*3) 3*(14*2)
n 1.8
m=nM=2*(23+14*3)*1.8*(23+14*3)/3*14*2=181.0714g
和正确答案差了那么远啊,我都快疯了, yzyhf1年前3
yzyhf1年前3 -
 小李子qiqi 共回答了19个问题
小李子qiqi 共回答了19个问题 |采纳率89.5%计算如下
2NaN3 = 2Na+ 3N2
2 3
n 1.8mol
n=2*1.8/3=1.2 mol
m=n*M=1.2*(23+14*3) =78 g
你的错误分析:
2NaN3 = 2Na+ 3N2
2*(23+14*3) 3*(14*2)
与数值2*(23+14*3) 3*(14*2)相对的是质量,不是物质的量!物质的量与化学计量数对应(即与2 3对应)!1年前查看全部
- 哪种化学反应对气球充气效果好第一种:汽车安全气囊和一种可自动充气气球的原理是利用叠氮化钠受撞击会分解,产生大量的气体氮气
哪种化学反应对气球充气效果好
第一种:汽车安全气囊和一种可自动充气气球的原理是利用叠氮化钠受撞击会分解,产生大量的气体氮气.
第二种:自动充气气球能自己充气是因为利用了稀盐酸(即食用柠檬酸)和碳酸氢钠(即食用小苏打粉)混合产生二氧化碳的化学原理.(此种气球大多是比较厚的材质)
请问:
1、这两种充气原理哪种更适合应用在比较小且薄的气球上.
2、哪种原理产生的温度更高(气球本体空间小且薄,如果贴近皮肤,会不会伤及皮肤). 等你在三西路1年前6
等你在三西路1年前6 -
 小鼻涕虫 共回答了19个问题
小鼻涕虫 共回答了19个问题 |采纳率89.5%第二种,第一种需要撞击,容易损坏气球,且反应太快.而第二种可以控制反应速率.第一种温度更高,但两种温度都不会伤及皮肤,就是盐酸要小心.1年前查看全部
- 汽车安全气囊内的物质,在碰撞瞬间能生成一种空气中含量最多的气体,该气体是( )
汽车安全气囊内的物质,在碰撞瞬间能生成一种空气中含量最多的气体,该气体是( )
A.氮气
B.氧气
C.稀有气体
D.二氧化碳 ttt10111年前1
ttt10111年前1 -
 神格化如每特 共回答了13个问题
神格化如每特 共回答了13个问题 |采纳率84.6%解题思路:空气中各成分的体积分数分别是:氮气大约占78%、氧气大约占21%、稀有气体大约占0.94%、二氧化碳大约占0.03%、水蒸气和其它气体和杂质大约占0.03%;汽车安全气囊内的物质,在碰撞瞬间能生成一种空气中含量最多的气体,该气体是氮气.A、汽车安全气囊内的物质,在碰撞瞬间能生成一种空气中含量最多的气体,该气体是氮气,因为氮气大约占78%,故选项正确;
B、氧气大约占21%,不是空气中最多的气体,故选项错误;
C、稀有气体大约占0.94%,含量较少,故选项错误;
D、二氧化碳大约占0.03%,含量较少,故选项错误;
故选A点评:
本题考点: 空气的成分及各成分的体积分数.
考点点评: 本考点考查了空气中各种气体的含量,同学们要加强记忆有关的知识点,在理解的基础上加以应用,本考点基础性比较强,主要出现在选择题和填空题中.1年前查看全部
- (2008•顺义区一模)一种汽车安全气囊内贮有硝酸铵,当汽车在高速行驶中受到猛烈撞击时,发生化学反应NH4NO3
(2008•顺义区一模)一种汽车安全气囊内贮有硝酸铵,当汽车在高速行驶中受到猛烈撞击时,发生化学反应NH4NO3
X+2H2O,则X的化学式为( )撞击 .
A.NO
B.N2O
C.NO2
D.HNO3 hdwb3181年前1
hdwb3181年前1 -
 缨子儿 共回答了18个问题
缨子儿 共回答了18个问题 |采纳率94.4%解题思路:根据化学变化前后原子的种类、数目不变,由反应的化学方程式NH4NO3
X+2H2O,推断反应中生成物X的分子构成,根据分子的构成确定X物质的化学式.撞击 .由反应的化学方程式NH4NO3
撞击
.
X+2H2O,可得知:
反应前 反应后
N原子 2 0
H原子 4 4
O原子 3 2
根据化学变化前后原子的种类、数目不变,可判断生成物X的分子由2个N原子和1个O原子构成,则物质X的化学式为N2O;
故选B.点评:
本题考点: 有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 根据化学变化前后原子的种类、数目不变,由反应的化学方程式,可以推断反应中某物质的分子构成及物质化学式的确定.1年前查看全部
- 为使汽车安全转弯,以下做法可取的是( )
为使汽车安全转弯,以下做法可取的是( )
A.遇到弯道应当加快速度通过
B.遇到弯道应当减速通过
C.建造公路时,弯道内侧要比外侧高
D.建造公路时,弯道内、外侧一样高 蓝色血液的蓝1年前1
蓝色血液的蓝1年前1 -
 herlunngowa 共回答了19个问题
herlunngowa 共回答了19个问题 |采纳率89.5%解题思路:汽车在水平弯道转弯时,做的是圆周运动.此时汽车需要的向心力是由静摩擦力提供的,而汽车的最大安全速度是指由路面的最大静摩擦力提供向心力,从而求出的速度.当速度再大时,汽车就会侧向滑动,失去控制了.建造公路时,弯道内侧要比外侧低,速度恰当时,由重力和路面的支持力的合力提供向心力.A、汽车在圆弧水平弯道路面行驶,做圆周运动,其所需要的向心力由静摩擦力提供,则:
F静=m
v2
R由上式可知,当静摩擦力越大时,速度也越大.所以静摩擦力最大时,速度达最大.当速度继续增大时,静摩擦力不足以提供所需要的向心力,将做离心运动,所以为了安全转弯,必须减速,故A错误,B正确.
C、建造公路时,弯道内侧要比外侧低,速度恰当时,由重力和路面的支持力的合力提供向心力.故C错误,D错误.
故选:B.点评:
本题考点: 向心力.
考点点评: 搞清汽车做圆周运动所需要的向心力来源是本题关键,同时知晓安全速度是指汽车在转向时没有侧向位移,不发生离现象.1年前查看全部
- 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
应用研究:
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为______.
制备研究:
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______.
Na2CO3质量分数测定:工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体).
(3)装置A的作用是______.设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,______;⑤再次称量装置C.计算碳酸钠含量至少需要测定______(填数字)个数据.根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因______.
NaN3纯度测定:
精确称量0.140g NaN3样品,设计如图装置,测定其纯度.已知2NaN3→3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差______(填“变大”、“变小”或“不变”),说明气密性良好.
(5)使小试管中的NaN3样品与M溶液接触的操作是______.
(6)使用冷水冷凝的目的是______.反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是______.
(7)常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是______(填字母序号).
A.100mLB.1LC.2L
(8)计算NaN3样品的纯度(写出计算过程). magichmw1年前1
magichmw1年前1 -
 叮当喵 共回答了21个问题
叮当喵 共回答了21个问题 |采纳率95.2%解题思路:(1)根据信息判断反应物、生成物、反应条件,然后写出方程式.
(2)根据质量守恒定律和氨水呈碱性回答.
(3)根据碱石灰的成分和用途回答前一空;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置.
(4)根据出现液面差后,如装置严密,装置内的气压不变的情况回答.
(5)使锥形瓶倾斜,让小试管倾斜其中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝可除去生成的气体中的水蒸气;生成的气体进入量气管后,右管中液面上升,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出.
(8)先根据体积和密谋计算氮气的体积,再利用关系式2NaN3→3N2计算NaN3样品的纯度.(1)汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2,即反应物是NaN3,生成物是Na、N2,条件是撞击,所以反应方程式为 2NaN3
撞击
.
2Na+3N2↑.
(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X为氨气,氨水呈碱性,检验时用无色酚酞试纸或红色石蕊试纸.
(3)碱石灰的主要成分是氧化钙和氢氧化钠,二者既能吸收水分,又能吸收二氧化碳气体,所以A的作用是除去空气中的二氧化碳和水蒸气;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置;计算碳酸钠含量,要知道样品的质量、反应前后C装置的质量,共3个数据;制备工业级NaN3时同时生成氢氧化钠,它能和空气中的二氧化碳反应生成Na2CO3.
(4)连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,如装置严密,装置内气压不变,两边高度差不变.
(5)使小试管中的NaN3样品与M溶液接触的操作是使锥形瓶倾斜,让小试管中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝的目的是除去生成的气体中的水蒸气;为了排除两侧液面不水平,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出,所以选100mL的量筒.
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%.
故答案为:(1)2NaN3
撞击
.
2Na+3N2↑;
(2)无色酚酞试纸或红色石蕊试纸;
(3)除去空气中的二氧化碳和水蒸气;鼓入空气;3;制备过程中未除净的氢氧化钠与空气中的二氧化碳反应生成的;
(4)不变;
(5)使锥形瓶倾斜;
(6)除去生成的气体中的水蒸气;调节量气管使,两侧的液面保持水平;
(7)A;
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%..点评:
本题考点: 实验探究物质的组成成分以及含量;化学实验方案设计与评价.
考点点评: 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练.1年前查看全部
- 汽车安全气囊内所装化学物质,能在碰撞后10毫秒内生成氮气,氮气还是常用的食品保鲜充填气体,你认为选用它做食品保鲜填充气的
汽车安全气囊内所装化学物质,能在碰撞后10毫秒内生成氮气,氮气还是常用的食品保鲜充填气体,你认为选用它做食品保鲜填充气的原因是______.
 duanduanup1年前1
duanduanup1年前1 -
 可靠135 共回答了17个问题
可靠135 共回答了17个问题 |采纳率76.5%解题思路:食品的保鲜需选用性质稳定、无毒、无任何副作用的物质,需要考虑物质的化学性质是否活泼、是否对人体有害、原料是否易得、价格是否经济等方面的问题.氮气是常用的充填气体,选用氮气的主要原因是氮气的化学性质不活泼,对人体无害,原料易得,价格经济.
故答案为:化学性质不活泼,对人体无害,原料易得,价格经济.点评:
本题考点: 常见气体的用途.
考点点评: 与生活相关的化学知识,是化学考查热点,物质的性质决定物质的用途,在学习过程中要注意理论联系实际,运用所学知识去解决实际问题.1年前查看全部
- 叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:2NaNH2+N2O
叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:2NaNH2+N2O
 叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
2NaNH2+N2O═NaN3+NaOH+NH3↑
3NaNH2+NaNO3═NaN3+3NaOH+NH3↑
(1)①氮原子的L层电子排布图______.
②氮所在的周期中,第一电离能最大的元素为______(填元素符号).
③与N3互为等电子体的粒子为______(写出一种).
④氨气的电子式______.
(2)NH3沸点(-33.34℃)比N2O沸点(-88.49℃)高,其主要原因是______
(3)依据价层电子对互斥理论,NO-3间构型呈______形.
(4)汽车安全气囊的设计是基于反应6NaN3+Fe2O3═3Na2O+2Fe+9N2↑,生成物中的铁是一种常见物质,而铁的晶体有三种堆积方式,其中两种的堆积方式如图所示,下列有关铁及晶体的说法中正确的是______.
A.金属铁的导电性是由于通电时产生的自由电子作定向移动
B.α-Fe、γ-Fe的堆积方式分别与钾和铜相同
C.空间利用率α-Fe大于γ-Fe
D.金属铁内部存在金属键
(5)铁的上述两种晶体(α-Fe:γ-Fe)的密度比值为______.(写成小数,保留2位有效数字)
 布诺美1年前1
布诺美1年前1 -
 Qlxs 共回答了14个问题
Qlxs 共回答了14个问题 |采纳率85.7%(1)①氮原子的L层上,2s能级上有2个电子、2p能级上有3个电子,根据能量最低原理、洪特规则、保里不相容原理知,其L层电子排布图为 ,故答案为:
,故答案为: ;
;
②同一周期中,元素第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素大于相邻元素,所以第二周期元素中第一电离能最大的是Ne,故答案为:Ne;
③价电子数相等、原子个数相等的微粒互斥等电子体,与N3互为等电子体的粒子有CO2等,故答案为:CO2等;
④氨气分子中氮原子和每个氢原子之间都存在一个共用电子对,氨气分子的电子式为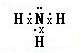 ,故答案为:
,故答案为: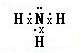 ;
;
(2)NH3中存在氢键,N2O中不存在氢键,氢键的存在导致NH3沸点(-33.34℃)比N2O沸点(-88.49℃)高,故答案为:氨气分子间存在氢键;
(3)NO-3中价层电子对个数=3+[1/2](5+1-3×2)=3且不含孤电子对,所以其空间构型为平面三角形,故答案为:平面三角;
(4)A.金属铁的导电性是由于通电时自由电子作定向移动,电子不是通电才产生的,故错误;
B.α-Fe、γ-Fe的堆积方式分别与钾和铜相同,α-Fe为体心立方堆积,γ-Fe为面心立方堆积,故正确;
C.空间利用率α-Fe小于γ-Fe,故错误;
D.金属晶体中存在金属键,所以金属铁内部存在金属键,故正确;
故选BD;
(5)α-Fe中Fe原子个数=1+8×[1/8]=2,γ-Fe中Fe原子个数=8×[1/8]+6×
1
2=4,设Fe原子半径为r,α-Fe中晶胞边长=
4r
3,γ-Fe中晶胞的边长=
4r
2,α-Fe密度ρ=
m
V=
56
NA×2
(
4r
3)3,γ-Fe密度=
56
NA×4
(1年前查看全部
- (2011•娄底)汽车安全气囊内所装化学物质,能在碰撞后10毫秒内,生成一种空气中含量最多的气体,该气体是( )
(2011•娄底)汽车安全气囊内所装化学物质,能在碰撞后10毫秒内,生成一种空气中含量最多的气体,该气体是( )
A.氮气
B.氧气
C.稀有气体
D.二氧化碳 llsherry12031年前1
llsherry12031年前1 -
 三级棍 共回答了23个问题
三级棍 共回答了23个问题 |采纳率91.3%解题思路:熟记空气中各成分及体积分数,就能解决这一题目.空气中各成分及体积分数为:氮气78%、氧气21%、稀有气体0.94%、二氧化碳0.03%、水蒸气和杂质0.03%.所以空气中含量最多的气体是氮气.
故选:A.点评:
本题考点: 空气的成分及各成分的体积分数.
考点点评: 此题考查学生只要能熟记空气中各成分及体积分数,再能灵活运用,就能很轻松的解决此类问题.1年前查看全部
- (2014•黄冈模拟)LiN3与NaN3在军事和汽车安全气囊上有重要应用.
 (2014•黄冈模拟)LiN3与NaN3在军事和汽车安全气囊上有重要应用.
(2014•黄冈模拟)LiN3与NaN3在军事和汽车安全气囊上有重要应用.
(1)N元素基态原子核外电子排布图为______.
(2)熔点LiN3______NaN3(填写“>”“<”或“=”)理由是______.
(3)工业上常用反应NaNO2+N2H4═NaN3+2H2O制备NaN3
①该反应中出现的第一电离能最大的元素是______(填元素符号,下同),电负性最大的元素是______.
②NO2-空间构型是______.
③N2H4中N原子的杂化方式为______,N2H4极易溶于水,请用氢键表示式写出N2H4水溶液中存在的所有类型的氢键______.
(4)LiN3的晶体为立方体,如图所示,若已知LiN3的密度为ρ g/cm3,摩尔质量为M g/mol,NA表示阿伏伽德罗常数,则LiN3晶体中阴,阳离子之间的最近距离为
×2 2
×10103 2M ρ•NA pm.
×2 2
×10103 2M ρ•NA  扑壳07281年前1
扑壳07281年前1 -
 zhgtv 共回答了23个问题
zhgtv 共回答了23个问题 |采纳率100%解题思路:(1)根据N原子序数,结合能量最低原则、泡利不相容原理和洪特规则,写出核外电子排布式,从而写出核外电子排布图;
(2)判断两种化合物均为离子晶体,利用离子晶体晶格能比较熔点;
(3)①反应中所含元素为:Na、N、O和H元素,根据第一电离能和电负性递变规律判断;
②根据NO2-的杂化类型,判断其空间构型;
③根据N2H4中N原子成键数和孤对电子数判断杂化方式;H与N和O形成化学键时,彼此间容易形成氢键;
(4)根据晶胞结构计算出晶胞中所含微粒的数目,再根据密度和摩尔质量,计算出晶胞体积,从而得到晶胞边长,阴、阳离子之间的最近距离为晶胞边长的
倍.2 2 (1)N原子序数为7,核外电子排布式为1s22s22p3,根据洪特规则和泡利不相容原理,其核外电子排布图为
 ,故答案为:
,故答案为: ;
;
(2)两种化合物均为离子晶体,晶格能越大,熔点越高,由于Li+半径小于Na+,晶格能较大,熔点高,故答案为:>;Li+半径小,晶格能大,熔点高;
(3)①第一电离能同周期从左到右,呈增大趋势,由于N原子价电子半充满,比O原子稳定,第一电离能大于O;电负性,同周期从左到右,逐渐增大,电负性较强的为O原子,故答案为:N;O;
②NO2-中N原子价电子对数为:[5+1/2]=3,形成三条杂化轨道,其中两条杂化轨道与O形成了两条共价键,一对孤对电子占据剩余的杂化轨道,其空间构型为V形,
故答案为:V形;
③N2H4中N原子与另一个N原子形成一条共价键,与两个氢原子形成两条共价键,共形成三条共价键,还有一对孤对电子占据一条杂化轨道,即共形成了4条杂化轨道,杂化类型为sp3;一对孤对电子占据剩余的杂化轨道,其空间构型为V形,故答案为:V形;N-H键中的H原子可与其相邻的N-H键中的N原子形成氢键、可与O-H中的O原子形成氢键,O-H中的H原子可与相邻的O-H中的O原子形成氢键,也可和N-H键中的N原子形成氢键,故答案为: ;
;
(4)Li+位于晶胞顶点和面心,数目为:2×[1/2]+8×[1/8]=2,N3-位于面心,数目为:4×[1/2]=2,则一个晶胞质量为:[M
NA×2g,一个晶胞体积为:
2M
NA/ρ]cm3,晶胞边长为:
3
2M
ρ•NA
cm=
3
2M
ρ•NA
×1010pm,阴、阳离子之间的最近距离为晶胞边长的
2
2倍,为
2点评:
本题考点: 晶胞的计算;原子核外电子排布;元素电离能、电负性的含义及应用;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查电子排布图、分子空间构型、杂化类型的判断以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法.1年前查看全部
- 汽车安全气囊内所装化学物质,能在碰撞后10毫秒内生成一种空气中体积分数最大的气体,该气体是
汽车安全气囊内所装化学物质,能在碰撞后10毫秒内生成一种空气中体积分数最大的气体,该气体是
A 氧气
B 二氧化碳
C 稀有气体
D 氮气 zjzzfh1011年前1
zjzzfh1011年前1 -
 我是朱佳静 共回答了16个问题
我是朱佳静 共回答了16个问题 |采纳率81.3%D1年前查看全部
- 汽车安全保护装置有哪些类型?请具体说明,
 实现理想1年前1
实现理想1年前1 -
 眉眼如花 共回答了18个问题
眉眼如花 共回答了18个问题 |采纳率100%亮才牌汽车安全保护器分为主动保护和被动保护,最大限度保护人身安全,其他的有安全气囊安全带等.目前国际汽车保护装置只注重保护人,不注重保护车,却不知保护了车也就保护了人.贺亮才发明的汽车安全保护器,使人与车都受到了保护,是一项了不起的发明.1年前查看全部
- (2013•江苏三模)在5-氨基四唑()中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
 (2013•江苏三模)在5-氨基四唑(
(2013•江苏三模)在5-氨基四唑(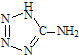 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
(1)基态Ga原子的电子排布式可表示为______;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为______,其中N原子的杂化类型为______;在1mol 5-氨基四唑中含有的σ键的数目为______.
(3)叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为______.
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物.其结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,这种碳氮化钛化合物的化学式为______. 小马跑跑1年前1
小马跑跑1年前1 -
 风知我心 共回答了19个问题
风知我心 共回答了19个问题 |采纳率94.7%解题思路:(1)Ga是31号元素,其核外有31个电子,根据构造原理写出其核外电子排布式;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大;根据价层电子对互斥理论确定其杂化方式;共价单键是σ键,共价双键中一个是σ键一个是π键;
(3)①根据价层电子对互斥理论确定其空间构型;
②利用均摊法计算该晶胞中含有的各种原子个数,从而确定其化学式.(1)Ga是31号元素,其核外有31个电子,根据构造原理知,其核外电子排布式为:[Ar]3d104s24p1
,故答案为:[Ar]3d104s24p1;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大,吸引电子能力大小顺序是N>C>H,所以其电负性大小顺序是N>C>H;
含有两个共价单键和一个孤电子对的N原子其杂化方式是sp2,含有三个共价单键和一个孤电子对的N原子其杂化方式是sp3;
共价单键是σ键,共价双键中一个是σ键一个是π键,所以该分子中含有9个σ键,所以在1mol 5-氨基四唑中含有的σ键的数目为 9NA,
故答案为:N>C>H;sp2、sp3;9NA;
(3)①N3-中价层电子对=2+
1
2(5+1−2×3)=2,且该离子中不含孤电子对,所以其空间构型是直线型,故答案为:直线型;
②该晶胞中碳原子个数=8×
1
8=1,N原子个数=6×
1
2=3,Ti原子个数=1+12×
1
4=4,所以其化学式为:Ti4CN3,故答案为:Ti4CN3.点评:
本题考点: 晶胞的计算;原子核外电子排布;判断简单分子或离子的构型.
考点点评: 本题考查电负性、化学式的确定、杂化方式的判断等知识点,会运用价层电子对互斥理论确定杂化方式和空间构型,难度不大.1年前查看全部
- 叠氮化钠(NaN 3 )被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN 3 )被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
应用研究:
(1)汽车经撞击后,30毫秒内引发NaN 3 ,迅速分解为Na、N 2 ,反应方程式为______.
制备研究:
(2)将金属钠与液态氨反应得NaNH 2 ,再将NaNH 2 与N 2 O反应可生成NaN 3 、NaOH和气体X,该反应的化学方程式为2NaNH 2 +N 2 O=NaN 3 +NaOH+X,实验室检验X气体使用的试纸是湿润的______.
Na 2 CO 3 质量分数测定:工业级NaN 3 中常含有少量的Na 2 CO 3 ,为测定样品中Na 2 CO 3 的质量分数设计如图
装置(已知H 2 SO 4 溶液与NaN 3 ,反应不生成气体).
(3)装置A的作用是______.设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,______;⑤再次称量装置C.计算碳酸钠含量至少需要测定______(填数字)个数据.根据制备反应,分析工业级NaN 3 中含有Na 2 CO 3 的可能原因______.
NaN 3 纯度测定:
精确称量0.140gNaN 3 样品,设计如图装置,测定其纯度.已知2NaN 3 →3N 2
(NaN 3 中的N全部转化为N 2 ,其他产物略),反应中放出大量的热.
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差______(填“变大”、“变小”或“不变”),说明气密性良好.
(5)使小试管中的NaN 3 样品与M溶液接触的操作是______.
(6)使用冷水冷凝的目的是______.反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是______.
(7)常温下测得量气管读数为67.2mL(N 2 的密度为1.25g/L),则实验中选用的量气管规格合适的是______(填字母序号).
A.100mLB.1LC.2L
(8)计算NaN 3 样品的纯度(写出计算过程). 某迴1年前1
某迴1年前1 -
 bluewaterfall 共回答了21个问题
bluewaterfall 共回答了21个问题 |采纳率95.2%(1)汽车经撞击后,30毫秒内引发NaN 3 迅速分解为Na、N 2 ,即反应物是NaN 3 ,生成物是Na、N 2 ,条件是撞击,所以反应方程式为 2NaN 3
撞击
.
2Na+3N 2 ↑.
(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X为氨气,氨水呈碱性,检验时用无色酚酞试纸或红色石蕊试纸.
(3)碱石灰的主要成分是氧化钙和氢氧化钠,二者既能吸收水分,又能吸收二氧化碳气体,所以A的作用是除去空气中的二氧化碳和水蒸气;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置;计算碳酸钠含量,要知道样品的质量、反应前后C装置的质量,共3个数据;制备工业级NaN 3 时同时生成氢氧化钠,它能和空气中的二氧化碳反应生成Na 2 CO 3 .
(4)连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,如装置严密,装置内气压不变,两边高度差不变.
(5)使小试管中的NaN 3 样品与M溶液接触的操作是使锥形瓶倾斜,让小试管中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝的目的是除去生成的气体中的水蒸气;为了排除两侧液面不水平,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出,所以选100mL的量筒.
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN 3 样品的纯度X
2NaN 3 →3N 2
130 84
X×0.140g0.084g
X=92.86%
答:NaN 3 样品的纯度92.86%.
故答案为:(1)2NaN 3
撞击
.
2Na+3N 2 ↑;
(2)无色酚酞试纸或红色石蕊试纸;
(3)除去空气中的二氧化碳和水蒸气;鼓入空气;3;制备过程中未除净的氢氧化钠与空气中的二氧化碳反应生成的;
(4)不变;
(5)使锥形瓶倾斜;
(6)除去生成的气体中的水蒸气;调节量气管使,两侧的液面保持水平;
(7)A;
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN 3 样品的纯度X
2NaN 3 →3N 2
130 84
X×0.140g0.084g
X=92.86%
答:NaN 3 样品的纯度92.86%..1年前查看全部
- (2010•扬州)叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
(2010•扬州)叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
应用研究:
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为2NaN3
2Na+3N2↑撞击 .2NaN3.
2Na+3N2↑撞击 .
制备研究:
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______.
Na2CO3质量分数测定:工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体).
(3)装置A的作用是______.设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,______;⑤再次称量装置C.计算碳酸钠含量至少需要测定______(填数字)个数据.根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因______.
NaN3纯度测定:
精确称量0.140g NaN3样品,设计如图装置,测定其纯度.已知2NaN3→3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差______(填“变大”、“变小”或“不变”),说明气密性良好.
(5)使小试管中的NaN3样品与M溶液接触的操作是______.
(6)使用冷水冷凝的目的是______.反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是______.
(7)常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是______(填字母序号).
A.100mLB.1LC.2L
(8)计算NaN3样品的纯度(写出计算过程). qwert_6681年前1
qwert_6681年前1 -
 我就是爱八卦 共回答了21个问题
我就是爱八卦 共回答了21个问题 |采纳率81%解题思路:(1)根据信息判断反应物、生成物、反应条件,然后写出方程式.
(2)根据质量守恒定律和氨水呈碱性回答.
(3)根据碱石灰的成分和用途回答前一空;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置.
(4)根据出现液面差后,如装置严密,装置内的气压不变的情况回答.
(5)使锥形瓶倾斜,让小试管倾斜其中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝可除去生成的气体中的水蒸气;生成的气体进入量气管后,右管中液面上升,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出.
(8)先根据体积和密谋计算氮气的体积,再利用关系式2NaN3→3N2计算NaN3样品的纯度.(1)汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2,即反应物是NaN3,生成物是Na、N2,条件是撞击,所以反应方程式为 2NaN3
撞击
.
2Na+3N2↑.
(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X为氨气,氨水呈碱性,检验时用无色酚酞试纸或红色石蕊试纸.
(3)碱石灰的主要成分是氧化钙和氢氧化钠,二者既能吸收水分,又能吸收二氧化碳气体,所以A的作用是除去空气中的二氧化碳和水蒸气;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置;计算碳酸钠含量,要知道样品的质量、反应前后C装置的质量,共3个数据;制备工业级NaN3时同时生成氢氧化钠,它能和空气中的二氧化碳反应生成Na2CO3.
(4)连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,如装置严密,装置内气压不变,两边高度差不变.
(5)使小试管中的NaN3样品与M溶液接触的操作是使锥形瓶倾斜,让小试管中的药品流出来.
(6)反应可能产生水蒸气,使用冷水冷凝的目的是除去生成的气体中的水蒸气;为了排除两侧液面不水平,液柱形成的压强对气体体积大小有影响,反应后读数时,还需要进行的操作是调节量气管使,两侧的液面保持水平.
(7)量取体积时,量筒的量程要和所测体积相近,且只能一次量出,所以选100mL的量筒.
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%.
故答案为:(1)2NaN3
撞击
.
2Na+3N2↑;
(2)无色酚酞试纸或红色石蕊试纸;
(3)除去空气中的二氧化碳和水蒸气;鼓入空气;3;制备过程中未除净的氢氧化钠与空气中的二氧化碳反应生成的;
(4)不变;
(5)使锥形瓶倾斜;
(6)除去生成的气体中的水蒸气;调节量气管使,两侧的液面保持水平;
(7)A;
(8)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3→3N2
130 84
X×0.140g0.084g
X=92.86%
答:NaN3样品的纯度92.86%..点评:
本题考点: 实验探究物质的组成成分以及含量;化学实验方案设计与评价.
考点点评: 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练.1年前查看全部
- 汽车中常配有一种汽车安全气囊,内部贮存有硝酸铵.当汽车高速行驶中受到猛烈撞击时,硝酸铵会迅速分解产生大量一氧化二氮气体和
汽车中常配有一种汽车安全气囊,内部贮存有硝酸铵.当汽车高速行驶中受到猛烈撞击时,硝酸铵会迅速分解产生大量一氧化二氮气体和另一种氧化物充满气囊,以防止乘坐人员受伤.
(1)写出硝酸铵受撞击后发生分解反应的化学方程式:NH4NO3
N2O↑+2H2O撞击 .NH4NO3.
N2O↑+2H2O撞击 .
(2)此反应中,所有反应物和生成物中氮元素的化合价分别是多少______. 宇观1年前1
宇观1年前1 -
 哑女公主 共回答了15个问题
哑女公主 共回答了15个问题 |采纳率86.7%解题思路:(1)根据题意,硝酸铵受撞击后发生分解反应生成一氧化二氮气体和另一种氧化物,根据质量守恒定律,另一种氧化物是水,写出反应的化学方程式即可.
(2)根据原子团中正负化合价代数和等于原子团的化合价、在化合物中正负化合价代数和为零,结合各含氮元素的化学式进行解答本题.(1)根据题意,硝酸铵受撞击后发生分解反应生成一氧化二氮气体和另一种氧化物,根据质量守恒定律,另一种氧化物是水,反应的化学方程式为:NH4NO3
撞击
.
N2O↑+2H2O.
(2)铵根显+1价,氢元素显+1价,设铵根中氮元素的化合价为x,可得:x+(+1)×4=+1,x=-3.
硝酸根显-1价,氧元素显-2价,设硝酸根中氮元素的化合价为y,可得:y+(-2)×3=-1,y=+5.
氧元素显-2价,设一氧化二氮中氮元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:2z+(-2)=0,则z=+1.
故答案为:(1)NH4NO3
撞击
.
N2O↑+2H2O;(2)-3、+5、+1.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;有关元素化合价的计算.
考点点评: 本题难度不是很大,掌握化学方程式的书写方法、利用化合价的原则计算指定元素的化合价的方法是正确解答本题的关键.1年前查看全部
- 高级汽车中常配置一种汽车安全气囊,内部贮存有硝酸铵(NH4NO3),当汽车高速行驶中受到猛烈撞击时,硝酸铵迅速反应产生大
高级汽车中常配置一种汽车安全气囊,内部贮存有硝酸铵(NH4NO3),当汽车高速行驶中受到猛烈撞击时,硝酸铵迅速反应产生大量一氧化二氮(N2O)气体和另一种氧化物充满气囊,填补在驾驶员与挡风玻璃、方向盘之间,防止人员受伤.
(1)NH4NO3受撞击后发生反应的化学方程式为NH4NO3
N2O↑+2H2O撞击 .NH4NO3,反应的基本类型是______反应.
N2O↑+2H2O撞击 .
(2)此反应中反应物和生成物中氮元素的化合价从左到右依次是______. yuch011x1年前1
yuch011x1年前1 -
 蓝月新 共回答了19个问题
蓝月新 共回答了19个问题 |采纳率94.7%解题思路:(1)书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须依据客观事实、遵守质量守恒定律.结合反应特点来分析反应类型;
(2)根据化学式求化合价要根据在化合物中正负化合价代数和为零来求化学式.(1)硝酸铵受撞击时易分解产生一氧化二氮气体和水.该反应的化学方程式为:NH4NO3
撞击
.
N2O↑+2H2O;符合“一变多”的特点,属于分解反应;故填:NH4NO3
撞击
.
N2O↑+2H2O;分解;
(2)由于铵根显+1价,设氮元素的化合价为X:由X+(+1)×4=+1,解得X=-3,硝酸根显-1价,设其中氮元素化合价为Y:由Y+(-2)×3=-1解得Y=+5,设N2O中氮元素化合价为Z:Z×2+(-2)=0解得Z=+1.
故填:-3,+5,+1.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;有关元素化合价的计算;反应类型的判定.
考点点评: 要熟记方程式的书写方法,容易出错的地方是气体上升符号容易漏标,在计算原子团中某元素的化合价时要根据正负化合价代数和为原子团的化合价,来考虑本题.1年前查看全部
- (10分)叠氮化钠(NaN 3 )被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究。
(10分)叠氮化钠(NaN 3 )被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究。

【查阅资料】
①NaN 3 受撞击会生成Na、N 2 .
②NaN 3 遇盐酸、H 2 SO 4 溶液无气体生成.
③碱石灰是CaO和 NaOH的混合物.
④NaN 3 的制备方法是:将金属钠与液态氨反应制得NaNH 2 ,再将NaNH 2 与N 2 O反应可生成NaN 3 、NaOH和氨气(NH 3 ).
【问题探究】
⑴汽车经撞击后,30毫秒内引发NaN 3 迅速分解,写出该反应的化学方程式:
① 。
⑵工业级NaN 3 中常含有少量的Na 2 CO 3 ,其原因是(用化学方程式表示):
② 。
⑶为测定某工业级NaN 3 样品中含有Na 2 CO 3 的质量分数,化学小组同学设计了如下实验
装置。
①小明同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na 2 CO 3 的纯度,小组内同学通过讨论认为不可以,其理由可能是 ③ 。
②小刚同学在大家讨论的基础上,设计了装置II.请分析:装置II中A的作用 ④ ;若无装置C,对测定结果造成的影响是 ⑤ (填“偏大”、“偏小”或“无影响”);
③根据装置II,小组同学设计的实验步骤有:
a.称量装置D.
b.称量样品,检查装置气密性.
c.打开弹簧夹,鼓入空气.
d.打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞.
其正确顺序为 ⑥ (填字母序号,可重复).
⑷该小组对某一工业级NaN 3 样品进行检测。取100克该样品于烧杯中,加水将其溶解,然后逐滴加入一定溶质质量分数的稀硫酸并不断振荡。
首先发生的反应是:2Na 2 CO 3 +H 2 SO 4 =2NaHCO 3 +Na 2 SO 4 ;然后发生的反应是:2NaHCO 3 +H 2 SO 4 = Na 2 SO 4 +2H 2 O+2CO 2 ↑;在上述过程中生成二氧化碳的质量与加入稀硫酸质量的关系如图甲所示。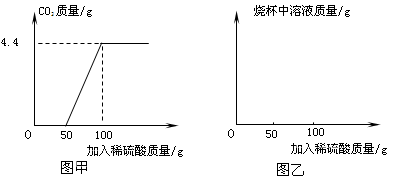
①请你根据以上信息,在图乙的坐标系中画出检测过程中烧杯中溶液的质量随滴加硫酸溶液质量的变化曲线。
②计算该样品中纯碱的质量分数。 hanml1年前1
hanml1年前1 -
 李小马哥哥 共回答了24个问题
李小马哥哥 共回答了24个问题 |采纳率87.5%①2NaN 3 2Na+3N 2 ↑② 2NaOH+CO 2 =Na 2 CO 3 +H 2 O③ 浓盐酸有挥发性,挥发出的氯化氢气体会带来实验误差 ④ 吸收空气中的二氧化碳...1年前查看全部
- 叠氮化钠(NaN 3 )被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN 3 )被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【应用研究】
(1)汽车经撞击后,30毫秒内引发NaN 3 ,迅速分解为Na、N 2 ,反应方程式为 。
【制备研究】
(2)将金属钠与液态氨反应得NaNH 2 ,再将NaNH 2 与N 2 O反应可生成NaN 3 、NaOH和气体X,该反应的化学方程式为2NaNH 2 +N 2 O===NaN 3 +NaOH+X,实验室检验X 气体使用的试纸是湿润________。
【Na 2 CO 3 质量分数测定】工业级NaN 3 中常含有少量的Na 2 CO 3 ,为测定样品中Na 2 CO 3 的质量分数设计如图装置(已知H 2 SO 4 溶液与NaN 3 ,反应不生成气体)。 (碱石灰是NaOH和CaO的混合物)
(3)装置A的作用是 。设计的实验步骤为:
①精确称量样品,检查装置气密性;
②打开弹簧夹,鼓入空气,称量装置C;
③关闭弹簧夹,打开分液漏斗活塞;
④再打开弹簧夹, ;
⑤再次称量装置C。计算碳酸钠含量至少需要测定 (填数字)个数据。根据制备反应,分析工业级NaN 3 中含有Na 2 CO 3 的可能原因 。
【NaN 3 纯度测定】精确称量0.140gNaN 3 样品,设计如图装置,测定其纯度。已知2NaN 3 3N 2 (NaN 3 中的N全部转化为N 2 ,其他产物略),反应中放出大量的热。
3N 2 (NaN 3 中的N全部转化为N 2 ,其他产物略),反应中放出大量的热。 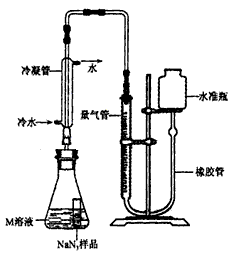
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差 (填“变大”、“变小”或“不变”),说明气密性良好。
(5)使小试管中的NaN 3 样品与M溶液接触的操作是 。
(6)使用冷水冷凝的目的是 。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是 。
(7)常温下测得量气管读数为67.2 mL(N 2 的密度为 1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN 3 样品的纯度(写出计算过程)。 线在涯天1年前1
线在涯天1年前1 -
 酸甜口香糖 共回答了19个问题
酸甜口香糖 共回答了19个问题 |采纳率84.2%1年前查看全部
- 2010浙江化学卷中有一道题汽车安全气囊是行车安全的重要保障.当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末分解
2010浙江化学卷中有一道题
汽车安全气囊是行车安全的重要保障.当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害.为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验.
经组成分析,确定该粉末仅含Na、Fe、N、O四种元素;水溶性试验表明,固体粉末部分溶解;经检测,可溶物为化合物甲,不溶物为红棕色固体,可溶于盐酸.取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L.单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质.化合物丙与空气接触可转化为可溶性盐.
请回答下列问题:
(1)甲的化学式为____,丙的电子式为__________.
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为____.
(3)单质乙与红棕色粉末发生反应的化学方程式为________,安全气囊中红棕色粉末的作用是 ___________________.
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是____.
A.KCl
B.KNO3
C.Na2S
D.CuO
(5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分(不考虑结晶水合物)__________.
为什么第(4)问是选择BD?硝酸钾不是只有在酸性条件下才有氧化性吗? 一老实人1年前1
一老实人1年前1 -
 三更雨6952 共回答了25个问题
三更雨6952 共回答了25个问题 |采纳率88%由题意,可推知甲为NaN3,不溶物为红棕色固体为Fe2O3,单质乙为Na,化合物丙为Na2O,Fe2O3的作用是氧化剂,氧化NaN3,有利于放出氮气,所以第(4)问选有氧化性的BD.这里的条件是通电点火造成高温,在高温下固体硝酸钾具有强氧化性.硝酸钾在酸性条件下才有氧化性是指在溶液中.1年前查看全部
- 汽车安全气囊内所装化学物质,能在碰撞后10毫秒内,生成一种空气中含量最多的气体,该气体是( )
汽车安全气囊内所装化学物质,能在碰撞后10毫秒内,生成一种空气中含量最多的气体,该气体是( )
A.氮气
B.氧气
C.二氧化碳
D.稀有气体 wangyuanhuai1年前1
wangyuanhuai1年前1 -
 瞎走乱逛 共回答了9个问题
瞎走乱逛 共回答了9个问题 |采纳率100%解题思路:根据题意,汽车安全气囊内所装化学物质,能在碰撞后10毫秒内,生成一种空气中含量最多的气体,空气中各成分的体积分数进行分析判断即可.空气中各成分及体积分数为:氮气78%、氧气21%、稀有气体0.94%、二氧化碳0.03%、水蒸气和杂质0.03%,空气中含量最多的气体是氮气;则汽车安全气囊内所装化学物质,能在碰撞后10毫秒内,生成一种空气中含量最多的气体是氮气.
故选:A.点评:
本题考点: 空气的成分及各成分的体积分数.
考点点评: 本题难度不大,熟记空气的成分及各成分的体积分数是解答此类题的关健.1年前查看全部
- 叠氮化钠(NaN 3 )是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。实验室测定叠氮化钠样品
叠氮化钠(NaN 3 )是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。实验室测定叠氮化钠样品中NaN 3 的质量分数。实验步骤如下:
①称取约2.5000g叠氮化钠试样,配成250mL溶液。
②准确量取25.00mL溶液置于锥形瓶中,用滴定管加入50.00mL 0.1000mol·L -1
(NH 4 ) 2 Ce(NO 3 ) 6 (六硝酸铈铵),
[发生反应为:2(NH 4 ) 2 Ce(NO 3 ) 6 +2NaN 3 =4NH 4 NO 3 +2Ce(NO 3 ) 3 +2NaNO 3 +3N 2 ↑](杂质不参与反应)。
③反应后将溶液稍稀释,然后向溶液中加入5mL浓硫酸,滴入2滴邻菲哕啉指示液,用0.0500mol·L -1 (NH 4 ) 2 Fe(SO 4 ) 2 (硫酸亚铁铵)标准滴定溶液滴定过量的Ce 4+ 至溶液由淡绿色变为黄红色(发生的反应为:Ce 4+ +Fe 2+ = Ce 3+ +Fe 3+ ),消耗硫酸亚铁铵标准溶液24.00mL。
(1)步骤①配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有 、 。
(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为 。
(3)若其它读数正确,滴定到终点后,读取滴定管中 (NH 4 ) 2 Fe(SO 4 ) 2 标准溶液体积按图图示读取,将导致所测定样品中叠氮化钠质量分数 (选填:“偏大”、“偏小”或“不变”)。
(4)通过计算确定叠氮化钠试样中含NaN 3 的质量分数为多少(写出计算过程)。 1202YY1年前1
1202YY1年前1 -
 tuliplin2005 共回答了17个问题
tuliplin2005 共回答了17个问题 |采纳率100%(1)250mL容量瓶、胶头滴管(每空1分,共2分)
(2)2NaN 3 2Na + 3N 2 ↑(2分)
2Na + 3N 2 ↑(2分)
(3)偏小(2分)
(4)n[(NH 4 ) 2 Ce(NO 3 ) 6 ]= 0.1000mol·L -1 ×50.00×10 -3 L=5.000×10 -3 mol
n[(NH 4 ) 2 Fe(SO 4 ) 2 ]= 0.0500mol·L -1 ×24.00×10 -3L=1.200×10-3 mol
与NaN 3 反应的n[(NH 4 ) 2 Ce(NO 3 ) 6 ]= 5.000×10 -3 mol-1.200×10 -3 mol
=3.800×10 -3 mol
ω= =0.9880 (共6分)
=0.9880 (共6分)
<>1年前查看全部
- (2013•顺义区二模)叠氮化钠(NaN3)受撞击时能在瞬间完全分解为钠和氮气,故可应用于汽车安全气囊.若产生56克(标
(2013•顺义区二模)叠氮化钠(NaN3)受撞击时能在瞬间完全分解为钠和氮气,故可应用于汽车安全气囊.若产生56克(标准状况下体积为44.8升)的氮气,应在气囊内填充叠氮化钠(NaN3)的质量是多少?
 快乐虹猫蓝兔1年前1
快乐虹猫蓝兔1年前1 -
 酷玩数码 共回答了20个问题
酷玩数码 共回答了20个问题 |采纳率90%解题思路:根据叠氮化钠分解的化学方程式结合生成的氮气的质量可以计算出叠氮化钠的质量.设应填充叠氮化钠的质量为x
2NaN3
撞击
.
2Na+3N2↑
13084
X56g
[130/x]=[84/56g]
解得:x≈86.7g
答:应填充叠氮化钠的质量为86.7g点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 根据化学反应方程式的计算的审题是非常关键的,一般是抓住“三找”;即一找化学反应方程式,二找已知量和未知量,三找用到的相对质量关系.1年前查看全部
- 汽车安全气囊内的物质在汽车受到碰撞时会迅速生成一种空气里含量最多的气体,从而保护驾乘人员减少损伤,该种气体是( ) A
汽车安全气囊内的物质在汽车受到碰撞时会迅速生成一种空气里含量最多的气体,从而保护驾乘人员减少损伤,该种气体是( ) A.氧气 B.水蒸气 C.二氧化碳 D.氮气  效果vur1年前1
效果vur1年前1 -
 fjjhh 共回答了19个问题
fjjhh 共回答了19个问题 |采纳率89.5%空气的组成按体积计算,大约是氮气78%,氧气21%,稀有气体0.94%,二氧化碳0.03%,其它气体和杂质0.03%,空气里含量最多的气体是氮气.故D正确.
故选D.1年前查看全部
- 硝酸铵是一种高效氮肥,白色固体,易溶于水,高级汽车中常配置有一种汽车安全气袋,内部贮存有硝酸铵.当汽车高速行驶中受到猛烈
硝酸铵是一种高效氮肥,白色固体,易溶于水,高级汽车中常配置有一种汽车安全气袋,内部贮存有硝酸铵.当汽车高速行驶中受到猛烈撞击时,硝酸铵迅速分解产生大量一氧化二氮气体和另一种氧化物充满气袋,填补在驾驶员与挡风玻璃、方向盘之间,防止驾驶员受伤.根据以上叙述填写下列各空白:(1)硝酸铵的物理性质是_________ (2)硝酸铵的化学性质是_________ (3)硝酸铵受撞击后发生分解反应的化学方程式是______________ (4)此反应中反应物和生成物中氮元素的化合价有_______种,分别是_______ 尤其是(2)(3),辛苦辛苦~
 4g1xi1年前1
4g1xi1年前1 -
 龙nn宗 共回答了22个问题
龙nn宗 共回答了22个问题 |采纳率100%(1)硝酸铵的物理性质是:白色固体,易溶于水.(2)硝酸铵的化学性质是:受到猛烈撞击时,会迅速分解产生大量一氧化二氮气体和水.(3)NH4NO3=撞击=N2O+2H2O (4)两种 +5和—31年前查看全部
大家在问
- 1他( )节省下自己的零花钱,( )靠帮邻居干活来凑这笔钱
- 2检验某物质中是否含有碳酸根或碳酸氢根时用到的试剂有( )和( ),发生的相关现象是?
- 3学校元旦文艺晚会需用气球3000个,某班全体同学自愿承担吹气球的工作.有10名同学最后因排练节目没有参加,这样,其他同学
- 4Tomorrow ia Millie's birthday.同义句
- 5一物质熔点214-217摄氏度,易溶于热水、乙醇、乙酸乙酯,微溶于冷水,不易溶于己烷,固态呈白色粉末状.能不能告诉我这种
- 6英语题,要解释和答案1.In spring,it will be warmer and warmer,( ) more
- 7(2014•沈阳二模)如图,某几何体的主视图和俯视图都是矩形,左视图是等腰直角三角形,则该几何体的体积为______.
- 8笔直走,朝左拐。翻译
- 9∫(cosx)ª dx (上限2/π,下限0)=?
- 100矩阵是几行几列的?还是0矩阵可以是任意几行几列,只要全是0就可以?
- 11例1、 三个连续奇数的和比其中最小的一个大36,求这三个连续奇数.
- 12工业生产中使用的乙炔主要来源于------,乙烯与甲烷在结构上的主要差异是---------,与乙烯结构相似的
- 13英语翻译在当前市场竞争日益激烈的环境下,如何提升企业自身竞争力的问题摆在每个企业面前,而强化企业内部控制建设是提升企业竞
- 14英语中be系动词可以和其他的动词一起使用吗
- 15空间中如何用向量证明平行,要公式!急!