是缺铁性贫血还是地中海贫血?患者信息:女 28岁 广东 深圳 病情描述(发病时间、主要症状等):孕妇第一次产检(14周6
 ellychen2022-10-04 11:39:541条回答
ellychen2022-10-04 11:39:541条回答患者信息:女 28岁 广东 深圳
病情描述(发病时间、主要症状等):
孕妇第一次产检(14周6天),末梢血化验结果:
检验项目x05结果 x05单位x05参考值范围
白细胞数(WBC)x059.5x05X10E9/Lx054~10
淋巴细胞绝对值(Lymph#)x0527x05X10E9/Lx050.4.1
中间型细胞绝对值(Mid#)x050.6x05X10E9/Lx050.1.8
中性粒细胞绝对值(Gran#)x056.2x05X10E9/Lx052~7.8
淋巴细胞百分数(Lymph%)x0528.1x05%x0520~40
中间型细胞百分数(Mid%)x056.6x05%x051~15
中性粒细胞百分数(Gran%)x0565.3x05%x0550~70
血红蛋白(HGB)x0592↓x05g/Lx05女:110~150
红细胞数(RBC)x054.15x05X10E12/Lx05女:3.5
红细胞比积(HCT)x0530↓x05%x0536~48
红细胞平均体积(MCV)x0572.4↓x05fLx0580~99
红细胞平均血红蛋白含量x0522.1↓x05Pgx0526~32
红细胞平均血红蛋白浓度x05306↓x05g/Lx05320~360
红细胞分布宽度(RDW-CV)x0516.9↑x05%x0511.14.5
红细胞分布宽度标准差x0544.3x05fLx0537~54
血小板数(PLT)x05251x05X10E9/Lx05100~300
血小板平均体积(MPV)x057.9x05fLx057.10.4
血小板分布宽度(PDW)x0516x05%x0515~17
血小板压积(PCT)x050.198x05%x050.108~0.282
白细胞数(WBC) 9.5
想得到怎样的帮助:
通过上面的检验结果,请知道的告诉我下:是属缺铁性贫血还是地中海贫血?跪谢!心急!
曾经治疗情况及是否有过敏、遗传病史:
无

已提交,审核后显示!提交回复
共1条回复
 gyf888 共回答了24个问题
gyf888 共回答了24个问题 |采纳率95.8%- 从报告上看是属于一般性贫血,没有大的问题,不用紧张,只要平时吃多一点补血的食物即可,关键是心情开朗,才有利于胎儿的发育.
- 1年前
相关推荐
- 从血红蛋白中铁元素的化合价看,缺铁性贫血患者应补几价铁元素
 kkk1230001年前3
kkk1230001年前3 -
 美如烟 共回答了16个问题
美如烟 共回答了16个问题 |采纳率87.5%血红蛋白里是二价铁,三价铁有强氧化性1年前查看全部
- 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe 2+ 的存在,设计并进行了如下实验 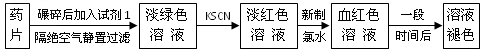
⑴试剂1是_____________。
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是
________________________。
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想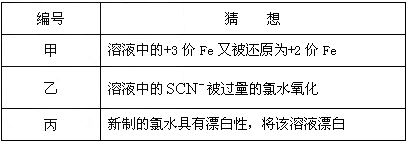
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充) 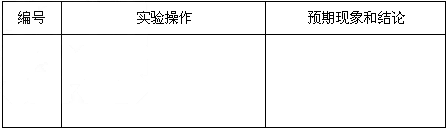
⑷另一同学为了检测“速力菲”药片中铁的含量,设计并进行了如下实验:
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H 2 O 2 溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为____________。 liuguzh1年前1
liuguzh1年前1 -
 llwwll11 共回答了16个问题
llwwll11 共回答了16个问题 |采纳率87.5%1年前查看全部
- 硫酸亚铁可用于治疗缺铁性贫血.某贫血患者每天需补充1.12g铁元素,则他服用的药物中含硫酸亚铁的质量至少为( )
硫酸亚铁可用于治疗缺铁性贫血.某贫血患者每天需补充1.12g铁元素,则他服用的药物中含硫酸亚铁的质量至少为( )
A. 3.80g
B. 6.95g
C. 10g
D. 3.04g 我不想说不1年前1
我不想说不1年前1 -
 ylk1100 共回答了14个问题
ylk1100 共回答了14个问题 |采纳率85.7%解题思路:此题需要先计算硫酸亚铁的含铁质量分数,然后利用铁的质量除以铁的质量分数即可求出硫酸亚铁的质量.先计算硫酸亚铁中铁的质量分数,然后用铁的质量除以其质量分数即可.
硫酸亚铁中铁的质量分数是:[56/56+32+16×4]×100%=36.8%
需硫酸亚铁的质量是 1.12g÷36.8%=3.04g
故选D点评:
本题考点: 化合物中某元素的质量计算.
考点点评: 此题是对化学式计算的考查,主要利用了元素的质量等于物质的质量乘以元素的质量分数的计算方法,属基础性化学计算题.1年前查看全部
- 下列关于“化学与生活”的认识不正确的是 A.食用铁强化酱油有助于预防缺铁性贫血 B.回收处理废旧电池既可节约金属资源又可
下列关于“化学与生活”的认识不正确的是
a.食用铁强化酱油有助于预防缺铁性贫血 b.回收处理废旧电池既可节约金属资源又可减少环境污染 c.用聚氯乙烯塑料作食品包装袋有害健康 d.为提高牛奶的含氮量,可向牛奶中添加三聚***胺  我胆子比肚子大1年前1
我胆子比肚子大1年前1 -
 yunluo6 共回答了22个问题
yunluo6 共回答了22个问题 |采纳率86.4%D
1年前查看全部
- 硫酸亚铁可用于治疗缺铁性贫血其化学式为FeSO4根据硫酸亚铁的化学式计算某贫血者需要补充14克铁
硫酸亚铁可用于治疗缺铁性贫血其化学式为FeSO4根据硫酸亚铁的化学式计算某贫血者需要补充14克铁
至少需要多少克硫酸亚铁? hanqiao12281年前1
hanqiao12281年前1 -
 mini0110 共回答了22个问题
mini0110 共回答了22个问题 |采纳率81.8%56 152
14 x
x==14*152/56==38 g
即需要 38 g FeSO41年前查看全部
- (2008•滨湖区一模)“速力菲”是治疗缺铁性贫血的药物,其主要成分是琥珀酸亚铁(化学式为C4H4O4Fe).
(2008•滨湖区一模)“速力菲”是治疗缺铁性贫血的药物,其主要成分是琥珀酸亚铁(化学式为C4H4O4Fe).
试计算:
(1)琥珀酸亚铁中碳、氢、氧三种元素原子个数比 ______.
(2)某病人每天需服用0.6g速力菲,那么他每天从药物中摄取的铁元素的总量约为 ______. 恼人的世界1年前1
恼人的世界1年前1 -
 4_llll 共回答了19个问题
4_llll 共回答了19个问题 |采纳率94.7%解题思路:(1)根据化学式某元素右下角的数字为该元素原子个数,即可求出琥珀酸亚铁中碳、氢、氧三种元素原子个数比;
(2)根据物质中某元素的质量分数=[该元素相对原子质量×原子个数/该物质的相对分子量]×100%,先求出琥珀酸亚铁中铁元素的质量分数,再求出0.6g速力菲中铁元素的总量即可.(1)根据化学式某元素右下角的数字为该元素原子个数,则琥珀酸亚铁中碳、氢、氧三种元素原子个数比为:
4:4:4=1:1:1;故答案为:1:1:1;
(2)根据物质中某元素的质量分数=[该元素相对原子质量×原子个数/该物质的相对分子量]×100%,则
琥珀酸亚铁中铁元素的质量分数=[56/172]×100%=32.6%
0.6g速力菲中铁元素的总量为:0.6×32.6%=0.195 g
故答案为:0.195 g.点评:
本题考点: 化合物中某元素的质量计算;分子和原子的区别和联系.
考点点评: 本题考查学生对物质中某元素的质量分数的计算在解题中的应用.1年前查看全部
- 下列关于人体健康说法正确的是( ) A.油脂危害健康,应尽量不吃 B.食用加入铁强化剂的酱油,有助于防止缺铁性贫血 C
下列关于人体健康说法正确的是( ) A.油脂危害健康,应尽量不吃 B.食用加入铁强化剂的酱油,有助于防止缺铁性贫血 C.微量元素是人体必需的,应尽可能多吃含微量元素的营养补剂 D.食用甲醛溶液浸泡保鲜的水产品有利健康  ii三号1年前1
ii三号1年前1 -
 甜蜜的笑容 共回答了14个问题
甜蜜的笑容 共回答了14个问题 |采纳率85.7%A、适当的摄取油脂肪,可以为身体提供能量;如脂肪中的磷脂和胆固醇是人体细胞的主要成分,可以供给人体必需的脂肪酸,促进一些维生素的吸收,调节生理功能的作用,尽量不吃油脂是错误的,故选项说法错误.
B、铁是合成血红蛋白的主要元素,缺乏会患贫血;食用加入铁强化剂的酱油,有助于防止缺铁性贫血,故选项说法正确.
C、即使是必须元素,也有一个合理摄入量的问题,摄入不足或摄入过量均不利于人体健康,故选项说法错误.
D、甲醛有毒,能破坏人体蛋白质的结构,使蛋白质变质,不能食用甲醛溶液浸泡保鲜的水产品,故选项说法错误.
故选B.1年前查看全部
- 用铁锅炒菜可以减少缺铁性贫血的发生,为什么加入少量食醋效果会更好?
用铁锅炒菜可以减少缺铁性贫血的发生,为什么加入少量食醋效果会更好?
长期使用铁锅炒菜可以减少缺铁性贫血的发生,如果在炒菜时加入少量食醋效果会更好,理由是?Feso4(硫酸亚铁)可做治疗什么的药剂.医疗上防止它被氧化的方法是什么? 落寞流浪者1年前1
落寞流浪者1年前1 -
 酷你一毕 共回答了15个问题
酷你一毕 共回答了15个问题 |采纳率80%食醋是酸,可以溶解铁,促进吸收 治疗缺铁性贫血,与还原性的维生素C同服1年前查看全部
- 如果用铁锅炒菜,可有效减少缺铁性贫血的发生,若炒菜时经常加入适量食醋,效果更好,理由是——?
 hj_april1年前4
hj_april1年前4 -
 uunannan 共回答了15个问题
uunannan 共回答了15个问题 |采纳率86.7%醋酸可以将铁锅中的铁反应成离子的形式.更容易被人们吸收.
Fe+ 2H+=Fe2+ H2o 应该就是这个式子.1年前查看全部
- 葡萄糖酸亚铁是治疗缺铁性贫血的一种药品,它的化学式为C 12 H 22 FeO 14 ,求:
葡萄糖酸亚铁是治疗缺铁性贫血的一种药品,它的化学式为C 12 H 22 FeO 14 ,求:
(1)葡萄糖酸亚铁的相对分子质量为______;
(2)该物质中铁元素的质量分数为______;
(3)若某病人要补充2.8g铁元素,医生开给病人______g葡萄糖酸亚铁. 本假本1年前1
本假本1年前1 -
 xiaomaque_2000 共回答了20个问题
xiaomaque_2000 共回答了20个问题 |采纳率70%(1)相对分子的质量为组成分子的各原子的相对原子质量之和,则有12×12+22+56+16×14=446(2)物质中某元素的质量分数= 该元素相对原子量×原子个数 该物质的相对分子量 ×100%= 56 446 ...1年前查看全部
- (11分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是
(11分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe 2 + 的存在,设计并进行了如下实验:

⑴试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,写出+2价Fe在空气中转化为+3价Fe的化学方程式 ;
⑶该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。 2848750131年前1
2848750131年前1 -
 骂偶的算你的 共回答了26个问题
骂偶的算你的 共回答了26个问题 |采纳率88.5%(11分)⑴稀盐酸 KSCN溶液 2Fe 2 + +Cl 2 =2Fe 3 + +2Cl - Fe 3 + +SCN - =[Fe(SCN)] 2 +  ...1年前查看全部
- 一道初三化学题!急急急急急!硫酸亚铁(FeSO4)可用于治疗缺铁性贫血,根据硫酸亚铁的化学试计算:某贫血患者需补充7g铁
一道初三化学题!急急急急急!
硫酸亚铁(FeSO4)可用于治疗缺铁性贫血,根据硫酸亚铁的化学试计算:
某贫血患者需补充7g铁,至少需要多少克硫酸亚铁(结果保留一位小数)
提示:相对原子质量,Fe 56;S 2;O;16
我数学不是很好所以做起来就感觉转不过弯儿来.希望大家帮帮忙忙,给解决一下,最好要带有步骤!谢谢啊! 小黑无常1年前3
小黑无常1年前3 -
 20011199 共回答了21个问题
20011199 共回答了21个问题 |采纳率95.2%补血需要的是铁 计算亚硝酸铁中的含铁量
Fe%=Fe/FeSO4=56/(56+32+16×4)%=36.8%
每天需要铁7G 所以
亚硝酸铁=7/36.8%=19.0克1年前查看全部
- I.铁是人体必须的微量元素,绿矾(FeSO 4 ·7H 2 O)是治疗缺铁性贫血药品的重要成份。
I.铁是人体必须的微量元素,绿矾(FeSO 4 ·7H 2 O)是治疗缺铁性贫血药品的重要成份。
(1)FeSO 4 溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是 ;实验室在配制FeSO 4 溶液时常加入 以防止其被氧化,请你设计一个实验证明FeSO 4 溶液是否被氧化 。
(2)测定绿矾样品含量的实验步骤:
a. 称取5.7g样品,溶解,配成250mL溶液
b.量取25mL待测溶液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO 4 溶液滴定至终点,消耗KMnO 4 溶液体积为40mL
根据以上步骤回答下列问题:
①用硫酸酸化的KMnO 4 滴定终点的标志是 。
②计算上述产品中FeSO 4 ·7H 2 O的质量分数为 。
II.硫酸亚铁铵(NH 4 ) 2 Fe(SO 4 ) 2 ·6H 2 O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(3)硫酸亚铁铵不易被氧化的原因 。
(4)为检验分解产物的成份,设计如下实验装置进行实验,加热A中硫酸亚铁铵至分解完全。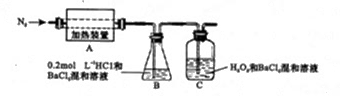
①A中固体充分加热较长时间后,通入氮气,目的是 。
②装置B中BaC1 2 溶液的作用是为了检验分解产物中是否有SO 3 气体生成,若含有该气体,观察到的观象为 。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示) metp1年前1
metp1年前1 -
 奥兰多 共回答了23个问题
奥兰多 共回答了23个问题 |采纳率87%(16分)I.(1)12Fe 2 + +3O 2 +6H 2 O=4Fe(OH) 3 ↓+8Fe 3 + (其它合理答案也给分)(2分);
铁粉(1分);取少量FeSO 4 溶液置于试管中,加数滴KSCN溶液,如果溶液变红,则说明FeSO 4 溶液已被氧化,如不变红,则说明FeSO 4 溶液没有被氧化。(2分)
(2)①当最后一滴酸性高锰酸钾溶液滴入锥形瓶恰好出现浅紫红色,半分钟内不褪色,说明达到终点。(2分) ②97.54%(3分)
Ⅱ.(3)硫酸亚铁铵溶液中NH 4 + 水解增大c(H + ),抑制了上述氧化还原反应的进行。(2分)
(4)①使分解产生的气体在B和C中被吸收充分(1分)②溶液变混浊或出现白色沉淀(1分)
③SO 2 +H 2 O 2 +Ba 2 + =BaSO 4 ↓+2H + 或SO 2 +H 2 O 2 =SO 4 2 - +2H + 、SO 4 2 - +Ba 2 + =BaSO 4 ↓(2分)
1年前查看全部
- 缺铁性贫血是指人体内贮存的铁不足时,影响血红蛋白合成而引起的一种细胞低血素贫血。问题一:已知某种
缺铁性贫血是指人体内贮存的铁不足时,影响血红蛋白合成而引起的一种细胞低血素贫血。问题一:已知某种
酸盐可以用来治疗缺铁性贫血,制药厂在药片外包一层特制的糖衣,以防止它在空气中变质、失效。该药品的化学式为()
1·怎样证明该药品溶液中含有的金属阳离子的价态?
2.请你设计一个实验,以证明该药片是否变质。
 神仙老头1年前1
神仙老头1年前1 -
 简单是快乐 共回答了18个问题
简单是快乐 共回答了18个问题 |采纳率94.4%你好,你是医学生?平时补铁的要不都是亚铁吗,如果被氧化的话会变成3价铁,Fe3+在溶液中显黄色,而Fe2+显浅绿色,好像其氢氧化物颜色也不一样1年前查看全部
- 绿矾(FeSO 4 ·7H 2 O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产
绿矾(FeSO 4 ·7H 2 O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

已知:室温下饱和H 2 S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe 3+ 的实验操作是__________ ____________________ 。
(2)操作II中,通入硫化氢至饱和的目的是 ;在溶液中用硫酸酸化至pH=2的目的是 。
(3)操作IV的顺序依次为: 、 ___ 、 。
操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。
(4)测定绿矾产品中Fe 2+ 含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO 4 溶液滴定至终点,消耗KMnO 4 溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe 2+ +MnO 4 ¯+8H + →5Fe 3+ +Mn 2+ +4H 2 O)。
①判断此滴定实验达到终点的方法是 。
②计算上述样品中FeSO 4 ·7H 2 O的质量分数为 _ (用小数表示,保留三位小数)。 经过好几个1年前1
经过好几个1年前1 -
 yan_erluck 共回答了26个问题
yan_erluck 共回答了26个问题 |采纳率92.3%(1)取少量晶体溶于水,滴加KSCN溶液,若溶液不显现红色,表明溶液不含Fe 3 + (1分)
(2)除去溶液中的Sn 2+ 离子,并防止Fe 2 + 被氧化 (2分) 防止Fe 2 + 离子生成沉淀(1分)
(3)蒸发 (1分)冷却结晶 (1分) 过滤(1分)②降低洗涤过程中FeSO 4 ·7H 2 O的损耗(1分)
(4)①滴加最后一滴KMnO 4 溶液时,溶液变成浅红色且半分钟内不褪色。(2分)
② 0.975 (2分)
1年前查看全部
- 速力菲是治疗缺铁性贫血的药物,其主要成分是琥珀酸亚铁(化学式为C 4 H 4 O 4 Fe).某病人每天需服用0.6g琥
速力菲是治疗缺铁性贫血的药物,其主要成分是琥珀酸亚铁(化学式为C 4 H 4 O 4 Fe).某病人每天需服用0.6g琥珀酸亚铁,那么他每天从药物中摄取的铁元素的总量约为( ) A.0.290g B.0.326g C.0.195g D.0.543g  小马过河-01年前1
小马过河-01年前1 -
 莲红 共回答了15个问题
莲红 共回答了15个问题 |采纳率80%根据物质中某元素的质量分数=
该元素相对原子质量×原子个数
该物质的相对分子量 ×100%,则
琥珀酸亚铁中铁元素的质量分数=
56
12×4+1×4+16×4+56 ×100%=32.6%
0.6g速力菲中铁元素的总量为:0.6g×32.6%=0.195 g
故选C1年前查看全部
- 为了帮助治病(指缺铁性贫血),他平时应注意多吃含(铁)和( )的食物
 电电101年前5
电电101年前5 -
 曹小月 共回答了16个问题
曹小月 共回答了16个问题 |采纳率87.5%维生素B12和叶酸1年前查看全部
- 生活中充满化学,下列有关生活中的化学常识说法不正确的是( ) A.长期用铁强化酱油作佐料,可预防缺铁性贫血 B.食用的
生活中充满化学,下列有关生活中的化学常识说法不正确的是( ) A.长期用铁强化酱油作佐料,可预防缺铁性贫血 B.食用的碘盐是纯的碘酸钾 C.花草汁沾在白色衣物上可用漂白粉溶液洗去 D.苹果久置变甜主要是因为发生了水解反应  蓉儿宝贝1年前1
蓉儿宝贝1年前1 -
 兰若诗的黄小咬 共回答了29个问题
兰若诗的黄小咬 共回答了29个问题 |采纳率82.8%A.铁为血红蛋白的重要元素,长期食用含铁物质可预防缺铁性贫血,故A正确;
B.食用的碘盐为含有碘酸钾的NaCl,不是纯净物,故B错误;
C.漂白粉可生成具有漂白性的HClO,能漂白衣服上的有色物质,故C正确;
D.苹果的主要成分为淀粉,久置可水解生成葡萄糖,具有甜味故D正确.
故选B.1年前查看全部
- (2009•湛江二模)亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫血,但是摄
(2009•湛江二模)亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害.下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含Fe2+34%~36%,是糖衣片,…,与Vc(维生素C)同服可增加本品吸收.某同学设计实验时对其中的铁成分进行了验证.请完成该实验:
(1)第一步:查阅资料得知,双氧水可以氧化SCN-生成N2、CO2和SO42−,也可以将Fe2+氧化成Fe3+.
(2)第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色浑浊液,说明有______离子存在(填离子符号);
(3)第三步:往上述溶液中滴入几滴KSCN溶液,出现浅红色,说明溶液中有少量Fe3+离子存在.该离子存在的原因可能是(填序号):______
①药品中的铁本来就是以三价铁的形式存在;
②在制药过程中生成少量三价铁;
③本实验过程中有少量三价铁生成.
(4)第四步:将第三步所得溶液分成2份,分别装在A、B两个试管中.
(5)第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去.
①红色变深的原因是(用离子方程式表示):______;
②溶液红色又褪去的原因可能是:______;
③请自选中学实验室中常用仪器、药品,设计实验证明溶液红色褪去的原因:______.
(6)第六步:向B试管的溶液中加入一片Vc片,片刻后溶液红色也褪去,说明Vc有______性;怎样理解药品说明中所述“与Vc同服可增加本品吸收”这句话?______. 调味料的味道1年前1
调味料的味道1年前1 -
 潘黄河 共回答了22个问题
潘黄河 共回答了22个问题 |采纳率95.5%解题思路:(2)依据亚铁离子在溶液中先浅绿色分析;
(3)依据Vc中铁元素素的主要作用是亚铁离子,铁离子有毒分析,铁离子不是药片中含有的,是过程中氧化得到的铁离子,故①错误,在本 制药过程中生成少量三价铁;
③本实验过程中有少量三价铁生成;
(5)①过氧化氢具有氧化性氧化亚铁离子为铁离子,铁离子结合硫氰根离子性质血红色溶液;
②溶液红色又褪去的原因可能是过氧化氢氧化硫氰根离子分析;
③依据铁离子结合硫氰根离子形成血红色溶液,加入过氧化氢会褪色设计实验证明;
(6)加入Vc试管中红色褪去证明Vc具有还原性含有铁离子,人体只能吸收Fe2+,Fe2+在人体血红蛋白中起传送O2的作用,服用VC可防止药品的Fe2+氧化成Fe3+.(2)亚铁离子在溶液中先浅绿色,向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色浑浊液,说明含有亚铁离子,故答案为:Fe2+;
(3)依据Vc中铁元素素的主要作用是亚铁离子,铁离子有毒分析,铁离子不是药片中含有的,是过程中氧化得到的铁离子,故①错误,在本制药过程中生成少量三价铁;
或本实验过程中有少量三价铁生成,②③正确,
故答案为:②③;
(5)①过氧化氢具有氧化性氧化亚铁离子为铁离子,铁离子结合硫氰根离子性质血红色溶液,溶液红色变深,反应的离子方程式为:2Fe2++H2O+2H+=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3(血红色),
故答案为:2Fe2++H2O+2H+=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3(血红色);
②溶液红色又褪去的原因可能是过氧化氢氧化硫氰根离子,H2O2氧化SCN-,使平衡Fe3++3SCN-⇌Fe(SCN)3左移,红色消失,
故答案为:H2O2氧化SCN-,使平衡Fe3++3SCN-⇌Fe(SCN)3左移,红色消失;
③依据铁离子结合硫氰根离子形成血红色溶液,加入过氧化氢会褪色设计实验证明,取一支试管,加入少量FeCl3溶液和几滴KSCN溶液,溶液变为红色,再加入适量H2O2振荡,产生气泡,红色褪去,说明是H2O2氧化了溶液的SCN-离子使溶液褪色,
故答案为:取一支试管,加入少量FeCl3溶液和几滴KSCN溶液,溶液变为红色,再加入适量H2O2振荡,产生气泡,红色褪去,说明是H2O2氧化了溶液的SCN-离子使溶液褪色;
(6)加入Vc试管中红色褪去证明Vc具有还原性含有铁离子,人体只能吸收Fe2+,Fe2+在人体血红蛋白中起传送O2的作用,服用VC可防止药品的Fe2+氧化成Fe3+,
故答案为:还原;Fe2+在人体血红蛋白中起传送O2的作用,Fe3+没有此功能,服用VC可防止药品的Fe2+氧化成Fe3+.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了铁及其化合物性质的分析应用,实验设计验证方法和实验过程和反应实质的理解是解题关键,题目难度中等.1年前查看全部
- 高一化学高手请进.硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,而硫酸铁则无此药效.当用硫酸亚铁制成药片时外表有一层特殊的糖
高一化学高手请进.
硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,而硫酸铁则无此药效.当用硫酸亚铁制成药片时外表有一层特殊的糖衣,①这层糖衣的作用是什么?若糖衣有损害,②如何检验药片是否已变质?写出主要实验步骤及实验现象 htdong02291年前1
htdong02291年前1 -
 28j6ie 共回答了27个问题
28j6ie 共回答了27个问题 |采纳率88.9%糖衣的作用有两个,第一是防止亚铁被氧化为三价铁,第二是使病人服用药丸不那么痛苦
检验药片变质,可以取一部分药片,加水溶解,滴加硫氰酸钾溶液,如果出现血红色就表明有三价铁生成,变质了,如果没有说明没有变质1年前查看全部
- 绿矾(FeSO 4 ·7H 2 O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产
绿矾(FeSO 4 ·7H 2 O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法 
已知:室温下饱和H 2 S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe 3+ 的实验操作是________________________________________________________。
(2)操作II中,通入硫化氢至饱和的目的是_________________;在溶液中用硫酸酸化至pH=2的目的是_________________。
(3)操作IV的顺序依次为:_________、冷却结晶、_____________ 。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②______________________。
(5)测定绿矾产品中Fe 2+ 含量的方法是:
a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO 4 溶液滴定至终点,消耗KMnO 4 溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe 2+ +MnO 4 - +8H + →5Fe 3+ +Mn 2+ +4H 2 O)。
①判断此滴定实验达到终点的方法是_______________。
②计算上述样品中FeSO 4 ·7H 2 O的质量分数为___________(用小数表示,保留三位小数)
③若用上述方法测定的样品中FeSO 4 ·7H 2 O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有_____________;_____________。 穿着qq呢1年前1
穿着qq呢1年前1 -
 bye2008 共回答了16个问题
bye2008 共回答了16个问题 |采纳率93.8%(1)取少量晶体溶于水,滴加KSCN溶液,若溶液不显现红色,表明溶液不含Fe 3+
(2)除去溶液中的Sn 2+ 离子,并防止Fe 2+ 被氧化;防止Fe 2+ 离子生成沉淀
(3)蒸发浓缩;过滤洗涤
(4)降低洗涤过程中FeSO 4 ·7H 2 O的损耗
(5)①滴加最后一滴KMnO 4 溶液时,溶液变成浅红色且半分钟内不褪色;②0.975;③样品中存在少量的杂质;样品部分被氧化1年前查看全部
- Ⅰ.铁是人体必需的微量元素,绿矾(FeSO 4 ·7H 2 O)是治疗缺铁性贫血药品的重要成分。
Ⅰ.铁是人体必需的微量元素,绿矾(FeSO 4 ·7H 2 O)是治疗缺铁性贫血药品的重要成分。
(1)FeSO 4 溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是 ;实验室在配制FeSO 4 溶液时常加入 以防止其被氧化。请你设计一个实验证明FeSO 4 溶液是否被氧化 。
Ⅱ.硫酸亚铁铵[(NH 4 ) 2 Fe(SO 4 ) 2 ·6H 2 O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(2)硫酸亚铁铵不易被氧化的原因是 。
(3)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。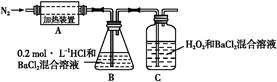
①A中固体充分加热较长时间后,通入氮气,目的是 。
②装置B中BaCl 2 溶液的作用是为了检验分解产物中是否有SO 3 气体生成,若含有该气体,观察到的现象为 。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示)。 浪无声1年前1
浪无声1年前1 -
 夜留情 共回答了21个问题
夜留情 共回答了21个问题 |采纳率76.2%Ⅰ.(1)12Fe 2+ +3O 2 +6H 2 O=Fe(OH) 3 ↓+8Fe 3+ (其他合理答案也给分) 铁粉 取少量FeSO 4 溶液于试管中,加数滴KSCN溶液,如果溶液变红,则说明FeSO 4 溶液已被氧化,如不变红,则说明FeSO 4 溶液没有被氧化。
Ⅱ.(2)硫酸亚铁铵溶液中N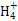 发生水解增大c(H + ),抑制了Fe 2+ 氧化反应的进行。
发生水解增大c(H + ),抑制了Fe 2+ 氧化反应的进行。
(3)①使分解产生的气体在B、C中被吸收充分
②溶液变浑浊(或出现白色沉淀)
③SO 2 +H 2 O 2 +Ba 2+ =aSO 4 ↓+2H + (或SO 2 +H 2 O 2 =H + +S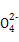 、S
、S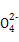 +Ba 2+ =aSO 4 ↓)
+Ba 2+ =aSO 4 ↓)
(1)Fe 2+ 被O 2 氧化为Fe 3+ ,最终生成红褐色的Fe(OH) 3 沉淀;加入铁粉可以防止Fe 2+ 被氧化为Fe 3+ ;通常用KSCN检验Fe 3+ 。
(2)N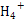 水解显酸性,c(H + )越大,反应4Fe 2+ +O 2 +10H 2 O=Fe(OH) 3 ↓+8H + 正向进行的程度越小,Fe 2+ 越不易被氧化。
水解显酸性,c(H + )越大,反应4Fe 2+ +O 2 +10H 2 O=Fe(OH) 3 ↓+8H + 正向进行的程度越小,Fe 2+ 越不易被氧化。
(3)①通入N 2 可以将装置中的气体全部排到B和C,保证被完全吸收。
②SO 2 不和BaCl 2 反应,但SO 3 可以和BaCl 2 反应产生BaSO 4 沉淀。
③H 2 O 2 将SO 2 氧化为S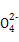 ,再与Ba 2+ 反应生成BaSO 4 沉淀。
1年前查看全部
,再与Ba 2+ 反应生成BaSO 4 沉淀。
1年前查看全部
- 硫酸亚铁可以用于治疗缺铁性贫血.某缺血患者每天补充1.12g铁元素,则他服用药物中含硫酸亚铁的质量至少为
硫酸亚铁可以用于治疗缺铁性贫血.某缺血患者每天补充1.12g铁元素,则他服用药物中含硫酸亚铁的质量至少为
具体的过程怎么理解,别人写的我都看不懂,求指导! yogiye1年前1
yogiye1年前1 -
 好心要让你听见 共回答了23个问题
好心要让你听见 共回答了23个问题 |采纳率95.7%硫酸亚铁中铁的质量分数为:56/152x100%=36.8%
则他服用药物中含硫酸亚铁的质量至少为:1.12/36.8%=3.04g1年前查看全部
- 有一种病叫做缺铁性贫血,这里的“缺铁”指的是缺少
有一种病叫做缺铁性贫血,这里的“缺铁”指的是缺少
A、铁单质
B、铁元素
C、三氧化二铁
D、四氧化二铁
A、铁单质
B、铁元素
C、三氧化二铁
D、四氧化三铁
刚才打错了改过来 雯静h1年前1
雯静h1年前1 -
 qingyishuixiu 共回答了20个问题
qingyishuixiu 共回答了20个问题 |采纳率90%1年前查看全部
- 绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.孔雀石主要含Cu2(OH)2CO3,还含有Fe、Si的化合物
绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.孔雀石主要含Cu2(OH)2CO3,还含有Fe、Si的化合物(含硅物质不溶于酸).某工厂设计以孔雀石、废铁屑、稀硫酸等为原料制备CuSO4•5H2O与FeSO4•7H2O,流程如图所示.请回答下列问题:
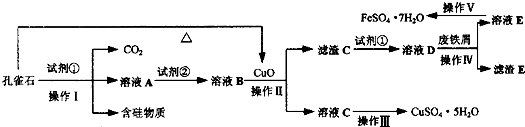
(1)试剂①为______,孔雀石与试剂①反应的主要化学方程式为______.
(2)溶液A中的金属阳离子除Cu2+外,还可能含有Fe2+和Fe3+中的一种或两种,检验Fe3+存在的最佳试剂为______.为了确定溶液A中是否含有Fe2+并测定其浓度大小,设计以下实验方案:
①配制溶液.取A溶液10mL,配成250mL,配制溶液所需的仪器除了量筒、烧杯、玻璃棒、胶头滴管外,还需要的仪器是______.
②滴定检测.取25mL所配溶液于锥形瓶中,滴加a mol•L-1酸性KMnO4溶液V ml时,溶液恰好变为淡紫色且半分钟内不变色.
③分析计算.A溶液中是否含有Fe2+?______(填“含有”或“不含有”,若填“不含有”,则下列空白不用填写),则A溶液中C(Fe2+)为______.
(3)从以下试剂中选择:试剂②为______(填序号),选择原因是______.
a.KMnO4
b.(NH4)2S
c.H2O2
d.Cl2
(4)已知滤渣C为Fe(OH)3,试解释向溶液B中加入CuO的作用:______.
(5)由溶液C获得CuSO4•5H2O,需要经过加热蒸发、______、过滤等操作.除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器,该仪器在此操作中的主要作用是______.
(6)操作V得到的绿矾晶体用少量液体洗涤,该液体可以是______(填序号).
A.冰水
B.蒸馏水
C.80%酒精溶液
D.CCl4. adslwlqq1年前1
adslwlqq1年前1 -
 sdrg2 共回答了19个问题
sdrg2 共回答了19个问题 |采纳率89.5%解题思路:(1)根据反应物、生成物以及反应原理书写反应方程式;
(2)检验Fe3+存在的最佳试剂为KSCN溶液;
①配250mL溶液还需要250ml容量瓶;
③原溶液被稀释后,Cu2+呈浅蓝色,Fe3+呈浅黄色,两者都不与高锰酸钾溶液反应,所以滴定时参加反应的离子是Fe2+,故A溶液中含有Fe2+;
(3)能将Fe2+氧化而又不引入新杂质;
(4)加入试剂和酸反应调节溶液PH使铁离子全部沉淀,加入的试剂不能引入新的杂质;
(5)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流;
(6)洗涤晶体表面的杂质离子时,既不能使主要物质减少,又能把杂质离子洗去.(1)制备的产物为硫酸盐,碱式碳酸铜又不溶于水,试剂①为稀硫酸,反应方程式为:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,
故答案为:稀硫酸;Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;
(2)检验Fe3+选择KSCN溶液,Fe3+遇KSCN溶液变血红色,故答案为:KSCN溶液;
①一般用量筒量取溶液,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀.
所以需要的仪器为:托盘天平、药匙、烧杯、筒量(可用、也可不用)、玻璃棒、250ml容量瓶、胶头滴管.
故答案为:250ml容量瓶;
③原溶液被稀释后,Cu2+呈浅蓝色,Fe3+呈浅黄色,两者都不与高锰酸钾溶液反应,所以滴定时参加反应的离子是Fe2+,故A溶液中含有Fe2+;由关系式:5Fe2+~MnO4-,可得A溶液中C(Fe2+)为=5aVmol/L,故答案为:含有;5aVmol/L;
(3)为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2,故答案为:C;既能将Fe2+氧化而又不引入新杂质;
(4)氧化铜和酸反应调节溶液PH使铁离子全部沉淀,加入的试剂不能引入新的杂质,故答案为:除去多余的稀硫酸,调节溶液的PH;
(5)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流,故答案为:冷却结晶;引流;
(6)冰水和蒸馏水均使晶体损耗较多,四氯化碳不能洗去杂质,故选80%酒精溶液,故答案为:C.点评:
本题考点: 铜金属及其重要化合物的主要性质;硫酸亚铁的制备.
考点点评: 本题考查金属及其重要化合物的主要性质,题目难度中等,注意(4)中沉淀铁离子时不能引入新的杂质.1年前查看全部
- 铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种
铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe 2+ 的存在, 设计并进行了如下实验: 
(1)试剂1是_____________。加入新制氯水后溶液中发生的离子反应方程式是__________, ____________。
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是____________。
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充) 
 zjl20501年前1
zjl20501年前1 -
 kuoaijia 共回答了15个问题
kuoaijia 共回答了15个问题 |采纳率73.3%1年前查看全部
- 缺铁性贫血会引发:A丙酮酸中毒B乳酸中毒C尿素中毒D二氧化碳中毒
缺铁性贫血会引发:A丙酮酸中毒B乳酸中毒C尿素中毒D二氧化碳中毒
并说明为什么! wizardheng1年前1
wizardheng1年前1 -
 帮主零 共回答了19个问题
帮主零 共回答了19个问题 |采纳率94.7%选B,由于缺铁,人的血红蛋白减少,运输的氧气减少,使细胞进行无氧呼吸,乳酸增多,引起中毒.1年前查看全部
- 乳酸亚铁片可用于治疗缺铁性贫血.如图为乳酸亚铁片说明书上的部分文字.请仔细阅读后回答以下问题:
乳酸亚铁片可用于治疗缺铁性贫血.如图为乳酸亚铁片说明书上的部分文字.请仔细阅读后回答以下问题:
【主要成分】乳酸亚铁(化学式C6H10FeO6)
【用量】成人治疗量0.3g~0.6g/日
【注意事项】①宜饭后口服
②服时忌茶,以免被鞣质沉淀
【规格】0.1g/片
(1)乳酸亚铁组成元素有______种,其中碳、铁两种元素的质量比为______;
(2)乳酸亚铁的相对分子质量为______;
(3)某成人每天分2次服药,1次最多服用______片. CT-MRI1年前1
CT-MRI1年前1 -
 miya1230 共回答了14个问题
miya1230 共回答了14个问题 |采纳率78.6%解题思路:(1)根据物质的化学式来分析组成元素和计算元素的质量比;
(2)根据相对分子的质量为组成分子的各原子的相对原子质量之和,进行解答;
(3)根据题中信息:成人每天最多服用0.6g,分二次服药,即可解答.(1)由乳酸亚铁的化学式C6H10FeO6可知,它是由碳、氢、铁、氧四种元素组成的,根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得乳酸亚铁分子中碳、铁两种元素的质量比为 (12×6):56=9:7;
(2)根据相对分子的质量为组成分子的各原子的相对原子质量之和,可得乳酸亚铁的相对分子质量为:12×6+10+56+16×6=234;
(3)根据题中信息:成人每天最多服用0.6g,分二次服药,一次最多服用3片;
故答案为:(1)4; 9:7;(2)234; (3)3.点评:
本题考点: 元素质量比的计算;相对分子质量的概念及其计算.
考点点评: 本题考查学生根据图示信息、化合物中各元素质量比、相对分子的质量计算方法进行解题的能力.1年前查看全部
- (2005•绵阳)(1)硫酸亚铁是一种重要的化工原料,可用作杀虫剂、净水剂和木材防腐剂,还可用来治疗缺铁性贫血.工业上用
 (2005•绵阳)(1)硫酸亚铁是一种重要的化工原料,可用作杀虫剂、净水剂和木材防腐剂,还可用来治疗缺铁性贫血.工业上用废铁屑与稀硫酸反应制硫酸亚铁,主要反应的化学方程式为______.
(2005•绵阳)(1)硫酸亚铁是一种重要的化工原料,可用作杀虫剂、净水剂和木材防腐剂,还可用来治疗缺铁性贫血.工业上用废铁屑与稀硫酸反应制硫酸亚铁,主要反应的化学方程式为______.
废铁屑与硫酸反应产生的气体中含有有毒气体H2S,用CuSO4溶液可以吸收这种气体并产生黑色沉淀,该反应的化学方程式为______.
(2)为了探究CO的还原性,某同学将绕成螺旋状的铜丝放在酒精灯上加热至铜丝变黑后,立即将铜丝伸入盛满CO的集气瓶中(内装适量澄清石灰水),铜丝又恢复光亮的红色,振荡集气瓶,还可以看到集气瓶中______.
上述实验过程中,能表明CO具有还原性的反应的化学方程式是CuO+CO
Cu+CO2△ .CuO+CO.将上述表面变黑的铜丝冷却后放入稀硫酸中,可以看到的现象是____________,______.
Cu+CO2△ .
(3)一包白色固体可能含有NaCl、CuSO4、NH4NO3、BaC12、K2 C O3中的一种或几种.有同学进行下列实验来确定该固体的成分:
(a)取少许固体放入试管,加入NaOH浓溶液并微热,把湿润的红色石蕊试纸放在试管口,试纸变为蓝色.
(b)取一些白色固体放入试管加水溶解,得无色透明溶液.
(c)向实验b所得溶液中滴2滴酚酞试液,溶液变为红色,再向其中加入过量CaC12溶液,红色褪去,产生白色沉淀.
(d)将实验c所得溶液中的沉淀滤去,向滤液中加入AgNO3溶液,又产生白色沉淀.
①根据以上实验现象判断:这包白色固体中一定有______,肯定没有______.
②若用这包白色固体配成稀溶液来浇花,可产生的作用是______(填下列选项的字母序号).
A.促进花草的茎、叶生长茂盛,叶色浓绿
B.促进花草的根系发达,增强抗寒抗旱能力
C.促进花草生长健壮,茎杆粗硬,增强对病虫害和倒伏的抵抗能力
(4)实验室需用20%的稀硫酸(密度为1.14g•cm-3)460mL,若用如图标签所示的硫酸来配制,则至少需用这种硫酸______
mL. tit1111年前1
tit1111年前1 -
 枫籽 共回答了17个问题
枫籽 共回答了17个问题 |采纳率94.1%解题思路:(1)铁屑与稀硫酸反应制硫酸亚铁和氢气,写出化学方程式;已知反应物为硫化氢和硫酸铜,生成物为硫化铜和硫酸,故可写出化学方程式;
(2)根据一氧化碳和氧化铜反应产生铜和二氧化碳写出方程式分析现象;根据氧化铜和硫酸反应产生硫酸铜和水描述现象;
(3)a、取少许固体放入试管,加入NaOH浓溶液并微热,把湿润的红色石蕊试纸放在试管口,试纸变为蓝色,说明产生碱性气体,可证明硝酸铵的存在;
b、取一些白色固体放入试管加水溶解,得无色透明溶液,说明没有蓝色硫酸铜的存在,且碳酸钾和氯化钡反应会产生碳酸钡沉淀,所以碳酸钾和氯化钡不能共存;
c、向实验b所得溶液中滴2滴酚酞试液,溶液变为红色,说明溶液显碱性,再向其中加入过量CaC12溶液,红色褪去,产生白色沉淀,则有碳酸钾的存在;又因为碳酸钾和氯化钡不能共存,故没有氯化钡;
d、将实验c所得溶液中的沉淀滤去,向滤液中加入AgNO3溶液,又产生白色沉淀,说明有氯离子的存在,但氯离子可能来自氯化钠,也可能来自过量的氯化钙,因此氯化钠可能含有;
①据以上现象分析得出结论;②根据物质中含有的营养元素氮、磷、钾的作用分析;
(4)设出浓硫酸的体积,利用m=ρV可计算溶液的质量,再根据溶液配制前后溶质的质量不变来列式计算浓硫酸的质量和体积.(1)铁屑与稀硫酸反应制硫酸亚铁和氢气,反应的方程式为:Fe+H2SO4=FeSO4+H2↑;已知反应物为硫化氢和硫酸铜,生成物为硫化铜和硫酸,故可写出化学方程式.
故答案为:Fe+H2SO4=FeSO4+H2↑;H2S+CuSO4═CuS↓+H2SO4;
(2)一氧化碳和氧化铜反应产生铜和二氧化碳,故看到石灰水变浑浊,反应的方程式为:CuO+CO
△
.
Cu+CO2;氧化铜和硫酸反应产生硫酸铜和水,反应的现象为:黑色固体逐渐消失,反应的方程式为:CuO+H2SO4=CuSO4+H2O;
故答案为:石灰水变浑浊;CuO+CO
△
.
Cu+CO2;黑色固体逐渐消失;溶液由无色变成蓝色;CuO+H2SO4=CuSO4+H2O;
(3)a、取少许固体放入试管,加入NaOH浓溶液并微热,把湿润的红色石蕊试纸放在试管口,试纸变为蓝色,说明产生碱性气体,其中硝酸铵和氢氧化钠反应产生的氨气的水溶液显碱性,可证明硝酸铵的存在;
b、取一些白色固体放入试管加水溶解,得无色透明溶液,说明没有蓝色硫酸铜的存在,且碳酸钾和氯化钡反应会产生碳酸钡沉淀,所以碳酸钾和氯化钡不能共存;
c、向实验b所得溶液中滴2滴酚酞试液,溶液变为红色,说明溶液显碱性,再向其中加入过量CaC12溶液,红色褪去,产生白色沉淀,则有碳酸钾的存在;又因为碳酸钾和氯化钡不能共存,故没有氯化钡;
d、将实验c所得溶液中的沉淀滤去,向滤液中加入AgNO3溶液,又产生白色沉淀,说明有氯离子的存在,但氯离子可能来自氯化钠,也可能来自过量的氯化钙,因此氯化钠可能含有;
①故一定含有:NH4NO3、K2 C O3;一定没有:CuSO4、BaC12;
②根据NH4NO3、K2 C O3中含有的营养成分是氮和钾,氮能够促进作物的叶子生长,钾能够促进作物的茎秆粗壮,故选项为:AC;
(4)设需要浓硫酸的体积为V,则
根据浓溶液在配制稀溶液时溶质的质量不变得,
V×1.84g/cm3×98%=460mL×1.14g/cm3×20%
解得V=58.2mL
故答案为:58.2mL点评:
本题考点: 金属的化学性质;一氧化碳的化学性质;有关溶质质量分数的简单计算;物质的鉴别、推断.
考点点评: 本题考查属于综合性的问题,考查了金属的化学性质、一氧化碳的还原性、物质的鉴别、有关溶质质量分数的计算等,可依据相关的知识逐一分析解答.1年前查看全部
- (10分) 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)
(10分) 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe 2+ 的存在,设计并进行了如下实验:

⑴试剂1是 。
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是 。
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)编号 猜想 甲 溶液中的+3价Fe又被还原为+2价Fe 乙 溶液中的  被过量的氯水氧化
被过量的氯水氧化丙 新制的氯水具有漂白性,将该溶液漂白 ⑷另一同学为了检测“速力菲”药片中铁的含量,设计并进行了如下实验:编号 实验操作 预期现象和结论
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H 2 O 2 溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为 。 popboy11年前1
popboy11年前1 -
 民大张伟 共回答了23个问题
民大张伟 共回答了23个问题 |采纳率87%1年前查看全部
- (2013•怀柔区一模)绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等
(2013•怀柔区一模)绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

查询资料,得有关物质的数据如下表:
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为______.25℃时 pH值 饱和H2S溶液 3.9 SnS沉淀完全 1.6 FeS开始沉淀 3.0 FeS沉淀完全 5.5
A.KSCN溶液B.NaOH溶液C.KMnO4溶液D.苯酚溶液
(2)操作II中,通入硫化氢至饱和的目的是______;在溶液中用硫酸酸化至pH=2的目的是______.
(3)操作IV的顺序依次为______、冷却结晶、______.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②______.
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为______(填仪器名称).
②判断此滴定实验达到终点的方法是______.
③计算上述样品中FeSO4•7H2O的质量分数为______. fanxiang7981年前1
fanxiang7981年前1 -
 如果有来世xuan 共回答了18个问题
如果有来世xuan 共回答了18个问题 |采纳率94.4%解题思路:(1)依据三价铁离子的检验方法分析回答,三价铁离子遇硫氰酸钾溶液变血红色;于苯酚呈紫色溶液;
(2)依据流程关系图分析,通入硫化氢制饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=2为了除去杂质离子Sn2+;
(3)操作IV的目的是从滤液中析出绿矾晶体,利用蒸发浓缩,结晶洗涤得到晶体;
(4)操作IV得到的绿矾晶体用少量冰水洗涤目的是洗去表面杂质,温度降低绿矾溶解度降低,减少绿矾晶体的损失;
(5)①高锰酸钾溶液具有强氧化性能氧化橡胶管,不能用简式滴定管;
②利用高锰酸钾溶液紫红色指示反应终点;
③依据滴定实验的反应终点时发生的反应进行计算.(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是利用三价铁离子检验方法分析,三价铁离子遇硫氰酸根离子会反应生成硫氰酸铁血红色,证明铁离子的存在,
A、KSCN溶液和三价铁离子反应生成血红色溶液,可以检验铁离子的检验,故A符合;
B、NaOH溶液和亚铁离子反应生成白色沉淀迅速变化为灰绿色最后变为红褐色,和铁离子反应生成红褐色沉淀,不能检验铁离子的存在,故B不符合;
C、KMnO4溶液不与铁离子反应物现象发生,故C不符合;
D、苯酚溶液和铁离子反应生成紫色溶液,可以检验铁离子的存在,故D符合;
故答案为:AD;
(2)通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,
故答案为:除去溶液中的Sn2+离子,并防止Fe2+被氧化;防止Fe2+离子生成沉淀;
(3)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发、结晶、过滤、洗涤,
故答案为:蒸发浓缩;过滤洗涤;
(4)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,故答案为:降低洗涤过程中FeSO4•7H2O的损耗;
(5)①高锰酸钾溶液具有强氧化性能氧化橡胶管,不能用简式滴定管,用酸式滴定管,故答案为:酸式滴定管;
②滴定实验达到终点时,滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色,故答案为:滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
③a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL,则
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0200L
计算得到;n(Fe2+)=0.001mol;
则250mL溶液中含Fe2+=0.001mol×[250/25]=0.01mol;
FeSO4•7H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;
质量分数=[2.78g/2.85g]×100%=97.54%,
故答案为:97.54%.点评:
本题考点: 硫酸亚铁的制备.
考点点评: 本题考查了铁盐亚铁盐的性质应用,分离混合物的实验方法设计和分析判断,滴定实验的分析判断,数据计算,误差分析的方法,题目难度中等.1年前查看全部
- (2013•渭南二模)I.铁是人体必须的微量元素,绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成份.
 (2013•渭南二模)I.铁是人体必须的微量元素,绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成份.
(2013•渭南二模)I.铁是人体必须的微量元素,绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成份.
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是______;实验室在配制FeSO4溶液时常加入______以防止其被氧化,请你设计一个实验证明FeSO4溶液是否被氧化______.
(2)测定绿矾样品含量的实验步骤:
a.称取5.7g样品,溶解,配成250mL溶液
b.量取25mL待测溶液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL
根据以上步骤回答下列问题:
①用硫酸酸化的KMnO4滴定终点的标志是______.
②计算上述产品中FeSO4•7H2O的质量分数为______.
II.硫酸亚铁铵(NH4)2Fe(SO4)2•6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁.
(3)硫酸亚铁铵不易被氧化的原因______.
(4)为检验分解产物的成份,设计如图实验装置进行实验,加热A中硫酸亚铁铵至分解完全.
①A中固体充分加热较长时间后,通入氮气,目的是______.
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的观象为______.
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为______(用离子方程式表示) 下一步241年前1
下一步241年前1 -
 hnshao 共回答了26个问题
hnshao 共回答了26个问题 |采纳率76.9%解题思路:Ⅰ、(1)硫酸亚铁被空气中的氧气氧化为硫酸铁,依据电荷守恒和原子守恒写出离子方程式,为防止硫酸亚铁被氧化,常加入铁粉,证明硫酸亚铁溶液是否被氧化,可以利用生成的铁离子的特征性质,和硫氰酸钾反应生成血红色溶液设计实验证明;
(2)①依据高锰酸钾溶液的颜色来指示反应终点,滴入最后一滴高锰酸钾溶液变化为紫红色,半分钟不褪色说明达到反应终点;
②依据滴定实验的反应终点时发生的反应进行计算,依据铁元素守恒,结合滴定过程的反应离子方程式计算得到;
Ⅱ、(3)硫酸亚铁铵不易被氧化硫酸亚铁铵溶液中铵根离子水解显酸性,氢离子浓度增大,抑制氧化还原反应的发生;
(4)①依据实验测定过程分析,通入氮气可以使分解生成的气体全部赶到装置BC中完全吸收;
②三氧化硫和氯化钡溶液反应生成硫酸钡沉淀;
③装置C中通入二氧化硫和过氧化氢发生氧化还原反应,生成硫酸和氯化钡反应生成硫酸钡沉淀.Ⅰ、(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+;实验室在配制FeSO4溶液时常加入铁粉防止亚铁离子被氧化,实验证明FeSO4溶液是否被氧化,利用氧化生成的铁离子的特征性质设计实验验证,取少量溶液与试管中,滴加几滴硫氰酸钾溶液,若变红色证明硫酸亚铁已被氧化,若未变红色证明硫酸亚铁未被氧化,
故答案为:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+;铁粉;取少量溶液与试管中,滴加几滴硫氰酸钾溶液,若变红色证明硫酸亚铁已被氧化,若未变红色证明硫酸亚铁未被氧化;
(2)①依据高锰酸钾溶液的颜色来指示反应终点,滴入最后一滴高锰酸钾溶液变化为紫红色,半分钟不褪色说明达到反应终点,
故答案为:当滴入最后一滴高锰酸钾溶液变化为紫红色,半分钟不褪色说明达到反应终点;
②a.称取5.7g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为40.00mL;依据反应方程式进行计算:
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0400L
计算得到;n(Fe2+)=0.002mol;
则250mL溶液中含Fe2+=0.002mol×[250/25]=0.02mol;
FeSO4•7H2O物质的量为0.02mol,质量=0.02mol×278g/mol=5.56g;
质量分数=[5.56g/5.7g]×100%=97.54%,故答案为:97.54%;
Ⅱ、(3)硫酸亚铁铵不易被氧化的原因是因为溶液中铵根离子水解显酸性,氢离子浓度增大,抑制氧化还原反应的发生,
故答案为:溶液中铵根离子水解显酸性,氢离子浓度增大,抑制氧化还原反应的发生;
(4)①A中固体充分加热较长时间后,通入氮气目的是使分解生成的 气体在BC装置中完全吸收,
故答案为:使分解生成的气体在BC装置中完全吸收;
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊,
故答案为;溶液变浑浊;
③装置C中通入二氧化硫和过氧化氢发生氧化还原反应,生成硫酸和氯化钡反应生成硫酸钡沉淀,反应的离子方程式为:SO2+H2O2+Ba2+=BaSO4↓+2H+,
故答案为:SO2+H2O2+Ba2+=BaSO4↓+2H+.点评:
本题考点: 探究物质的组成或测量物质的含量;离子方程式的书写.
考点点评: 本题考查了物质存在和性质的实验探究方法和实验设计判断,氧化还原反应和盐类水解的分析应用是解题关键,题目难度中等.1年前查看全部
- 缺铁性贫血 是因为体内缺乏铁,血红蛋白不能合成?
缺铁性贫血 是因为体内缺乏铁,血红蛋白不能合成?
缺铁性贫血是因为体内缺乏铁,血红蛋白不能合成.是否正确?为什么
不能合成?为什么? 茗岚君1年前1
茗岚君1年前1 -
 d_h_boo 共回答了18个问题
d_h_boo 共回答了18个问题 |采纳率83.3%缺铁性贫血(iron deficiency anemia,IDA)是由于体内缺少铁质而影响血红蛋白合成所引起的一种常见贫血.这种贫血特点是骨髓、肝、脾及其他组织中缺乏可染色铁血清铁浓度和血清转铁蛋白饱和度均降低.
红细胞的携氧生理功能是通过胞内的血红蛋白来实现的.血红蛋白(Hb)分子是有核红细胞、网织红细胞内形成的一种含色素蛋白质.色素部分为亚铁血红素,蛋白质部分是珠蛋白.亚铁血红素由铁原子和原卟啉组成.红细胞内缺铁,原卟啉不能和铁原子结合成为亚铁血红素,造成血红蛋白的生成减少,红细胞胞浆减少、体积小,发生小细胞低色素性贫血;严重时粒细胞、血小板的生成也受影响.1年前查看全部
- (2006•从化市一模)某人在医院做检验的结果为“缺铁性贫血”,这里的铁是指( )
(2006•从化市一模)某人在医院做检验的结果为“缺铁性贫血”,这里的铁是指( )
A.铁元素
B.铁原子
C.铁离子
D.氧化铁 shenfuyiumei1年前1
shenfuyiumei1年前1 -
 新vv 共回答了30个问题
新vv 共回答了30个问题 |采纳率93.3%解题思路:铁在人体内是以+2价铁离子络合的形式存在的,并不是以+3价的铁离子、铁原子形式存在,更不是以氧化铁的形式存在,所以“缺铁性贫血”里的铁指的是铁元素.铁在人体内是以+2价铁离子络合的形式存在的,并不是以+3价铁离子、铁原子形式存在,更不是以氧化铁的形式存在,所以“缺铁性贫血”里的铁指的是铁元素,故答案为:A
点评:
本题考点: 人体的元素组成与元素对人体健康的重要作用;分子、原子、离子、元素与物质之间的关系.
考点点评: 铁离子是指Fe3+,Fe2+是亚铁离子.1年前查看全部
- (2010•宁德)(1)乳酸亚铁片可用于治疗缺铁性贫血.如图为乳酸亚铁片说明上的部分文字.请仔细阅读后回答以下问题: [
(2010•宁德)(1)乳酸亚铁片可用于治疗缺铁性贫血.如图为乳酸亚铁片说明上的部分文字.请仔细阅读后回答以下问题:
①乳酸亚铁中含有______种元素.[主要成分]乳酸亚铁,化学式
c6h10feo6•3h2o
[用量]成人治疗量0.3~0.6g/日
[注意事项]1.宜饭后口服
2.服时忌茶,以免被鞣质沉淀
[规格]0.1g/片
②乳酸亚铁中碳、铁两种元素的质量比为______.
③服药时不能喝茶的原因是______.
(2)下表是元素周期表的一部分,请你根据下表回答问题:
①钠的相对原子质量是______3li
锂
6.9414be
铍
9.0125b
硼
10.816c
碳
12.017n
氮
14.018o
氧
16.009f
氟
19.0010ne
氖
20.1811na
钠
22.9912mg
镁
24.3113al
铝
26.9814si
硅
28.0915p
磷
30.9716s
硫
32.0617cl
氯
35.4518ar
氩
39.95
②上表中,金属元素有______种.
③食盐的主要成分是______(填化学式).
(3)今年西南的持久旱灾牵动***人民的心,灾区饮水安全成为人们关注的重要问题.请你应用以下资料及所学的化学知识,为灾区人民提供饮水安全常识.
【资料在线】***生活饮用水的标准:
①为了使灾区饮用水达到感官指标中的任意一项要求,可采用的净水方法有______(写出一种方法即可).感官指标 化学指标 细菌学指标 水质***
且澄清透明ph6.5~8.5;总硬度<250mg/l
(以碳酸钙计);铜<1.0mg/l;…等细菌总数<100个/ml等
②检验灾区某水样是硬水还是软水,常用的物质是______.
③漂白粉可用于饮用水的杀菌消毒,其有效成分是次氯酸钙 化学式为ca(clo)2,次氯酸钙可发生如下反应:ca(clo)2+x+h2o=caco3↓+2hclo,则x的化学式为______.
④爱护水资源,人人有责.作为中学生,在日常生活中,你的节水方法是______(写出一种方法即可). honlang5111年前1
honlang5111年前1 -
 专程来捣乱 共回答了21个问题
专程来捣乱 共回答了21个问题 |采纳率76.2%解题思路:(1)根据标签中所标明的物质的化学式,判断物质的组成元素,并利用相对原子质量计算组成元素的质量比;根据标签中注意事项,说明服药时不能喝茶的原因;
(2)根据元素周期表查出钠元素的相对原子质量;根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,进行解答;生活中用到的很多种盐,在我们化学课本中经常提到,如做为调味品的食盐,其主要成分是氯化钠;
(3)根据净水的方法进行分析;肥皂水可以检验水样是硬水还是软水;利用质量守恒定律可求出X的化学式;根据节约用水的方法和措施进行分析解答.(1)①根据乳酸亚铁的化学式,可知该物质由C、H、O、Fe四种元素组成;
②乳酸亚铁中碳、铁两种元素的质量比=(12×5):56=15:14;
③根据标签中的注意事项可知,该药品中所含乳酸亚铁能与茶水形成沉淀而降低药效,因此服药时不能喝茶;
(2)根据元素周期表查出钠元素的相对原子质量为:24.31;根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,由此可知表中,属于金属元素的有5种;氯化钠是食盐的主要成分,其化学式为:NaCl;
(3)常用的净水方法有:过滤或蒸馏或吸附或沉淀等;肥皂水可以检验水样是硬水还是软水;在化学反应中原子的种类和数目在化学反应前后都不变,因此可化学方程式推出X的化学式为CO2;在生活中节水措施有:首先,要树立惜水意识,开展水资源警示教育;其次,必须合理开发水资源,避免水资源破坏;第三,提高水资源利用率,减少水资源浪费;第四、进行水资源污染防治,实现水资源综合利用.节约用水人人有责,如刷牙用口杯接水;工业用水重复利用;洗衣水用来拖地后再冲厕所;园林采用喷灌浇水;生活污水集中处理后再利用等.
故答案为:
(1)①4;②15:14;③以免乳酸亚铁被鞣质沉淀;
(2)22.99;5;NaCl;
(3)过滤(或蒸馏或吸附或沉淀等合理答案);肥皂水;CO2;洗脸水用来拖地板等合理答案.点评:
本题考点: 标签上标示的物质成分及其含量;水的净化;元素周期表的特点及其应用;化学式的书写及意义;元素质量比的计算;有关化学式的计算和推断;化学性质与物理性质的差别及应用;保护水资源和节约用水.
考点点评: 通过阅读图标、图表回答问题,体现了获得信息并利用所学知识处理信息的能力.1年前查看全部
- 缺铁性贫血为何是小细胞低色素性贫血?缺铁会导致细胞变小?会造成低色素?(这个色素是指?)
 hellobiqing1年前1
hellobiqing1年前1 -
 珊瑚盏 共回答了19个问题
珊瑚盏 共回答了19个问题 |采纳率89.5%是的,缺铁会造成红细胞的变小,低色素是指血红素的减少,因而缺铁性贫血又称小细胞低色素性贫血.铁是血红素生成的辅酶(必需材料),血红素是血红蛋白的主要成分,血红蛋白又是红细胞的主要组成部分,因而,缺铁会造成血红素的降低,红细胞体积变小.
在显微镜在观察血涂片,缺铁贫较正常血细胞体积变小,颜色变淡.1年前查看全部
- 硫酸亚铁可用于治疗缺铁性贫血.计算:若某病人补充2.8g铁元素,医生应开给病人多少
硫酸亚铁可用于治疗缺铁性贫血.计算:若某病人补充2.8g铁元素,医生应开给病人多少
克含硫酸亚铁80%的药品? 满天花想雨1年前2
满天花想雨1年前2 -
 海儿007 共回答了16个问题
海儿007 共回答了16个问题 |采纳率100%80%×2.8g等于179.2
无节操啊,哟哟切克闹~1年前查看全部
- 某超市出售的一种麦片,含有微量的颗粒极小的还原性铁粉,常服可治疗缺铁性贫血.
 使智使勇使贪使愚1年前6
使智使勇使贪使愚1年前6 -
 秦汉唐明 共回答了17个问题
秦汉唐明 共回答了17个问题 |采纳率100%鉄粉与胃酸反映生成2价鉄离子
Fe+2HCl=FeCl2+H2↑
铁离子能被吸收1年前查看全部
- 硫酸亚铁可用于治疗缺铁性贫血.计算:
硫酸亚铁可用于治疗缺铁性贫血.计算:
(1)硫酸亚铁(FeSO4)中铁、硫、氧三种元素的质量比为______.
(2)某贫血患者共需补充1.4g铁元素,服用的药物中相当于需要硫酸亚铁晶体(FeSO4•7H2O)多少克? 展云帆1年前1
展云帆1年前1 -
 偶素快男控 共回答了12个问题
偶素快男控 共回答了12个问题 |采纳率100%解题思路:根据硫酸亚铁的化学式为FeSO4,利用相对原子质量来计算元素的质量比、元素的质量分数,再根据需要的铁的质量及铁的质量分数来计算硫酸亚铁晶体的质量.(1)硫酸亚铁的化学式为FeSO4:
FeSO4中铁、硫、氧三种元素的质量比=56:32:(16×4)=7:4:8;
故答案为:7:4:8
(2)设需要硫酸亚铁晶体(FeSO4•7H2O)质量为m
m×[56/278]×100%=1.4g m=6.95g
答:相当于硫酸亚铁晶体的质量为6.95g.点评:
本题考点: 元素质量比的计算;化合物中某元素的质量计算.
考点点评: 本题考查学生利用化学式的进行简单计算,学生熟悉原子的相对原子质量、元素质量比及元素质量分数的计算方法即可解答.1年前查看全部
- (2011•如皋市模拟)绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁屑(含少量锡等杂质)生
(2011•如皋市模拟)绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:

已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是______.
(2)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是______;通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②______.
(3)操作IV的顺序依次为:______、结晶______.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②______.
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe2++MnO-4+8H+═5Fe3++Mn2++4H2O).
①计算上述样品中FeSO4•7H2O的质量分数为______.
②若用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有______;______. korla30g1年前1
korla30g1年前1 -
 太湖渔翁1 共回答了24个问题
太湖渔翁1 共回答了24个问题 |采纳率87.5%解题思路:(1)依据三价铁离子的检验方法分析回答,三价铁离子遇硫氰酸钾溶液变血红色;
(2)依据流程关系图分析,在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=2为了除去杂质离子Sn2+;通入硫化氢制饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;
(3)操作IV的目的是从滤液中析出绿矾晶体,利用蒸发浓缩,结晶洗涤得到晶体;
(4)操作IV得到的绿矾晶体用少量冰水洗涤目的是洗去表面杂质,温度降低绿矾溶解度降低,减少绿矾晶体的损失;
(5)依据滴定实验的反应终点时发生的反应进行计算,根据实验过程中操作的误差分析方法进行判断.(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是利用三价铁离子检验方法分析,三价铁离子遇硫氰酸根离子会反应生成硫氰酸铁血红色,证明铁离子的存在,
故答案为:取少量晶体溶于水,滴加KSCN溶液,若不出现血红色,表明不含有Fe3+;
(2)已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,
故答案为:使Sn2+完全变成SnS沉淀,而Fe2+不沉淀;防止Fe2+的氧化;
(3)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发、结晶、过滤、洗涤,故答案为:蒸发、过滤洗涤;
(4)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,
故答案为:降低洗涤过程中FeSO4•7H2O的损耗;
(5)①a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL;依据反应方程式减小计算:
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0200L
计算得到;n(Fe2+)=0.001mol;
则250mL溶液中含Fe2+=0.001mol×[250/25]=0.01mol;
FeSO4•7H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;
质量分数=[2.78g/2.85g]×100%=97.54%;
故答案为:97.54%;
②用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因是洗涤不彻底,亚铁离子被空气中的氧气部分氧化,
故答案为:样品中存在少量的杂质(如H2O、H2SO4等);样品部分被氧化.点评:
本题考点: 铁盐和亚铁盐的相互转变;氧化还原反应的计算;制备实验方案的设计.
考点点评: 本题考查了铁盐亚铁盐的性质应用,分离混合物的实验方法设计和分析判断,滴定实验的分析判断,数据计算,误差分析的方法,题目难度中等.1年前查看全部
- 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物.该药品不溶于水但能溶于人体多的胃酸.某同学为了检测“速力菲”药片多Fez+的存在,设计并进行了如下实验:

(1)试剂1是______,加入新制氯水后溶液多发生的离子反应方程式是:______,______;
(z)加入KSCN溶液后,在未加新制氯水的情况下,溶液多也产生了红色,其可能的原因是______;
(四)在实验多发现放置一段时间,溶液的颜色会逐渐褪去.为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确.写出有关的实验操作、预期现象和结论.(不一定填满,也可以补充)编号 猜 想 甲 溶液多的+四价Fe又被还原为+z价Fe 乙 溶液多的SCN-被过量的氯水氧化 丙 新制的氯水具有漂白性,将该溶液漂白 编号 实验操作 预期现象和结论 ①  外来人口请多关照1年前1
外来人口请多关照1年前1 -
 chris_tj 共回答了13个问题
chris_tj 共回答了13个问题 |采纳率92.3%解题思路:(1)根据图示分析可知,加入试剂1用于溶解药品,应该选用加入非氧化性的酸;氯气氧化亚铁离子生成铁离子,铁离子与硫氰根离子结合生成硫氰化铁;
(2)亚铁离子具有较强的还原性,部分亚铁离子能够被空气中氧气氧化成铁离子;
(3)若溶液中的SCN-被过量的氯水氧化,可以再向溶液中加入硫氰化钾溶液,根据反应现象进行判断.(1)试剂1用于溶解样品,可以选用稀盐酸或者稀硫酸;氯气氧化亚铁离子生成铁离子,离子方程式为:7Fe7++Cm7=7Fe多++7Cm-;
铁离子与硫氰根离子结合生成硫氰化铁,离子方程式为:Fe多++SCN-=[Fe(SCN)]7+ (或Fe多++多SCN-=Fe(SCN)多),
故答案为:稀盐酸(或稀硫酸溶液);7Fe7++Cm7=7Fe多++7Cm-;Fe多++SCN-=[Fe(SCN)]7+ (或Fe多++多SCN-=Fe(SCN)多);
(7)少量亚铁离子被空气中的氧气氧化成铁离子,所以加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,
故答案为:少量Fe7+被空气中氧气氧化成Fe多+.
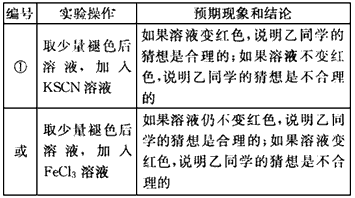
(多)乙的猜想为:溶液中的SCN-被过量的氯水氧化,若检验乙同学的猜想是否正确,可以取少量褪色后溶液,加入KSCN溶液,如果溶液变红色,说明乙同学的猜想是合理的;如果溶液不变红色,说胆乙同学的猜想是不合理的,
故答案为:
编号实验操作预期现象和结论
①取少量褪色后溶液,加入KSCN溶液如果溶液变红色,说明乙同学的猜想是合理的;如果溶液不变红色,说胆乙同学的猜想是不合理的
或取少量褪色后溶液,加入FeCm多溶液如果溶液仍不变红色,说明乙同学的猜想是合理的;如果溶液变红色,说明乙同学的猜想是不合理的.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查铁离子与亚铁离子的检验,难度中等.注意明确检验铁离子和亚铁离子的方法,试题培养了学生灵活应用所学知识的能力.1年前查看全部
- 硫酸亚铁(FeSO4)可用于治疗缺铁性贫血,根据硫酸亚铁的化学式计算:
硫酸亚铁(FeSO4)可用于治疗缺铁性贫血,根据硫酸亚铁的化学式计算:
(1)硫酸亚铁的相对分子质量.
(2)硫酸亚铁中铁、硫、氧三种元素的质量比.
(3)硫酸亚铁中铁元素的质量分数(结果保留一位小数). honh1361年前1
honh1361年前1 -
 qq42178217 共回答了12个问题
qq42178217 共回答了12个问题 |采纳率91.7%解题思路:根据硫酸亚铁的化学式为FeSO4,利用相对原子来计算相对分子质量、元素的质量比、元素的质量分数.(1)由硫酸亚铁的化学式为FeSO4,
则相对分子质量为56+32+16×4=152,
答:硫酸亚铁的相对分子质量为152;
(2)由硫酸亚铁的化学式为FeSO4,
则铁、硫、氧三种元素的质量比为56×1:32×1:16×4=7:4:8,
答:硫酸亚铁中铁、硫、氧三种元素的质量比为7:4:8;
(3)由硫酸亚铁的化学式为FeSO4,
则铁元素的质量分数为[56/56+32+16×4]×100%=36.8%,
答:硫酸亚铁中铁元素的质量分数为36.8%.点评:
本题考点: 相对分子质量的概念及其计算;元素质量比的计算;元素的质量分数计算.
考点点评: 本题考查利用物质的化学式进行简单计算,熟悉原子的相对原子质量、物质的构成及相关概念是解答本题的关键.1年前查看全部
- 铁是人体必需的微量元素,它是血红蛋白的成分,能帮助氧气的运输.缺少铁元素,易患缺铁性贫血.医学上经常用硫酸亚铁糖衣片给这
铁是人体必需的微量元素,它是血红蛋白的成分,能帮助氧气的运输.缺少铁元素,易患缺铁性贫血.医学上经常用硫酸亚铁糖衣片给这种病人补铁.现取20粒糖衣片,质量为10g,溶于40g水中.向所配溶液中滴加氯化钡溶液至略过量过滤、洗涤、干燥,称量得知,沉淀质量为2.33g.已知:FeSO4+BaCl2=BaSO4↓+FeCl2,试计算:
(1)该糖衣片中硫酸亚铁的质量分数.
(2)1粒糖衣片中含铁元素的质量是______g. highhill198407251年前4
highhill198407251年前4 -
 wuxianlhui 共回答了21个问题
wuxianlhui 共回答了21个问题 |采纳率100%解题思路:根据化学的化学方程式FeSO4+BaCl2=BaSO4↓+FeCl2,由生成的沉淀硫酸钡的质量计算参加反应的硫酸亚铁的质量即10g糖衣片中所含硫酸亚铁的质量;由所计算的硫酸亚铁的质量,利用糖衣片中硫酸亚铁的质量分数=硫酸亚铁的质量20粒糖衣片的质量10g×100%完成硫酸亚铁的质量分数的计算;由所计算硫酸亚铁的质量,计算其中铁元素的质量,所得铁元素质量的二十分之一即1粒糖衣片中含铁元素的质量.(1)设参加反应的硫酸亚铁的质量为x
FeSO4+BaCl2=BaSO4↓+FeCl2
152 233
x 2.33g
[152/x=
233
2.33g] x=1.52g
该糖衣片中硫酸亚铁的质量分数=[1.52g/10g×100%=15.2%
答:该糖衣片中硫酸亚铁的质量分数为15.2%;
(2)1粒糖衣片中含铁元素的质量=(1.52g×
56
152×100%)×
1
20]=0.028g
故答案为:0.028.点评:
本题考点: 根据化学反应方程式的计算;元素的质量分数计算.
考点点评: 根据化学方程式表示反应中物质的质量比,可由反应中某一物质的质量计算反应中其它物质的质量.1年前查看全部
- (1)缺铁性贫血中的“铁”指?A铁单质B铁元素C四氧化三铁D三氧化二铁(2)t摄氏度时某物质溶解度为10g该物质的饱和溶
(1)缺铁性贫血中的“铁”指?
A铁单质
B铁元素
C四氧化三铁
D三氧化二铁
(2)t摄氏度时某物质溶解度为10g该物质的饱和溶液中溶质.溶剂.溶液之间的质量比为?
A溶液:溶质=10:1 B溶液:溶剂=10:11
C溶剂:溶液=11:10 D溶剂:溶质=10:1
(3)下列物质溶解于水溶液,温度升高的是?
A:NaOH固体 B:NaCl固体
C:NH4NO3固体 D:蔗糖固体 汉卿83411年前7
汉卿83411年前7 -
 w6621380 共回答了15个问题
w6621380 共回答了15个问题 |采纳率86.7%1.B.铁元素
2.D.溶解度=100g溶剂中可溶的溶质的质量,溶解度=10g,即100g溶质中可溶的溶质为10g,溶剂:溶质=10:1,溶液:溶质=11:1
3.A.NaOH溶于水放热,温度升高,NaCl,蔗糖溶于水温度不变,NH4NO3溶于水吸热,温度降低1年前查看全部
- 硫酸亚铁是一种可用于治疗缺铁性贫血的药剂.硫酸亚铁药片外表包有一层特制的弹衣,以保护硫酸亚铁
硫酸亚铁是一种可用于治疗缺铁性贫血的药剂.硫酸亚铁药片外表包有一层特制的弹衣,以保护硫酸亚铁
1请完成硫酸亚铁在硫酸酸化的条件下与空气中氧气反应的离子方程式
2.反应中的氧化剂是
3试设计一个实验方案,探究某硫酸亚铁药片是否被氧化.请在答题卡的表格中,写出实验步骤以及预期现象和结论
注:限选实验试剂0.1mol/L-1KSCN.Cl2水
把药品糖衣刮去,用研体研碎,取少量研碎的粉末在试管中,用少量的蒸馏水溶解
结论:硫酸亚铁在蒸馏水中溶解
结论:
结论3; qinqklboy1年前1
qinqklboy1年前1 -
 紫轩女人 共回答了22个问题
紫轩女人 共回答了22个问题 |采纳率86.4%1、4Fe2+ + 4H+ +O2 =4Fe3+ +2 H2O
2、氧气
3、步骤2:加入0.1mol/L-1KSCN,没有血红色
结论:硫酸亚铁没有被氧化
步骤3:加入Cl2水,出现血红色
结论:亚铁离子被氯水氧化为铁离子1年前查看全部
- (2008•潮州二模)富马酸亚铁FeH2C4O4,商品名富血铁,含铁量高,是治疗缺铁性贫血常见的药物.某校研究性学习小组
(2008•潮州二模)富马酸亚铁FeH2C4O4,商品名富血铁,含铁量高,是治疗缺铁性贫血常见的药物.某校研究性学习小组通过查阅大量资料后,决定自行制备富血铁并检测其含铁量.
富马酸(HOOC-CH=CH-COOH)的性质:
Fe2+的性质:分子式 相对分子质量 溶解度和溶解性 酸性 H4C4O4 116 在水中:0.7g(25℃)、9.8g(97.5℃).
盐酸中:可溶.二元酸,且0.1mol/L H4C4O4的pH=2.
Ⅰ、富马酸亚铁的制备开始沉淀时的pH 完全沉淀时的pH 7.6 9.6
①将适量的富马酸置于100mL烧杯中,加水20mL在热沸搅拌下,加入Na2CO3溶液10mL,使其pH为6.5~6.7;
②将上述溶液转移至100mL圆底烧瓶中,装好回流装置,加热至沸;
③缓慢加入新制的FeSO4溶液30mL,维持温度100℃,充分搅拌1.5小时.
④冷却、过滤,洗涤沉淀,然后水浴干燥,得到棕色粉末.
试回答:
步骤①中加入Na2CO3,反应的离子方程式______(富马酸及其酸根用化学式表示).
步骤①中反应后控制溶液pH为6.5~6.7;若反应后溶液的pH太小,则引起的后果是______.若反应后溶液的pH太大则引起的后果是______.
Ⅱ、产品纯度测定
准确称取富血铁0.3200g,加煮沸过的3mol/LH2SO4溶液15mL,待样品完全溶解后,加煮沸过的冷水50mL和4滴邻二氮菲-亚铁指示剂,立即用(NH4)2Ce(SO4)3(硫酸高铈铵)0.1000mol/L标准溶液进行滴定.直至溶液刚好变为浅蓝色即为终点.测得其体积为18.50mL,计算样品中富血铁的质量分数,写出计算过程.(Fe2++Ce4+═Fe3++Ce3+)n(FeH2C4O4)=n(Ce4+)=0.1000mol/L×0.01850L=0.001850mol,
m(FeH2C4O4)=0.001850mol×170g/mol=0.3145g,
w(FeH2C4O4)=[0.3145g/0.3200g]×100%=98.28%n(FeH2C4O4)=n(Ce4+)=0.1000mol/L×0.01850L=0.001850mol,.
m(FeH2C4O4)=0.001850mol×170g/mol=0.3145g,
w(FeH2C4O4)=[0.3145g/0.3200g]×100%=98.28% 我是鄂人1年前1
我是鄂人1年前1 -
 dd7355 共回答了11个问题
dd7355 共回答了11个问题 |采纳率81.8%解题思路:Ⅰ、根据制备流程可知,富马酸的酸性大于碳酸,富马酸与碳酸钠反应生成H2C4O42-和二氧化碳气体,据此写出反应的离子方程式;若pH太小,富马酸与碳酸钠反应生成的H2C4O42-的浓度过低;若反应后溶液的pH太大,亚铁离子与氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁进一步反应生成氢氧化铁,导致降低了富马酸亚铁的产率;
Ⅱ、先计算出消耗的Ce4+离子的物质的量,然后根据反应方程式计算出亚铁离子的物质的量、质量,最后计算出样品中富血铁的质量分数.Ⅰ、富马酸与碳酸钠反应生成富马酸钠和二氧化碳、水,反应的离子方程式为:H4C4O4+CO32-═H2C4O42-+CO2↑+H2O;反应后控制溶液pH为6.5~6.7,若反应后溶液的pH太小,反应生成的H2C4O42-的浓度过低,影响富马酸亚铁的制取;若反应后溶液的pH太大,亚铁离子能够与氢氧根离子反应生成氢氧化亚铁,而氢氧化亚铁进一步被氧化成氢氧化铁,影响富马酸亚铁的产率,
故答案为:H4C4O4+CO32-═H2C4O42-+CO2↑+H2O;H2C4O42-的浓度过低(或生成的阴离子含有H3C4O4-);Fe2+易转化为Fe(OH)2,并进一步被氧化为Fe(OH)3,从而降低富马酸亚铁的产率;
Ⅱ、滴定过程中消耗的Ce4+离子的物质的量为:n(Ce4+)=0.1000mol/L×0.01850L=0.001850mol,
根据反应方程式Fe2++Ce4+═Fe3++Ce3+可知:n(FeH2C4O4)=n(Ce4+)=0.001850mol,
富马酸亚铁的质量为:m(FeH2C4O4)=0.001850mol×170g/mol=0.3145g,
样品中富血铁的质量分数为:w(FeH2C4O4)=[0.3145g/0.3200g]×100%=98.28%,
故答案为:n(FeH2C4O4)=n(Ce4+)=0.1000mol/L×0.01850L=0.001850mol,
m(FeH2C4O4)=0.001850mol×170g/mol=0.3145g,
w(FeH2C4O4)=[0.3145g/0.3200g]×100%=98.28%.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了制取富马酸亚铁方法及测定富马酸亚铁样品中的质量分数,题目难度中等,注意掌握根据滴定原理计算样品纯度的方法,试题有利于培养学生的分析、理解能力.1年前查看全部
- 某种含硫酸亚铁的药物可以用于治疗缺铁性贫血.某贫血患者每天需服用这种含铁原素10%的药物112mg,则每天他服用这种药物
某种含硫酸亚铁的药物可以用于治疗缺铁性贫血.某贫血患者每天需服用这种含铁原素10%的药物112mg,则每天他服用这种药物中含硫酸亚铁(FeSo4)的质量是:(该物质其他成分不含铁元素)
拜托解题的时候把解题过程和思路写下来,这种题目我一向不怎么会解答.
答案也一并写出来. 白桦林江枫1年前1
白桦林江枫1年前1 -
 csxu2005 共回答了21个问题
csxu2005 共回答了21个问题 |采纳率85.7%Fe的质量为112*10%=11.2mg
FeSO4的原子相对质量为152 ,Fe的相对原子质量为56
FeSO4:Fe=152:56
因为Fe=11.2mg
解得FeSO4=30.4mg1年前查看全部
- 硫酸亚铁可用于治疗缺铁性贫血.某贫血患者每天需补充1.12g铁元素,则他服用的药物中含硫酸亚铁的质量至少为( )
硫酸亚铁可用于治疗缺铁性贫血.某贫血患者每天需补充1.12g铁元素,则他服用的药物中含硫酸亚铁的质量至少为( )
A. 3.80g
B. 6.95g
C. 10g
D. 3.04g 士多啤犁1年前4
士多啤犁1年前4 -
 zongdiaodu77 共回答了23个问题
zongdiaodu77 共回答了23个问题 |采纳率95.7%解题思路:此题需要先计算硫酸亚铁的含铁质量分数,然后利用铁的质量除以铁的质量分数即可求出硫酸亚铁的质量.先计算硫酸亚铁中铁的质量分数,然后用铁的质量除以其质量分数即可.
硫酸亚铁中铁的质量分数是:[56/56+32+16×4]×100%=36.8%
需硫酸亚铁的质量是 1.12g÷36.8%=3.04g
故选D点评:
本题考点: 化合物中某元素的质量计算.
考点点评: 此题是对化学式计算的考查,主要利用了元素的质量等于物质的质量乘以元素的质量分数的计算方法,属基础性化学计算题.1年前查看全部
- 为什么长期缺乏铁会出现缺铁性贫血?
 僧行者1年前1
僧行者1年前1 -
 jochleo 共回答了25个问题
jochleo 共回答了25个问题 |采纳率92%血红蛋白是高等生物体内负责运载氧的一种蛋白质.可以用平均细胞血红蛋白浓度测出浓度.血红蛋白是使血液呈红色的蛋白,它由四条链组成,两条α链和两条β链,每一条链有一个包含一个铁原子的环状血红素.氧气结合在铁原子...1年前查看全部
大家在问
- 1动物成体个体死亡后,能产生——————,保证种族的————————
- 2他既会唱歌又会跳舞用英语怎么说!
- 3生物的遗传信息储存在基因的( )中.
- 4xy方程式怎么算98/x+42/y=872/x+108/y=12
- 5品质源于设计 英语怎么说
- 6鸟下面加个儿读什么
- 7一个单人旁加一个几 怎么念?加个儿呢?
- 8五年级分数解方程题
- 9i 的相关语法?请
- 10朤、惢、燚、湬、壵、垚分别怎么读
- 11矩形两对角线的夹角是60°,一条对角线与较短边的和是18,则矩形较长边是多少
- 12“鋈牖”这两个字怎么读啊
- 13电子绕核运动可等效为环形电流.设氢原子沿半径为r的圆形轨道运动,已知电子质量为m,电子的电量为e,则其
- 14英语造句!超级急!用found got came began gave went grew had heard knew
- 15仿写句子.到了正午,天安门广场已经成了人的海洋,红旗翻动,像海上波浪