1atm,600℃下苯蒸汽与水蒸气的密度分别是是多少啊?
 bondchen95332022-10-04 11:39:541条回答
bondchen95332022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 整志为 共回答了12个问题
整志为 共回答了12个问题 |采纳率83.3%- 1atm,600℃下苯蒸汽的密度是1.085 kg/m3
水蒸气的密度是0.250 kg/m3 - 1年前
相关推荐
- 化学计算题,质量守恒1.将MgCl2·6H2O固体加热至600℃左右,得到amolMgO bmolMgCl2、HCl和水
化学计算题,质量守恒
1.将MgCl2·6H2O固体加热至600℃左右,得到amolMgO bmolMgCl2、HCl和水若干,若不补充其他原料,用产生的HCl和产生的水制取36.5%的盐酸,则a:b=? 小草陈1年前1
小草陈1年前1 -
 zhangyanshou 共回答了20个问题
zhangyanshou 共回答了20个问题 |采纳率95%配平:(a+b)MgCl2.6H2O-----a MgO+bMgCl2+2a HCl +(5a+6b)H2O
36.5%=2a*36.5/[2a*36.5+(5a+6b)*18]
解得 a/b=4/11年前查看全部
- A g食盐和B g98%的浓硫酸混合后微热,生成无色气体溶于水,然后把剩余物再加热到600℃,又有气体产生,用
A g食盐和B g98%的浓硫酸混合后微热,生成无色气体溶于水,然后把剩余物再加热到600℃,又有气体产生,用
100mL水吸收后来得到的气体,待反应完全,将所得溶液加入1.7%的硝酸银溶液10g,恰好完全反应,问参加反应的食盐和浓硫酸各多少克? 还不知道啊1年前1
还不知道啊1年前1 -
 shcna 共回答了22个问题
shcna 共回答了22个问题 |采纳率90.9%首先分析,食盐与浓硫酸在加热时反应为NaCl+H2SO4(浓)=(微热)NaHSO4+HCl(气体),随着硫酸的浓度降低反应就停止;接着高温到600°,继续发生反应NaCl+NaHSO4=(600度)Na2SO4+HCl(气体)
第二次反应生成的气体为氯化氢,被水吸收后与1.7%硝酸银的溶液10g签好完全反应,硝酸银的物质的量为1.7%x10/170=0.001mol,则第二步反应生成的氯化氢为0.001mol
NaCl + NaHSO4=(600度)Na2SO4+HCl(气体)
1 1 1
=0.001 =0.001 0.001
NaCl + H2SO4(浓)=(微热)NaHSO4+HCl
1 1 1
=0.001 =0.001 0.001
则总共反应的NaCl (食盐)为0.001+0.001=0.002mol,即0.002x58.5=0.117g;总共反应的浓硫酸为0.001mol,即0.001x98=0.098g.1年前查看全部
- (2007•宿迁二模)某校化学兴趣小组学生取纯净的Na2SO3•7H2O 50.00g,然后隔绝空气在600℃以上的强热
(2007•宿迁二模)某校化学兴趣小组学生取纯净的Na2SO3•7H2O 50.00g,然后隔绝空气在600℃以上的强热至恒重(完全反应),分析及计算表明,恒重后的固体质量相当于无水亚硫酸钠的计算值,而且各元素的组成也与无水亚硫酸钠符合,但将它溶于水,却发现溶液的碱性大大高于期望值.经过仔细思考,这位同学猜想Na2SO3加热后发生了歧化反应从而很好解释这种反常现象,并设计了另一组实验,验证了自己的解释是正确的.
(1)加热Na2SO3•7H2O时为什么要隔绝空气(请用简要文字和化学方程式表示)?______.
(2)他对反应现象的解释是______(用化学方程式表达)
(3)溶液的碱性大大高于期望值的原因是:(用离子方程式表达)______.
(4)你估计他设计了什么实验来验证他的猜想.(请写出一种可行的实验方案):
实验试剂 操作 现象 结论 有关方程式 ______ ______ ______ ______ ______  gl56781年前1
gl56781年前1 -
 物质 共回答了20个问题
物质 共回答了20个问题 |采纳率75%解题思路:(1)亚硫酸钠在空气中易被氧气氧化为硫酸钠;
(2)Na2SO3加热后发生了歧化反应,硫元素化合价从+4价变化为-2价和+6价;
(3)Na2SO3加热后发生了歧化反应生成了硫化钠,溶液中水解程度大于亚硫酸钠的水解程度,溶液减小增强;
(4)猜想Na2SO3加热后发生了歧化反应生成硫化钠和硫酸钠,设计实验可以检验S2-和SO42-的方案都可以;(1)亚硫酸钠在空气中易被氧气氧化为硫酸钠,热Na2SO3•7H2O时要隔绝空气,反应的化学方程式为:2Na2SO3+O2=2Na2SO4,
故答案为:Na2SO3在空气中加热时易被氧气氧化为Na2SO4,2Na2SO3+O2=2Na2SO4;
(2)Na2SO3加热后发生了歧化反应,硫元素化合价从+4价变化为-2价和+6价,反应的化学方程式为:4Na2SO3=Na2S+3Na2SO4,
故答案为:4Na2SO3=Na2S+3Na2SO4;
(3)溶液的碱性大大高于期望值的原因是,Na2SO3加热后发生了歧化反应生成了硫化钠,溶液中硫离子水解程度大于亚硫酸根离子水解程度,溶液碱性增强,反应的离子方程式为:S2-+H2O⇌HS-+OH-,故答案为:S2-+H2O⇌HS-+OH-;
(4)硫离子能和酸反应生成硫化氢,硫离子的检验方法:取适量加热后的固体加入适量的水配成溶液,取溶液适量于试管中,向其中加稀盐酸,如有臭鸡蛋蛋气味气体生成,则证明有S2-,硫酸根离子可以和钡离子反应生成硫酸钡,再加入氯化钡溶液出现白色沉淀证明含有硫酸根离子,离子方程式为S2-+2H+=H2S↑、Ba2++SO42-=BaSO4↓,
故答案为:
实验试剂 操作 现象 结论 有关方程式
氯化钡溶液、盐酸 取适量加热后的固体加入适量的水配成溶液,取溶液适量于试管中,向其中加稀盐酸;再向溶液中加入氯化钡溶液 有臭鸡蛋蛋气味气体硫化氢生成;出现硫酸钡白色淀 证明分解产物中含有硫化钠和硫酸钠 S2-+2H+=H2S↑、Ba2++SO42-=BaSO4↓.点评:
本题考点: 性质实验方案的设计.
考点点评: 本题考查了亚硫酸钠的性质分析判断,反应化学方程式和离子方程式的书写方法,实验方案的设计和实验现象的判断是解题关键,题目难度中等.1年前查看全部
- 普通化学11. 将1.00 mol SO2 和1.00 mol O2 的混合物在600℃和总压力为 100 kPa的恒压
普通化学
11. 将1.00 mol SO2 和1.00 mol O2 的混合物在600℃和总压力为 100 kPa的恒压下,通过 V2O5 催化剂使生成 SO3,达到平衡后总压仍为100kPa,测得混合物中剩余的氧气(O2 )为0.615 mol,试计算标准平衡常数K(873K) 。 ykhutao1年前1
ykhutao1年前1 -
 qqwwzx121 共回答了24个问题
qqwwzx121 共回答了24个问题 |采纳率95.8%我们这样看
将1.00 mol SO2 和1.00 mol O2 的混合物在600℃和总压力为 100 kPa的恒压下,通过 V2O5 催化剂使生成 SO3,达到平衡后总压仍为100kPa,
也就是横温横压下的问题
测得混合物中剩余的氧气(O2 )为0.615 mol
列出方程式1年前查看全部
- 在一定条件下,二氧化硫和氧气发生如下反应:2SO 2 (g)+O 2 (g) 2SO 3 (g) ;△H<0。600℃时
在一定条件下,二氧化硫和氧气发生如下反应:2SO 2 (g)+O 2 (g)  2SO 3 (g) ;△H<0。600℃时,在某密闭容器中,将二氧化硫和氧气混合,反应过程中 SO 2 、O 2 、SO 3 物质的量有如图所示的变化。其中
2SO 3 (g) ;△H<0。600℃时,在某密闭容器中,将二氧化硫和氧气混合,反应过程中 SO 2 、O 2 、SO 3 物质的量有如图所示的变化。其中
10min到15min时,与图像不相符的变化是 [ ]
[ ]A.加了催化剂
B.增加SO 3 的物质的量
C.升高温度
D.缩小容器体积 hcpaiwsl1年前1
hcpaiwsl1年前1 -
 harry1207 共回答了22个问题
harry1207 共回答了22个问题 |采纳率81.8%B1年前查看全部
- 火炉中心温度可达600℃左右,用锡焊补的铝锅能烧开水的原因是
 4461912221年前2
4461912221年前2 -
 小野寺 共回答了11个问题
小野寺 共回答了11个问题 |采纳率100%水和锅的温度是一体的 一样的 水的沸点1oo 再加热也不会上升 只是沸腾 也就只有1oo了1年前查看全部
- 有一块烧红的铁块,温度是600℃,质量为2㎏.把它的温度降低到30℃,要放出多少热量?这些热量可以烧开多
有一块烧红的铁块,温度是600℃,质量为2㎏.把它的温度降低到30℃,要放出多少热量?这些热量可以烧开多
少20℃的水/ 唯有泪干行1年前1
唯有泪干行1年前1 -
 wildbird2011 共回答了17个问题
wildbird2011 共回答了17个问题 |采纳率88.2%1:
Q放=Cm(t1-t2)
=460*2*(600-30)
=524400J
2:
Q吸=Cm(t2-t1)
524400=4200m*(100-20)
m=1.56kg1年前查看全部
- 600℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g) 2SO3(g);△H<0.反应过
600℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g) 2SO3(g);△H<0.反应过
程中SO2、O2、SO3物质的量变化如图,下列说法不正确的是( )
A. 反应从0 min开始,到第一次平衡时,二氧化硫的转化率为40%
B.反应进行到10min至15min的曲线变化可能升高了温度
C.反应进行至20min时,曲线发生变化是因为通入了氧气
D.在15-20min;25-30min内时反应处于平衡状态

为什么B说的不正确,感觉B中说可能是对的。 网尼1年前1
网尼1年前1 -
 1000000个为什么 共回答了11个问题
1000000个为什么 共回答了11个问题 |采纳率81.8%没有图啊1年前查看全部
- 600℃,A.B.C三种气体在密闭容器中,浓度变化情况如图所示,仅从图上分析不能得出有关A的结论的是\x05\x05\x
600℃,A.B.C三种气体在密闭容器中,浓度变化情况如图所示,仅从图上分析不能得出有关A的结论的是x05x05x05x05
x05A、A是反应物
x05B、前4分钟,A的分解率是0.1mol/(L.min)
x05C、4分钟后,若升高温度,A的转化率增大
x05D、4分钟后,若增大压强,A的转化率减小
 zerolfly1年前3
zerolfly1年前3 -
 zc5102000 共回答了20个问题
zc5102000 共回答了20个问题 |采纳率95%C、4分钟后,若升高温度,A的转化率增大1年前查看全部
- 在体积恒定的密闭容器中,一定量的SO2与1.100molO2在催化剂作用下加热到600℃发生反应:2SO2+O2催化剂△
在体积恒定的密闭容器中,一定量的SO2与1.100molO2在催化剂作用下加热到600℃发生反应:2SO2+O2
2SO3;△H<0.当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%.下列有关叙述正确的是( )催化剂 △
A. 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B. 降低温度,正反应速率减小程度比逆反应速率减小程度大
C. 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g
D. 达到平衡时,SO2的转化率为90% oliver2311年前1
oliver2311年前1 -
 wuxiaogang110 共回答了23个问题
wuxiaogang110 共回答了23个问题 |采纳率78.3%解题思路:A、同一物质的正、逆反应速率相等说明可逆反应到达平衡;
B、降低温度,正、逆反应速率都减小,该反应正反应是放热反应,降低温度平衡向正反应移动,逆反应速率减小程度更大;
C、混合气体通入通入过量BaCl2溶液中,得到沉淀为硫酸钡,根据差量法计算平衡时生成的三氧化硫的物质的量,根据硫元素守恒有n(BaSO4)=n(SO3),再根据m=nM计算硫酸钡的质量;
D、令开始加入的SO2为amol,利用压强之比等于物质的量之比计算a的值,根据差量法计算参加反应的二氧化硫的物质的量,再根据转化率定义计算.A、SO3的生成速率与SO2的消耗速率都表示正反应速率,反应始终相等,不能说明到达平衡,故A错误;
B、降低温度,正、逆反应速率都减小,该反应正反应是放热反应,降低温度平衡向正反应移动,逆反应速率减小程度更大,故B错误;
C、混合气体通入通入过量BaCl2溶液中,得到沉淀为硫酸钡,平衡时气体的物质的量减少0.315mol,则:
2SO2+O2
催化剂
△2SO3 物质的量减少△n
2 1
n(SO3) 0.315mol
所以n(SO3)=2×0.315mol=0.63mol,
根据硫元素守恒有n(BaSO4)=n(SO3)=0.63mol,所以生成的硫酸钡的质量为0.63mol×233g/mol=146.79g,故C错误;
D、令开始加入的SO2为amol,利用压强之比等于物质的量之比,则:
(a+1.1)mol×82.5%=(a+1.1-0.315)mol,
解得a=0.7,
平衡时气体的物质的量减少0.315mol,则:
2SO2+O2
催化剂
△2SO3 物质的量减少△n
2 1
n(SO2) 0.315mol
所以n(SO2)=2×0.315mol=0.63mol,
故二氧化硫的转化率为[0.63mol/0.7mol]×100%=90%,故D正确;
故选D.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡状态的判断、影响反应速率的因素、化学平衡计算等,难度中等,C选项中注意二氧化硫与氯化钡不能反应,D选项中注意数据的处理与差量法利用.1年前查看全部
- 87.75g食盐与18mol/L的浓硫酸55.5mL混合微热后能产生氯化氢气体多少mol?②再加热到600℃,反应后能产
87.75g食盐与18mol/L的浓硫酸55.5mL混合微热后能产生氯化氢气体多少mol?②再加热到600℃,反应后能产生氯化氢多少mol?③若将两次生成的氯化氢气体用219g水吸收,生成盐酸的密度为1.098g/mL,求盐酸的物质的量浓度和溶液的质量分数.
 ELNE1年前1
ELNE1年前1 -
 nl9906 共回答了18个问题
nl9906 共回答了18个问题 |采纳率88.9%1、
设微热消耗H2SO4 b mol
NaCl+H2SO4(浓)===NaHSO4+HCl
58.5g 1
87.75g b
得到 58.5/87.75=1/b b=1.5
原来浓硫酸的物质的量为 18*0.0555=0.999mol1年前查看全部
- 请速度回答以下问题|,10点之前回答 化学兴趣小组的同学将Na2SO3在隔绝空气并经600℃以上
请速度回答以下问题|,10点之前回答 化学兴趣小组的同学将Na2SO3在隔绝空气并经600℃以上
化学兴趣小组的同学将Na2SO3在隔绝空气并经600℃以上的强热至恒重,然后对加热后的固体进行元素定性定量分析,确定固体组成与Na2SO3无异;但加热后固体溶于水,得到的溶液的PH比Na2SO3溶液的PH高.
(2)强热后的物质是什么呢?同学们作如下探究
A分析猜想:Na2SO3在强热下发生了分解反应(自身氧化还原反应)
B该残留物可能的存在物质:
假设1:(请有心人回答)
假设2:(请有心人回答)
用高中常用物质鉴定假设1和假设2(请有心人回答)
如果回答出假设1和假设2分别是什么即可以得到30分,鉴定会加分至60. windeyes61年前1
windeyes61年前1 -
 昂麻 共回答了26个问题
昂麻 共回答了26个问题 |采纳率96.2%假设1生成了Na2SO4和Na2S
假设2生成了NaOH 和SO2
验证假设1
设Na2SO3完全转化为Na2SO4和Na2S,需分别检出SO42-离子和S2-离子.
SO42-离子的检出:SO42-+Ba2+=BaSO4 ↓ 不溶于盐酸
S2-离子的检出:方法1:加沉淀剂如:S2-+Pb2+=PbS↓ (黑) (或醋酸铅 结果试纸变黑)
方法2:加盐酸S2-+2H+=H2S↓(可闻到硫化氢特殊气味)
检验假设2
设Na2SO3转化为NaOH 和SO2 SO2已经气态消失 ,所以只需要加入NH4+的东西 如NH4Cl
在试管口放湿润的红色石蕊试纸 发现变蓝色 则 该假设成立1年前查看全部
- 物理中的融化和凝固以下是练习册中出现的几道比较苦恼的题 可能 1、铝的熔点是600℃,那么温度为660℃的铝的状态是()
物理中的融化和凝固
以下是练习册中出现的几道比较苦恼的题 可能 1、铝的熔点是600℃,那么温度为660℃的铝的状态是() A.液态 B.固态 C.固液共存 D.以上三种情况都有 我认为:A;练习册正解:D 2、午饭后,小明和小玲到商店,小明买了根冰棍,小玲买了根棒棒糖,当他们把冰棍和棒棒糖放进嘴里后,都慢慢消失了.下列对这一变化描述正确的是() A.冰棍溶解了,把棒棒糖熔化了 B.冰棍熔化了,棒棒糖溶解了 C.冰棍棒棒糖都熔化了 D.冰棍和棒棒糖都熔解了 我认为:题目中出现了错别字.我只知道溶解和熔化 B 请各位高手如果知道如何解题的请解释清楚. rian1841年前1
rian1841年前1 -
 bmifdo3 共回答了24个问题
bmifdo3 共回答了24个问题 |采纳率91.7%1、铝的熔点是600℃,那么温度为660℃的铝的状态是() A.液态 B.固态 C.固液共存D.以上三种情况都有 晶体的温度刚好为熔点时,可以是刚达到熔点,此时刚要开始熔化,所以还是固体,熔化过程温度保持在熔点值,此时未完全熔化所以是固液共存,最后熔化刚结束,温度还在熔点,此时是固体 2、午饭后,小明和小玲到商店,小明买了根冰棍,小玲买了根棒棒糖,当他们把冰棍和棒棒糖放进嘴里后,都慢慢消失了.下列对这一变化描述正确的是() A.冰棍溶解了,把棒棒糖熔化了 B.冰棍熔化了,棒棒糖溶解了 C.冰棍棒棒糖都熔化了 D.冰棍和棒棒糖都熔解了 溶解是一个化学变化,溶解指的是一种液体对于固体/液体/或气体产生化学反应使其成为分子状态的均匀相的过程称为溶解.一种物质(溶质)分散于另一种物质(溶剂)中成为溶液的过程.如食盐或蔗糖溶解于水而成水溶液.简单点说棒棒糖是和空气中的水分溶成糖水,而冰棍是固态的糖水变成液态的,所以是熔化1年前查看全部
- 《新科学家》网站报道,科学家通过电解Fe 2 O 3 、SiO 2 、CaO的熔融液(1 600℃)制得了铁,
《新科学家》网站报道,科学家通过电解Fe 2 O 3 、SiO 2 、CaO的熔融液(1 600℃)制得了铁,按照树状分类法对熔融液中的三种物质进行分类,其中正确的是( ) A.均属于混合物 B.均属于金属氧化物 C.均属于纯净物 D.均属于非金属氧化物  涵江心1年前1
涵江心1年前1 -
 koalo 共回答了15个问题
koalo 共回答了15个问题 |采纳率86.7%根据概念和树状分类法,Fe 2 O 3 、SiO 2 、CaO三种物质是纯净物中的氧化物,有金属氧化物,也有非金属氧化物,但不是混合物;
故选C.1年前查看全部
- 将11.7克NaCl与10克浓度为98%的硫酸反应,微热时生成多少克HCl?继续加热到600℃,又生成多少克HCl?
将11.7克NaCl与10克浓度为98%的硫酸反应,微热时生成多少克HCl?继续加热到600℃,又生成多少克HCl?
看图片

 king07461年前1
king07461年前1 -
 孙悟空地金箍棒 共回答了12个问题
孙悟空地金箍棒 共回答了12个问题 |采纳率66.7%氯化钠与浓硫酸微热时反应生成硫酸氢钠与氯化氢,加热至高温时生成硫酸钠与氯化氢,分别利用方程式再根据不足量物质计算即可.1年前查看全部
- 请提供一种耐高温 耐腐蚀的材料要求耐温600℃以上,能够长期接触硫酸、盐酸、氢氟酸等强酸
 caihui02201年前1
caihui02201年前1 -
 jaklet3 共回答了13个问题
jaklet3 共回答了13个问题 |采纳率76.9%石墨材质.1年前查看全部
- (2011•茂名二模)化学兴趣小组的同学将Na2SO3在隔绝空气并经600℃以上的强热至恒重,然后对加热后固体进行元素定
(2011•茂名二模)化学兴趣小组的同学将Na2SO3在隔绝空气并经600℃以上的强热至恒重,然后对加热后固体进行元素定性定量分析,确定固体组成与Na2SO3无异;但把加热后固体溶于水,得到的溶液pH值比Na2SO3溶液的pH高.
(1)Na2SO3溶液呈______性(填“酸”或“碱”),其原理是(以相关的离子方程式表示)______.
(2)强热后的物质是什么呢?同学作如下探究
①分析猜想:Na2SO3在强热下发生了分解反应(自身氧化还原反应)
②该残留物可能的存在物质:
假设1:______;
假设2:______.
③设计实验方案证明你的假设,请按下表格式完成相关内容.(限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、试管夹;6mol•L-1 HCl、0.1mol•L-1BaCl2、0.1mol•L-1KCl、蒸馏水)
实验步骤 预期现象和结论 步骤1:取少量固体分别于试管中,加入一定量的蒸馏水溶解 固体全部溶解 步骤2: 步骤3  tiankon4562171年前1
tiankon4562171年前1 -
 jyj0123 共回答了22个问题
jyj0123 共回答了22个问题 |采纳率81.8%解题思路:(1)Na2SO3为强碱弱酸盐,SO32-水解呈碱性;
(2)Na2SO3在强热下发生了自身氧化还原反应,化合价升高可生成Na2SO4,说明化合价降低生成可能生成S或Na2S,产物全部溶于水,得到的溶液pH值比Na2SO3溶液的pH高,说明生成Na2S,根据Na2SO3、Na2SO4、Na2S的性质进行检验.(1)Na2SO3为强碱弱酸盐,SO32-水解呈碱性,水解的离子方程式为SO32-+H2O
 HSO3-+OH-,
HSO3-+OH-,
故答案为:碱;SO32-+H2O HSO3-+OH-;
HSO3-+OH-;
(2)②Na2SO3在强热下发生了自身氧化还原反应,化合价升高可生成Na2SO4,说明化合价降低生成可能生成S或Na2S,产物全部溶于水,得到的溶液pH值比Na2SO3溶液的pH高,
说明生成Na2S,
则有两种可能:如全部发生分解反应,则生成Na2S 和Na2SO4;如部分发生分解反应,则有Na2S、Na2SO3 和Na2SO4存在,
故答案为:Na2S 和Na2SO4;Na2S、Na2SO3 和Na2SO4;
③如固体中含有Na2S和Na2SO3,在酸性条件下发生:SO32-+2S2-+6H+=3S↓+3H2O,则溶液变浑浊,如仅有特殊气味的气体放出,说明固体中含有Na2S,发生:S2-+2H+=H2S↑;
然后取反应后的澄清溶液滴加0.1 mol•L-1BaCl2溶液,若有白色沉淀生成,则说明固体中含有Na2SO4.否则假设1成立,
故答案为:
实验步骤 预期现象和结论
步骤2:往试管中,加入足量6 mol•L-1 HCl 若溶液变浑浊,则说明固体中含有Na2S和Na2SO3;若溶液没有变浑浊,而仅有特殊气味的气体放出,说明固体中
含有Na2S
步骤3:取步骤2中的澄清液于试管,然后往试管中加入少量0.1 mol•L-1BaCl2 若有白色沉淀生成,则说明固体中含有Na2SO4.结合步骤2,若溶液没有变浑浊,只有气体放出,则假设1成立;若溶液变浑浊,则假设2成立.点评:
本题考点: 含硫物质的性质及综合应用;盐类水解的应用.
考点点评: 本题考查含硫物质的性质及综合应用,题目难度中等,本题注意物质的组成判断的几个关键点①得到的溶液pH值比Na2SO3溶液的pH高;②固体全部溶解.1年前查看全部
- 哪种金属高温不容易变形起码500 600℃
 淡雾听竹1年前1
淡雾听竹1年前1 -
 galy43517 共回答了21个问题
galy43517 共回答了21个问题 |采纳率95.2%单元素金属钨,钼等
还有一些合金金属,比如说镍基合金,钛合金等,不过好像价钱比较高啊.
主要还是看你有什么用途了!1年前查看全部
- 已知铅的比热容为0.13×103J/(kg•℃),质量为100g的铅温度由600℃降低100℃,可放出______焦耳的
已知铅的比热容为0.13×103J/(kg•℃),质量为100g的铅温度由600℃降低100℃,可放出______焦耳的热量.这些热量能使200g的铜温度从20℃升高到______℃.铜的比热容为0.39×103J/(kg•℃)
 alobort1年前0
alobort1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成
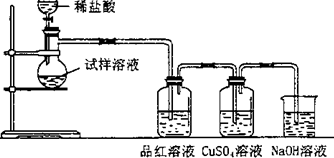 无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入稀盐酸,根据实验现象判断固体试样含有什么成分?(已知:Na2 S+2HCl═2NaCl+H2S+SO2+2H2S═3S+2H2 O)
无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入稀盐酸,根据实验现象判断固体试样含有什么成分?(已知:Na2 S+2HCl═2NaCl+H2S+SO2+2H2S═3S+2H2 O)
(1)无水亚硫酸钠受热分解的化学方程式是______,装置中的NaOH溶液的作用是______.
(2)如果加热温度在600℃以上,再向所得固体的试样溶液中缓缓滴加稀盐酸至足量,观察到CuSO4溶液中出现黑色沉淀,试分析其他装置中可能出现的现象.试样溶液:______,解释这种现象的离子方程式是______;品红溶液:______,出现这种现象的原因是:______.
(3)若加入了足量的稀盐酸后,品红溶液和CuSO4溶液中仍无明显的现象发生,原因是______. cubumayi1年前1
cubumayi1年前1 -
 shenmeheshenme 共回答了20个问题
shenmeheshenme 共回答了20个问题 |采纳率90%解题思路:(1)根据题示信息可推出分解产物是Na2SO4;无水亚硫酸钠受热分解会产生SO2、H2S等气体;
(2)SO32-、S2-可在酸性条件下转化为单质硫;品红溶液不裉色;根据SO32-+2S2-+6H+=3S↓+3H2O解题;
(3)品红溶液和硫酸铜溶液中都没有明显现象,说明在烧瓶中没有放出SO2,也没有放出H2S.(1)亚硫酸钠在600℃以上可分解,这在中学化学中未介绍,但根据题示信息可推出分解产物.根据“Na2SO3分解生成Na2S+另一种固体”,可从硫元素化合价变化进行推理分析,另一种固体中硫元素的化合价应高于+4价,所以这种固体是Na2SO4,解的化学方程式是4Na2SO3=Na2S+3Na2SO4;从中可得出,装置中会产生SO2、H2S等气体,考虑到这些气体都不能直接排放到空气中,所以氢氧化钠溶液的作用是吸收SO2或H2S,故答案为:4Na2SO3=Na2S+3Na2SO4;吸收H2S或SO2气体;
(2)温度高于600℃时,Na2SO3开始分解,所得固体可能是Na2SO3、Na2S等的混合物.滴入稀盐酸时,SO32-、S2-可在酸性条件下转化为单质硫.根据“硫酸铜中出现黑色沉淀”可得出,烧瓶中没有SO2放出.所以试样溶液出现的现象是:有淡黄色沉淀生成并有气泡冒出.SO32-+2S2-+6H+=3S↓+3H2O,S2-+2H+=H2S↑.品红溶液不裉色;因为加热后的固体试样中所含亚硫酸钠和硫化钠的物质的量之比小于1:2,在酸性溶液中反应,Na2S过量,产生气体只含H2S,不含SO2,故答案为:有淡黄色沉淀生成,并有气泡冒出;SO32-+2S2-+6H+=3S↓+3H2O,S2-+2H+=H2S↑;有气泡生成但不褪色;加热后固体中所含的Na2SO3和Na2S的物质的量之比小于1:2,在酸性溶液中反应产生的气体只含H2S,而不含SO2;
(3)品红溶液和硫酸铜溶液中都没有明显现象,说明在烧瓶中没有放出SO2,也没有放出H2S,进而可推出,加热后的固体试样中所含亚硫酸钠和硫化钠的物质的量之比恰好等于1:2,在酸性溶液中两者恰好完全反应,不产生H2S和SO2,
故答案为:加热后固体中所含Na2SO3和Na2S的物质的量之比等于1:2,在酸性溶液中恰好生成S,不产生H2S和SO2.点评:
本题考点: 性质实验方案的设计.
考点点评: 本题考查定性与定量实验,难度较大,注意实验现象的分析推测、实验结果的研究处理等都会涉及到定量问题,同一实验在不同条件下可能会产生不同的结果.1年前查看全部
- 将11.7g 氯化钠跟15g 98% 的浓硫酸反应,微热时生成多少克氯化氢?继续加热到600℃时,又生成多少克的氯化氢?
 aa19821年前1
aa19821年前1 -
 我是nn 共回答了12个问题
我是nn 共回答了12个问题 |采纳率83.3%在里面,仔细看一下.
新春快乐!1年前查看全部
- 求一句科技英语的汉译英.由图可见,“在600℃时该材料的收缩率是850℃时的72%” 双引号中的部分应该怎么样翻译成准确
求一句科技英语的汉译英
.由图可见,“在600℃时该材料的收缩率是850℃时的72%” 双引号中的部分应该怎么样翻译成准确的科技英语?
背景是一个材料在烧结过程中发生收缩,当850℃时达到最大收缩值,此时材料的收缩率为A%,这句想表达的意思就是升温到600℃时材料已经收缩到了最大收缩值的72%,也就是收缩率是(72*A)%
求各路高手指点. WindChild1年前3
WindChild1年前3 -
 62962423 共回答了20个问题
62962423 共回答了20个问题 |采纳率90%在600℃时该材料的收缩率是850℃时的72% .
The shrinkage of this material is 72% when under the temperature 600 ℃ as much as that when under the temperature 850 ℃.1年前查看全部
- 水星表面温度是—173℃,白天的温度比夜间的温度高600℃,则水星表面拜托的温度是?
 hen9901231年前1
hen9901231年前1 -
 浪漫cc888 共回答了14个问题
浪漫cc888 共回答了14个问题 |采纳率85.7%427度1年前查看全部
- 2.在600℃下用碳还原FeO制取铁,求反应体系中允许的最大压力.
2.在600℃下用碳还原FeO制取铁,求反应体系中允许的最大压力.
已知FeO(s)=Fe(s)+1/2O2(g)
C(s)+O2(g)=CO2(g)
2C(s)+O2(g)=2CO(g) welcomebetter1年前1
welcomebetter1年前1 -
 风之酷 共回答了16个问题
风之酷 共回答了16个问题 |采纳率100%无解,这个涉及了实际应用了,不只是化学方面的,这个是物理方面的问题了1年前查看全部
- 将浓硫酸,氯化钠,二氧化锰混合物缓慢加热到600℃以上,把制得的氯气全部通入足量
将浓硫酸,氯化钠,二氧化锰混合物缓慢加热到600℃以上,把制得的氯气全部通入足量
将浓硫酸,氯化钠,二氧化锰混合物缓慢加热到600℃以上,把制得的氯气全部通入足量KI溶液中,能置换出含杂质3%的碘6.35克.若食盐的纯度为958%,那么参加反应的食言有多少克?
=出了点小问题。食盐纯度是95%。我们班有算出来是2.99也有貌似是3.79的。 39166011年前3
39166011年前3 -
 迷茫的眼睛 共回答了18个问题
迷茫的眼睛 共回答了18个问题 |采纳率94.4%利用得失电子守恒
2NaCl-------I2
117 254
x*95% 6.35g*97%
117:254=x*95%:(6.35g*97%) x=2.99g1年前查看全部
- 一道化学题. 4NH3 +5O2 →4NO+6H2O,500升NH3,600℃,10atm.求NH3的n
一道化学题. 4NH3 +5O2 →4NO+6H2O,500升NH3,600℃,10atm.求NH3的n
用公式PV=nRT→n=(PV/RT)=(10*500)/(0.082*873)
问一下,R为什么不是用8.31(Pa・m^ 3/mol・K)?T不是273.1吗,为什么这里是873? 马德里1年前2
马德里1年前2 -
 hulala9846 共回答了21个问题
hulala9846 共回答了21个问题 |采纳率90.5%气体常数在单位不同时取值有两个
国际单位制时,即P的单位是千帕,V的单位立方米,T的单位开尔文,n的单位摩尔,R=8.314帕米^3/摩尔·K
常用单位制时,即P的单位是大气压,V的单位升,T的单位开尔文,n的单位摩尔,R=0.0821大气压 升/摩尔·K
这里的单位是L(升)所以用的是常用单位制的那个.
T的单位是开尔文(即K),如果用摄氏度转换的话需要加上273.1,这里把后面的0,1给忽略了,但是做题时还是不要去掉,保持题目的完整性.1年前查看全部
- 额,化学问题在线等.1 600℃时,反应CO(g)+ O2(g) 可逆号 CO2(g)的平衡常数K=1×104.经测定,
额,化学问题在线等.
1 600℃时,反应CO(g)+ O2(g) 可逆号 CO2(g)的平衡常数K=1×104.经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L.若在汽车的排气管上增加一个1 600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L.则CO的补燃转化率为 玉辣椒1年前1
玉辣椒1年前1 -
 冷锦颦 共回答了21个问题
冷锦颦 共回答了21个问题 |采纳率95.2%t提示1、温度都是1600度,所以平衡常数不变设CO转化浓度x--------------------------CO(g)+----------- O2(g) CO2(g)起始cmol/L--------4.0×10-5mol/L------4.0×10-4mol/L------------4.0×10-4mol/L转化c----...1年前查看全部
大家在问
- 1(2003•济南)四大文明发源地不在亚洲的是( )
- 2如图,在△ABC中,∠BAC=90°,AB=AC,点D是BC的中点,DE⊥AB,DF⊥AC垂足分别为E,F.求证:四边形
- 3请修改以下一段话--指出错误并改正(一)
- 4(2005•宜昌)禁止青少年吸烟的原因是( )
- 5下列关于细胞结构的说法中,正确的是( )
- 6中心法则内容是什么?
- 7fande中英文翻译,newfande这是什么意思啊?
- 8小明上初中后一直是一位品学兼优的学生,临近中考学习状态却出现了异常:学习劲头明显不足,成绩有所下降。小明的班主任想要勉励
- 9英语翻译1、我没有奢求过什么 只是想 和你在一起的时间 能多一点 再多一点 2、你的名字 我的姓氏 3、这是一个不能说的
- 10英语翻译The United States has deployed nuclear-powered carriers
- 11我的内心十分纠结,离寒假结束只有6天了,我寒假作业动都没动有三科的作业,我想赶完,但是,我又很想玩,总是会找各种理由,让
- 12一质量为10kg的物体从斜面的底端在平行于斜面的恒力作用下,由静止开始向上运动,4s后撤去外力
- 13凹镜与凹透镜有什么区别,凸镜与凸透镜呢
- 14一个MP4 英文翻译是a还是an
- 15文中画线句中了什么修辞?有何好处?
