脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
 一生漂浮2022-10-04 11:39:541条回答
一生漂浮2022-10-04 11:39:541条回答| 脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。 (1)硫化氢与FeCl 3 溶液反应生成单质硫,其离子方程式为_______________________________________。 (2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式(忽略氧的氧化还原)为 ___________________________________;该方法的优点是____________________________________。 (3)一定温度下,1 mol NH 4 HS固体在定容真空容器中可部分分解为硫化氢和氨气。 ①当反应达平衡时p(NH 3 )×p(H 2 S) = a(Pa 2 ),则容器中的总压为_____________Pa; |
 |
| ②如图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。 |

已提交,审核后显示!提交回复
共1条回复
相关推荐
- 为什么合成氨原料气中的二氧化碳必须脱除
 cloudybird1年前1
cloudybird1年前1 -
 orookie 共回答了19个问题
orookie 共回答了19个问题 |采纳率89.5%粗原料气经CO变换以后,变换气中除H2外,还有CO2、CO和CH4等组分,其中以CO2含量最多。CO2既是氨合成催化剂的毒物,又是制造尿素、碳酸氢铵等氮肥的重要原料。因此变换气中CO2的脱除必须兼顾这两方面的要求。
一般采用溶液吸收法脱除CO2。根据吸收剂性能的不同,可分为两大类。一类是物理吸收法,如低温甲醇洗法(Rectisol),聚乙二醇二甲醚法(Selexol),碳酸丙烯酯法。一类...1年前查看全部
- (2012•北京)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
 (2012•北京)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(2012•北京)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是______.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:______.n(SO32-):n(HSO3-) 91:9 1:1 9:91 pH 8.2 7.2 6.2
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):______.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:
①HSO3-在阳极放电的电极反应式是______.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:______. w5155151年前1
w5155151年前1 -
 两颗星JW 共回答了12个问题
两颗星JW 共回答了12个问题 |采纳率91.7%解题思路:(1)根据SO2和先水反应生成H2SO3,然后H2SO3不稳定能被空气中的氧气氧化生成H2SO4;
(2)根据酸性氧化物和碱反应生成盐和水,注意弱电解质写化学式;
(3)①根据溶液中HSO3-浓度和SO32-浓度的相对大小确定溶液的酸碱性;
②根据溶液中电荷守恒和物料守恒确定溶液中各种离子浓度的关系;
(4)①阳极上阴离子放电发生氧化反应;
②阴极上氢离子得电子发生还原反应,同时生成亚硫酸根离子,溶液中钠离子向阴极移动,导致生成吸收液;(1)SO2和先水反应生成H2SO3,反应方程式为:SO2+H2O⇌H2SO3;H2SO3不稳定能被空气中的氧气氧化生成H2SO4,反应方程式为2H2SO3+O2=2H2SO4;
故答案为:SO2+H2O⇌H2SO3;2H2SO3+O2=2H2SO4.
(2)SO2和氢氧化钠反应生成亚硫酸钠和水,反应方程式为:2OH-+SO2=SO32-+H2O;
故答案为:2OH-+SO2=SO32-+H2O.
(3)①在溶液中主要以HSO3-存在,HSO3-的电离很微弱,所以n(SO32-):n(HSO3-)<1:1,根据表格知,当亚硫酸氢根离子的物质的量大于亚硫酸根离子的物质的量时,亚硫酸氢钠溶液呈酸性;亚硫酸氢根离子既能水解又能电离,亚硫酸氢钠溶液呈酸性同时说明HSO3-的电离程度大于水解程度.
故答案为:酸;HSO3-存在HSO3-⇌H++SO32-和HSO3-+H2O⇌H2SO3+OH-,HSO3-的电离程度大于水解程度.
②当溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度.
a、溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,所以c(Na+)=2c(SO32-)+c(HSO3-),故a正确.
b、溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故b正确.
c、溶液呈电中性,溶液中阴阳离子所带电荷相等,得c(Na+)+c(H-)=2c(SO32-)+c(HSO3-)+c(OH-),故c错误.
故选:ab.
(4)①当吸收液的pH降至约为6时,吸收液中阴离子主要是亚硫酸氢根离子,亚硫酸氢根离子在阳极上失电子和水反应生成硫酸根离子和氢离子,电极反应式为:HSO3-+H2O-2e-=SO42-+3H+.
故答案为:HSO3-+H2O-2e-=SO42-+3H+.
②电解时,溶液中阳离子向阴极移动,氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,导致加速HSO3-电离生成SO32-,钠离子进入阴极室,吸收液就可以再生.
故答案为:氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生;点评:
本题考点: 二氧化硫的污染及治理;电解原理;离子浓度大小的比较.
考点点评: 本题考查了污染物的处理,涉及到离子方程式、化学方程式和离子浓度大小的比较等知识点,难度不大,需要注意的是比较溶液中各种离子浓度相对大小时要结合电荷守恒和物料守恒分析解答.1年前查看全部
- 燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
 燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
(1)用化学方程式表示NO形成硝酸型酸雨的反应______.
(2)能作脱除剂的物质很多,下列说法正确的是______.
a.用 H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用 Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
(3)尿素[CO(NH2)2]在一定条件下能有效将NOx转化为N2.
Ⅰ.已知可通过下列方法合成尿素:
2NH3(g)+CO2(g)⇌H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)⇌CO(NH2)2(s)+H2O(l)△H=+28.5kJ/mol
①尿素释放出NH3的热化学方程式是______.
②写出有利于尿素释放NH3的条件并说明理由______.
Ⅱ.CO(NH2)2与某种烟气(主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
①曲线a 对应CO(NH2)2 与NO的物质的量比值是______.②曲线a、b、c中,800℃~900℃区间内发生主要反应的化学方程式是______.
③900℃~1200℃区间内脱除率下降,NO浓度明显上升.发生的主要反应是______.
④曲线a中,NO的起始浓度为6×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为______ mg/(m3•s). UFOsp1年前1
UFOsp1年前1 -
 无心恋栈1 共回答了18个问题
无心恋栈1 共回答了18个问题 |采纳率77.8%解题思路:(1)一氧化氮不稳定,易和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮;
(2)a.一氧化氮不易溶于,而二氧化氮易溶于水,反应生成NO;
b.亚硫酸钠不稳定,易被氧气氧化;
C.用CO作脱除剂,则氮氧化物得电子发生还原反应;
(3)Ⅰ. ①根据盖斯定律,将两个热化学方程式相加,然后进行颠倒即得目标方程式,其焓变进行相应改变;
②尿素释放NH3的反应是吸热反应,根据温度对化学平衡及氨气溶解度的影响进行分析;
Ⅱ.①CO(NH2)2 的含量越高,NO脱除率越高;
②、800℃~900℃区间内NO脱除率增大,NO参加反应,即尿素与NO反应生成N2;
③、900℃~1200℃区间内脱除率下降,NO浓度上升,反应中应该生成NO;
④、A点到BNO脱除率由0.55变为0.75,故NO的浓度变化量为(0.75-0.55)×6×10-4 mg/m3=1.2×10-4 mg/m3,再利用[浓度变化量/时间]计算NO的脱除速率.(1)一氧化氮不稳定,易和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,故NO形成硝酸型酸雨的反应为:2NO+O2═2NO2、3NO2+H2O═2HNO3+NO,故答案为:2NO+O2═2NO2、3NO2+H2O═2HNO3+NO;
(2)a.一氧化氮不易溶于,而二氧化氮易溶于水,反应生成NO,不利于吸收含氮烟气中的NO,故a正确;
b.亚硫酸钠不稳定,易被氧气氧化,O2会降低Na2SO3的利用率,故b正确;
C.用CO作脱除剂,被氧化,则氮氧化物得电子发生还原反应,不会生成NO2,烟气中NO2的浓度不增加,故c错误;
故答案为:ab;
(3)①已知:2NH3(g)+CO2(g)⇌H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)⇌CO(NH2)2(s)+H2O(l)△H=+28.5kJ/mol
根据盖斯定律,两热化学方程式相加得2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(l)△H=-131kJ/mol,
故尿素释放出NH3的热化学方程式为:CO(NH2)2(s)+H2O(l)⇌2NH3(g)+CO2(g)△H=+131kJ/mol,
故答案为:CO(NH2)2(s)+H2O(l)⇌2NH3(g)+CO2(g)△H=+131kJ/mol;
②释放氨气的反应是吸热反应,升高温度,有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行,
故答案为:升高温度;升高温度有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行;
Ⅱ.①CO(NH2)2 的含量越高,NO的转化率越大,即NO脱除率越高,所以曲线a 对应CO(NH2)2 与NO的物质的量比值是3:1,故答案为3:1;
②800℃~900℃区间内NO脱除率增大,所以NO是作为反应物参加反应,高温时,尿素分解生成氨气、二氧化碳,氨气和一氧化氮发生氧化还原反应生成氮气,即尿素与NO反应生成N2,同时生成二氧化碳和水,所以反应方程式为:4NH3+6NO═5N2+6H2O 或 2CO(NH2)2+6 NO═2CO2+4H2O+5N2,
故答案为:4NH3+6NO═5N2+6H2O 或 2CO(NH2)2+6 NO═2CO2+4H2O+5N2;
③900℃~1200℃区间内脱除率下降,所以NO浓度上升,则该反应中应该有NO,尿素分解生成的氨气和烟气中的氧气反应生成一氧化氮和水,导致NO浓度增大,所以反应方程式为:4NH3+5O2═4NO+6H2O,
故答案为:4NH3+5O2═4NO+6H2O;
④A点到BNO脱除率由0.55变为0.75,故NO的浓度变化量为(0.75-0.55)×6×10-4 mg/m3=1.2×10-4 mg/m3
所以NO的脱除速率=
1.2×10−4mg/m3
0.8s=1.5×10-4mg/(m3.s),
故答案为:1.5×10-4.点评:
本题考点: 化学平衡的计算;热化学方程式;化学平衡的调控作用;氮的氧化物的性质及其对环境的影响;常见的生活环境的污染及治理.
考点点评: 本题考查氮的化合物及其性质,注意尿素加热时会分解生成氨气,且尿素是有机氮肥,正确分析图象是解本题的关键,注意图象中的曲线趋向和转折点,题目难度中等.1年前查看全部
- 在等量的情况,用什么东西脱除二氧化碳最好,效率最高?
在等量的情况,用什么东西脱除二氧化碳最好,效率最高?
脱气体中的二氧化碳 prggeve91年前2
prggeve91年前2 -
 ansha2251 共回答了22个问题
ansha2251 共回答了22个问题 |采纳率90.9%工业上一般用两种,石灰乳和烧碱溶液,就是氢氧化钙和氢氧化钠,因为他们吸收二氧化碳的速率快、效率高、价格低、废物利用率高!
你说的等量是什么等量,质量还是物质的量,质量相等的时候,氢氧化钠溶液吸收的最快最多!等物质的量,氢氧化钾最好,但是贵!1年前查看全部
- 液化天然气净化处理,为什么要先脱除二氧化碳,酸性气体,再脱除水,重烃,
 aa决定不等了1年前1
aa决定不等了1年前1 -
 到底要怎么样啊 共回答了17个问题
到底要怎么样啊 共回答了17个问题 |采纳率94.1%提供您点资料,希望能帮到您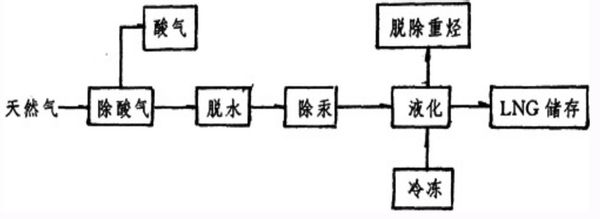
在天然气液化厂内将天然气进行净化,液化和储存.
液化冷冻工艺通常采用以乙烷,丙烷及混合冷冻剂作为循环介质的压缩循环冷冻法.
天然气运输可分为长输管线运输和LNG 运输两种.长输管线运输:将气田开采的天然气依次经过首站加压、分输站、压力站、清管站等输送至城市输配站,向消费地区供气.
LNG 运输:主要包括LNG 液化生产、LNG 液化运输和LNG接收和存储三个部分.
液化生产:天然气经过预处理后在液化天然气工厂进行液化,液化流程可分为级联式液化流程、混合制冷剂液化流程和带膨胀机的液化流程,液化装置有基本负荷型液化装置(大型液化装置)和调峰型液化装置(小流量液化装置).
液化运输:LNG 液化运输一般分为海运和公路运输两种,海运一般采用LNG 专用船,公路运输一般采用LNG 槽车等.
接收和存储:LNG 接收站是LNG 气源与用户管网的连接点,主要功能是LNG 的接收、再气化和输送.1年前查看全部
- (2014•杭州一模)铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下( )
 (2014•杭州一模)铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下( )
(2014•杭州一模)铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下( )
①Fe3O4(s)+3H2S(g)+H2(g)⇌3FeS(s)+4H2O(g)
②Fe2O3(s)+2H2S(g)+H2(g)⇌2FeS(s)+3H2O(g)
③FeO(s)+H2S(g)⇌FeS(s)+H2O(g)
温度与上述各反应的平衡常数的关系如图所示.下列有关说法正确的是( )
A.反应①、②、③中铁的氧化物都是氧化剂
B.反应①、②、③的正反应都是放热反应
C.反应①、②、③中,温度越高H2S的脱除率越高
D.反应①、②、③中,压强越大H2S脱除率越高 zhang861年前1
zhang861年前1 -
 关切 共回答了20个问题
关切 共回答了20个问题 |采纳率95%解题思路:A.根据化合价的变化判断,氧化剂中元素的化合价降低;
B.根据图象可知升温平衡常数都减小,平衡左移,则正反应都是放热反应;
C.升温平衡常数都减小,说明升温平衡左移H2S的脱除率降低;
D.这三个可逆反应中反应前后气体体积不变,压强不影响平衡移动.A.根据化合价判断,①、②中铁的氧化物都是氧化剂、③中各元素化合价均无变化,不是氧化剂,故A错误;
B.根据图象可知,反应①、②、③升温平衡常数都减小,说明升温平衡左移,则反应①、②、③正反应都是放热反应,故B正确;
C.反应①、②、③中升温平衡常数都减小,说明升温平衡左移H2S的脱除率降低,故C错误;
D.反应①、②、③中,反应前后气体体积不变,所以增大压强平衡不移动,只改变反应速率,所以H2S脱除率不变,故D错误;
故选B.点评:
本题考点: 氧化还原反应;化学平衡的影响因素.
考点点评: 本题考查了氧化还原反应、化学平衡的影响因素等,注意反应的特点、图象的正确分析,难度一般.1年前查看全部
- 直接排放含SO 2 的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO 2 .
直接排放含SO 2 的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO 2 .
(1)用化学方程式表示S形成硫酸酸雨的反应方程式______,______.
(2)在钠碱循环法中,Na 2 SO 3 溶液作为吸收液,可由NaOH溶液吸收SO 2 制得,该反应的离子方程式是______.
(3)吸收液吸收SO 2 的过程中,pH随n(SO 3 2- ),n(HSO 3 - )变化关系如下表:
①上表判断NaHSO 3 溶液显______性,用化学平衡原理解释:______.n(SO 3 2- ):n(HSO 3 - ) 91:9 1:1 1:91 pH 8.2 7.2 6.2
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):______.
a、c(Na + )=2c(SO 3 2- )+c(HSO 3 - )
b、c(Na + )>c(HSO 3 - )>c(SO 3 2- )>c(H - )=c(OH - )
c、c(Na + )+c(H - )=c(SO 3 2- )+c(HSO 3 - )+c(OH - )
(4)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如图:
①HSO 3 - 在阳极放电的电极反应式是______.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:______.
 hhy12141年前1
hhy12141年前1 -
 小妖飘飘301 共回答了14个问题
小妖飘飘301 共回答了14个问题 |采纳率78.6%(1)二氧化硫是酸性氧化物,和水反应生成亚硫酸,反应方程式为:SO 2 +H 2 O⇌H 2 SO 3 ;亚硫酸不稳定能被空气中的氧气氧化生成硫酸,反应方程式为2H 2 SO 3 +O 2 =2H 2 SO 4 .故答案为:SO 2 +H 2 O⇌H 2 SO...1年前查看全部
- (2014•福建模拟)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(2014•福建模拟)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是______.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①上表判断NaHSO3溶液显______性,n(SO32-):n(HSO3-) 99:1 1:1 1:99 pH 8.2 7.2 6.2
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):______
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如图:
①HSO3-在阳极放电的电极反应式是______.
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.简述再生原理:______. mm08241年前1
mm08241年前1 -
 coldMM 共回答了21个问题
coldMM 共回答了21个问题 |采纳率81%解题思路:(1)根据SO2和先水反应生成H2SO3,然后H2SO3不稳定能被空气中的氧气氧化生成H2SO4;
(2)根据酸性氧化物和碱反应生成盐和水,注意弱电解质写化学式;
(3)①根据溶液中HSO3-浓度和SO32-浓度的相对大小确定溶液的酸碱性;
②根据溶液中电荷守恒和物料守恒确定溶液中各种离子浓度的关系;
(4)①阳极上阴离子放电发生氧化反应;
②阴极上氢离子得电子发生还原反应,同时生成亚硫酸根离子,溶液中钠离子向阴极移动,导致生成吸收液;(1)SO2和先水反应生成H2SO3,反应方程式为:SO2+H2O⇌H2SO3;H2SO3不稳定能被空气中的氧气氧化生成H2SO4,反应方程式为2H2SO3+O2=2H2SO4;
故答案为:SO2+H2O⇌H2SO3;2H2SO3+O2=2H2SO4.
(2)SO2和氢氧化钠反应生成亚硫酸钠和水,反应方程式为:2OH-+SO2=SO32-+H2O;
故答案为:2OH-+SO2=SO32-+H2O.
(3)①在溶液中主要以HSO3-存在,HSO3-的电离很微弱,所以n(SO32-):n(HSO3-)<1:1,根据表格知,当亚硫酸氢根离子的物质的量大于亚硫酸根离子的物质的量时,亚硫酸氢钠溶液呈酸性;
故答案为:酸;
②当溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度.
a、溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,所以c(Na+)=2c(SO32-)+c(HSO3-),故a正确.
b、溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故b正确.
c、溶液呈电中性,溶液中阴阳离子所带电荷相等,得c(Na+)+c(H-)=2c(SO32-)+c(HSO3-)+c(OH-),故c错误.
故选:ab.
(4)①当吸收液的pH降至约为6时,吸收液中阴离子主要是亚硫酸氢根离子,亚硫酸氢根离子在阳极上失电子和水反应生成硫酸根离子和氢离子,电极反应式为:HSO3-+H2O-2e-=SO42-+3H+.
故答案为:HSO3-+H2O-2e-=SO42-+3H+.
②电解时,溶液中阳离子向阴极移动,氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,导致加速HSO3-电离生成SO32-,钠离子进入阴极室,吸收液就可以再生.
故答案为:阴极室H+放电,OH-浓度增大,当PH>8时溶液NaOH浓度较大,可有效吸收SO2循环使用.点评:
本题考点: 二氧化硫的污染及治理;原电池和电解池的工作原理;离子浓度大小的比较.
考点点评: 本题考查了污染物的处理,涉及到离子方程式、化学方程式和离子浓度大小的比较等知识点,难度不大,需要注意的是比较溶液中各种离子浓度相对大小时要结合电荷守恒和物料守恒分析解答.1年前查看全部
- 天然气怎么脱除氮气?天然气中含有氮气,含量在30%左右,但由于气量比较小,只有10万方/每天,使用低温法脱氮不经济,有没
天然气怎么脱除氮气?
天然气中含有氮气,含量在30%左右,但由于气量比较小,只有10万方/每天,使用低温法脱氮不经济,有没有更经济的脱氮方式? wujl7771年前1
wujl7771年前1 -
 WOSHIWXX 共回答了18个问题
WOSHIWXX 共回答了18个问题 |采纳率100%活性氧化铝球
活性氧化铝球是具有很多毛细管道的白色球状,有很多毛细孔通道,这些孔道的表面有较高的活性,能对气体,蒸汽,液体的水份具有选择吸附本能主要去除水中的氟离子效果非常好.1年前查看全部
- (2014•北京)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)
(2014•北京)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L FeCl2溶液,研究废液再生机理.记录如下(a,b,c代表电压值):
(1)用KSCN溶液检测处Fe3+的现象是______.序号 电压/V 阳极现象 检验阳极产物 Ⅰ x≥a 电极附近出现黄色,有气泡产生 有Fe3+、有Cl2 Ⅱ a>x≥b 电极附近出现黄色,无气泡产生 有Fe3+,无Cl2 Ⅲ b>x>0 无明显变化 无Fe3+,无Cl2
(2)Ⅰ中Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化,写出有关反应:______.
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有______性.
(4)Ⅱ中虽未检验处Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照试验,记录如下:
①NaCl溶液的浓度是______mol/L.序号 电压/V 阳极现象 检验阳极产物 Ⅳ a>x≥c 无明显变化 有Cl2 Ⅴ c>x≥b 无明显变化 无Cl2
②Ⅳ中检验Cl2的实验方法:______
③与Ⅱ对比,得出的结论(写出两点):______. sdmbf1年前1
sdmbf1年前1 -
 支离破碎YOO 共回答了18个问题
支离破碎YOO 共回答了18个问题 |采纳率94.4%解题思路:(1)依据铁离子的检验方法和试剂颜色变化分析;
(2)依据电解原理,氯离子在阳极失电子生成氯气,氯气具有氧化性氧化亚铁离子生成铁离子溶液变黄色;
(3)Fe3+产生的原因还可能是Fe2+在阳极放电,依据氧化还原反应分析Fe2+具有还原性;
(4)①电解pH=1的0.1mol/L FeCl2溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难度相同的条件下进行分析判断;
②依据检验氯气的实验方法分析;
③依据图表数据比较可知,电解pH=1的NaCl溶液做对照试验与Ⅱ对比,通过控制电压证明了亚铁离子还原性大于氯离子优先放电,生成铁离子的两种可能.(1)检验铁离子的试剂是硫氰酸钾溶液,用KSCN溶液检测处Fe3+的现象是溶液变红色,故答案为:溶液变红;
(2)依据电解原理,氯离子在阳极失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑,氯气具有氧化性氧化亚铁离子生成铁离子溶液变黄色,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-;
故答案为:2Cl--2e-=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl-;
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,元素化合价升高,依据氧化还原反应分析Fe2+具有还原性,故答案为:还原性;
(4)①电解pH=1的0.1mol/L FeCl2溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难度相同的条件下进行,所以氯化钠溶液的浓度为0.2mol/L,故答案为:0.2;
②依据检验氯气的实验方法分析,取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色证明生成氯气,否则无氯气生成,
故答案为:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色;
③依据图表数据比较可知,电解pH=1的NaCl溶液做对照试验与Ⅱ对比,通过控制电压证明了亚铁离子还原性大于氯离子优先放电,说明生成铁离子的两种可能,一是二价铁失电子变成三价铁,二是氯离子失电子变成氯气,氯气再氧化二价铁变成三价铁.对于补充的那个实验,实验四的电压高,氯气放电,实验五电压低,氯气不放电,而实验二氯气皆放电;
故答案为:通过控制电压,证实了产生Fe3+的两种原因,通过控制电压,验证了Fe3+先于Cl-放电.点评:
本题考点: 电解原理;二价Fe离子和三价Fe离子的检验.
考点点评: 本题考查了离子检验方法和现象分析,电解原理的分析应用,电解反应,电极产物的理解应用,掌握基础是关键,题目难度中等.1年前查看全部
- 直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2,
直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2,
(1)硫原子电子排布式为______.
(2)在钠碱循环法中,常用Na2SO3溶液作为吸收液,写出SO2被Na2SO3溶液吸收的离子方程式是______.
(3)当Na2SO3吸收SO2至溶液呈中性时,溶液中所有离子浓度从大到小排列顺序是(已知:当c(SO32-)=c(HSO3-)时,溶液的pH=7.2)______.
(4)工业上也可利用原电池原理,用SO2和O2来制备H2SO4,该原电池中负极反应式为______. elon5201年前1
elon5201年前1 -
 tinggy4 共回答了19个问题
tinggy4 共回答了19个问题 |采纳率78.9%解题思路:(1)S的原子序数为16,结合电子排布规律解答;
(2)SO2被Na2SO3溶液吸收生成亚硫酸氢钠;
(3)呈中性时,由c(SO32-)=c(HSO3-)时,溶液的pH=7.2,则c(HSO3-)>c(SO32-);
(4)利用原电池原理,用SO2和O2来制备H2SO4,二氧化硫在负极失去电子.(1)S的原子序数为16,则电子排布式为1s22s22p63s23p4或[Ne]3s23p4,故答案为:1s22s22p63s23p4或[Ne]3s23p4;
(2)SO2被Na2SO3溶液吸收生成亚硫酸氢钠,离子反应为SO32-+SO2+H2O=2HSO3-,故答案为:SO32-+SO2+H2O=2HSO3-.
(3)呈中性时,由c(SO32-)=c(HSO3-)时,溶液的pH=7.2,则c(HSO3-)>c(SO32-),则离子浓度大小为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-);
(4)利用原电池原理,用SO2和O2来制备H2SO4,二氧化硫在负极失去电子,负极反应为SO2-2e-+2H2O=SO42-+4H+,故答案为:SO2-2e-+2H2O=SO42-+4H+.点评:
本题考点: 离子浓度大小的比较;原电池和电解池的工作原理;二氧化硫的污染及治理.
考点点评: 本题考查较综合,涉及电子排布式、离子反应、离子浓度大小的比较、原电池,注重高考常考考点的考查,(3)为解答的难点,把握电离大于水解即可,题目难度中等.1年前查看全部
- (2013•朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
 (2013•朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
(2013•朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
(1)用化学方程式表示NO形成硝酸型酸雨的反应______
(2)能作脱除剂的物质很多,下列说法正确的是______
a.用 H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用 Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
(3)尿素[CO(NH2)2]在一定条件下能有效将NOx转化为N2.
Ⅰ.已知可通过下列方法合成尿素:
2NH3(g)+CO2(g)⇌H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)⇌CO(NH2)2(s)+H2O(l)△H=+28.5kJ/mol
①尿素释放出NH3的热化学方程式是______
②写出有利于尿素释放NH3的条件并说明理由______
Ⅱ.CO(NH2)2与某种烟气(主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
①曲线a 对应CO(NH2)2 与NO的物质的量比值是______.
②曲线a、b、c中,800℃~900℃区间内发生主要反应的化学方程式是______.
③900℃~1200℃区间内脱除率下降,NO浓度上升.发生的主要反应是______.
④曲线a中,NO的起始浓度为6×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为______ mg/(m3•s). 简单的爱你XQ1年前1
简单的爱你XQ1年前1 -
 哭泣羽 共回答了15个问题
哭泣羽 共回答了15个问题 |采纳率100%解题思路:(1)一氧化氮不稳定,易和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮;
(2)a.一氧化氮不易溶于,而二氧化氮易溶于水,反应生成NO;
b.亚硫酸钠不稳定,易被氧气氧化;
C.用CO作脱除剂,则氮氧化物得电子发生还原反应;
(3)Ⅰ. ①根据盖斯定律,将两个热化学方程式相加,然后进行颠倒即得目标方程式,其焓变进行相应改变;
②尿素释放NH3的反应是吸热反应,根据温度对化学平衡及氨气溶解度的影响进行分析;
Ⅱ.①CO(NH2)2 的含量越高,NO脱除率越高;
②、800℃~900℃区间内NO脱除率增大,NO参加反应,即尿素与NO反应生成N2;
③、900℃~1200℃区间内脱除率下降,NO浓度上升,反应中应该生成NO;
④、A点到BNO脱除率由0.55变为0.75,故NO的浓度变化量为(0.75-0.55)×6×10-4 mg/m3=1.2×10-4 mg/m3,再利用
[浓度变化量/时间]计算NO的脱除速率.(1)一氧化氮不稳定,易和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,故NO形成硝酸型酸雨的反应为:2NO+O2═2NO2、3NO2+H2O═2HNO3+NO,故答案为:2NO+O2═2NO2、3NO2+H2O═2HNO3+NO;
(2)a.一氧化氮不易溶于,而二氧化氮易溶于水,反应生成NO,不利于吸收含氮烟气中的NO,故a正确;
b.亚硫酸钠不稳定,易被氧气氧化,O2会降低Na2SO3的利用率,故b正确;
C.用CO作脱除剂,被氧化,则氮氧化物得电子发生还原反应,不会生成NO2,烟气中NO2的浓度不增加,故c错误;
故答案为:ab;
(3)①已知:2NH3(g)+CO2(g)⇌H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)⇌CO(NH2)2(s)+H2O(l)△H=+28.5kJ/mol
根据盖斯定律,两热化学方程式相加得2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(l)△H=-131kJ/mol,
故尿素释放出NH3的热化学方程式为:CO(NH2)2(s)+H2O(l)⇌2NH3(g)+CO2(g)△H=+131kJ/mol,
故答案为:CO(NH2)2(s)+H2O(l)⇌2NH3(g)+CO2(g)△H=+131kJ/mol;
②释放氨气的反应是吸热反应,升高温度,有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行,
故答案为:升高温度;升高温度有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行;
Ⅱ.①CO(NH2)2 的含量越高,NO的转化率越大,即NO脱除率越高,所以曲线a 对应CO(NH2)2 与NO的物质的量比值是3:1,故答案为3:1;
②800℃~900℃区间内NO脱除率增大,所以NO是作为反应物参加反应,高温时,尿素分解生成氨气、二氧化碳,氨气和一氧化氮发生氧化还原反应生成氮气,即尿素与NO反应生成N2,同时生成二氧化碳和水,所以反应方程式为:4NH3+6NO═5N2+6H2O 或 2CO(NH2)2+6 NO═2CO2+4H2O+5N2,
故答案为:4NH3+6NO═5N2+6H2O 或 2CO(NH2)2+6 NO═2CO2+4H2O+5N2;
③900℃~1200℃区间内脱除率下降,所以NO浓度上升,则该反应中应该有NO,尿素分解生成的氨气和烟气中的氧气反应生成一氧化氮和水,导致NO浓度增大,所以反应方程式为:4NH3+5O2═4NO+6H2O,
故答案为:4NH3+5O2═4NO+6H2O;
④A点到BNO脱除率由0.55变为0.75,故NO的浓度变化量为(0.75-0.55)×6×10-4 mg/m3=1.2×10-4 mg/m3
所以NO的脱除速率=
1.2×10−4mg/m3
0.8s=1.5×10-4mg/(m3.s),
故答案为:1.5×10-4.点评:
本题考点: 氮的氧化物的性质及其对环境的影响;化学平衡的影响因素.
考点点评: 本题考查氮的化合物及其性质,注意尿素加热时会分解生成氨气,且尿素是有机氮肥,正确分析图象是解本题的关键,注意图象中的曲线趋向和转折点.1年前查看全部
- 如何减少二氧化碳的排放,特别是用什么方法,脱除烟气中的二氧化碳?
 破车依微克1年前1
破车依微克1年前1 -
 骄傲满屋 共回答了19个问题
骄傲满屋 共回答了19个问题 |采纳率89.5%使用清洁能源,像太阳能、风能等等
用氨水脱除烟气中CO21年前查看全部
- 含结晶水的硫酸钠和碳酸钠各自脱除结晶水的温度为多少
 wuyy021年前1
wuyy021年前1 -
 yahooaaa 共回答了14个问题
yahooaaa 共回答了14个问题 |采纳率85.7%硫酸钠含十个结晶水,110左右失结晶水.碳酸钠含10个结晶水的在33度开始风化,含1个结晶水的109度失结晶水.1年前查看全部
大家在问
- 1与愚公移山相近的成语有什么?意思是什么?
- 2小学五年级数学竞赛试题?帮助出几题
- 3GBC Avanta 系列原子吸收 3000
- 4下列关于控制废电池危害的根本措施的叙述,正确的一项是( )
- 5在一幅比例尺是1/2500000的地图上,量得甲到乙的距离是16厘米.一辆车从甲开往乙,平均每小时行80千米,至
- 6我想知道一个圆柱体产品的表面积计算方法
- 7如图,以△ABC的每一条边为边作三个正三角形△ABD、△BCE和△ACF.已知这三个正三角形构成的图形中,甲、乙阴影部分
- 8如图,点B为AC上一点,分别以AB,BC为边在AC的同侧作等边三角形ABD和三角形BCE点M,P,N,分别为AC,AD
- 9用“然”字组词再填空表示恭敬的样子( )表示高大的样子( )表示光明正大的样子( )表示正大刚直的样子( )表示光影的样
- 10微积分问题,告诉我为什么啊,很简单的
- 11Hurry up !We have ___ time !
- 1217-(4/5+42×2/7)
- 13如何列竖式计算?
- 14—Do you mind if I invite Lily to join us?
- 15猪生九仔,连母十个样,说明生物具有()特征




