能溶于硝酸的化合物有哪些?
 mh_s_xu2022-10-04 11:39:541条回答
mh_s_xu2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 lx3212849 共回答了12个问题
lx3212849 共回答了12个问题 |采纳率91.7%- 一般金属性的物质都溶于酸,比如
NH4(铵)、K(钾)、Na(钠)、Ba(钡)、Ca(钙)、Mg(镁)、Al(铝)、Mn(锰)、Zn(锌)、Fe(铁)、Cu(铜)、Ag(汞)
这些金属都是溶于硝酸中的,与硝酸根分别结合所得到的就是盐
即:NH4NO3铵盐 KNO3钾盐 NaNO3钠盐 Ba(NO3)2钡盐 Ca(NO3)2钙盐 Mg(NO3)2镁盐 Al(NO3)2铝盐 Mn(NO3)2锰盐 Zn(NO3)2锌盐 Fe(NO3)3铁盐 Cu(NO3)2铜盐 Ag(NO3)2汞盐 - 1年前
相关推荐
- 高一化学中学的酸都有哪些?如题,除了盐酸 硫酸 硝酸 碳酸 硅酸 醋酸 还有哪些能把化学式写出来吗?形如H3XO4和HX
高一化学中学的酸都有哪些?
如题,除了盐酸 硫酸 硝酸 碳酸 硅酸 醋酸 还有哪些能把化学式写出来吗?形如H3XO4和HXO4的什么酸啊. d1503721年前3
d1503721年前3 -
 虫子521 共回答了25个问题
虫子521 共回答了25个问题 |采纳率100%卤族元素加H都是算
HF氢氟酸
HBr氢溴酸
HI氢碘酸
HClO4高氯酸(最强的酸)
H3PO4磷酸
HClO次氯酸
H2SO3亚硫酸
HNO2亚硝酸
还有有机的酸
草酸 苯酚1年前查看全部
- 将1.28g 铜粉全部溶解在硝酸中.假设产生气体不含N2O4,则参加反应的硝酸物质的量可能为?
将1.28g 铜粉全部溶解在硝酸中.假设产生气体不含N2O4,则参加反应的硝酸物质的量可能为?
05 老娘就是看不惯1年前4
老娘就是看不惯1年前4 -
 云风飘流 共回答了23个问题
云风飘流 共回答了23个问题 |采纳率87%首先n(cu)=0.02mol,反应生成cu(no3)2所需hno3为0.04mol
假设产生气体是no,由转移电子数守恒得n(no)*3=0.02*2 得n(no)=0.013mol,所需hno3为0.04+0.013=0.053mol
假设是no2,同理所需hno3是0.04+0.04(no2的物质的量)=0.08mol
所以介于0.053mol与0.08mol之间1年前查看全部
- 知道氮氧化物的量如何求算硝酸的量
 willing心愿1年前1
willing心愿1年前1 -
 fbywhy 共回答了17个问题
fbywhy 共回答了17个问题 |采纳率88.2%基本上就是根据氮原子守恒,分析氮原子的去向,或者是用化合价的升价相同来解决,具体问题具体分析.1年前查看全部
- 检验氯离子时为什么要加硝酸酸化的硝酸银?
 ansun3201年前5
ansun3201年前5 -
 wxiaozhi 共回答了16个问题
wxiaozhi 共回答了16个问题 |采纳率93.8%如果溶液中存在SO42-、CO32- 等离子时,它们也会与Ag+生成白色的沉淀,这将干扰AgCl沉淀的判断,但Ag2SO4、Ag2CO3等在硝酸中是可溶的,故加用硝酸酸化的硝酸银,可以排除其它离子的干扰.1年前查看全部
- 什么叫硝酸酸化RT.
 zuoxun1年前1
zuoxun1年前1 -
 lotus2003 共回答了22个问题
lotus2003 共回答了22个问题 |采纳率95.5%就是用硝酸来降低溶液的ph值.1年前查看全部
- 3.84克铜投入盛定量浓度HNO3中标准状况下收集到1.68L气体时铜恰全消耗写化学方程式求反应中耗硝酸物质量
3.84克铜投入盛定量浓度HNO3中标准状况下收集到1.68L气体时铜恰全消耗写化学方程式求反应中耗硝酸物质量
能具体点吗
方程式帮我写清楚点好吗
我会非常感谢 moonfetch1年前1
moonfetch1年前1 -
 hst168 共回答了19个问题
hst168 共回答了19个问题 |采纳率89.5%n(Cu)=0.06mol
n气体=0.075mol
所以反应就是8Cu+24HNO3=8Cu(NO3)2+3NO(气体)+5NO2(气体)+12H2O
消耗硝酸物质的量为0.18mol1年前查看全部
- 甲醇 乙醇 硝酸 硫酸 双氧水可以用来清洁什么
甲醇 乙醇 硝酸 硫酸 双氧水可以用来清洁什么
清洗什么物品 不把斋的和尚被封1年前2
不把斋的和尚被封1年前2 -
 vampire32167 共回答了17个问题
vampire32167 共回答了17个问题 |采纳率70.6%甲醇 乙醇清洗油污及其他有机物
硝酸洗可除去银镜、铜镜等物质
硫酸洗可除去金属、金属氧化物
双氧水可以除去带有还原性的物质,1年前查看全部
- S和N;O和CL非金属性哪个大就已S,N为例,如果N大的化,那么最高价水化物硝酸的酸性将比硫酸的大,但事实是这样吗?
 嗔恋1年前3
嗔恋1年前3 -
 djgh 共回答了21个问题
djgh 共回答了21个问题 |采纳率95.2%这么说不确切 而且实际酸性硝酸确实大于硫酸的一级电离(二级电离只有10%)
这个不准确说法的来源应该是
首先 最高价态氧化性越高 其最高价含氧酸酸性越强 而 有的时候 价态越高 氧化性越强
这两点被压缩误读成了你的说法
实质原因是 含氧酸也就是最高价水化物提供酸性的H都连氧上
氧化性越强吸引电子的能力越强 连在上面O对连在这个O上的氢原子束缚力就越小 也就是这个H越容易失去电子 也就是H越容易脱离 成为H+
也就是酸性强1年前查看全部
- 溶液的配制 500g/L硝酸溶液的配制方法
 尉迟于菟1年前1
尉迟于菟1年前1 -
 fenni5 共回答了18个问题
fenni5 共回答了18个问题 |采纳率94.4%如果要配制1升这种浓度的硝酸,那么首先要计算出所用浓硝酸的质量,我们常用的浓硝酸的质量分数为65%,那么所需要浓硝酸的质量是
500÷65%=769.23克
将769.23克65%的浓硝酸放入到容量瓶中,在搅拌的情况下,加水至一升即可.1年前查看全部
- (2012•许昌三模)将Fe和Cu的混合物17.6g完全溶解于足量的硝酸溶液中,收集反应产生的X气体.再向所得溶液中加入
(2012•许昌三模)将Fe和Cu的混合物17.6g完全溶解于足量的硝酸溶液中,收集反应产生的X气体.再向所得溶液中加入足量的NaOH溶液,产生31.2g沉淀.根据题意推断气体X的成分可能是( )
A.0.2 mol NO2和0.1mol N2O4
B.0.8molNO
C.0.3 mol NO2和0.3molNO
D.0.1molNO2、0.2mol NO和0.05molN2O4 weiwei515561年前1
weiwei515561年前1 -
 knv123 共回答了31个问题
knv123 共回答了31个问题 |采纳率100%解题思路:向Fe、Cu混合物与足量的硝酸反应所得溶液中加入足量的NaOH溶液,产生31.2g沉淀为氢氧化铜及铁的氢氧化物的质量,沉淀增重为氢氧根的质量,根据电荷守恒可知,金属提供的电子等于氢氧根的物质的量,结合选项根据电子转移守恒验证判断.向Fe、Cu混合物与足量的硝酸反应所得溶液中加入足量的NaOH溶液,产生31.2沉淀为氢氧化铜及铁的氢氧化物质量,沉淀增重为氢氧根的质量,所以沉淀中氢氧根的质量为31.2g-17.6g=13.6g,其物质的量为[13.6g/17g/mol]=0.8mol,根据电荷守恒可知,17.6g的Fe和Cu提供的电子为0.8mol,
A、生成0.2mo1NO2和0.1mo1N2O4,N元素获得电子为0.2mol×(5-4)+0.1mol×2×(5-4)=0.4mol,得失电子不相等,故A错误;
B、生成0.8molNO,N元素获得电子为0.8mol×(5-2)=2.4mol,得失电子不相等,故B错误;
C、生成0.3mo1NO2和0.3mo1NO,N元素获得电子为0.3mol×(5-4)+0.3mol×(5-2)=1.2mol,得失电子不相等,故C错误;
D、生成0.1molNO2、0.2mol NO和0.05molN2O4,N元素获得电子为0.1mol×(5-4)+0.2mol×(5-2)+0.05mol×2×(5-4)=0.8mol,得失电子相等,故D正确.
故选:D.点评:
本题考点: 化学方程式的有关计算;有关混合物反应的计算.
考点点评: 本题考查混合物的计算、氧化还原反应计算等,难度中等,计算金属提供的电子的物质的量是解题的关键,注意守恒思想的运用.1年前查看全部
- 已知常温下,硝酸浓度越稀,其还原产物的价态越低.(本题气体数据均已折算至标准状况)
已知常温下,硝酸浓度越稀,其还原产物的价态越低.(本题气体数据均已折算至标准状况)
(1)实验室欲用70%的浓硝酸(密度1.41g/mL)配制1.0mol/L的稀硝酸(密度1.04g/mL)500mL.求:70%浓硝酸的物质的量浓度______mol/L(保留1位小数,下同),配制时需浓硝酸______mL.
(2)将9.65克某铜锌合金加入到足量的浓硝酸中,得到气体 6.72L(假设不含N2O4),则该合金中铜与锌的物质的量之比为______.
(3)向100mL某浓度的硝酸溶液中加入足量的铁粉,铁粉部分溶解,却无气体产生.向反应后的溶液中加入过量的氢氧化钠溶液,过滤后对滤渣进行洗涤后灼烧得到固体物质4.8g,写出铁与硝酸反应的化学方程式______,该硝酸溶液的物质的量浓度______.
(4)将13克锌加入到200mL 3.6mol/L的硝酸溶液中,锌全部溶解,得到无色气体2.464L(已知常温下N2O3为液体),测得反应后的溶液pH=0(假设反应前后溶液体积无变化).取少量反应后的溶液加入足量的氢氧化钠溶液并加热,无刺激性气味的气体生成.试求该无色气体的组成及其物质的量. 扭曲的小圈儿1年前1
扭曲的小圈儿1年前1 -
 83648364 共回答了19个问题
83648364 共回答了19个问题 |采纳率84.2%解题思路:(1)根据c=[1000ρw/M]计算浓硝酸的浓度,根据稀释定律计算所需浓硝酸的体积;
(2)6.72LNO2的物质的量为0.3mol,设Cu为xmol,Zn为ymol,根据质量9.65g与生成NO2的物质的量0.3mol列式计算;
(3)铁粉部分溶解,说明生成Fe(NO3)2,却无气体产生说明即生成NH4NO3;
(4)由加入NaOH没有刺激性气体产生,得到没有生成NH3,则得到的无色气体为NO、N2,根据原子守恒和得失电子守恒计算物质的量.(1)浓硝酸的物质的量浓度c=[1000ρw/M]=[1000×1.41×70%/63]mol/L=15.7 mol/L,
由稀释定律可得:15.7 mol/L×V浓硝酸 =1.0mol/L×500mL,解得:V浓硝酸 =31.8ml,
故答案为:15.7;31.8;
(2)标准状况下,6.72LNO2的物质的量为[6.72L/22.4L/mol]=0.3mol,设Cu为xmol,Zn为ymol,则
①xmol×64g/mol+ymol×65g/mol=9.65g
②2xmol+2ymol=0.3mol,
①②联立解得:x=0.1,y=0.05,
因此该合金中铜与锌的物质的量之比为0.1mol:0.05mol=2:1,
故答案为:2:1;
(3)铁粉部分溶解,说明生成Fe(NO3)2,却无气体产生说明即生成NH4NO3,所以方程式为10HNO3+4Fe=4Fe(NO3)2+NH4NO3+3H2O,
再加NaOH,Fe(NO3)2都转化成Fe(OH)2,并进一步转化成Fe(OH)3,再灼烧,则生成Fe2O3为4.8g,Fe2O3的物质的量为[4.8g/160g/mol]=.03mol,
所以Fe为0.03mol×2=0.06mol,HNO3为0.06mol×[10/4]=0.15mol,因此该硝酸溶液的物质的量浓度为[0.15mol/0.1L]=1.5mol/L,
故答案为:10HNO3+4Fe=4Fe(NO3)2+NH4NO3+3H2O;1.5mol/L;
(4)13g锌的物质的量为[13g/65g/mol]=0.2mol,2.464L气体共[2.464L/22.4L/mol]=0.11mol,HNO3的物质的量为0.2L×3.6mol/L=0.72mol,测得反应后的溶液pH=0,则剩余H+的物质的量为1mol/L×0.2L=0.2mol,因此有0.72mol-0.2mol=0.52mol硝酸发生了反应,
由加入NaOH没有刺激性气体产生,得到没有生成NH3,NO2为红棕色气体,因此得到的无色气体为NO、N2;
化学方程式为20Zn+52HNO3=20Zn(NO3)2+26H2O+10NO(g)+N2(g),
因此无色气体为NO 0.1mol和N2 0.01mol,
答:无色气体有NO和N2组成,NO 0.1mol,N2 0.01mol.点评:
本题考点: 化学方程式的有关计算;物质的量浓度的相关计算.
考点点评: 本题考查了化学方程式的计算,侧重于化学性质、原子守恒、电荷守恒的应用,题目难度较大,熟悉物质的性质及物质之间的转化是解题的关键.1年前查看全部
- 木炭与浓硝酸反应硝酸的还原产物是NO还是NO2北师大《无机化学》的写法是NO2,但是严宣申老师的《普通无机化学》说是NO
木炭与浓硝酸反应
硝酸的还原产物是NO还是NO2
北师大《无机化学》的写法是NO2,但是严宣申老师的《普通无机化学》说是NO.
我个人认为是NO2.烦请各位高手给我一个明确的说法, 月影酒馆1年前1
月影酒馆1年前1 -
 艾楚风 共回答了14个问题
艾楚风 共回答了14个问题 |采纳率85.7%浓硝酸与木炭,应该是生成NO2,应该不会生成NO,因为当浓硝酸变为稀硝酸反应便停止发生,所以不会生成NO,不行就做个试验1年前查看全部
- 将1.92 g 纯铜片投入足量的某硝酸溶液中,铜片完全溶解.放出气体有导管通过盛有蒸馏水的洗气瓶充分反应,测得洗气瓶中液
将1.92 g 纯铜片投入足量的某硝酸溶液中,铜片完全溶解.放出气体有导管通过盛有蒸馏水的洗气瓶充分反应,测得洗气瓶中液体增重W g.排水后理论上从洗气瓶出气口收集到气体(S.T.P)__________mL.
答案是448,怎么会没有W的=.= 胡aa1年前1
胡aa1年前1 -
 王府井前门 共回答了21个问题
王府井前门 共回答了21个问题 |采纳率90.5%这个题目.有点意思,你看好
铜是在不加热的情况不和稀硝酸反应
所以那个一定是浓硝酸
产生的气体是NO2
依据电子守恒 1.92克铜是0.03摩尔
转移了0.06摩尔电子 即有0.06摩尔NO2产生
0.06摩尔的NO2会与水反应生成NO
3摩尔NO2产生1摩尔NO
所以产生气体体积是0.02摩尔×22.4升每摩尔
就是448ML
那个W是骗人用的.
祝你新年快乐 学习进步!1年前查看全部
- 硝酸工业生产中的尾气可用纯碱溶液吸收.有关的化学反应为:1、2NO2+Na2CO3=NaNO2+NaNO3+CO2 2、
硝酸工业生产中的尾气可用纯碱溶液吸收.有关的化学反应为:1、2NO2+Na2CO3=NaNO2+NaNO3+CO2 2、NO+NO2+Na2CO2=2NaNO+CO2 现有1000g质量分数为21.2%的纯碱吸收液吸收尾气,每产生22.4L(标准状况)CO2时,吸收液质量增加了44g.计算吸收液中NaNO2与NaNO3的物质的量比
 猪头肉炒饭1年前1
猪头肉炒饭1年前1 -
 fly1025228 共回答了26个问题
fly1025228 共回答了26个问题 |采纳率84.6%第二个反应该是:NO + NO2 + Na2CO3 ==== 2NaNO2 + CO2
【解析】
反应①
2NO2 + Na2CO3==== NaNO2 + NaNO3 + CO2 液体增重
质量 2×46 92-44=48
物质的量 2 1
反应②
NO + NO2 + Na2CO3 ==== 2NaNO2 + CO2 液体增重
质量 30 46 138 44 30+46-44=32
物质的量 1 1 2 1
现在假设,由NO2和Na2CO3反应,生成的CO2为 Xmol
而,有NO、NO2和Na2CO3反应,生成的CO2为Y mol
得到俩方程: X + Y = 1 (该等式为CO2的物质的量)
48X + 32Y = 44 (该等式为、溶液增重的质量)
====> X=0.75 Y =0.25
所以,在反应①中,生成NaNO2 0.75mol、NaNO3 0.75mol
在反应②中,生成NaNO2 0.5mol
也就是说,总共生成NaNO2 1.25mol NaNO3 0.75mol
物质的量比为: NaNO2 : NaNO3 = 0.75 : 1.25 = 3:5
就是这样~~~
回答满意请采纳!1年前查看全部
- "硝酸的酸酐不可由单质和氧气直接化合"WHY
 中国青年ww学院1年前1
中国青年ww学院1年前1 -
 coolfzb 共回答了21个问题
coolfzb 共回答了21个问题 |采纳率95.2%N2O5是硝酸酸酣但氮气和氧只能先化合成NO或NO2,必须先由低价再氧化为高价,所以硝酸的酸酣不能直接制取.1年前查看全部
- 硝酸的酸酐是什么?什么叫酸酐?
 华之靖1年前1
华之靖1年前1 -
 1fytry 共回答了20个问题
1fytry 共回答了20个问题 |采纳率95%硝酸的酸酐是N2O5
酸酐就是跟碱,反应能生成相对应盐+水的酸性氧化物!
比如N2O5+2NaOH===2NaNO3+H2O
或者H2SO4的酸酐是SO3,那么其酸酐是SO3
SO3+2NaOH===Na2SO4+H2O
或者你可以这样理解比如HNO3中N的化合价是+5价,那么它的酸酐就是+5的N的氧化物N2O5,这样会比较简单的找出相对应的酸酐!
就是这样的!1年前查看全部
- 初中化学中什么白色沉淀不溶于硝酸
 未激活2171年前4
未激活2171年前4 -
 wsq1214 共回答了15个问题
wsq1214 共回答了15个问题 |采纳率80%AgCl
BaSO41年前查看全部
- 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原
物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
A. 1:4
B. 1:5
C. 2:3
D. 2:5 jlingka1年前3
jlingka1年前3 -
 Eaglet_01 共回答了15个问题
Eaglet_01 共回答了15个问题 |采纳率86.7%解题思路:锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒规律来解决.锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒,2mol锌失去4mol电子,生成2mol锌离子,由于生成硝酸锌,则其结合的硝酸根离子是4mol,则剩余的1mol的硝酸被还原为N2O就得到4mol电子,硝酸也全部反应,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是1:4,即4Zn+10HNO3(一般稀)=4Zn(NO3)2+N2O↑+5H2O.故选A.
点评:
本题考点: 硝酸的化学性质;氧化还原反应的电子转移数目计算.
考点点评: 本题是对硝酸的氧化性知识的考查,注意电子守恒思想在氧化还原反应中的运用.1年前查看全部
- H2SO4(硫酸)和HNO3(硝酸)哪个酸性更强?
 特蕾西麦格雷帝1年前4
特蕾西麦格雷帝1年前4 -
 072570 共回答了19个问题
072570 共回答了19个问题 |采纳率84.2%1、氧化性:
硝酸 〉硫酸
2、酸性:
中学化学中,所谓的酸性通常指物质在水溶液中表现出来的性质.酸性强弱是指酸将质子给予水分子的能力.常用酸在水中的电离常数来衡量.硝酸和硫酸的电离方程式如下:
HNO3 = H(+) + NO3(-) pKa = -1.34
H2SO4 = H(+) + HSO4(-) pKa = -3
HSO4(-) = H(+) + SO4(2-) pKa = 1.9
显然pKa(HNO3) > pKa(H2SO4),即Ka(HNO3) < Ka(H2SO4),说明硫酸比硝酸的酸性更强.1年前查看全部
- 1.氯化铜和硫酸能反应么?我觉得可以,可为什么氯化银和硝酸不能反应?
1.氯化铜和硫酸能反应么?我觉得可以,可为什么氯化银和硝酸不能反应?
2.碳酸钠解离到水中是什么样的?产生OH离子?那这时它是具有碳酸根离子的性质还是OH离子的性质? zpml20041年前8
zpml20041年前8 -
 放ヌ弃 共回答了22个问题
放ヌ弃 共回答了22个问题 |采纳率86.4%不反应啊!
交换成分后没有沉淀\气体\水等
不符合复分解反映规律!氯化银和硝酸不反应!因为:
AgNO3+HCl=AgCl(沉淀)+HNO3,所以氯化银是不会跟硝酸银反应的....碳酸钠是强碱弱酸盐,所以水溶液显一定的碱性1年前查看全部
- 初三科学四道选择题1.为了中和某一氢氧化钠溶液,要消耗一定量的盐酸,如改用与盐酸质量分数相同的等质量的硝酸,则反应后的溶
初三科学四道选择题
1.为了中和某一氢氧化钠溶液,要消耗一定量的盐酸,如改用与盐酸质量分数相同的等质量的硝酸,则反应后的溶液的pH( )
A.=7 B.大于7 C.小于7
2.用浓度和质量都相同的两份盐酸分别与足量的碳酸钙和碳酸镁反应,则比较生成CO2的质量正确的是( )
A.相等 B.CaCO3 C.MgCO3 D.无法比较
3.已知浓硫酸的密度比稀硫酸的密度大.质量分数分别是90%和10%的两种硫酸溶液等体积混合后,所得硫酸溶液中溶质的质量分数 ( )
A.大于50% B.小于50% C.=50% D.无法确定
4.有w克10%的NaCl溶液,若将其浓度增大一倍,采取的措施是( )
A.把溶剂蒸发掉一半 B.把溶剂蒸发掉0.5w克 C.加如0.1w克NaCl D.加入w克10%的NaCl溶液
请认真答,很急,非常感谢!
 cureeric1年前1
cureeric1年前1 -
 lxf1000 共回答了20个问题
lxf1000 共回答了20个问题 |采纳率85%BAAB
如果需要过程请补充.1年前查看全部
- 取三张蓝色石蕊试纸湿润后贴在玻璃片上,然后按顺序分别滴加65%硝酸溶液、98%的硫酸溶液、新制氯水,三张试纸最终变成(
取三张蓝色石蕊试纸湿润后贴在玻璃片上,然后按顺序分别滴加65%硝酸溶液、98%的硫酸溶液、新制氯水,三张试纸最终变成( ).
 屋檐无语1年前1
屋檐无语1年前1 -
 诗韵梦月 共回答了25个问题
诗韵梦月 共回答了25个问题 |采纳率88%取三张蓝色石蕊试纸湿润后贴在
玻璃片上,然后按顺序分别滴加65%硝酸溶液、98%的硫酸溶液、新制氯水,三张试纸最终变成( ).
(A)白、红、白 (B)红、黑、白
(C)红、红、红 (D)白、黑、白1年前查看全部
- (10分)硝酸是一种重要的 化工原料,工业上生产硝酸的主要过程如下:
(10分)硝酸是一种重要的
 化工原料,工业上生产硝酸的主要过程如下:
化工原料,工业上生产硝酸的主要过程如下:
(1)以N 2 和H 2 为原料合成氨气。一定温度下,在密闭容器中充入ImolN 2 和3molH 2 发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,则N 2 的转化率
,则N 2 的转化率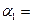 ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为 ,则
,则
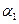 (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH 3 +5O 2 4NO+6H 2 O 4NO+3O 2 +2H 2 O=4HNO 3
4NO+6H 2 O 4NO+3O 2 +2H 2 O=4HNO 3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO 2 +Na 2 CO 3 =NaNO 2 +NaNO 3 +CO 2 ,NO+NO 2 +Na 2 CO 3 =2NaNO 2 +CO 2 。若在标准状况下有NO、NO 2 的混合气体(不考虑N 2 O 4 )恰好与50mL 1. 0 mol·L -1 的Na 2 CO 3 溶液反应完全,且生成NaNO 2 和NaNO 3 的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
0 mol·L -1 的Na 2 CO 3 溶液反应完全,且生成NaNO 2 和NaNO 3 的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程) h686421861年前1
h686421861年前1 -
 叫我qq胡 共回答了12个问题
叫我qq胡 共回答了12个问题 |采纳率91.7%(1)12.5%或1/8、>(4分,每空2分)(2)9(3分)
(2)解析:由反应4NH 3 +5O 2 4NO+6H 2 O、4NO+3O 2 +2H 2 O=4HNO 3 得:
4NO+6H 2 O、4NO+3O 2 +2H 2 O=4HNO 3 得:
NH 3 +2O 2 =HNO 3 +H 2 O,3.4吨液氨产生的硝酸为12.6吨,水为3.6吨,则理论上需加水的质量为为:126.t/50%-(12.6+3.6)t=9t
(3)(3分)由反应转化关系知,反应过程中钠元素 守恒,设NaNO 2 和NaNO 3 的物质的量分别为4a mol和a mol,则4a+a=50mL×10 -3 mL·L -1 ×1.0 mol·L -1 ×2,解得:a=0.02 mol,于是,推出NO、NO 2 的物质的量分虽为:0.03 mol、0.07 mol,即:NO所占的体积分数为30%。
守恒,设NaNO 2 和NaNO 3 的物质的量分别为4a mol和a mol,则4a+a=50mL×10 -3 mL·L -1 ×1.0 mol·L -1 ×2,解得:a=0.02 mol,于是,推出NO、NO 2 的物质的量分虽为:0.03 mol、0.07 mol,即:NO所占的体积分数为30%。
略1年前查看全部
- 硝酸具有挥发性说明硝酸不稳定?如题.
 yuanyou30001年前4
yuanyou30001年前4 -
 djspark 共回答了23个问题
djspark 共回答了23个问题 |采纳率91.3%不对
具有挥发性的东西不一定都不稳定,如浓盐酸也具有挥发性,但是盐酸比较稳定
硝酸不稳定是硝酸本身自有的性质,和挥发性无关
有挥发性的东西不一定不稳定,不具有挥发性的东西也不一定稳定1年前查看全部
- 负一硝酸氢氧根,负二硫酸碳酸根,负三磷酸根正一价是氨根举例说明,
 非常fish1年前2
非常fish1年前2 -
 llsky21 共回答了23个问题
llsky21 共回答了23个问题 |采纳率100%NaOH
CaSO4
CaCO3
H3PO2
NH4Cl1年前查看全部
- 化学酸碱盐溶解性顺口溜“钾钠铵盐硝酸溶,盐酸盐中除去银,碳磷酸溶钾钠铵,硫酸铅和钡不溶”是什么意思?
 怎么爱都不够1年前3
怎么爱都不够1年前3 -
 longjingbinbin 共回答了19个问题
longjingbinbin 共回答了19个问题 |采纳率73.7%就是初中阶段常见盐的溶解性
以一句就是指钾钠铵的盐溶液易溶于水,例如碳酸钾碳酸钠氯化钠氯化铵硫酸钾,等等
第二句指AgCl不易溶于水(极难溶)
第三句知此俩酸根离子盐只有钾钠铵溶,即碳酸钠,碳酸钾,碳酸铵,其他不溶,如碳酸钡,碳酸钙等等不溶.
最后一句与第2句类似1年前查看全部
- 甲烷、氨气、溴化氢、碘化氢、硝酸、碳酸、磷酸、亚硫酸的化学式是什么?
 断刀流水11151年前1
断刀流水11151年前1 -
 烁远 共回答了17个问题
烁远 共回答了17个问题 |采纳率100%CH4,NH3,BrH,IH,HNO3,H2CO3,H3PO4,H2SO31年前查看全部
- 例如:二缩三硝酸,一缩二乙二醇.
例如:二缩三硝酸,一缩二乙二醇.
$(co) teneyoon1年前1
teneyoon1年前1 -
 非仙子 共回答了22个问题
非仙子 共回答了22个问题 |采纳率100%两个简单含氧酸分子间缩去一分子水,可以用“一缩某二酸”来命名.二缩三硝酸 是三个硝酸分子之间缩去两分子水;一缩二乙二醇 是两个乙二酸分子之间缩去一份子水1年前查看全部
- 化学高手进!关于氧化还原和硝酸(NO3离子)的问题
化学高手进!关于氧化还原和硝酸(NO3离子)的问题
书上说,硝酸(HNO3)有强的氧化性,所以可以与一些物质发生氧化还原反应.
例如HNO3+Cu的反应.
书上的E.C.S.的列表,写的是NO3-是强的氧化剂(oxidizing agent)
我想问,那么在Fe(铁)和Cu(NO3)2的反应中,为什么NO3-不是氧化剂了?是因为只要不是硝酸,而是和其他元素组成盐,它就不具氧化性了? 江南茶秀1年前4
江南茶秀1年前4 -
 dhscjx 共回答了19个问题
dhscjx 共回答了19个问题 |采纳率89.5%NO3的强氧化性要在酸性条件下才显现出来.在铁和硝酸铜的反应中,若加入硫酸,NO3-的氧化性就会显现出来了.1年前查看全部
- 硫酸 盐酸 硝酸 氯酸钾 高锰酸钾 锰酸钾 氯化钠 食盐 氯化钾
硫酸 盐酸 硝酸 氯酸钾 高锰酸钾 锰酸钾 氯化钠 食盐 氯化钾
氯化钙 氯化镁 氯化锌 氯化铝 氯化银 氯化铁 氯化亚铁 氯化铜 氯化亚铜 氯化钡 sp_zy1年前3
sp_zy1年前3 -
 江薇cc 共回答了16个问题
江薇cc 共回答了16个问题 |采纳率87.5%H2SO4
HCl
HNO3
KClO3
KMnO4
K2MnO4
KMnO3
NaCl
NaCl
KCl
CaCl2
MgCl2
ZnCl2
AlCl3
AgCl
FeCl3
FeCl2
CuCl2
CuCl
BaCl2
Cu(OH)2CO31年前查看全部
- 氯化氢,硫酸,硝酸都是什么性酸,氧化性还是还原性,为什么
 xinliyi1年前1
xinliyi1年前1 -
 天地随风 共回答了23个问题
天地随风 共回答了23个问题 |采纳率91.3%盐酸是非氧化性酸,只是具有酸的通性,但氯化氢气体具有一定的还原性(-1价的氯化合价可升高),但不强
硫酸分两种情况,稀硫酸具有酸的通性,氧化性却很弱(主要是SO4 2-的氧化性弱),所以是非氧化性酸,而浓硫酸除了具有酸的通性外,由于水的含量极少,因此浓硫酸主要以H2SO4分子的形式存在,而H2SO4分子具有很强的氧化性,所以它是强氧化性酸,与强还原性的物质(如硫化氢等)无法共存,它与金属反应生成最高价态的金属盐,并且可与活动性表中排在H后的铜、汞、银等金属反应
硝酸无论稀浓,都同时具有酸的通性强氧化性,它的氧化性主要来自NO3-离子,也属于强氧化性酸1年前查看全部
- Cu-HNO3反应的一道题.含a mol Cu,b mol Ag的金属混合物与含c mol HNO3的某浓度硝酸恰好反应
Cu-HNO3反应的一道题.
含a mol Cu,b mol Ag的金属混合物与含c mol HNO3的某浓度硝酸恰好反应.
生成气体只有m mol NO2和 n mol NO.下列式子不成立的是.
A.2a+b=m+3n
B.8a/3+2b=c
C.c=2m+4n
D.c=2a+b+m+n.
有分给的. 约定齐1年前1
约定齐1年前1 -
 逸五 共回答了16个问题
逸五 共回答了16个问题 |采纳率81.3%选B
A 得失电子守恒:Cu Ag 失电子数等于NO2 NO 得电子数:则有2a+b=m+3n
B.错误
D 氮守恒:HNO3中的N等于Cu(NO3)2 AgNO3 NO2 NO 中的N相加,则有c=2a+b+m+n.
C.D中有c=2a+b+m+n.A中有2a+b=m+3n 代入D中即得c=2m+4n1年前查看全部
- 硝酸是什么气体溶于水,为何和金属反应不一定放出氢气?
 kundali1年前3
kundali1年前3 -
 forevernan 共回答了15个问题
forevernan 共回答了15个问题 |采纳率93.3%五氧化二氮,是硝酸酸酐不假,但常温下为白色固体,微溶于水,热水才全溶.融水后生成硝酸.
二氧化氮是红棕色气体,溶水生成硝酸.在无氧气条件下还会生成无色气体一氧化氮,有氧气时生成硝酸.以下为化学式:
4NO2+3O2+2H2O=4HNO3 3NO2+H2O=2HNO3+NO1年前查看全部
- 酸碱和盐的溶解性表的读法~例如:H2SO4(硫酸),HCL(盐酸),HNO3(硝酸) NaOH(氢氧化钠),KOH(氢氧
酸碱和盐的溶解性表的读法~
例如:H2SO4(硫酸),HCL(盐酸),HNO3(硝酸)
NaOH(氢氧化钠),KOH(氢氧化钾),NH4OH(氨水)
Na2CO3(碳酸钠),CuSO4(硫酸铜) ,NH4NO3(硝酸铵) bmx9991年前1
bmx9991年前1 -
 13aizjb 共回答了14个问题
13aizjb 共回答了14个问题 |采纳率92.9%H2CO3【碳酸】.HF【氢氟酸】
CaOH【氢氧化钙】.Cu(OH)2【氢氧化铜】.Fe(OH)2【氢氧化亚铁】.Fe(OH)3【氢氧化铁】.
CaCO3【碳酸钙】.Ca2NO3【硝酸钙】.Na2CO3【碳酸钠】.AgCl【氯化银】1年前查看全部
- 像一个澄清的溶液中加入硝酸酸化的BaNO3,有白色沉淀生成,可否说明溶液中只有SO4离子而没有CO3离子?
 lolo80031年前2
lolo80031年前2 -
 mazland 共回答了13个问题
mazland 共回答了13个问题 |采纳率92.3%s是的!
加BaNO3有白色沉淀生成,说明可能含有CO3离子和SO4离子,若是硝酸酸化,即溶液中有硝酸,在硝酸存在时,CO3离子,会变成气体二氧化碳,碳酸钡溶解;若白色沉淀不溶解,只能是硫酸钡,即说明溶液中只有SO4离子1年前查看全部
- 尿素,醋酸.硝酸三者的相对分子质量相近,形成的晶体都属于分子晶体,但三者的溶沸点相差较大,
 魍魉魑魅111年前3
魍魉魑魅111年前3 -
 寒城风云 共回答了24个问题
寒城风云 共回答了24个问题 |采纳率100%首先硝酸是无机物,无机物的溶沸点一般都比有机物要高,醋酸和尿素的主要是空间结构不同!1年前查看全部
- 硝酸与H前金属反应生成什么?有没有稀和浓的差异?
硝酸与H前金属反应生成什么?有没有稀和浓的差异?
硝酸是只有对H后金属有氧化性么?还是与H前也有? ronyers1年前2
ronyers1年前2 -
 思念人之屋1 共回答了18个问题
思念人之屋1 共回答了18个问题 |采纳率100%有,浓的生成二氧化氮,稀得生成一氧化氮.对什么金属都有氧化性.比如氢后的铜,1年前查看全部
- 为什么高氯酸酸性最强?高溴酸,高碘酸,硝酸都是强酸,相同浓度下都能完全电离,那么ph应该相同啊?
 michelle12301年前3
michelle12301年前3 -
 神kk 共回答了17个问题
神kk 共回答了17个问题 |采纳率76.5%酸性有强弱,只是水中都 反应变成了水合氢离子,故酸性一样,也就是说在水这个溶剂中不能区分这几个酸的酸性强弱1年前查看全部
- 镁和硝酸反应配平!( )Mg+( )HNO3==( )Mg(NO3)2+( )NH4NO3+( )H2O
 任未来1年前2
任未来1年前2 -
 小笑世上士 共回答了20个问题
小笑世上士 共回答了20个问题 |采纳率95%4 10 4 1 31年前查看全部
- 一定量的铁和氧化铁混合物投入250mL2mol/L的硝酸溶液中,反应完全后,无固体剩余,生成1.12LNO气体
一定量的铁和氧化铁混合物投入250mL2mol/L的硝酸溶液中,反应完全后,无固体剩余,生成1.12LNO气体
一定量的Fe和Fe2O3混合物投入250ml2mol/L的HNO3溶液中,反应完全后,无固体剩余,生成1.12LNO气体(标况),再向反应后溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是?400ml
错了,答案是450ml怎么算的? ssx05461年前2
ssx05461年前2 -
 Doffy 共回答了13个问题
Doffy 共回答了13个问题 |采纳率84.6%生成1.12LNO气体(标况)——需要硝酸1.12/22.4=0.05摩尔,这是被还原的硝酸的物质的量;250ml2mol/L的HNO3溶液中含有硝酸=2*0.25=0.5摩尔,这是硝酸总的物质的量.
那么总的物质的量—被还原的物质的量=0.5-0.05=0.45摩尔,0.45摩尔消耗1mol/L的NaOH溶液体积=0.45/1=0.45升=450毫升.1年前查看全部
- 小刚也查阅了一分资料,了解到氯化铜溶液,硝酸铜溶液中均含有铜离子,氯化钠溶液中含有氯离子,硝酸钠溶液含硝酸离子.他于是马
小刚也查阅了一分资料,了解到氯化铜溶液,硝酸铜溶液中均含有铜离子,氯化钠溶液中含有氯离子,硝酸钠溶液含硝酸离子.他于是马上到实验室观察氯化钠,硝酸钠,氯化铜,硝酸铜溶液的颜色,基于这些溶液的颜色他可以作一个判断,若 ,则可以得出结论——铜离子使硫酸铜溶液呈现蓝色.
 我是驹1年前1
我是驹1年前1 -
 riot转圈圈 共回答了19个问题
riot转圈圈 共回答了19个问题 |采纳率89.5%若 氯化铜,硝酸铜溶液为蓝色,氯化钠,硝酸钠溶液为无色 ,则可以得出结论——铜离子使硫酸铜溶液呈现蓝色.1年前查看全部
- 磷酸二氢钠与少量氢氧化钠的反应如题,然后加氯化钙溶液,有何现象?若用硝酸代替氢氧化钠溶液,将有什么现象?为什么?自学者需
磷酸二氢钠与少量氢氧化钠的反应
如题,然后加氯化钙溶液,有何现象?
若用硝酸代替氢氧化钠溶液,将有什么现象?
为什么?
自学者需要琢磨嗯. 青草燕窝1年前2
青草燕窝1年前2 -
 鹰之梦残剑1 共回答了22个问题
鹰之梦残剑1 共回答了22个问题 |采纳率90.9%没有任何现象
NaH2PO4+NaOH=Na2HPO4+H2O(氢氧化钠是少量,因此只反应一个H+)
CaCl2和Na2HPO4不反应.
有白色沉淀生成
NaH2PO4+HNO3=NaNO3+H3PO4
2H3PO4+3CaCl2=Ca3(PO4)2+6HCl
Ca3(PO4)2是白色沉淀1年前查看全部
- 为什么硝酸银只能用硝酸酸化?原理何在 以次推广到:物质酸化时的原里和注意事项?
 夏之湖1年前2
夏之湖1年前2 -
 sdhfbjkfg 共回答了20个问题
sdhfbjkfg 共回答了20个问题 |采纳率85%因为银离子与其他酸根会生成沉淀,再一点是为了避免引入杂质.酸化硝酸银是为了防止银离子的水解产生沉淀.酸化的原理主要就是避免引入杂质(尽量使用相应的酸根,当然也有例外),避免使药剂变质(就是别让药剂发生化学反应).1年前查看全部
- 有四种物质的溶液,1氢氧化钡2硫酸钠3硝酸4氯化铁
有四种物质的溶液,1氢氧化钡2硫酸钠3硝酸4氯化铁
不用其他试剂就可以将它们逐一鉴别出来,其鉴别顺序是?
A 1234
B 4321
C 3124
D 4132 liquan21281年前3
liquan21281年前3 -
 阳光ss 共回答了16个问题
阳光ss 共回答了16个问题 |采纳率87.5%氯化铁呈黄色,所以先鉴别出来是氯化铁.
用三支试管,各取少量其它三种待测液,然后分别加入氯化铁溶液,产生红褐色沉淀的为氢氧化钡溶液.
再另取二支试管,各取已产生的红褐色沉淀,然后分别其它二种待测液,红褐色沉淀消失的为硝酸,无现象的为硫酸钠.
所以答案为D.1年前查看全部
- 下列场合中不能之接使用氮气的是 A 填充灯泡 B做焊接保护气 C 制硝酸 D制氨 选C的理由是
 瓷漆xx1年前2
瓷漆xx1年前2 -
 辋阕 共回答了14个问题
辋阕 共回答了14个问题 |采纳率92.9%题目应该是“不能直接使用氮气的是”.
答案应该是C.原因是工业上制备硝酸是用氨的催化氧化法,先得到NO,然后再和氧气作用得到NO2,最后NO2和水反应得到硝酸的,所以不能直接使用氮气!
具体如下:
其法以氨和空气为原料,用Pt—Rh合金网为催化剂在氧化炉中于 800℃进行氧化反应,生成的NO在冷却时与O2生NO2,NO2在吸收塔内用水吸收在过量空气中O2的作用下转化为硝酸,最高浓度可达50%.
4NH3+5O2=催化剂、高温=4N0+6H20 ①
2NO+O2==2NO2 ②
3NO2+H2O==2HNO3+NO ③
4NO2+O2+2H2O==4HNO3 ④
③中的NO可以进入②中继续利用制取的50%的硝酸用硝酸镁或者浓H2SO4做吸水剂,蒸馏,可得到高浓度的硝酸,甚至98%以上的“发烟”硝酸.
尾气处理,生产过程中NO循环使用,可以最大程度利用原料,并且减少尾气中的NOX 的排放,
尾气一般用NaOH溶液进行吸收 ,发生氧化还原反应,可以综合利用尾气中的NOX
2NO2+2NaOH =NaNO2 +NaNO3 +H2O
NO +NO2 +2NaOH =2NANO3+H2O1年前查看全部
- 含硝酸跟离子的溶液中,有氨根离子、钡离子、亚铁离子、溴离子.在这溶液中,为什么能大量共存?亚铁不是会水解吗?
 谷熙1年前2
谷熙1年前2 -
 clematis 共回答了18个问题
clematis 共回答了18个问题 |采纳率88.9%NH4+ + H2O ==可逆== NH3 H2O + H+
Fe2+ + 2H2O ==可逆== Fe(OH)2 + 2H+
NH4+ 和 Fe2+ 在溶液中都会发生小程度的水解,它们产生的H+会互相抑制对方的水解,减弱水解的程度,此时可以认为NH4+和Fe2+可以大量共存
若是将其中一种离子换成弱酸银离子如HCO3-
HCO3- + H2O ==可逆== H2CO3 + OH-
这个时候产生的OH-会和阳离子水解产生的H+反应,使得阴阳离子双方的水解程度增大,此时不能共存1年前查看全部
- 什么材料的槽子能够盛装硝酸、铬酸、氢氟酸混合液?并且能够耐85度加温浓缩?
什么材料的槽子能够盛装硝酸、铬酸、氢氟酸混合液?并且能够耐85度加温浓缩?
现有一含有以上三酸混合液的槽液报废,需要加温浓缩处理.想单独用一个槽子加温浓缩,不知道选用什么材料的槽子?并且想问一下如果是移动的应选用什么样的装置(大致有2000升溶液)? 落叶的旋律1年前1
落叶的旋律1年前1 -
 颜的同事 共回答了17个问题
颜的同事 共回答了17个问题 |采纳率70.6%用聚四氟乙烯罐子吧!我们经常做实验用的就是这种罐子哦!不过价格也不是那么便宜的!1年前查看全部
- 27%的盐酸怎么样配比王水?一般的说是用硝酸浓度为68% 盐酸的浓度为36%-38%按照 体积比1:3来配比.可要是盐酸
27%的盐酸怎么样配比王水?
一般的说是用硝酸浓度为68% 盐酸的浓度为36%-38%按照 体积比1:3来配比.可要是盐酸的密度是27%呢?怎么配比? 爱乐天1年前3
爱乐天1年前3 -
 荷米恩 共回答了16个问题
荷米恩 共回答了16个问题 |采纳率93.8%王水的浓度是粗略的,在这个范围的配比都能有这个效果,差不多1:2多一点就行了,就当稀释前后总体极不变,化学中的近似是很重要的,要学会忽略,像1:2,1:3这种数字的话只要精确到整数位就可以了1年前查看全部
- (1)二氧化氮溶于水中生成硝酸和一氧化氮
(1)二氧化氮溶于水中生成硝酸和一氧化氮
(2)盐酸与碳酸钠反应成制取二氧化碳
写出它们的化学式
要配平 viviching1年前1
viviching1年前1 -
 BMW0708 共回答了15个问题
BMW0708 共回答了15个问题 |采纳率86.7%3NO2+2H2O=2HNO3+NO
2HCl+Na2CO3=2NaCl+CO2↑1年前查看全部
大家在问
- 1AB平行CD,PM、QM、QN分别为角APQ、角BPQ,角PQC,角PQD的
- 21公尺等于几米?
- 3卿卿子矜,悠悠我心!所谓伊人,在水一方!
- 4英语小故事带翻译20字,明天要交了,急呀!
- 53600元钱的百分之80是多少钱啊,这个我老是不会算.
- 6粮店运进一批大米和面粉,大米重量的3/4与面粉共重950千克,大米重量的1/3与面粉重量的2/5相等,你知道
- 7已知关于X的方程2(X-3A)+5=X-A+4的解适合不等式2(X-5)≤8A,求A的取值范围
- 8导体电阻(电阻率)怎样进行首检?
- 9石油的分馏中哪些是纯净物?
- 10求过三点A(-1,3)、B(0,2)、C(1,-1)的圆方程(结果化为标准式)
- 11英语语法中什么是逻辑主语
- 12某化合物能使紫色石蕊试液变红注意是化合物,这种化合物是什么?(二氧化碳化合能形成)
- 13匀变速直线运动的加速度随时间均匀变化.为什么是错的
- 14英语小故事800字~900字
- 15桃花源记 便的一山,山有小口,仿佛若有光 的 语言节奏划分?仿佛 的意思?若 的意思?为什么合在一起?
