价电子排布式与电子排布式有什么不同,怎么写价电子排布式
 2005sunny2022-10-04 11:39:541条回答
2005sunny2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 来源人 共回答了17个问题
来源人 共回答了17个问题 |采纳率88.2%- 价电子是最外层的排布式,电子排布是所有电子的排布式
- 1年前
相关推荐
- 元素金(Au)处于周期表中的第六周期,与Cu同族,其价电子排布与Cu相似,Au原子的价电子排布式为______;一种铜金
元素金(Au)处于周期表中的第六周期,与Cu同族,其价电子排布与Cu相似,Au原子的价电子排布式为______;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为______;该晶体中,原子之间的强相互作用是______;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图)的结构相似,该晶体储氢后的化学式应为______.
 iwaka1年前1
iwaka1年前1 -
 水漫桥 共回答了29个问题
水漫桥 共回答了29个问题 |采纳率93.1%解题思路:铜是29号元素,在元素周期表位置:第四周期、ⅠB族,价电子排布式为3d104s1,Au原子的价电子排布式为5d106s1;
根据均摊法计算晶胞中Cu、Au原子数目,确定合金中二者原子数目之比;
铜金合金晶体属于金属晶体,据此判断化学键类型;
CaF2的结构如图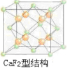 ,利用均摊法计算.
,利用均摊法计算.
铜是29号元素,在元素周期表位置:第四周期、ⅠB族,价电子排布式为3d104s1,元素金(Au)处于周期表中的第六周期,与Cu同族,其价电子排布与Cu相似,Au原子的价电子排布式为5d106s1;
铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则晶胞中Cu原子数目=6×[1/2]=3,晶胞中Au原子数目=8×[1/8]=1,故晶胞中Cu原子与Au原子数量之比为3:1;铜金合金晶体属于金属晶体,含有化学键类型为金属键;
CaF2的结构如图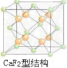 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,
故答案为:5d106s1;3:1;金属键;Cu3AuH8.点评:
本题考点: 原子核外电子排布;晶胞的计算.
考点点评: 本题考查元素的核外电子排布式、化学键类型、均摊法计算原子个数比及化学式等知识,题目难度中等,注意均摊法的应用和知识的迁移能力的培养.1年前查看全部
- 原子的外围电子排布式,价电子排布式,最外层电子排布式不用写Ar么
 水蜜桃9991年前1
水蜜桃9991年前1 -
 纯白黛黑 共回答了17个问题
纯白黛黑 共回答了17个问题 |采纳率88.2%写个0族原子在前面的是简化电子排布式1年前查看全部
- Cu2+的价电子排布式中,3D9中的电子为什么不到4S中去.不是能量最低原理
Cu2+的价电子排布式中,3D9中的电子为什么不到4S中去.不是能量最低原理
Cu2+的价电子排布式中,3D9中的电子为什么不到4S中去.不是说能量最低原理嘛!4S的能量比3D低嘛……为什么3D的电子不往4S去! ii阻击手1年前1
ii阻击手1年前1 -
 美容最后一站 共回答了24个问题
美容最后一站 共回答了24个问题 |采纳率87.5%Cu2+带2个正电荷,4S比3d离原子核远 ,把电子从离原子核近的地方拿到远的地方是要克服电场力做功,能量升高,但这时整个离子带正电荷,核对电子的束缚比原子时要强,电子在低能量轨道上降低的能量不足以抵消其升高的电势能1年前查看全部
- 短周期元素74原子最外电子层中具有最多4未成对电子,元素Y4价电子排布式为nsnnpn+2,则7、Y组成4微粒中,不可能
短周期元素74原子最外电子层中具有最多4未成对电子,元素Y4价电子排布式为nsnnpn+2,则7、Y组成4微粒中,不可能存在4是( )
A.X2Y5
B.XY42-
C.XY2-
D.XY3- 菲菲~粉红1年前1
菲菲~粉红1年前1 -
 小雅的青春dd册 共回答了15个问题
小雅的青春dd册 共回答了15个问题 |采纳率93.3%解题思路:短周期元素X的原子最外电子层中具有最多的未成对电子,X外围电子排布为2s22p3或3s23p3,为N元素或P元素;元素Y的价电子排布式为nsnnpn+2,s能级最多容纳2个电子,故n=2,Y核外电子排布为1s22s22p4,则Y为O元素,结合二者构成的常见物质(或微粒)及元素化合价解答.短周期元素X的原子最外电子层t具有最多的未成对电子,X外围电子排布为tstt二3或3st3二3,为十元素或二元素;元素Y的价电子排布式为十s十十二十+t,s能级最多容纳t个电子,故十=t,Y核外电子排布为tsttstt二4,则Y为O元素,
4.可形成十tO十、二tO十,故4不选;
B.XY4t-tX的化合价为+6价,而十或二的最高价为+十价,则不可能存在,故B选;
C.可形成十Ot-,故C不选;
D.可形成十O3-,故D不选;
故选:B.点评:
本题考点: 原子结构与元素的性质.
考点点评: 本题考查原子结构与性质关系、核外电子排布等,掌握电子排布规律推出元素是关键,难度中等,注意利用列举法进行的解答.1年前查看全部
- 外层电子排布式是什么?和价电子排布式有什么关系?
 wu9876543211年前1
wu9876543211年前1 -
 h1k2x3 共回答了13个问题
h1k2x3 共回答了13个问题 |采纳率84.6%表示原子核外电子排布的图式之一.有七个电子层,分别用1、2、3、4、5、6、7等数字表示K、L、M、N、O、P、Q等电子层,用s、p、d、f等符号分别表示各电子亚层,并在这些符号右上角用数字表示各亚层上电子的数目.如氧原子的电子排布式为.迄今为止,只发现了7个电子层!
电子排布式是指用能级的符号及能级中容纳电子数值表达核外电子运动的状态.
电子排布式中的内层电子排布可用相应的稀有气体的元素符号加方括号来表示,以简化电子排布式.以稀有气体的元素符号加方括号的部分称为“原子实”.
原理
处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守泡利不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生.
举例
如碳、氧、钠、钙原子的电子排布式分别是1s2 2s2 2p2、1s2 2s2 2p4 、1s2 2s2 2p6 3s1、1s2 2s2 2p6 3s2 3p6 4s2 ,其简化的电子排布式可以分别表示为[He]2s2 2p2、[Ne]3s1、[Ar]4s2.
原子实——[He]:1s2、[Ne]:1s2 2s2 2p6、[Ar]:1s2 2s2 2p6 3s2 3p6、[Kr]:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6、
[Xe]:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6、[Rn]:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p6、[Uuo]:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d10 7s2 7p6
主族元素的价层电子指最外层电子,价电子排布式即外围电子排布式.例如:Al:3s2 3p1
价电子排布式又称作特征电子构型.
外围电子与价电子概念不同.
外围电子是指原子核外最高能级组上的电子.
价电子是指原子核外能与其它原子形成化学键的电子.虽都是核外电子,但范围不同.
此外:
主族元素的价电子就是主族元素原子的最外层电子;过渡元素的价电子不仅是最外层电子,次外层电子及
某些元素的倒数第三层电子也可成为价电子.
外围电子包括成键电子和非成键电子.1年前查看全部
- Cr的价电子排布式为什么包括3d10,价电子不是只是最外层电子数吗?还有为什么Cr的最高正价是+5?
 再见尤加利1年前1
再见尤加利1年前1 -
 唐笑笑 共回答了21个问题
唐笑笑 共回答了21个问题 |采纳率95.2%Cr价电子排布3d5 4s1,d轨道半充满能量低要低于S轨道全满,根据能量最低原则,其排布是3d5,4s1.另外,Cr的最高正价是+6,重铬酸钾中就是+6价1年前查看全部
- 原子序数为84的元素的价电子排布式
 梨花山庄小娘一支1年前1
梨花山庄小娘一支1年前1 -
 huige521 共回答了20个问题
huige521 共回答了20个问题 |采纳率80%排布式
2 | 8 | 18 | 32 | 18 | 61年前查看全部
- 写出基态原子或离子的价电子排布式
写出基态原子或离子的价电子排布式
Fe___ Fe2+______ Fe3+______ 天天49431年前1
天天49431年前1 -
 忆父 共回答了17个问题
忆父 共回答了17个问题 |采纳率88.2%Fe 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Fe2+ 1s2 2s2 2p6 3s2 3p6 3d6
Fe3+ 1s2 2s22p63s23p63d5
这里格式改不了 在右上角标就是了1年前查看全部
- 上表为周期表的一部分,其中的编号代表所对应的元素.请回答下列问题:(1)⑨号元素的基态原子的价电子排布式是______,

上表为周期表的一部分,其中的编号代表所对应的元素.请回答下列问题: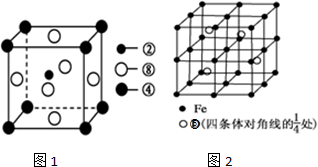
(1)⑨号元素的基态原子的价电子排布式是______,与其同周期,且基态原子的核外未成对电子数最多的元素是______(写出元素符号),②号元素基态原子的电子排布图为______.
(2)①号与③号元素形成的含有18电子的物质为______(写出名称),②号与③号元素形成的,能造成温室效应的物质的空间构型为______.②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如右图1所示,则该化合物的化学式为______(用对应的元素符号表示),常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是______.
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,有关该分子的说法中正确的是______.
a.该分子属于含有极性键的非极性分子 b.该分子含有4个σ键和1个π键
c.该分子中的②原子采取sp2杂化 d.该物质易溶于水,并能和水反应得到酒精
(4)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成含有10个电子的分子X,将过量的X通入盛有硫酸铜溶液的试管里,产生的现象为______.
(5)若⑤元素与Fe元素形成某种晶体如图2所示.若晶胞的边长为a nm,则合金的密度为5.56×1023 a3NA g/cm3.5.56×1023 a3NA  狮戒畈1年前0
狮戒畈1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 钴原子在基态时的价电子排布式
 一剑定清风1年前1
一剑定清风1年前1 -
 郎小强 共回答了19个问题
郎小强 共回答了19个问题 |采纳率94.7%3d7 4s21年前查看全部
- Fe和As的价电子排布式和原子结构示意图怎么写?
 后天尘缘1年前1
后天尘缘1年前1 -
 击箸 共回答了2个问题
击箸 共回答了2个问题 |采纳率50%Fe:1s22s22P63s23P63d64s2 As:1s22s22P63S23P63d104s24P51年前查看全部
- 化学问题,什么是价电子?比如cu的价电子排布式怎么写?3d104s1?取排布式的最后2位?
 如如是1年前1
如如是1年前1 -
 能_ff 共回答了19个问题
能_ff 共回答了19个问题 |采纳率89.5%价电子是原子在参与化学反应时能够用于成键的电子,是原子核外跟元素化合价有关的电子.在主族元素中,价电子数就是最外层电子数.副族元素原子的价电子,除最外层电子外,还可包括次外层电子.Cu的核外电子排布式应为1s22s22p63s23p63d104s1 ,价电子排布式3d104s11年前查看全部
- 【二选一—物质结构与性质】碳、氧、铁、铜等是与人类生产、生活息息相关的化学元素。(1)基态铜原子的价电子排布式为____
【二选一—物质结构与性质】
碳、氧、铁、铜等是与人类生产、生活息息相关的化学元素。
(1)基态铜原子的价电子排布式为___________,铜原子的电子占有___________种能量不同的原子轨道。
(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子中C原子的杂化类型为___________杂化。
(3)甲烷和四氯化碳具有相似的空间结构,但常温下甲烷是气体,四氯化碳是液体,其原因是________________ 。
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。
请回答:
表中的金属元素是_____________(填字母)。若A、B、C依次为同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是______________。
(5)元素钴(Co)可形成分子式均为Co(NH 3 ) 5 BrSO 4 的两种配合物,其中一种化学式为[Co(NH 3 ) 5 Br]SO 4 ,往其溶液中加BaCl 2 溶液时,现象是_____________ ;往另一种配合物的溶液中加入BaCl 2 溶液时,无明显现象,若加入AgNO 3 溶液时,产生淡黄色沉淀,则第二种配合物的化学式为_______________。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为____________。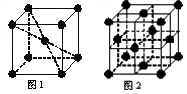
 zjh64191年前1
zjh64191年前1 -
 oo00601 共回答了11个问题
oo00601 共回答了11个问题 |采纳率90.9%(1)[Ar] 3d 10 4s 1 ;7
(2)sp
(3)甲烷和四氯化碳均为分子晶体,而四氯化碳的相对分子质量比甲烷的相对分子质量大,四氯化碳分子间作用力比甲烷分子间作用力强,四氯化碳的沸点比甲烷高,故常温下甲烷是气体,四氯化碳是液体。
(4)D E F; B的np轨道上的电子半满,能量比A和C低,第一电离能比A和C大
(5)产生白色沉淀;[Co (NH 3 ) 5 SO 4 ]Br
(6)2∶31年前查看全部
- 下列叙述正确的是( )①配位键在形成时,是由成键双方各提供一个电子形成共用电子对②价电子排布式为ns2的原子属于ⅠA或
下列叙述正确的是( )
①配位键在形成时,是由成键双方各提供一个电子形成共用电子对
②价电子排布式为ns2的原子属于ⅠA或ⅡA族元素
③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素
④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O2,CO2这样的分子
⑤化合物NH4Cl和CuSO4•5H2O都存在配位键
⑥AgCl是一种白色的沉淀,不溶于硝酸溶液,浓硫酸溶液,烧碱溶液,却能溶于氨水中.
A.①③
B.②③
C.⑤⑥
D.④⑤ 九九三1年前1
九九三1年前1 -
 shftianya 共回答了22个问题
shftianya 共回答了22个问题 |采纳率81.8%解题思路:①含有空轨道和含有孤电子对的原子之间易形成配位键;
②价电子排布式为ns2的原子属于ⅠA或ⅡA族元素,还可能属于0族;
③根据最后排入电子名称确定元素在周期表中所属区名称;
④H2O2是极性分子;
⑤含有空轨道和含有孤电子对的原子之间易形成配位键;
⑥AgCl和氨水反应生成络合物.①配位键在形成时,是由成键双方一个提供空轨道、一个提供孤电子对形成的,故错误;
②价电子排布式为ns2的原子属于ⅠA或ⅡA族元素,还可能属于0族,如He,故错误;
③根据最后排入电子名称确定元素在周期表中所属区名称,Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]3d104s24p2,属于P区元素,故错误;
④H2O2结构不对称,属于极性分子,故错误;
⑤氯化铵中氮原子提供孤电子对、一个氢原子提供空轨道,二者形成配位键;CuSO4•5H2O中水中氧原子提供孤电子对、铜提供空轨道,二者形成配位键,所以NH4Cl和CuSO4•5H2O都存在配位键,故正确;
⑥AgCl和氨水反应生成络合物离子银氨离子,所以氯化银能溶于氨水中,故正确;
故选C.点评:
本题考点: 配合物的成键情况;元素周期表的结构及其应用;原子核外电子排布;极性分子和非极性分子;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查较综合,涉及配位键、元素周期表区的划分等知识点,知道配位键的形成条件、元素周期表结构、基态原子核外电子排布等知识点,
组成为ABn型化合物,极性分子、非极性分子的判断方法有:
1.中心原子化合价法:
若中心原子A的化合价等于族的序数,则该化合物为非极性分子,如:CH4,SO3,PCl5;
2.受力分析法:
若已知键角(或空间结构)可进行受力分析,合力为0者为非极性分子,如:CO2、C2H4、BF3;
3、非极性分子:
同种原子组成的双原子发生都是非极性分子,不同原子组成的双原子分子是极性分子.1年前查看全部
- 下列化学用语正确的是( )A.Mg2+的结构示意图:B.C2H2的电子式:C.基态Cr的价电子排布式:3d44s2D.
下列化学用语正确的是( )
A.Mg2+的结构示意图:
B.C2H2的电子式: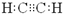
C.基态Cr的价电子排布式:3d44s2
D.HClO的结构式:H-Cl-O 雨中情圆1年前1
雨中情圆1年前1 -
 gaotian11 共回答了10个问题
gaotian11 共回答了10个问题 |采纳率90%解题思路:A.镁离子的核外电子总数为10,最外层为8个电子;
B.乙炔为共价化合物,分子中存在1个碳碳三键、2个碳氢键;
C.3d轨道达到半满状态时能量最低,Cr的3d轨道为5个电子;
D.次氯酸分子中不存在氢氯键,其分子中存在1个氢氧键、1个氧氯键.A.镁离子的核电荷数为12,核外电子总数为10,其正确的离子结构示意图为:
 ,故A错误;
,故A错误;
B.乙炔分子中存在1个碳碳三键,乙炔的电子式为: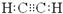 ,故B正确;
,故B正确;
C.基态Cr的3d轨道处于半满状态时能量最低,其正确的价电子排布式为:3d54s1,故C错误;
D.次氯酸的电子式为: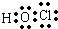 ,将共用电子对换成短线即为结构式,次氯酸的结构式为:H-O-Cl,故D错误;
,将共用电子对换成短线即为结构式,次氯酸的结构式为:H-O-Cl,故D错误;
故选B.点评:
本题考点: 电子式、化学式或化学符号及名称的综合.
考点点评: 本题考查了电子式、离子结构示意图、电子排布式、结构式等化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及正确的表示方法,明确离子结构示意图与原子结构示意图的区别.1年前查看全部
- A、B、C、D分别代表四种不同的短周期元素。A元素的价电子排布式为ns 1 ,B元素的价电子排布式为ns n np n
A、B、C、D分别代表四种不同的短周期元素。A元素的价电子排布式为ns 1 ,B元素的价电子排布式为ns n np n ,C元素的主要化合价为-2,D元素原子的L电子层的p轨道中有3个电子。 (1)若A元素价电子排布式为2s 1 ,A、B、C、D四种元素的第一电离能(I 1 )由大到小的顺序是______>______>______>______(用元素符号表示)
(2)有两种三原子分子,分子的空间构型为直线形,这两种化合物由B、C、D中的两种元素组成。根据等电子原理,写出这两种化合物的分子式:______、_____。
(3)若A元素价电子排布式为3s 1 ,则A与C形成的两种化合物的电子式分别为_________、________。 絮飞陌上1年前0
絮飞陌上1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 过渡元素的价电子排布式是【Ar】外的轨道还是最外层轨道?为什么?
 ellen55781年前1
ellen55781年前1 -
 gotogoto 共回答了16个问题
gotogoto 共回答了16个问题 |采纳率87.5%是指【Ar】外的轨道
比如.Fe的电子排布式是【Ar】3d6 4s2,那么它的价电子式就是3d6 4s21年前查看全部
- 26号元素的价电子排布式
 雪城飞虎1年前1
雪城飞虎1年前1 -
 zhaoxu0908 共回答了14个问题
zhaoxu0908 共回答了14个问题 |采纳率85.7%Fe:1s2 2s2 2p6 3s2 3p6 3d6 4s21年前查看全部
- 基态铁原子的价电子排布式怎么写?
 z西门吹风c1年前1
z西门吹风c1年前1 -
 ynkmgjx 共回答了22个问题
ynkmgjx 共回答了22个问题 |采纳率90.9%+26 2 8 14 2 1s2 2s2 2p6 3s2 3p6 3d6 4s2 或[Ar] 3d6 4s21年前查看全部
- 核外电子排布和价电子排布式一样吗?
 豆豆1011年前1
豆豆1011年前1 -
 123胡雷 共回答了15个问题
123胡雷 共回答了15个问题 |采纳率93.3%一样的.
价电子指原子核外电子中能与其他原子相互作用形成化学键的电子.
主族元素的价电子就是主族元素原子的最外层电子;过渡元素的价电子不仅是最外层电子,次外层电子及某些元素的倒数第三层电子也可成为价电子.1年前查看全部
- 苯分子的价电子排布式
 广鹿飞雪1年前1
广鹿飞雪1年前1 -
 police_Wolf 共回答了19个问题
police_Wolf 共回答了19个问题 |采纳率84.2%苯在常温下为一种无色、有甜味的透明液体,并具有强烈的芳香气味的有机物,苯常作为有机溶剂,苯的价电子排布为:
苯化学式为C6H6 其中每两个碳原子之间形成单双交替的特殊的化学键,所以我们写其价电子排布的时候只需要把苯结构式中的短线用圆点代替即可,不过由于苯的特殊,一般情况下不会要求写电子式.1年前查看全部
- 原子外围电子排布式 与 价电子排布式的关系
原子外围电子排布式 与 价电子排布式的关系
麻烦分主族元素和副族元素来回答 sand200620061年前1
sand200620061年前1 -
 nicoandyu 共回答了18个问题
nicoandyu 共回答了18个问题 |采纳率94.4%原子核外电子指的是核外面所有的电子,而价电子一般来说,对于主族元素就是最外层电子数,而对副族来说,价电子可能是最外层电子以外,还包括次外层和倒数第三层的电子.例如:Na 它的价电子就是它的最外层电子数,即1个,其外围轨道排布式为:1S2 2S22P6 3S1;它的价电子排布式为:3S1(即最外层电子只有1个) 而过渡元素例如Fe,其外围轨道排布式为:1S2 2S22P6 3S23P6 4S2 3d6;它的价电子排布式为:4S2 3d6(你可以参看元素周期表)1年前查看全部
大家在问
- 1地球引力的问题轨道舱环绕地球时不需额外动力,但是地球的引力不会影响轨道舱的速度吗?
- 2王明同学在修理电子玩具时,需要用一个75Ω的电阻
- 3快乐五周年的英文?请不要用翻译工具!我要准确的答案的!
- 4导体中自由电子的数量是和电阻有关系吗?(个人认为电阻越大自由电子数量越少),
- 5向下列溶液中同过量的CO2,溶液中一定有固体析出的是
- 67*7的方格纸中,至多放入多少枚棋子,使得任意四个棋子都不能构成长方形
- 7五柳先生传和桃花源记的区别
- 8一个基因型为AaXY的精原细胞,在减数分裂过程中,由于染色体分配紊乱,产生了一个基因型为AAaX的精子,则另三个精子的基
- 93公斤用英语怎么翻译
- 10对话式的结尾有何作用
- 11【求助】用乙醇做溶剂,怎么除去反应过程中产生的水
- 12一步反应生成乙醇的物质急
- 13葡萄糖怎样反应生成乙醇
- 14乙酸和乙醇反应生成已酯的酯化反应中的水和已酯怎么带走
- 15太阳系中自转速度最慢的是什么星球
